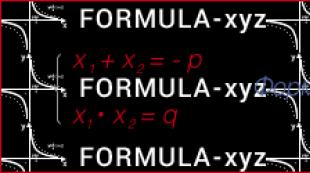Transport piki kontsentratsioonigradienti. Naatriumi (Na) kontsentratsioonigradient kui membraani transpordi liikumapanev jõud. Dx – kontsentratsiooni gradient
Tasakaalupotentsiaal on transmembraanse elektrilaengute erinevuse väärtus, mille juures ioonide rakku sisenev ja sealt väljuv vool muutub samaks, s.o. tegelikult ioonid ei liigu.
Kaaliumiioonide kontsentratsioon rakus on palju suurem kui rakuvälises vedelikus, samas kui naatriumi- ja kloriidiioonide kontsentratsioon on vastupidiselt rakuvälises vedelikus palju suurem. Orgaanilised anioonid on suured molekulid, mis ei läbi rakumembraan.
See kontsentratsiooni erinevus või kontsentratsiooni gradient on edasiviiv jõud lahustunud ioonide difusiooniks madalama kontsentratsiooniga piirkonda või vastavalt termodünaamika teisele seadusele madalamale energiatasemele. Seega peavad naatriumkatioonid difundeeruma rakku ja kaaliumi katioonid sealt välja.
Arvesse tuleb võtta rakumembraani läbilaskvust erinevate ioonide jaoks ja see varieerub sõltuvalt raku aktiivsuse seisundist. Puhkuse ajal kl plasmamembraan avatud on ainult kaaliumi ioonikanalid, millest teised ioonid läbi ei pääse.
Rakust lahkudes vähendavad kaaliumi katioonid selles positiivsete laengute arvu ja suurendavad samal ajal nende arvu membraani välispinnal. Rakku jäänud orgaanilised anioonid hakkavad piirama kaaliumi katioonide edasist vabanemist, kuna membraani sisepinna anioonide ja selle välispinna katioonide vahel tekib elektriväli ja tekib elektrostaatiline külgetõmme. Rakumembraan ise osutub polariseerituks: positiivsed laengud on rühmitatud selle välispinnale ja negatiivsed laengud sisemisele.
Seega, kui membraan on valmis mis tahes ioone läbima, siis ioonivoolu suuna määravad kaks asjaolu: kontsentratsioonigradient ja elektrivälja toime ning kontsentratsioonigradient võib suunata ioone ühes suunas ja elektriväli teises. Kui need kaks jõudu on tasakaalus, siis ioonide vool praktiliselt peatub, kuna rakku sisenevate ioonide arv võrdub lahkuvate ioonide arvuga. Seda seisundit nimetatakse tasakaalupotentsiaal.
aktiivne transport t
Ioonide difusioon peaks vähendama kontsentratsiooni gradienti, kuid kontsentratsiooni tasakaal tähendaks raku surma. Pole juhus, et ta kulutab rohkem kui 1/3 oma energiaressurssidest gradientide säilitamisele, ioonse asümmeetria säilitamisele. Ioonide transport läbi rakumembraani kontsentratsioonigradientide vastu on aktiivne, st. energiamahukas transpordiviis, selle tagab naatrium-kaaliumpump.
See on suur terviklik rakumembraani valk, mis eemaldab rakust pidevalt naatriumioone ja pumpab samaaegselt sinna kaaliumiioone. Sellel valgul on ATPaasi omadused – ensüüm, mis lagundab ATP-d membraani sisepinnal, kuhu valk seob kolm naatriumiooni. ATP molekuli lõhenemisel vabanevat energiat kasutatakse pumbavalgu teatud lõikude fosforüülimiseks, mille järel valgu konformatsioon muutub ja see eemaldab rakust kolm naatriumiooni, kuid võtab korraga kaks kaaliumiiooni väljastpoolt ja toob kaasa need rakku (joonis 4.1).
Seega ühes pumbatsüklis eemaldatakse rakust kolm naatriumiooni, sinna viiakse kaks kaaliumiiooni ning sellele tööle kulub ühe ATP molekuli energia. Nii säilib kõrge kaaliumi kontsentratsioon rakus ja naatriumi kontsentratsioon rakuvälises ruumis. Arvestades, et nii naatrium kui ka kaalium on katioonid, s.t. kannavad positiivseid laenguid, siis elektrilaengute jaotamise pumba ühe tsükli kogutulemus on ühe positiivse laengu eemaldamine rakust. Selle tegevuse tulemusena muutub membraan seestpoolt veidi negatiivsemaks ja seetõttu võib naatrium-kaaliumpumpa pidada elektrogeenseks.
1 sekundiga suudab pump rakust eemaldada umbes 200 naatriumiooni ja üheaegselt rakku üle kanda ligikaudu 130 kaaliumiiooni ning membraanipinna ühele ruutmikromeetrile saab paigutada 100-200 sellist pumpa. Lisaks naatriumile ja kaaliumile transpordib pump rakku glükoosi ja aminohappeid kontsentratsioonigradientide vastu; see, justkui möödasõidul, sai nime: symport. Naatrium-kaaliumpumba jõudlus sõltub naatriumiioonide kontsentratsioonist rakus: mida kõrgem see on, seda kiiremini pump töötab. Kui naatriumioonide kontsentratsioon rakus väheneb, vähendab pump oma aktiivsust.
Koos rakumembraanis oleva naatrium-kaaliumpumbaga on spetsiaalsed kaltsiumioonide pumbad. Samuti kasutavad nad ATP energiat kaltsiumiioonide rakust välja viimiseks, mille tulemusena tekib kaltsiumi oluline kontsentratsioonigradient: väljaspool rakku on seda palju rohkem kui rakus. See põhjustab kaltsiumiioonide pidevat püüdlust rakku siseneda, kuid puhkeolekus ei lase rakumembraan neid ioone peaaegu läbi läbida. Mõnikord aga avab membraan nendele ioonidele kanaleid ja siis on neil väga oluline roll vahendajate vabanemisel või teatud ensüümide aktiveerimisel.
Seega aktiivne transport tekitab kontsentratsiooni ja elektrilised gradiendid, mis mängivad silmapaistvat rolli kogu raku eluea jooksul.
Õppeaine "Entsütoos. Eksotsütoos. Rakufunktsioonide regulatsioon" sisukord:1. Na/K-pumba (naatrium-kaaliumpumba) mõju membraanipotentsiaalile ja rakumahule. Konstantne raku maht.
3. Endotsütoos. Eksotsütoos.
4. Difusioon ainete ülekandel raku sees. Difusiooni tähtsus endotsütoosi ja eksotsütoosi korral.
5. Aktiivne transport organellide membraanides.
6. Transport rakuvesiikulites.
7. Transport organellide moodustamise ja hävitamise teel. Mikrokiud.
8. Mikrotuubulid. Tsütoskeleti aktiivsed liikumised.
9. Aksoni transport. Kiire aksoni transport. Aeglane aksoni transport.
10. Raku funktsioonide reguleerimine. Reguleeriv toime rakumembraanile. membraanipotentsiaal.
11. Ekstratsellulaarsed reguleerivad ained. sünaptilised vahendajad. Kohalikud keemilised mõjurid (histamiin, kasvufaktor, hormoonid, antigeenid).
12. Intratsellulaarne suhtlus teiste vahendajate osalusel. Kaltsium.
13. Tsükliline adenosiinmonofosfaat, cAMP. cAMP raku funktsiooni reguleerimisel.
14. Inositoolfosfaat "IF3". Inositooltrifosfaat. Diatsüülglütserool.
Tähendus Na/K-pump puuri jaoks ei piirdu normaalse K+ ja Na+ gradientide stabiliseerimisega üle membraani. Na+ membraanigradiendis salvestatud energiat kasutatakse sageli teiste ainete membraanitranspordi tagamiseks. Näiteks joonisel fig. 1.10 näitab Na + ja suhkru molekulide "sümpporti" rakku. Membraani transpordivalk transpordib suhkrumolekuli rakku isegi kontsentratsioonigradienti vastu, samas kui Na+ liigub piki kontsentratsiooni ja potentsiaali gradienti, mis annab energiat suhkrute transpordiks. Selline suhkrute transport sõltub täielikult olemasolust kõrge naatriumigradient I; kui naatriumi rakusisene kontsentratsioon oluliselt suureneb, siis suhkrute transport peatub.
Riis. 1.8. Molekulide transpordikiiruse ja nende kontsentratsiooni suhe (kanalisse sisenemise või pumba sidumispunktis) kanali kaudu difusiooni ajal või pumpamise transpordi ajal. Viimane küllastub kõrgel kontsentratsioonil (maksimaalne kiirus, V max); abstsissil olev väärtus, mis vastab poolele pumba maksimaalsest kiirusest (Vmax/2), on tasakaalukontsentratsioon KtErinevate suhkrute jaoks on erinevad sümportsüsteemid. Aminohapete transport rakku on sarnane suhkrute transpordiga, mis on näidatud joonisel fig. 1,10; seda pakub ka Na+ gradient; neid on vähemalt viis erinevaid süsteeme sümportid, millest igaüks on spetsialiseerunud ühele seotud aminohapete rühmale.
 Riis. 1.10. Membraani lipiidide kaksikkihti manustatud valgud vahendavad glükoosi ja Na importi rakku, samuti Ca / Na antiporti, milles liikumapanevaks jõuks on Na gradient läbi rakumembraani.
Riis. 1.10. Membraani lipiidide kaksikkihti manustatud valgud vahendavad glükoosi ja Na importi rakku, samuti Ca / Na antiporti, milles liikumapanevaks jõuks on Na gradient läbi rakumembraani.
Välja arvatud sümportsüsteemid on ka sadamavastane". Üks neist näiteks kannab ühe tsükli jooksul rakust välja ühe kaltsiumiooni vastutasuks kolme sissetuleva naatriumiooni eest (joonis 1.10). Energia Ca2+ transpordiks tekib tänu kolme naatriumiooni sisenemisele piki kontsentratsiooni ja potentsiaalset gradienti. See energia on piisav (puhkepotentsiaali juures), et säilitada kõrge kaltsiumiioonide gradient (alla 10-7 mol/l raku sees kuni ligikaudu 2 mmol/l väljaspool rakku).
Dx on kontsentratsiooni gradient,
T - absoluutne temperatuur
M mol
Jm = ––- ––––(–- ––––) ; m - aine kogus
S × t m koos Jm-ga – (pasknäär) – aine voo tihedus.
Elektrokeemiline potentsiaal- energiaga võrdne väärtus Gibbs G elektrivälja asetatud antud aine mooli kohta.
Gibbsi vaba energia (või lihtsalt Gibbsi energia ehk Gibbsi potentsiaal ehk kitsas tähenduses termodünaamiline potentsiaal) on suurus, mis näitab energia muutust keemiline reaktsioon andes seeläbi vastuse küsimusele keemilise reaktsiooni põhimõttelisest võimalikkusest; on termodünaamiline potentsiaal järgmisel kujul:
G=U+PV–TS
kus U - siseenergia, P - rõhk, V - maht, T - absoluutne temperatuur, S - entroopia.
(Keemias ja termodünaamikas on termodünaamiline entroopia S, mida sageli nimetatakse lihtsalt entroopiaks, termodünaamilise süsteemi oleku funktsioon)
Gibbsi energiat võib mõista kui süsteemi (kristall, vedelik jne) keemilist koguenergiat.
Gibbsi energia mõistet kasutatakse laialdaselt termodünaamikas ja keemias.
Termodünaamiline entroopia S, mida sageli nimetatakse lihtsalt entroopiaks, on keemias ja termodünaamikas termodünaamilise süsteemi oleku funktsioon.
Lahjendatud lahuste puhul määratakse aine voolutihedus Nernst-Plancki võrrand.
d × Cd × φ
jm=–U × R × T––––- –U × C × Z × F––––- ;
d × x d × x
U–osakeste liikuvus,
R- gaasikonstant 8,31 j/mol,
DC
z–elektrolüüdi iooni laeng,
Faraday F-arv 96500 kg/mol,
dφ-elektrivälja potentsiaal,
dφ
Passiivse transpordi ajal aine ülekandumisel on kaks põhjust: kontsentratsioonigradient ja elektripotentsiaali gradient. (Gradidi ees olevad miinusmärgid näitavad, et kontsentratsioonigradient põhjustab aine liikumise kõrgema kontsentratsiooniga kohtadest madalama kontsentratsiooniga kohtadesse.) Elektripotentsiaali gradient põhjustab positiivsete laengute ülekande kõrgema potentsiaaliga kohtadest madalama potentsiaaliga kohtadesse.
Võib toimuda ainete passiivne ülekandmine madalama kontsentratsiooniga kohtadest kõrgema kontsentratsiooniga kohtadesse (kui võrrandi teine liige on absoluutväärtuses suurem kui esimene).
Kui mitte elektrolüüdid Z=0; või puudub elektriväli, siis tekib lihtne difusioon - Ficki seadus.
Jm =–-D ×––––;
D on difusioonikoefitsient;
- –- ––– kontsentratsiooni gradient;
Difusioon - ainete spontaanne liikumine suurema kontsentratsiooniga kohtadest madalama aine kontsentratsiooniga kohtadesse, mis on tingitud molekulide kaootilisest soojusliikumisest.
Aine difusiooni läbi lipiidide kaksikkihi põhjustab kontsentratsioonigradient läbi membraani. Membraani läbilaskvuse koefitsient sõltub membraani omadustest ja veetavatest ainetest. (Kui aine kontsentratsioonid membraani pinnal on otseselt võrdelised kontsentratsioonidega väljaspool membraani).
P=-–- ––- – läbilaskvuse koefitsient
K–jaotuskoefitsient, mis näitab aine kontsentratsiooni suhet väljaspool membraani ja selle sees.
L–membraani paksus;
D on difusioonikoefitsient;
Koefitsient mida suurem on läbilaskvus, seda suurem on difusioonikoefitsient (mida väiksem on membraani viskoossus), seda õhem on membraan ja seda paremini lahustub aine membraanis.
Mittepolaarsed ained - orgaanilised rasvhapped - tungivad hästi läbi membraani, halvasti - polaarsed veeslahustuvad ained: soolad, alused, suhkrud, aminohapped.
Soojusliikumise käigus moodustuvad sabade vahele väikesed vabad tasapinnad – nn labad, mille kaudu võivad polaarsed molekulid tungida. Mida suurem on molekul, seda väiksem on selle aine membraani läbilaskvus. Ülekande selektiivsuse tagab teatud raadiusega pooride kogum membraanis, mis vastab läbistava osakese suurusele.
Hõlbustatud difusioon- toimub kandjamolekulide osalusel. Kaaliumioonide kandja on valinomütsiin, millel on manseti kuju; seest vooderdatud polaarsete rühmadega ja väljast mittepolaarsete rühmadega. Iseloomustab kõrge selektiivsus. Valinomütsiin moodustab kompleksi mansetti sisenevate kaaliumiioonidega ja lahustub ka membraani lipiidfaasis, kuna selle välismolekul on mittepolaarne.
Valinomütsiini molekulid membraani pinnal hõivavad kaaliumiioone ja kannavad seda läbi membraani. Ülekanne võib toimuda mõlemas suunas.
Hõlbustatud difusioon toimub kõrgema ülekantava aine kontsentratsiooniga kohtadest madalama kontsentratsiooniga kohtadesse.
Erinevused hõlbustatud ja lihtsa difusiooni vahel:
1) aine ülekandmine kandjaga on kiirem.
2) Hõlbustatud difusioonil on küllastusomadus, kontsentratsiooni suurenemisel membraani ühel küljel suureneb voo tihedus, kuni kõik kandjamolekulid on hõivatud
3) hõlbustatud difusiooni korral täheldatakse kantavate ainete konkurentsi, kui kandja kannab erinevaid aineid; samas on ühed ained paremini talutavad kui teised ja mõne ainete lisamine raskendab teiste transportimist.Seega on suhkrutest glükoos paremini talutav kui fruktoos, fruktoos parem kui ksüloos ja ksüloos parem kui arabinoos .
4) On aineid, mis blokeerivad hõlbustatud difusiooni – need moodustavad kandjamolekulidega tugeva kompleksi. Liikumatud molekulid – kandjad, mis on fikseeritud läbi membraani, kanduvad molekulilt molekuli.
Filtreerimine - lahuse liikumine läbi membraani pooride rõhugradiendi toimel. Ülekandekiirus filtreerimise ajal järgib Poiseuille'i seadust.
D v P1 – P2
–- –– = - ––––––;
Selleks, et mõista, kuidas ja miks närvi- või lihasrakkudes erutus toimub, on vaja kõigepealt mõista raku ja selle keskkonna vahelise ainete vahetamise põhireegleid, kuna ioonid ja väikesed molekulid lahustuvad vesikeskkonnas samaaegselt. rakus ja rakuvälises ruumis, kus nende kontsentratsioon erineb rakusisesest. Mõnikord öeldakse bioloogide seas, et mistahes bioloogilise probleemi uurimiseks lõi Jumal ideaalse organismi. Membraaniteooria aluseks olevad katsed viidi läbi 1940. aastatel hiiglaslike kalmaari aksonitega.
Nende aksonite läbimõõt ulatub 1 mm-ni, neid on näha isegi palja silmaga, neisse on lihtne sisestada elektroode, et uurida elektriliste signaalide – aktsioonipotentsiaalide – tekkimist. Just sellisel objektil töötasid membraaniteooria rajajad Briti füsioloogid Alan Hodgkin ja Andrew Huxley (Hodgkin A., Huxley A.), 1963. aasta Nobeli preemia laureaadid. Kalmaari hiidaksonite tsütoplasma erineb ümbritsevast rakuvälisest vedelikust mõne iooni kontsentratsiooni poolest (tabel 4.1).
Tasakaalupotentsiaal on selline transmembraanse elektrilaengute erinevuse väärtus, mille juures ioonide vool rakku ja sealt välja muutub samaks, st tegelikult ioonid ei liigu.
Nagu tabelist näha, on kaaliumiioonide kontsentratsioon rakus palju suurem kui ekstratsellulaarses vedelikus, samas kui naatriumi- ja kloriidiioonide kontsentratsioon on vastupidiselt rakuvälises vedelikus palju suurem. Orgaanilised anioonid on suured molekulid, mis ei läbi rakumembraani.
Kas kalmaari närvirakke uurides on õige või mitte teha järeldusi soojavereliste loomade, eriti inimeste rakumembraanide kohta? Võrdleme nende hiiglaslikke aksoneid näiteks soojavereliste lihasrakkudega (tabel 4.2).

Erinevatesse liikidesse kuuluvate loomade erinevates rakkudes ioonide kontsentratsioonide mõõtmistulemused annavad loomulikult nende kontsentratsioonide erinevad väärtused, kuid üks asi on ühine kõigi rakkude jaoks, kõigil loomaliikidel: kaaliumiioonide kontsentratsioon on alati kõrgem rakus ning naatriumi- ja klooriioonide kontsentratsioon rakuvälises vedelikus.

See erinevus kontsentratsioonis või kontsentratsioonigradient on liikumapanev jõud lahustunud ioonide difusioonil madalama kontsentratsiooniga piirkonda või vastavalt termodünaamika teisele seadusele madalamale energiatasemele. Vaadates uuesti tabelites toodud arve, võib täpselt ennustada, et naatriumkatioonid peavad difundeeruma rakku ja kaaliumi katioonid sealt välja.
Kuid kõik pole nii lihtne, kuna on vaja arvestada rakumembraani läbilaskvusega erinevate ioonide jaoks ja see muutub sõltuvalt raku aktiivsuse seisundist. Puhkeolekus on plasmamembraanil avatud ainult kaaliumi ioonikanalid, millest teised ioonid läbi ei pääse. Kas see tähendab, et kaaliumiioonid võivad puhkeraku membraani kaudu vabalt välja pääseda?
Rakust lahkudes vähendavad kaaliumi katioonid selles positiivsete laengute arvu ja suurendavad samal ajal nende arvu membraani välispinnal. Rakku jäänud orgaanilised anioonid hakkavad piirama kaaliumi katioonide edasist vabanemist, kuna membraani sisepinna anioonide ja selle välispinna katioonide vahele tekib elektriväli ja tekib elektrostaatiline külgetõmme. Rakumembraan ise osutub polariseerituks: positiivsed laengud on rühmitatud selle välispinnale ja negatiivsed laengud sisemisele.
Seega, kui membraan on valmis mis tahes ioone läbima, siis ioonivoolu suuna määravad kaks asjaolu: kontsentratsioonigradient ja elektrivälja toime ning kontsentratsioonigradient võib suunata ioone ühes suunas ja elektriväli teises. Kui need kaks jõudu on tasakaalus, siis ioonide vool praktiliselt peatub, kuna rakku sisenevate ioonide arv võrdub lahkuvate ioonide arvuga. Seda seisundit nimetatakse tasakaalupotentsiaaliks (E) ja selle väärtuse saab arvutada Nernsti võrrandi abil (Nernst W., 1888):

kus R on gaasikonstant, Т on absoluutne temperatuur (310 kehatemperatuuril), z on iooni valents (kaalium = 1), F on Faraday konstant, a on kaaliumiioonide kontsentratsioon väljaspool rakku, [K]i on kaaliumiioonide kontsentratsioon rakus.
Kui asendame võrrandis konstantide väärtuse ja ioonide kontsentratsiooni, on kalmaari aksoni membraani tasakaalupotentsiaal kaaliumioonide jaoks võrdne -75 mV (soojavereliste loomade lihasmembraani jaoks -97 mV). ). See tähendab, et sellise transmembraanse potentsiaali erinevuse ja kaaliumiioonide intra- ja ekstratsellulaarsete kontsentratsioonide väärtuste korral muutub nende vool rakust võrdseks rakku siseneva vooluga. Kui transmembraanse potentsiaali erinevus muutub väiksemaks, hakkavad kaaliumiioonid rakust lahkuma, kuni tasakaalupotentsiaali väärtus taastub.
Puhkeolekus olevates gliiarakkudes läbib membraan ainult kaaliumiioone, seetõttu langeb nende tegelik transmembraanse potentsiaali erinevus kokku arvutatud väärtusega, s.o. kaaliumi tasakaalupotentsiaali väärtusega - 75 mV. Kuid enamiku neuronite puhul on olukord erinev, kuna nende puhkeolekus olev membraan võimaldab läbida mitte ainult kaaliumiioone, vaid väikestes kogustes ka naatriumi- ja kloriidioone. Sellega seoses on transmembraanse potentsiaali erinevus mõnevõrra väiksem kui tasakaalu kaaliumipotentsiaal, kuid mitte oluliselt, kuna kaaliumiioonide läbilaskvus puhkeolekus on palju suurem kui naatriumi- ja kloriidioonide puhul.
Nernsti võrrandit kasutades on lihtne leida mis tahes ioonide tasakaalupotentsiaalide väärtus (naatriumi ja kloori puhul on need toodud tabelis 1). Naatriumi tasakaalupotentsiaal on + 55 mV ja selle kontsentratsioon rakuvälises keskkonnas on palju suurem kui rakus; mõlemad soodustavad naatriumioonide sisenemist rakku. Kuid puhkeolekus ei anna rakumembraan neile sellist võimalust: selle läbilaskvus naatriumioonide jaoks on äärmiselt väike.
Ioonide difusioon peaks vähendama kontsentratsiooni gradienti, kuid kontsentratsiooni tasakaal tähendaks raku surma. Pole juhus, et ta kulutab rohkem kui 1/3 oma energiaressurssidest gradientide säilitamisele, ioonse asümmeetria säilitamisele. Ioonide ülekanne läbi rakumembraani kontsentratsioonigradientide vastu on aktiivne, st energiat tarbiv transpordiviis, seda tagab naatrium-kaaliumpump.

See on suur terviklik rakumembraani valk, mis eemaldab rakust pidevalt naatriumioone ja pumpab samaaegselt sinna kaaliumiioone. Sellel valgul on ATPaasi omadused – ensüüm, mis lagundab ATP-d membraani sisepinnal, kuhu valk seob kolm naatriumiooni. ATP molekuli lõhenemisel vabanevat energiat kasutatakse pumbavalgu teatud osade fosforüülimiseks, mille järel valgu konformatsioon muutub ja see eemaldab rakust kolm naatriumiooni, kuid võtab korraga kaks kaaliumiiooni väljastpoolt ja toob kaasa need rakku (joonis 4.1).
Seega ühes pumbatsüklis eemaldatakse rakust kolm naatriumiooni, sinna viiakse kaks kaaliumiiooni ning sellele tööle kulub ühe ATP molekuli energia. Nii säilib kõrge kaaliumi kontsentratsioon rakus ja naatriumi kontsentratsioon rakuvälises ruumis. Kui võtta arvesse, et nii naatrium kui ka kaalium on katioonid ehk kannavad positiivseid laenguid, siis elektrilaengute jaotamise pumba ühe tsükli kogutulemus on ühe positiivse laengu eemaldamine rakust. Selle tegevuse tulemusena muutub membraan seestpoolt veidi negatiivsemaks ja seetõttu võib naatrium-kaaliumpumpa pidada elektrogeenseks.
1 sekundiga suudab pump rakust eemaldada umbes 200 naatriumiooni ja üheaegselt rakku üle kanda ligikaudu 130 kaaliumiiooni ning membraanipinna ühele ruutmikromeetrile saab paigutada 100-200 sellist pumpa. Lisaks naatriumile ja kaaliumile transpordib pump rakku glükoosi ja aminohappeid kontsentratsioonigradientide vastu; see, justkui möödasõidul, sai nime: symport. Naatrium-kaaliumpumba jõudlus sõltub naatriumiioonide kontsentratsioonist rakus: mida kõrgem see on, seda kiiremini pump töötab. Kui naatriumioonide kontsentratsioon rakus väheneb, vähendab pump oma aktiivsust.
Koos rakumembraanis oleva naatrium-kaaliumpumbaga on spetsiaalsed kaltsiumioonide pumbad. Samuti kasutavad nad ATP energiat kaltsiumiioonide rakust välja viimiseks, mille tulemusena tekib kaltsiumi oluline kontsentratsioonigradient: väljaspool rakku on seda palju rohkem kui rakus. See põhjustab kaltsiumiioonide pidevat püüdlust rakku siseneda, kuid puhkeolekus ei lase rakumembraan neid ioone peaaegu läbi läbida. Mõnikord aga avab membraan nendele ioonidele kanaleid ja siis on neil väga oluline roll vahendajate vabanemisel või teatud ensüümide aktiveerimisel.
Seega tekitab aktiivne transport kontsentratsiooni ja elektrilisi gradiente, mis mängivad silmapaistvat rolli kogu raku eluea jooksul.
4.3. Passiivne transport – difusioon
Pumpade tööst tekkivad gradiendid võimaldavad ioonidel liikuda läbi membraani suuremast energia tase väiksemaks difusiooni teel, kui loomulikult on avatud ioonkanalid. Selline kanal on suurmolekulaarne integraalvalk, mille molekul läbib kahekordse membraanilipiidide kihi. Sellel molekulil on veega täidetud poorid, mille läbimõõt ei ületa 1 nm. Sellisest august pääsevad läbi ainult kaaliumiioonid (joonis 4.2).
Kaaliumiiooni raadius on 0,133 nm, naatriumioonil veelgi väiksem - 0,098 nm, kuid pidevalt avatud kanaleid läbib ainult kaalium. Fakt on see, et iooni tegelikud mõõtmed määrab selle hüdratatsioonikihi paksus, mis katab kõik vesilahuses olevad ioonid. Veemolekulid käituvad nagu dipoolid: nende hapnikuaatomite elektronid on tugevamad kui vesinikuaatomite omad, mis tähendab, et hapnik kannab nõrka negatiivset laengut. Seetõttu tõmbavad veemolekulid kaaliumi-, naatriumi- ja kaltsiumi katioonide positiivsed laengud. Kuid kuna veemolekuli vesinikuaatomitel on nõrk positiivne laeng, tõmbavad veemolekulid ka kloorianioonide poole.
Väiksema ioonraadiusega on naatriumiooni elektriväli tugevam kui kaaliumi oma ja seetõttu on selle hüdratatsioonikiht paksem. See ei lase naatriumioonidel läbida kanaleid, mis on saadaval ainult kaaliumi läbimiseks. Sellepärast toimub rakumembraani puhkeolekus selle kaudu valdavalt ühte tüüpi ioonide voog - kaalium, mis väljub rakust pidevalt mööda kontsentratsioonigradienti.
Äsjakirjeldatud kanalid, millest kaaliumiioonid läbivad, on alati avatud: nii puhkeolekus kui ka raku ergutamise ajal - need ei sõltu eriti välistingimustest ja on seetõttu passiivset tüüpi kanalid. Seevastu on juhitavad ioonkanalid, millest enamik on raku puhkeolekus suletud ja nende avamiseks on vaja neile kuidagi toimida. Seetõttu juhitakse selliseid kanaleid ja sõltuvalt juhtimismeetodist jagunevad need kolme tüüpi:
1) potentsiaalist sõltuv;
2) kemosõltuv;
3) juhitakse mehaaniliselt.
Seadet, millega kanaleid avatakse või suletakse, nimetatakse sageli väravamehhanismiks või isegi väravaks, kuigi selline võrdlus pole päris õige. Kaasaegsed ideed ioonikanalite kohta on arenenud seoses nende uurimise kahe metodoloogilise lähenemisviisiga. Esiteks on see patch clamp meetod, mis võimaldab jälgida ioonvoolu läbi ühe kanali. Selle tehnika leiutasid 70ndate lõpus Erwin Neher ja Bert Zakman (Neher E., Sakmann B.), 1991. aasta Nobeli preemia laureaadid. Teiseks aitas kanalite omaduste mõistmisele kaasa nende mudelite konstrueerimine, mis põhines paljude kanalivalkude dešifreeritud geneetilisel koodil ja sellega seoses loodud molekulide aminohappejärjestusel.
Iga kanali moodustavad mitmed valgu subühikud (joonis 4.3), mis on pikad aminohapete ahelad, mis on keerdunud a-heeliksiks. A-heeliksi kuju võib muutuda näiteks transmembraanse potentsiaalide erinevuse muutumise tõttu (mis on pingega seotud kanalite puhul äärmiselt oluline).

A-heeliksi kuju muutumine viib aminohapete, sealhulgas elektrilaengut kandvate hapete liikumiseni. Selle tulemusena võivad aminohapete nagu lüsiini või arginiini laengud olla ioonikanali siseseinas ja muuta selle hüdrofiilseks: siis saavad hüdraatunud ioonid kanali läbida. Alfa-heeliksi naasmine endisele kujule toob kaasa asjaolu, et kanali siseseinasse ilmuvad taas hüdrofoobsed piirkonnad ja seetõttu ioonivoog peatub.
Erinevat tüüpi kanalite moodustamises osaleb kaks kuni seitse subühikut, iga alaühiku valguahel läbib mitu korda rakumembraani ja iga ristumisala täidab konkreetset ülesannet: mõned moodustavad kanali seinad, teised toimivad andurina. elektrivälja muutuste jaoks ja teised ulatuvad membraani välisküljest kaugemale, on retseptorid, neljandad ühendavad kanali tsütoskeletiga.
Pingepiiranguga kanalid avanevad või sulguvad teatud muudatuste tõttu membraanipotentsiaal. Näiteks naatriumikanalid on puhkeolekus suletud, kuid kui membraanipotentsiaal väheneb kriitilise väärtuseni, siis need avanevad. Kui depolarisatsioon jätkub membraani potentsiaali positiivse väärtuseni (st membraani siseküljel on rohkem positiivseid laenguid kui välisküljel), siis kanalid sulguvad.
Kemosõltuvad kanalid avanevad neurotransmitteri kinnitumise tõttu kanalivalgu väljapoole väljaulatuva glükoproteiini retseptori piirkonnaga, mis on teatud tüüpi kanal, mida kasutatakse sünapsides (joonis 4.4). Mehaaniliselt juhitavad kanalid on iseloomulikud venitustele ja survele reageerivate neuronite tundlikele otstele. Need kanalid on erilisel viisil ühendatud tsütoskeletiga, mis viib nende avanemiseni, kui rakk deformeerub.

Kanali avamise hetk on vaid hetk, mis kestab sekundi miljondikuid. Kuid isegi avatud olekus ei ole kanalid kaua - vaid paar millisekundit, pärast mida need suletakse kiiresti. Avatud kanali läbilaskevõime on aga hämmastav: ioonide vool toimub kiirusega kuni 100 000 000 iooni/s, mida saab võrrelda ainult "kiiremate" ensüümide, näiteks karboanhüdraasi aktiivsusega, mis katalüüsib süsihappegaasi moodustumine ja dehüdratsioon vere erütrotsüütides.
Lisaks avatud ja suletud konformatsioonilisele olekule võivad kanalid inaktiveeruda, mis tähendab, et need on suletud, kuid ei allu tavapäraselt juhtimismehhanismide tegevusele ega avane. Inaktiveerimise seisund tekib kohe pärast kanali sulgemist, kestab mitu ms ja seda kontrollivad valgu molekuli spetsiifilised subühikud või spetsiifilised piirkonnad. Kanali inaktiveerimise ajal lakkab rakk reageerimast teda erutavatele stiimulitele, mis on defineeritud terminiga refraktoriness, st ajutine mitteerutuvus.
Ioonkanalid on olemas iga keharaku membraanis, kuid lihastes ja eriti närvirakkudes on nende tihedus palju suurem kui teiste kudede rakkudes. Neuronites leiti lisaks kanalite suurele tihedusele ka nende suur mitmekesisus. See pole juhuslik, sest just kanalid määravad kindlaks elektriliste signaalide esinemise tingimused, signaalide endi olemuse, nende juhtivuse kiiruse jne, mis tegelikult võimaldavad neuronitel täita oma põhiülesannet: vastu võtta, töödelda ja edastada teavet.
4.5. Ioonkanali blokaatorid
On üsna palju aineid, mis võivad pöörduvalt või pöördumatult seostuda valgu molekulidega ja seeläbi neid blokeerida, st eemaldada need kontrollimehhanismidele allumisest. Blokeeritud kanalid osutuvad enamasti suletuks, kuigi mõnel juhul on kanali avatud asend fikseeritud.
Paljud ammu tuntud loomset või taimset päritolu mürgid on võimelised kanaleid blokeerima. Näiteks mõnede liigendkalade ( Tetrodontiformes ) sisikond sisaldab tetrodotoksiini, mis blokeerib naatriumikanaleid. Sellesse järjekorda kuuluvad kurikuulsad puhmikud, mis nõudsid arvestatava hulga gurmaanide elu, aga ka Peeter Suure lahe vetes ujuvad koerkalad, mis võivad paisuda ja teha üsna valju häält. Tetrodotoksiini on pikka aega kasutatud membraani läbilaskvuse uurimisega seotud eksperimentaalses praktikas.
Naatriumikanaleid võib blokeerida ka teine loomamürk – batrahhotoksiin, mis sisaldub mõne Lõuna-Ameerika konna, näiteks täpilise mürginoolekonna limas. Indiaanlased mürgitasid selle mürgiga oma nooli, kuigi nad ei taibanud, et batrahhotoksiin blokeerib naatriumikanaleid ja selline blokaad ei lase närvirakke erutada.
Teised Lõuna-Ameerika indiaanlased valmistasid mürgitatud nooli teise mürgi, taimse mürgi abil - see on teatud tüüpi viinapuudest ekstraheeritud curare puu mahl. Kurare mürk blokeerib selektiivselt neuromuskulaarsete sünapside kemosõltuvad kanalid. Samad sünapsid blokeerib pöördumatult madude mürk alfa-bungarotoksiin, mis vabaneb bungarite hammustamisel, nad on ka kraitid - kobrade lähisugulased.
Kunstliku päritoluga aine - tetraetüülammoonium blokeerib spetsiifiliselt kaaliumikanalid; seda kasutati sageli eksperimentaalses praktikas. Paljusid kasutatakse meditsiinis raviained, mille rakenduspunktiks on ioonkanalid: selliste ainete abil on võimalik juhtida teatud ioonkanaleid ja seeläbi mõjutada neuronite tegevust.
Puhkeseisundis paikneb plasmamembraani välisküljel õhuke kiht positiivseid laenguid, siseküljel aga negatiivseid. Välispinna elektrilaeng loetakse nulliks, seega on transmembraanse potentsiaali erinevus ehk membraani puhkepotentsiaal negatiivne. Enamiku neuronite tüüpilisel juhul on puhkepotentsiaal ligikaudu -60 - -70 mV.
Puhkepotentsiaali otsese mõõtmise tehnika töötati välja 1940. aastate lõpus. Valmistati spetsiaalne mõõteelektrood: õhuke klaaskapillaar pikendatud otsaga, mille läbimõõt ei ületa 1 µm ja mis täideti juhtiva soolalahusega (3M KCl). mis ei muuda membraani sisemist laengut. Sellesse lahusesse sisestati kapillaari laiast otsast metalljuht ja õhukese otsaga torgati rakumembraan. Teine elektrood oli klooritud hõbeplaat ja see asetati väliskeskkonda; kasutati nõrkade elektriliste signaalide võimendit ja galvanomeetrit (joon. 4.5). Uuringu objektiks oli hiiglaslik kalmaari akson, just selle kohta õnnestus neil saada andmeid, mis olid membraani teooria aluseks (Hodgkin Huxley).

Kuidas puhkemembraani potentsiaal tekib? Enne sellele küsimusele vastamist tuleks veel kord meelde tuletada, et naatrium-kaaliumpumba töö rakus tekitab kõrge kaaliumiioonide kontsentratsiooni ning nende ioonide jaoks on rakumembraanis avatud kanalid. Mööda kontsentratsioonigradienti rakust väljuvad kaaliumiioonid suurendavad positiivsete laengute arvu membraani välispinnal. Rakus on palju suurmolekulaarseid orgaanilisi anioone ja seetõttu on membraan seestpoolt negatiivselt laetud. Kõik teised ioonid võivad puhkemembraanist läbida väga väikeses koguses, nende kanalid on enamasti suletud. Seetõttu tuleneb puhkepotentsiaal peamiselt rakust tuleva kaaliumiioonide voolust.
Seda järeldust on eksperimentaalselt üsna lihtne kontrollida. Kui näiteks kaaliumiioonide kontsentratsiooni raku ümber kunstlikult suurendada, siis nende vool rakust väheneb või isegi peatub üldse, kuna selle voolu liikumapanevaks jõuks olev kontsentratsioonigradient väheneb. Ja siis hakkab puhkepotentsiaal vähenema, see võib muutuda nulliks, kui kaaliumi kontsentratsioon membraani mõlemal küljel osutub samaks. On veel üks võimalus tõestada puhkepotentsiaali kaaliumi olemust. Kui kaaliumikanalid blokeeritakse tetraetüülammooniumiga, siis kaaliumiioonide vool peatub ja pärast seda hakkab puhkepotentsiaal vähenema.
Raku membraan puhkeolekus läbib väheses koguses naatriumi- ja kloriidioone. Kaks jõudu juhivad naatriumiioone rakku: kõrge väliskontsentratsioon ja raku elektronegatiivne sisekeskkond. Isegi väike kogus naatriumi, mis siseneb rakku, viib membraani depolarisatsioonini - puhkepotentsiaali vähenemiseni. Klooriioonidel on raskem rakku sattuda, kuna neid tõrjub membraani sisepinna elektronegatiivne laengukiht ja kloori tasakaalupotentsiaali väärtus -60 mV erineb vähe normaalsest väärtusest. puhkepotentsiaal. Iga kolme ioonitüübi membraani selektiivse läbilaskvuse ja nende kontsentratsioonide suhe kirjeldab Goldmani võrrandit:

kus E m on membraanipotentsiaali väärtus, P on membraani läbilaskvus, olenevalt selle paksusest ja iooni liikuvusest selles, a on iooni kontsentratsioon väljast, i on selle kontsentratsioon seestpoolt , R, T ja F on sama tähendusega, mis Nernsti võrrandis .
Sellest võrrandist järeldub, et puhkepotentsiaali tegelik väärtus (Em = - 65 mV) on kompromiss kaaliumi (- 75 mV), naatriumi (+ 55 mV) ja kloori (- 60 mV) tasakaalupotentsiaalide vahel. On lihtne ennustada, et membraani naatriumi läbilaskvuse suurenemine põhjustab depolarisatsiooni ja selle kloori läbilaskvuse suurenemine hüperpolarisatsiooni.
Kui võtta 1-ks membraani läbilaskvus puhkeolekus kaaliumiioonide puhul, on selle läbilaskvus naatriumiioonide puhul 0,04 ja kloori puhul 0,45. Kuid kui membraan on ergastatud, see suhe muutub ja aktsioonipotentsiaali tipu tipus on 1 (K) : 20 (Na) : 0,45 (Cl).
Goldmanni võrrand võimaldab teil arvutada puhkemembraani potentsiaali väärtuse, kui on teada ioonide kontsentratsioon rakus ja väljaspool seda, samuti nende ioonide läbilaskvus. Puhkemembraani potentsiaali tegelik väärtus on kõige lähemal neile pidevalt avatud kanaleid läbivate kaaliumiioonide tasakaalupotentsiaali väärtusele. Olukord muutub otsustavalt, kui rakku stimuleeritakse, kui naatriumi läbilaskvus suureneb ja tekib depolariseeriv retseptori potentsiaal ehk postsünaptiline potentsiaal.
Aktsioonipotentsiaal tekib ainult teatud depolariseeriva nihke korral, näiteks vahemikus -65 mV kuni -55 mV. Kui depolarisatsioon on väiksem, siis aktsioonipotentsiaali ei teki: selliseid depolariseerivaid nihkeid nimetatakse alamlävideks. Siin toodud arvud on suhtelised, erinevates rakkudes võivad need olla väiksemad või suuremad, kuid alati on läviväärtusena määratletud väikseim depolariseeriv nihe, mis põhjustab aktsioonipotentsiaali ilmnemist.
Retseptori või postsünaptiliste potentsiaalide tekkimine on seotud membraani naatriumi läbilaskvuse suhteliselt väikese lokaalse suurenemisega. Naatriumiioonide sisenemine rakku ja sellest tulenev lokaalne depolarisatsioon viib lokaalse elektrivoolu tekkeni. Selle levimist piki membraani takistab membraani enda elektritakistus, seetõttu ei saa mõnes kohas alanud passiivne depolarisatsioon kaugele levida – passiivsed elektrilised reaktsioonid on alati lokaalsed.
Kuid kui lokaalsete depolariseerivate nihete summa võib ikkagi neuroni päästiktsooni membraani depolariseerida kriitiline tase, kuni läviväärtuseni, siis toimub aktiivne ja maksimaalne raku vastus vastavalt reeglile "kõik või mitte midagi". Depolarisatsioon kriitilise väärtuseni toob kaasa konformatsioonilised muutused naatriumikanalite siseseinas ja polaarsete aminohapete liikumise. Selle tulemusena avaneb 0,3 - 0,5 nm läbimõõduga poor, millest pääsevad läbi naatriumkatioonid (vt joonis 4.3). Anioonide vool läbi selle kanali on võimatu, sest selle suudmes on glutamiinhappe karboksüülrühmade negatiivsed laengud, mis tõrjuvad anioonide negatiivseid laenguid.
Naatriumi tasakaalupotentsiaal on +55 mV ja kanalid selle jaoks avanevad membraanipotentsiaali väärtusel -55 mV, mistõttu naatriumioonid sisenevad rakku suure kiirusega: ühe kanali kaudu kuni 107 iooni/s. Naatriumikanalite tihedus varieerub vahemikus 1 kuni 50 ruutmikromeetri kohta. Selle tulemusena muutub membraani potentsiaali väärtus negatiivsest (-55 mV) 0,2 - 0,5 ms pärast positiivseks (umbes +30 mV), kuigi see ei saavuta naatriumi tasakaalupotentsiaali väärtust.
Selline kiire depolarisatsioon taastub ise: mida rohkem naatriumi rakku siseneb ja mida suurem on membraanipotentsiaali nihe, seda rohkem naatriumikanaleid avaneb ja seejärel siseneb rakku veelgi rohkem naatriumi:

Kui membraanipotentsiaali väärtus läheneb tasakaalulise naatriumipotentsiaali väärtusele, siis naatriumioonide liikumapanev jõud nõrgeneb, kuid samal ajal liikumapanev jõud suureneb, sundides kaaliumiioone, mille kanalid on pidevalt avatud, rakust lahkuma. . Kui membraanipotentsiaal muutub positiivseks, sulguvad pingepõhised naatriumikanalid ja rakust lähtuv kaaliumivool suureneb järsult. Sellega seoses toimub repolarisatsioon, st membraanipotentsiaali algväärtuse taastamine (mõnikord põhjustab kaaliumi väljundvool isegi lühiajalist hüperpolarisatsiooni). Aktsioonipotentsiaali kaks faasi, depolarisatsioon ja repolarisatsioon, moodustavad aktsioonipotentsiaali tipu ehk tipu (joonis 4.6).

Naatriumikanalite avanemine toimub ebatavaliselt kiiresti, mitte rohkem kui 10 mikrosekundi (st miljondiksekundi) jooksul, need jäävad avatuks mitu millisekundit, seejärel sulguvad kiiresti ja mõneks ajaks muutub kanalivalgu konformatsioon selliseks, et ei saa aktiveerida ja seega kanaleid avada. Seda seisundit nimetatakse tulekindlaks, umbes 1 ms jooksul on see absoluutne ja seejärel suhteline: absoluutse tulekindluse korral ei saa kanaleid avada ühegi toiminguga, suhtelise tulekindlusega ei saa neid aktiveerida lävedepolarisatsiooniga, kuid see võib olla üle läve.
Tulekindla oleku kogukestus määrab neuroni maksimaalse ergastuse sageduse. Näiteks kui tulekindel periood kestab 2 ms, siis saab neuron 1 s jooksul tulistada maksimaalselt 500 korda (1 s = 1000 ms: 2 ms = 500). Mõned neuronid võivad süttida sagedamini kui 500/s, teised harvemini: vastavalt sellele võib esimest nimetada labiilsemaks kui teist. Rakkude labiilsuse või funktsionaalse liikuvuse probleem XIX lõpus- 20. sajandi alguses uuris vene füsioloog N. E. Vvedensky, ta tutvustas ka labiilsuse mõõdu mõistet, kuna suurim arv elektrilised võnked, mida närv või lihas suudab sekundiga reprodutseerida. Nii et näiteks närv on Vvedenski järgi võimeline ergastama kuni 500/s ja lihas ainult kuni 200/s, st närv on labiilsem objekt kui lihas.
Mida keerulisemaid ülesandeid aju lahendab, seda rohkem suur kogus ta vajab neuroneid. Kolju ja seljaajukanaliga piiratud ruumi peab aga mahtuma kogu neuronite mass ning seetõttu peavad närvirakud olema väikesed ja nende protsessid üsna õhukesed. Kuid nagu teate, mida peenem ja pikem on juht, seda suurem on takistus seda läbivale voolule. Tööpinge neuronis (V) ei saa olla suurem kui aktsioonipotentsiaali amplituud, st ligikaudu 100-120 mV, ja vool (I) on Ohmi seaduse kohaselt otseselt võrdeline pingega ja pöördvõrdeline takistus: I = V / R
Sellest järeldub, et aktsioonipotentsiaal tavapärasel viisil elektri juhtimiseks ei saa levida kaugele. Väga õhuke aksonmembraan, mida ümbritseb elektrit juhtiv keskkond, on väga suure mahtuvusega, mis pärsib elektrisignaali levikut. Lihtsamalt öeldes: õhuke tsütoplasmaatiline protsess on väga halb juht. Kuid vaatamata sellele levivad aktsioonipotentsiaalid piki aksonit suure kiirusega, ulatudes 100 m/s. Kuidas see juhtub?
Kui naatriumi läbilaskvus membraani ergastatud piirkonnas tõuseb ja aktsioonipotentsiaal tekib, algab positiivsete laengute elektrotooniline levik ergastamata alale - see protsess on ringvool (joonis 4.7). Selline vool depolariseerib külgneva ala, mida pole veel ergastatud, ja kui see depolarisatsioon jõuab läveni, tekib aktsioonipotentsiaal. Nüüd muutub see piirkond membraani järgmisele alale mõjuva ringvoolu allikaks, nüüd tekib selles piirkonnas aktsioonipotentsiaal, mille kõik parameetrid on seda tüüpi neuronite jaoks standardsed.

Pärast naatriumi läbilaskvuse suurenemist aktsioonipotentsiaali moodustumise ajal suureneb kaaliumi vool rakust. Koos kaaliumiga lahkuvad rakust positiivsed laengud ning membraanipotentsiaali eelmine väärtus taastub. Mis tahes pikkuse aksoni korral on aktsioonipotentsiaalide amplituud kõikjal muutumatu, kuna aksoni igas eraldi sektsioonis moodustuvad need tegelikult uuesti. Füsioloogilises mõttes on see oluline, sest signaali püsivus tähendab info edastamist mööda aksonit ilma moonutusteta.
Müeliniseerunud aksonites levib ringvool külgnevasse sõlme, kus tekib aktsioonipotentsiaal. Naatriumikanalite tihedus Ranvieri lõikepunktides on palju suurem kui tavalisel müeliniseerimata membraanil ja siia tulnud elektrotooniline ringvool depolariseerib lõikepunkti kergesti läviväärtuseni. Saadud aktsioonipotentsiaal toimib järgmise pealtkuulamise jaoks ringvoolu allikana.
Ergastuse juhtimist närvis või lihases saab registreerida ekstratsellulaarsete elektroodide abil, mis asetatakse nende pinnale kahele erinevale punktile ja ühendatakse salvestusseadmega. Aktsioonipotentsiaali levimisel depolariseerub membraan vaheldumisi esmalt ergutusallikale lähima elektroodi all ja seejärel kaugema elektroodi all. Mõlemal juhul registreeritakse elektroodide potentsiaalide erinevus, kuna üks neist asub depolariseeritud ja seetõttu elektronegatiivses piirkonnas väljaspool membraani ning teine jääb puutumatusse elektropositiivsesse punkti, kus ergastus ei ole veel alanud või on tekkinud. juba lõppenud.
Kahe elektroodi abil membraani läbivate aktsioonipotentsiaalide registreerimist nimetatakse bipolaarseks. Selle meetodi abil registreeritakse kaks aktsioonipotentsiaali faasi: positiivne ja negatiivne. Kui ühe elektroodi all asuv ala muudetakse mitteerututavaks (selleks saate seda mõjutada mingi anesteetikumiga, näiteks novokaiiniga), jääb aktsioonipotentsiaalist alles ainult üks faas. Sellist määramist nimetatakse unipolaarseks (või monopolaarseks).
Mõnede autoimmuun- ja viirushaiguste korral hävib müeliinkesta, mis põhjustab arvukalt neuroloogilisi häireid kuni mõne funktsiooni täieliku kadumiseni; samas võib häirida nii emotsionaalne aktiivsus kui ka intellekt. Demüeliniseeriva haiguse näide on hulgiskleroos.
Kokkuvõte
Elektriliste signaalide tekkimine on seotud rakumembraani omadustega. Membraanpumbad loovad ioonide kontsentratsiooni gradiente. Puhkeolekus kaaliumi jaoks avanevad ioonikanalid võimaldavad sellel rakust lahkuda ja loovad seeläbi puhkemembraani potentsiaali, mis on lähedane kaaliumi tasakaalupotentsiaalile. Kui see väheneb läviväärtuseni, tekivad pingest sõltuvad naatriumikanalid avanevad ja isetaastuv depolarisatsioon, membraanipotentsiaali väärtus muutub positiivseks, mis põhjustab naatriumikanalite sulgumise, mis on ajutiselt inaktiveeritud. Kaaliumiioonide väljuv vool taastab membraanipotentsiaali varasema väärtuse. Aktsioonipotentsiaali tekkimine põhjustab ringikujulise elektrivoolu ilmnemise, mis depolariseerib membraani külgneva osa läviväärtuseni. Sellega seoses levib aktsioonipotentsiaal mööda aksonit ilma amplituudi vähenemiseta.
Küsimused enesekontrolliks
46. Milliste ioonide kontsentratsioon rakus on palju suurem kui rakuvälises vedelikus?
A. naatrium; B. Kaalium; V. Kaltsium; G. Kloor; D. Magneesium.
47. Millised ioonkanalid on raku füsioloogilise puhkamise ajal avatud?
A. Kõigi katioonide jaoks; B. Anioonide jaoks; B. Naatriumi jaoks; D. Kaaliumi jaoks; B. Kaltsiumi jaoks.
48. Kui suur on hiidkalmaari aksoni membraani tasakaalupotentsiaal kaaliumioonide jaoks?
A. +55 mV; B. +25-30 mV; V = 0; G. -60 mV; D. -75 mV.
49. Miks peetakse naatrium-kaaliumpumpa elektrogeenseks?
A. See tarbib ATP energiat; B. See loob kaaliumikontsentratsiooni gradiendi; B. See viib naatriumi rakust välja; D. Ühe tsükli jooksul eemaldab see rakust positiivse laengu; D. See annab glükoosi ja aminohapete sümporti.
50. Milliste ioonide rakku sisenemist takistab membraani sise- ja välispinna vaheline elektriväli?
A. Kaliya; B. naatrium; B. Kloor; G. Kaltsium; E. Kõik katioonid.
51. Mis tüüpi kanalite kaudu kaaliumiioonid difundeeruvad, kui rakk on füsioloogilises puhkeseisundis?
A. potentsiaalne sõltuv; B. Kemosõltuv; B. Potentsiaalist sõltuv ja kemoteraapiast sõltuv; G. mehaaniliselt juhitav; D. Passiivne.
52. Milline järgmistest on tüüpiline tulekindluse seisundile?
A. pingest sõltuvate kanalite aktiveeritud olek; B. pingest sõltuvate kanalite inaktiveeritud olek; B. Potentsiaalist sõltuvate kanalite avatud olek; D. Potentsiaalist sõltuvate kanalite suletud olek; E. Potentsiaalist sõltuvate kanalite läbilaskevõime suurendamine.
53. Milline järgmistest ainetest on blokeerija ioonkanalid kaaliumi jaoks?
A. Tetraetüülammoonium; B. Tetrodotoksiin; B. Batrakotoksiin; G. Curare; E. a-Bungarotoksiin.
54. Milline peaks olema väikseim depolarisatsiooninihe, kui membraani potentsiaal on -69 mV ja depolarisatsiooni kriitiline tase on -56 mV?
A. 6 mV; B. 9 mV; V. 11 mV; D. 13 mV; D. 15 mV.
55. Kui neuroni refraktaarne periood kestab 3 ms, siis millise maksimaalse sagedusega saab seda ergutada?
A. 555 Hz; B. 444 Hz; V. 333 Hz; D. 222 Hz; D. 111 Hz.
56. Milliseks ioonide liikumiseks läbi puhkeolekus raku rakumembraani on vaja energiat?
A. Kaltsium rakus; B. Naatrium rakku; B. Kloor puuri kohta; G. Kaalium rakust; D. Kaltsium rakust.
57. Milline ioonide liikumine toimub ainult difusiooni teel?
A. Naatrium rakust; B. Kaalium rakust välja; B. Kaltsium rakust; G. Kaalium puuris; D. Glükoos rakku.
58. Mis põhjustab ergastamisel avanevate pingest sõltuvate naatriumikanalite sulgumise?
A. Repolarisatsiooni protsess; B. Membraanipotentsiaali algväärtuse taastamine; B. Membraanipotentsiaali positiivse väärtuse määramine; D. Depolarisatsiooni kriitilise taseme saavutamine; D. Hüperpolarisatsiooni esinemine.
59. Millised peaksid olema kloori membraani läbilaskvuse suurenemise tagajärjed membraanipotentsiaali reaalväärtusel -55 mV?
A. Vähenenud membraanipotentsiaal; B. Hüperpolarisatsioon; B. Depolarisatsioon; D. Membraani potentsiaali väärtus ei muutu; D. Tekib tegevuspotentsiaal.
60. Iga aktsioonipotentsiaal moodustub kahest faasist, mis üksteise järel asendavad – need on:
A. Hüperpolarisatsioon-depolarisatsioon; B. Depolarisatsioon-repolarisatsioon; B. Hüperpolarisatsioon-repolarisatsioon; G. Repolarisatsioon – depolarisatsioon; E. Repolarisatsioon - membraanipotentsiaali algväärtuse taastamine.
Tere! Definitsiooni järgi on kontsentratsioonigradient suunatud madalama kontsentratsiooni küljelt kõrgema kontsentratsiooni poolele. Seetõttu öeldakse, et difusioon on alati suunatud kontsentratsioonigradiendi vastu, st. suurema kontsentratsiooniga küljelt väiksema kontsentratsiooniga küljele.
Kui aga lugeda kirjandust raku elutegevusest, fotosünteesist, siis seal on alati kirjas, et “mööda kontsentratsioonigradienti” on kontsentratsiooni vähenemise suunas ja “vastu kontsentratsioonigradienti” on kontsentratsiooni suurenemise suunas ja seega on näiteks lihtne difusioon rakkudes (või muidu tavaline difusioon) suunatud piki kontsentratsioonigradienti.
Kuid siin on vastuolu. Selgub, et väljend "mööda kontsentratsioonigradienti" on tegelikult liikumine, mis on vastupidine kontsentratsiooni gradiendi suunale. Kuidas see saab olla?
See püsiv ja laialt levinud viga on tingitud kontsentratsioonigradiendi vektori suuna mõistmise erinevusest füüsikas ja bioloogias. Bioloogid eelistavad rääkida kontsentratsioonigradiendi vektori suunast suuremalt väärtuselt väiksemale ja füüsikud väiksemast suuremale.