Sipelghappe tabel. Sipelghappe struktuurkeemiline valem. Aine kasutamine Sipelghape
Sipelghappe koostoime ammoniaagilahusegahõbehüdroksiid(hõbepeegli reaktsioon). Sipelghappemolekul HCOOH sisaldab aldehüüdrühma, nii et seda saab lahuses avada aldehüüdidele iseloomulike reaktsioonide, näiteks hõbepeegli reaktsiooniga.
Katseklaasis valmistatakse argentum(I)hüdroksiidi ammoniaagilahus. Selleks lisage 1-2 ml argentum (I) nitraadi 1% lahusele 1-2 tilka 10% naatriumhüdroksiidi lahust, tekkinud argentum (I) oksiidi sade lahustatakse, lisades tilkhaaval 5. % ammoniaagi lahus. Saadud selgele lahusele lisatakse 0,5 ml sipelghapet. Katseklaasi koos reaktsiooniseguga kuumutatakse mitu minutit veevannis (vee temperatuur vannis on 60 0 -70 0 C). Metallist hõbe eraldub katseklaasi seintele peegelkatte kujul või tumeda sademe kujul.
HCOOH+2Ag[(NH3)2]OH → CO2 + H2O+2Ag+ 4NH3
b) Sipelghappe oksüdeerimine kaaliumpermanganaadiga. Katseklaasi pannakse ligikaudu 0,5 g sipelghapet või selle soola, 0,5 ml 10% sulfaathappe lahust ja 1 ml 5% kaaliumpermanganaadi lahust. Katseklaas suletakse gaasi väljalasketoruga korgiga, mille ots lastakse 2 ml lubja- (või bariit)veega teise katseklaasi ja reaktsioonisegu kuumutatakse.
5HCOOH+2KMnO4+3H2SO4 → 5CO2+8H2O+K2SO4+2MnSO4
V) Sipelghappe lagunemine kuumutamisel kooskontsentreeritud väävelhape. (Käsitöö!) Kuiva katseklaasi lisage 1 ml sipelghapet või 1 g selle soola ja 1 ml kontsentreeritud sulfaathapet. Katseklaas suletakse gaasi väljalasketoruga korgiga ja kuumutatakse ettevaatlikult. Sipelghape laguneb, moodustades süsinik(II)oksiidi ja vee. Süsinik(II)oksiid süüdatakse gaasi väljalasketoru avause juures. Pöörake tähelepanu leegi olemusele.
Pärast töö lõpetamist tuleb reaktsiooniseguga katseklaasi jahutada, et peatada mürgise vingugaasi eraldumine.
Kogemus 12. Steariin- ja oleiinhapete koostoime leelistega.
Kuivas katseklaasis lahustage ligikaudu 0,5 g steariini dietüüleetris (ilma kuumutamata) ja lisage 2 tilka fenoolftaleiini 1% alkoholilahust. Seejärel lisatakse tilkhaaval 10% naatriumhüdroksiidi lahust. Esialgu ilmuv karmiinpunane värv kaob raputamisel.
Kirjutage steariinhappe ja naatriumhüdroksiidi reaktsiooni võrrand. (Steariin on steariin- ja palmitiinhappe segu.)
C17H35COOH+NaOH→C17H35COONa+H2O
naatriumstearaat
Korrake katset 0,5 ml oleiinhappega
C17H33COOH+NaOH→C17H33COONa+H2O
naatriumoleaat
Kogemus 13. Oleiinhappe ja broomivee ja kaaliumpermanganaadi lahuse suhe.
A) Oleiinhappe reaktsioon broomiveega Katseklaasi valatakse 2 ml vett ja lisatakse umbes 0,5 g oleiinhapet. Segu loksutatakse tugevalt.
b) Oleiinhappe oksüdeerimine kaaliumpermanganaadiga. Katseklaasi pannakse 1 ml 5% kaaliumpermanganaadi lahust, 1 ml 10% naatriumkarbonaadi lahust ja 0,5 ml oleiinhapet. Segu segatakse intensiivselt. Pange tähele reaktsioonisegus toimuvaid muutusi.

Kogemus 14. Bensoehappe sublimatsioon.
Väikeste bensoehappekoguste sublimeerimine toimub portselantopsis, mis on suletud koonilise lehtri laia otsaga (vt joonis 1), mille läbimõõt on veidi väiksem topsi läbimõõdust.
Lehtri tila on kinnitatud statiivi jalasse ja kaetud tihedalt vatiga ning selleks, et sublimaat tassi tagasi ei kukuks, kaetakse see ümmarguse filterpaberitükiga, milles on mitu auku. Väikeste bensoehappekristallidega (t pl = 122,4 0 C; sublimeerub alla t pl) portselantopsi kuumutatakse ettevaatlikult aeglaselt väikesel leek-gaaspõletil (asbestvõrgul). Ülemist lehtrit saate jahutada, kui asetate peale külma veega niisutatud filterpaberi. Pärast sublimatsiooni peatumist (15-20 minuti pärast) kantakse sublimaat ettevaatlikult spaatliga pudelisse.

Märge. Töö teostamiseks võib bensoehapet saastada liivaga.
Katseklaas, milles emulsioon on moodustunud, suletakse tagasijooksukorgiga, kuumutatakse veevannis, kuni see hakkab keema, ja loksutatakse. Kas õli lahustuvus suureneb kuumutamisel?
Katset korratakse, kuid päevalilleõli asemel lisatakse katseklaasidesse orgaaniliste lahustitega väike kogus loomset rasva (sea-, veise- või lambarasv).
b) Rasva küllastumatuse määra määramine reaktsioonil broomigavesi. (Käsitöö!) Katseklaasi valatakse 0,5 ml päevalilleõli ja 3 ml broomivett. Katse sisu loksutatakse tugevalt. Mis juhtub broomveega?
V) Taimeõli koostoime kaaliumi vesilahusegapermanganaat (E.E. Wagneri reaktsioon). Katseklaasi valatakse ligikaudu 0,5 ml päevalilleõli, 1 ml 10% naatriumkarbonaadi lahust ja 1 ml 2% kaaliumpermanganaadi lahust. Loksutage katseklaasi sisu tugevalt. Kaaliumpermanganaadi lilla värv kaob.
Broomvee värvimuutus ja reaktsioon kaaliumpermanganaadi vesilahusega on kvalitatiivsed reaktsioonid mitmekordse sideme (küllastumatus) esinemisele orgaanilise aine molekulis.
G) Rasva seebistamine naatriumhüdroksiidi alkoholilahusega 1,5–2 g tahket rasva pannakse 50–100 ml mahutavusega koonilisse kolbi ja lisatakse 6 ml 15% naatriumhüdroksiidi alkoholilahust. Kolb suletakse õhkjahutiga korgiga, reaktsioonisegu segatakse ja kolbi kuumutatakse veevannis loksutades 10-12 minutit (vee temperatuur vannis on umbes 80 0 C). Reaktsiooni lõppemise kindlakstegemiseks valatakse mõni tilk hüdrolüsaati 2-3 ml kuuma destilleeritud vette: kui hüdrolüsaat lahustub täielikult, ilma rasvatilku vabastamata, võib reaktsiooni lugeda lõppenuks. Pärast seebistamise lõppu soolatakse seep hüdrolüsaadist välja, lisades 6–7 ml kuuma küllastunud naatriumkloriidi lahust. Vabanenud seep hõljub pinnale, moodustades lahuse pinnale kihi. Pärast settimist jahutatakse segu külma veega ja tahkunud seep eraldatakse.
Protsessi keemia, kasutades näitena tristeariini:

Kogemus 17. Seebi ja sünteetiliste pesuvahendite omaduste võrdlus
A) Seos fenoolftaleiiniga. Valage ühte katseklaasi 2-3 ml 1% pesuseebi lahust ja teise sama palju sünteetilise pesupulbri 1% lahust. Lisage mõlemasse katseklaasi 2-3 tilka fenoolftaleiini lahust. Kas neid pesuvahendeid saab kasutada leelisetundlike kangaste pesemiseks?
b) Seos hapetega. Katseklaasides olevatele seebi ja pesupulbri lahustele lisage mõni tilk 10% happelahust (kloriid või sulfaat). Kas raputamisel tekib vaht? Kas testitud toodete puhastusomadused säilivad happelises keskkonnas?
C17H35COONa+HCl→C17H35COOH↓+NaCl
V) SuhtumineTokaltsiumkloriid. Seebi ja pesupulbri lahustele katseklaasides lisage 0,5 ml 10% kaltsiumkloriidi lahust. Loksutage katseklaaside sisu. Kas see tekitab vahu? Kas neid pesuvahendeid saab kasutada ka karedas vees?
C17H35COONa+CaCl2 →Ca(C17H35COO)2↓+2NaCl
Kogemused 18 . Glükoosi interaktsioon argentum(I)oksiidi ammoniaagilahusega (hõbepeegli reaktsioon).
Katseklaasi valatakse 0,5 ml argentum(I) nitraadi 1% lahust, 1 ml 10% naatriumhüdroksiidi lahust ja tilkhaaval lisatakse 5% ammoniaagi lahust, kuni moodustub argentum(I) hüdroksiidi sade. lahustub. Seejärel lisage 1 ml 1% glükoosilahust ja kuumutage katseklaasi sisu 5 - 10 minutit veevannis temperatuuril 70 0 - 80 0 C. Katseklaasi seintele eraldub metallist hõbedat. peegelkate. Kuumutamise ajal ei tohi katseklaase raputada, vastasel juhul ei eraldu katseklaaside seintele metallist hõbedat, vaid tumeda sademe kujul. Hea peegli saamiseks keedetakse esmalt 10% naatriumhüdroksiidi lahust katseklaasides, seejärel loputatakse need destilleeritud veega.

Katseklaasi valatakse 3 ml 1% sahharoosilahust ja lisatakse 1 ml 10% väävelhappe lahust. Saadud lahust keedetakse 5 minutit, seejärel jahutatakse ja neutraliseeritakse kuiva naatriumvesinikkarbonaadiga, lisades seda segades väikeste portsjonitena (olge ettevaatlik, eraldunud süsinikmonooksiidist (IY) vedelik vahutab). Pärast neutraliseerimist (kui CO 2 eraldumine peatub) lisatakse võrdne kogus Fehlingi reaktiivi ja vedeliku ülemist osa kuumutatakse, kuni see hakkab keema.
Kas reaktsioonisegu värvus muutub?
Teises katseklaasis kuumutatakse 1,5 ml 1% sahharoosilahuse ja võrdse koguse Fehlingi reagendi segu. Võrreldakse katse tulemusi - sahharoosi reaktsiooni Fehlingi reagendiga enne hüdrolüüsi ja pärast hüdrolüüsi.
C 12 H 22 O 11 + H 2 O C 6 H 12 O 6 + C 6 H 12 O 6
glükoos fruktoos
Märge. Koolilaboris võib Fehlingi reaktiivi asendada vaskhüdroksiidiga (ΙΙ).
Katse 20. Tselluloosi hüdrolüüs.
Asetage mõned väga peeneks hakitud filterpaberi (tselluloosi) tükid kuiva 50–100 ml koonilisse kolbi ja niisutage neid kontsentreeritud sulfaathappega. Segage kolvi sisu põhjalikult klaaspulgaga, kuni paber on täielikult hävinud ja moodustub värvitu viskoosne lahus. Seejärel lisatakse sellele väikeste portsjonitena (ettevaatlikult!) segades 15–20 ml vett, kolb ühendatakse õhkjahutiga ja reaktsioonisegu keedetakse perioodiliselt segades 20–30 minutit. Pärast hüdrolüüsi lõppu valatakse 2–3 ml vedelikku, neutraliseeritakse kuiva naatriumkarbonaadiga, lisades seda väikeste portsjonitena (vedel vahud) ja redutseerivate suhkrute olemasolu tuvastatakse reaktsioonil Fehlingi reagendi või vasega (ΙΙ). ) hüdroksiid.
(C6H10O5)n+nH2O→nC6H12O6
Tselluloosi glükoos
Katse 21. Glükoosi koostoime vaskhüdroksiidiga (ΙΙ).
a) Katseklaasi pannakse 2 ml 1% glükoosilahust ja 1 ml 10% naatriumhüdroksiidi. Lisage saadud segule 1–2 tilka 5% vase (ΙΙ) sulfaadi lahust ja raputage katseklaasi sisu. Algselt moodustunud sinakas vask(II)hüdroksiidi sade lahustub koheselt, mille tulemuseks on sinine läbipaistev vask(II)sahharaadi lahus. Protsessi keemia (lihtsustatud): -  b) Katseklaasi sisu kuumutatakse põleti leegi kohal, hoides katseklaasi kaldu nii, et ainult lahuse ülemine osa kuumeneb ja alumine osa jääb kuumutamata (kontrolliks). Õrnalt keemiseni kuumutamisel muutub sinise lahuse kuumutatud osa vask(I)hüdroksiidi moodustumise tõttu oranžikaskollaseks. Pikema kuumutamise korral võib tekkida vask(I)oksiidi sade.
b) Katseklaasi sisu kuumutatakse põleti leegi kohal, hoides katseklaasi kaldu nii, et ainult lahuse ülemine osa kuumeneb ja alumine osa jääb kuumutamata (kontrolliks). Õrnalt keemiseni kuumutamisel muutub sinise lahuse kuumutatud osa vask(I)hüdroksiidi moodustumise tõttu oranžikaskollaseks. Pikema kuumutamise korral võib tekkida vask(I)oksiidi sade.
 Kogemus 22. Sahharoosi koostoime metallhüdroksiididega. A) Reaktsioon vaskhüdroksiidiga (ΙΙ) leeliselises keskkonnas. Katseklaasis segage 1,5 ml 1% sahharoosi lahust ja 1,5 ml 10% naatriumhüdroksiidi lahust. Seejärel lisatakse tilkhaaval 5% vasksulfaadi (ΙΙ) lahus. Algselt moodustunud kahvatusinine vaskhüdroksiidi (ΙΙ) sade lahustub raputamisel ja lahus omandab sinakasvioletse värvuse kompleksse vask (ΙΙ) sahharaadi moodustumise tõttu.
Kogemus 22. Sahharoosi koostoime metallhüdroksiididega. A) Reaktsioon vaskhüdroksiidiga (ΙΙ) leeliselises keskkonnas. Katseklaasis segage 1,5 ml 1% sahharoosi lahust ja 1,5 ml 10% naatriumhüdroksiidi lahust. Seejärel lisatakse tilkhaaval 5% vasksulfaadi (ΙΙ) lahus. Algselt moodustunud kahvatusinine vaskhüdroksiidi (ΙΙ) sade lahustub raputamisel ja lahus omandab sinakasvioletse värvuse kompleksse vask (ΙΙ) sahharaadi moodustumise tõttu.
b) Kaltsiumsahharaadi saamine. Väikeses klaasis (25 - 50 ml), valage 5 - 7 ml 20% sahharoosilahust ja lisage segades tilkhaaval värskelt valmistatud lubjapiim. Kaltsiumhüdroksiid lahustub sahharoosilahuses. Sahharoosi võimet toota lahustuvaid kaltsiumsahharaate kasutatakse tööstuses suhkru puhastamiseks suhkrupeedist eraldamisel. V) Spetsiifilised värvireaktsioonid. Kahte katseklaasi valatakse 2-5 ml 10% sahharoosi lahust ja 1 ml 5% naatriumhüdroksiidi lahust. Seejärel lisage paar tilka ühte katseklaasi 5- protsentuaalne koobalt (ΙΙ) sulfaadi lahus, teises - paar tilka 5- nikkel (ΙΙ) sulfaadi protsentuaalne lahus. Koobaltsoolaga katseklaasis ilmub violetne värv ja niklisoolaga katseklaasis roheline värv, katse 23. Tärklise koostoime joodiga. Katseklaasi valatakse 1 ml 1% tärklisepasta lahust ja seejärel lisatakse mõni tilk joodi veega tugevalt lahjendatud kaaliumjodiidis. Katseklaasi sisu muutub siniseks. Saadud tumesinine vedelik kuumutatakse keemiseni. Värv kaob, kuid ilmub uuesti pärast jahutamist. Tärklis on heterogeenne ühend. See on segu kahest polüsahhariidist - amüloosist (20%) ja amülopektiinist (80%). Amüloos lahustub soojas vees ja annab joodiga sinise värvi. Amüloos koosneb peaaegu hargnemata kruvi- või heeliksistruktuuriga glükoosijääkide ahelatest (umbes 6 glükoosijääki kruvi kohta). Heeliksi sisse jääb umbes 5 μm läbimõõduga vaba kanal, millesse on põimitud joodi molekulid, moodustades värvilisi komplekse. Kuumutamisel need kompleksid hävivad. Amülopektiin ei lahustu soojas vees ja paisub selles, moodustades tärklisepasta. See koosneb glükoosijääkide hargnenud ahelatest. Amülopektiin koos joodiga annab punakasvioletse värvuse joodi molekulide adsorptsiooni tõttu külgahelate pinnal. Kogemus 24. Tärklise hüdrolüüs. A) Tärklise happeline hüdrolüüs. 50 ml koonilisse kolbi valatakse 20–25 ml 1% tärklisepastat ja 3–5 ml 10% sulfaathappe lahust. 1 ml väga lahjendatud joodi lahust kaaliumjodiidis (helekollane) valatakse 7–8 katseklaasi, katseklaasid asetatakse alusele. Lisage esimesse katseklaasi 1–3 tilka katseks valmistatud tärkliselahust. Märgitakse saadud värv. Seejärel kuumutatakse kolbi asbestvõre peal väikese põleti leegiga. 30 sekundit pärast keetmise algust võetakse pipetiga lahuse teine proov, mis lisatakse joodilahusega teise katseklaasi ja pärast loksutamist märgitakse lahuse värvus. Seejärel võetakse lahuse proovid iga 30 sekundi järel ja lisatakse järgmistesse joodilahusega katseklaasidesse. Pange tähele lahuste värvi järkjärgulist muutumist reaktsioonil joodiga. Värvimuutus toimub järgmises järjekorras, vt tabelit.
Pärast seda, kui reaktsioonisegu lakkab joodiga värvi andmast, keedetakse segu veel 2–3 minutit, seejärel jahutatakse ja neutraliseeritakse 10-protsendilise naatriumhüdroksiidi lahusega, lisades seda tilkhaaval, kuni keskkond on aluseline ( roosa värvuse ilmumine fenoolftaleiini indikaatorpaberil). Osa leeliselisest lahusest valatakse katseklaasi, segatakse võrdse koguse Fehlingi reaktiiviga või värskelt valmistatud vaskhüdroksiidi (ΙΙ) suspensiooniga ja vedeliku ülemist osa kuumutatakse, kuni see hakkab keema.
(
Lahustuv
Dekstriinid
C6H10O5)n (C6H10O5)x (C6H10O5)y
maltoos
n/2 C 12 H 22 O 11 nC 6 H 12 O 6
b) Tärklise ensümaatiline hüdrolüüs.
Närige hästi väike tükk musta leiba ja asetage see katseklaasi. Lisage sellele mõni tilk 5-protsendilist vasksulfaadi (ΙΙ) lahust ja 05–1 ml 10-protsendilist naatriumhüdroksiidi lahust. Katseklaasi koos selle sisuga kuumutatakse. 3. Lämmastikku sisaldavate orgaaniliste ainete tootmise ja omaduste uurimise näidiskatsete tehnika ja metoodika.
Varustus: keeduklaasid, klaaspulk, katseklaasid, Wurtzi kolb, tilklehter, keeduklaas, klaasist gaasi väljalasketorud, ühenduskummtorud, kild.
Reaktiivid: aniliin, metüülamiin, lakmus ja fenoolftaleiini lahused, kontsentreeritud kloriidhape, naatriumhüdroksiidi lahus (10%), valgendi lahus, kontsentreeritud sulfaathape, kontsentreeritud nitraathape, munavalge, vasksulfaadi lahus, plumbum (ΙΙ) atsetaat, fenooli lahus, formaliini.
Kogemus 1. Metüülamiini valmistamine. Lisage 100-150 ml Wurtzi kolbi 5-7 g metüülamiinkloriidi ja sulgege see korgiga, millesse on sisestatud tilklehter. Ühendage kummitoruga gaasi väljalasketoru klaasiotsaga ja langetage see veeklaasi. Lisage lehtrist tilkhaaval kaaliumhüdroksiidi lahus (50%). Kuumutage segu kolvis ettevaatlikult. Sool laguneb ja eraldub metüülamiin, mille tunneb kergesti ära iseloomuliku lõhna järgi, mis meenutab ammoniaagi lõhna. Metüülamiin koguneb klaasi põhja veekihi alla: + Cl - +KOH → H 3 C – NH 2 +KCl+H 2 O
Kogemus 2. Metüülamiini põletamine. Metüülamiin põleb õhus värvitu leegiga. Asetage põlev killu eelmises katses kirjeldatud seadme gaasi väljalasketoru avasse ja jälgige metüülamiini põlemist: 4H 3 C – NH 2 +9O 2 → 4CO 2 +10 H 2 O+2N 2
Kogemus 3. Metüülamiini seos indikaatoritega. Viige saadud metüülamiin vee ja ühe indikaatoriga täidetud katseklaasi. Lakmus muutub siniseks ja fenoolftaleiin karmiinpunaseks: H 3 C – NH 2 + H – OH → OH See näitab metüülamiini põhiomadusi.
Kogemus 4. Soolade moodustumine metüülamiini toimel. a) Katseklaasi avasse tuuakse kontsentreeritud kloriidhappega niisutatud klaaspulk, millest eraldub metüülamiingaas. Võlukepp on mähitud udusse.
H 3 C – NH 2 +HCl → + Cl -
b) 1–2 ml valatakse kahte katseklaasi: ühte - ferum (III) kloriidi 3% lahus, teise - 5% vask (ΙΙ) sulfaadi lahus. Metüülamiini gaas juhitakse igasse katseklaasi. Ferum (III) kloriidi lahusega katseklaasis sadestub pruun sade ja vask (III) sulfaadi lahusega katseklaasis algselt moodustunud sinine sade lahustub, moodustades komplekssoola, mis on värvunud helesiniseks. . Protsesside keemia:
3 + OH - +FeCl 3 → Fe(OH)↓+3 + Cl -
2 + OH - +CuSO 4 → Cu(OH) 2 ↓+ + SO 4 -
4 + OH - + Cu(OH) 2 → (OH) 2 + 4H 2 O
Kogemus 5. Aniliini reaktsioon kloriidhappega. Katseklaasis koos 5 Lisage sama kogus kontsentreeritud kloriidhapet ml aniliinile. Jahutage katseklaasi külmas vees. Ilmub aniliinvesinikkloriidi sade. Lisage tahke vesinikkloriidaniliiniga katseklaasi veidi vett. Pärast segamist lahustub aniliinvesinikkloriid vees.
C 6 H 5 – NH 2 + HCl → Cl - Katse 6. Aniliini interaktsioon broomveega. Lisage 2-3 tilka aniliini 5 ml veele ja loksutage segu tugevalt. Lisage saadud emulsioonile tilkhaaval broomivett. Segu värvus muutub ja tribromoaniliini valge sade sadestub.

Kogemused 7. Kanga värvimine aniliinvärviga. Villa värvimine Ja happevärvidega siid. Lahustage 0,1 g metüülapelsini 50 ml vees. Lahus valatakse 2 klaasi. Ühele neist lisatakse 5 ml 4N sulfaathappe lahust. Seejärel kastetakse mõlemasse klaasi valge villase (või siidi) kanga tükid. Kudedega lahuseid keedetakse 5 minutit. Seejärel võetakse kangas välja, pestakse veega, pressitakse välja ja kuivatatakse õhu käes, riputatakse klaasvarraste külge. Pöörake tähelepanu kangatükkide värviintensiivsuse erinevusele. Kuidas mõjutab söötme happesus kanga värvimisprotsessi?
Kogemus 8. Tõendid funktsionaalrühmade olemasolu kohta aminohapete lahustes. a) Karboksüülrühma tuvastamine. 1 ml 0,2% naatriumhüdroksiidi lahusele, mis on fenoolftaleiiniga roosaks värvitud, lisage tilkhaaval 1% aminoatsetaathappe (glütsiini) lahust, kuni segu värvub: HOOC – CH 2 – NH 2 + NaOH → NaOOC – CH 2 – NH 2 + H 2 O b) Aminorühma tuvastamine. 1 ml 0,2% kloriidhappe lahusele, mis on värvitud siniseks Kongo indikaatoriga (happeline keskkond), lisage tilkhaaval 1% glütsiini lahust, kuni segu värvus muutub roosaks (neutraalne keskkond):
HOOC – CH 2 – NH 2 +HCl → Cl -
Kogemus 9. Aminohapete mõju näitajatele. Lisage katseklaasi 0,3 g glütsiini ja lisage 3 ml vett. Valage lahus kolme katseklaasi. Esimesse katseklaasi lisage 1-2 tilka metüülapelsini, teise sama palju fenoolftaleiini lahust ja kolmandasse lakmuslahust. Indikaatorite värvus ei muutu, mis on seletatav happeliste (-COOH) ja aluseliste (-NH 2) rühmade olemasoluga glütsiini molekulis, mis on vastastikku neutraliseeritud.
Kogemus 10. Valgu sade. a) Lisage tilkhaaval vasksulfaadi ja plumbum (ΙΙ) atsetaadi lahused kahte valgulahusega katseklaasi. Moodustuvad flokuleeritud sademed, mis lahustuvad liigsetes soolalahustes.
b) Lisage valgulahusega kahte katseklaasi võrdsed kogused fenooli ja formaliini lahuseid. Jälgige valkude sadestumist. c) Kuumutage valgulahust põleti leegis. Jälgige lahuse hägusust, mis on tingitud valguosakeste lähedal asuvate hüdratatsioonikestade hävimisest ja nende suurenemisest.
Kogemus 11. Valkude värvireaktsioonid. a) Ksantoproteiini reaktsioon. Lisage 1 ml valgule 5-6 tilka kontsentreeritud nitraathapet. Kuumutamisel muutuvad lahus ja sade erekollaseks. b) Biureetreaktsioon. 1–2 ml valgulahusele lisatakse sama kogus lahjendatud vasksulfaadi lahust. Vedelik muutub punakasvioletseks. Biureedi reaktsioon võimaldab tuvastada valgu molekulis peptiidsideme. Ksantoproteiini reaktsioon toimub ainult siis, kui valgumolekulid sisaldavad aromaatseid aminohappejääke (fenüülalaniin, türosiin, trüptofaan).
Kogemus 12. Reaktsioonid uureaga. A) Karbamiidi lahustuvus vees. Asetage katseklaasi 0,5 g kristallilist uureat ja lisage järk-järgult vett, kuni uurea on täielikult lahustunud. Tilk saadud lahust kantakse punasele ja sinisele lakmuspaberile. Milline reaktsioon (happeline, neutraalne või aluseline) toimub karbamiidi vesilahusel? Vesilahuses esineb uureat kahes tautomeerses vormis:

b) Karbamiidi hüdrolüüs. Nagu kõik happeamiidid, hüdrolüüsub uurea kergesti happelises ja aluselises keskkonnas. Valage katseklaasi 1 ml 20% uurea lahust ja lisage 2 ml selget bariidivett. Lahust keedetakse, kuni katseklaasi ilmub baariumkarbonaadi sade. Katseklaasist vabanenud ammoniaak tuvastatakse märja lakmuspaberi sinaka järgi.
H 2 N – C – NH 2 +2H 2 O → 2NH 3 + [HO – C – OH] → CO 2
→H2O 
Ba(OH) 2 + CO 2 → BaCO 3 ↓+ H 2 O
c) Biureedi moodustumine. Kuumutatakse kuivas katseklaasis 0,2 g uureat. Esiteks sulab uurea (temperatuuril 133 C), seejärel laguneb edasisel kuumutamisel, vabastades ammoniaagi. Ammoniaaki saab tuvastada lõhna järgi (hoolikalt!) ja katseklaasi avasse toodud märja punase lakmuspaberi sinaka tõttu. Mõne aja pärast tahkub katseklaasi sulam, hoolimata jätkuvast kuumutamisest:

Jahutage katseklaasi ja lisage 1-2 ml vett ja lahustage biureet madalal kuumusel. Sulatus sisaldab lisaks biureedile teatud koguses tsüanuurhapet, mis lahustub vees halvasti, mistõttu lahus muutub häguseks. Kui sete on settinud, valage biureedi lahus teise katseklaasi, lisage paar tilka 10% naatriumhüdroksiidi lahust (lahus muutub selgeks) ja 1-2 tilka 1% vasksulfaadi (ΙΙ) lahust. Lahus muutub roosakasvioletseks. Liigne vasksulfaat (ΙΙ) varjab iseloomuliku värvuse, muutes lahuse siniseks ja seetõttu tuleks seda vältida.
Kogemus 13. Orgaaniliste ainete funktsionaalne analüüs. 1. Orgaaniliste ühendite kvalitatiivne elementanalüüs. Kõige levinumad elemendid orgaanilistes ühendites peale süsiniku on vesinik, hapnik, lämmastik, halogeenid, väävel, fosfor. Tavapärased kvalitatiivsed analüüsimeetodid ei ole orgaaniliste ühendite analüüsimisel rakendatavad. Süsiniku, lämmastiku, väävli ja muude elementide tuvastamiseks hävitatakse orgaaniline aine naatriumiga sulandumisel ning uuritavad elemendid muudetakse anorgaanilisteks ühenditeks. Näiteks süsinik muutub süsinikoksiidiks (IU), vesinik veeks, lämmastik naatriumtsüaniidiks, väävel naatriumsulfiidiks, halogeenid naatriumhalogeniidideks. Järgmisena avastatakse elemendid tavapäraste analüütilise keemia meetodite abil.
1. Süsiniku ja vesiniku tuvastamine aine vask(II)oksiidi oksüdeerimise teel.

Seade süsiniku ja vesiniku samaaegseks tuvastamiseks orgaanilises aines:
1 – kuiv katseklaas sahharoosi ja vask(II)oksiidi seguga;
2 – lubjaveega katseklaas;
4 – veevaba vasksulfaat (ΙΙ).
Kõige levinum universaalne orgaanilise aine tuvastamise meetod. süsinik ja samal ajal vesinik on vask(II)oksiidi oksüdatsioon. Sel juhul muundatakse süsinik süsinikoksiidiks (IU) ja vesinik veeks. Asetage 0,2 gaasi väljalasketoruga kuiva katseklaasi (joonis 2). - 0,3 g sahharoosi ja 1–2 g vask(II)oksiidi pulbrit. Katseklaasi sisu segatakse põhjalikult, segu kaetakse pealt vask(II)oksiidi kihiga. - umbes 1 g. Katseklaasi ülemisse ossa (korgi alla) asetatakse väike tükk vatti, mis valatakse vähese veevaba vask(II)sulfaadiga. Katseklaas suletakse gaasi väljalasketoruga korgiga ja kinnitatakse statiivi jalga kergelt kaldega korgi poole. Lasen gaasi väljalasketoru vaba otsa lubja- (või bariit-) veega katseklaasi, nii et toru puudutab peaaegu vedeliku pinda. Esiteks kuumutatakse kogu katseklaasi, seejärel reaktsioonisegu sisaldavat osa tugevalt. Pange tähele, mis juhtub lubjaveega. Miks muudab vase (ΙΙ) sulfaat värvi?
Protsesside keemia: C12H22O11 +24CuO→12CO2 +11H2O+24Cu
Ca(OH) 2 +CO 2 → CaCO 3 ↓+H 2 O
CuSO 4 +5H 2 O → CuSO 4 ∙ 5H 2 O
2. Beilstei näidis peal halogeenid. Orgaanilise aine kaltsineerimisel vask(II)oksiidiga toimub selle oksüdatsioon. Süsinik muundatakse süsinik(ІУ) oksiidiks, vesinikuks - vette ja halogeenid (va fluor) moodustavad Cuprumiga lenduvaid halogeniide, mis värvivad leegi erkroheliseks. Reaktsioon on väga tundlik. Siiski tuleb meeles pidada, et leeki värvivad ka mõned teised vasksoolad, näiteks lämmastikku sisaldavate orgaaniliste ühendite (uurea, püridiini derivaadid, kinoliin jne) kaltsineerimisel tekkinud tsüaniidid. Vasktraati hoiab pistik kinni ja teine ots (silmus) kaltsineeritakse põleti leegis, kuni leek lakkab värvimast ja pinnale tekib must vask(II)oksiidi kate. Jahutatud silmust niisutatakse katseklaasi valatud kloroformiga ja sisestatakse uuesti põleti leeki. Esiteks muutub leek helendavaks (süsinik põleb), seejärel ilmub intensiivne roheline värv. 2Cu+O2 →2CuO
2CH – Cl 3 +5CuO→CuCl2 +4CuCl+2CO2 +H2O
Kontrollkatse tuleks teha, kasutades kloroformi asemel halogeenivaba ainet (benseen, vesi, alkohol). Puhastamiseks niisutatakse traati kloriidhappega ja kaltsineeritakse.
II. Funktsionaalrühmade avamine. Eelanalüüsi (füüsikalised omadused, elementaaranalüüs) põhjal on võimalik ligikaudselt määrata klass, kuhu antud uuritav aine kuulub. Neid eeldusi kinnitavad kvalitatiivsed vastused funktsionaalrühmadele.
1. Kvalitatiivsed reaktsioonid mitmele süsinik-süsinik sidemele. a) broomi lisamine. Topelt- ja kolmiksidemeid sisaldavad süsivesinikud lisavad kergesti broomi:

0,1 g (või 0,1 ml) aine lahusele 2-3 ml süsiniktetrakloriidis või kloroformis lisatakse loksutades tilkhaaval 5% broomi lahus samas lahustis. Broomi värvi silmapilkne kadumine viitab mitmekordse sideme olemasolule aines. Kuid broomilahuse värvi muudavad ka liikuvat vesinikku sisaldavad ühendid (fenoolid, aromaatsed amiinid, tertsiaarsed süsivesinikud). Asendusreaktsioon toimub aga vesinikbromiidi vabanemisel, mille olemasolu saab hõlpsasti tuvastada märja sinise lakmuse või Kongo paberi abil. b) Katse kaaliumpermanganaadiga. Nõrgalt aluselises keskkonnas kaaliumpermanganaadi mõjul aine oksüdeerub mitmiksideme lõhustamisega, lahuse värvus muutub ja moodustub flokuleeriv MnO 2 sade. - mangaani (IU) oksiid. 0,1 g (või 0,1 ml) vees või atsetoonis lahustatud ainele lisatakse loksutades tilkhaaval 1% kaaliumpermanganaadi lahust. Karmiinpunane-violetne värvus kaob kiiresti ja ilmub pruun MnO 2 sade. Kaaliumpermanganaat aga oksüdeerib teiste klasside aineid: aldehüüdid, mitmehüdroksüülsed alkoholid, aromaatsed amiinid. Sel juhul muutuvad ka lahused värvi, kuid oksüdatsioon toimub üldiselt palju aeglasemalt.
2. Aromaatsete süsteemide tuvastamine. Erinevalt alifaatsetest ühenditest võivad aromaatsed ühendid kergesti läbida asendusreaktsioone, moodustades sageli värvilisi ühendeid. Tavaliselt kasutatakse selleks nitreerimis- ja alküülimisreaktsioone. Aromaatsete ühendite nitreerimine. ('Ettevaatust! Veojõud!,) Nitreerimine viiakse läbi lämmastikhappe või nitreerimisseguga:
R – H + HNO 3 → RNO 2 + H 2 O
0,1 g (või 0,1 ml) ainet pannakse katseklaasi ja järk-järgult lisatakse pidevalt loksutades 3 ml nitreerimissegu (1 osa kontsentreeritud nitraathapet ja 1 osa kontsentreeritud sulfaathapet). Katseklaas suletakse pika klaastoruga korgiga, mis toimib püstjahutina ja kuumutatakse veevannis. 5 min temperatuuril 50 0 C. Segu valatakse klaasi koos 10 g purustatud jääga. Kui selle tulemusena sadestub tahke toode või õli, mis ei lahustu vees ja erineb algsest ainest, siis võib eeldada aromaatse süsteemi olemasolu. 3. Alkoholide kvalitatiivsed reaktsioonid. Alkoholide analüüsimisel kasutatakse nii hüdroksüülrühma liikuva vesiniku kui ka kogu hüdroksüülrühma asendusreaktsioone. a) Reaktsioon naatriummetalliga. Alkoholid reageerivad kergesti naatriumiga, moodustades alkoholis lahustuvad alkoholaadid:
2 R – OH + 2 Na → 2 RONa + H2
Katseklaasi pannakse 0,2–0,3 ml veevaba uuritavat ainet ja lisatakse ettevaatlikult väike hirsitera suurune metallist naatriumitükk. Gaasi eraldumine naatriumi lahustumisel näitab aktiivse vesiniku olemasolu. (Selle reaktsiooni võivad aga anda ka happed ja CH-happed.) b) Reaktsioon vask(II)hüdroksiidiga. Kahe-, kolme- ja mitmehüdroksüülsetes alkoholides lahustub erinevalt ühehüdroksüülsetest alkoholidest värskelt valmistatud vask(II)hüdroksiid, moodustades vastavate derivaatide (glükolaadid, glütseraadid) komplekssoolade tumesinise lahuse. Mõned tilgad valatakse katseklaasi (0,3–0,5 ml) 3% vask (ΙΙ) sulfaadi lahust ja seejärel 1 ml 10% naatriumhüdroksiidi lahust. Sadeneb želatiinsinine vaskhüdroksiidi (ΙΙ) sade. Sademe lahustumine 0,1 g uuritava aine lisamisel ja lahuse värvuse muutumine tumesiniseks kinnitavad mitmehüdroksüülse alkoholi olemasolu, mille hüdroksüülrühmad asuvad külgnevates süsinikuaatomites.
4. Fenoolide kvalitatiivsed reaktsioonid. a) Reaktsioon ferum(III)kloriidiga. Fenoolid annavad ferum(III)kloriidiga intensiivse värvusega komplekssoolasid. Tavaliselt ilmub sügavsinine või lilla värvus. Mõned fenoolid annavad rohelise või punase värvuse, mis on vees ja kloroformis rohkem väljendunud ning alkoholis halvem. Mitu uuritava aine kristalli (või 1-2 tilka) asetatakse katseklaasis 2 ml vette või kloroformi, seejärel lisatakse loksutades 1-2 tilka 3-protsendilist ferum(III)kloriidi lahust. Fenooli juuresolekul ilmub intensiivne violetne või sinine värv. Alifaatsed fenoolid koos ferum (ΙΙΙ) kloriidiga alkoholis annavad eredama värvuse kui vees ja fenoole iseloomustab veripunane värvus. b) Reaktsioon broomveega. Fenoolid koos tasuta orto- Ja paar- benseenitsükli positsioonid muudavad broomivee kergesti värvituks, mille tulemuseks on 2,4,6-tribromofenooli sade 
Väikest kogust uuritavat ainet loksutatakse 1 ml veega, seejärel lisatakse tilkhaaval broomivett. Lahus muudab värvi Ja valge sademe sade.
5. Aldehüüdide kvalitatiivsed reaktsioonid. Erinevalt ketoonidest oksüdeeruvad kõik aldehüüdid kergesti. Sellel omadusel põhineb aldehüüdide, kuid mitte ketoonide avastamine. a) Hõbedase peegli reaktsioon. Kõik aldehüüdid on kergesti redutseeritavad argentum(I)oksiidi ammoniaagilahusega. Ketoonid ei anna sellist reaktsiooni:
Hästi pestud katseklaasis segage 1 ml hõbenitraadi lahust 1 ml lahjendatud naatriumhüdroksiidi lahusega. Argentum (I) hüdroksiidi sade lahustatakse 25% ammoniaagilahuse lisamisega. Saadud lahusele lisatakse mõni tilk analüüsitava aine alkoholilahust. Katseklaas asetatakse veevanni ja kuumutatakse temperatuurini 50 0 - 60 0 C. Kui katseklaasi seintele eraldub metallist hõbedast läikiv kate, näitab see aldehüüdrühma olemasolu proovis. Tuleb märkida, et seda reaktsiooni võivad anda ka teised kergesti oksüdeeruvad ühendid: mitmehüdroksüülsed fenoolid, diketoonid, mõned aromaatsed amiinid. b) Reaktsioon langetusvedelikuga. Rasvad aldehüüdid on võimelised redutseerima kahevalentse vase ühevalentseks:
 Katseklaasi, milles on 0,05 g ainet ja 3 ml langetusvedelikku, kuumutatakse 3 - 5 minutit keevas veevannis. Kollase või punase vask(I)oksiidi sademe ilmumine kinnitab aldehüüdrühma olemasolu. b. Hapete kvalitatiivsed reaktsioonid. a) Happesuse määramine. Karboksüülhapete vesi-alkoholilahused näitavad happelist reaktsiooni lakmusele, Kongole või universaalsele indikaatorile. Tilk uuritava aine alkoholi vesilahust kantakse sinisele märjale lakmus-, Kongo- või universaalsele indikaatorpaberile. Happe juuresolekul muudab indikaator oma värvi: lakmus muutub roosaks, Kongo siniseks ja universaalne indikaator, olenevalt happesusest, kollasest oranžiks. Tuleb meeles pidada, et sulfoonhapped, nitrofenoolid ja
Mõned teised liikuva "happelise" vesinikuga ühendid, mis ei sisalda karboksüülrühma, võivad samuti anda indikaatori värvimuutuse. b) Reaktsioon naatriumvesinikkarbonaadiga. Kui karboksüülhapped interakteeruvad naatriumvesinikkarbonaadiga, eraldub süsinik(IY) oksiid: katseklaasi valatakse 1–1,5 ml naatriumvesinikkarbonaadi küllastunud lahust ja lisatakse 0,1–0,2 ml uuritava aine alkoholi vesilahust. . Süsinikoksiidi (IY) mullide eraldumine näitab happe olemasolu.
Katseklaasi, milles on 0,05 g ainet ja 3 ml langetusvedelikku, kuumutatakse 3 - 5 minutit keevas veevannis. Kollase või punase vask(I)oksiidi sademe ilmumine kinnitab aldehüüdrühma olemasolu. b. Hapete kvalitatiivsed reaktsioonid. a) Happesuse määramine. Karboksüülhapete vesi-alkoholilahused näitavad happelist reaktsiooni lakmusele, Kongole või universaalsele indikaatorile. Tilk uuritava aine alkoholi vesilahust kantakse sinisele märjale lakmus-, Kongo- või universaalsele indikaatorpaberile. Happe juuresolekul muudab indikaator oma värvi: lakmus muutub roosaks, Kongo siniseks ja universaalne indikaator, olenevalt happesusest, kollasest oranžiks. Tuleb meeles pidada, et sulfoonhapped, nitrofenoolid ja
Mõned teised liikuva "happelise" vesinikuga ühendid, mis ei sisalda karboksüülrühma, võivad samuti anda indikaatori värvimuutuse. b) Reaktsioon naatriumvesinikkarbonaadiga. Kui karboksüülhapped interakteeruvad naatriumvesinikkarbonaadiga, eraldub süsinik(IY) oksiid: katseklaasi valatakse 1–1,5 ml naatriumvesinikkarbonaadi küllastunud lahust ja lisatakse 0,1–0,2 ml uuritava aine alkoholi vesilahust. . Süsinikoksiidi (IY) mullide eraldumine näitab happe olemasolu.
RCOOH + NaHCO 3 → RCOONa + CO 2 + H 2 O
7. Amiinide kvalitatiivsed reaktsioonid. Amiinid lahustuvad hapetes. Paljudel amiinidel (eriti alifaatsetel seeriatel) on iseloomulik lõhn (heeringas, ammoniaak jne). Amiinide aluselisus. Alifaatsed amiinid kui tugevad alused võivad muuta selliste indikaatorite värvi nagu punane lakmus, fenoolftaleiin ja universaalne indikaatorpaber. Indikaatorpaberile (lakmus, fenoolftaleiin, universaalne indikaatorpaber) kantakse tilk uuritava aine vesilahust. Indikaatori värvi muutus näitab amiinide olemasolu. Sõltuvalt amiini struktuurist varieerub selle aluselisus laias vahemikus. Seetõttu on parem kasutada universaalset indikaatorpaberit. 8. Polüfunktsionaalsete ühendite kvalitatiivsed reaktsioonid. Bifunktsionaalsete ühendite (süsivesikud, aminohapped) kvaliteetseks tuvastamiseks kasutage ülalkirjeldatud reaktsioonide kompleksi.
Klass: 10
Tunni esitlus
Tagasi ette
Tähelepanu! Slaidide eelvaated on ainult informatiivsel eesmärgil ja ei pruugi esindada kõiki esitluse funktsioone. Kui olete sellest tööst huvitatud, laadige alla täisversioon.
1. Tunni eesmärk: tutvustada õpilastele metaanhappe üld- ja spetsiifilisi omadusi ristsõna “Sipelghappe keemia” täitmisel, sh orgaanilise aine valemi tuletamise ülesannete lahendamisel (vt. Lisa 1 ) (slaidid 1-2).
2. Tunni tüüp:õppetund uue materjali õppimiseks.
3. Varustus: arvuti, projektor, ekraan, videod keemilisest eksperimendist (sipelghappe oksüdeerimine kaaliumpermanganaadiga ja sipelghappe lagunemine kontsentreeritud väävelhappe mõjul), esitlus tunni jaoks, lehed õpilastele (vt. 2. lisa ).
4. Tunni edenemine
Sipelghappe struktuuri uurides teatab õpetaja, et see hape erineb teistest küllastunud monokarboksüülhapete homoloogse rea liikmetest, kuna karboksüülrühm ei ole seotud süsivesinikradikaaliga –R, vaid H-aatomiga ( slaid 3). Õpilased jõuavad järeldusele, et sipelghappel on nii karboksüülhapete kui ka aldehüüdide omadused, st. on aldehüüdhape (slaid 4).
Nomenklatuuri uurimine toimub probleemi lahendamise protsessis ( slaid 5): « Küllastunud ühealuselise karboksüülhappe sooli nimetatakse formiaatideks. Määrake selle happe nimi (vastavalt IUPAC-i nomenklatuurile), kui on teada, et see sisaldab 69,5% hapnikku" Ülesande lahenduse kirjutab üks klassi õpilastest tahvlile. Vastus on ant või metaan hape ( slaid 6).
Järgmisena ütleb õpetaja õpilastele ( slaid 7), et sipelghapet leidub röövikute ja mesilaste kibedates eritistes, kõrvenõgestes, männiokas, mõnedes puuviljades, loomade higis ja uriinis ning happelises eritises. sipelgad, kus selle avastas 1794. aastal saksa keemik Margraf Andreas-Sigismund ( slaid 8).
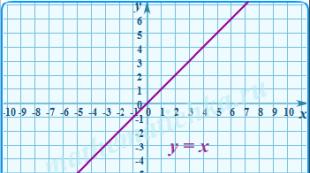
Sipelghappe füüsikalisi omadusi uurides teatab õpetaja, et see on värvitu, terava lõhna ja terava maitsega söövitav vedelik, mille keemis- ja sulamistemperatuurid on veelähedased (tkeemistemperatuur = 100,7 o C, sulamistemperatuur = 8,4 o C ). Nagu vesi, moodustab see vesiniksidemeid, seega vedelas ja tahkes olekus lineaarseid ja tsüklilisi assotsiatsioone ( slaid 9), seguneb veega mis tahes vahekorras ("nagu lahustub sarnases"). Järgmisena palutakse ühel õpilasel lahendada tahvli juures ülesanne: " On teada, et sipelghappe lämmastikuauru tihedus on 3,29. Seetõttu võib väita, et gaasilises olekus eksisteerib sipelghape kujul...» Ülesande lahendamisel jõuavad õpilased järeldusele, et gaasilises olekus esineb sipelghape kujul dimeerid- tsüklilised kaaslased ( slaid 10).
Sipelghappe valmistamine ( slaid 11-12) uurime järgmiste näidete abil:
1. Metaani oksüdeerimine katalüsaatoril:
2. Vesiniktsüaniidhappe hüdrolüüs (siinkohal tuleb õpilastele meelde tuletada, et süsinikuaatomis ei saa olla korraga rohkem kui kaks hüdroksüülrühma – karboksüülrühma moodustumisel toimub dehüdratsioon):
3. Kaaliumhüdriidi koostoime süsinikmonooksiidiga (IV):
4. Oksaalhappe termiline lagunemine glütserooli juuresolekul:
5. Süsinikmonooksiidi koostoime leelisega:
6. Kõige tulusam viis (majanduslike kulude seisukohalt – jäätmevaba protsess) sipelghappe tootmiseks on sipelghappe estri saamine (millele järgneb happeline hüdrolüüs) süsinikmonooksiidist ja küllastunud monohüdraadist alkoholist:
Kuna viimane sipelghappe saamise meetod on kõige lootustandvam, palutakse õpilastel lahendada tahvlil järgmine ülesanne ( slaid 12): „Kinnitage alkoholi valem, mida kasutatakse korduvalt (naases tsüklisse) vingugaasiga (II) reageerimiseks, kui on teada, et 30 g eetri põlemisel tekib 22,4 liitrit süsihappegaasi ja 18 g vett. Määrake selle alkoholi nimi."Ülesande lahendamise käigus jõuavad õpilased järeldusele, et sipelghappe sünteesiks kasutatakse seda metüül alkohol ( slaid 13).
Sipelghappe mõju inimorganismile uurimisel ( slaid 14) õpetaja teavitab õpilasi, et sipelghappe aurud ärritavad ülemisi hingamisteid ja silmade limaskesti, avaldavad ärritavat või söövitavat toimet - põhjustavad keemilist toimet. põletused (slaid 15). Järgmisena palutakse koolilastel leida meediast või teatmeteostest viise, kuidas nõgesest ja sipelgahammustusest põhjustatud põletustunnet kõrvaldada (vaadatakse järgmises tunnis).
Hakkame uurima sipelghappe keemilisi omadusi ( slaid 16) reaktsioonidest O-H sideme lõhustumisega (H-aatomi asendamine):


Materjali konsolideerimiseks tehakse ettepanek lahendada järgmine probleem ( slaid 18): « 4,6 g sipelghappe interaktsioonil tundmatu küllastunud ühehüdroksüülse alkoholiga tekkis 5,92 g estrit (kasutatakse lahustina ja lisandina teatud tüüpi rummile iseloomuliku aroomi andmiseks, kasutatakse vitamiinide B1, A, E tootmisel ). Määrake estri valem, kui on teada, et reaktsiooni saagis on 80%. Nimetage ester IUPAC-i nomenklatuuri järgi.Ülesande lahendamisel jõuavad kümnenda klassi õpilased järeldusele, et saadud ester on - etüülformiaat (slaid 19).
Õpetaja teatab ( slaid 20), mis reageerib sipelghappe C-H sideme lõhustumisega (a-C aatomi juures). pole tüüpiline, sest R=H. Ja reaktsioon C-C sideme lõhustamisega (karboksüülhapete soolade dekarboksüülimine viib alkaanide moodustumiseni!) viib vesiniku tootmiseni:
Happe redutseerimisreaktsioonide näidetena anname interaktsiooni vesiniku ja tugeva redutseerija - vesinikjodiidhappega:
Sissejuhatus oksüdatsioonireaktsioonidesse, mis kulgevad vastavalt skeemile ( slaid 21):
on soovitatav teostada ülesande ajal ( slaid 22):
« Korreleerige reagentide valemid, reaktsioonitingimused reaktsiooniproduktidega"(õpetaja võib näidata esimest võrrandit näitena ja ülejäänud pakkuda õpilastele kodutööna):
| UNDC + | Reaktiiv, reaktsioonitingimused | Toode 1 |
Toode 2 |
|||
| 1) | Ag 2 O, NH 3, t o C | 1) | CO | 1) | – | |
| 2) | Br 2 (lahus) | 2) | CO, H2O | 2) | K2SO4, MnSO4 | |
| 3) | KMnO4, H2SO4, t o C | 3) | H2O | 3) | Cu2Ov | |
| 4) | Cl2 (lahus) | 4) | CO2 | 4) | HCl | |
| 5) | Cu(OH)2 (värske), t o C | 5) | CO 2, H 2 O | 5) | Agv | |
| 6) | Ir või Rh | 6) | CO 2, H 2 | 6) | HBr | |
| 7) | H2O2 | 7) | CO, H2 | 7) | H-C(O)OOH | |
Vastused tuleks üles kirjutada numbrite jadana.
Vastused:
| 1) 2) 3) 4) 5) 6) 7) |
5 4 5 4 5 6 3 |
5 6 2 4 3 1 7 |
Võrrandeid koostades jõuavad õpilased järeldusele, et kõigis neis reaktsioonides on see, mis juhtub oksüdatsioon sipelghape, sest see on tugev redutseerija ( slaid 23).
Teema “Sipelghappe kasutamine” uurimine toimub diagrammiga tutvudes ( slaid 24).
Õpilased selgitavad "sipelgalkoholi" kasutamist meditsiinis (saate Internetis kasutada) ja nimetab haigust - reuma(slaid 25).
Vaba aja olemasolul teavitab õpetaja õpilasi ( slaid 26), et varasem "sipelgaalkohol" valmistati sipelgatele alkoholi sisse immutamisega.
Teatab, et sipelghappe kogutoodang maailmas on viimastel aastatel hakanud kasvama, kuna... Kõikides maailma riikides täheldatakse mesilaste hukkumist lestadest (Varroa): mesilaste kitiinse katte läbi närides imevad nad välja hemolümfi ja mesilased surevad (sipelghape on nende lestade vastu tõhus vahend).
5. Tunni kokkuvõte
Tunni lõpus teevad õpilased kokkuvõtte: hindavad oma klassikaaslaste tööd tahvli ääres, selgitavad, millise uue õppematerjaliga (sipelghappe üld- ja spetsiifilised omadused) nad on tutvunud.
6. Kirjandus
1. Deryabina N.E. Orgaaniline keemia. Raamat 1. Süsivesinikud ja nende monofunktsionaalsed derivaadid. Õpik-märkmik. – M.: IPO “Nikitski väravates”, 2012. – Lk 154-165.
2. Kazennova N.B. Orgaanilise keemia juhend õpilastele/keskkoolile. – M.: Akvaarium, 1997. – Lk 155-156.
3. Levitina T.P. Orgaanilise keemia käsiraamat: õpik. – Peterburi: “Paritet”, 2002. – Lk 283-284.
4. Keemiaõpetaja/Toim. A.S. Egorova. 14. väljaanne – Rostov n/d: Phoenix, 2005. – Lk 633-635.
5. Rutzitis G.E., Feldman F.G. Keemia 10. Orgaaniline keemia: Õpik 10. klassile. Keskkool. – M., 1992. – Lk 110.
6. Tšernobelskaja G.M. Keemia: õpik. hüvitis arstiabi eest haridust Asutused/ G.M. Tšernobelskaja, I.N. Tšertkov.– M.: Bustard, 2005. – Lk.561-562.
7. Atkins P. Molekulid: Transl. inglise keelest – M.: Mir, 1991. – Lk 61-62.
Struktuurivalem
Vene nimi
Aine ladinakeelne nimetus: Sipelghape
Acidum formicicum ( perekond. Acidum formicici)Brutovalem
CH2O2Aine farmakoloogiline rühm Sipelghape
Nosoloogiline klassifikatsioon (ICD-10)
CAS-kood
64-18-6Aine omadused Sipelghape
Orgaaniline hape, pKa (20 °C) 3,75. Seguneb vee, eetri, metanooli, etanooliga; moodustab veega (77,5%) aseotroopse segu. Meditsiinipraktikas kasutatakse seda 1,4% alkoholilahuse (sipelgalkohol) kujul - läbipaistev värvitu vedelik, millel on omapärane terav lõhn.
Farmakoloogia
farmakoloogiline toime- põletikuvastane, lokaalanesteetikum, lokaalne ärritav, häiriv, kudede ainevahetust parandav.Põhjustab refleksreaktsioone, mis on põhjustatud naha ja lihaskoe tundlike närvilõpmete ärritusest ning millega kaasneb valu ja veresoonte läbilaskvust reguleerivate enkefaliinide ja neuropeptiidide moodustumise ja vabanemise stimuleerimine. Stimuleerib histamiini, kiniinide ja teiste bioloogiliselt aktiivsete ühendite vabanemist, mis laiendavad veresooni, stimuleerivad immunoloogilisi protsesse ja mõjutavad vere hüübimist.
Kasutatakse toiduainetööstuses heakskiidetud toidulisandina E236.
Aine kasutamine Sipelghape
Müosiit, reumaatiline valu, neuralgia, radikuliit.
Vastunäidustused
Ülitundlikkus, dermatiit, ekseem, naha terviklikkuse rikkumine.
Aine kõrvaltoimed Sipelghape
Lokaalne nahaärritus (punetus, sügelus, koorumine).
Manustamisviisid
Väliselt.
Ettevaatusabinõud aine suhtes Sipelghape
On vaja vältida limaskestadele kandmist ja allaneelamist.
Koostoimed teiste toimeainetega
Kaubanimed
| Nimi | Vyshkowski indeksi ® väärtus |
1670. aastal viis inglise botaanik ja zooloog John Ray (1627-1705) läbi ebatavalise katse. Ta pani punased metssipelgad anumasse, valas vette, kuumutas keemiseni ja lasi anumast läbi kuuma auru. Keemikud nimetavad seda protsessi aurudestillatsiooniks ja seda kasutatakse laialdaselt paljude orgaaniliste ühendite eraldamiseks ja puhastamiseks. Pärast auru kondenseerumist sai Rey uue keemilise ühendi vesilahuse. Seda eksponeeriti ja seetõttu nimetati seda sipelghappeks (tänapäevane nimi on metaan). Metaanhappe soolade ja estrite nimed - formiaadid - on samuti seotud sipelgatega (ladina formica - "sipelgas").
Seejärel tegid entomoloogid - putukaspetsialistid (kreeka keelest "entokon" - "putukas" ja "logod" - "õpetus", "sõna"), et emastel ja töötavatel sipelgatel on kõhus mürgised näärmed, mis toodavad hapet. Metssipelgal on umbes 5 mg. Hape toimib putukate relvana kaitseks ja rünnakuks. Vaevalt leidub inimest, kes poleks oma hammustusi kogenud. Tunne meenutab väga nõgesepõletust, sest sipelghapet leidub ka selle taime kõige peenemates karvades. Naha sisse kleepunud need purunevad ja nende sisu põleb valusalt.
Sipelghapet leidub ka mesilasmürgis, männiokastes, siidiussi röövikutes ning vähesel määral erinevates viljades, elundites, kudedes ning loomade ja inimeste eritistes. 19. sajandil sipelghape (naatriumsoola kujul) saadi kunstlikult süsinikmonooksiidi (II) toimel niiskusele kõrgendatud temperatuuril: NaOH + CO = HCOONa. Ja vastupidi, kontsentreeritud sipelghappe mõjul laguneb see gaasi eraldumisega: HCOOH = CO + H 2 O. Seda reaktsiooni kasutatakse laboris puhta saamiseks. Sipelghappe naatriumsoola – naatriumformiaadi – tugeval kuumutamisel toimub hoopis teistsugune reaktsioon: kahe happemolekuli süsinikuaatomid tunduvad olevat ristseotud ja tekib naatriumoksalaat – oksaalhappe sool: 2HCOONa = NaOOC- COONa + H 2.
Oluline erinevus sipelghappe ja teiste vahel on see, et sellel, nagu kahepalgelisel Janusel, on nii happe kui ka süsinikuaatomi omadused, mis kuuluvad aldehüüdrühma H-CO-. Seetõttu redutseerib sipelghape oma lahustest hõbedat - see annab "hõbepeegli" reaktsiooni, mis on iseloomulik aldehüüdidele, kuid mitte hapetele. Sipelghappe puhul kaasneb selle reaktsiooniga, mis on samuti ebatavaline, süsihappegaasi eraldumine orgaanilise happe (sipelghappe) oksüdeerumisel anorgaaniliseks happeks (süsinik), mis on ebastabiilne ja laguneb: HCOOH + [O] = HO-CO-OH = CO 2 + H 2 O.
Sipelghape on kõige lihtsam ja samal ajal tugevaim karboksüülhape, see on kümme korda tugevam kui äädikhape. Kui saksa keemik Justus Liebig esimest korda veevaba sipelghapet hankis, selgus, et see on väga ohtlik ühend. Nahaga kokkupuutel see mitte ainult ei põle, vaid ka sõna otseses mõttes lahustab selle, jättes raskesti paranevad haavad. Nagu Liebigi kaastööline Karl Vogt (1817-1895) meenutas, oli tal kogu ülejäänud elu käel arm – Liebigiga ühiselt läbiviidud “eksperimendi” tulemus. Ja see pole üllatav - hiljem avastati, et veevaba sipelghape lahustab isegi nailoni, nailoni ja muid polümeere, mis ei võta teiste hapete ja leeliste lahjendatud lahuseid.
Sipelghape leidis ootamatu rakenduse nn raskete vedelike tootmisel – vesilahustes, milles isegi kivid ei vaju. Geoloogid vajavad selliseid vedelikke mineraalide eraldamiseks tiheduse järgi. Metalli lahustamisel 90% sipelghappe lahuses saadakse talliumformiaat HCOOTl. See tahke sool ei pruugi olla tiheduse rekord, kuid seda eristab erakordselt hea lahustuvus: 0,5 kg (!) talliumformiaati saab lahustada 100 g vees toatemperatuuril. Küllastunud vesilahuse puhul varieerub tihedus 3,40 g/cm 3 (temperatuuril 20 o C) kuni 4,76 g/cm 3 (temperatuuril 90 o C). Talliumformiaadi ja talliummalonaadi, maloonhappe soola CH 2 (COOTl) 2 segu lahusel on veelgi suurem tihedus.
Nende lahustamisel (kaalusuhtes 1:1) minimaalses koguses vees moodustub kordumatu tihedusega vedelik: 20 o C juures 4,324 g/cm 3 ja 95 o C juures lahuse tihedus. võib suurendada kuni 5,0 g/cm 3 . Sellises lahuses hõljuvad bariit (heavy spar), kvarts, korund, malahhiit ja isegi graniit!
Sipelghappel on tugevad bakteritsiidsed omadused. Seetõttu kasutatakse selle vesilahuseid toiduainete säilitusainena ning paarikaupa desinfitseerivad need toidunõusid (sh veinivaate) ja hävitavad mesilastandi. Hõõrumiseks kasutatakse meditsiinis sipelghappe nõrka alkoholi vesilahust (sipelgalkohol).