ខ្សែសង្វាក់ដឹកជញ្ជូនអ៊ីដ្រូសែន និងអេឡិចត្រុង (ខ្សែសង្វាក់ផ្លូវដង្ហើម) ។ ស្មុគស្មាញផ្ទេរអេឡិចត្រុង។ ផូស្វ័រអុកស៊ីតកម្ម។ ទ្រឹស្តីគីមីវិទ្យានៃការកត់សុី និងផូស្វ័រ។ យន្តការសម្រាប់ភ្ជាប់ដំណើរការនៃការដឹកជញ្ជូនអេឡិចត្រុងជាមួយនឹងការបង្កើត ATP ។ ផ្លូវដង្ហើម
ផូស្វ័រអុកស៊ីតកម្ម
យន្តការនៃ phosphorylation អុកស៊ីតកម្មត្រូវបានស្នើឡើងដំបូងដោយ Peter Mitchell ។ យោងតាមសម្មតិកម្មនេះការផ្ទេរអេឡិចត្រុងដែលកើតឡើងនៅភ្នាស mitochondrial ខាងក្នុងបណ្តាលឱ្យមានការបូមនៃអ៊ីយ៉ុង H + ពីម៉ាទ្រីស mitochondrial ចូលទៅក្នុងចន្លោះ interemembrane ។ នេះបង្កើតជម្រាលនៃកំហាប់អ៊ីយ៉ុង H + រវាង cytosol និងចន្លោះ intramitochondrial ដែលបិទជិត។ អ៊ីយ៉ុងអ៊ីដ្រូសែនជាធម្មតាអាចត្រលប់ទៅម៉ាទ្រីស mitochondrial ក្នុងវិធីតែមួយ - តាមរយៈអង់ស៊ីមពិសេសដែលបង្កើត ATP - ATP synthase ។
យោងទៅតាមគំនិតទំនើបភ្នាស mitochondrial ខាងក្នុងមានផ្ទុកនូវអង់ស៊ីមស្មុគស្មាញជាច្រើនរួមទាំងអង់ស៊ីមជាច្រើន។ អង់ស៊ីមទាំងនេះត្រូវបានគេហៅថាអង់ស៊ីមផ្លូវដង្ហើម ហើយលំដាប់នៃទីតាំងរបស់ពួកគេនៅក្នុងភ្នាសត្រូវបានគេហៅថា ខ្សែសង្វាក់ផ្លូវដង្ហើម (ខ្សែសង្វាក់ដឹកជញ្ជូនអេឡិចត្រុង)។
គោលការណ៍ទូទៅនៃ phosphorylation អុកស៊ីតកម្ម
ជាទូទៅការងារនៃសង្វាក់ផ្លូវដង្ហើមមានដូចខាងក្រោម៖
- NADH និង FADH 2 បង្កើតឡើងក្នុងប្រតិកម្ម catabolism ផ្ទេរអាតូមអ៊ីដ្រូសែន (នោះគឺអ៊ីដ្រូសែនប្រូតុង និងអេឡិចត្រុង) ទៅអង់ស៊ីមនៃខ្សែសង្វាក់ផ្លូវដង្ហើម។
- អេឡិចត្រុងផ្លាស់ទីតាមអង់ស៊ីមនៃខ្សែសង្វាក់ផ្លូវដង្ហើម ហើយបាត់បង់ថាមពល។
- ថាមពលនេះត្រូវបានប្រើដើម្បីបូមប្រូតុង H+ ពីម៉ាទ្រីសទៅក្នុងលំហអន្តរភ្នាស។
- នៅចុងបញ្ចប់នៃសង្វាក់ផ្លូវដង្ហើម អេឡិចត្រុងវាយប្រហារអុកស៊ីហ្សែន ហើយបន្ថយវាទៅក្នុងទឹក។
- ប្រូតុង H+ ប្រញាប់ត្រឡប់ទៅម៉ាទ្រីស ហើយឆ្លងកាត់ ATP synthase ។
- ក្នុងពេលជាមួយគ្នានេះពួកគេបាត់បង់ថាមពលដែលត្រូវបានប្រើសម្រាប់ការសំយោគ ATP ។
ដូច្នេះទម្រង់កាត់បន្ថយនៃ NAD និង FAD ត្រូវបានកត់សុីដោយអង់ស៊ីមនៃខ្សែសង្វាក់ផ្លូវដង្ហើម ដោយសារផូស្វាតត្រូវបានបន្ថែមទៅ ADP ពោលគឺ phosphorylation ។ ដូច្នេះដំណើរការទាំងមូលត្រូវបានគេហៅថា phosphorylation អុកស៊ីតកម្ម។
តើសក្តានុពលប្រូតុងត្រូវបានជំរុញនៅឯណា? សក្តានុពលប្រូតុងត្រូវបានបំប្លែងដោយ ATP synthase ទៅជាថាមពលចំណងគីមីនៃ ATP ។ ការងាររួមបញ្ចូលគ្នានៃ ETC និង ATP synthase ត្រូវបានគេហៅថា phosphorylation អុកស៊ីតកម្ម។
នៅក្នុង eukaryotic mitochondria ខ្សែសង្វាក់ដឹកជញ្ជូនអេឡិចត្រុងចាប់ផ្តើមជាមួយនឹងការកត់សុីនៃ NADH និងការថយចុះនៃ ubiquinone Q ដោយស្មុគស្មាញ I. បន្ទាប់ ស្មុគស្មាញ II កត់សុី succinate ទៅ fumarate និងកាត់បន្ថយ ubiquinone Q ។ Ubiquinone Q ត្រូវបានកត់សុី និងកាត់បន្ថយដោយ cytochrome c complex III ។ នៅចុងបញ្ចប់នៃខ្សែសង្វាក់, ស្មុគស្មាញ IV ជំរុញការផ្ទេរអេឡិចត្រុងពី cytochrome c ទៅអុកស៊ីសែនដើម្បីបង្កើតទឹក។ ជាលទ្ធផលនៃប្រតិកម្ម រាល់ប្រូតុង 6 និងអេឡិចត្រុង 6 ដែលត្រូវបានបញ្ចេញតាមធម្មតា ម៉ូលេគុលទឹក 2 ត្រូវបានបញ្ចេញដោយសារតែការចំណាយនៃ 1 ម៉ូលេគុលនៃ O2 និង 10 ម៉ូលេគុល NAD∙H ។
ស្មុគស្មាញ I ឬ NADH dehydrogenase complex កត់សុី NAD-H ។ ស្មុគ្រស្មាញនេះដើរតួនាទីសំខាន់នៅក្នុងដំណើរការនៃការដកដង្ហើមកោសិកា និង។ ស្ទើរតែ 40% នៃជម្រាលប្រូតុងសម្រាប់ការសំយោគ ATP ត្រូវបានបង្កើតឡើងដោយស្មុគស្មាញនេះ។ ស្មុគស្មាញ I កត់សុី NADH និងកាត់បន្ថយម៉ូលេគុលមួយនៃ ubiquinone ដែលត្រូវបានបញ្ចេញទៅក្នុងភ្នាស។ សម្រាប់រាល់ម៉ូលេគុល NADH អុកស៊ីតកម្ម ស្មុគស្មាញផ្ទេរប្រូតុងចំនួនបួនឆ្លងកាត់ភ្នាស។ ស្មុគស្មាញ NADH dehydrogenase យកអេឡិចត្រុងពីរពីវាហើយផ្ទេរពួកវាទៅ ubiquinone ។ Ubiquinone គឺរលាយជាតិខ្លាញ់។ Ubiquinone នៅខាងក្នុងភ្នាសបានសាយភាយទៅជាស្មុគស្មាញ III ។ ក្នុងពេលជាមួយគ្នានេះ ស្មុគ្រស្មាញ I បូម 2 ប្រូតុង និង 2 អេឡិចត្រុងពីម៉ាទ្រីសចូលទៅក្នុង mitochondria ។
ខ្សែសង្វាក់ដឹកជញ្ជូនអេឡិចត្រុងនៃស្មុគ្រស្មាញ I. ព្រួញពណ៌ប្រផេះ - ផ្លូវដឹកជញ្ជូនមិនទំនង ឬឥឡូវនេះមិនដំណើរការ
ចង្កោម N5 មានសក្តានុពលទាបបំផុត និងកំណត់អត្រាលំហូរសរុបនៃអេឡិចត្រុងនៅទូទាំងសង្វាក់។ ជំនួសឱ្យ ligands ធម្មតាសម្រាប់មជ្ឈមណ្ឌលជាតិដែក-ស្ពាន់ធ័រ (សំណល់ cysteine បួន) វាត្រូវបានសម្របសម្រួលដោយសំណល់ cysteine បីនិងសំណល់ histidine មួយហើយក៏ត្រូវបានហ៊ុំព័ទ្ធដោយសំណល់ប៉ូលដែលត្រូវបានចោទប្រកាន់ទោះបីជាវាស្ថិតនៅជ្រៅនៅក្នុងអង់ស៊ីមក៏ដោយ។
ចង្កោម N7 មានវត្តមានតែនៅក្នុងស្មុគស្មាញ I នៃបាក់តេរីមួយចំនួនប៉ុណ្ណោះ។ វាត្រូវបានដកចេញយ៉ាងសំខាន់ពីចង្កោមផ្សេងទៀត ហើយមិនអាចផ្លាស់ប្តូរអេឡិចត្រុងជាមួយពួកវាបាន ដូច្នេះវាទំនងជាវត្ថុបុរាណ។ នៅក្នុងស្មុគស្មាញបាក់តេរីមួយចំនួនដែលទាក់ទងនឹងស្មុគស្មាញ I សំណល់ cysteine អភិរក្សចំនួន 4 ត្រូវបានរកឃើញរវាង N7 និងចង្កោមផ្សេងទៀត ហើយនៅក្នុងស្មុគស្មាញបាក់តេរី I Aquifex aeolicusចង្កោម Fe 4 S 4 បន្ថែមត្រូវបានរកឃើញភ្ជាប់ N7 ជាមួយចង្កោមដែលនៅសល់។ ពីនេះវាធ្វើតាមនោះ។ A. aeolicusស្មុគ្រស្មាញ I បន្ថែមពីលើ NADH អាចប្រើអ្នកបរិច្ចាគអេឡិចត្រុងផ្សេងទៀតដែលផ្ទេរពួកវាតាមរយៈ N7 ។
ស្មុគ្រស្មាញ NADH dehydrogenase កត់សុី NADH ដែលបង្កើតឡើងក្នុងម៉ាទ្រីសកំឡុងពេលវដ្តអាស៊ីត tricarboxylic ។ អេឡិចត្រុងពី NADH ត្រូវបានប្រើដើម្បីស្ដារអ្នកដឹកជញ្ជូនភ្នាស ubiquinone Q ដែលផ្ទេរពួកវាទៅស្មុគស្មាញបន្ទាប់នៃខ្សែសង្វាក់ដឹកជញ្ជូនអេឡិចត្រុង mitochondrial ស្មុគស្មាញ III ឬ cytochrome bc 1- ស្មុគស្មាញ។
ស្មុគ្រស្មាញ NADH dehydrogenase ដំណើរការដូចស្នប់ប្រូតុង៖ សម្រាប់រាល់ NADH ដែលបានកត់សុី និងកាត់បន្ថយ Q ប្រូតុងចំនួនបួនត្រូវបានបូមតាមរយៈភ្នាសចូលទៅក្នុងចន្លោះប្រហោងខាងក្នុង៖
សក្ដានុពលអេឡិចត្រូគីមីដែលបានបង្កើតកំឡុងពេលប្រតិកម្មត្រូវបានប្រើដើម្បីសំយោគ ATP ។ ប្រតិកម្មដែលជំរុញដោយស្មុគ្រស្មាញ I គឺអាចបញ្ច្រាស់បាន ដែលជាដំណើរការមួយហៅថា ការកាត់បន្ថយ NAD+ ដែលបណ្ដាលមកពីការ aerobic succinate ។ នៅក្រោមលក្ខខណ្ឌនៃសក្តានុពលភ្នាសខ្ពស់ និងកាត់បន្ថយ ubiquinols លើស ស្មុគស្មាញអាចកាត់បន្ថយ NAD+ ដោយប្រើអេឡិចត្រុងរបស់ពួកគេ និងបញ្ជូនប្រូតុងត្រឡប់ទៅម៉ាទ្រីសវិញ។ បាតុភូតនេះជាធម្មតាកើតឡើងនៅពេលដែលមាន succinate ច្រើន ប៉ុន្តែ oxaloacetate ឬ malate តិចតួច។ ការកាត់បន្ថយ ubiquinone ត្រូវបានអនុវត្តដោយអង់ស៊ីម succinate dehydrogenase ឬ mitochondrial ។ នៅក្រោមលក្ខខណ្ឌនៃជម្រាលប្រូតុងខ្ពស់ ភាពស្និទ្ធស្នាលនៃស្មុគ្រស្មាញសម្រាប់ ubiquinol កើនឡើង ហើយសក្តានុពល redox នៃ ubiquinol ថយចុះដោយសារតែការកើនឡើងនៃកំហាប់របស់វា ដែលអាចធ្វើឱ្យមានការដឹកជញ្ជូនអេឡិចត្រុងបញ្ច្រាសតាមសក្តានុពលអគ្គិសនីនៃភ្នាស mitochondrial ខាងក្នុងទៅ NAD បាតុភូតនេះត្រូវបានគេសង្កេតឃើញនៅក្នុងលក្ខខណ្ឌមន្ទីរពិសោធន៍ ប៉ុន្តែគេមិនដឹងថាវាកើតឡើងនៅក្នុងកោសិការស់ឬយ៉ាងណានោះទេ។
ក្នុងដំណាក់កាលដំបូងនៃការស្រាវជ្រាវទៅលើស្មុគ្រស្មាញ I គំរូដែលបានពិភាក្សាយ៉ាងទូលំទូលាយគឺផ្អែកលើការសន្មត់ថាប្រព័ន្ធស្រដៀងគ្នានឹងដំណើរការនៅក្នុងស្មុគ្រស្មាញ។ ទោះជាយ៉ាងណាក៏ដោយ ការសិក្សាក្រោយៗមកមិនបានរកឃើញ quinones ដែលមានទំនាក់ទំនងខាងក្នុងនៅក្នុងស្មុគស្មាញ I ហើយបានបដិសេធទាំងស្រុងនូវសម្មតិកម្មនេះ។
ស្មុគ្រស្មាញ NADH dehydrogenase ហាក់ដូចជាមានយន្តការដឹកជញ្ជូនប្រូតុងតែមួយគត់តាមរយៈការផ្លាស់ប្តូរទម្រង់នៃអង់ស៊ីមខ្លួនឯង។ អនុផ្នែក ND2, ND4 និង ND5 ត្រូវបានគេហៅថា antiport-like ព្រោះវាមានលក្ខណៈដូចគ្នាបេះបិទនឹងគ្នាទៅវិញទៅមក និងបាក់តេរី Mrp Na+/H+ antiports។ អនុផ្នែកទាំងបីនេះបង្កើតបានបណ្តាញប្រូតុងធំៗចំនួនបី ដែលផ្សំឡើងពីសំណល់អាស៊ីតអាមីណូដែលត្រូវបានចោទប្រកាន់ (ជាចម្បង lysine និង glutamate)។ ឆានែលប្រូតុងទីបួនត្រូវបានបង្កើតឡើងដោយផ្នែកនៃអនុ Nqo8 និងអនុរងតូច ND6, ND4L និង ND3 ។ ឆានែលនេះគឺស្រដៀងគ្នានៅក្នុងរចនាសម្ព័ន្ធទៅនឹងឆានែលស្រដៀងគ្នានៃផ្នែករងដូច antiport ប៉ុន្តែមានមួយចំនួនធំមិនធម្មតានៃសំណល់ glutamate ខ្ចប់យ៉ាងក្រាស់នៅផ្នែកខាងម៉ាទ្រីសដែលជាមូលហេតុដែលវាត្រូវបានគេហៅថា E-channel (ឡាតាំង E ត្រូវបានគេប្រើជាស្តង់ដារ ការកំណត់ glutamate) ។ ពី C-terminus នៃអនុ ND5 ពង្រីកផ្នែកបន្ថែមដែលមាន helices transmembrane ពីរតភ្ជាប់ដោយ α-helix (HL) ដែលវែងខុសពីធម្មតា (110 Å) α-helix (HL) ដែលឆ្លងកាត់ផ្នែកខាងម៉ាទ្រីសទល់មុខនៃស្មុគស្មាញ ភ្ជាប់រាងកាយទាំងបី។ អង្គភាពរងដូច antiport និងអាចពាក់ព័ន្ធនឹងការដឹកជញ្ជូនអេឡិចត្រុង coupling ជាមួយនឹងការរៀបចំឡើងវិញតាមទម្រង់។ ធាតុភ្ជាប់មួយទៀត βH ត្រូវបានបង្កើតឡើងដោយស៊េរីនៃការត្រួតស៊ីគ្នា និង α-helices ហើយមានទីតាំងនៅទល់មុខផ្នែក periplasmic នៃស្មុគស្មាញ។ គេនៅមិនទាន់ដឹងច្បាស់ថា តើការដឹកជញ្ជូនអេឡិចត្រុងត្រូវភ្ជាប់ជាមួយការផ្ទេរប្រូតុងយ៉ាងដូចម្តេច? វាត្រូវបានគេជឿថាការចោទប្រកាន់អវិជ្ជមានដ៏មានអានុភាពនៃចង្កោម N2 អាចរុញច្រាន polypeptides ជុំវិញដែលបណ្តាលឱ្យមានការផ្លាស់ប្តូរទម្រង់ដែលរីករាលដាលទៅផ្នែករងដូច antiport ទាំងអស់ដែលស្ថិតនៅឆ្ងាយពីគ្នាទៅវិញទៅមក។ សម្មតិកម្មមួយទៀតបង្ហាញថាការផ្លាស់ប្តូរអនុលោមភាពបណ្តាលឱ្យកន្លែងចង ubiquinone វែងមិនធម្មតាធ្វើឱ្យមានស្ថេរភាព ubiquinol Q-2 ជាមួយនឹងសក្តានុពល redox ទាបបំផុត និងបន្ទុកអវិជ្ជមាន។ ពត៌មានលំអិតជាច្រើននៃ kinetics នៃការផ្លាស់ប្តូរអនុលោមភាព និងការដឹកជញ្ជូនប្រូតុងដែលពាក់ព័ន្ធនៅតែមិនទាន់ដឹងនៅឡើយ។
ថ្នាំស្មុគស្មាញ I inhibitor ដែលត្រូវបានសិក្សាច្រើនបំផុតគឺ rotenone (ត្រូវបានគេប្រើយ៉ាងទូលំទូលាយជាថ្នាំសំលាប់សត្វល្អិតសរីរាង្គ) ។ Rotenone និង rotenoids គឺជា isoflavonoids ដែលមាននៅក្នុងឫសនៃរុក្ខជាតិត្រូពិចមួយចំនួនដូចជា អង់តូនី (ឡូហ្គានីសៀ), ឌឺរីសនិង ឡុងកូកាពស (ហ្វាបាសេ) Rotenone ត្រូវបានគេប្រើជាយូរមកហើយជាថ្នាំសម្លាប់សត្វល្អិត និងថ្នាំពុលត្រី ដោយសារតែ mitochondria នៃសត្វល្អិត និងត្រីមានភាពរសើបខ្លាំងចំពោះវា។ វាត្រូវបានគេដឹងថាជនជាតិដើមភាគតិចនៃ French Guiana និងជនជាតិឥណ្ឌានៅអាមេរិកខាងត្បូងផ្សេងទៀតបានប្រើរុក្ខជាតិដែលមានផ្ទុក rotenone សម្រាប់ការនេសាទនៅដើមសតវត្សទី 17 ។ Rotenone ធ្វើអន្តរកម្មជាមួយកន្លែងចង ubiquinone និងប្រកួតប្រជែងជាមួយស្រទាប់ខាងក្រោមសំខាន់។ វាត្រូវបានបង្ហាញថាការទប់ស្កាត់ជាប្រព័ន្ធរយៈពេលវែងនៃស្មុគស្មាញ I ដោយ rotenone អាចបណ្តាលឱ្យមានការស្លាប់ដោយជ្រើសរើសនៃសរសៃប្រសាទ dopaminergic (ការសម្ងាត់នៃសារធាតុបញ្ជូនសរសៃប្រសាទ dopamine) ។ Piericidin A ដែលជាសារធាតុទប់ស្កាត់ស្មុគស្មាញ I ដ៏មានឥទ្ធិពលមួយផ្សេងទៀតដែលមានរចនាសម្ព័ន្ធស្រដៀងនឹង ubiquinone ធ្វើសកម្មភាពស្រដៀងគ្នា។ សូដ្យូមអាមីតាល់ ដែលជាដេរីវេនៃអាស៊ីត barbituric ក៏ជាកម្មសិទ្ធិរបស់ក្រុមនេះដែរ។
ទោះបីជាការសិក្សាជាង 50 ឆ្នាំនៃស្មុគស្មាញ I ក៏ដោយវាមិនអាចរកឃើញសារធាតុរារាំងដែលរារាំងការផ្ទេរអេឡិចត្រុងនៅក្នុងស្មុគស្មាញនោះទេ។ ថ្នាំទប់ស្កាត់ Hydrophobic ដូចជា rotenone ឬ piericidin គ្រាន់តែរំខានការផ្ទេរអេឡិចត្រុងពីចង្កោមស្ថានីយ N2 ទៅ ubiquinone ។
សារធាតុមួយទៀតដែលរារាំងស្មុគស្មាញ I គឺ adenosine diphosphate ribose ក្នុងប្រតិកម្មអុកស៊ីតកម្មរបស់ NADH ។ វាភ្ជាប់ទៅនឹងអង់ស៊ីមនៅកន្លែងភ្ជាប់នុយក្លេអូទីត (FAD)។
ថ្នាំទប់ស្កាត់ដ៏មានឥទ្ធិពលបំផុតមួយចំនួននៃស្មុគស្មាញ I រួមមានគ្រួសារ acetogenin ។ សារធាតុទាំងនេះត្រូវបានបង្ហាញដើម្បីបង្កើតតំណភ្ជាប់គីមីជាមួយអនុ ND2 ដែលបង្ហាញដោយប្រយោលនូវតួនាទីរបស់ ND2 ក្នុងការចង ubiquinone ។ វាគួរឱ្យចាប់អារម្មណ៍ក្នុងការកត់សម្គាល់ថា acetogenin rolliniastatin-2 គឺជាសារធាតុរារាំងស្មុគស្មាញដំបូងគេដែលខ្ញុំបានរកឃើញដើម្បីចងនៅកន្លែងផ្សេងក្រៅពី rotenone ។
ថ្នាំប្រឆាំងនឹងជំងឺទឹកនោមផ្អែម metformin មានប្រសិទ្ធិភាព inhibitory កម្រិតមធ្យម; ជាក់ស្តែង ទ្រព្យសម្បត្តិរបស់ថ្នាំនេះបង្កប់នូវយន្តការនៃសកម្មភាពរបស់វា។
អេឡិចត្រុងពី succinate ត្រូវបានផ្ទេរដំបូងទៅ FAD ហើយបន្ទាប់មកតាមរយៈចង្កោម Fe-S ទៅកាន់ Q. ការដឹកជញ្ជូនអេឡិចត្រុងនៅក្នុងស្មុគស្មាញមិនត្រូវបានអមដោយការបង្កើតជម្រាលប្រូតុងទេ។ 2H+ ដែលបង្កើតឡើងកំឡុងពេលអុកស៊ីតកម្មនៃ succinate នៅតែមាននៅផ្នែកម្ខាងនៃភ្នាស ពោលគឺនៅក្នុងម៉ាទ្រីស ហើយបន្ទាប់មកត្រូវបានស្រូបយកឡើងវិញក្នុងអំឡុងពេលកាត់បន្ថយ quinone ។ ដូច្នេះ ស្មុគ្រស្មាញ II មិនរួមចំណែកដល់ការបង្កើតជម្រាលប្រូតុងឆ្លងកាត់ភ្នាសទេ ហើយមានមុខងារត្រឹមតែជាអ្នកដឹកជញ្ជូនអេឡិចត្រុងពី succinate ទៅ ubiquinone ប៉ុណ្ណោះ។
ជាលទ្ធផលនៃការកត់សុីនៃ succinate អេឡិចត្រុងរបស់វាត្រូវបានផ្ទេរទៅ FAD ហើយបន្ទាប់មកផ្ទេរតាមខ្សែសង្វាក់នៃចង្កោមដែក - ស្ពាន់ធ័រពីចង្កោមទៅចង្កោម។ នៅទីនោះ អេឡិចត្រុងទាំងនេះត្រូវបានផ្ទេរទៅម៉ូលេគុល ubiquinone ដែលរង់ចាំនៅកន្លែងចង។
មានការសន្មត់ផងដែរថាដើម្បីការពារអេឡិចត្រុងពីការទទួលដោយផ្ទាល់ពីចង្កោមទៅ heme យន្តការច្រកទ្វារពិសេសមួយដំណើរការ។ បេក្ខភាពទំនងសម្រាប់ច្រកទ្វារគឺអ៊ីស្ទីឌីន -207 នៃអនុក្រុម B ដែលមានទីតាំងនៅដោយផ្ទាល់រវាងចង្កោមដែក-ស្ពាន់ធ័រ និង heme ជិតនឹង ubiquinone ដែលចងភ្ជាប់ ហើយប្រហែលជាអាចគ្រប់គ្រងលំហូរនៃអេឡិចត្រុងរវាងមជ្ឈមណ្ឌល redox ទាំងនេះ។
មានថ្នាំទប់ស្កាត់ស្មុគស្មាញ II ពីរប្រភេទ៖ ខ្លះរារាំងហោប៉ៅចង succinate និងខ្លះទៀតរារាំងហោប៉ៅចង ubiquinol ។ ថ្នាំទប់ស្កាត់ដែលធ្វើត្រាប់តាម ubiquinol រួមមាន carboxin និង thenoyltrifluoroacetone ។ Inhibitors-analogs នៃ succinate រួមមានសមាសធាតុសំយោគ malonate ក៏ដូចជាសមាសធាតុនៃវដ្ត Krebs malate និង oxaloacetate ។ គួរឱ្យចាប់អារម្មណ៍ oxaloacetate គឺជាថ្នាំទប់ស្កាត់ស្មុគស្មាញ II ដ៏មានឥទ្ធិពលបំផុត។ ហេតុអ្វីបានជាការរំលាយអាហារធម្មតានៃវដ្តអាស៊ីត tricarboxylic រារាំងស្មុគស្មាញ II នៅតែមិនច្បាស់លាស់ ទោះបីជាវាត្រូវបានគេណែនាំថាវាអាចបម្រើតួនាទីការពារដោយកាត់បន្ថយការដឹកជញ្ជូនអេឡិចត្រុងបញ្ច្រាសនៅក្នុងស្មុគស្មាញ I ដែលជាលទ្ធផលនៃការបង្កើត superoxide ។
ថ្នាំទប់ស្កាត់ការចម្លង Ubiquinol ត្រូវបានគេប្រើជាថ្នាំសម្លាប់ផ្សិតក្នុងវិស័យកសិកម្មតាំងពីទសវត្សរ៍ឆ្នាំ 1960 ។ ឧទាហរណ៍ carboxin ត្រូវបានប្រើប្រាស់ជាចម្បងសម្រាប់ជំងឺដែលបង្កឡើងដោយ basidiomycetes ដូចជា stem rust and basidiomycete disease ។ Rhizoctonia. ថ្មីៗនេះ ពួកគេត្រូវបានជំនួសដោយសមាសធាតុផ្សេងទៀត ជាមួយនឹងជួរដ៏ធំទូលាយនៃភ្នាក់ងារបង្ករោគ។ សមាសធាតុបែបនេះរួមមាន boscalid, penthiopyrad និង fluopyram ។ ផ្សិតសំខាន់ៗក្នុងវិស័យកសិកម្មមួយចំនួនមិនងាយនឹងធ្វើសកម្មភាពរបស់ថ្នាំទប់ស្កាត់ជំនាន់ថ្មីនេះទេ។
Cytochrome-bc1-complex (ស្មុគ្រស្មាញ cytochrome bc 1) ទាំង ubiquinol-cytochrome c-oxidoreductase ឬស្មុគស្មាញ III - ស្មុគស្មាញពហុប្រូតេអ៊ីននៃខ្សែសង្វាក់ផ្លូវដង្ហើមនៃការដឹកជញ្ជូនអេឡិចត្រុងនិងម៉ាស៊ីនបង្កើតជីវគីមីដ៏សំខាន់បំផុតនៃជម្រាលប្រូតុងនៅលើភ្នាស mitochondrial ។ ស្មុគស្មាញ transmembrane ពហុប្រូតេអ៊ីននេះត្រូវបានអ៊ិនកូដដោយ mitochondrial (cytochrome ខ) និងហ្សែននុយក្លេអ៊ែរ។
ស៊ីតូក្រូម- បស 1- ស្មុគស្មាញ oxidizes កាត់បន្ថយ ubiquinone និងកាត់បន្ថយ cytochrome c (E°"=+0.25 V) យោងតាមសមីការ៖
ការដឹកជញ្ជូនអេឡិចត្រុងនៅក្នុងស្មុគ្រស្មាញត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងការផ្ទេរប្រូតុងពីម៉ាទ្រីស (ក្នុង) ទៅកាន់លំហរខាងក្នុង (ចេញ) និងការបង្កើតជម្រាលប្រូតុងនៅលើភ្នាស mitochondrial ។ សម្រាប់រាល់អេឡិចត្រុងពីរដែលឆ្លងកាត់ខ្សែសង្វាក់ដឹកជញ្ជូនពី ubiquinone ទៅ cytochrome c ប្រូតុងពីរត្រូវបានស្រូបចេញពីម៉ាទ្រីស ហើយ 4 ទៀតត្រូវបានបញ្ចេញទៅក្នុងលំហរចន្លោះ។ កាត់បន្ថយ cytochrome c ផ្លាស់ទីតាមភ្នាសក្នុងប្រភាគ aqueous និងផ្ទេរអេឡិចត្រុងមួយទៅស្មុគស្មាញផ្លូវដង្ហើមបន្ទាប់ cytochrome oxidase ។
ព្រឹត្តិការណ៍ដែលកើតឡើងត្រូវបានគេស្គាល់ថាជា Q-cycle ដែលត្រូវបានប្រកាសដោយ Peter Mitchell ក្នុងឆ្នាំ 1976 ។ គោលការណ៍នៃវដ្ត Q គឺថាការផ្ទេរ H+ ឆ្លងកាត់ភ្នាសកើតឡើងជាលទ្ធផលនៃការកត់សុី និងការថយចុះនៃ quinones នៅលើស្មុគស្មាញខ្លួនឯង។ ក្នុងករណីនេះ quinones រៀងៗខ្លួនផ្តល់និងយក 2H + ពីដំណាក់កាល aqueous ជ្រើសរើសពីផ្នែកផ្សេងគ្នានៃភ្នាស។
រចនាសម្ព័ន្ធនៃស្មុគស្មាញ III មានមជ្ឈមណ្ឌលពីរឬ "ហោប៉ៅ" ពីរដែលក្នុងនោះ quinones អាចចងបាន។ មួយក្នុងចំណោមពួកគេ មជ្ឈមណ្ឌល Q out ស្ថិតនៅចន្លោះចង្កោមដែក-ស្ពាន់ធ័រ 2Fe-2S និង heme ខលីត្រ នៅជិតផ្នែកខាងក្រៅនៃភ្នាស, ប្រឈមមុខនឹងចន្លោះ interemembrane ។ កាត់បន្ថយ ubiquinone (QH 2) ចងនៅក្នុងហោប៉ៅនេះ។ មួយទៀត Q នៅក្នុងហោប៉ៅត្រូវបានរចនាឡើងដើម្បីចងអុកស៊ីតកម្ម ubiquinone (Q) ហើយមានទីតាំងនៅជិតផ្នែកខាងក្នុង (ខាងក្នុង) នៃភ្នាសក្នុងការទំនាក់ទំនងជាមួយម៉ាទ្រីស។
លក្ខខណ្ឌចាំបាច់ និងខុសពីធម្មតាសម្រាប់ប្រតិបត្តិការនៃវដ្ត Q គឺជាការពិតដែលថាអាយុកាល និងស្ថានភាពនៃ semiquinones នៅក្នុងមជ្ឈមណ្ឌលចងពីរគឺខុសគ្នា។ នៅក្នុងមជ្ឈមណ្ឌល Q out, Q គឺមិនស្ថិតស្ថេរ និងដើរតួជាភ្នាក់ងារកាត់បន្ថយដ៏រឹងមាំដែលមានសមត្ថភាពបរិច្ចាគ e - ទៅ heme ដែលមានសក្តានុពលទាបដោយ។ Q មានអាយុវែងដែលទាក់ទងគ្នាត្រូវបានបង្កើតឡើងនៅក្នុង Q នៅកណ្តាលសក្តានុពលដែលអនុញ្ញាតឱ្យវាដើរតួជាភ្នាក់ងារអុកស៊ីតកម្មទទួលយកអេឡិចត្រុងពី heme ។ ខហ. ចំណុចសំខាន់មួយទៀតនៃវដ្ត Q ត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងភាពខុសគ្នានៃអេឡិចត្រុងពីរដែលរួមបញ្ចូលនៅក្នុងស្មុគស្មាញតាមបណ្តោយផ្លូវពីរផ្សេងគ្នា។ ការសិក្សាអំពីរចនាសម្ព័ន្ធគ្រីស្តាល់នៃស្មុគស្មាញបានបង្ហាញថាទីតាំងនៃមជ្ឈមណ្ឌល 2Fe-2S ទាក់ទងទៅនឹងមជ្ឈមណ្ឌល redox ផ្សេងទៀតអាចផ្លាស់ប្តូរបាន។ វាបានប្រែក្លាយថាប្រូតេអ៊ីន Rieske មានដែនចល័តមួយ ដែលចង្កោម 2Fe-2S ពិតជាមានទីតាំងនៅ។ ការទទួលយកអេឡិចត្រុង និងត្រូវបានកាត់បន្ថយ មជ្ឈមណ្ឌល 2Fe-2S ផ្លាស់ប្តូរទីតាំងរបស់វា ដោយផ្លាស់ទីឆ្ងាយពីមជ្ឈមណ្ឌល Q out និង heme ខលីត្រ ដោយ 17 ជាមួយនឹងការបង្វិល 60 ° ហើយដោយហេតុនេះចូលទៅជិត cytochrome គ. ដោយបានផ្តល់អេឡិចត្រុងទៅស៊ីតូក្រូម មជ្ឈមណ្ឌល 2Fe-2S ផ្ទុយទៅវិញ ផ្លាស់ទីទៅជិតមជ្ឈមណ្ឌល Q ចេញ ដើម្បីបង្កើតទំនាក់ទំនងកាន់តែជិតស្និទ្ធ។ ដូចនេះ មុខងារ shuttle មួយប្រភេទ ធានាថា អេឡិចត្រុងទីពីរទៅ hemes ខអិល និង ខហ. រហូតមកដល់ពេលនេះនេះគឺជាឧទាហរណ៍តែមួយគត់ដែលការដឹកជញ្ជូនអេឡិចត្រុងនៅក្នុងស្មុគស្មាញត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងដែនចល័តនៅក្នុងរចនាសម្ព័ន្ធប្រូតេអ៊ីន។
ប្រភាគតូចមួយនៃអេឡិចត្រុងចាកចេញពីខ្សែសង្វាក់ដឹកជញ្ជូនមុនពេលឈានដល់ស្មុគស្មាញ IV ។ ការលេចធ្លាយឥតឈប់ឈរនៃអេឡិចត្រុងទៅអុកស៊ីហ៊្សែននាំឱ្យមានការបង្កើត superoxide ។ ប្រតិកម្មចំហៀងតូចនេះនាំទៅដល់ការបង្កើតនូវវិសាលគមទាំងមូលនៃប្រភេទអុកស៊ីហ្សែនប្រតិកម្ម ដែលមានជាតិពុលខ្លាំង និងដើរតួនាទីយ៉ាងសំខាន់ក្នុងការវិវត្តន៍នៃរោគសាស្ត្រ និងភាពចាស់)។ ការលេចធ្លាយអេឡិចត្រូនិចកើតឡើងជាចម្បងនៅកន្លែង Q នៅកន្លែង។ ដំណើរការនេះត្រូវបានផ្សព្វផ្សាយដោយ antimycin A. វារារាំង hemes ខនៅក្នុងស្ថានភាពកាត់បន្ថយរបស់ពួកគេ រារាំងពួកគេមិនឱ្យបញ្ចេញអេឡិចត្រុងទៅលើ semiquinone Q ដែលនាំទៅរកការកើនឡើងនៃកំហាប់របស់វា។ Semiquinone មានប្រតិកម្មជាមួយនឹងអុកស៊ីសែនដែលនាំទៅដល់ការបង្កើត superoxide ។ superoxide លទ្ធផលចូលទៅក្នុងម៉ាទ្រីស mitochondrial និងចន្លោះ interemembrane ពីកន្លែងដែលវាអាចចូលទៅក្នុង cytosol ។ ការពិតនេះអាចត្រូវបានពន្យល់ដោយការពិតដែលថា Complex III ប្រហែលជាផលិត superoxide ក្នុងទម្រង់នៃ HOO ដែលមិនមានផ្ទុក ដែលអាចជ្រាបចូលទៅក្នុងភ្នាសខាងក្រៅបានយ៉ាងងាយស្រួលបើប្រៀបធៀបទៅនឹង Superoxide (O 2 -) ។
សារធាតុទាំងនេះមួយចំនួនត្រូវបានប្រើប្រាស់ជាថ្នាំសម្លាប់មេរោគ (ដូចជា ស្តេរ៉ូប៊ីលូរីន ដេរីវេទីវ ដែលត្រូវបានគេស្គាល់ថា អេហ្សស៊ីស្ត្រូប៊ីន ដែលជាសារធាតុរារាំងគេហទំព័រ Q ext) និងថ្នាំប្រឆាំងនឹងជំងឺគ្រុនចាញ់ (atovaquone)។
Cytochrome c oxidase (cytochrome oxidase) ឬ cytochrome c oxygen oxidoreductase ដែលត្រូវបានគេស្គាល់ផងដែរថាជា cytochrome aa 3 និង complex IV គឺជា oxidase ស្ថានីយនៃខ្សែសង្វាក់ដឹកជញ្ជូនអេឡិចត្រុងផ្លូវដង្ហើមតាមបែប aerobic ដែលជំរុញការផ្ទេរអេឡិចត្រុងពី cytochrome ។ ជាមួយទៅអុកស៊ីសែនដើម្បីបង្កើតទឹក។ Cytochrome oxidase មានវត្តមាននៅក្នុងភ្នាសខាងក្នុងនៃ mitochondria នៃ eukaryotes ទាំងអស់ ដែលជាទូទៅគេហៅថា complex IV ក៏ដូចជានៅក្នុងភ្នាសកោសិកានៃបាក់តេរី aerobic ជាច្រើន។
Complex IV បន្តបន្ទាប់បន្សំអុកស៊ីតកម្មម៉ូលេគុលចំនួនបួននៃ cytochrome c ហើយដោយទទួលយកអេឡិចត្រុងចំនួនបួនកាត់បន្ថយ O 2 ទៅ H 2 O ។ ក្នុងអំឡុងពេលកាត់បន្ថយ O 2 H + ចំនួនបួនត្រូវបានចាប់យកពី
អង់ស៊ីមនៃខ្សែសង្វាក់ដឹកជញ្ជូនអេឡិចត្រុងត្រូវបានជួសជុលនៅក្នុងភ្នាស mitochondrial តាមរបៀបដែលសកម្មភាពរបស់ពួកគេមានលក្ខណៈជាវ៉ិចទ័រ ពោលគឺត្រូវបានកំណត់លក្ខណៈមិនត្រឹមតែដោយទំហំនៃអត្រាប្រតិកម្មប៉ុណ្ណោះទេ ប៉ុន្តែវាក៏មានទិសដៅតាមលំហ ដែលស្រដៀងទៅនឹងសកម្មភាពដឹកជញ្ជូន ATPases ផងដែរ។ . ការបង្ហាញសំខាន់នៃវ៉ិចទ័រនៅក្នុងខ្សែសង្វាក់ផ្លូវដង្ហើមគឺការផ្ទេរអ៊ីយ៉ុងអ៊ីដ្រូសែនពីផ្នែកខាងក្នុងនៃភ្នាស (ពីផ្នែកម៉ាទ្រីស) ទៅផ្នែកខាងក្រៅ (ចូលទៅក្នុងលំហរចន្លោះ)។
មានចំណុចបីនៅក្នុងខ្សែសង្វាក់ផ្លូវដង្ហើមដែលទាក់ទងនឹងការបូមប្រូតុង៖ ស្មុគស្មាញ I, III និង IV ។
Coenzyme Q ដោយមានការចូលរួមពី NADH dehydrogenase (ស្មុគស្មាញ I) ភ្ជាប់អេឡិចត្រុង (ក៏ដូចជាប្រូតុង) ពីសមាសធាតុនៃខ្សែសង្វាក់ផ្លូវដង្ហើមនៅផ្នែកខាងម៉ាទ្រីសនៃភ្នាស ហើយអេឡិចត្រុង និងប្រូតុងត្រូវបានបញ្ចេញនៅផ្នែកម្ខាងនៃភ្នាស។ ហើយអេឡិចត្រុងត្រូវបានទទួលយកដោយសមាសធាតុបន្ទាប់នៃខ្សែសង្វាក់ផ្លូវដង្ហើម ហើយប្រូតុងចូលទៅក្នុងលំហលំហអន្តរមមប្រេន។ យន្តការនេះត្រូវបានគេហៅថា Q-cycle ។ Cytochrome c reductase (ស្មុគស្មាញ III) ធ្វើសកម្មភាពស្រដៀងគ្នា។ នៅក្នុងតំបន់នៃ cytochrome oxidase (ស្មុគស្មាញ IV) អ៊ីយ៉ុង Cu2+ អាចពាក់ព័ន្ធនឹងការបូមប្រូតុង។
ការផ្ទេរអេឡិចត្រុងពីរតាមរយៈស្មុគ្រស្មាញនីមួយៗអនុញ្ញាតឱ្យបូមប្រូតុងចំនួនបួន។ ដូច្នេះខ្សែសង្វាក់ដឹកជញ្ជូនអេឡិចត្រុងដើរតួជាស្នប់ប្រូតុងដោយបូមអ៊ីយ៉ុងអ៊ីដ្រូសែនពីម៉ាទ្រីសទៅខាងក្រៅនៃភ្នាស។
ជាលទ្ធផល ភាពខុសគ្នានៃកំហាប់ប្រូតុងលេចឡើងនៅផ្នែកម្ខាងនៃភ្នាស ហើយនៅពេលជាមួយគ្នានោះ ភាពខុសគ្នានៃសក្តានុពលអគ្គិសនីដែលមានសញ្ញាបូកនៅលើផ្ទៃខាងក្រៅ។ នៅក្នុងពាក្យផ្សេងទៀតថាមពលនៃភាពខុសគ្នានៅក្នុងសក្តានុពល redox នៃសារធាតុត្រូវបានបំលែងទៅជាថាមពលនៃសក្តានុពលអេឡិចត្រូតប្រូតុង ArH + ។
សក្ដានុពលអេឡិចត្រូគីមីបង្ខំឱ្យប្រូតុងផ្លាស់ទីក្នុងទិសដៅផ្ទុយ - ពីផ្ទៃខាងក្រៅទៅខាងក្នុង។ ATP synthetase គឺជាប្រូតេអ៊ីន oligomeric ដ៏ធំមួយដែលក្នុងនោះបីផ្នែកត្រូវបានសម្គាល់: ផ្នែកមួយដែលលាតសន្ធឹងទៅក្នុងម៉ាទ្រីស mitochondrial (F1) ដែលបង្កើតឡើងពីបីគូនៃ sf dimers; ផ្នែក transmembrane (F0) បង្កើតជាឆានែល hydrophilic និងតំបន់មធ្យម FA ។ អង្គភាពរង F1 មានគេហទំព័រសកម្មដែលសំយោគ ATP ។ ប្រូតុងផ្លាស់ទីតាមឆានែល ATP synthase ហើយថាមពលពីចលនានេះត្រូវបានប្រើដើម្បីបង្កើត ATP ។ យន្តការជាក់លាក់នៃការភ្ជាប់គ្នា ពោលគឺការបំប្លែងសក្តានុពលអេឡិចត្រូគីមីទៅជាថាមពលនៃចំណងម៉ាក្រូនៃ ATP នៅតែមិនច្បាស់លាស់ទាំងស្រុង។
ATP លទ្ធផលដោយមានការចូលរួមពី ADP-ATP translocase ត្រូវបានបញ្ជូនពីម៉ាទ្រីសទៅផ្នែកខាងក្រៅនៃភ្នាស ហើយចូលទៅក្នុង cytosol ។ ក្នុងពេលជាមួយគ្នានេះ translocase ដូចគ្នាផ្ទេរ ADP ក្នុងទិសដៅផ្ទុយពី cytosol ទៅម៉ាទ្រីស mitochondrial ។
នៅក្រោមលក្ខខណ្ឌសិប្បនិមិត្ត ការពិសោធន៍នៅក្នុង vitro វាអាចធ្វើទៅបានដើម្បីបង្កើតលើសពី ATP ពីផ្ទៃខាងក្នុងនៃភ្នាសខាងក្នុង។ ក្នុងករណីនេះ ប្រតិកម្មកើតឡើងពីស្តាំទៅឆ្វេង ពោលគឺអង់ស៊ីមធ្វើការជា ATPase ដឹកជញ្ជូនដែលផ្ទេរប្រូតុង (H+-ATPase)។ ក្នុងករណីនេះភ្នាសត្រូវបានផ្តល់ថាមពល: ArH + កើតឡើងដោយសារតែថាមពលនៃ ATP hydrolysis ។
១១.៣.៣.១. អ្នកដឹកជញ្ជូនអេឡិចត្រុង
ក្រុមហ៊ុនដឹកជញ្ជូនអេឡិចត្រុងមានទីតាំងនៅលើផ្ទៃឬជ្រៅនៅក្នុងភ្នាស mitochondrial ខាងក្នុងដែលត្រូវបានរៀបចំជាឈើឆ្កាងចំនួននិងដង់ស៊ីតេវេចខ្ចប់ដែលទាក់ទងទៅនឹងតម្រូវការថាមពលរបស់កោសិកា។
អ្នកដឹកជញ្ជូនអេឡិចត្រុងជាច្រើនគឺជាប្រូតេអ៊ីនដែលមាន heme ជាក្រុមសិប្បនិម្មិត។
លក្ខណៈសម្បត្តិនៃម៉ូលេគុល heme អាស្រ័យលើប្រូតេអ៊ីនដែលវាត្រូវបានភ្ជាប់។ លើសពីនេះទៀត hemes នៅក្នុង cytochromes ផ្សេងគ្នាអាចមានភាពខុសប្លែកគ្នានៅក្នុងរចនាសម្ព័ន្ធនៃក្រុមចំហៀងនិងវិធីសាស្រ្តនៃការភ្ជាប់ទៅនឹង apoprotein ។ ដូច្នេះ cytochromes អាចមានភាពខុសប្លែកគ្នានៅក្នុងសក្តានុពល redox ទោះបីជាពួកវាទាំងអស់មានក្រុមសិប្បនិម្មិតដូចគ្នាក៏ដោយ។
ឧបករណ៍បញ្ជូនអេឡិចត្រុងត្រូវបានគេហៅថា cytochromes ព្រោះវាមានពណ៌ក្រហម។ cytochromes ផ្សេងៗគ្នាត្រូវបានកំណត់ដោយសន្ទស្សន៍អក្សរ៖ s 1, s, a, a 3 –តាមលំដាប់នៃទីតាំងរបស់ពួកគេនៅក្នុងសៀគ្វី។
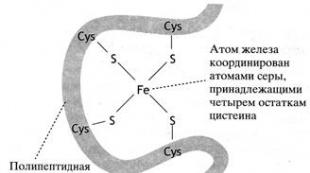
ប្រភេទផ្សេងទៀតនៃអ្នកផ្ទុកអេឡិចត្រុងដែលមានជាតិដែកដែលមិនមានជាតិដែករួមមានប្រូតេអ៊ីនដែលអាតូមដែកត្រូវបានផ្សារភ្ជាប់ទៅនឹងក្រុម sulfhydryl នៃសំណល់ប្រូតេអ៊ីន cysteine ក៏ដូចជាទៅ anions sulfhydryl នៃសំណល់ដែលបង្កើតជាស្ពាន់ធ័រដែក - ស្ពាន់ធ័រឬមជ្ឈមណ្ឌល ( រូប 29)។

អង្ករ។ ២៩.រចនាសម្ព័ន្ធនៃមជ្ឈមណ្ឌលដែក - ស្ពាន់ធ័រ
ដូចនៅក្នុង cytochromes អាតូមដែកនៅក្នុងមជ្ឈមណ្ឌលបែបនេះអាចទទួលយក និងបរិច្ចាគអេឡិចត្រុង ដោយឆ្លាស់គ្នាចូលទៅក្នុងរដ្ឋ ferro (Fe 2+) និង ferri (Fe 3+) ។ មជ្ឈមណ្ឌលជាតិដែក-ស្ពាន់ធ័រដំណើរការរួមគ្នាជាមួយអង់ស៊ីមដែលមានផ្ទុក flavin ទទួលយកអេឡិចត្រុងពី succinate dehydrogenase និង dehydrogenases ដែលពាក់ព័ន្ធនឹងការកត់សុីជាតិខ្លាញ់។
ប្រភេទផ្សេងទៀតនៃការដឹកជញ្ជូនគឺប្រូតេអ៊ីនដែលមាន FMN ។ FMN (flavin adenine mononucleotide) គឺជាសមាសធាតុមួយដែលជាពាក់កណ្តាល flavin នៃម៉ូលេគុល FAD ។ FMN ផ្ទេរអេឡិចត្រុងពី FADN ទៅមជ្ឈមណ្ឌលដែក-ស្ពាន់ធ័រ។
អ្នកដឹកជញ្ជូនប្រូតេអ៊ីនទាំងអស់គឺជាប្រូតេអ៊ីនអាំងតេក្រាលដែលកាន់កាប់ទីតាំងថេរយ៉ាងតឹងរឹងនៅក្នុងភ្នាសហើយត្រូវបានតម្រង់ទិសតាមរបៀបជាក់លាក់មួយ។ ករណីលើកលែងគឺ cytochrome c ដែលត្រូវបានចងរលុងទៅនឹងភ្នាសខាងក្រៅ ហើយងាយស្រួលទុកវាចោល។

ក្រុមហ៊ុនដឹកជញ្ជូនអេឡិចត្រុងដែលមិនមានប្រូតេអ៊ីនតែមួយគត់គឺ ubiquinone ដែលត្រូវបានគេដាក់ឈ្មោះដូច្នេះដោយសារតែនៅលើដៃមួយវាគឺជា quinone ហើយម្យ៉ាងវិញទៀតវាត្រូវបានរកឃើញនៅគ្រប់ទីកន្លែង (ពីភាសាអង់គ្លេស។ គ្រប់ទីកន្លែង- សព្វគ្រប់) ។ ឈ្មោះអក្សរកាត់របស់វាគឺ CoQ, UQ ឬសាមញ្ញ Q ។ មជ្ឈមណ្ឌលស្ពាន់ធ័រដែកទាំងអស់បរិច្ចាគអេឡិចត្រុងទៅ ubiquinone ។
ក្នុងអំឡុងពេលកាត់បន្ថយ ubiquinone មិនត្រឹមតែទទួលបានអេឡិចត្រុងប៉ុណ្ណោះទេ ថែមទាំងប្រូតុងផងដែរ (រូបភាព 30) ។

Fig.30 ។ Ubiquinone - coenzyme Q (a)
និងការផ្លាស់ប្តូរ redox របស់វា (ខ)
ជាមួយនឹងការកាត់បន្ថយអេឡិចត្រុងមួយ វាប្រែទៅជា semiquinone (រ៉ាឌីកាល់សេរីសរីរាង្គ) ហើយជាមួយនឹងការកាត់បន្ថយអេឡិចត្រូដពីរ វាប្រែទៅជា hydroquinone ។ វាគឺជាការបង្កើតកម្រិតមធ្យមនៃរ៉ាឌីកាល់សេរីដែលអនុញ្ញាតឱ្យ ubiquinone បម្រើជាក្រុមហ៊ុនដឹកជញ្ជូនមិនមែនពីរទេ ប៉ុន្តែអេឡិចត្រុងមួយ។ កន្ទុយ hydrophobic វែងខ្លាំង (អាតូមកាបូន 40 ក្នុងសំណល់ isoprenoid ជាប់គ្នាដប់) ផ្តល់ឱ្យ ubiquinone នូវសមត្ថភាពក្នុងការបញ្ចូល និងផ្លាស់ទីដោយសេរីនៅក្នុងស្រទាប់ដែលមិនមានប៉ូលនៃភ្នាសខាងក្នុងនៃ mitochondrial ។
១១.៣.៣.២. ទីតាំងនៃវ៉ិចទ័រ
លំហូរនៃអេឡិចត្រុងរវាងក្រុមហ៊ុនដឹកជញ្ជូនត្រូវបានដឹកនាំពីក្រុមហ៊ុនដឹកជញ្ជូនដែលមានសក្តានុពលកាត់បន្ថយខ្ពស់ (ឧ. សក្ដានុពល redox ទាប) ទៅកាន់ក្រុមហ៊ុនដឹកជញ្ជូនដែលមានសក្តានុពលកាត់បន្ថយទាប (ឧ. កត់សុីកាន់តែច្រើន ជាមួយនឹងសក្តានុពល redox ខ្ពស់ជាង) (រូបភាព 31) ។

រូបភាពទី ៣១ ។សក្តានុពល Redox នៃសមាសធាតុខ្សែសង្វាក់ផ្លូវដង្ហើមនៅក្នុង mitochondria
នៅក្នុងខ្សែសង្វាក់ mitochondrial អ្នកដឹកជញ្ជូនមានសក្តានុពល redox ខុសៗគ្នា។
ឧបករណ៍បញ្ជូនអេឡិចត្រុងនៅក្នុងខ្សែសង្វាក់មានទីតាំងនៅក្នុងសៀគ្វីដែល DG 0 (ថាមពលឥតគិតថ្លៃ) ថយចុះបន្តិចម្តង ៗ ហើយសក្តានុពល redox កើនឡើងស្របគ្នា។ នៅដំណាក់កាលនីមួយៗនៃការផ្ទេរអេឡិចត្រុងទៅកាន់ក្រុមហ៊ុនដឹកជញ្ជូនដែលនៅជិតខ្សែសង្វាក់ ថាមពលឥតគិតថ្លៃត្រូវបានបញ្ចេញ។
កំឡុងពេលអុកស៊ីតកម្មនៃជាតិស្ករ អេឡិចត្រុងត្រូវបានផ្ទេរពី NADH និង FADH 2 ទៅអុកស៊ីសែន។ អ្នកដឹកជញ្ជូនជាច្រើនត្រូវបានចូលរួមនៅក្នុងដំណើរការនេះ ប៉ុន្តែពួកគេអាចត្រូវបានដាក់ជាក្រុមទៅជាស្មុគស្មាញចំនួន 4 ដែលត្រូវបានបង្កប់នៅក្នុងភ្នាស mitochondrial
(រូបភាព 32) ។

អង្ករ។ ៣២.ស្មុគស្មាញដឹកជញ្ជូនអេឡិចត្រុងចំនួនបួន
នៅក្នុងភ្នាស mitochondrial
រវាងស្មុគ្រស្មាញ អេឡិចត្រុងផ្លាស់ទីរួមគ្នាជាមួយក្រុមហ៊ុនដឹកជញ្ជូនចល័ត៖ ubiquinone និង cytochrome គ. Ubiquinone ទទួលអេឡិចត្រុងពីស្មុគស្មាញ I និង II ហើយផ្ទេរពួកវាទៅស្មុគស្មាញ III ។ Cytochrome c ដើរតួជាអន្តរការីរវាងស្មុគស្មាញ III និង IV ។ ស្មុគស្មាញ I ផ្ទេរអេឡិចត្រុងពី NADH ទៅ Q; ស្មុគស្មាញ II - ពី succinate តាមរយៈ FADN 2 ទៅ Q; complex III ប្រើ QH 2 ដើម្បីកាត់បន្ថយ cytochrome c ហើយស្មុគស្មាញ IV ផ្ទេរអេឡិចត្រុងពី cytochrome ជាមួយសម្រាប់អុកស៊ីសែន។ ស្មុគស្មាញ I, III និង IV ត្រូវបានគេហៅថារៀងគ្នា NADH-CoQ reductase, CoQH 2 -cytochrome ជាមួយ-reductase និង cytochrome oxidase ។ ស្មុគស្មាញ IV - cytochrome oxidase - មានប្រូតេអ៊ីនជាច្រើន។ វាទទួលបានអេឡិចត្រុងពី cytochrome ជាមួយនៅខាងក្រៅភ្នាស mitochondrial ខាងក្នុង។ នៅលើផ្លូវរបស់ពួកគេទៅកាន់អុកស៊ីសែន អេឡិចត្រុងទាំងនេះឆ្លងកាត់ cytochromes កនិង ក ៣ដែលមានអាតូមទង់ដែង ដែលបំប្លែងទៅជារដ្ឋ Cu + និង Cu 2+ ។ Cytochrome oxidase កាត់បន្ថយអុកស៊ីសែនដោយឥតគិតថ្លៃ៖
អូ 2 + 4 អ៊ី - + 4H + ® 2H 2 ឱ
១១.៣.៣.៣. ទ្រឹស្តីគីមីវិទ្យារបស់ Mitchell
ការដឹកជញ្ជូនអេឡិចត្រុងតាមខ្សែសង្វាក់ផ្លូវដង្ហើមនាំទៅដល់ការបង្កើត ATP ។ គំនិតនៃយន្តការនៃការដឹកជញ្ជូនអេឡិចត្រុងភ្ជាប់ជាមួយការសំយោគ ATP ត្រូវបានបង្កើតឡើងដោយអ្នកជីវគីមីជនជាតិអង់គ្លេស Peter Mitchell ក្នុងឆ្នាំ 1961 (Mitchell បានទទួលរង្វាន់ណូបែលនៅឆ្នាំ 1978) ។ Mitchell បានរកឃើញថាលំហូរនៃអេឡិចត្រុងបណ្តាលឱ្យប្រូតុងត្រូវបានបូមចេញពី mitochondria ចូលទៅក្នុងបរិយាកាសជុំវិញដោយបង្កើតជម្រាលប្រូតុងឆ្លងកាត់ភ្នាស (pH នៃដំណោះស្រាយខាងក្រៅថយចុះ) ។ ដោយសារប្រូតុងគឺជាភាគល្អិតដែលមានបន្ទុកវិជ្ជមាន ដោយសារតែការបូមចេញពី mitochondria ភាពខុសគ្នានៃសក្តានុពលអគ្គិសនី (ដក - ខាងក្នុង) និង pH ខុសគ្នា (ខ្ពស់ជាង - ខាងក្នុង) កើតឡើងនៅលើភ្នាស។ រួមគ្នា ជម្រាលអគ្គិសនី និងកំហាប់បង្កើតបានជាកម្លាំងជំរុញប្រូតុង (យោងតាម Mitchell) ដែលជាប្រភពថាមពលសម្រាប់ការសំយោគ ATP (រូបភាព 33)។


អង្ករ។ ៣៣.គ្រោងការណ៍នៃការសំយោគ ATP នៅក្នុងផ្ទៃក្នុង
ភ្នាស mitochondrial
កម្លាំងជំរុញប្រូតុងជំរុញឱ្យស្មុគស្មាញ ATP synthase ដែលប្រើលំហូរនៃអេឡិចត្រុងដើម្បីសំយោគ ATP ពី ADP និងផូស្វ័រ។ ស្មុគស្មាញគឺជាបណ្តាញប្រូតុងឯកទេស (ការព្យាករណ៍រាងផ្សិតដែលគ្របដណ្តប់ផ្ទៃខាងក្នុងនៃគ្រីស្តាល់) ។ ស្មុគ្រស្មាញត្រូវបានតំណាងដោយសមាសធាតុទំនាក់ទំនងគ្នាពីរ F 0 F 1 ដែលនីមួយៗមានម៉ូលេគុលប្រូតេអ៊ីនជាច្រើន។ F 0 ត្រូវបានបិទនៅក្នុងភ្នាស ហើយ F 1 មានទីតាំងនៅលើផ្ទៃរបស់វា។ វាគឺនៅក្នុង F1 ដែល ATP ត្រូវបានសំយោគខណៈពេលដែល F0 ដំណើរការមុខងារនៃឆានែលប្រូតុងដោយខ្លួនឯង (រូបភាព 34) ។

រូបភាពទី 34 ។តំណាងគ្រោងការណ៍នៃរចនាសម្ព័ន្ធ "ផ្សិត" នៃ F 0 F 1 ATP synthetase ពី E. coli ។ សមាសធាតុ F 0 ជ្រាបចូលទៅក្នុងភ្នាសបង្កើតជាឆានែលសម្រាប់ប្រូតុង។ វាត្រូវបានសន្មត់ថា F 1 មានបីក្រុមរង a និង 3 b ដែលត្រូវបានរៀបចំដូច្នេះពួកវាបង្កើតបានជារចនាសម្ព័ន្ធ hexameric ដូចជា "មួកផ្សិត" និងមួយ g, មួយ d និង e រងដែលបង្កើតជា "ដំបង" តភ្ជាប់ F 0 ។ ទៅកាន់ប៉ុស្តិ៍ F 1
វាមិនត្រូវបានគេដឹងច្បាស់អំពីរបៀបដែល ATP ត្រូវបានបង្កើតតាមរយៈការសំយោគ ATP ។ យោងតាមទ្រឹស្ដីមួយ ក្នុងអំឡុងពេលផ្ទេរប្រូតុងតាមរយៈកត្តា F0 ការផ្លាស់ប្តូរទម្រង់កើតឡើងនៅក្នុងសមាសធាតុ F1 ដែលសំយោគ ATP ពី ADP និងផូស្វ័រ។
សម្រាប់រាល់គូនៃអេឡិចត្រុងដែលបានផ្ទេរពី NADH ទៅអុកស៊ីសែន មានប្រូតុងចំនួន 10 ត្រូវបានបូមចេញពីម៉ាទ្រីស mitochondrial ។ ដូច្នេះការកត់សុីនៃម៉ូលេគុល 1 NADH នាំទៅដល់ការសំយោគម៉ូលេគុល 2.5 ATP ហើយការកត់សុីនៃម៉ូលេគុល 1 FADH 2 នាំទៅដល់ការសំយោគម៉ូលេគុល 1.5 ATP ។ ពីមុនវាត្រូវបានគេជឿថាម៉ូលេគុល ATP បីនិងពីរត្រូវបានសំយោគរៀងគ្នា។ បរិមាណទាំងនេះជាធម្មតាត្រូវបានគេហៅថាសមាមាត្រ P/O ចាប់តាំងពីការផ្ទេរអេឡិចត្រុង 2 គឺស្មើនឹងការថយចុះនៃអាតូមអុកស៊ីសែន 1 ។
ទិន្នផលនៃ ATP កំឡុងពេលអុកស៊ីតកម្មនៃម៉ូលេគុលគ្លុយកូសទៅជា CO 2 និង H 2 O ។
Glycolysis ផលិតម៉ូលេគុល ATP 2 (4 ត្រូវបានផលិតប៉ុន្តែ 2 ត្រូវបានប្រើប្រាស់) ។ ក្នុងអំឡុងពេល glycolysis ម៉ូលេគុល 2 នៃ NADH ក្នុង 1 ម៉ូលេគុលនៃគ្លុយកូសក៏ត្រូវបានបង្កើតឡើងនៅក្នុង cytoplasm ផងដែរ។ 2 ម៉ូលេគុល ATP ត្រូវបានបង្កើតឡើងនៅក្នុងវដ្តនៃអាស៊ីតនៃក្រូចឆ្មា (ពី 1 ម៉ូលេគុលគ្លុយកូស 2 ម៉ូលេគុល acetyl-CoA ត្រូវបានបង្កើតឡើង ដែលបង្កឱ្យមានការវិលជុំនៃវដ្តពីរ)។
សម្រាប់រាល់ម៉ូលេគុលគ្លុយកូស 1 ម៉ូលេគុល pyruvate dehydrogenase ផលិត 2 ម៉ូលេគុលនៃ NADH ហើយវដ្តនៃអាស៊ីតនៃក្រូចឆ្មាផលិត 6 ម៉ូលេគុលនៃ NADH ។ ការកត់សុីរបស់ពួកគេនាំទៅដល់ការសំយោគម៉ូលេគុល ATP ចំនួន 20 ។ ម៉ូលេគុល ATP បីបន្ថែមទៀតត្រូវបានបង្កើតឡើងដោយសារតែការកត់សុីនៃ FADH 2 កំឡុងពេលបំប្លែង succinate ទៅ fumarate ។
ទិន្នផលសរុបនៃម៉ូលេគុល ATP នឹងអាស្រ័យលើយន្តការ shuttle (glycerophosphate និង malate aspartate) ដែលត្រូវបានប្រើប្រាស់ដោយកោសិកាដើម្បីបញ្ជូន NADH ទៅកាន់ខ្សែសង្វាក់ផ្លូវដង្ហើម។ នៅក្នុងយន្តការ glycerol phosphate អេឡិចត្រុងពី NADH ត្រូវបានផ្ទេរទៅ dihydroxyacetone phosphate ដើម្បីបង្កើត glycerol-3-phosphate ដែលផ្ទេរអេឡិចត្រុងទៅខ្សែសង្វាក់ផ្លូវដង្ហើម (រូបភាព 35) ។ វាកើតឡើងជាមួយនឹងការចូលរួមនៃអង់ស៊ីម glycerol-3-phosphate dehydrogenase ។ ដោយមានជំនួយពី cytoplasmic NADH, mitochondrial FAD ដែលជាក្រុមសិប្បនិម្មិតនៃ flavoprotein - glycerol-3-phosphate dehydrogenase ត្រូវបានស្តារឡើងវិញ។

អង្ករ។ ៣៥.យន្តការបិទទ្វារ glycerol phosphate
ប្រព័ន្ធ shuttle មួយផ្សេងទៀត ប្រព័ន្ធ malate-aspartate ផ្ទេរអេឡិចត្រុងពី cytoplasmic NADH ទៅ mitochondrial NAD + (រូបភាព 36) ។ នេះនាំឱ្យមានការបង្កើត mitochondrial NADH ដែលត្រូវបានកត់សុីបន្ថែមទៀតនៅក្នុងខ្សែសង្វាក់ដឹកជញ្ជូនអេឡិចត្រុង។ នៅក្នុង cytoplasm NADH កាត់បន្ថយ oxaloacetate ទៅជា malate ។ ក្រោយមកទៀត ដោយមានជំនួយពីក្រុមហ៊ុនដឹកជញ្ជូន ចូលទៅក្នុង mitochondria ដែលជាកន្លែងដែលវាត្រូវបាន reoxidized ទៅជា oxaloacetate ជាមួយនឹងការកាត់បន្ថយ NAD + ។ Oxaloacetate ខ្លួនវាមិនអាចចាកចេញពី mitochondria បានទេ ដូច្នេះដំបូងវាប្រែទៅជា aspartate ដែលត្រូវបានដឹកជញ្ជូនដោយក្រុមហ៊ុនដឹកជញ្ជូនចូលទៅក្នុង cytoplasm ។ នៅក្នុង cytoplasm, aspartate ត្រូវបាន deaminated, ប្រែទៅជា oxaloacetate ហើយដោយហេតុនេះបិទយន្តការ shuttle ។

Fig.36 ។ Malate-aspartate shuttle system សម្រាប់ការផ្ទេរអេឡិចត្រុង
ប្រព័ន្ធនៃប្រូតេអ៊ីន transmembrane ដែលទាក់ទងនឹងរចនាសម្ព័ន្ធ និងមុខងារ និងឧបករណ៍បញ្ជូនអេឡិចត្រុង។ វាអនុញ្ញាតឱ្យអ្នករក្សាទុកថាមពលដែលបានបញ្ចេញក្នុងអំឡុងពេលអុកស៊ីតកម្មនៃ NAD * H និង FADH2 ដោយអុកស៊ីសែនម៉ូលេគុលក្នុងទម្រង់ជាសក្តានុពលនៃប្រូតុង transmembrane ដោយសារតែការផ្ទេរតាមលំដាប់នៃអេឡិចត្រុងតាមខ្សែសង្វាក់រួមជាមួយនឹងការបូមប្រូតុងតាមរយៈភ្នាស។ ខ្សែសង្វាក់ដឹកជញ្ជូននៅក្នុង eukaryotes ត្រូវបានធ្វើមូលដ្ឋានីយកម្មនៅលើភ្នាស mitochondrial ខាងក្នុង។ មានស្មុគ្រស្មាញ multienzyme 4 នៅក្នុងខ្សែសង្វាក់ផ្លូវដង្ហើម។ វាក៏មានស្មុគ្រស្មាញមួយទៀតដែលមិនពាក់ព័ន្ធនឹងការផ្ទេរអេឡិចត្រុង ប៉ុន្តែសំយោគ ATP ។
ទី 1 - CoA oxidoreductase ។
1. ទទួលអេឡិចត្រុងពី NADH ហើយផ្ទេរពួកវាទៅ coenzyme Q (ubiquinone) ។ 2.ផ្ទេរ 4 H+ ions ទៅផ្ទៃខាងក្រៅនៃភ្នាស mitochondrial ខាងក្នុង។
ទី 2-FAD-dependent dehydrogenases ។
1. ការកាត់បន្ថយ FAD ដោយ cytochrome c oxidoreductase ។
2. ទទួលអេឡិចត្រុងពី coenzyme Q ហើយផ្ទេរពួកវាទៅ cytochrome c ។
3.ផ្ទេរ 2 H+ ions ទៅផ្ទៃខាងក្រៅនៃភ្នាស mitochondrial ខាងក្នុង។
ទី 4-cytochrome c-oxygen oxidoreductase ។
1. ទទួលយកអេឡិចត្រុងពី cytochrome c និងផ្ទេរពួកវាទៅអុកស៊ីសែនដើម្បីបង្កើតជាទឹក។
2.ផ្ទេរ 4 H+ ions ទៅផ្ទៃខាងក្រៅនៃភ្នាស mitochondrial ខាងក្នុង។ អាតូមអ៊ីដ្រូសែនទាំងអស់ដែលបានបំបែកចេញពីស្រទាប់ខាងក្រោមដោយ dehydrogenases នៅក្រោមលក្ខខណ្ឌ aerobic ឈានដល់ភ្នាស mitochondrial ខាងក្នុងដែលជាផ្នែកមួយនៃ NADH ឬ FADH2 ។
នៅពេលដែលអេឡិចត្រុងផ្លាស់ទី ពួកវាបាត់បង់ថាមពល -> ថាមពលត្រូវបានចំណាយដោយស្មុគ្រស្មាញលើការបូមប្រូតុង H ។ ការផ្ទេរអ៊ីយ៉ុង H កើតឡើងនៅក្នុងតំបន់ដែលបានកំណត់យ៉ាងតឹងរ៉ឹង -> តំបន់ផ្សំ។ លទ្ធផល៖ ATP ត្រូវបានផលិត៖ អ៊ីយ៉ុង H+ បាត់បង់ថាមពលដែលឆ្លងកាត់ ATP synthase ។ ផ្នែកមួយនៃថាមពលនេះចំណាយលើការសំយោគ ATP ។ ផ្នែកផ្សេងទៀតត្រូវបានរលាយដូចជាកំដៅ។
ខ្សែសង្វាក់ផ្លូវដង្ហើម mitochondrial មាន 5 ស្មុគស្មាញ multienzyme ដែលជាផ្នែករងដែលត្រូវបានអ៊ិនកូដដោយទាំងហ្សែននុយក្លេអ៊ែរនិង mitochondrial ។ Coenzyme Q10 និង cytochrome c ត្រូវបានចូលរួមនៅក្នុងការដឹកជញ្ជូនអេឡិចត្រុង។ អេឡិចត្រុងបានមកពីម៉ូលេគុល NAD*H និង FAD"H ហើយត្រូវបានដឹកជញ្ជូនតាមខ្សែសង្វាក់ផ្លូវដង្ហើម។ ថាមពលដែលបានបញ្ចេញត្រូវបានប្រើដើម្បីដឹកជញ្ជូនប្រូតុងទៅកាន់ភ្នាសខាងក្រៅនៃ mitochondria ហើយជម្រាលអេឡិចត្រូគីមីជាលទ្ធផលត្រូវបានប្រើដើម្បីសំយោគ ATP ដោយប្រើស្មុគស្មាញ V នៃ ខ្សែសង្វាក់ផ្លូវដង្ហើម mitochondrial
44. លំដាប់និងរចនាសម្ព័ន្ធនៃអ្នកដឹកជញ្ជូនអេឡិចត្រុងនៅក្នុងសង្វាក់ផ្លូវដង្ហើម
1 ស្មុគស្មាញ។ NADH-CoQ oxidoreductase
ស្មុគ្រស្មាញនេះក៏មានឈ្មោះធ្វើការ NADH dehydrogenase មាន FMN (flavin mononucleotide) ម៉ូលេគុលប្រូតេអ៊ីន 22 ដែលក្នុងនោះ 5 គឺជាប្រូតេអ៊ីនដែក-ស្ពាន់ធ័រដែលមានទម្ងន់ម៉ូលេគុលសរុបរហូតដល់ 900 kDa ។
ទទួលយកអេឡិចត្រុងពី NADH ហើយផ្ទេរពួកវាទៅ coenzyme Q (ubiquinone) ។
ផ្ទេរអ៊ីយ៉ុង 4 H + ទៅផ្ទៃខាងក្រៅនៃភ្នាស mitochondrial ខាងក្នុង។
2 ស្មុគស្មាញ។ dehydrogenases ដែលពឹងផ្អែកលើ FAD
វារួមបញ្ចូលអង់ស៊ីមដែលពឹងផ្អែកលើ FAD ដែលមានទីតាំងនៅលើភ្នាសខាងក្នុង - ឧទាហរណ៍ acyl-SCoA dehydrogenase (ការកត់សុីអាស៊ីតខ្លាញ់), succinate dehydrogenase (វដ្តនៃអាស៊ីត tricarboxylic), mitochondrial glycerol-3-phosphate dehydrogenase (NADH ចូលទៅក្នុង mitochondria) ។
ការកាត់បន្ថយ FAD ក្នុងប្រតិកម្ម redox ។
ធានាការផ្ទេរអេឡិចត្រុងពី FADN2 ទៅប្រូតេអ៊ីនដែក - ស្ពាន់ធ័រនៃភ្នាស mitochondrial ខាងក្នុង។ អេឡិចត្រុងទាំងនេះបន្ទាប់មកទៅ coenzyme Q.
46. យន្តការជីវគីមីនៃការបំបែកអុកស៊ីតកម្ម និងផូស្វ័រ កត្តាដែលបណ្តាលឱ្យពួកវាការផ្តាច់ការដកដង្ហើម និងផូស្វ័រ
សារធាតុគីមីមួយចំនួន (ប្រូតូណូហ្វ័រ) អាចដឹកជញ្ជូនប្រូតុង ឬអ៊ីយ៉ុងផ្សេងទៀត (អ៊ីយ៉ូណូហ្វ័រ) ពីចន្លោះប្រហោងក្នុងភ្នាសចូលទៅក្នុងម៉ាទ្រីស ដោយឆ្លងកាត់បណ្តាញប្រូតុងនៃ ATP synthase ។ ជាលទ្ធផលសក្តានុពលអេឡិចត្រូគីមីបាត់ហើយការសំយោគ ATP ឈប់។ បាតុភូតនេះត្រូវបានគេហៅថា uncoupling នៃការដកដង្ហើមនិង phosphorylation ។ ជាលទ្ធផលនៃការ uncoupling បរិមាណ ATP ថយចុះហើយ ADP កើនឡើង។ ក្នុងករណីនេះ អត្រាអុកស៊ីតកម្មនៃ NADH និង FADH2 កើនឡើង ហើយបរិមាណអុកស៊ីសែនស្រូបយកក៏កើនឡើងដែរ ប៉ុន្តែថាមពលត្រូវបានបញ្ចេញក្នុងទម្រង់កំដៅ ហើយសមាមាត្រ P/O ថយចុះយ៉ាងខ្លាំង។ តាមក្បួនមួយ uncouplers គឺជាសារធាតុ lipophilic ដែលងាយស្រួលឆ្លងកាត់ស្រទាប់ lipid នៃភ្នាស។ សារធាតុមួយក្នុងចំណោមសារធាតុទាំងនេះគឺ 2,4-dinitrophenol (Fig ។ 6-17) ដែលងាយស្រួលឆ្លងកាត់ពីទម្រង់អ៊ីយ៉ូដទៅវត្ថុដែលមិនមានអ៊ីយ៉ូដ ដោយភ្ជាប់ប្រូតុងនៅក្នុងលំហអន្តរភ្នាស ហើយផ្ទេរវាទៅក្នុងម៉ាទ្រីស។
ឧទាហរណ៏នៃ uncouplers ក៏អាចជាថ្នាំមួយចំនួនផងដែរ ឧទាហរណ៍ dicumarol - anticoagulant (សូមមើលផ្នែកទី 14) ឬការរំលាយអាហារដែលត្រូវបានបង្កើតឡើងនៅក្នុងរាងកាយ bilirubin - ផលិតផលនៃ catabolism (សូមមើលផ្នែកទី 13) thyroxine - អរម៉ូនទីរ៉ូអ៊ីត (សូមមើលផ្នែក។ ១១). សារធាតុទាំងអស់នេះបង្ហាញប្រសិទ្ធភាពមិនផ្គូផ្គងតែនៅកំហាប់ខ្ពស់ប៉ុណ្ណោះ។
ការបិទ phosphorylation នៅពេលបាត់បង់ ADP ឬ phosphate inorganic ត្រូវបានអមដោយការរារាំងផ្លូវដង្ហើម (ឥទ្ធិពលនៃការគ្រប់គ្រងផ្លូវដង្ហើម) ។ ផលប៉ះពាល់មួយចំនួនធំដែលបំផ្លាញភ្នាស mitochondrial រំខានដល់ការភ្ជាប់គ្នារវាងអុកស៊ីតកម្ម និងផូស្វ័រ ដែលអនុញ្ញាតឱ្យការផ្ទេរអេឡិចត្រុងកើតឡើង សូម្បីតែអវត្ដមាននៃការសំយោគ ATP (ឥទ្ធិពល uncoupling)
1. ទិន្នផលសរុប៖
ដើម្បីសំយោគម៉ូលេគុល ATP 1 ប្រូតុង 3 ត្រូវបានទាមទារ។
2. សារធាតុរារាំង phosphorylation អុកស៊ីតកម្ម៖
សារធាតុរារាំងរារាំង V complex៖
Oligomycin - រារាំងបណ្តាញប្រូតុងនៃ ATP synthase ។
Atractyloside, cyclophylline - ប្លុក translocases ។
3. Uncouplers នៃ phosphorylation អុកស៊ីតកម្ម៖
Uncouplers គឺជាសារធាតុ lipophilic ដែលអាចទទួលយកប្រូតុង និងផ្ទេរវាតាមរយៈភ្នាសខាងក្នុងនៃ mitochondria ដោយឆ្លងកាត់ V complex (ឆានែលប្រូតុងរបស់វា)។ ឧបករណ៍ផ្ដាច់៖
ធម្មជាតិ - ផលិតផលនៃ lipid peroxidation, អាស៊ីតខ្លាញ់ខ្សែសង្វាក់វែង; កម្រិតធំនៃអរម៉ូនទីរ៉ូអ៊ីត។
សិប្បនិម្មិត - dinitrophenol, អេធើរ, ដេរីវេនៃវីតាមីន K, ថ្នាំស្ពឹក។