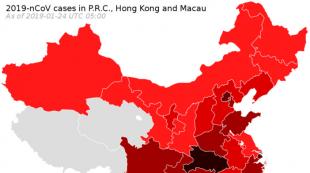
Дәрілік заттарды ластанудан қорғау. Қорқынышты сөз ластануы! Мемлекеттік фармакопея
Шөптік дәрілік шикізат оны дайындаудың барлық кезеңдерінде (жинау, кептіру, ұнтақтау, орау, сақтау) микроорганизмдермен ластануы мүмкін. Шикізаттарда ауа микрофлорасының өкілдері басым, споралы және спорасыз таяқшалар, кокктар, пигментті бактериялар, зеңдер, ашытқылар жиі кездеседі. Өсімдіктің дәрілік шикізатында бола отырып, микробтар оны механикалық түрде ластап қана қоймайды, сонымен қатар дұрыс сақталмаған жағдайда (жоғары ылғалдылық, бөлменің шаңдылығы, жәндіктердің, кеміргіштердің болуы және т.б.) оны өмір бойы пайдаланады. Сонымен қатар микробтық ферменттердің әсерінен фармакологиялық маңызды белсенді заттар жойылады, бұл оның емдік құндылығының төмендеуіне әкеледі. Бұзылу белгілері - бұл құрылымның, түстің, иістің өзгеруі. Жаңа піскен шикізат әсіресе тез бұзылады.
Дайын өнімнің ластану көздері – дәріханалардың стерильденбеген ауасы, құрал-жабдықтар, шикізат, ыдыс-аяқ, тығындар, су, қызметкерлердің қолдары. Микробтардың, әсіресе патогендердің рецепттер арқылы таралу мүмкіндігі де маңызды болып отыр.
Микробтардың зақымдануы:
ұнтақтар (әсіресе тальк, крахмал), алымдар
ерітінділер, сусындар, инфузиялар, қайнатпалар, тамшылар
жақпа, пасталар, шарлар, суппозиторийлер
стерильді инъекциялық препараттар
Микробтардың ең көп саны су инфузиясында, қайнатпаларда, ең азы - тұнбаларда болуы мүмкін. Сондықтан тоңазытқышта инфузиялар мен қайнатпаларды сақтау 2 күннен аспауы керек.
Дайын дәрілік заттардың құрамында болғандықтан, оларда микроорганизмдер көбейіп, препараттың белсенді компоненттерін бұзады. Тұнбалар мен қайнатпалардың зақымдануының жиі кездесетін белгілері бұлыңғырлықтың пайда болуы, түсінің өзгеруі, қабықшаның, шөгінділердің, қышқыл иістің және т.б. Бұл бұзылу белгілері әсіресе қант шәрбаты қосылғанда және жылы бөлмеде сақталғанда айқын көрінеді. Дайын өнімнің микробтармен ластануы көп жағдайда дәріханаларда санитарлық-гигиеналық режимнің сақталуына байланысты.
Микробтық ластануды болдырмау үшін дәрі-дәрмектерді қабылдау кезінде келесі ережелерді сақтау керек:
ауаны бактерицидтік шамдармен дезинфекциялау,
жеке гигиена ережелерін сақтау,
дәрілік заттарды дайындау технологиясын сақтау,
дәрілік шикізатты және дайын дәрілік формаларды дұрыс сақтау,
қажет болса, консерванттарды қолданыңыз.
3.1. Дәрілік заттардың микробтық ластануын анықтау
Дүниежүзілік денсаулық сақтау ұйымының және Беларусь Республикасының Мемлекеттік фармакопеясының талаптарына сәйкес, дәрілік заттардың микробтық ластануын шектейтін белгілі бір стандарттар бар. Дәрілік препараттардағы микроорганизмдерді анықтау үшін микробиологиялық талдау әдістері қолданылады. Әдетте 1 г құрғақ препараттағы немесе 1 мл ерітіндідегі микроорганизмдердің санын анықтайды. Белгілі бір дәрілік форманың микробиологиялық талдау әдістері жеке болып табылады. Бұл препараттардың өздерінің бактерицидтік және бактериостатикалық әрекетіне, сондай-ақ микроорганизмдердің осы препаратқа сезімталдығына немесе төзімділігіне байланысты.
Дәрілік заттардың, субстанциялардың және дәрілік заттарды өндіруге арналған көмекші материалдардың микробиологиялық тазалығы 5.1-бапта белгіленген талаптарға сәйкес келуі керек. Беларусь Республикасының Мемлекеттік Фармакопеясы «Стерилизация бойынша жалпы мәтіндер» (3-4 кестелер).
3-кесте – Дәрілік заттардың микробиологиялық тазалығы
|
Қолдану | ||
|
Парентеральді енгізу үшін Көзге арналған дәрілер Ашық жаралар мен күйіктерге жағуға арналған «Стерилділік» талабына жататын басқа да дәрілік заттар |
Стерилділік |
|
|
Жергілікті қолдану үшін, тері арқылы Интравагинальды қолдану үшін yxa, noca қуысында нұсқаулық үшін Тыныс алу жолдарына енгізу үшін (стерильді болуы керек препараттарды қоспағанда) |
Аэробты бактериялар мен саңырауқұлақтардың жалпы саны (барлығы) - 1 г немесе 1 мл-де 10 2-ден көп емес Бактериялар тұқымдасының болмауы Enterobacteriaceae 1 г немесе 1 мл Болмауы П. аeruginosa 1 г немесе 1 мл Болмауы С. аураeбізл г немесе 1 мл |
|
|
Ішке немесе тік ішекке енгізуге арналған A. Дәрілерuсинтетикалық текті заттардан B. Дәрілік нысандар табиғи текті заттардан (өсімдік, жануар, минералды), артында Санатқа енгізілген қаражатты қоспағанда 4 |
Аэробты бактериялардың жалпы саны 1 г немесе 1 мл-де 10 3-тен көп емес Саңырауқұлақтардың жалпы саны 1 г немесе 1 мл-де 10 2-ден аспайды Болмауы Е. коли 1 г немесе 1 мл Аэробты бактериялардың жалпы саны 1 г немесе 1 мл-де 10 4-тен көп емес Саңырауқұлақтардың жалпы саны 1 г немесе 1 мл-де 10 2-ден аспайды Болмауы Е. коли 1 г немесе 1 мл Тұқымның бактерияларының болмауы Сальмонелла 10 г немесе 10 мл Болмауы П. aeruginosa 1 г немесе 1 мл Болмауы С. алтын алтын 1 г немесе 1 мл Энтеробактериялар - 1 г немесе 1 мл-де 10 2 артық емес |
|
|
AT. Балаларға арналған дәрілер |
Аэробты бактериялардың жалпы саны 1 г немесе 1 мл-де 500-ден аспайды Саңырауқұлақтардың жалпы саны - 1 г немесе 1 мл-де 50-ден аспайды Enterobacteriaceae 1 г немесе 1 мл Болмауы П. aeruginosa 1 г немесе 1 мл Болмауы С. алтын алтын 1 г немесе 1 мл |
|
|
Шикізаттың бір түрінен (оралған өнімдер) немесе бірнеше (алымдар), сондай-ақ «ангро» шөптік шикізаттан тұратын дәрілік заттар А. Термиялық өңдеу арқылы дайындалған инфузия және қайнатпа түрінде қолданылатын дәрілік шөп өнімдері немесе дәрілік шикізат "ангро" B. Термиялық өңдеусіз қолданылатын дәрілік шөп өнімдері немесе дәрілік шикізат «ангро». |
Аэробты бактериялардың жалпы саны 1 г немесе 1 мл-де 10 7-ден аспайды Саңырауқұлақтардың жалпы саны 1 г немесе 1 мл-де 10 5-тен аспайды Е. коли- 1 г-де 10 2 артық емес Аэробты бактериялардың жалпы саны 1 г немесе 1 мл-де 10-нан көп емес Саңырауқұлақтардың жалпы саны 1 г немесе 1 мл-де 10 4-тен аспайды Болмауы Е. коли 1 г немесе 1 мл Тұқымның бактерияларының болмауы Сальмонелла 10 г немесе 10 мл Энтеробактериялар - 1 г немесе 1 мл-де 10 2 артық емес |
4-кесте – Дәрілік заттарды өндіруге арналған заттар мен көмекші материалдардың микробиологиялық тазалығы
|
Қолдану | ||
|
Заттар өндіру үшін: Стерильді дәрілер Санатқа жататын стерильді емес дәрілік заттар 2 |
Аэробты бактериялар мен саңырауқұлақтардың жалпы саны (барлығы) 1 г немесе 1 мл-де 10 2 артық емес Отбасының бактерияларының болмауы Энтеробактерияларceae 1 г немесе 1 мл |
|
|
3В санатына жататын стерильді емес дәрілік заттар |
Болмауы П. aeruginosa 1 г немесе 1 мл Болмауы С. алтын алтын 1 г немесе 1 мл |
|
|
Синтетикалық заттар стерильді емес дәрілік заттарды өндіруге арналған шығу тегі |
Аэробты бактериялардың жалпы саны 1 г немесе 1 мл-де 10 2-ден аспайды Саңырауқұлақтардың жалпы саны 10 2 1 г немесе 1 мл-ден аспайды Болмауы Е. коли 1 г немесе 1 мл |
|
|
Табиғи заттар шығу тегі (өсімдік, жануар немесе минерал) Көмекші материалдар (бидай ұны, крахмал, тальк және т.б.).) |
Аэробты бактериялардың жалпы саны 1 г немесе 1 мл-де 10 2-ден аспайды Саңырауқұлақтардың жалпы саны 1 г немесе 1 мл-де 10-нан аспайды Болмауы Е. коли 1 г немесе 1 мл Тұқымның бактерияларының болмауы Сальмонелла 10 г немесе 10 мл Болмауы П. aeruginosa 1 г немесе 1 мл Болмауы С. алтын алтын 1 г немесе 1 мл Энтеробактериялар 10 2 1 г немесе 1 мл артық емес |
Кестелерден көрініп тұрғандай, стерильді іріңді жараларды, жараларды, күйіктерді жергілікті емдеу үшін жаңа туған нәрестелерге арналған инъекциялар, майлар, пленкалар, көз тамшылары және барлық дәрілік нысандар болуы керек.
Қабылдауға арналған дәрілік формалар бойынша osпатогенді және шартты патогенді микроорганизмдер болмауы керек.
Жергілікті, интравагинальды дәрілік формалар үшін, сондай-ақ құлақ және мұрын қуысында қолдану үшін 1 г (мл) препаратқа 100 микробтық жасушалардан артық емес рұқсат етіледі.
Кейбір стерильді емес дәрілік заттардың құрамында микробқа қарсы белсенділігі бар компоненттер мен консерванттар бар. Микробиологиялық тазалыққа сынау нәтижелерін қате бағалауды болдырмау үшін дәрілік препараттың әсері келесі сынақ дақылдарына қатысты алдын ала анықталады: Стафилококк алтын алтын, Escherichia coli, Pseudomonas aeruginosa, таяқша subtilis (цереус), Candida albicans. Сынақ дақылдарын өсіру үшін сәйкес орталар пайдаланылады (5-кесте).
Кесте 5. Сынақ дақылдарын өсіруге арналған орталар
Айқас контаминацияның алдын алу
өндірісте
5.18. Шикізаттың немесе өнімнің басқа шикізатпен немесе өнімдермен ластануын болдырмау керек. Кездейсоқ айқас ластану қаупі шаңның, газдардың, булардың, аэрозольдердің немесе микроорганизмдердің бақылаусыз таралуынан, материалдар мен өнімдерді өңдеуден, жабдық пен персонал киіміндегі қалдықтардан туындайды. Тәуекел дәрежесі ластаушы заттың түріне және ластанған өнімге байланысты. Ең қауіпті ластаушы заттарға сезімталдығы жоғары заттар, құрамында тірі микроорганизмдер бар биологиялық дәрілік заттар, кейбір гормондар, цитотоксикалық препараттар және басқа да жоғары белсенді заттар жатады. Ең қауіптісі инъекцияға арналған препараттардың, сондай-ақ үлкен дозада және/немесе ұзақ уақыт бойы қабылданатын препараттардың ластануы болып табылады.
5.19. Айқас ластануды болдырмау үшін тиісті техникалық және/немесе ұйымдастыру шараларын қабылдау қажет, мысалы:
арнайы аймақтарда өндіру (пенициллиндер, тірі вакциналар, құрамында тірі бактериялар бар дәрілер және кейбір басқа да биологиялық өнімдер сияқты өнімдер үшін міндетті) немесе тиісті тазалаудан кейін өндірістік циклдар принципіне негізделген өндіріс (уақыты бойынша бөлінген науқандар);
ауа құлыптары мен сору құрылғыларының болуы және ұйымдастырылуы;
тазартылмаған немесе өңделмеген ауаның рециркуляциясы немесе қайта кіруі нәтижесінде пайда болатын ластану қаупін азайту;
қорғаныс киімдерін өнімдермен жұмыс істейтін үй-жайларда сақтау, бұл айқаспалы ластану қаупін тудырады;
белгілі тиімділігі бар тазалау және залалсыздандыру әдістерін қолдану, өйткені тиімсіз тазартылған жабдық әдетте айқас ластану көзі болып табылады;
өндірістің «жабық жүйелерін» пайдалану;
қалдықтарды бақылау және жабдықтың тазалау күйін көрсететін жапсырмаларды жағу.
5.20. Айқас ластануды болдырмау шаралары және олардың тиімділігі бекітілген процедураларға сәйкес мерзімді түрде тексерілуі керек.
Валидация
5.21. Валидация қызметі осы Ережені қолдауы керек; олар белгіленген тәртіпке сәйкес жүзеге асырылуы тиіс. Нәтижелер мен қорытындылар құжатталған болуы керек.
5.22. Жаңа өнеркәсіптік регламентті немесе жаңа өндіріс әдісін енгізу кезінде олардың сериялық өндіріске жарамдылығын дәлелдеу қажет. Көрсетілген материалдар мен құрал-жабдықтарды пайдалана отырып, процесс қажетті сападағы өнімдерді дәйекті түрде өндіретінін дәлелдеу керек.
5.23. Өндіріс процесіндегі елеулі өзгерістер, соның ішінде өнім сапасына және/немесе процестің қайталану мүмкіндігіне әсер етуі мүмкін жабдыққа немесе шикізатқа кез келген өзгертулер валидациялануы тиіс.
5.24. Процестер мен процедуралар белгілі бір нәтижелерге қол жеткізу үшін жарамды болып қалуын қамтамасыз ету үшін мерзімді қайта тексеруден (қайта тексеруден) өтуі керек.
көзішикізат
5.25. Шикізат сатып алу жауапты операция болып табылады, оған жеткізушілер туралы егжей-тегжейлі және толық ақпараты бар қызметкерлер тартылуы керек.
5.26. Шикізатты тек тиісті спецификацияда көрсетілген рұқсат етілген жеткізушілерден және мүмкіндігінше тікелей өндірушіден сатып алу керек. Өндірушінің шикізатқа арналған техникалық сипаттамаларын жеткізушілермен келісу ұсынылады. Өндіруші мен жеткізуші арасында өңдеу, таңбалау, орау, қабылдамау процедуралары және шағымдарды өңдеу талаптары бойынша шикізатты өндіру мен бақылаудың барлық аспектілері келісілуі керек.
5.27. Әрбір жеткізілімде қаптаманың және пломбалардың бүтіндігі, жеткізілім құжатында көрсетілген ақпараттың жеткізушінің этикеткаларына сәйкестігі тексерілуі керек.
5.28. Егер шикізаттың бір жеткізілімі әртүрлі партиялардан тұратын болса, онда әрбір партия сынамаларды алу, сынау және пайдалануға рұқсат беру үшін жеке партия ретінде қарастырылуы керек.
5.29. Сақтау аймағында орналасқан шикізат тиісті түрде таңбалануы керек (осы Қағидалардың I бөлігінің 5.13-тармағын қараңыз). Белгілер кем дегенде келесі ақпаратты қамтуы керек:
өнімнің атауы және қажет болған жағдайда ішкі зауыттық код;
қабылдау кезінде берілген өндірушінің сериялық нөмірі және/немесе сериялық нөмірі;
мүмкін болған жағдайда, мазмұнның күйі (мысалы: карантинге жатқызылған, сынақта, рұқсат етілген, қабылданбаған);
жарамдылық мерзімі немесе қажет болған жағдайда қайта бақылау қажет болған күн.
Толық компьютерлендірілген сақтау жүйелері пайдаланылса, бұл ақпараттың барлығын затбелгіге енгізу қажет емес.
5.30. Шикізаттың әрбір контейнерінің мазмұнының түпнұсқалығын қамтамасыз ету үшін тиісті процедуралар немесе шаралар болуы керек. Сынамалар алынған контейнерлер таңбалануы керек (осы Қағидалардың I бөлімінің 6.13 тармағын қараңыз).
5.31. Сапаны бақылау бөлімі бекіткен және жарамдылық мерзімі өтпеген шикізатты ғана пайдаланыңыз.
5.32. Шикізаттарды таза және дұрыс таңбаланған ыдыстарға дұрыс өлшенгенін немесе дұрыс өлшенгенін қамтамасыз ету үшін жазбаша рәсімге сәйкес тағайындалған адамдар ғана босатуы керек.
5.33. Әрбір берілген шикізатқа және оның массасына немесе көлеміне тәуелсіз тексеру жүргізілуі керек; бұл шолу құжатталуы керек.
5.34. Әрбір партияға шығарылатын шикізат бірге сақталуы және анық таңбалануы керек.
Технологиялық операциялар:
аралық және сусымалы өнімдер
5.35. Кез келген технологиялық операцияны бастамас бұрын жұмыс алаңы мен жабдықтың тазартылуын және жоспарланған операцияға қатысы жоқ кез келген шикізаттың, өнімдердің, өнім қалдықтарының немесе құжаттамалардың болмауын қамтамасыз ету үшін шаралар қабылдау қажет.
5.36. Аралық өнімдер мен сусымалы өнімдер тиісті жағдайларда сақталуы керек.
5.37. Маңызды процестер валидациялануы тиіс (осы Қағидалардың 5.21 5.24 – «Валидация» - I бөлімін қараңыз).
5.38. Өндіріс процесінде барлық қажетті бақылау және бақылау жүргізіліп, құжатталуы керек. өндірістік орта.
5.39. Күтілетін нәтижеден кез келген елеулі ауытқу құжатталуы және зерттелуі керек.
Қаптама материалдары
5.40. Бастапқы және басып шығарылған орау материалдарын сатып алу, бақылау және өңдеуге шикізат сияқты назар аудару керек.
5.41. Баспа өнімдеріне ерекше назар аудару керек. Олар рұқсат етілмеген адамдардың кіруіне жол бермеу үшін тиісті қауіпсіз жағдайларда сақталуы керек. Кесілген жапсырмалар мен басқа да шашыраңқы баспа материалдары араласып кетпес үшін жабық контейнерлерде бөлек сақталуы және тасымалдануы керек. Орам материалдарын пайдалануға рұқсатты тек бекітілген және құжатталған рәсімге сәйкес арнайы тағайындалған адамдар беруі керек.
5.42. Әрбір жөнелтуге немесе бастапқы немесе басып шығарылған орау материалдарының сериясына сәйкестендіру нөмірі немесе сәйкестендіру белгісі тағайындалуы керек.
5.43. Жарамдылық мерзімі өткен немесе жарамсыз баспа немесе бастапқы орау материалдары құжаттамамен бірге жойылуы керек.
Буып-түю операциялары
5.44. Буып-түю операцияларын жоспарлау кезінде айқас ластану, араластыру немесе алмастыру қаупін азайтуға ерекше назар аудару керек. Физикалық бөлу талап етілетін жағдайларды қоспағанда, әртүрлі үлгідегі өнімдерді бір-біріне жақын орналастыруға жол берілмейді.
5.45. Буып-түю операцияларын бастамас бұрын жұмыс аймағының, орау желілерінің, баспа машиналарының және басқа жабдықтардың таза болуын және бұрын қолданылған препараттардың, материалдардың немесе жоспарланған операция үшін қажет емес құжаттардың болмауын қамтамасыз ету үшін шаралар қабылдау қажет. Желіні тазалау тиісті процедураға сәйкес жүргізілуі керек.
5.46. Әрбір орау орнында немесе жолда оралған өнімнің атауы мен сериясының нөмірі көрсетілуі керек.
5.47. Өнімдер мен орау материалдарын орау алаңына қабылдаған кезде олардың саны, сәйкестігі және орау нұсқауларына сәйкестігі тексерілуі керек.
5.48. Бастапқы орау материалдары толтыру операциясы басталғанға дейін таза болуы керек. Шыны сынықтары мен металл бөлшектері сияқты кез келген ластануды болдырмау және жою үшін абай болу керек.
5.49. Жалпы ереже бойынша, таңбалау орау және пломбалаудан кейін мүмкіндігінше тезірек орындалуы керек. Егер бұл орын алмаса, шатасу немесе қате таңбалау орын алмау үшін қажетті шараларды қабылдау қажет.
5.50. Кез келген басып шығару операцияларының дәлдігі (мысалы, партия нөмірлері, жарамдылық мерзімі) бөлек процесс қадамы ретінде немесе орау процесінде орындалғанына қарамастан, мұқият бақылануы және құжатталуы керек. Қолмен таңбалауға ерекше назар аудару керек, оны үнемі тексеріп отыру керек.
5.51. Кесілген жапсырмаларды пайдалану және штамптарды орау сызығынан тыс қолдану кезінде ерекше сақтық шараларын сақтау қажет. Араласудың алдын алу үшін кесілген жапсырмалардың орнына орамдағы жапсырмаларды қолданған жөн.
5.52. Барлық электрондық кодтарды оқу құралдары, жапсырма есептегіштері және ұқсас құрылғылардың дұрыс жұмыс істеуін тексеру үшін тексерулер жүргізілуі керек.
5.53. Басып шығару немесе бедерлеу арқылы қолданылатын орауыш материалдардың таңбалауы анық және өшуге немесе тозуға төзімді болуы керек.
5.54. Желілік өнімді орау процесін бақылаған кезде, кем дегенде мыналарды тексеру керек:
пакеттердің жалпы көрінісі;
пакеттердің толықтығы;
бұйымдардың сәйкес түрлерін және орау материалдарын пайдалану;
кез келген таңбаны қолданудың дұрыстығы;
желідегі басқару құрылғыларының дұрыс жұмыс істеуі.
Қаптама желісінен алынған үлгілерді желіге қайтаруға болмайды.
5.55. Өнімдерді орау кезінде күтпеген жағдайлар орын алса, оларды арнайы тексеруден, тергеуден кейін және тиісті уәкілетті тұлғаның рұқсатымен ғана өндіріске қайтаруға болады. Бұл әрекеттер хаттама түрінде ресімделіп, белгіленген тәртіпте сақталуы тиіс.
5.56. Баланс кезінде сусымалы өнімдердің, басып шығарылған орауыш материалдарының саны мен өндірілген дайын өнім бірліктерінің саны арасындағы елеулі немесе әдеттен тыс сәйкессіздік анықталса, сәйкессіздіктің себебін тексеру және босатуға рұқсат бергенге дейін анықтау қажет.
5.57. Буып-түю операциялары аяқталғаннан кейін партия нөмірі бар кез келген қалған орау материалдары жойылып, құжатталуы керек. Таңбаланбаған орау материалдары бекітілген тәртіпке сәйкес қоймаға қайтарылады.
Дайын өнім
5.58. Шығару рұқсат етілгенге дейін дайын өнімдер өндіруші белгілеген шарттарда карантинде сақталуы керек.
5.59. Шығаруға рұқсат алғанға дейін дайын өнімді және құжаттаманы бағалау жүргізілуі керек, оның тәртібі осы Қағидалардың 6-тарауында («Сапаны бақылау») келтірілген.
5.60. Шығарылғаннан кейін дайын өнім өндіруші белгілеген шарттарда сатылатын қор ретінде сақталуы керек.
Қабылданбаған, қайта пайдаланылған
және қайтарылған материалдар мен өнімдер
5.61. Қабылданбаған материалдар мен өнімдер анық таңбалануы және тыйым салынған жерлерде бөлек сақталуы керек. Олар жеткізушіге қайтарылуы, қайта өңделуі (егер бар болса) немесе жойылуы керек. Қабылданған кез келген іс-әрекеттер құжатталуы және тиісті өкілеттігі бар тұлғалармен мақұлдануы тиіс.
5.62. Дайын өнім сапасының нашарлауы болмаса және техникалық сипаттамалардың барлық талаптары орындалған жағдайда, бас тартылған өнімді қайта өңдеуге ерекше жағдайларда рұқсат етіледі. Өңдеу рұқсат етілген өнеркәсіптік ережелерге сәйкес ықтимал тәуекелді бағалаудан кейін құжаттамадан кейін жүзеге асырылады.
5.63. Өндірістің белгілі бір сатысында бұрын өндірілген тиісті сападағы партиялардың барлығын немесе бір бөлігін бір өнімнің партиясымен біріктіру жолымен салалық нормативтік құқықтық актілерде көзделген қайта пайдалануға байланысты тәуекелдерді бағалау ескеріле отырып, алдын ала рұқсат етілуге тиіс. сақтау мерзіміне кез келген ықтимал әсерді қоса алғанда. Қайта пайдалану әрекеттері құжатталуы керек.
5.64. Өңдеуден өткен кез келген дайын өнімді немесе қайта өңделген өнімдер енгізілген өнімдерді қосымша бақылау қажеттілігін сапаны бақылау бөлімі анықтайды.
5.65 Өндірушінің бақылауын жоғалтқан нарықтан қайтарылған өнім, егер оның сапасының белгіленген талаптарға сәйкестігі расталмаса, жойылуы керек. Қайта сату, қайта таңбалау немесе қайта пайдалану туралы шешім жазбаша рәсімге сәйкес сапаны бақылау бөлімі жүргізетін арнайы талдаудан кейін ғана қабылдануы мүмкін. Бұл ретте өнімнің сипатын, оның негізі мен жай-күйін, арнайы сақтау шарттарына сәйкестігін және шығарылған күннен бастап өткен уақытты ескеру қажет. Өнімнің сапасына күмән тудыратын болса, оны қайта пайдалануға немесе қайта шығаруға жол берілмейді, бірақ белсенді ингредиенттерді қалпына келтіру үшін оны химиялық өңдеуге рұқсат етіледі. Барлық орындалған әрекеттер құжатталуы керек.
Бөлім6. САПА БАҚЫЛАУ
Принцип
Сапаны бақылау сынамаларды алуды, сынауды және техникалық шарттар, нұсқаулықтар мен басқа да құжаттардың талаптарына сәйкестігін тексеруді, жұмысты ұйымдастыруды, құжаттаманы және шығаруға рұқсат беруді қамтиды. Сапаны бақылаудың мақсаты белгіленген талаптарға сай келмейтін материалдарды немесе бұйымдарды пайдалануды немесе сатуды болдырмау болып табылады. Сапаны бақылау тек зертханалық жұмыстармен шектелмейді, ол өнімнің сапасына қатысты барлық шешімдерге қатысуы керек. Сапаны бақылау бөлімінің қанағаттанарлық жұмысының негізгі қағидасы оның өндірістік бөлімдерден тәуелсіздігі болып табылады (сонымен қатар осы Қағидалардың I бөлімінің 1-тарауын қараңыз).
Жалпы талаптар
6.1. Әрбір дәрі өндірушіде сапаны бақылау бөлімі болуы керек. Бұл бөлім басқа бөлімдерден тәуелсіз болуы керек. Бұл бөлім меңгерушісінің тиісті біліктілігі мен тәжірибесі болуы керек, оның қарамағында бір немесе бірнеше бақылау зертханалары болуы керек. Бөлім сапаны бақылау бойынша барлық іс-шаралардың тиімді және сенімді орындалуын қамтамасыз ету үшін жеткілікті ресурстармен қамтамасыз етілуі керек.
6.2. Сапаны бақылау бөлімі басшысының негізгі міндеттері осы Қағидалардың I бөлімінің 2-тарауында жинақталған. Жалпы сапаны бақылау бөлімінің басқа да міндеттері болуы мүмкін, мысалы, сапаны бақылаудың барлық процедураларын белгілеу, валидациялау және енгізу, шикізаттың, материалдардың және өнімдердің бақылау үлгілерін сақтау, шикізат пен өнімдердің қаптамасының дұрыс таңбалануын қамтамасыз ету, өнімді бақылау. тұрақтылық , өнім сапасына қатысты шағымдарды тергеуге қатысу және т.б. Барлық осы жауапкершіліктер бекітілген рәсімдерге сәйкес жүзеге асырылуы және қажет болған жағдайда құжатталуы керек.
6.3. Дайын өнімнің сапасын бағалау кезінде өндіріс жағдайларын, технологиялық бақылау нәтижелерін, өндірістік құжаттаманы қарауды (орау құжаттамасын қоса алғанда), дайын өнімнің техникалық сипаттамаларына сәйкестігін және дайын өнімнің түпкілікті қаптамасын тексеруді қоса алғанда, барлық тиісті факторларды ескеру қажет. .
6.4. Сапаны бақылау персоналының сынамаларды алу және қажетті зерттеулерді жүргізу үшін өндіріс аймақтарына қол жетімділігі болуы керек.
Жақсы зертханалық сапаны бақылау ережелері
6.5. Бақылау зертханаларының үй-жайлары мен жабдықтары осы Қағидалардың 3-тарауының I бөлігінде келтірілген сапаны бақылау аймақтарына қойылатын жалпы және арнайы талаптарға сәйкес болуы керек.
6.6. Зертханалардың персоналы, үй-жайлары мен жабдықтары өндіріс түрі мен көлеміне сәйкес болуы керек. Кейбір жағдайларда, осы Қағидалардың 1-бөлігінің 7-тарауында («Басқа ұйымға берілген қызмет (аутсорсинг)») белгіленген талаптарға сәйкес және тиісті жазбалар енгізілген жағдайда үшінші тарап зертханаларын пайдалануға рұқсат етіледі. сапасын бақылау құжаттары.
Құжаттама
6.7. Анықтамалық зертханалардың құжаттамасы осы Қағидалардың I бөлімінің 4-тарауында баяндалған қағидаттарға сәйкес болуы керек. Бұл құжаттаманың маңызды бөлігі сапаны бақылауға қатысты. Сапаны бақылау бөлімінде келесі құжаттамалар дайын болуы керек:
техникалық шарттар;
сынамаларды алу процедуралары;
орындалған сынақтар бойынша әдістер мен құжаттар (соның ішінде аналитикалық операциялық парақтар және/немесе зертханалық журналдар);
аналитикалық есептер және/немесе сертификаттар;
қажет болған жағдайда өндірістік ортаның мониторингінің нәтижелері;
сынау әдісін валидациялау хаттамалары, қажет болған жағдайда;
аспаптарды калибрлеу және жабдыққа қызмет көрсету процедуралары мен хаттамалары.
6.8. Өнім партиясын өндірудің жазбаларына қатысты кез келген сапаны бақылау құжаттамасы серияның жарамдылық мерзімі аяқталғаннан кейін бір жыл бойы және белгіленген тәртіпте уәкілетті тұлға серияның сәйкестігін бағалаған соң кемінде бес жыл бойы сақталуы тиіс. тәртіппен (осы Қағиданың I бөлігінің 2.4-тармағының с тармақшасы).
6.9. Кейбір деректер түрлері үшін (мысалы, аналитикалық сынақтардың нәтижелері, дайын өнімнің шығуы, өндірістік ортаның параметрлері және т. параметрлерді өзгерту.
6.10. Пакеттік құжаттаманың бөлігі болып табылатын ақпаратқа қосымша, зертханалық журналдар және/немесе жазбалар сияқты басқа да бастапқы деректер сақталуы және оңай қол жетімді болуы керек.
Үлгі таңдау
6.11. Сынамаларды іріктеу мыналарды анықтайтын бекітілген жазбаша рәсімдерге сәйкес жүргізілуі керек:
сынама алу әдісі;
қолданылатын жабдық;
алынатын үлгінің мөлшері;
таңдалған үлгіні бөліктерге бөлу тәртібі (қажет болған жағдайда);
сынама алу үшін қолданылатын ыдыстардың түрі мен күйі;
іріктелген үлгілері бар ыдыстарды және сынамалар алынған ыдыстарды анықтау;
әсіресе стерильді және қауіпті заттардың сынамаларын іріктеу кезінде қажет болатын кез келген ерекше сақтық шаралары;
сақтау шарттары;
сынама алу жабдығын тазалау және сақтау тәртібі.
6.12. Таңдалған бақылау үлгілері шикізат, орау материалдары немесе дайын өнім партиясының репрезентативті үлгісін көрсетуі керек. Процестегі ең маңызды қадамдарды (мысалы, бастау немесе аяқтау) бақылау үшін қосымша үлгілер де алынуы мүмкін.
6.13. Алынған үлгілері бар ыдыстың жапсырмасында оның мазмұны, партия нөмірі, сынама алынған күні, сондай-ақ осы үлгілер алынған қаптаманың белгісі көрсетілуі тиіс.
6.14. Бақылау және мұрағаттық үлгілерге қойылатын қосымша талаптар осы Қағидалардың 19-қосымшасында келтірілген.
Тестілеу
6.15. Сапаны бақылау әдістері фармакопеялық сапа стандарттарында белгіленген әдістерді қоспағанда, валидациялануы тиіс. Тіркеу дерекнамасында берілген барлық сынақтар бекітілген әдістерге сәйкес жүргізілуі керек.
6.16. Алынған сынақ нәтижелері олардың бір-бірімен сәйкестігіне көз жеткізу үшін жазылады және тексеріледі. Барлық есептеулер мұқият тексерілуі керек.
6.17. Жүргізілген сынақтар кем дегенде келесі деректерді құжаттай отырып жазылуы керек:
бастапқы материалдың, орау материалдарының немесе өнімдердің атауы және қажет болған жағдайда дәрілік нысаны;
қабылдау кезінде тағайындалған серия нөмірі және қажет болған жағдайда өндірушінің сериясының нөмірі және өндірушінің және/немесе жеткізушінің атауы;
бақылауларды, есептеулерді және жүргізілген талдаулар нәтижелерін қамтитын барлық құжаттарға сілтемелерді қоса алғанда, сынақ нәтижелері;
сынақ мерзімі;
тестілеуді өткізген тұлғалардың тегі мен аты-жөні;
сынақтардың орындалуын және қажет болған жағдайда есептеулер нәтижелерін тексерген адамдардың тегі мен инициалдары;
өнімді мақұлдау немесе бас тарту туралы нақты мәлімдеме (немесе өнімнің мәртебесі туралы басқа шешім), күні және жауапты тұлғаның қолы.
6.18. Барлық технологиялық бақылаулар, оның ішінде өндірістік персоналдың өндірістік аймақта орындайтын бақылаулары сапаны бақылау бөлімі бекіткен процедураларға сәйкес жүзеге асырылуы және олардың нәтижелері құжатталуы керек.
6.19. Зертханалық реактивтердің, көлемді зертханалық шыны ыдыстар мен титрлеу ерітінділерінің, стандартты үлгілердің және қоректік орталардың сапасына ерекше назар аудару керек. Оларды дайындау және дайындау белгіленген тәртіппен бекітілген нұсқаулықтардың талаптарына сәйкес болуы керек.
6.20. Реагенттердің зертханалық ерітінділері дайындалған күні және орындаушылардың қолдарымен таңбалануы керек. Жапсырмада тұрақсыз реагенттер мен қоректік орталардың жарамдылық мерзімі және оларды сақтаудың ерекше шарттары көрсетілуі керек. Титрленген ерітінділер үшін соңғы титрлеу күнін және сәйкес түзету коэффициентін көрсету керек.
6.21. Қажет болған жағдайда, сынау үшін пайдаланылатын әрбір заттың (мысалы, реагенттер мен анықтамалық материалдар) алынған күні оны пайдалану және сақтау бойынша тиісті нұсқаулармен бірге контейнерде көрсетілуі керек. Кейбір жағдайларда реагентті алғаннан кейін немесе қолданар алдында оны сәйкестендіру және/немесе басқа сынақтар үшін сынау қажет болуы мүмкін.
6.22. Компоненттерді, бастапқы материалдарды немесе өнімдерді бақылау үшін пайдаланылатын жануарлар, қажет болса, өңдеу алдында карантинге алынуы керек. Жануарларды күту және бақылау олардың мақсатына сай болуын қамтамасыз ету үшін ұйымдастырылуы керек. Жануарлар таңбалануы және алдыңғы өңдеу жазбалары құжатталуы керек.
Құжат... бақылау сапасыбағынышты дәрілікпішіндер. Өндірістік компания дәрілікқаражат - ұйымдастыружүзеге асыру өндіріс дәріліксәйкес қаражат талаптарФедералды...
Бір-біріне ұқсас екі өрнектің немесе пішіннің элементтерін біріктіру арқылы жаңа өрнектің немесе форманың пайда болуы. Мысалы, «мағына ойнайды» деген қате тіркес «рөл ойнайды» және «өзгеріс жасайды» деген екі тіркестің ластануы ретінде пайда болды. Бір жақты тіркестердегі немесе мақал-мәтелдердегі («Құдыққа түкірме, ұшпайсың – ұстамас») қосылыстардан басқа, атаулар мен сөздердің (дәлірек айтқанда, түбір) тіркесімі де ластану деп аталады. , мысалы, «Ф. Толстоевский» (Толстой мен Достоевский), «трагикомический» ( қайғылыжәне комикс) немесе «Поэзия академиясында - в көл сарайы ақ мәрмәр» (Игорь Северянин).
Кең мағынада ластану ұғымы келесі ережелерге негізделген:
- Формальды түрде неоформацияда екі бастапқы сөз де кем дегенде бір әріппен (дәлірек айтқанда, фонема) беріледі.
- Жаңа формация мағынасында екі төл сөздің де мағыналары бір-бірімен күрделі түрде өрілген.
- Қолдану саласы – айдарлар
- Таңдалған бөліктің сипаты:
- жалпы есімдер, қараңыз: гейбіздің заманымыздың шоғыры; Мен министр болдым қоршауолар; сотсержанки; сыранер әрқашан дайын; неге қорлайсың қарқынателье? (сонымен қатар кашенизмді қараңыз)
- аты-жөні, қараңыз.: Қазір шахтада МГӨБ жұмыс істейді қағуановски; Борис инкаЛаевич соғыс жолында; Кім болды, кім Аллажәне т.б.;
- аббревиатуралар, қараңыз: Most to AiFқаланың жаңа күні; AiFория; БАМмомындық; Үлкен тудырады SORMнения және т.б.
- жарияланымда қарастырылған тақырыптың «сәні», қараңыз: гей nially!; бірге ғаламторадам баласы парасатты болып көтеріле ме?; ВИЧжоқ үнсіздік және т.б.
Әдебиетте
Контаминацияны әр түрлі шығармалардағы эпизодтар мен басқа әдеби шығармадағы оқиғаларды оқиғаға енгізу деп те атайды.
Химия және биология
фармацевтикалық препараттар
Фармацевтикада – араластыру (дәрілік заттарды дұрыс таңдамауға әкелетін курорт). Бұл термин нормативтік құжаттарда қолданылады.
да қараңыз
Ескертпелер
Викимедиа қоры. 2010 ж.
Синонимдер:Басқа сөздіктерде «Ластану» деген не екенін қараңыз:
ластану- (психологияда) (латын тілінен contaminatio араластыру) әртүрлі сөздерге қатысты буындарды бір сөзге біріктіруден тұратын сөздердің қате қайталануы (мысалы, «белок» және «орам» сөздерінің орнына «белтоқ» деп айтылады). ). Осындай өзгерістер... Үлкен психологиялық энциклопедия
- [лат. contaminatio mixing] 1) гетерогенді факторларды жаңа жиынтыққа араластыру, біріктіру; 2) lingv. екі сөздің және өрнектің бөліктерін араластыру нәтижесінде жаңа сөздің немесе өрнектің пайда болуы (мысалы, k ретінде қате «ойын мағынасы» ... ... Орыс тілінің шетел сөздерінің сөздігі
Араластыру, байланыс, ластану Орыс синонимдерінің сөздігі. ластану Орыс тілінің синонимдер сөздігін араластыру қараңыз. Практикалық нұсқаулық. М.: Орыс тілі. Александрова З.Е. 2011 ... Синонимдік сөздік
- (латын тілінен contaminatio контакт араластыру), 1) жаңа бірліктердің пайда болуына немесе әрқашан табиғи емес, бірінің дамуына әкелетін тілдік бірліктердің (көбінесе сөздер немесе сөз тіркестерінің) мағынасы немесе дыбыстық ұқсастықтарының өзара әрекеттесуі. ... ... Үлкен энциклопедиялық сөздік
Магманың толық ассимиляцияланған иесімен немесе басқа магмамен араласуы. н.К. процесінде бөгде материал магмамен оның тікелей балқуы немесе матасоматикалық реакциялар арқылы және бір бөлігін алып тастау арқылы ассимиляцияланады ... ... Геологиялық энциклопедия
- (лат. contaminatio араластыру) әртүрлі объектілерге жататын бөліктердің кескіндегі немесе концепциядағы бірігуімен сипатталатын ақпаратты жалған жаңғырту. Ластану құбылысының көрінуі үшін семантикалық және фонетикалық ... ... маңызды. Психологиялық сөздік
БАСТАУ, ластану, әйелдер. (лат. contaminatio контакт) (линг.). Екі біртекті дауыссыз форманың элементтерін біріктіру арқылы сөздің жаңа формасының немесе өрнектің немесе жаңа мағынаның пайда болуы. Дұрыс емес өрнек...... СөздікУшаков
Ластану, және, әйелдер. 1. Араластыру, жалғау (кітап). 2. Тіл білімінде: екі тіркес немесе форма элементтерін біріктіру арқылы жаңа сөз тіркесінің, сөздің, форманың пайда болуы, п. ұқсас (мысалы, «мәнді ойнату» қате өрнегі ... ... Ожеговтың түсіндірме сөздігі
Үлгіге немесе мәдениетке ластаушы заттардың түсуі; микробиологияда. - таза дақылдың бөгде микроорганизмдермен бітелуі (контаминациясы). (Дереккөз: «Микробиология: терминдер сөздігі», Фирсов Н.Н., М: Bustard, 2006) ... Микробиология сөздігі
ластану- және, жақсы. ластану f. лат. контаминацияның жанасуы, араласуы. 1. тіл. Екі сөздің немесе сөз тіркесінің бөліктерін қиылысу, біріктіру арқылы жаңа сөздің немесе сөз тіркесінің пайда болуы; мысалы, қате өрнек - мұраны жинау ... Орыс тілінің галлицизмдерінің тарихи сөздігі
ЛАСТАНУ- (латын тілінен contaminatio дескация, жұқтыру), жұқтыру сәті, яғни ағзаға инфекцияның енуі үшін аз қолданылатын термин (Инфекцияны қараңыз). Психиатрияда K. термині сөздердің қате қосылуын білдіреді, қашан басы немесе аяғы ... ... Үлкен медициналық энциклопедия
Кітаптар
- Қазіргі ағылшын тіліндегі ластану: A Fait Accompli, Н.А.Лаврова. Монография қазіргі заманғы контаминацияның сөзжасамдық моделін көпөлшемді зерттеуге арналған. Ағылшын тілі. Жұмыс құрылымдық-семантикалық және ... зерттейді.
Бүгінгі таңда тұтыну нарығына түсетін дәрілік заттардың сапасы мен қауіпсіздігін бақылау басты мәселелердің біріне айналып отыр. Фармацевтика өнеркәсібінде дәрілік заттардың сапасын қамтамасыз ету жүйесі оларды жасаудан бастап сатуға және тұтынушыға пайдалануға дейін енгізілуде. Дәрілік формалардың сапасын сипаттайтын маңызды көрсеткіштердің бірі оның микробиологиялық тазалығы болып табылады.
Көптеген препараттар микроорганизмдердің дамуы үшін орта ретінде қызмет етеді. Микроорганизмдермен ластанған (контаминацияланған) препараттар науқасқа қауіп төндіреді. Эволюция процесінде ересек адамның денесінің көмегімен әртүрлі жүйелермикрофлорадан қорғауға бейімделген (эпидермистің десквамациясы, асқазанның қышқыл ортасы, көз жасы сұйықтығындағы лизоцим және т.б.), бірақ ең маңызды мүшелер мен биологиялық сұйықтықтар (ми, жүрек, қан, цереброспинальды сұйықтық) әрқашан стерильді болып қалады. Жаңа туған нәрестенің қорғаныс механизмдері жетілмеген, ал науқас адамда олар әлсіреген, сондықтан стерильді емес сыртқы дәрілік формаларды (майлар, майлар және т.б.) қолданғанда инфекция қаупі күрт артады. Денені жұқтыру қаупі инъекциялық ерітінділерді енгізу кезінде, жарақаттарды, күйіктерді, үсіктерді емдеуде де үлкен.
Дәрілік формадағы микроорганизмдер белсенді және қосалқы заттардың ыдырауын тудыруы мүмкін. Бұл препараттың емдік әсерін жоғалтуға, дәрілік форманың сыртқы түрін өзгертуге, кейде улы өнімдердің пайда болуына әкеледі. Патогендік микроорганизмдерден айырмашылығы, көптеген сапрофиттер ферменттердің үлкен жиынтығына ие және әртүрлі заттарды, ақуыздарды, липидтерді және т.б. ыдыратуға қабілетті.
Дәрілік формалар мен заттардың жойылу қарқындылығы олардың концентрациясына, ылғалдылығына, қоршаған орта температурасына, сондай-ақ бастапқы ластану сипаты мен дәрежесіне байланысты. Дәрілердің жарамдылық мерзімі де маңызды.
Микробтық ластану көздері:
ішкі ауа. Үлкен қаланың 1 литр ауасында микрофлораның тасымалдаушысы болып табылатын 1 мыңнан 1 миллионға дейін әртүрлі бөлшектер болатыны белгілі - бір микроорганизм 1000 суспензиялы бөлшектерді құрайды;
жануар текті, өсімдік және синтетикалық бастапқы дәрілік және қосалқы заттар (мысалы, қатты ластанған – панкреатин, пепсин, глюкоза, тальк, крахмал, агар және т.б.);
тасымалдау, сақтау кезінде микробтық ластану орын алатын тазартылған суды қоса алғанда, дисперсиялық орталар;
көмекші материалдар (сүзу – мақта, қағаз, дәке; орау – қағаз, бөтелкелер, банкалар, қораптар, тығындар);
Адам. Тыныш күйде адам 1 минут ішінде 200 мыңға дейін әртүрлі бөлшектерді (қабыршықтар, эпидермис жасушалары және т.б.) шығарады, қозғалыс кезінде - 1 миллионға дейін, сондықтан дәріхана сауда алаңында келушілердің айтарлықтай санының болуы, сырттан шаң мен кірдің енуі өндірістік үй-жайларға енетін микрофлораның ауасының жоғарылауына әкеледі;
дәріхана қызметкерлері. Таза бөлмелердегі арнайы киімдердің өзінде қызметкерлер қоршаған ортаға көлемі 0,5 мкм-ден 5 мкм-ге дейінгі 2 миллионға дейін бөлшектерді, 5 мкм өлшемдегі 300 мың бөлшектерді және құрамында микроорганизмдер бар 160-тан астам бөлшектерді шығарады.
Ластанудың негізгі көзі – ауыз бен мұрын. Сөйлескен кезде адам шығаратын бөлшектердің саны артады;
технологиялық процесс (жабдықтар, құрылғылар, құрылғылар).
Соңғы жылдары дәрілік заттардың микробтық ластану проблемасы халықаралық симпозиумдарда, Дүниежүзілік фармацевтер федерациясының отырыстарында және басқа комиссияларда талқылау тақырыбына айналды, өйткені көптеген фармацевтикалық өнімдер микроорганизмдердің көбеюі үшін субстрат ретінде қызмет етеді.
Өйткені Дәріхана денсаулық сақтау мекемесі болғандықтан, ол жоғары санитарлық деңгейге сай болуы керек. Сондықтан дәріхана үй-жайларында, жабдықтарда және қызметкерлердің қолдарында ауаның микробтық ластануын азайтуға бағытталған шаралар үлкен мәндәрілік заттардың микробтық ластануын азайту және кейбір жағдайларда толығымен жою.
8.2.1 Бастапқы материалдардың немесе өнімдердің басқа материалдармен және өнімдермен ластануын болдырмау керек. Өндіріс процесінде кездейсоқ көлденең ластану қаупі шаңның, газдардың, булардың, аэрозольдердің немесе
материалдар мен бұйымдардан, сондай-ақ жабдықтар мен адамдардың киімдеріндегі қалдық ластаушы заттардан микроорганизмдер.
8.2.2 Тәуекел дәрежесі ластану түріне және ластануға ұшыраған өнімге байланысты. Ең қауіпті ластаушы заттарға (ластаушылар) сенсибилизаторлық заттар, құрамында тірі микроорганизмдер бар биологиялық препараттар, кейбір гормондар, цитотоксиндер және басқа да күшті әсер ететін заттар жатады.
8.2.3 Контаминация әсіресе инъекцияға қолданылатын препараттар үшін, сондай-ақ жоғары дозаларға, ұзақ мерзімді қолдануға және/немесе ұзақ қолдануға арналған препараттар үшін қауіпті.
8.2.4 Айқас ластануды болдырмау үшін келесідей техникалық және ұйымдастыру шаралары қарастырылуы керек:
Өндіріс алаңдарын бөлу (осындай препараттар, пенициллиндер, тірі вакциналар, тірі микроорганизмдерден бактериялық препараттар және кейбір басқа да биологиялық өнімдер үшін міндетті) немесе циклдар арасында үй-жайлар мен жабдықтарды тиісті түрде тазалай отырып, олардың өндірістік циклдерін уақытында бөлу;
Ауа құлыптарын және шығару құрылғыларын ұйымдастыру;
Тазаланбаған немесе жеткіліксіз өңделген ауаның рециркуляциясы немесе қайта кіруі нәтижесінде пайда болатын ластану қаупін азайту;
Өте тиімді тазалау және өңдеу әдістерін қолдану, себебі жеткіліксіз тиімді тазалау жиі айқас ластанудың себебі болып табылады.
Өндірістің «тұйық контурларын» пайдалану;
Тазалық күйін көрсететін жабдықтың қалдықтарын бақылау және таңбалау.
8.2.5 Айқас ластануды болдырмау шараларының тиімділігі бекітілген нұсқауларға сәйкес мерзімді түрде тексерілуі керек.
Валидация (біліктілік)
8.3.1 Валидация (біліктілік) зерттеулері жақсы өндірістің тиімділігін арттыруы және бекітілген нұсқауларға сәйкес жүргізілуі керек. Олардың нәтижелері мен қорытындылары жазылуы керек.
8.3.2 Өндірістің жаңа тәртібін немесе өндіріс әдістерін бекіткен кезде өндіріс процесінің, жаппай өндіріске қолданылатын материалдар мен жабдықтардың жарамдылығын тексеру қажет. Белгіленген процесс, қолданылатын материалдар мен белгіленген жабдық қажетті сападағы өнімді дәйекті түрде шығаратынын көрсету керек.
8.3.3 Өнім сапасына немесе процестің қайталану мүмкіндігіне әсер етуі мүмкін жабдық пен материалдардағы кез келген өзгерістерді қоса алғанда, технологиядағы елеулі өзгерістер валидациялануы (біліктілігі) болуы керек.
8.3.4 Өндірістік процестер мен процедуралар қажетті нәтижелерге қол жеткізуді жалғастыратынын растау үшін қайта тексерілуі керек.
Шикізат
8.4.1 Шикізат сатып алу жауапты операция болып табылады, оны жеткізушілер туралы толық және толық ақпараты бар қызметкерлер орындауы керек.
8.4.2 Бастапқы материалдарды тиісті спецификацияда көрсетілгендей бекітілген жеткізушілерден және мүмкіндігінше тікелей өндірушіден сатып алу керек. Оларға қойылатын талаптар дәрілік заттарды өндіруші бекіткен және жеткізушімен келісілген бастапқы материалдарға арналған спецификацияда көрсетілуі тиіс. Шикізатты өндіруге және бақылауға қатысты барлық аспектілер, соның ішінде оларды өңдеу, таңбалау, орау, сондай-ақ шағымдарды беру және өнімді қабылдамау процедуралары жеткізуші мен өндіруші арасында келісілуі керек.
8.4.3 Әрбір жеткізілімде ыдыстың, қаптаманың және пломбалардың бүтіндігі, сондай-ақ жүкқұжаты мен жеткізушінің таңбасындағы деректердің сәйкестігі тексерілуі керек.
8.4.4 Егер бастапқы материалдардың бір жөнелтілімі бірнеше партиялардан тұратын болса, онда әрбір партия сынамаларды алу, сынау және рұқсат беру үшін тәуелсіз деп қарастырылуы керек.
8.4.5 Қоймаға орналастырылған бастапқы материалдар тиісті түрде таңбалануы керек. Таңбалау кем дегенде келесі ақпаратты қамтуы керек:
Түпнұсқа өнімнің белгіленуі және қажет болған жағдайда ішкі код;
Қабылдау кезінде берілген сериялық нөмір;
Мүмкін болса, мазмұнның күйі (мысалы, карантинге жатқызылған, сынақтан өткен, тазартылған, қабылданбаған);
Қажет болса, жарамдылық мерзімі немесе қайта тексеру қажет болған күн.
Егер қоймалар толығымен компьютерлендірілген болса, онда бұл барлық ақпаратты затбелгіде көрсету қажет емес.
8.4.6 Бастапқы материалдардың әрбір қаптамасының мазмұнының сәйкестігін бақылау үшін нұсқаулар мен процедуралар әзірленіп, бекітілуі керек. Үлгілері алынған сусымалы дайын өнімнің қаптамалары тиісті түрде таңбалануы керек.
8.4.7 Дәрілік заттарды өндіру кезінде сапаны бақылау бөлімі бекіткен және жарамдылық мерзімі аяқталмаған бастапқы материалдарды ғана пайдалануға болады.
8.4.8 Шикізатты тек тағайындалған адамдар жазбаша нұсқауларға сәйкес, қажетті материалдардың таза және дұрыс таңбаланған ыдыстарға дәл өлшеніп, өлшенгеніне көз жеткізу үшін жіберуі керек.
8.4.9 Әрбір шығарылатын заттың, оның массасы мен көлемінің тәуелсіз тексеруі жүргізілуі керек. Сынақ нәтижелері құжатталған болуы керек.
8.4.10 Әрбір партия үшін берілген материалдар бірге сақталуы және анық таңбалануы керек.
8.5 Процесс кезеңдері: аралық және сусымалы дайын өнімдер
8.5.1 Кез келген технологиялық операцияны бастамас бұрын, өндіріс аймағы мен жабдықтың таза болуын және шикізат қалдықтарының, өнімдердің, өнім қалдықтарының немесе процеске қатысы жоқ құжаттамалардың болмауын қамтамасыз ету үшін шаралар қабылдау қажет.
8.5.2 Аралық және сусымалы дайын өнімдер тиісті жағдайларда сақталуы керек.
8.5.3 Маңызды процестер осы стандарттың 8.3 «Валидация (біліктілік)» тармақшасына сәйкес валидациялануы тиіс.
8.5.4 Барлық қажетті ішкі бақылау және бақылау операцияларының орындалуы құжатталған болуы керек. қоршаған ортаныңөндірісте.
8.5.5 Күтілетін кірістіліктен кез келген елеулі ауытқу тіркеліп, зерттелуі керек.
Қаптама материалдары
8.6.1 Шикізат сияқты таза және таңбаланған орама материалын сатып алуға, сақтауға және бақылауға бірдей назар аудару керек.
8.6.2 Белгіленген материалдардың сапасына ерекше назар аудару керек:
Олар рұқсат етілмеген адамдардың қол жеткізуін болдырмайтын қауіпсіз ортада сақталуы керек;
Кесілген жапсырмалар мен басқа да бір-біріне ұқсамайтын материалдар араласып кетпес үшін жабық контейнерлерде бөлек сақталуы және тасымалдануы керек;
8.6.3 Қаптама материалдарын пайдалануға рұқсатты тек бекітілген жазбаша нұсқауларға сәйкес арнайы тағайындалған адамдар беруі керек.
8.6.4 Таңбаланған немесе бастапқы орау материалының әрбір жөнелтіліміне немесе партиясына бірегей нөмір немесе ерекше белгі берілуі тиіс.
8.6.5 Жарамдылық мерзімі өтіп кеткен немесе пайдалануға жарамсыз таңбаланған немесе бастапқы орауыш материалдары хаттамамен жойылуы керек.
Буып-түю операциялары
8.7.1 Буып-түю операцияларының дизайны айқас ластану, араластыру немесе алмастыру қаупін барынша азайтуы керек. Егер орау орындарының физикалық бөлінуі болмаса, әр түрлі өнім түрлерін жақын жерде орау мүмкін емес.
8.7.2 Буып-түю операцияларын бастамас бұрын, жұмыс алаңының, орау желілерінің, таңбалау машиналарының және басқа жабдықтың таза болуын және ағымдағы процесте пайдаланылмаса, алдыңғы жұмысқа қатысты материалдардың, өнімдердің немесе құжаттаманың жоқтығына көз жеткізіңіз. Өнімді орау желісін дайындау (тазалау) нұсқаулыққа сәйкес жүргізілуі керек.
8.7.3 Буып-түюге жататын өнімнің атауы мен сериясының нөмірі әрбір жолда немесе қондырғыда көрсетілуі керек.
8.7.4 Өнімдер мен орау материалдары орау бөліміне түскен кезде олардың саны, түпнұсқалығы және орау нұсқауларына сәйкестігі тексерілуі керек.
8.7.5 Құюға арналған бастапқы қаптама жұмысты бастамас бұрын таза болуы керек. Шыны және металл бөлшектерінің болуына жол бермеуге ерекше назар аудару керек.
8.7.6 Таңбалауды өнімдерді толтырғаннан кейін және тығыздағаннан кейін мүмкіндігінше тезірек жүргізу керек. Егер бұл қандай да бір себептермен мүмкін болмаса, өнімнің шатасуы немесе қате таңбалануын болдырмау үшін қажетті шараларды қабылдау қажет.
8.7.7 Кез келген таңбалаудың дұрыстығы (мысалы, кодтау немесе жарамдылық мерзімі), орау процесінде және одан тыс жерде мұқият бақылануы және құжатталуы керек. Қолмен таңбалауға ерекше назар аудару керек, ол белгілі бір уақыт аралығында бақылануы керек.
8.7.8 Кесілген жапсырмаларды және орау сызығынан тыс таңбалауды пайдалану кезінде ерекше сақтық шараларын сақтау керек. Араласудың алдын алу үшін кесілген жапсырмалардың орнына орамдағы жапсырмаларды пайдалану ұсынылады.
8.7.9 Электрондық код оқу құралдарының, жапсырма есептегіштердің және ұқсас құрылғылардың дұрыс жұмыс істеуін бақылау керек.
8.7.10 Баспа немесе бедерлеу арқылы қолданылатын орау материалдары туралы ақпарат түсінікті, жарыққа (өшіруге) және өшірілуге төзімді болуы керек.
8.7.11 Өнімдерді орау кезінде он-лайн инспекциясын жүргізген кезде, кем дегенде мыналарды тексеру қажет:
Пакеттің жалпы көрінісі;
Қаптаманың толықтығы;
Тиісті өнімдер мен орау материалдарын пайдалану;
Басылған жазулардың дұрыстығы;
Желідегі басқару құрылғыларының дұрыс жұмыс істеуі.
Қаптама желісінен алынған өнім үлгілерін қайтаруға болмайды.
8.7.12 Буып-түю кезінде күтпеген жағдайлар туындаған өнімдер арнайы тексеруден, тергеуден кейін және Уәкілетті тұлғаның рұқсатымен ғана өндіріске қайта қайтарылуы мүмкін. Мұндай жағдайларда егжей-тегжейлі жазбалар жасалып, сақталуы керек.
8.7.13 Егер сусымалы дайын өнімнің саны, таңбалау орауыш материалдары мен алынған дайын өнім бірліктерінің саны арасында елеулі және әдеттен тыс сәйкессіздік болса, тексеру жүргізіліп, осы фактіге қанағаттанарлық түсіндірме беру қажет. осы өнім үшін маркетингтік рұқсат алуға тапсырыс беріңіз.
8.7.14 Буып-түю операциялары аяқталғаннан кейін кез келген қалған партиялық нөмірленген орауыш материалдар жойылуы және жойылу тиісті жазбамен құжатталуы керек. Реттік нөмірі жоқ орау материалдарын қоймаға қайтару бекітілген нұсқаулыққа сәйкес жүзеге асырылады.
Дайын өнім
8.8.1 Дайын өнімдер өндіруші белгілеген шарттарда сатуға рұқсат берілгенге дейін карантинде сақталуы тиіс.
8.8.2 Дайын өнімнің сапасын бағалау тәртібі және тіркеу куәлігін алу үшін қажетті құжаттамаға қойылатын талаптар осы Сапаны бақылау стандартының 9-бөлімінде келтірілген.
8.8.3 Тіркеу куәлігі берілгеннен кейін дайын өнім өндіруші белгілеген шарттарда дайын өнім қоймасында сақталады.