Kyselina glutámová je neurotransmiter. Neurotransmitery a najdôležitejšie spôsoby liečby duševných chorôb. Gamk: hlavný inhibičný neurotransmiter
· Prirodzený obsah glutamanu · Aplikácie · Poznámky · Súvisiace články · Oficiálna stránka ·
Glutamát je najrozšírenejší excitačný neurotransmiter v nervový systém stavovcov. V chemických synapsiách sa glutamát ukladá v presynaptických vezikulách (vezikuly). Nervový impulz spúšťa uvoľňovanie glutamátu z presynaptického neurónu. Na postsynaptickom neuróne sa glutamát viaže a aktivuje postsynaptické receptory, ako sú NMDA receptory. Vďaka zapojeniu glutamátu do synaptickej plasticity sa glutamát podieľa na takých kognitívnych funkciách, ako je učenie a pamäť. Jedna forma synaptickej plasticity, nazývaná dlhodobá potenciácia, sa vyskytuje pri glutamátergických synapsiách v hipokampe, neokortexe a iných častiach mozgu. Glutamát sa podieľa nielen na klasickom vedení nervový impulz z neurónu na neurón, ale aj hromadnou neurotransmisou, kedy sa signál prenáša do susedných synapsií sumáciou glutamátu uvoľneného v susedných synapsiách (tzv. extrasynaptická alebo hromadná neurotransmisia))) Okrem toho hrá glutamát rozhodujúcu úlohu pri tzv. reguláciu rastových čapíkov a synaptogenézu počas vývoja mozgu, ako to opísal Mark Matson.
Glutamátové transportéry boli nájdené na neurónových a neurogliálnych membránach. Rýchlo odstraňujú glutamát z extracelulárneho priestoru. Pri poškodení alebo chorobe mozgu môžu pôsobiť opačným smerom, čím sa glutamát môže hromadiť mimo bunky. Tento proces vedie k vstupu veľkého množstva vápenatých iónov do bunky cez kanály NMDA receptorov, čo následne spôsobuje poškodenie až smrť bunky – čo sa nazýva excitotoxicita. Mechanizmy bunkovej smrti tiež zahŕňajú:
- poškodenie mitochondrií nadmerne vysokým vnútrobunkovým vápnikom,
- Glu/Ca2±sprostredkovaná podpora transkripčných faktorov proapoptotických génov alebo znížená transkripcia antiapoptotických génov.
Excitotoxicita v dôsledku zvýšeného uvoľňovania glutamátu alebo jeho zníženého spätného vychytávania sa vyskytuje v ischemickej kaskáde a je spojená s mozgovou príhodou a pozoruje sa aj pri ochoreniach ako amyotrofická laterálna skleróza, latyrizmus, autizmus, niektoré formy mentálnej retardácie, Alzheimerova choroba. Naopak pri klasickej fenylketonúrii sa pozoruje pokles uvoľňovania glutamátu, čo vedie k poruche expresie glutamátových receptorov.Kyselina glutámová sa podieľa na realizácii epileptického záchvatu. Mikroinjekcia kyseliny glutámovej do neurónov spôsobuje spontánnu depolarizáciu a tento vzor pripomína paroxyzmálnu depolarizáciu počas záchvatov. Tieto zmeny v epileptickom ohnisku vedú k otvoreniu napäťovo závislých vápnikových kanálov, čo opäť stimuluje uvoľňovanie glutamátu a ďalšiu depolarizáciu. Úloha glutamátového systému má dnes veľké miesto v patogenéze takých duševných porúch, ako je schizofrénia a depresia. Jednou z najrýchlejšie študovaných teórií etiopatogenézy schizofrénie v súčasnosti je hypotéza hypofunkcie NMDA receptora: pri použití antagonistov NMDA receptorov, ako je fencyklin, sa u zdravých dobrovoľníkov v experimente objavia symptómy schizofrénie. V tejto súvislosti sa predpokladá, že hypofunkcia NMDA receptorov je jednou z príčin porúch dopaminergného prenosu u pacientov so schizofréniou. Boli tiež získané údaje, že poškodenie NMDA receptorov imunitným zápalovým mechanizmom („anti-NMDA receptorová encefalitída“) má klinický obraz akútnej schizofrénie. V etiopatogenéze endogénnej depresie sa predpokladá, že zohráva úlohu nadmerná glutamátergická neurotransmisia, čo dokazuje účinnosť disociatívneho anestetika ketamínu s jednorazovým použitím pri depresii rezistentnej na liečbu v experimente.
Glutamátové receptory
Existujú ionotropné a metabotropné (mGLuR 1-8) glutamátové receptory.
Ionotropné receptory sú NMDA receptory, AMPA receptory a kainátové receptory.
Endogénne ligandy glutamátového receptora sú kyselina glutámová a kyselina asparágová. Glycín je tiež potrebný na aktiváciu NMDA receptorov. Blokátory NMDA receptorov sú PCP, ketamín a iné. AMPA receptory sú tiež blokované CNQX, NBQX. Kyselina kainová je aktivátorom kainátových receptorov.
"Obeh" glutamátu
V prítomnosti glukózy v mitochondriách nervových zakončení dochádza pomocou enzýmu glutaminázy k deaminácii glutamínu na glutamát. Počas aeróbnej oxidácie glukózy sa tiež glutamát reverzibilne syntetizuje z alfa-ketoglutarátu (vytvoreného v Krebsovom cykle) pomocou aminotransferázy.
Glutamát syntetizovaný neurónom sa pumpuje do vezikúl. Tento proces je transport spojený s protónmi. Ióny H + sú pumpované do vezikuly pomocou protón-dependentnej ATPázy. Keď protóny vychádzajú pozdĺž gradientu, molekuly glutamátu vstupujú do vezikuly pomocou vezikulárneho glutamátového transportéra (VGLUT).
Glutamát sa vylučuje do synaptickej štrbiny, odkiaľ sa dostáva do astrocytov, kde sa transaminuje na glutamín. Glutamín sa uvoľňuje späť do synaptickej štrbiny a až potom je vychytávaný neurónom. Podľa niektorých správ sa glutamát nevracia priamo spätným vychytávaním.
Úloha glutamátu v acidobázickej rovnováhe
Deaminácia glutamínu na glutamát pomocou enzýmu glutaminázy vedie k tvorbe amoniaku, ktorý sa zase viaže na voľný protón a vylučuje sa do lumenu obličkového tubulu, čo vedie k zníženiu acidózy. K premene glutamátu na -ketoglutarát dochádza aj pri tvorbe amoniaku. Ďalej sa ketoglutarát rozkladá na vodu a oxid uhličitý. Tie sa pomocou karboanhydrázy cez kyselinu uhličitú premenia na voľný protón a hydrouhličitan. Protón sa vylučuje do lumenu obličkového tubulu kotransportom s iónom sodíka a hydrogénuhličitan vstupuje do plazmy.
Glutamátergný systém
V CNS je asi 106 glutamátergických neurónov. Telá neurónov ležia v mozgovej kôre, bulbus olfactorius, hipokampus, substantia nigra, cerebellum. V mieche - v primárnej aferentácii dorzálnych koreňov.
V GABAergných neurónoch je glutamát prekurzorom inhibičného neurotransmitera, kyseliny gama-aminomaslovej, produkovanej enzýmom glutamátdekarboxylázou.
V srdci mozgu je interakcia nervových buniek a tie spolu hovoria pomocou látok nazývaných mediátory. Existuje pomerne veľa mediátorov, napríklad acetylcholín, norepinefrín. Jeden z najdôležitejších mediátorov a možno aj najdôležitejší sa nazýva kyselina glutámová, čiže glutamát. Ak sa pozriete na štruktúru nášho mozgu a aké látky používajú rôzne nervové bunky, potom glutamát vylučuje asi 40 % neurónov, to znamená, že ide o veľmi veľkú časť nervových buniek. S uvoľňovaním glutamanu v našom mozgu, mozgu a mieche sa prenášajú hlavné informačné toky: všetko, čo súvisí so zmyslom (zrak a sluch), pamäť, pohyb, až kým sa nedostane do svalov - to všetko sa prenáša uvoľňovaním glutámovej kyselina. Preto si tento mediátor, samozrejme, zaslúži osobitnú pozornosť a veľmi aktívne sa študuje.
Z hľadiska svojej chemickej štruktúry je glutamát pomerne jednoduchá molekula. Je to aminokyselina a potravinová aminokyselina, to znamená, že podobné molekuly získavame jednoducho ako súčasť bielkovín, ktoré jeme. Ale musím povedať, že potravinový glutaman (z mlieka, chleba alebo mäsa) prakticky neprechádza do mozgu. Nervové bunky syntetizujú túto látku priamo na zakončeniach axónov, priamo v tých štruktúrach, ktoré sú súčasťou synapsií, „na mieste“ a ďalej izolované za účelom prenosu informácií.
Výroba glutamanu je veľmi jednoduchá. Východiskovým materiálom je kyselina α-ketoglutarová. Ide o veľmi bežnú molekulu, získava sa pri oxidácii glukózy, vo všetkých bunkách, vo všetkých mitochondriách je jej veľa. A ďalej na túto kyselinu α-ketoglutarovú stačí transplantovať akúkoľvek aminoskupinu prevzatú z akejkoľvek aminokyseliny a teraz dostaneme glutamát, kyselinu glutámovú. Kyselina glutámová môže byť tiež syntetizovaná z glutamínu. Toto je tiež potravinová aminokyselina, glutamát a glutamín sa veľmi ľahko premieňajú na seba. Napríklad, keď glutamát dokončí svoju funkciu v synapsii a prenesie signál, ďalej sa ničí za vzniku glutamínu.
Glutamát je excitačný mediátor, to znamená, že je vždy v našom nervovom systéme, v synapsiách, spôsobuje nervovú excitáciu a ďalší prenos signálu. V tomto sa glutamát líši napríklad od acetylcholínu alebo norepinefrínu, pretože acetylcholín a norepinefrín môžu spôsobiť excitáciu v niektorých synapsiách, inhibíciu v iných, majú zložitejší algoritmus práce. A glutamát v tomto zmysle je jednoduchší a zrozumiteľnejší, aj keď takú jednoduchosť vôbec nenájdete, keďže pre glutamát existuje asi 10 typov receptorov, teda citlivých proteínov, na ktoré táto molekula pôsobí a rôzne receptory vedú pri rôznych rýchlosti a s rôznymi parametrami glutamátového signálu.
Evolúcia rastlín našla množstvo toxínov, ktoré pôsobia na glutamátové receptory. Čo je pre rastliny vo všeobecnosti, je celkom jasné. Rastliny sú spravidla proti tomu, aby ich zvieratá jedli, takže evolúcia prichádza s nejakými ochrannými toxickými konštruktmi, ktoré zastavujú bylinožravce. Najsilnejšie rastlinné toxíny sú spojené s riasami a práve toxíny z rias môžu veľmi silne ovplyvniť glutamátové receptory v mozgu a spôsobiť celkové vzrušenie a kŕče. Ukazuje sa, že superaktivácia glutamátových synapsií je veľmi silná excitácia mozgu, kŕčovitý stav. Asi najznámejšia molekula z tejto série sa volá kyselina domoová, syntetizujú ju jednobunkové riasy – také riasy existujú, žijú v západnej časti Tichý oceán, na pobreží napríklad Kanada, Kalifornia, Mexiko. Otrava týchto rias toxínmi je veľmi, veľmi nebezpečná. A k tejto otrave niekedy dochádza, pretože zooplanktón sa živí jednobunkovými riasami, všetkými druhmi malých kôrovcov alebo napríklad lastúrnikmi, keď filtrujú vodu, vťahujú tieto bunky rias a potom v niektorých mušľách alebo ustriciach je príliš vysoká koncentrácia kyseliny domoovej a môže sa vážne otráviť.
Boli zaznamenané dokonca aj ľudské úmrtia. Je pravda, že sú single, no napriek tomu to hovorí o sile tohto toxínu. A veľmi charakteristická je otrava kyselinou domoovou v prípade vtákov. Ak niektoré morské vtáky, ktoré opäť jedia malé rybky živiace sa zooplanktónom, dostanú priveľa kyseliny domoovej, nastáva charakteristická psychóza: niektoré čajky alebo pelikány sa prestanú báť veľkých predmetov a naopak na ne útočia, teda stávajú sa agresívny . Niekedy na začiatku 60. rokov došlo k celej epidémii takýchto otráv a správy v novinách o tejto epidémii „vtáčej psychózy“ inšpirovali Daphne Du Maurier k napísaniu románu Vtáky a potom Alfred Hitchcock režíroval klasický triler Vtáky, kde uvidíte tisícky veľmi agresívnych čajok, ktoré potrápia hlavné postavy filmu. Prirodzene, v skutočnosti k takýmto globálnym otravám nedošlo, no napriek tomu má kyselina domoová veľmi charakteristické účinky a ona a jej podobné molekuly sú, samozrejme, pre mozog veľmi nebezpečné.
Kyselinu glutámovú a podobný glutamát jeme vo veľkom množstve jednoducho s bielkovinami v strave. Naše bielkoviny, ktoré sa nachádzajú v rôznych potravinách, obsahujú 20 aminokyselín. Glutamát a kyselina glutámová sú súčasťou tejto dvadsiatky. Okrem toho sú to najbežnejšie aminokyseliny, ak sa pozriete na štruktúru bielkovín úplne. Výsledkom je, že za deň s pravidelným jedlom zjeme od 5 do 10 gramov glutamanu a glutamínu. Kedysi bolo veľmi ťažké uveriť, že glutamát funguje ako mediátor v mozgu, pretože sa ukázalo, že látka, ktorú doslova konzumujeme v konských dávkach, plní v mozgu také jemné funkcie. Bola tam taká logická nezrovnalosť. Potom si však uvedomili, že v skutočnosti potravinový glutaman prakticky neprechádza do mozgu. Za to musíme poďakovať štruktúre nazývanej hematoencefalická bariéra, to znamená, že špeciálne bunky obklopujú všetky kapiláry, všetky malé cievy, ktoré prenikajú do mozgu a celkom pevne kontrolujú pohyb. chemických látok z krvi do nervového systému. Ak nie, tak nejaký zjedený rezeň či žemľa by v nás vyvolali kŕče a to, samozrejme, nikto nepotrebuje. Preto potravinový glutamát takmer neprechádza do mozgu a skutočne sa syntetizuje, aby vykonával funkcie mediátora priamo v synapsiách. Ak však zjete naraz veľa glutamanu, tak malé množstvo predsa len prenikne do mozgu. Potom môže nastať mierne vzrušenie, ktorého účinok je porovnateľný so šálkou silnej kávy. Tento efekt vysokých dávok glutamanu v potrave je známy a vyskytuje sa pomerne často, ak človek užíva glutaman vo veľkom množstve ako doplnok stravy.
Ide o to, že náš chuťový systém veľmi citlivý na glutamát. Opäť je to spôsobené tým, že v bielkovinách je veľa glutamátu. Ukazuje sa, že vývoj chuťového systému, naladenie na chemickú analýzu potravín, určil glutamát ako znak bielkovinového jedla, to znamená, že musíme jesť bielkoviny, pretože bielkoviny sú hlavným stavebným materiálom nášho tela. Podobne aj náš chuťový systém sa naučil veľmi dobre detegovať glukózu, pretože glukóza a podobné monosacharidy sú hlavným zdrojom energie a bielkoviny sú hlavným stavebným materiálom. Preto sa chuťový systém naladil na to, aby identifikoval glutamát ako signál bielkovinového jedla a spolu s kyslými, sladkými, slanými, horkými chuťami máme v jazyku citlivé bunky, ktoré reagujú špecificky na glutamát. A glutaman je tiež známa takzvaná chuťová prísada. Nazývať ho zvýrazňovačom chuti nie je úplne správne, pretože glutamát má svoju chuť, ktorá je rovnako dôležitá ako horká, kyslá, sladká a slaná.
Musím povedať, že existencia glutamátovej chuti je známa už viac ako sto rokov. Japonskí fyziológovia objavili tento efekt vďaka tomu, že glutamát (vo forme sójovej omáčky alebo omáčky z morských rias) sa v japonskej a čínskej kuchyni používa už veľmi dlho. V súlade s tým vyvstala otázka: prečo sú také chutné a prečo sa táto chuť tak líši od štandardných chutí? Ďalej boli objavené glutamátové receptory a potom sa už glutamát používal takmer v čistej forme (E620, E621 - glutaman sodný), aby sa pridával do rôznych potravín. Niekedy sa stáva, že glutamát je obviňovaný zo všetkých smrteľných hriechov, nazývajú to „ďalšia biela smrť“: soľ, cukor a glutamát sú biela smrť. To je, samozrejme, značne prehnané, pretože ešte raz opakujem: počas dňa zjeme od 5 do 10 gramov glutamanu a kyseliny glutámovej s bežným jedlom. Ak si teda do jedla pridáte trochu glutamanu, aby ste vyzdvihli tú mäsitú chuť, nie je na tom nič zlé, aj keď nadbytok, samozrejme, nie je zdravý.
V skutočnosti existuje veľa receptorov pre glutamát (asi 10 typov receptorov), ktoré vedú glutamátové signály rôznou rýchlosťou. A tieto receptory sa študujú predovšetkým z hľadiska analýzy pamäťových mechanizmov. Keď v našom mozgu a kôre hemisféry vzniká pamäť, to naozaj znamená, že synapsie začnú aktívnejšie fungovať medzi nervovými bunkami, ktoré prenášajú nejaký informačný tok. Hlavným mechanizmom na aktiváciu práce synapsií je zvýšenie účinnosti glutamátových receptorov. Pri analýze rôznych glutamátových receptorov vidíme, že rôzne receptory menia svoju účinnosť rôznymi spôsobmi. Asi najviac skúmané sú takzvané NMDA receptory. Toto je skratka, znamená N-metyl-D-aspartát. Tento receptor reaguje na glutamát a NMDA. Receptor NMDA sa vyznačuje tým, že je schopný ho blokovať horčíkový ión a ak je na receptor naviazaný horčíkový ión, potom tento receptor nefunguje. To znamená, že dostanete synapsiu, v ktorej sú receptory, ale tieto receptory sú vypnuté. Ak cez neurónovú sieť prešiel nejaký silný významný signál, potom sa magnéziové ióny (nazývajú sa aj magnéziové zátky) odtrhnú od NMDA receptora a synapsia doslova okamžite začne pracovať mnohonásobne efektívnejšie. Na úrovni prenosu informácií to znamená len zaznamenanie určitej stopy pamäte. V našom mozgu existuje štruktúra nazývaná hipokampus, takýchto synapsií s NMDA receptormi je len veľa a hipokampus je možno najviac študovanou štruktúrou z hľadiska pamäťových mechanizmov.
Ale NMDA receptory, objavenie sa a odchod magnéziovej zátky je mechanizmus krátkodobej pamäte, pretože zástrčka môže odísť a potom sa vrátiť - vtedy na niečo zabudneme. Ak sa tvorí dlhodobá pamäť, tam je všetko oveľa komplikovanejšie a fungujú tam iné typy glutamátových receptorov, ktoré sú schopné preniesť signál z membrány nervovej bunky priamo do jadrovej DNA. A po prijatí tohto signálu jadrová DNA spustí syntézu ďalších receptorov v kyseline glutámovej a tieto receptory sú vložené do synaptických membrán a synapsia začne pracovať efektívnejšie. To sa však nestane okamžite, ako v prípade vybitia horčíkovej zástrčky, ale vyžaduje si to niekoľko hodín, vyžaduje si opakovanie. Ale ak sa toto stalo, tak vážne a nadlho a to je základ našej dlhodobej pamäti.
Farmakológovia samozrejme využívajú glutamátové receptory na ovplyvňovanie rôznych funkcií mozgu, hlavne na zníženie excitácie nervového systému. Veľmi známy je liek s názvom ketamín. Pôsobí ako anestetikum. Ketamín je navyše známy ako molekula s narkotickým účinkom, pretože pri výstupe z narkózy sa často vyskytujú halucinácie, preto sa o ketamíne hovorí aj ako o halucinogénnej, psychedelickej droge, je veľmi ťažké sa s ním vyrovnať. Ale vo farmakológii sa to často stáva: látka, ktorá je najpotrebnejšia liek, má niektoré vedľajšie účinky, ktoré v konečnom dôsledku vedú k tomu, že distribúcia a používanie tejto látky musí byť veľmi prísne kontrolované.
Ďalšou veľmi známou molekulou v súvislosti s glutamátom je memantín, látka, ktorá dokáže celkom jemne blokovať NMDA receptory a v dôsledku toho znižovať aktivitu mozgovej kôry v rôznych oblastiach. Memantín sa používa v pomerne širokom spektre situácií. Jeho lekárenský názov je Akatinol. Používa sa na zníženie celkovej úrovne vzrušenia, aby sa znížila pravdepodobnosť epileptických záchvatov a azda najaktívnejšie použitie memantínu je v situáciách neurodegenerácie a Alzheimerovej choroby.
Historicky prvými otvorenými mediátormi boli acetylcholín a monoamíny. Je to spôsobené ich širokou distribúciou v periférnom nervovom systéme (aspoň v prípade acetylcholínu a norepinefrínu). Zďaleka však nie sú najbežnejšími mediátormi CNS. Viac ako 80 % nervových buniek mozgu a miechy využíva aminokyselinové látky ako mediátory, ktoré prenášajú väčšinu senzorických, motorických a iných signálov cez neurónové siete (excitačné aminokyseliny) a tiež riadia takýto prenos (inhibičné aminokyseliny ). Dá sa povedať, že aminokyseliny realizujú rýchly prenos informácií a monoamíny a acetylcholín vytvárajú všeobecné motivačné a emocionálne pozadie a „strážia“ úroveň bdelosti. Existujú ešte „pomalšie“ úrovne regulácie mozgovej činnosti – ide o systémy neuropeptidov a hormonálne vplyvy na centrálny nervový systém.
V porovnaní s tvorbou monoamínov je syntéza aminokyselinových mediátorov pre bunku jednoduchší proces a všetky majú jednoduché chemické zloženie. Mediátory tejto skupiny sa vyznačujú väčšou špecifickosťou synaptických účinkov – buď má konkrétna zlúčenina excitačné vlastnosti (kyseliny glutámová a asparágová) alebo inhibičné vlastnosti (glycín a kyselina gama-aminomaslová – GABA). Aminokyselinové agonisty a antagonisty spôsobujú predvídateľnejšie účinky v CNS ako acetylcholín a monoamínové agonisty a antagonisty. Na druhej strane vplyv na glutamátové alebo GABAergické systémy často vedie k príliš „širokým“ zmenám v celom CNS, čo si vytvára vlastné ťažkosti.
Hlavným excitačným neurotransmiterom CNS je kyselina glutámová. V nervovom tkanive sú vzájomné premeny kyseliny glutámovej a jej prekurzora glutamínu nasledovné:
Ako neesenciálna aminokyselina v potrave je široko distribuovaná v širokej škále bielkovín a jej denný príjem je najmenej 5-10 g. Kyselina glutámová však bežne preniká cez hematoencefalickú bariéru veľmi zle, čo chráni nás pred vážnymi poruchami mozgovej činnosti. Takmer všetok glutamát potrebný pre centrálny nervový systém sa syntetizuje priamo v nervovom tkanive, no situáciu komplikuje skutočnosť, že táto látka je aj medzistupňom v procesoch vnútrobunkového metabolizmu aminokyselín. Preto nervové bunky obsahujú veľa kyseliny glutámovej, z ktorej len malá časť plní funkcie mediátora. Syntéza takéhoto glutamátu prebieha v presynaptických zakončeniach; hlavným zdrojom prekurzorov je aminokyselina glutamín.
Po uvoľnení do synaptickej štrbiny pôsobí neurotransmiter na zodpovedajúce receptory. Rozmanitosť receptorov pre kyselinu glutámovú je extrémne veľká. V súčasnosti existujú tri typy ionotropných a až osem typov metabotropných receptorov. Posledne menované sú menej bežné a menej skúmané. Ich účinky je možné realizovať tak potlačením aktivity acenylátcyklázy, ako aj zvýšením tvorby diacylglycerolu a inozitoltrifosfátu.
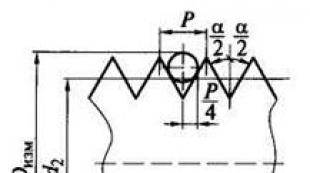
Ionotropné receptory kyseliny glutámovej sú pomenované podľa špecifických agonistov: NMDA receptory (agonista N-metyl-D-aspartátu), AMPA receptory (agonista kyseliny alfa-aminohydroxymetylizoxanolpropiónovej) a kainátové receptory (agonista kyseliny kainovej). Dnes sa najviac pozornosti venuje prvému z nich. NMDA receptory sú široko distribuované v CNS od miechy po mozgovú kôru, väčšina z nich v hipokampe. Receptor (obr. 3.36) pozostáva zo štyroch podjednotkových proteínov s dvoma aktívnymi centrami pre väzbu kyseliny glutámovej 1 a dve aktívne miesta pre väzbu glycínu 2. Tieto proteíny sa tvoria iónový kanál, ktorý môže byť blokovaný iónom horčíka 3 a blokátory kanálov 4.
O osude sprostredkovateľa, ktorý splnil svoju úlohu pri vysielaní signálu, platí príslovie: Maur vykonal svoju prácu - Maur musí odísť. Ak neurotransmiter zostane na postsynaptickej membráne, bude interferovať s prenosom nových signálov. Existuje niekoľko mechanizmov na elimináciu použitých molekúl mediátorov: difúzia, enzymatické štiepenie a opätovné použitie.
Difúziou vždy nejaká časť molekúl mediátora opustí synaptickú štrbinu a v niektorých synapsiách je tento mechanizmus hlavný. Enzymatické štiepenie je hlavným spôsobom odstránenia acetylcholínu v neuromuskulárnom spojení: toto sa vykonáva cholínesterázou pripojenou na okrajoch záhybov koncových platničiek. Vzniknutý acetát a cholín sa špeciálnym zachytávacím mechanizmom vracajú do presynaptického zakončenia.
Sú známe dva enzýmy, ktoré štiepia biogénne amíny: monoaminooxidáza (MAO) a katechol-o-metyltransferáza (COMT). Štiepenie neurotransmiterov proteínovej povahy môže nastať pôsobením extracelulárnych peptidáz, aj keď takéto mediátory zvyčajne miznú zo synapsie pomalšie ako tie s nízkou molekulovou hmotnosťou a často opúšťajú synapsiu difúziou.
Opätovné využitie mediátorov je založené na mechanizmoch vychytávania ich molekúl samotnými neurónmi a gliovými bunkami, ktoré sú špecifické pre rôzne neurotransmitery, pričom do tohto procesu sú zapojené špeciálne transportné molekuly. Špecifické mechanizmy opätovného použitia sú známe pre noradrenalín, dopamín, serotonín, glutamát, GABA, glycín a cholín (ale nie acetylcholín). Niektoré psychofarmakologické látky blokujú opätovné použitie mediátora (napríklad biogénne amíny alebo GABA) a tým predlžujú ich pôsobenie.
Samostatné systémy mediátorov
Chemická štruktúra najdôležitejších neurotransmiterov je znázornená na obrázku 6.1.
Acetylcholín
Vzniká pomocou enzýmu acetyltransferázy z acetylkoenzýmu A a cholínu, ktoré neuróny nesyntetizujú, ale zachytávajú sa zo synaptickej štrbiny alebo z krvi. Je jediným mediátorom všetkých motorických neurónov miechy a autonómnych ganglií, v týchto synapsiách je jeho pôsobenie sprostredkované H-cholinergnými receptormi a riadenie kanálov je priame, ionotropné. Acetylcholín uvoľňujú aj postgangliové zakončenia parasympatického oddelenia autonómneho nervového systému: tu sa viaže na M-cholinergné receptory, t.j. pôsobí metabotropne. V mozgu ho ako neurotransmiter využívajú početné pyramídové kortikálne bunky, ktoré pôsobia na bazálne gangliá, napríklad približne 40 % z celkového množstva acetylcholínu vytvoreného v mozgu sa uvoľňuje v nucleus caudatus. Pomocou acetylcholínu vzrušujú mozgové mandle bunky mozgovej kôry.
M-cholinergné receptory sa nachádzajú vo všetkých častiach mozgu (kôra, štruktúry limbického systému, talamus, trup), početné sú najmä v retikulárnej formácii. Pomocou cholinergných vlákien je stredný mozog spojený s ostatnými neurónmi horného mozgového kmeňa, optickými tuberkulami a kôrou. Možno je na prechod zo spánku do bdenia potrebná aktivácia týchto konkrétnych dráh, v každom prípade charakteristické zmeny na elektroencefalograme po užití inhibítorov cholínesterázy túto verziu potvrdzujú.
Pri progresívnej demencii, známej ako Alzheimerova choroba, sa zistilo zníženie aktivity acetyltransferázy v neurónoch Meinertových jadier umiestnených v bazálnom prednom mozgu, priamo pod striatum. V tomto ohľade je narušený cholinergný prenos, ktorý sa považuje za dôležitý článok vo vývoji ochorenia.
Antagonisty acetylcholínu, ako sa ukázalo pri pokusoch na zvieratách, bránia tvorbe podmienených reflexov a znižujú účinnosť duševnej činnosti. Inhibítory cholínesterázy vedú k hromadeniu acetylcholínu, čo je sprevádzané zlepšením krátkodobej pamäte, zrýchlenou tvorbou podmienených reflexov a lepším zachovaním pamäťových stôp.
Názor, že cholinergné systémy mozgu sú mimoriadne potrebné na realizáciu jeho intelektuálnej činnosti a na poskytovanie informačnej zložky emócií, je pomerne populárny.
Biogénne amíny
Ako už bolo spomenuté, biogénne amíny sa syntetizujú z tyrozínu a každý stupeň syntézy je riadený špeciálnym enzýmom. Ak má bunka kompletnú sadu takýchto enzýmov, potom bude vylučovať adrenalín a v menšom množstve aj jeho prekurzory – norepinefrín a dopamín. Napríklad tzv. chromafinné bunky drene nadobličiek vylučujú adrenalín (80 % sekrécia), norepinefrín (18 %) a dopamín (2 %). Ak neexistuje žiadny enzým na tvorbu adrenalínu, potom bunka môže uvoľňovať len norepinefrín a dopamín, a ak nie je potrebný žiadny enzým na syntézu norepinefrínu, potom dopamín bude jediným uvoľneným mediátorom, ktorého prekurzorom je L- DOPA sa nepoužíva ako sprostredkovateľ.
Dopamín, norepinefrín a epinefrín sa často označujú ako katecholamíny. Ovládajú metabotropné adrenoreceptory, ktoré sú prítomné nielen v nervových, ale aj v iných tkanivách tela. Adrenoreceptory sa delia na alfa-1 a alfa-2, beta-1 a beta-2: fyziologické účinky spôsobené pripojením katecholamínov na rôzne receptory sa výrazne líšia. Pomer rôznych receptorov nie je rovnaký v rôznych efektorových bunkách. Spolu s adrenoreceptormi spoločnými pre všetky katecholamíny existujú špecifické receptory pre dopamín, ktoré sa nachádzajú v centrálnom nervovom systéme a v iných tkanivách, napríklad v hladkých svaloch krvných ciev a v srdcovom svale.
Adrenalín je hlavným hormónom drene nadobličiek, citlivé sú naň najmä beta receptory. Existujú informácie o využití adrenalínu niektorými mozgovými bunkami ako mediátora. Norepinefrín je vylučovaný postgangliovými neurónmi sympatického oddelenia autonómneho nervového systému a v centrálnom nervovom systéme jednotlivými neurónmi miechy, mozočka a mozgovej kôry. Najväčšou akumuláciou noradrenergných neurónov sú modré škvrny – jadrá mozgového kmeňa.
Predpokladá sa, že nástup REM spánku je spojený s aktivitou týchto noradrenergných neurónov, ale ich funkcia nie je obmedzená len na toto. Rostrálne k modrým škvrnám sa vyskytujú aj noradrenergné neuróny, ktorých nadmerná aktivita zohráva vedúcu úlohu pri vzniku tzv. panický syndróm, sprevádzaný pocitom neprekonateľnej hrôzy.
Dopamín je syntetizovaný neurónmi v strednom mozgu a diencefalickej oblasti, ktoré tvoria tri dopamínergné systémy mozgu. Toto je po prvé nigrostriatálny systém: predstavujú ho neuróny v substantia nigra stredného mozgu, ktorých axóny končia v jadrách caudate a putamen. Po druhé, ide o mezolimbický systém, tvorený neurónmi ventrálneho tegmenta mostíka, ich axóny inervujú septum, mandle, časť frontálneho kortexu, t.j. štruktúry limbického systému mozgu. A po tretie, mezokortikálny systém: jeho neuróny sú v strednom mozgu a ich axóny končia v prednom cingulate gyrus, hlbokých vrstvách frontálneho kortexu, entorhinálnej a piriformnej (hruškovitej) kôre. Najvyššia koncentrácia dopamínu sa nachádza vo frontálnom kortexe.
Dopamínergné štruktúry zohrávajú významnú úlohu pri formovaní motivácií a emócií, v mechanizmoch udržania pozornosti a výbere najvýznamnejších signálov vstupujúcich do centrálneho nervového systému z periférie. Degenerácia neurónov substantia nigra vedie k súboru pohybových porúch známych ako Parkinsonova choroba. Na liečbu tohto ochorenia sa používa prekurzor dopamínu L-DOPA, ktorý na rozdiel od samotného dopamínu dokáže prekonať hematoencefalickú bariéru. V niektorých prípadoch sa pokúšajú liečiť Parkinsonovu chorobu injekciou tkaniva drene nadobličiek plodu do mozgovej komory. Injikované bunky môžu vydržať až rok a stále produkujú značné množstvo dopamínu.
Pri schizofrénii je zistená zvýšená aktivita mezolimbického a mezokortikálneho systému, ktorú mnohí považujú za jeden z hlavných mechanizmov poškodenia mozgu. Naproti tomu s tzv. veľká depresia musí užívať lieky, ktoré zvyšujú koncentráciu katecholamínov v synapsiách centrálneho nervového systému. Antidepresíva pomáhajú mnohým pacientom, no, žiaľ, nedokážu potešiť zdravých ľudí, ktorí len prežívajú nešťastné obdobie v živote.
Serotonín
Tento nízkomolekulárny neurotransmiter sa tvorí z aminokyseliny tryptofán pomocou dvoch enzýmov zapojených do syntézy. Významné nahromadenie serotonergných neurónov sa nachádza v jadrách raphe, tenkom páse pozdĺž strednej čiary kaudálnej retikulárnej formácie. Funkcia týchto neurónov súvisí s reguláciou úrovne pozornosti a reguláciou cyklu spánok-bdenie. Serotonergné neuróny interagujú s cholinergnými štruktúrami tegmentum pons a noradrenergnými neurónmi v locus coeruleus. Jedným z blokátorov serotonergných receptorov je LSD, dôsledkom užívania tejto psychotropnej látky je nerušený prechod do vedomia takýchto senzorických signálov, ktoré sú normálne oneskorené.
histamín
Táto látka zo skupiny biogénnych amínov sa syntetizuje z aminokyseliny histidín a v najväčšom množstve sa nachádza v žírnych bunkách a bazofilných granulocytoch krvi: tam sa histamín podieľa na regulácii rôznych procesov, vrátane tvorby okamžitých alergických reakcie. U bezstavovcov je celkom bežným mediátorom, u človeka sa využíva ako neurotransmiter v hypotalame, kde sa podieľa na regulácii endokrinných funkcií.
Glutamát
Najbežnejší excitačný neurotransmiter v mozgu. Vylučujú ho axóny väčšiny senzorických neurónov, pyramídové bunky zrakovej kôry, neuróny asociatívnej kôry, ktoré tvoria výbežky na striatum.
Receptory pre tento mediátor sa delia na ionotropné a metabotropné. Ionotropné glutamátové receptory sa v závislosti od ich agonistov a antagonistov delia na dva typy: NMDA (N-metyl-D-aspartát) a non-NMDA. NMDA receptory sú spojené s katiónovými kanálmi, cez ktoré je možný tok iónov sodíka, draslíka a vápnika, a kanály iných ako NMDA receptorov neumožňujú prechod vápnikových iónov. Vápnik vstupujúci cez kanály NMDA receptorov aktivuje kaskádu reakcií od vápnika závislých druhých poslov. Predpokladá sa, že tento mechanizmus hrá veľmi dôležitú úlohu pri tvorbe pamäťových stôp. Kanály spojené s NMDA receptormi sa otvárajú pomaly a iba v prítomnosti glycínu: sú blokované iónmi horčíka a narkotickým halucinogénom fencyklidínom (ktorý sa v anglickej literatúre nazýva „anjelský prach“).
Aktivácia NMDA receptorov v hipokampe je spojená so vznikom veľmi zaujímavého fenoménu – dlhodobej potenciácie, špeciálnej formy neuronálnej aktivity nevyhnutnej pre tvorbu dlhodobej pamäte (pozri kapitolu 17). Zaujímavý je aj fakt, že nadmerne vysoká koncentrácia glutamátu je toxická pre neuróny - túto okolnosť je potrebné brať do úvahy pri niektorých mozgových léziách (hemoragie, epileptické záchvaty, degeneratívne ochorenia, napr. Huntingtonova chorea).
GABA a glycín
Dva aminokyselinové neurotransmitery sú najdôležitejšie inhibičné neurotransmitery. Glycín inhibuje aktivitu interneurónov a motorických neurónov miechy. Vysoká koncentrácia GABA bola zistená v sivej hmote mozgovej kôry, najmä vo frontálnych lalokoch, v subkortikálnych jadrách (nucleus caudate a globus pallidus), v talame, hipokampe, hypotalame a retikulárnej formácii. Niektoré neuróny miechy, čuchového traktu, sietnice a cerebellum sa používajú ako inhibičný mediátor GABA.
Množstvo zlúčenín odvodených od GABA (piracetam, aminolon, oxybutyrát sodný alebo GHB – kyselina gama-hydroxymaslová) stimuluje dozrievanie mozgových štruktúr a vytváranie stabilných spojení medzi populáciami neurónov. To prispieva k formovaniu pamäte, čo bolo dôvodom pre použitie týchto zlúčenín v klinickej praxi na urýchlenie procesov obnovy po rôznych mozgových léziách.
Predpokladá sa, že psychotropná aktivita GABA je určená jej selektívnym účinkom na integračné funkcie mozgu, ktorý spočíva v optimalizácii rovnováhy aktivity interagujúcich mozgových štruktúr. Takže napríklad pri stavoch strachu, fóbiách pacientom pomáhajú špeciálne lieky proti poisteniu – benzodiazepíny, ktorých účinkom je zvýšenie citlivosti GABAergných receptorov.
Neuropeptidy
V súčasnosti sa asi 50 peptidov považuje za možné neurotransmitery, niektoré z nich boli predtým známe ako neurohormóny uvoľňované neurónmi, ale pôsobiace mimo mozgu: vazopresín, oxytocín. Iné neuropeptidy boli po prvýkrát študované ako lokálne hormóny tráviaceho traktu, napríklad gastrín, cholecystokinín atď., ako aj hormóny produkované v iných tkanivách: angiotenzín, bradykinín atď.
O ich existencii v ich bývalej kapacite stále niet pochýb, ale keď je možné zistiť, že konkrétny peptid je vylučovaný nervovým zakončením a pôsobí na susedný neurón, právom sa označuje ako neurotransmiter. V mozgu sa značné množstvo neuropeptidov uplatňuje v hypotalamo-hypofyzárnom systéme, hoci nemenej známa je napr. funkcia peptidov pri prenose citlivosti na bolesť v dorzálnych rohoch miechy.
Všetky peptidy pochádzajú z veľkých prekurzorových molekúl, ktoré sú syntetizované v tele bunky, modifikované v cytoplazmatickom retikule, konvertované v Golgiho aparáte a dodávané do nervového zakončenia rýchlym axonálnym transportom v sekrečných vezikulách. Neuropeptidy môžu pôsobiť ako excitačné aj inhibičné mediátory. Často sa správajú ako neuromodulátory, tzn. sami nevysielajú signál, ale podľa potreby zvyšujú alebo znižujú citlivosť jednotlivých neurónov alebo ich populácií na pôsobenie excitačných alebo inhibičných neurotransmiterov.
Podľa identických úsekov reťazca aminokyselín možno zistiť podobnosti medzi jednotlivými neuropeptidmi. Napríklad všetky endogénne opiátové peptidy na jednom konci reťazca majú rovnakú aminokyselinovú sekvenciu: tyrozín-glycín-glycín-fenylalanín. Práve toto miesto je aktívnym centrom molekuly peptidu. Často objavenie takejto podobnosti medzi jednotlivými peptidmi naznačuje ich genetickú príbuznosť. V súlade s týmto vzťahom bolo identifikovaných niekoľko hlavných rodín neuroaktívnych peptidov:
1.Opiátové peptidy: leucín-enkefalín, metionín-enkefalín, alfa-endorfín, gama-endorfín, beta-endorfín, dynorfín, alfa-neoendorfín.
2. Peptidy neurohypofýzy: vazopresín, oxytocín, neurofyzín.
3. Tachykiníny: látka P, bombezín, fizalemín, kasinín, uperoleín, eledoizín, látka K.
4. Sekretíny: sekretín, glukagón, VIP (vazoaktívny črevný peptid), faktor uvoľňujúci somatotropín.
5. Inzulíny: inzulín, inzulínu podobné rastové faktory I a II.
6. Somatostatíny: somatostatín, pankreatický polypeptid.
7. Gastríny: gastrín, cholecystokinín.
Niektoré neuróny môžu súčasne uvoľňovať peptidové a malé molekulové mediátory, ako je acetylcholín a VIP, pričom oba pôsobia na rovnaký cieľ ako synergisti. Ale môže to byť iné, ako napríklad v hypotalame, kde glutamát a dynorfín vylučovaný jedným neurónom pôsobia na rovnaký postsynaptický cieľ, ale glutamát excituje a opioidný peptid inhibuje. S najväčšou pravdepodobnosťou peptidy v takýchto prípadoch pôsobia ako neuromodulátory. Niekedy sa spolu s neurotransmiterom uvoľňuje aj ATP, ktorý je v niektorých synapsiách považovaný aj za mediátor, ak je samozrejme možné dokázať prítomnosť receptorov preň na postsynaptickej membráne.
Opiátové peptidy
Rodina opiátových peptidov zahŕňa viac ako tucet látok, ktorých molekuly obsahujú 5 až 31 aminokyselín. Tieto látky majú spoločné biochemické vlastnosti, aj keď spôsoby ich syntézy sa môžu líšiť. Napríklad syntéza beta-endorfínu je spojená s tvorbou adrenokortikotropného hormónu (ACTH) zo spoločnej veľkej molekuly prekurzorového proteínu, proopiomelanokortínu, zatiaľ čo enkefalíny sa tvoria z iného prekurzora a dynorfín z tretieho.
Hľadanie opiátových peptidov začalo po objavení opiátových receptorov v mozgu, ktoré viažu ópiové alkaloidy (morfín, heroín atď.). Keďže je ťažké predstaviť si vzhľad takýchto receptorov na viazanie iba cudzích látok, začali sa pozerať do tela. V roku 1975 Nature oznámil objav dvoch malých peptidov s piatimi aminokyselinami, ktoré sa viažu na opiátové receptory a sú účinnejšie ako morfín. Autori tejto správy (Hughes J., Smith T.W., Kosterlitz H.W. et al.) nazvali zistené látky enkefalíny (t. j. v hlave). Po krátkom čase boli z hypotalamo-hypofyzárneho extraktu izolované ďalšie tri peptidy, ktoré sa nazývali endorfíny, t.j. endogénne morfíny, potom bol objavený dynorfín atď.
Všetky opiátové peptidy sa niekedy označujú ako endorfíny. Viažu sa na opiátové receptory lepšie ako morfín a sú 20 až 700-krát účinnejšie ako morfín. Bolo popísaných päť funkčných typov opiátových receptorov, ktoré spolu so samotnými peptidmi tvoria veľmi zložitý systém. Naviazanie peptidu na receptor vedie k vytvoreniu druhých poslov súvisiacich so systémom cAMP.
Najvyšší obsah opioidných peptidov sa nachádza v hypofýze, no syntetizujú sa najmä v hypotalame. Značné množstvo beta-endorfínu sa nachádza v limbickom systéme mozgu, nachádza sa aj v krvi. Koncentrácia enkefalínov je obzvlášť vysoká v zadných rohoch miechy, kde sa prenášajú signály z bolestivých zakončení: tam enkefalíny znižujú uvoľňovanie látky P, mediátora prenosu informácie o bolesti.
U pokusných zvierat je možné vyvolať anestéziu mikroinjekciou beta-endorfínu do mozgovej komory. Ďalšou metódou úľavy od bolesti je elektrická stimulácia neurónov umiestnených v okolí komory: tým sa zvyšuje koncentrácia endorfínov a enkefalínov v mozgovomiechovom moku. K rovnakému výsledku, t.j. k anestézii viedlo ako zavedenie b-endorfínov, tak stimulácia periventrikulárnej (periventrikulárnej) oblasti u pacientov s rakovinou. Zaujímavosťou je, že hladina opiátových peptidov v likvore sa zvyšuje ako pri anestézii pomocou akupunktúry, tak aj pri placebo efekte (keď pacient užíva liek, nevediac, že neobsahuje účinnú látku).
Okrem analgetík, t.j. analgetický účinok, opioidné peptidy ovplyvňujú tvorbu dlhodobej pamäti, proces učenia, regulujú chuť do jedla, sexuálne funkcie a sexuálne správanie, sú dôležitým článkom v stresovej reakcii a adaptačnom procese, zabezpečujú prepojenie medzi nervovým, endokrinným a imunitných systémov (opiátové receptory sa nachádzajú v lymfocytoch a krvných monocytoch).
Zhrnutie
V centrálnom nervovom systéme sa na prenos informácií medzi bunkami používajú nízkomolekulárne aj peptidové neurotransmitery. Rôzne populácie neurónov používajú rôzne mediátory, táto voľba je geneticky podmienená a vybavená určitým súborom enzýmov nevyhnutných na syntézu. Pre ten istý mediátor majú rôzne bunky rôzne typy postsynaptických receptorov s ionotropnou alebo metabotropnou kontrolou. Metabotropná kontrola sa uskutočňuje za účasti transformujúcich sa proteínov a rôzne systémy sekundárnych sprostredkovateľov. Niektoré neuróny súčasne uvoľňujú peptidový mediátor spolu s mediátorom s nízkou molekulovou hmotnosťou. Neuróny, ktoré sa líšia vylučovaným mediátorom, sú sústredené v určitom poradí v rôznych štruktúrach mozgu.
Otázky na sebaovládanie
81. Ktoré z nasledujúcich kritérií nie je kritériom klasifikácie látky ako neurotransmitera?
A. Syntetizovaný v neuróne; B. Akumuluje sa v presynaptickom zakončení; B. Má špecifický účinok na efektor; G. Uvoľňuje sa do krvi; D. Pri umelom podávaní sa pozoruje účinok podobný tomu, ktorý sa deje pri prirodzenom uvoľňovaní.
A. Zabraňuje uvoľneniu mediátora z presynaptického zakončenia; B. Pôsobí ako sprostredkovateľ; B. Koná inak ako mediátor; G. Blokuje postsynaptické receptory; D. Neviaže sa na postsynaptické receptory.
83. Čo z toho je typické pre peptidové neurotransmitery?
A. Vznikajú pri enzymatickej oxidácii aminokyselín; B. Vzniká ako výsledok dekarboxylácie aminokyselín; B. Môžu byť syntetizované v presynaptickom zakončení; D. Dodáva sa do presynaptického konca pomalým axoplazmatickým transportom; D. Vzniká v bunkovom tele neurónu.
84. Čo spôsobuje prúd vápenatých iónov do presynaptického zakončenia pri prenose informácie cez synapsiu?
A. Akčný potenciál; B. Oddychový potenciál; B. Exocytóza; D. Spojenie synaptických vezikúl s cytoskeletom; D. Vznik postsynaptického potenciálu.
85. Čo premieňa excitáciu presynaptického zakončenia na neelektrickú aktivitu (uvoľnenie neurotransmiteru)?
A. Exocytóza; B. Vstupný prúd vápenatých iónov; B. Vstup sodíkových iónov po excitácii konca; D. Výstup draselných iónov počas repolarizácie; E. Zvýšenie aktivity enzýmov potrebných na syntézu mediátora.
86. Čo spôsobuje posttetanickú potenciáciu?
A. Súčet mediátorových kvánt; B. Zvýšenie rýchlosti difúzie mediátora; B. Zvýšenie koncentrácie vápenatých iónov v presynaptickom zakončení; D. Zvýšená aktivita enzýmov na syntézu mediátora; D. Kanály s vysokou hustotou pre vápnik v oblasti aktívnych zón.
87. Ktorá z nasledujúcich udalostí vedie k aktivácii G-proteínov?
A. Konverzia HDP na GTP; B. Konverzia ATP na cAMP; B. Aktivácia adenylátcyklázy; D. Aktivácia proteínkinázy; D. Tvorba postsynaptického potenciálu.
88. Ktoré z uvedených udalostí by sa mali počas metabotropnej kontroly vyskytnúť skôr ako iné?
A. Tvorba cAMP; B. Aktivácia proteínkinázy; B. Aktivácia adenylátcyklázy; D. aktivácia G-proteínu; D. Otvorenie iónového kanála.
89. Aká je funkcia presynaptických membránových autoreceptorov?
A. Implementácia spätného transportu neurotransmiterov; B. Regulácia množstva mediátora v synaptickej štrbine; B. Zapnutie mechanizmov rozdelenia mediátora; D. Ionotropná kontrola presynaptických membránových kanálov; E. Väzba mediátora uvoľneného z postsynaptického neurónu.
90. Ktorý z nasledujúcich mechanizmov sa nepoužíva na odstránenie neurotransmiterov zo synaptickej štrbiny?
A. Enzymatické štiepenie; B. Zachytenie molekúl mediátora gliovými bunkami; C. Zachytenie molekúl mediátora postsynaptickým neurónom; D. Transport molekúl mediátora na koniec presynaptického neurónu; D. difúzia.
91. Pri progresívnej demencii (Alzheimerova choroba) je narušená syntéza jedného z neurotransmiterov. toto:
A. Acetylcholín; B. Glutamát; B. dopamín; G. noradrenalín; D. GABA.
92. Aký neurotransmiter vylučujú neuróny modrej škvrny?
A. dopamín; B. glycín; B. Glutamát; G. noradrenalín; D. Adrenalín.
93. Aký mediátor sa syntetizuje v neurónoch substantia nigra stredného mozgu?
A. dopamín; B. noradrenalín; B. Acetylcholín; G. b-endorfín; D. Glutamát.
94. V ktorej z nasledujúcich mozgových štruktúr sa nachádza najvyššia koncentrácia dopamínu?
A. Retikulárna formácia; B. okcipitálna kôra; B. Predná kôra; G. Cerebellum; D. Thalamus.
95. Aký neurotransmiter vylučujú neuróny jadier raphe?
A. dopamín; B. noradrenalín; B. Serotonín; G. histamín; D. Glycín.
96. Aký mediátor pôsobí na NMDA receptory?
A. Acetylcholín; B. Glutamát; B. glycín; G. Enkefalin; D. Adrenalín.
97. Deriváty jedného z neurotransmiterov sa používajú na urýchlenie procesov obnovy a zlepšenie pamäti po poškodení mozgu. Uveďte to.
A. GABA; B. glycín; B. Acetylcholín; G. Glutamát; D. Dopamín.
98. Ktorá z nasledujúcich látok nie je peptidovým neurotransmiterom?
A. endorfín; B. glycín; B. látka P; G. Somatostatin; D. Enkephalin.
99. Aký mediátor syntetizujú niektoré neuróny mozgu a ovplyvňuje prenos informácií o bolestivých podnetoch v mieche?
A. endorfín; B. Enkefalín; C. Substance R. G. Oxytocin; D. Vasopresín.
100. V ktorej oblasti mozgu sa peptidové neurotransmitery najčastejšie používajú ako mediátory?
A. Cerebellum; B. Retikulárna formácia; B. Hypotalamus a hypofýza; G. Čelná kôra; D. Subkortikálne jadrá.
Bude venovaný šiesty (a posledný) článok zo série o neurotransmiteroch glutamát. Táto látka je nám známejšia ako zvýrazňovač chuti v potravinách, ale hrá dôležitú úlohu v našom nervovom systéme. Glutamát je najrozšírenejší excitačný neurotransmiter v nervovom systéme cicavcov vo všeobecnosti a ľudí zvlášť.
Molekuly a väzby
Glutamát (kyselina glutámová) je jednou z 20 esenciálnych aminokyselín. Okrem toho, že sa podieľa na syntéze bielkovín, môže pôsobiť ako neurotransmiter – látka, ktorá prenáša signál z jednej nervovej bunky do druhej v synaptickej štrbine. Treba mať na pamäti, že glutamát, ktorý je v potravinách, nepreniká hematoencefalickou bariérou, to znamená, že nemá priamy vplyv na mozog. Glutamát vzniká v bunkách nášho tela z α-ketoglutarátu transamináciou. Aminoskupina sa prenesie z alanínu alebo aspartátu a nahradí ketónový radikál α-ketoglutarátu (obr. 1). V dôsledku toho získame glutamát a pyruvát alebo kyselinu oxaloctovú (v závislosti od darcu aminoskupiny). Posledné dve látky sa podieľajú na mnohých dôležitých procesoch: kyselina oxaloctová je napríklad jedným z metabolitov veľkého a hrozného Krebsovho cyklu. K deštrukcii glutamátu dochádza pomocou enzýmu glutamátdehydrogenázy a pri reakcii vzniká už známy α-ketoglutarát a amoniak.
Obrázok 1. Syntéza glutamátu. Glutamát vzniká z α-ketoglutarátu nahradením ketoskupiny aminoskupinou. Pri uskutočňovaní reakcie v bunkách sa spotrebuje nikotínamid adenín dinukleotid fosfát (NADP, NADP). Obrázok z lektor.ukdw.ac.id.
Glutamát, rovnako ako väčšina iných mediátorov, má dva typy receptorov - ionotropný(ktoré otvárajú póry membrány pre ióny v reakcii na pripojenie ligandu) a metabotropný(ktoré po naviazaní na ligand spôsobujú v bunke metabolické preskupenia). Skupina ionotropných receptorov je rozdelená do troch rodín: NMDA receptory, AMPA receptory a receptory kyseliny kaínovej. NMDA receptory nazývané preto, lebo ich selektívnym agonistom, látkou, ktorá selektívne stimuluje tieto receptory, je N-metyl-D-aspartát (NMDA). Kedy AMPA receptory takým agonistom by bola kyselina a-aminometylizoxazolpropiónová a kainátové receptory selektívne stimulované kyselinou kainovou. Táto látka sa nachádza v červených riasach a používa sa v neurovedeckom výskume na modelovanie epilepsie a Alzheimerovej choroby. Nedávno boli doplnené aj ionotropné receptory 8-receptory: Nachádzajú sa na Purkyňových bunkách v mozočku cicavcov. Stimulácia "klasických" - NMDA-, AMPA- a kainátových - receptorov vedie k tomu, že draslík začína opúšťať bunku a vápnik a sodík vstupujú do bunky. Počas týchto procesov dochádza v neuróne k excitácii a spúšťa sa akčný potenciál. Metabotropný tie isté receptory sú spojené s G-proteínovým systémom a podieľajú sa na procesoch neuroplasticity. Neuroplasticita sa týka schopnosti nervových buniek vytvárať medzi sebou nové spojenia alebo ich ničiť. Pojem neuroplasticita zahŕňa aj schopnosť synapsií meniť množstvo uvoľneného neurotransmiteru v závislosti od toho, aké behaviorálne akty a myšlienkové procesy v danom momente prebiehajú a s akou frekvenciou.
Glutamátový systém je nešpecifický: takmer celý mozog „pracuje“ na kyseline glutámovej. Ostatné neurotransmiterové systémy opísané v predchádzajúcich článkoch mali viac-menej úzke špecifiká – napríklad dopamín ovplyvňoval naše pohyby a motiváciu. V prípade glutamanu sa to nestane – jeho vplyv na procesy vo vnútri mozgu je príliš široký a nevyberaný. Je ťažké vyčleniť akúkoľvek konkrétnu funkciu, okrem vzrušujúce. Z tohto dôvodu je potrebné hovoriť o glutamátovom systéme ako o kombinácii veľkého počtu spojení v mozgu. Takáto zbierka je tzv konektóm. Ľudský mozog obsahuje veľké množstvo neuróny, ktoré sa tvoria navzájom veľká kvantita spojenia. Zostavenie ľudského konektómu je úloha, ktorú dnes veda nedokáže. Popísalo to však už spojenie červíka Caenorhabditis elegans(obr. 2). Obdivovatelia myšlienky konektómu tvrdia, že naša identita je zaznamenaná v ľudských konektómoch: naša osobnosť a pamäť. Podľa ich názoru je naše „ja“ skryté v súhrne všetkých spojení. Taktiež „komunikátori“ veria, že po popísaní všetkých nervových spojení budeme schopní pochopiť príčinu mnohých psychických a neurologických porúch, a teda ich budeme vedieť úspešne liečiť.

Obrázok 2. Nematódový konektor Caenorhabditis elegans Každý neurón červa má svoje meno a všetky spojenia medzi neurónmi sa berú do úvahy a zakresľujú do diagramu. V dôsledku toho je schéma neprehľadnejšia ako mapa tokijského metra. Kreslenie z connectomethebook.com.
Zdá sa mi, že táto myšlienka je perspektívna. V zjednodušenej forme môžu byť spojenia medzi neurónmi reprezentované ako drôty, zložité káble spájajúce jeden neurón s druhým. Ak sú tieto spojenia poškodené - signál je skreslený, drôty sú prerušené - môže dôjsť k porušeniu koordinovanej práce mozgu. Takéto choroby, ktoré sa vyskytujú pri zlyhaní nervových komunikačných kanálov, sa nazývajú konekopatie. Termín je nový, ale skrývajú sa za ním vedcom už známe patologické procesy. Ak sa chcete dozvedieť viac o konektómoch, odporúčam prečítať si knihu Sebastiana Seunga “ Connectome. Ako z nás mozog robí to, čím sme» .
Preťaženie siete

Obrázok 3. Štruktúra memantínu. Memantín je derivátom uhľovodíka adamantánu (nezamieňať s adamantom). Kreslenie z Wikipédie.
V normálne fungujúcom mozgu sú signály z neurónov rovnomerne distribuované do všetkých ostatných buniek. Neurotransmitery sa uvoľňujú v požadovanom množstve a nie sú poškodené bunky. Po mozgovej príhode (akútna lézia) alebo pri demencii (dlhodobý proces) sa však glutamát začne uvoľňovať z neurónov do okolitého priestoru. Stimuluje NMDA receptory iných neurónov a vápnik vstupuje do týchto neurónov. Prílev vápnika spúšťa množstvo patologických mechanizmov, ktoré v konečnom dôsledku vedú k smrti neurónu. Proces poškodzovania buniek v dôsledku uvoľnenia veľkého množstva endogénneho toxínu (v tomto prípade glutamátu) je tzv. excitotoxicita.

Obrázok 4. Účinok memantínu pri Alzheimerovej demencii. Memantín znižuje intenzitu excitačných signálov, ktoré prichádzajú z kortikálnych neurónov do Meinertovho jadra. Acetylcholínové neuróny, ktoré tvoria túto štruktúru, regulujú pozornosť a množstvo ďalších kognitívnych funkcií. Zníženie nadmernej aktivácie Meinertovho jadra vedie k zníženiu príznakov demencie. Kreslenie z .
Aby ste zabránili rozvoju excitotoxicity alebo znížili jej účinok na priebeh ochorenia, môžete predpísať memantín. Memantín je veľmi krásna molekula antagonistu NMDA receptora (obr. 3). Najčastejšie sa liek predpisuje na vaskulárnu demenciu a demenciu pri Alzheimerovej chorobe. Normálne sú NMDA receptory blokované iónmi horčíka, ale pri stimulácii glutamátom sa tieto ióny uvoľnia z receptora a vápnik sa začne dostávať do bunky. Memantín blokuje receptor a bráni prechodu vápenatých iónov do neurónu – liek uplatňuje svoj neuroprotektívny účinok znížením celkového elektrického „šumu“ v signáloch bunky. Pri Alzheimerovej demencii sa okrem problémov sprostredkovaných glutamátom znižuje aj hladina acetylcholínu, neurotransmiteru, ktorý sa podieľa na procesoch ako pamäť, učenie a pozornosť. V súvislosti s touto črtou Alzheimerovej choroby používajú psychiatri a neurológovia na liečbu inhibítory acetylcholínesterázy, enzým, ktorý štiepi acetylcholín v synaptickej štrbine. Použitie tejto skupiny liekov zvyšuje obsah acetylcholínu v mozgu a normalizuje stav pacienta. Odborníci odporúčajú súbežné podávanie memantínu a inhibítorov acetylcholínesterázy na účinnejší boj proti demencii pri Alzheimerovej chorobe. Pri kombinovanom použití týchto liekov dochádza k ovplyvneniu dvoch mechanizmov rozvoja ochorenia naraz (obr. 4).
Demencia je dlhodobá mozgová lézia, pri ktorej pomaly dochádza k odumieraniu neurónov. A sú choroby, ktoré vedú k rýchlemu a rozsiahlemu poškodeniu nervového tkaniva. Excitotoxicita je dôležitou zložkou poškodenia nervových buniek pri mŕtvici. Z tohto dôvodu môže byť použitie memantínu pri cerebrovaskulárnych poruchách opodstatnené, ale výskum na túto tému sa len začína. V súčasnosti sa pracuje na myšiach, ktoré ukazujú, že podávanie memantínu v dávke 0,2 mg/kg denne znižuje rozsah poškodenia mozgu a zlepšuje prognózu cievnej mozgovej príhody. Snáď ďalšia práca na tejto téme zlepší liečbu cievnej mozgovej príhody u ľudí.
Hlasy v mojej hlave
Najčastejšie halucinácie u pacientov so schizofréniou sú sluchové: pacient počuje "hlasy" v hlave. Hlas môže nadávať, komentovať to, čo sa deje okolo, vrátane konania pacienta. Jedna moja pacientka mala „hlasy“ čítať nápisy obchodov na ulici, kadiaľ kráčala; ďalší počul hlas, ktorý povedal: "Vezmi si dôchodok a poďme do kaviarne." V súčasnosti existuje teória vysvetľujúca vznik takýchto hlasov. Predstavte si, že pacient ide po ulici. Vidí znak a mozog ho automaticky „prečíta“. Pri zvýšenej aktivite v spánkovom laloku, ktorý je zodpovedný za sluchové vnímanie, má pacient sluchové vnemy. Mohli by byť utlmené v dôsledku normálneho fungovania oblastí frontálneho kortexu, no nedeje sa to z dôvodu zníženia ich aktivity (obr. 5). Príčinou nadmernej aktivity sluchovej kôry môže byť hyperfunkcia glutamátového (excitačného) systému alebo defekt GABAergických štruktúr zodpovedných za normálnu inhibíciu v ľudskom mozgu. Nedostatočná aktivita predného laloku je pri schizofrénii s najväčšou pravdepodobnosťou spojená aj s porušením rovnováhy neurotransmiterov. Nesúlad akcií vedie k tomu, že človek začína počuť „hlasy“, ktoré jasne korelujú s prostredím alebo prenášajú jeho myšlienky. Veľmi často si v hlave „vyslovujeme“ svoje myšlienky, ktoré môžu byť aj zdrojom „hlasov“ v mozgu človeka so schizofréniou.

Obrázok 5. Výskyt sluchových halucinácií v mozgu pacienta so schizofréniou. Primárny vnem z automatického „čítania“ znakov alebo pri vzniku myšlienok, lokalizovaný v temporálnom kortexe (1), nie je potláčaný frontálnym kortexem (2). Parietálny kortex (3) zachytáva vznikajúci vzorec činnosti v mozgu a presúva ťažisko činnosti naň. Výsledkom je, že človek začne počuť „hlas“. Kreslenie z .
Týmto sa naša cesta do sveta neurotransmiterov končí. Stretli sme motivačný dopamín, upokojujúcu kyselinu γ-aminomaslovú a štyroch ďalších hrdinov nášho mozgu. Zaujímajte sa o svoj mozog – pretože, ako hovorí názov knihy Dicka Swaaba, . Neurotox. Res. 24 , 358–369;