ფერმენტული რეაქციების კინეტიკა. ფერმენტული რეაქციების სიჩქარის დამოკიდებულება სუბსტრატების, ფერმენტების კონცენტრაციაზე, ტემპერატურაზე რა თანმიმდევრობით მიმდინარეობს ფერმენტული რეაქცია ფერმენტების მიხედვით
ფერმენტული რეაქციების სიჩქარე დამოკიდებულია სუბ- კონცენტრაციაზე.
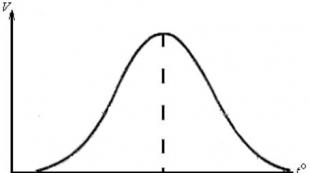
ფენა ეს დამოკიდებულება რთულია, რომელიც გარკვეული ფერმენტებისთვის აღწერილია პარაბოლური მრუდით (ნახ. 29).
სურათი 29 - ფერმენტული რეაქციის სიჩქარის დამოკიდებულება
სუბსტრატის კონცენტრაციაზე
დამოკიდებულების პარაბოლური ბუნება აიხსნება იმით, რომ როდესაც ფერმენტი ურთიერთქმედებს სუბსტრატთან, წარმოიქმნება ფერმენტ-სუბსტრატის კომპლექსი. თავდაპირველად სუბსტრატის კონცენტრაციის მატებასთან ერთად იზრდება ფერმენტ-სუბსტრატის კომპლექსების კონცენტრაცია რეაქციულ ნარევში, რაც გამოიხატება რეაქციის სიჩქარის პარალელურად ზრდით. სუბსტრატის გარკვეული კონცენტრაციის დროს (გაჯერება), ხდება რეაქციის ნარევში ფერმენტის მოლეკულების ყველა აქტიური ცენტრის ერთგვარი „გაჯერება“. ფერმენტული რეაქციის სიჩქარე გაჯერების კონცენტრაციაზე მაქსიმალური ხდება. სარეაქციო ნარევში სუბსტრატის შემცველობის შემდგომი გაზრდით, ის არ იცვლება.
სუბსტრატის კონცენტრაციაზე ფერმენტული რეაქციის სიჩქარის დამოკიდებულების გრაფიკიდან გამოითვლება ორი მნიშვნელოვანი მაჩვენებელი:
1. რეაქციის მაქსიმალური სიჩქარე (ვმაქსიმუმ). იგი განისაზღვრება, როგორც რეაქციის სიჩქარე სუბსტრატის გაჯერების კონცენტრაციაზე. მაქსიმალური სიჩქარის მნიშვნელობა ასახავს ფერმენტის კატალიზურ ძალას. უფრო დიდი ფერმენტები ვ max უფრო ძლიერი კატალიზატორებია. ისინი კატალიზირებენ სუბსტრატის მოლეკულების უფრო დიდი რაოდენობის ტრანსფორმაციას დროის ერთეულზე. მაქსიმალური სიჩქარე გამოიხატება ფერმენტის რევოლუციების რაოდენობით. ბრუნვის რიცხვი შეფასებულია სუბსტრატის მოლეკულების რაოდენობით, რომლებიც გარდაიქმნება ფერმენტის მიერ დროის ერთეულზე (s -1). ფერმენტების უმეტესობისთვის ბრუნვის რიცხვი 10 4-ის ფარგლებშია. ამავე დროს, არსებობს ფერმენტები, რომელთათვისაც სიჩქარემნიშვნელოვნად მეტი (600000 კარბანჰიდრაზასთვის) ან ამ მნიშვნელობაზე ნაკლები (100 ქიმოტრიფსინისთვის).
2. მიქაელის მუდმივი (TOმ). მიქაელის მუდმივი არის სუბსტრატის კონცენტრაცია, რომლის დროსაც რეაქციის სიჩქარე ნახევარი მაქსიმალურია. მაგნიტუდა TO m ასახავს ფერმენტის აფინურობას სუბსტრატის მიმართ. რაც უფრო დიდია ეს მნიშვნელობა, მით ნაკლებია ფერმენტი სუბსტრატის მიმართ. TO m გამოიხატება სუბსტრატის მოლებით. ასე რომ, ღირებულება TOმ გლუკოზასთან მიმართებაში გლუკოკინაზას ფერმენტისთვის არის 10 მმოლი, ხოლო ჰექსოკინაზასთვის - 0,01 მმოლი. ჰექსოკინაზა ავლენს უფრო დიდ მიდრეკილებას გლუკოზის მიმართ, ვიდრე გლუკოკინაზა; იმავე სუბსტრატის კონცენტრაციით, ის უფრო მაღალი სიჩქარით აკატალიზებს გლუკოზის ფოსფორილირებას.
ფერმენტული რეაქციის სიჩქარის სუბსტრატის კონცენტრაციაზე დამოკიდებულების მრუდის მათემატიკური ანალიზის საფუძველზე, L. Michaelis და M. Menten (1913) გამოიღეს ფორმულა, რომელიც საშუალებას გაძლევთ შეაფასოთ კავშირი რეაქციის სიჩქარეს შორის, მაქსიმალური მაჩვენებელი და მიქაელის მუდმივი. ამჟამად ის განისაზღვრება, როგორც მიქაელის-მენტენის განტოლება.
ვ o = ვმაქსიმალური [ ს]/კ m + [ ს],
სად ვ o - რეაქციის სიჩქარე, ს- სუბსტრატის კონცენტრაცია.
ფერმენტების ზოგადი თვისებები
სტრუქტურის, ფუნქციისა და უჯრედშიდა ლოკალიზაციის გარკვეული განსხვავებების არსებობის მიუხედავად, ფერმენტებს ახასიათებთ მთელი რიგი საერთო თვისებები. ეს მოიცავს მათი კატალიზური აქტივობის მანიფესტაციის დამოკიდებულებას ტემპერატურაზე (თერმოლაციაზე) და გარემოს pH-ზე, ასევე სუბსტრატის სპეციფიკაზე.
ფერმენტების დამახასიათებელი თვისებაა თერმოლიანობა. ეს ფენომენი შეიძლება ილუსტრირებული იყოს ფერმენტული რეაქციის სიჩქარის გრაფიკით რეაქციის ნარევის ტემპერატურის მიმართ (ნახ. 30).

სურათი 30 - ფერმენტული რეაქციის სიჩქარის დამოკიდებულება ტემპერატურაზე
რეაქციის საშუალება ( ტოპტიმალური ტემპერატურა; ვ- სიჩქარის რეაქცია)
როგორც წარმოდგენილი გრაფიკიდან ჩანს, 4 o C ტემპერატურაზე, ფერმენტული რეაქციები პრაქტიკულად არ ხდება. ამ მიზეზით ბიოქიმიური კვლევების ჩატარებამდე ბიოლოგიური ობიექტები შეიძლება ინახებოდეს ცივში გარკვეული დროის განმავლობაში. ეს არის სიცივე, რომელიც საშუალებას აძლევს საკვები პროდუქტების შენახვას აუტოლიზისგან (თვითმონელება).
ტემპერატურის მატებას თან ახლავს ფერმენტული რეაქციის სიჩქარის ზრდა. ამის მიზეზი სუბსტრატისა და ფერმენტის მოლეკულების კინეტიკური ენერგიის მატებაა, რაც ზრდის მათ შორის ურთიერთქმედების სიჩქარეს. მსგავსი ფენომენი შეინიშნება ტემპერატურამდე, რომელიც შეესაბამება ფერმენტის ოპტიმალურ ტემპერატურას. ფერმენტის ოპტიმალური ტემპერატურაშეესაბამება ტემპერატურას, რომლის დროსაც ფერმენტული რეაქციის სიჩქარე მაქსიმალურია. თბილსისხლიანი ცხოველების ფერმენტებისთვის ეს ჩვეულებრივ არის 28 o C ან 37 o C.
რეაქციის ნარევის ტემპერატურის შემდგომი ზრდა იწვევს ფერმენტული რეაქციის სიჩქარის თანდათანობით შემცირებას. ეს ფენომენი განპირობებულია ცილის პოლიპეპტიდური ჯაჭვის თერმული დენატურაციის პროცესით. დენატურაციას თან ახლავს ფერმენტის აქტიური ცენტრის სტრუქტურის ცვლილება, რაც იწვევს სუბსტრატისადმი ფერმენტის აფინურობის დაქვეითებას. 55 o C-ზე მაღალ ტემპერატურაზე ფერმენტების უმეტესობა მთლიანად კარგავს კატალიზურ თვისებებს (ინაქტივირებულია). ამასთან დაკავშირებით პასტერიზაციის პროცედურისთვის ფართოდ გამოიყენება გათბობა 55-56 o C-მდე, რაც ზრდის საკვები პროდუქტების (რძის და ა.შ.) შენახვის ვადას.
გარემოს pH დიდ გავლენას ახდენს ფერმენტული რეაქციის სიჩქარეზე. როგორც ნაჩვენები ფიგურიდან ჩანს. 31 დიაგრამაზე, იგი ფორმაში წააგავს ფერმენტული რეაქციის სიჩქარის ტემპერატურაზე დამოკიდებულების გრაფიკს.

სურათი 31 - სიჩქარეზე დამოკიდებულება ( ვ) ფერმენტული რეაქცია
გარემოს pH-ზე (pH opt – ფერმენტის pH ოპტიმალური)
ფერმენტული რეაქციის სიჩქარის მკვეთრი დაქვეითება უკიდურეს pH მნიშვნელობებში დაკავშირებულია ცილის მოლეკულის პოლიპეპტიდური ჯაჭვის დენატურაციის ფენომენთან მჟავებისა და ტუტეების გავლენის ქვეშ. ფერმენტი ავლენს მაქსიმალურ კატალიზურ ძალას pH მნიშვნელობით, რომელიც განისაზღვრება ტერმინით pH ოპტიმალურიფერმენტი. ყველაზე ცნობილ ფერმენტებს აქვთ ოპტიმალური pH 5.0-დან 7.5-მდე. ამავდროულად, არსებობს ფერმენტების მრავალი მაგალითი, რომლებშიც pH ოპტიმალური მნიშვნელობა გადადის მჟავე ან ტუტე pH მნიშვნელობების რეგიონში. ეს ფერმენტები მოიცავს:
ფერმენტული რეაქციების სიჩქარის pH-ზე დამოკიდებულების არსებობის მიზეზი განპირობებულია იმით, რომ გარემოს pH მნიშვნელობა მკვეთრად მოქმედებს სუბსტრატის ფუნქციური ჯგუფების იონიზაციის ხარისხზე. სუქცინის მჟავას მოლეკულის იონიზაციის თავისებურებები გარემოს სხვადასხვა მჟავიანობაზე (pH):

ამავდროულად, გარემოს pH ასევე გავლენას ახდენს ამინომჟავის რადიკალების იონიზაციის ხარისხზე, რომლებიც ქმნიან ფერმენტის აქტიურ ცენტრს:

თუ ფერმენტ-სუბსტრატის კომპლექსის წარმოქმნა სტაბილიზირებულია ელექტროსტატიკური ურთიერთქმედების გამო, მაშინ ცხადი ხდება pH-ის როლი ფერმენტული რეაქციის მიმდინარეობის ოპტიმალური პირობების უზრუნველყოფაში (სურ. 24).
ფერმენტების მიერ კატალიზებული რეაქციების სიჩქარე, რომელთა ურთიერთქმედებისას სუბსტრატებთან ელექტროსტატიკური ურთიერთქმედება არ არის მნიშვნელოვანი, ნაკლებად დამოკიდებულია საშუალო pH-ზე. ნახ. სურათი 32 გვიჩვენებს პაპაინის მიერ ცილის ჰიდროლიზის სიჩქარის დამოკიდებულებას. ამ ფერმენტის სუბსტრატთან ურთიერთქმედებისას ჰიდროფობიური ურთიერთქმედება ხდება მთავარი. როგორც წარმოდგენილი გრაფიკიდან ჩანს, პაპაინს ზოგადად არ აქვს მკაფიოდ განსაზღვრული pH ოპტიმუმი.

სურათი 32 - pH-ის ეფექტი პაპაინის მიერ ცილის ჰიდროლიზის სიჩქარეზე.
ფერმენტებს აქვთ გარკვეული სპეციფიკასუბსტრატებთან დაკავშირებით. სპეციფიკა გულისხმობს ფერმენტების უნარს კატალიზირება მოახდინოს სტრუქტურულად მსგავსი სუბსტრატების ერთი ან ჯგუფის ტრანსფორმაციაზე. არსებობს ფერმენტის სპეციფიკის რამდენიმე ტიპი.
· აბსოლუტური სპეციფიკა.ეს ეხება ფერმენტის უნარს, კატალიზირება მოახდინოს მხოლოდ ერთი სუბსტრატის ტრანსფორმაციაზე. აბსოლუტური სპეციფიკის მქონე ფერმენტებს მიეკუთვნება არგინაზა, ურიკაზას შემზღუდველი ფერმენტები და ა.შ.
· შედარებითი სპეციფიკა. ეს ნიშნავს ფერმენტის უნარს, კატალიზაცია მოახდინოს სტრუქტურის მსგავსი სუბსტრატების ჯგუფის ტრანსფორმაციაზე (ე.წ. პროტეოლიზური ფერმენტები ჰიდროლიზირებენ სხვადასხვა ცილებს, გლიცეროლის ლიპაზას ეთერებს და უფრო მაღალ ცხიმოვან მჟავებს, ჰექსოკინაზა ფოსფორილებს სხვადასხვა მონოსაქარიდებს). ამ შემთხვევაში სპეციფიკა განისაზღვრება იმით, რომ ფერმენტი მოქმედებს მხოლოდ გარკვეული ტიპის ბმაზე (პროტეოლიზური ფერმენტები ჰიდროლიზებენ პეპტიდურ კავშირს, ლიპაზა აჰიდროლიზებს ესტერულ კავშირს და ა.შ.).
· სტერეოსპეციფიკურობა . ეს ტერმინი ეხება ფერმენტის უნარს, მოახდინოს სუბსტრატის ერთი სტერეოიზომერის გარდაქმნა. ამრიგად, ფერმენტები, რომლებიც მონაწილეობენ მონოსაქარიდების გარდაქმნაში, ავლენენ სპეციფიკურობას მათთან მიმართებაში დ-სტერეოიზომერები და ფერმენტები, რომლებიც მონაწილეობენ ამინომჟავების ტრანსფორმაციაში - მათში ლ-სტერეოიზომერები.
ფერმენტის აქტივობა
ფერმენტების, როგორც კატალიზატორების თავისებურება ის არის, რომ მათ შეუძლიათ შეცვალონ თავიანთი კატალიზური თვისებები სხვადასხვა გარე ფაქტორების გავლენის ქვეშ. ფერმენტების კატალიზური მოქმედების სიძლიერის საზომია მათი აქტივობა. ფერმენტების უნარს, შეცვალონ თავიანთი აქტივობა სხვადასხვა პირობებში, დიდი ბიოლოგიური აზრი აქვს. ეს თვისება საშუალებას აძლევს ცოცხალ უჯრედს მოერგოს მეტაბოლური პროცესების მდგომარეობა უჯრედების უშუალო საჭიროებებს, რაც შეიძლება მნიშვნელოვნად შეიცვალოს სხვადასხვა გარე ფაქტორების გავლენის ქვეშ.
ფერმენტის აქტივობის განსაზღვრა მნიშვნელოვან როლს თამაშობს მათ დახასიათებაში. არსებობს რამდენიმე ზოგადი პრინციპი ფერმენტის აქტივობის რაოდენობრივი დასადგენად. ფერმენტის აქტივობა შეიძლება განისაზღვროს შემდეგნაირად:
· ან რეაქციულ ნარევში დაგროვების სიჩქარით, სადაც რეაქციის პროდუქტის ფერმენტია განთავსებული;
· ან რეაქციული ნარევიდან ფერმენტული რეაქციის სუბსტრატის გაქრობის სიჩქარით.
ორივე ეს მიდგომა ექვივალენტურია და შეიძლება გამოყენებულ იქნას პრაქტიკაში. თუმცა ფერმენტის აქტივობის განსაზღვრისას დაცული უნდა იყოს შემდეგი პირობები: სარეაქციო ნარევში, რომელშიც განისაზღვრება ფერმენტის აქტივობა,
· ტემპერატურა უნდა შეესაბამებოდეს ფერმენტის ტემპერატურულ ოპტიმალს;
· გარემოს pH უნდა შეესაბამებოდეს ამ ფერმენტის pH ოპტიმალურს;
· სუბსტრატის კონცენტრაცია არანაკლებ უნდა იყოს გაჯერებულზე;
· კოფაქტორები უნდა იყოს წარმოდგენილი, თუ ამ ფერმენტს აქვს რაიმე;
უნდა იყოს ფერმენტის აქტივატორები.
ამრიგად, ფერმენტის აქტივობა განისაზღვრება ოპტიმალურ პირობებში. ამ პირობებში ფერმენტის აქტივობა სატესტო ნიმუშში მისი შემცველობის პროპორციულია და, შესაბამისად, შეიძლება გამოყენებულ იქნას მისი კონცენტრაციის ირიბად შესაფასებლად.
ფერმენტის აქტივობა რაოდენობრივად გამოხატულია საქმიანობის ერთეულები. ფერმენტის აქტივობის ერთი ერთეული (U) არის ფერმენტის აქტივობა, რომლის დროსაც მისი გავლენის ქვეშ წარმოიქმნება რეაქციის პროდუქტის 1 მკმოლი (ან სუბსტრატის 1 მკმოლი ქრება) წუთში.. SI სისტემაში ფერმენტული აქტივობის ერთეულია კატალი (კატი). 1 კატა შეესაბამება ფერმენტის აქტივობას, რომელშიც წარმოიქმნება რეაქციის პროდუქტის ერთი მოლი (სუბსტრატის ერთი მოლი ქრება) წამში.
სპეციფიკური აქტივობის მნიშვნელობა ასევე გამოიყენება ფერმენტების დასახასიათებლად. ეს ერთეული ასახავს ფერმენტის აქტივობას ერთეულ მასაზე და გამოხატულია მკმოლ/წთ მგ პროტეინში. სპეციფიკური აქტივობის ერთეულები გამოიყენება ფერმენტული პრეპარატების სისუფთავის შესაფასებლად. რაც უფრო მაღალია სპეციფიკური აქტივობა, მით უფრო სუფთაა ფერმენტის პრეპარატი.
ფერმენტების კინეტიკა სწავლობს სხვადასხვა ფაქტორების (S და E კონცენტრაციები, pH, ტემპერატურა, წნევა, ინჰიბიტორები და აქტივატორები) გავლენას ფერმენტული რეაქციების სიჩქარეზე. ფერმენტული რეაქციების კინეტიკის შესწავლის მთავარი მიზანია ინფორმაციის მიღება, რომელიც საშუალებას იძლევა უფრო ღრმად გავიგოთ ფერმენტების მოქმედების მექანიზმი.
კინეტიკური მრუდი საშუალებას გაძლევთ განსაზღვროთ საწყისი რეაქციის სიჩქარე V 0.
სუბსტრატის გაჯერების მრუდი.
რეაქციის სიჩქარის დამოკიდებულება ფერმენტის კონცენტრაციაზე.
რეაქციის სიჩქარის დამოკიდებულება ტემპერატურაზე.
რეაქციის სიჩქარის დამოკიდებულება pH-ზე.
|
|
ფერმენტების უმეტესობის მოქმედებისთვის ოპტიმალური pH ფიზიოლოგიურ დიაპაზონშია 6.0-8.0. პეპსინი აქტიურია pH 1,5-2,0, რაც შეესაბამება კუჭის წვენის მჟავიანობას. არგინაზა, ღვიძლის სპეციფიკური ფერმენტი, აქტიურია 10.0-ზე. pH-ის გავლენა ფერმენტული რეაქციის სიჩქარეზე დაკავშირებულია ფერმენტის და სუბსტრატის მოლეკულებში იონოგენური ჯგუფების იონიზაციის მდგომარეობასა და ხარისხთან. ეს ფაქტორი განსაზღვრავს ცილის კონფორმაციას, აქტიური ცენტრისა და სუბსტრატის მდგომარეობას, ფერმენტ-სუბსტრატის კომპლექსის წარმოქმნას და თავად კატალიზის პროცესს. |
სუბსტრატის გაჯერების მრუდის მათემატიკური აღწერა, მიქაელის მუდმივი .
|
|
განტოლება, რომელიც აღწერს სუბსტრატის გაჯერების მრუდს, შემოთავაზებულია მაიკლისისა და მენტონის მიერ და ატარებს მათ სახელებს (Michaelis-Menten განტოლება): ვ = (ვ მაქს *[ ს])/(კმ+[ ს]) , სადაც Km არის მიქაელის მუდმივი. ადვილი გამოსათვლელია, რომ როდესაც V = V MAX /2 Km = [S], ე.ი. კმ არის სუბსტრატის კონცენტრაცია, რომლის დროსაც რეაქციის სიჩქარეა ½ V MAX. V MAX-ისა და კმ-ის განსაზღვრის გასამარტივებლად მიქაელის-მენტენის განტოლება შეიძლება ხელახლა გამოითვალოს. 1/V = (კმ+[S])/(V მაქს *[S]), 1/V = კმ/(V მაქს *[S]) + 1/V მაქს , |
|
|
1/ ვ = კმ/ ვ მაქს *1/[ ს] + 1/ ვ მაქსლაინვივერ-ბურკის განტოლება. განტოლება, რომელიც აღწერს Lineweaver-Burk ნახაზს, არის სწორი ხაზის განტოლება (y = mx + c), სადაც 1/V MAX არის სწორი ხაზის კვეთა y-ღერძზე; Km/V MAX - სწორი ხაზის ტანგენსი; სწორი ხაზის გადაკვეთა აბსცისის ღერძთან იძლევა მნიშვნელობას 1/კმ. Lineweaver-Burk ნაკვეთი საშუალებას გაძლევთ განსაზღვროთ კმ პუნქტების შედარებით მცირე რაოდენობით. ეს გრაფიკი ასევე გამოიყენება ინჰიბიტორების ეფექტის შეფასებისას, როგორც ქვემოთ იქნება განხილული. კმ-ის მნიშვნელობა ფართოდ მერყეობს: 10-6 მოლ/ლ ძალიან აქტიური ფერმენტებისთვის, 10-2-მდე დაბალი აქტიური ფერმენტებისთვის. |
კმ შეფასებებს პრაქტიკული მნიშვნელობა აქვს. კმ-ზე 100-ჯერ მეტი სუბსტრატის კონცენტრაციისას ფერმენტი იმუშავებს თითქმის მაქსიმალური სიჩქარით, ამიტომ მაქსიმალური სიჩქარე V MAX ასახავს აქტიური ფერმენტის რაოდენობას. ეს გარემოება გამოიყენება პრეპარატში ფერმენტის შემცველობის შესაფასებლად. გარდა ამისა, Km არის ფერმენტის მახასიათებელი, რომელიც გამოიყენება ენზიმოპათიების დიაგნოსტიკისთვის.
ფერმენტის აქტივობის დათრგუნვა.
ფერმენტების უკიდურესად დამახასიათებელი და მნიშვნელოვანი თვისებაა მათი ინაქტივაცია გარკვეული ინჰიბიტორების გავლენის ქვეშ.
ინჰიბიტორები - ეს არის ნივთიერებები, რომლებიც იწვევენ ფერმენტების მიერ კატალიზებული რეაქციების ნაწილობრივ ან სრულ დათრგუნვას.
ფერმენტული აქტივობის დათრგუნვა შეიძლება იყოს შეუქცევადი ან შექცევადი, კონკურენტული ან არაკონკურენტული.
შეუქცევადი ინჰიბირება - ეს არის ფერმენტის მუდმივი ინაქტივაცია, რომელიც გამოწვეულია ინჰიბიტორის მოლეკულის კოვალენტური შეერთებით აქტიურ ადგილზე ან სხვა სპეციალურ ცენტრში, რომელიც ცვლის ფერმენტის კონფორმაციას. ასეთი სტაბილური კომპლექსების დისოციაცია თავისუფალი ფერმენტის რეგენერაციასთან პრაქტიკულად გამორიცხულია. ასეთი დათრგუნვის შედეგების დასაძლევად სხეულმა უნდა მოახდინოს ახალი ფერმენტის მოლეკულების სინთეზირება.
შექცევადი ინჰიბიცია - ხასიათდება ინჰიბიტორის წონასწორული კომპლექსით ფერმენტთან არაკოვალენტური ბმების გამო, რის შედეგადაც ასეთ კომპლექსებს შეუძლიათ დისოციაცია ფერმენტის აქტივობის აღდგენით.
ინჰიბიტორების კლასიფიკაცია კონკურენტულ და არაკონკურენტულად ეფუძნება თუ არა ის დასუსტებულს ( კონკურენტული დათრგუნვა ) ან არ არის დასუსტებული ( არაკონკურენტული დათრგუნვა ) მათი ინჰიბიტორული მოქმედება სუბსტრატის კონცენტრაციის ზრდისას.
კონკურენტული ინჰიბიტორები - ეს არის, როგორც წესი, ნაერთები, რომელთა სტრუქტურა სუბსტრატის სტრუქტურის მსგავსია. ეს საშუალებას აძლევს მათ შეაერთონ იმავე აქტიურ ადგილას, როგორც სუბსტრატები, რაც ხელს უშლის ფერმენტის ურთიერთქმედებას სუბსტრატთან უკვე შეკავშირების ეტაპზე. შებოჭვის შემდეგ, ინჰიბიტორი შეიძლება გარდაიქმნას პროდუქტად ან დარჩეს აქტიურ ადგილზე, სანამ არ მოხდება დისოციაცია.
შექცევადი კონკურენტული დათრგუნვა შეიძლება წარმოდგენილი იყოს დიაგრამის სახით:
E↔ E-I → E + P 1
S (არააქტიური)
ფერმენტის ინჰიბირების ხარისხი განისაზღვრება სუბსტრატისა და ფერმენტის კონცენტრაციის თანაფარდობით.
ამ ტიპის ინჰიბირების კლასიკური მაგალითია სუქცინატდეჰიდროგენაზას (SDH) აქტივობის ინჰიბირება მალატის მიერ, რომელიც ანაცვლებს სუქცინატს სუბსტრატის ადგილიდან და ხელს უშლის მის გარდაქმნას ფუმარატად:

ინჰიბიტორის კოვალენტური შეკავშირება აქტიურ ადგილზე იწვევს ფერმენტის ინაქტივაციას (შეუქცევადი ინჰიბიცია). მაგალითი შეუქცევადი კონკურენტული დათრგუნვა შეიძლება გახდეს ტრიოსეფოსფატ იზომერაზას ინაქტივაცია 3-ქლოროაცეტოლ ფოსფატით. ეს ინჰიბიტორი არის სუბსტრატის, დიჰიდროქსიაცეტონ ფოსფატის სტრუქტურული ანალოგი და შეუქცევადად აკავშირებს გლუტამინის მჟავას ნარჩენებს აქტიურ ადგილზე:
ზოგიერთი ინჰიბიტორი მოქმედებს ნაკლებად შერჩევით, ურთიერთქმედებს კონკრეტულ ფუნქციურ ჯგუფთან სხვადასხვა ფერმენტის აქტიურ ადგილზე. ამრიგად, იოდოაცეტატის ან მისი ამიდის შეკავშირება ამინომჟავის ცისტეინის SH ჯგუფთან, რომელიც მდებარეობს ფერმენტის აქტიურ ცენტრში და მონაწილეობს კატალიზში, იწვევს ფერმენტის აქტივობის სრულ დაკარგვას:
R-SH + JCH 2 COOH → HJ + R-S-CH 2 COOH
ამიტომ, ეს ინჰიბიტორები ახდენენ ყველა ფერმენტის ინაქტივაციას, რომლებსაც აქვთ SH ჯგუფები ჩართული კატალიზში.
ჰიდროლაზების შეუქცევადი დათრგუნვა ნერვული აირების (სარინი, სომანი) მოქმედებით განპირობებულია მათი კოვალენტური შეკავშირებით აქტიურ ცენტრში სერინის ნარჩენებთან.
კონკურენტული ინჰიბირების მეთოდმა ფართო გამოყენება ჰპოვა სამედიცინო პრაქტიკაში. სულფონამიდური პრეპარატები, პ-ამინობენზოის მჟავას ანტაგონისტები, შეიძლება იყოს მეტაბოლიზებული კონკურენტული ინჰიბიტორების მაგალითი. ისინი უკავშირდებიან დიჰიდროპტერატ სინთეტაზას, ბაქტერიულ ფერმენტს, რომელიც გარდაქმნის p-ამინობენზოატს ფოლიუმის მჟავად, რომელიც აუცილებელია ბაქტერიების ზრდისთვის. ბაქტერია კვდება იმის შედეგად, რომ შეკრული სულფანილამიდი გარდაიქმნება სხვა ნაერთად და არ წარმოიქმნება ფოლიუმის მჟავა.
არაკონკურენტული ინჰიბიტორები ჩვეულებრივ აკავშირებს ფერმენტის მოლეკულას სუბსტრატის შეკვრის ადგილისგან განსხვავებულ ადგილას და სუბსტრატი პირდაპირ კონკურენციას არ უწევს ინჰიბიტორს. ვინაიდან ინჰიბიტორი და სუბსტრატი აკავშირებს სხვადასხვა ცენტრს, შესაძლებელია როგორც E-I კომპლექსის, ასევე S-E-I კომპლექსის წარმოქმნა. S-E-I კომპლექსი ასევე იშლება და წარმოიქმნება პროდუქტი, მაგრამ უფრო ნელი ტემპით, ვიდრე E-S, ამიტომ რეაქცია შენელდება, მაგრამ არ შეჩერდება. ამრიგად, შეიძლება მოხდეს შემდეგი პარალელური რეაქციები:
E↔ E-I ↔ S-E-I → E-I + P
შექცევადი არაკონკურენტული ინჰიბირება შედარებით იშვიათია.
არაკონკურენტულ ინჰიბიტორებს უწოდებენ ალოსტერული კონკურენტებისგან განსხვავებით ( იზოტერული ).
შექცევადი დათრგუნვა შეიძლება რაოდენობრივად შესწავლილი იყოს მიქაელის-მენტენის განტოლების გამოყენებით.
კონკურენტული დათრგუნვით, V MAX რჩება მუდმივი და კმ იზრდება.
|
|
|
არაკონკურენტული დათრგუნვით, V MAX მცირდება, ხოლო კმ უცვლელი რჩება.
|
|
|
თუ რეაქციის პროდუქტი აფერხებს ფერმენტს, რომელიც კატალიზებს მის წარმოქმნას, ინჰიბირების ამ მეთოდს ე.წ. რეტროინჰიბიცია ან უკუკავშირის დათრგუნვა . მაგალითად, გლუკოზა თრგუნავს გლუკოზა-6-ფოსფატაზას, რომელიც აკატალიზებს გლუკოზა-6-ფოსფატის ჰიდროლიზს.
ამ ინჰიბირების ბიოლოგიური მნიშვნელობა არის გარკვეული მეტაბოლური გზების რეგულირება (იხ. შემდეგი გაკვეთილი).
პრაქტიკული ნაწილი
დავალება მოსწავლეებისთვის
1. შეისწავლეთ ცილების დენატურაცია მინერალური და ორგანული მჟავების ხსნარების გავლენით და გახურებისას.
2. საფუარში კოენზიმის NAD-ის აღმოჩენა.
3. განსაზღვრეთ ამილაზას აქტივობა შარდში (სისხლის შრატი).
9. პრობლემების პასუხების სტანდარტები, ტესტის კითხვები, რომლებიც გამოიყენება კლასში ცოდნის გასაკონტროლებლად (შეიძლება გამოიყენოთ როგორც დანართი)
10. შესაძლო საგანმანათლებლო და კვლევითი სამუშაოს ბუნება და ფარგლები თემაზე
(კონკრეტულად მიუთითეთ UIRS-ის ბუნება და ფორმა: აბსტრაქტული პრეზენტაციების მომზადება, დამოუკიდებელი კვლევის ჩატარება, სიმულაციური თამაშები, სამედიცინო ისტორიის მომზადება მონოგრაფიული ლიტერატურისა და სხვა ფორმების გამოყენებით)
ფერმენტების კინეტიკა სწავლობს ფერმენტების მიერ კატალიზებული რეაქციების სიჩქარეს, რაც დამოკიდებულია სუბსტრატთან მათი ურთიერთქმედების სხვადასხვა პირობებზე (კონცენტრაცია, ტემპერატურა, pH და ა.შ.).
თუმცა, ფერმენტები არის ცილები, რომლებიც მგრძნობიარეა სხვადასხვა გარე გავლენის გავლენის მიმართ. ამიტომ, ფერმენტული რეაქციების სიჩქარის შესწავლისას, ისინი ძირითადად ითვალისწინებენ რეაქტიული ნივთიერებების კონცენტრაციას და ცდილობენ მინიმუმამდე დაიყვანონ ტემპერატურის, გარემოს pH-ის, აქტივატორების, ინჰიბიტორების და სხვა ფაქტორების გავლენა და შექმნან სტანდარტული პირობები. პირველ რიგში, ეს არის გარემოს pH მნიშვნელობა, რომელიც ოპტიმალურია მოცემული ფერმენტისთვის. მეორეც, რეკომენდებულია ტემპერატურის შენარჩუნება 25°C, სადაც ეს შესაძლებელია. მესამე, მიიღწევა ფერმენტის სრული გაჯერება სუბსტრატით. ეს წერტილი განსაკუთრებით მნიშვნელოვანია, რადგან სუბსტრატის დაბალი კონცენტრაციის დროს, ყველა ფერმენტის მოლეკულა არ მონაწილეობს რეაქციაში (ნახ. 6.5, ა), რაც ნიშნავს, რომ შედეგი შორს იქნება შესაძლო მაქსიმუმისგან. კატალიზებული რეაქციის უდიდესი ძალა, სხვა თანაბარი მნიშვნელობის მქონე, მიიღწევა, თუ თითოეული ფერმენტის მოლეკულა მონაწილეობს ტრანსფორმაციაში, ე.ი. ფერმენტ-სუბსტრატის კომპლექსის მაღალ კონცენტრაციაზე (ნახ. 6.5, V).თუ სუბსტრატის კონცენტრაცია არ უზრუნველყოფს ფერმენტის სრულ გაჯერებას (ნახ. 6.5, ბ), მაშინ რეაქციის სიჩქარე არ აღწევს მაქსიმალურ მნიშვნელობას.
ბრინჯი. 65.
A -სუბსტრატის დაბალი კონცენტრაციის დროს; 6 - სუბსტრატის არასაკმარისი კონცენტრაციით; V -როდესაც ფერმენტი მთლიანად გაჯერებულია სუბსტრატით
ზემოაღნიშნულ პირობებში გაზომილი ფერმენტული რეაქციის სიჩქარე და სუბსტრატით ფერმენტის სრული გაჯერება ე.წ. ფერმენტული რეაქციის მაქსიმალური სიჩქარე (V).
ფერმენტული რეაქციის სიჩქარე, რომელიც განისაზღვრება მაშინ, როდესაც ფერმენტი არ არის მთლიანად გაჯერებული სუბსტრატით, აღინიშნება ვ.
ფერმენტების კატალიზი შეიძლება გამარტივდეს შემდეგი სქემით:

სადაც F არის ფერმენტი; S - სუბსტრატი; FS - ფერმენტ-სუბსტრატის კომპლექსი.
ამ პროცესის თითოეული ეტაპი ხასიათდება გარკვეული სიჩქარით. ფერმენტული რეაქციის სიჩქარის საზომი ერთეული არის სუბსტრატის მოლების რაოდენობა, რომლებიც გარდაიქმნება დროის ერთეულზე.(იგივე ნორმალური რეაქციის სიჩქარე).
ფერმენტის სუბსტრატთან ურთიერთქმედება იწვევს ფერმენტ-სუბსტრატის კომპლექსის წარმოქმნას, მაგრამ ეს პროცესი შექცევადია. წინა და საპირისპირო რეაქციების სიჩქარე დამოკიდებულია რეაქტიული ნივთიერებების კონცენტრაციაზე და აღწერილია შესაბამისი განტოლებით:
წონასწორობის მდგომარეობაში, განტოლება (6.3) მოქმედებს, რადგან წინა და საპირისპირო რეაქციების სიჩქარე თანაბარია.
წინა (6.1) და საპირისპირო (6.2) რეაქციების სიჩქარის მნიშვნელობების ჩანაცვლებით განტოლებაში (6.3), მივიღებთ ტოლობას:
წონასწორობის მდგომარეობა ხასიათდება შესაბამისი წონასწორობის მუდმივი K p,უდრის წინა და საპირისპირო რეაქციების მუდმივთა თანაფარდობას (6.5). წონასწორობის მუდმივის ორმხრივი ეწოდება სუბსტრატის მუდმივი Ks,ან ფერმენტ-სუბსტრატის კომპლექსის დისოციაციის მუდმივი:

(6.6) განტოლებიდან ირკვევა, რომ სუბსტრატის მუდმივი მცირდება ფერმენტ-სუბსტრატის კომპლექსის მაღალ კონცენტრაციებზე, ე.ი. დიდი სტაბილურობით. შესაბამისად, სუბსტრატის მუდმივი ახასიათებს ფერმენტისა და სუბსტრატის აფინურობას და სიჩქარის მუდმივთა თანაფარდობას ფერმენტ-სუბსტრატის კომპლექსის წარმოქმნისა და დისოციაციისთვის.
სუბსტრატით ფერმენტის გაჯერების ფენომენი შეისწავლეს ლეონორ მიქაელისმა და მოდ მეპტენმა. შედეგების მათემატიკური დამუშავების საფუძველზე მათ გამოიღეს განტოლება (6.7), რომელმაც მიიღო მათი სახელები, საიდანაც ნათელია, რომ სუბსტრატის მაღალი კონცენტრაციისა და სუბსტრატის მუდმივის დაბალი მნიშვნელობისას ფერმენტული რეაქციის სიჩქარე მიისწრაფვის მაქსიმუმამდე. . თუმცა, ეს განტოლება შეზღუდულია, რადგან ის არ ითვალისწინებს ყველა პარამეტრს:
ფერმენტ-სუბსტრატის კომპლექსი რეაქციის დროს შეიძლება განიცადოს ტრანსფორმაციები სხვადასხვა მიმართულებით:
- დაშლა ძირითად ნივთიერებებად;
- გარდაიქმნება პროდუქტად, საიდანაც ფერმენტი გამოყოფილია უცვლელად.
მაშასადამე, ფერმენტული პროცესის საერთო მოქმედების აღსაწერად, კონცეფცია მაიკლისის მუდმივები Kt,რომელიც გამოხატავს კავშირს ფერმენტული კატალიზის სამივე რეაქციის სიჩქარის მუდმივებს შორის (6.8). თუ ორივე ტერმინი იყოფა რეაქციის სიჩქარის მუდმივზე ფერმენტ-სუბსტრატის კომპლექსის ფორმირებისთვის, მივიღებთ გამოხატულებას (6.9):

მნიშვნელოვანი დასკვნა გამომდინარეობს განტოლებიდან (6.9): მიქაელის მუდმივა ყოველთვის მეტია სუბსტრატის მუდმივზე ოდენობით. k 2 /k v
რიცხობრივად კ ტუდრის სუბსტრატის კონცენტრაციას, რომლის დროსაც რეაქციის სიჩქარე არის მაქსიმალური შესაძლო სიჩქარის ნახევარი და შეესაბამება სუბსტრატით ფერმენტის გაჯერებას, როგორც ნახ. 6.5, ბ.ვინაიდან პრაქტიკაში ყოველთვის არ არის შესაძლებელი სუბსტრატით ფერმენტის სრული გაჯერების მიღწევა, ეს არის ზუსტად კ ტგამოიყენება ფერმენტების კინეტიკური მახასიათებლების შედარებითი დახასიათებისთვის.
ფერმენტული რეაქციის სიჩქარე, როდესაც ფერმენტი არ არის მთლიანად გაჯერებული სუბსტრატით (6.10), დამოკიდებულია ფერმენტ-სუბსტრატის კომპლექსის კონცენტრაციაზე. პროპორციულობის კოეფიციენტი არის რეაქციის მუდმივი ფერმენტისა და პროდუქტის გამოთავისუფლებისთვის, რადგან ეს ცვლის ფერმენტ-სუბსტრატის კომპლექსის კონცენტრაციას:
გარდაქმნების შემდეგ, ზემოაღნიშნული დამოკიდებულებების გათვალისწინებით, ფერმენტული რეაქციის სიჩქარე, როდესაც ფერმენტი სუბსტრატით ბოლომდე არ არის გაჯერებული, აღწერილია განტოლებით (6.11), ე.ი. დამოკიდებულია ფერმენტის, სუბსტრატის კონცენტრაციაზე და მათ აფინურობაზე K s:
ფერმენტული რეაქციის სიჩქარის გრაფიკული დამოკიდებულება სუბსტრატის კონცენტრაციაზე არ არის წრფივი. როგორც აშკარაა ნახ. 6.6, სუბსტრატის კონცენტრაციის მატებასთან ერთად, შეინიშნება ფერმენტის აქტივობის ზრდა. თუმცა, როდესაც სუბსტრატით ფერმენტის მაქსიმალური გაჯერება მიიღწევა, ფერმენტული რეაქციის სიჩქარე მაქსიმალური ხდება. ამიტომ რეაქციის სიჩქარის შემზღუდველი ფაქტორი არის ფერმენტ-სუბსტრატის კომპლექსის წარმოქმნა.
პრაქტიკამ აჩვენა, რომ სუბსტრატის კონცენტრაციები, როგორც წესი, გამოიხატება ერთიანობაზე გაცილებით ნაკლები მნიშვნელობებით (10 6 -10 3 მოლი). გამოთვლებში ასეთი რაოდენობით მუშაობა საკმაოდ რთულია. ამიტომ, G. Lineweaver და D. Burke შემოგვთავაზეს ფერმენტული რეაქციის სიჩქარის გრაფიკული დამოკიდებულების გამოხატვა არა პირდაპირ კოორდინატებში, არამედ შებრუნებულებში. ისინი გამოვიდნენ დაშვებიდან, რომ თანაბარი რაოდენობით მათი ინვერსიები ასევე ტოლია:

ბრინჯი. 6.6.
გამოხატვის (6.13) ტრანსფორმაციის შემდეგ ვიღებთ გამონათქვამს, რომელსაც ე.წ ლაინვივერ-ბურკის განტოლება (6.14):
Lineweaver-Burk განტოლების გრაფიკული დამოკიდებულება წრფივია (ნახ. 6.7). ფერმენტის კინეტიკური მახასიათებლები განისაზღვრება შემდეგნაირად:
- ორდინატთა ღერძზე მოწყვეტილი სეგმენტი უდრის 1/V;
- აბსცისის ღერძზე მოწყვეტილი სეგმენტი -1-ის ტოლია /თ.

ბრინჯი. 6.7.
ითვლება, რომ Lineweaver-Burk მეთოდი შესაძლებელს ხდის რეაქციის მაქსიმალური სიჩქარის უფრო ზუსტად განსაზღვრას, ვიდრე პირდაპირ კოორდინატებში. ღირებული ინფორმაცია ფერმენტების დათრგუნვის შესახებ ასევე შეიძლება მოიპოვოს ამ გრაფიკიდან.
მიქაელის-მენტენის განტოლების გარდაქმნის სხვა გზებიც არსებობს. გრაფიკული დამოკიდებულებები გამოიყენება ფერმენტულ პროცესზე სხვადასხვა გარეგანი გავლენის გავლენის შესასწავლად.
ფერმენტოლოგიის ეს ფილიალი სწავლობს სხვადასხვა ფაქტორების გავლენას ფერმენტული რეაქციის სიჩქარეზე. ერთი სუბსტრატის ერთ პროდუქტად გადაქცევის შექცევადი რეაქციის ფერმენტული კატალიზის ზოგადი განტოლების გათვალისწინებით (1),
ძირითადი ფაქტორები, რომლებიც გავლენას ახდენენ ფერმენტული რეაქციის სიჩქარეზე, უნდა დასახელდეს: სუბსტრატის კონცენტრაცია [S], ფერმენტის კონცენტრაცია [E] და რეაქციის პროდუქტის კონცენტრაცია [P].
ზოგიერთი ფერმენტის ურთიერთქმედება მათ სუბსტრატთან შეიძლება აღწერილი იყოს ფერმენტული რეაქციის V სიჩქარის დამოკიდებულების ჰიპერბოლური მრუდით სუბსტრატის [S] კონცენტრაციაზე (ნახ. 19):

სურ. 19. ფერმენტული რეაქციის სიჩქარის დამოკიდებულება სუბსტრატის კონცენტრაციაზე.
ამ მრუდზე შეიძლება გამოიყოს სამი მონაკვეთი, რაც აიხსნება ფერმენტის სუბსტრატთან ურთიერთქმედების მექანიზმის დებულებებით: OA - V-ის პირდაპირპროპორციული დამოკიდებულების მონაკვეთი [S]-ზე, ფერმენტის აქტიურ ცენტრებზე. თანდათან ივსება სუბსტრატის მოლეკულებით არასტაბილური კომპლექსური ES-ის წარმოქმნით; სექცია AB - V-ის მრუდი დამოკიდებულება [S]-ზე, ფერმენტის აქტიური ცენტრების სრული გაჯერება სუბსტრატის მოლეკულებით ჯერ არ არის მიღწეული. ES კომპლექსი არასტაბილურია გარდამავალი მდგომარეობის მიღწევამდე, E და S-ის საპირისპირო დისოციაციის ალბათობა ჯერ კიდევ მაღალია; მონაკვეთი BC - დამოკიდებულება აღწერილია ნულოვანი რიგის განტოლებით, მონაკვეთი პარალელურია [S] ღერძის, მიღწეულია აქტიური ფერმენტების სრული გაჯერება სუბსტრატის მოლეკულებით, V=V max.
მრუდის დამახასიათებელი ფორმა მათემატიკურად არის აღწერილი ბრიგს-ჰალდანის განტოლებით:
V=V მაქსიმალური ● [S]/კმ + [S] (2),
სადაც Km არის მიქაელის-მენტენის მუდმივი, რიცხობრივად ტოლია სუბსტრატის კონცენტრაციისა, რომლის დროსაც ფერმენტული რეაქციის სიჩქარე უდრის ნახევარ V max-ს.
რაც უფრო დაბალია ფერმენტის Km, მით უფრო მაღალია ფერმენტის აფინურობა სუბსტრატთან, მით უფრო სწრაფად მიიღწევა სუბსტრატის გარდამავალი მდგომარეობა და ის გადაიქცევა რეაქციის პროდუქტად. თითოეული ჯგუფისთვის სპეციფიკური ფერმენტის სუბსტრატისთვის Km-ის მნიშვნელობების პოვნა მნიშვნელოვანია უჯრედში ამ ფერმენტის ბიოლოგიური როლის დადგენაში.
ფერმენტების უმეტესობისთვის შეუძლებელია ჰიპერბოლური მრუდის აგება (ნახ. 19) ამ შემთხვევაში გამოიყენება ორმაგი რეციპროკალების მეთოდი (Lineweaver-Burk), ე.ი. გამოსახულია 1/[V]-ის გრაფიკული დამოკიდებულება 1/[S]-ზე (სურ. 20). ექსპერიმენტში ასეთი მრუდების აგების მეთოდი ძალიან მოსახერხებელია ფერმენტის აქტივობაზე სხვადასხვა ტიპის ინჰიბიტორების გავლენის შესწავლისას (იხილეთ შემდგომ ტექსტში).

სურ.20. გრაფიკი 1/[V] წინააღმდეგ 1/[S] (Lineweaver-Burk მეთოდი),
სადაც y არის ამოჭრილი განყოფილება - , და x არის ამოჭრილი განყოფილება -  , კუთხის α - ტანგენსი.
, კუთხის α - ტანგენსი.
ფერმენტული რეაქციის V სიჩქარის დამოკიდებულება ფერმენტის კონცენტრაციაზე [E].
ეს გრაფიკული დამოკიდებულება (ნახ. 21) განიხილება გარემოს ოპტიმალურ ტემპერატურაზე და pH-ზე, სუბსტრატის კონცენტრაციებზე მნიშვნელოვნად აღემატება ფერმენტის აქტიური ცენტრების გაჯერების კონცენტრაციას.

ბრინჯი. 21. ფერმენტის კონცენტრაციის გავლენა ფერმენტული რეაქციის სიჩქარეზე.
ფერმენტული რეაქციის სიჩქარის დამოკიდებულება კოფაქტორის ან კოენზიმის კონცენტრაციაზე.კომპლექსური ფერმენტებისთვის გასათვალისწინებელია, რომ ჰიპოვიტამინოზის დროს ვიტამინების კოენზიმური ფორმების დეფიციტი და ორგანიზმში ლითონის იონების შეყვანის დარღვევა აუცილებლად იწვევს კურსისთვის საჭირო შესაბამისი ფერმენტების კონცენტრაციის დაქვეითებას. მეტაბოლური პროცესები. აქედან გამომდინარე, უნდა დავასკვნათ, რომ ფერმენტის აქტივობა პირდაპირ არის დამოკიდებული კოფაქტორის ან კოენზიმის კონცენტრაციაზე.
პროდუქტის კონცენტრაციის გავლენა ფერმენტული რეაქციის სიჩქარეზე.ადამიანის ორგანიზმში წარმოქმნილი შექცევადი რეაქციებისთვის, გასათვალისწინებელია, რომ პირდაპირი რეაქციის პროდუქტები შეიძლება გამოყენებულ იქნას ფერმენტის მიერ, როგორც სუბსტრატები საპირისპირო რეაქციისთვის. ამიტომ, დინების მიმართულება და Vmax-ის მიღწევის მომენტი დამოკიდებულია საწყისი სუბსტრატებისა და რეაქციის პროდუქტების კონცენტრაციების თანაფარდობაზე. მაგალითად, ალანინ ამინოტრანსფერაზას აქტივობა, რომელიც ახდენს ტრანსფორმაციის კატალიზებას:
ალანინი + ალფა-კეტოგლუტარატი ↔ პირუვატი + გლუტამატი
დამოკიდებულია უჯრედში კონცენტრაციის თანაფარდობაზე:
[ალანინი + ალფა-კეტოგლუტარატი] / [პირუვატი + გლუტამატი].
ფერმენტების მოქმედების მექანიზმი. ფერმენტების კატალიზის თეორიები
ფერმენტები, ისევე როგორც არაცილოვანი კატალიზატორები, ზრდის ქიმიური რეაქციის სიჩქარეს ამ რეაქციის აქტივაციის ენერგიის შემცირების უნარის გამო. ფერმენტული რეაქციის აქტივაციის ენერგია გამოითვლება, როგორც სხვაობა მიმდინარე რეაქციის სისტემაში ენერგიის მნიშვნელობასა და რეაქციის დასაწყისში განსაზღვრულ ენერგიას შორის (იხ. გრაფიკული დამოკიდებულება ნახ. 22).

ბრინჯი. 22. ქიმიური რეაქციის ენერგეტიკული მდგომარეობის გრაფიკული დამოკიდებულება ფერმენტის გარეშე (1) და ფერმენტის (2) არსებობისას რეაქციის დროზე.
ვ. ჰენრის და, კერძოდ, ლ. მიქაელის, მ. მენტენის ნაშრომმა მონოსუბსტრატის შექცევადი ფერმენტული რეაქციების მექანიზმის შესწავლაზე შესაძლებელი გახადა პოსტულაცია, რომ ფერმენტ E პირველად შექცევადად და შედარებით სწრაფად ერწყმის თავის სუბსტრატს S-ს ფერმენტის წარმოქმნით. სუბსტრატის კომპლექსი (ES):
E+S<=>ES (1)
ES-ის წარმოქმნა ხდება წყალბადის ბმების, ელექტროსტატიკური, ჰიდროფობიური ურთიერთქმედების, ზოგიერთ შემთხვევაში კოვალენტური, საკოორდინაციო ბმების გამო, აქტიური ცენტრის ამინომჟავის ნარჩენების გვერდით რადიკალებსა და სუბსტრატის ფუნქციურ ჯგუფებს შორის. კომპლექსურ ფერმენტებში სუბსტრატთან კონტაქტის ფუნქცია შეიძლება შეასრულოს სტრუქტურის არაცილოვანმა ნაწილმაც.
შემდეგ ფერმენტ-სუბსტრატის კომპლექსი იშლება მეორე, უფრო ნელ, შექცევად რეაქციაში, რათა წარმოქმნას რეაქციის პროდუქტი P და თავისუფალი ფერმენტი E:
ES<=>EP<=>E+P (2)
ამჟამად, ზემოხსენებული მეცნიერების, ისევე როგორც კეილინ დ., ჩენს ბ., კოშლანდი დ. („გამოწვეული კორესპონდენციის თეორია“) მუშაობის წყალობით, არსებობს თეორიული დებულებები მოქმედების მექანიზმში ოთხი ძირითადი პუნქტის შესახებ. სუბსტრატზე არსებული ფერმენტი, რომელიც განსაზღვრავს ფერმენტების უნარს დააჩქაროს ქიმიური რეაქციები:
1. ორიენტაცია და მიდგომა . ფერმენტს შეუძლია სუბსტრატის მოლეკულის შებოჭვა ისე, რომ ფერმენტის მიერ თავდასხმული ბმა არა მხოლოდ კატალიზური ჯგუფის სიახლოვეს მდებარეობს, არამედ სწორად არის ორიენტირებული მის მიმართ. საგრძნობლად გაიზარდა ალბათობა იმისა, რომ ES კომპლექსი მიაღწიოს გარდამავალ მდგომარეობას ორიენტაციისა და სიახლოვის გზით.
2. სტრესი და დაძაბულობა : გამოწვეული მიმოწერა. სუბსტრატის მიმაგრებამ შეიძლება გამოიწვიოს კონფორმაციული ცვლილებები ფერმენტის მოლეკულაში, რაც იწვევს აქტიური ცენტრის სტრუქტურაში დაძაბულობას და ასევე გარკვეულწილად დეფორმირებს შეკრული სუბსტრატს, რითაც ხელს უწყობს ES კომპლექსის მიერ გარდამავალი მდგომარეობის მიღწევას. E და S მოლეკულებს შორის წარმოიქმნება ეგრეთ წოდებული ინდუცირებული კორესპონდენცია.
ფერმენტული რეაქციების სიჩქარე დამოკიდებულია ფერმენტის კონცენტრაციაზე, სუბსტრატს, ტემპერატურაზე, pH-ზე და აქტივატორებისა და ინჰიბიტორების არსებობაზე.
ჭარბი სუბსტრატის პირობებში, რეაქციის სიჩქარე პირდაპირპროპორციულია ფერმენტის კონცენტრაცია (ნახ. 3.2).
ბრინჯი. 3.2. რეაქციის სიჩქარის დამოკიდებულება ფერმენტის კონცენტრაციაზე.
რეაქციის სიჩქარის დამოკიდებულება სუბსტრატის კონცენტრაცია წარმოდგენილია სურათზე 3.3.
ბრინჯი. 3.3. რეაქციის სიჩქარის დამოკიდებულება სუბსტრატის კონცენტრაციაზე.
გრაფიკზე არის 3 განყოფილება. სუბსტრატის დაბალი კონცენტრაციისას (განყოფილება ა) რეაქციის სიჩქარე პირდაპირპროპორციულია სუბსტრატის კონცენტრაციისა და ემორჩილება პირველი რიგის კინეტიკას. მდებარეობა ჩართულია ბ(შერეული რიგის რეაქცია) ეს დამოკიდებულება ირღვევა. მდებარეობა ჩართულია გრეაქციის სიჩქარე მაქსიმალურია და არ არის დამოკიდებული სუბსტრატის კონცენტრაციაზე.
ფერმენტული რეაქცია ხასიათდება ფერმენტ-სუბსტრატის კომპლექსის წარმოქმნით, რომელიც იშლება თავისუფალი ფერმენტისა და რეაქციის პროდუქტის წარმოქმნით.
ამ განტოლებაში k 1 არის ფერმენტ-სუბსტრატის კომპლექსის წარმოქმნის სიჩქარის მუდმივი, k 2 არის ფერმენტ-სუბსტრატის კომპლექსის დისოციაციის მუდმივი თავისუფალი ფერმენტისა და სუბსტრატის შესაქმნელად, ხოლო k 3 არის დისოციაციის სიჩქარის მუდმივი. ფერმენტ-სუბსტრატის კომპლექსი თავისუფალი ფერმენტისა და რეაქციის პროდუქტზე.
მიქაელისმა და მენტენმა შემოგვთავაზეს განტოლება, რომელიც აღწერს რეაქციის სიჩქარის დამოკიდებულებას სუბსტრატის კონცენტრაციაზე.
v არის რეაქციის სიჩქარე მოცემული სუბსტრატის კონცენტრაციაზე; Ks – ფერმენტ-სუბსტრატის კომპლექსის დისოციაციის მუდმივი; Vmax - მაქსიმალური რეაქციის სიჩქარე.
Ks=k -2 /k 1 ე.ი. საპირისპირო რეაქციის მუდმივის შეფარდება წინა რეაქციის მუდმივთან.
თუმცა, ეს განტოლება აღწერს მხოლოდ მონაკვეთს აგრაფიკზე და არ ითვალისწინებს რეაქციის პროდუქტების გავლენას ფერმენტული პროცესის სიჩქარეზე.
ჰალდანმა და ბრიგსმა შეცვალეს დისოციაციის მუდმივა განტოლებაში მიქაელისის მუდმივით (კმ).
მიქაელის მუდმივირიცხობრივად სუბსტრატის კონცენტრაციის ტოლია, რომლის დროსაც რეაქციის სიჩქარე მაქსიმუმის ნახევარია. მიქაელის მუდმივი ახასიათებს ფერმენტისა და სუბსტრატის აფინურობას. ფერმენტის მაღალი აფინურობა სუბსტრატის მიმართ ხასიათდება დაბალი Km მნიშვნელობით და პირიქით.
მიქაელისა და მენტენის მიერ შემოთავაზებული გრაფიკის გამოყენება მოუხერხებელია. უფრო მოსახერხებელი გრაფიკული წარმოდგენისთვის G. Lineweaver-მა და D. Burke-მ შეცვალეს ჰალდანისა და ბრიგსის განტოლება ორმაგი რეციპროკალების მეთოდის გამოყენებით, იმ პრინციპზე დაყრდნობით, რომ თუ ორ სიდიდეს შორის თანასწორობაა, მაშინ რეციპროკალებიც ტოლი იქნება.
რეაქციის სიჩქარის დამოკიდებულების გრაფიკული წარმოდგენა pH აქვს ზარის ფორმა. pH მნიშვნელობა, რომლის დროსაც ფერმენტი ავლენს მაქსიმალურ აქტივობას, ეწოდება ოპტიმალური pH(ნახ. 5.4 A) . ფერმენტების უმეტესობისთვის ოპტიმალური pH არის 6-8. გამონაკლისი არის პეპსინი, რომლის ოპტიმალურია 2.0. როდესაც pH იცვლება ამა თუ იმ მიმართულებით ოპტიმალურიდან, რეაქციის სიჩქარე მცირდება ფერმენტისა და სუბსტრატის ფუნქციური ჯგუფების იონიზაციის გამო, რაც არღვევს ფერმენტ-სუბსტრატის კომპლექსის წარმოქმნას.
ბრინჯი. 3.4. რეაქციის სიჩქარის დამოკიდებულება pH-ზე (A) და ტემპერატურაზე (B).
ქიმიური რეაქციის სიჩქარე მატებასთან ერთად 2-ჯერ იზრდება ტემპერატურა 10°C-ით. თუმცა, ფერმენტის ცილოვანი ბუნების გამო, ტემპერატურის შემდგომი მატებასთან ერთად, ხდება ფერმენტის დენატურაცია. ტემპერატურა, რომლის დროსაც რეაქციის სიჩქარე მაქსიმალურია, ეწოდება ტემპერატურა ოპტიმალური(ნახ. 3.4. B) . ფერმენტების უმეტესობისთვის ოპტიმალური ტემპერატურაა 37-40°C. გამონაკლისია კუნთების მიოკინაზა, რომელიც უძლებს 100°C-მდე გათბობას.
ფერმენტის აქტივატორები– ეს არის ნივთიერებები 1), რომლებიც ქმნიან ფერმენტის აქტიურ ცენტრს (Co 2+, Mg 2+, Zn 2+, Fe 2+, Ca 2+); 2) ფერმენტ-სუბსტრატის კომპლექსის წარმოქმნის ხელშეწყობა (Mg 2+); 3) SH ჯგუფების შემცირება (გლუტათიონი, ცისტეინი, მერკაპტოეთანოლი); 4) ცილა-ფერმენტის მშობლიური სტრუქტურის სტაბილიზაცია. ფერმენტული რეაქციები ჩვეულებრივ აქტიურდება კათიონებით (პერიოდიულ ცხრილში 19-დან 30-მდე). ანიონები ნაკლებად აქტიურია, თუმცა ქლორის იონებს და ზოგიერთი სხვა ჰალოგენის ანიონებს შეუძლიათ გაააქტიურონ პეპსინი, ამილაზა და ადენილატ ციკლაზა. პროტეინები შეიძლება იყოს აქტივატორები: აპოპროტეინი A-I (LCAT), აპოპროტეინი C-II (LPL).
აქტივატორების მოქმედების მექანიზმი:
1) მონაწილეობა ფერმენტების აქტიური ცენტრის ფორმირებაში;
2) ხელი შეუწყოს სუბსტრატისა და ფერმენტის შეკავშირებას;
3) მონაწილეობა ფერმენტის მშობლიური სტრუქტურის ფორმირებაში.
ინჰიბიტორები- ნივთიერებები, რომლებიც იწვევენ ფერმენტების მიერ კატალიზებული რეაქციების ნაწილობრივ ან სრულ დათრგუნვას.
ინჰიბიტორები იყოფა არასპეციფიკურიდა კონკრეტული. არასპეციფიკური ინჰიბიტორების მოქმედება არ არის დაკავშირებული ფერმენტების მოქმედების მექანიზმთან. ეს ინჰიბიტორები იწვევენ ფერმენტის ცილის დენატურაციას (სითბო, მჟავები, ტუტეები, მძიმე ლითონების მარილები და ა.შ.).
სპეციფიკური ინჰიბიტორები გავლენას ახდენენ ფერმენტების მოქმედების მექანიზმზე. სპეციფიკური ინჰიბიტორები იყოფა 2 ჯგუფად: შექცევადი და შეუქცევადი. შეუქცევადი ინჰიბიტორები იწვევენ ფერმენტის ფუნქციური ჯგუფების მუდმივ, შეუქცევად ცვლილებას ან ცვლილებას მჭიდრო ან კოვალენტური შეკავშირების გზით. ამ ჯგუფში შედის: 1) ლითონის ინჰიბიტორებიფერმენტები (HCN, RCN, HF, CO და სხვ.). ეს ნაერთები უკავშირდებიან ცვლადი ვალენტობის მქონე ლითონებს (Cu ან Fe), რის შედეგადაც ირღვევა ფერმენტების სასუნთქი ჯაჭვის გასწვრივ ელექტრონების გადაცემის პროცესი. ამიტომ ამ ინჰიბიტორებს რესპირატორულ შხამებს უწოდებენ. 2) SH ჯგუფების შემცველი ფერმენტების ინჰიბიტორები(მონოიდოაცეტატი, დიიოდოაცეტატი, იოდოაცეტამიდი, დარიშხანის და ვერცხლისწყლის ნაერთები). 3) აქტიურ ცენტრში OH ჯგუფის შემცველი ფერმენტების ინჰიბიტორები (ორგანოფოსფორის ნაერთები, ინსექტიციდები). ეს ინჰიბიტორები, უპირველეს ყოვლისა, თრგუნავენ ქოლინესტერაზას აქტივობას, ფერმენტს, რომელიც მთავარ როლს ასრულებს ნერვული სისტემის აქტივობაში.
შექცევადიდათრგუნვა შეიძლება რაოდენობრივად განისაზღვროს მაიკლის-მენტენის განტოლების გამოყენებით. შექცევადი ინჰიბიტორები იყოფა კონკურენტუნარიანი და არაკონკურენტული.
კონკურენტული ინჰიბიტორები- ეს არის სუბსტრატის აგებულებით მსგავსი ნივთიერებები. ინჰიბიტორი უკავშირდება ფერმენტის აქტიურ ადგილს და ხელს უშლის ფერმენტ-სუბსტრატის კომპლექსის წარმოქმნას.
კონკურენტული ინჰიბირების კლასიკური მაგალითია სუქცინატდეჰიდროგენაზას ინჰიბირება მალონის მჟავით. სუქცინატდეჰიდროგენაზა კატალიზებს სუქცინის მჟავას (სუკცინატის) დაჟანგვას დეჰიდროგენაციის გზით ფუმარინის მჟავამდე.
თუ მალონის მჟავას (ინჰიბიტორს) დაემატება საშუალო, მაშინ, მისი სტრუქტურული მსგავსების შედეგად ჭეშმარიტ სუქცინატ სუქცინატთან, ის რეაგირებს აქტიურ ადგილზე და წარმოქმნის ფერმენტ-ინჰიბიტორ კომპლექსს, მაგრამ რეაქცია არ მოხდება.
ინჰიბიტორის ეფექტი აღმოიფხვრება სუბსტრატის კონცენტრაციის გაზრდა. კონკურენტული ინჰიბიციით, ფერმენტული რეაქციების კინეტიკა იცვლება: კმ იზრდება, V max რჩება მუდმივი(ნახ. 3.5).
ბრინჯი. 3.5. კონკურენტული ინჰიბიტორების მოქმედება ფერმენტული რეაქციის სიჩქარეზე
კონკურენტული ინჰიბირების მეთოდმა იპოვა გამოყენება სამედიცინო პრაქტიკაში, როგორც ანტიმეტაბოლიტები.
მაგალითად, სულფონამიდური პრეპარატები გამოიყენება ბაქტერიებით გამოწვეული ზოგიერთი ინფექციური დაავადების სამკურნალოდ. ეს პრეპარატები სტრუქტურულად ჰგავს პარაამინობენზოის მჟავას, რომელსაც ბაქტერიული უჯრედი იყენებს ფოლიუმის მჟავას სინთეზისთვის, რომელიც აუცილებელია ბაქტერიების სიცოცხლისთვის. ამ სტრუქტურული მსგავსების გამო, სულფონამიდი ბლოკავს ფერმენტის მოქმედებას კომპლექსიდან პარაამინობენზოის მჟავის გადაადგილებით იმ ფერმენტთან, რომელიც ასინთეზირებს ფოლიუმის მჟავას.
არაკონკურენტული ინჰიბიტორები -ნივთიერებები, რომლებიც სტრუქტურულად არ ჰგავს სუბსტრატებს. არაკონკურენტული ინჰიბიტორები უკავშირდება არა აქტიურ ადგილს, არამედ ფერმენტის მოლეკულის სხვა ადგილს, მაგალითად, ალოსტერულ ცენტრში. ეს ცვლის აქტიური ცენტრის კონფორმაციას ისე, რომ ირღვევა სუბსტრატის ურთიერთქმედება მასთან.
არაკონკურენტული ინჰიბირებისთვის: V max მცირდება, მაგრამ K m არ იცვლება(ნახ. 3.6).