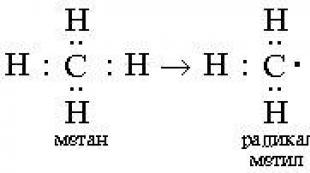Reacții chimice în tabelul de chimie organică. Tipuri de reacții chimice în chimia organică - Knowledge Hypermarket. Clasificarea reacțiilor chimice după mecanisme
CH 3 -CH 3 + Cl 2 – (hv) ---- CH 3 -CH 2 Cl + HCl
C 6 H 5 CH 3 + Cl 2 --- 500 C --- C 6 H 5 CH 2 Cl + HCl
Reacții de adaos
Astfel de reacții sunt tipice pentru compușii organici care conțin legături multiple (duble sau triple). Reacțiile de acest tip includ reacții de adăugare de halogeni, halogenuri de hidrogen și apă la alchene și alchine
CH3 -CH=CH2 + HCI ---- CH3 -CH(Cl)-CH3
Reacții de eliminare
Acestea sunt reacții care duc la formarea de legături multiple. La eliminarea halogenurilor de hidrogen și a apei se observă o anumită selectivitate a reacției, descrisă de regula lui Zaitsev, conform căreia un atom de hidrogen este eliminat din atomul de carbon la care există mai puțini atomi de hidrogen. Exemplu de reacție
CH3-CH(Cl)-CH2-CH3 + KOH →CH3-CH=CH-CH3 + HCI
Polimerizare și policondensare
n(CH 2 =CHCl) (-CH 2 -CHCl)n
Redox
Cea mai intensă dintre reacțiile oxidative este arderea, o reacție caracteristică tuturor claselor de compuși organici. În acest caz, în funcție de condițiile de ardere, carbonul este oxidat în C (funingine), CO sau CO 2, iar hidrogenul este transformat în apă. Cu toate acestea, pentru chimiștii organici, reacțiile de oxidare efectuate în condiții mult mai blânde decât arderea sunt de mare interes. Agenți oxidanți utilizați: soluții de Br2 în apă sau Cl2 în CCl 4 ; KMnO4 în apă sau acid diluat; oxid de cupru; hidroxizi de argint (I) sau cupru (II) proaspăt precipitați.
3C 2 H 2 + 8KMnO 4 +4H 2 O→3HOOC-COOH + 8MnO 2 + 8KOH
Esterificare (și reacția sa de hidroliză inversă)
R 1 COOH + HOR 2 H+ R 1 COOR 2 + H 2 O
Cicloadiția
Y R Y-R
‖ + ‖ → ǀ ǀ
R Y R-Y
‖ + →
11. Clasificarea reacțiilor organice după mecanism. Exemple.
Mecanismul de reacție implică o descriere detaliată pas cu pas a reacțiilor chimice. În același timp, se stabilește ce legături covalente sunt rupte, în ce ordine și în ce fel. Formarea de noi legături în timpul procesului de reacție este de asemenea descrisă cu atenție. Când luați în considerare mecanismul de reacție, în primul rând, acordați atenție metodei de rupere a legăturii covalente din molecula care reacţionează. Există două astfel de moduri - homolitic și heterolitic.
Reacții radicale se procedează prin scindarea homolitică (radicală) a unei legături covalente:

Legăturile covalente nepolare sau cu polar scăzut (C–C, N–N, C–H) suferă clivaj radical la temperaturi ridicate sau sub influența luminii. Carbonul din radicalul CH 3 are 7 electroni exteriori (în loc de un înveliș octet stabil în CH 4). Radicalii sunt instabili; au tendința de a capta electronul lipsă (până la o pereche sau până la un octet). Una dintre modalitățile de a forma produse stabile este dimerizarea (combinația a doi radicali):
CH3 + CH3CH3 : CH 3,
N + N N : N.
Reacții radicale - acestea sunt, de exemplu, reacțiile de clorurare, bromurare și nitrare a alcanilor:

Reacții ionice apar cu clivajul legăturii heterolitice. În acest caz, se formează intermediar ionii organici de scurtă durată - carbocationi și carbanioni - cu sarcină pe atomul de carbon. În reacțiile ionice, perechea de electroni de legătură nu este separată, ci trece în întregime la unul dintre atomi, transformându-l într-un anion:

Legăturile puternic polare (H–O, C–O) și ușor polarizabile (C–Br, C–I) sunt predispuse la clivaj heterolitic.
Distinge reacții nucleofile (nucleofil– căutând nucleul, un loc cu lipsă de electroni) și reacții electrofile (electrofil– cautarea electronilor). Afirmația că o anumită reacție este nucleofilă sau electrofilă se referă întotdeauna la reactiv. Reactiv– o substanță care participă la reacție cu o structură mai simplă. Substratul– o substanță inițială cu o structură mai complexă. Grup ieșitor este un ion înlocuibil care a fost legat de carbon. Produs de reacție– substanță nouă care conține carbon (scrisă în partea dreaptă a ecuației reacției).
LA reactivi nucleofili(nucleofilii) includ ioni încărcați negativ, compuși cu perechi singure de electroni, compuși cu legături duble carbon-carbon. LA reactivi electrofili(electrofilii) includ ioni încărcați pozitiv, compuși cu învelișuri de electroni neumplute (AlCl 3, BF 3, FeCl 3), compuși cu grupări carbonil, halogeni. Electrofilii sunt orice atom, moleculă sau ion capabil să adauge o pereche de electroni în procesul de formare a unei noi legături. Forța motrice a reacțiilor ionice este interacțiunea ionilor încărcați opus sau a fragmentelor de molecule diferite cu o sarcină parțială (+ și –).
Exemple de diferite tipuri de reacții ionice.
Substituția nucleofilă :
Substituție electrofilă :
Adăugarea nucleofilă (CN – se adaugă mai întâi, apoi H +):

Conexiune electrofilă (Se adaugă mai întâi H +, apoi X –):

Eliminarea prin acțiunea nucleofililor (bazelor) :
Eliminare la acțiune electrofili (acizi) :
Când apar reacții chimice, unele legături se rup, iar altele se formează. Reacțiile chimice sunt împărțite în mod convențional în organice și anorganice. Reacțiile organice sunt considerate a fi reacții în care cel puțin unul dintre reactanți este un compus organic care își schimbă structura moleculară în timpul reacției. Diferența dintre reacțiile organice și cele anorganice este că, de regulă, moleculele sunt implicate în ele. Viteza unor astfel de reacții este scăzută, iar randamentul produsului este de obicei de numai 50-80%. Pentru a crește viteza de reacție, se folosesc catalizatori și se crește temperatura sau presiunea. În continuare, vom lua în considerare tipurile de reacții chimice din chimia organică.
Clasificarea după natura transformărilor chimice
- Reacții de substituție
- Reacții de adaos
- Reacția de izomerizare și rearanjare
- Reacții de oxidare
- Reacții de descompunere
Reacții de substituție
În timpul reacțiilor de substituție, un atom sau un grup de atomi din molecula inițială este înlocuit cu alți atomi sau grupuri de atomi, formând o nouă moleculă. De regulă, astfel de reacții sunt caracteristice hidrocarburilor saturate și aromatice, de exemplu:
Reacții de adaos
Când apar reacții de adiție, o moleculă a unui nou compus se formează din două sau mai multe molecule de substanțe. Astfel de reacții sunt tipice pentru compușii nesaturați. Există reacții de hidrogenare (reducere), halogenare, hidrohalogenare, hidratare, polimerizare etc.:
- Hidrogenarea– adăugarea unei molecule de hidrogen:
Reacția de eliminare
Ca urmare a reacțiilor de eliminare, moleculele organice pierd atomi sau grupuri de atomi și se formează o substanță nouă care conține una sau mai multe legături multiple. Reacțiile de eliminare includ reacții dehidrogenare, deshidratare, dehidrohalogenareși așa mai departe.:
Reacții de izomerizare și rearanjare
În timpul unor astfel de reacții, are loc rearanjarea intramoleculară, adică. tranziția atomilor sau a grupurilor de atomi de la o parte a moleculei la alta fără a modifica formula moleculară a substanței care participă la reacție, de exemplu: 

Reacții de oxidare
Ca urmare a expunerii la un reactiv oxidant, starea de oxidare a carbonului într-un atom organic, moleculă sau ion crește din cauza pierderii de electroni, ducând la formarea unui nou compus: 
Reacții de condensare și policondensare
Constă în interacțiunea mai multor (două sau mai multe) compuși organici cu formarea de noi legături C-C și a unui compus cu greutate moleculară mică:
Policondensarea este formarea unei molecule de polimer din monomeri care conțin grupări funcționale cu eliberarea unui compus cu greutate moleculară mică. Spre deosebire de reacțiile de polimerizare, care au ca rezultat formarea unui polimer având o compoziție similară monomerului, ca urmare a reacțiilor de policondensare, compoziția polimerului rezultat diferă de monomerul său:
Reacții de descompunere
Acesta este procesul de descompunere a unui compus organic complex în substanțe mai puțin complexe sau simple:

C18H38 → C9H18 + C9H20
Clasificarea reacțiilor chimice după mecanisme
Reacțiile care implică ruperea legăturilor covalente în compușii organici sunt posibile prin două mecanisme (adică o cale care duce la ruperea unei legături vechi și formarea uneia noi) - heterolitic (ionic) și homolitic (radical).
Mecanism heterolitic (ionic).
În reacțiile care au loc conform mecanismului heterolitic, se formează particule intermediare de tip ionic cu un atom de carbon încărcat. Particulele care poartă o sarcină pozitivă se numesc carbocationi, iar cele negative se numesc carbanioni. În acest caz, nu are loc ruperea perechii de electroni comune, ci trecerea acesteia la unul dintre atomi, cu formarea unui ion: 
Puternic polar, de exemplu H–O, C–O și ușor polarizabile, de exemplu legăturile C–Br, C–I prezintă o tendință de clivaj heterolitic.
Reacțiile care au loc conform mecanismului heterolitic sunt împărțite în nucleofil şi electrofilă reactii. Un reactiv care are o pereche de electroni pentru a forma o legătură se numește nucleofil sau donator de electroni. De exemplu, HO-, RO-, CI-, RCOO-, CN-, R-, NH2, H20, NH3, C2H5OH, alchene, arene.
Un reactiv care are un înveliș de electroni neumplut și este capabil să atașeze o pereche de electroni în procesul de formare a unei noi legături Următorii cationi sunt numiți reactivi electrofili: H +, R 3 C +, AlCl 3, ZnCl 2, SO 3 , BF3, R-CI, R2C=0
Reacții de substituție nucleofilă
Caracteristică pentru halogenuri de alchil și arii: 
Reacții de adiție nucleofile 
Reacții de substituție electrofilă

Reacții de adiție electrofile 
Homolitic (mecanism radical)
În reacțiile care decurg conform mecanismului omolitic (radical), în prima etapă legătura covalentă este ruptă cu formarea de radicali. Radicalul liber rezultat acționează apoi ca un reactiv de atac. Scindarea legăturilor printr-un mecanism radical este tipică pentru legăturile covalente nepolare sau cu polar scăzut (C–C, N–N, C–H).
Distingeți între reacțiile de substituție radicală și reacțiile de adiție radicalică
Reacții de deplasare radicală
Caracteristic alcanilor 
Reacții de adiție radicală
Caracteristic alchenelor și alchinelor 
Astfel, am examinat principalele tipuri de reacții chimice din chimia organică
Categorii,În timpul reacției, unele legături chimice din moleculele substanțelor care reacţionează sunt rupte, iar altele se formează. Reacțiile organice sunt clasificate în funcție de tipul de rupere a legăturilor chimice din particulele care reacţionează. Dintre acestea, se pot distinge două grupuri mari de reacții - radicale și ionice.
Reacțiile radicale sunt procese care implică scindarea homolitică a unei legături covalente. În clivajul homolitic, perechea de electroni care formează legătura este împărțită în așa fel încât fiecare dintre particulele rezultate să primească un electron. Ca rezultat al clivajului omolitic, se formează radicali liberi:
Un atom sau o particulă neutră cu un electron nepereche se numește radical liber.
Reacțiile ionice sunt procese care implică scindarea heterolitică a legăturilor covalente, când ambii electroni de legătură rămân cu una dintre particulele legate anterior:
Ca urmare a clivajului legăturii heterolitice, se obțin particule încărcate: nucleofile și electrofile.
O particulă nucleofilă (nucleofilă) este o particulă care are o pereche de electroni la nivelul electronilor exterior. Datorită unei perechi de electroni, un nucleofil este capabil să formeze o nouă legătură covalentă.
O particulă electrofilă (electrofilă) este o particulă care are un nivel exterior de electroni neumplut. Un electrofil prezintă orbitali neumpluți, liberi pentru formarea unei legături covalente datorită electronilor particulei cu care interacționează.
În chimia organică, toate modificările structurale sunt considerate în raport cu atomul (sau atomii) de carbon implicați în reacție.
În conformitate cu cele de mai sus, clorurarea metanului sub influența luminii este clasificată ca substituție radicalică, adăugarea de halogeni la alchene ca adiție electrofilă și hidroliza halogenurilor de alchil ca substituție nucleofilă.
Cele mai frecvente tipuri de reacții sunt:
Tipuri de bază de reacții chimice
eu. Reacții de substituție(înlocuirea unuia sau mai multor atomi de hidrogen cu atomi de halogen sau un grup special) RCH 2 X + Y → RCH 2 Y + X
II. Reacții de adaos RCH=CH2 + XY → RCHX−CH2Y
III. Reacții de eliminare RCHX−CH 2 Y → RCH=CH 2 + XY
IV. Reacții de izomerizare (rearanjare).
V. Reacții de oxidare(interacțiune cu oxigenul atmosferic sau cu agentul oxidant)
În aceste tipuri de reacții de mai sus, se disting și ele de specialitateȘi personalizate reactii.
De specialitate:
1) hidrogenare (interacțiune cu hidrogenul)
2) dehidrogenare (eliminare dintr-o moleculă de hidrogen)
3) halogenare (interacțiune cu halogen: F 2, Cl 2, Br 2, I 2)
4) dehalogenare (eliminare dintr-o moleculă de halogen)
5) hidrohalogenare (interacțiune cu halogenură de hidrogen)
6) dehidrohalogenare (eliminare dintr-o moleculă de halogenură de hidrogen)
7) hidratare (interacțiune cu apa într-o reacție ireversibilă)
8) deshidratare (clivare dintr-o moleculă de apă)
9) hidroliza (interacțiunea cu apa într-o reacție reversibilă)
10) polimerizare (producerea unui schelet de carbon mai mare din compuși simpli identici)
11) policondensare (obținerea unui schelet de carbon mărit multiplu din doi compuși diferiți)
12) sulfonare (reacție cu acid sulfuric)
13) nitrare (interacțiune cu acidul azotic)
14) fisurare (reducerea scheletului de carbon)
15) piroliza (descompunerea substanţelor organice complexe în altele mai simple sub influenţa temperaturilor ridicate)
16) reacție de alchilare (introducerea unui radical alcan în formulă)
17) reacția de acilare (introducerea grupării –C(CH 3)O în formulă)
18) reacție de aromatizare (formarea de hidrocarburi a unui număr de arene)
19) reacția de decarboxilare (eliminarea grupării carboxil -COOH) din moleculă
20) reacție de esterificare (interacțiunea unui alcool cu un acid sau producerea unui ester dintr-un alcool sau acid carboxilic)
21) reacție „oglindă de argint” (interacțiune cu o soluție de amoniac de oxid de argint (I))
Reacții nominale:
1) Reacția Wurtz (alungirea scheletului de carbon în timpul interacțiunii unei hidrocarburi halogenate cu un metal activ)
2) Reacția lui Kucherov (producția de aldehidă prin reacția acetilenei cu apa)
3) Reacția Konovalov (interacțiunea unui alcan cu acid azotic diluat)
4) Reacția Wagner (oxidarea hidrocarburilor cu o legătură dublă de către oxigen a agentului de oxidare într-un mediu slab alcalin sau neutru în condiții normale)
5) Reacția Lebedev (dehidrogenarea și deshidratarea alcoolilor pentru a produce alcadiene)
6) Reacția Friedel-Crafts (reacția de alchilare a unei arene cu un cloroalcan pentru a obține omologi de benzen)
7) Reacția Zelinsky (producția de benzen din ciclohexan prin dehidrogenare)
8) Reacția Kirchhoff (conversia amidonului în glucoză sub acțiunea catalitică a acidului sulfuric)
Instituție de învățământ bugetar municipal
„Școala medie nr. 19”
Michurinsk, regiunea Tambov
Tipuri de reacții chimice
Chimie anorganică
Golovkina Svetlana Alexandrovna,
profesor de chimie MBOU Școala Gimnazială Nr. 19, Michurinsk
Conţinut
Rezumat……………………………………………………………………………….3
Introducere…………………………………………………………………………………………… 4
Specificația testului…………………………………………………………….5
Teste clasa a IX-a………………………………………………………………………15
Teste clasa a XI-a……………………………………………………………………………………………24
Resurse informaționale……………………………………………………..33
Adnotare.
Această lucrare reflectă abordarea autorilor de a studia tipurile de reacții chimice din chimia organică. Materialul propus poate fi de interes pentru profesorii de chimie care lucrează în școlile primare și gimnaziale, deoarece oferă o generalizare a conceptelor de bază ale tipurilor de reacții chimice din chimia organică, ceea ce le va permite să se pregătească pentru Examenul de Stat și Statul Unificat. Material pentru examen și exersare pe această temă.
Introducere.
Materialul de chimie organică este greu de înțeles, mai ales în clasa a IX-a, unde se alocă foarte puțin timp studiului său, cu o cantitate mare de material teoretic. Întrebările despre chimia organică sunt incluse în KIM-urile Academiei de Științe de Stat și Examenul de stat unificat; atunci când pregătesc elevii pentru certificarea finală, profesorul se confruntă adesea cu o înțelegere greșită a acestui material. Puteți intensifica în mod activ procesul de predare și îmbunătăți calitatea asimilării chimiei organice prin utilizarea tehnologiilor moderne de predare în studiul său, de exemplu, utilizarea TIC, tehnologiile de control al testelor. În manual, profesorii își împărtășesc experiențele atunci când studiază materiale mici, dar complexe.
Specificarea testelor de pregătire pentru examenul de stat și examenul unificat de stat
Prescrierea testelor– evaluarea pregătirii educaționale generale a elevilor pe tipuri de reacții chimice.
Continuitatea conținutului materialului de testare - arată relația dintre conceptele de bază ale chimiei anorganice și organice.
Caracteristicile conținutului testului - Fiecare versiune a controlului de testare constă din trei părți și sarcini. Sarcinile de același nivel de complexitate și formă de prezentare sunt grupate în anumite părți ale lucrării.
Partea A conține 10 sarcini pentru alegerea unui răspuns de un nivel de complexitate de bază A1, A2 .... A10
Partea B conține 3 sarcini pentru alegerea unui răspuns de nivel de dificultate crescut B1, B2, B3
Partea C conține 1 sarcină nivel ridicat de complexitate.
Tabelul 1 Distribuția sarcinilor pe părți ale muncii.
Întrebări cu alegere multiplă Ei verifică partea principală a materialului studiat: limbajul științei chimice, legăturile chimice, cunoașterea proprietăților substanțelor organice, tipurile și condițiile reacțiilor chimice.
Sarcini cu un nivel crescut de dificultate Ei testează cunoștințele despre reacțiile redox la un nivel crescut. Lucrarea oferă sarcini cu variante multiple.
Executarea sarcinilor cu un nivel crescut de complexitate vă permite să diferențiați elevii în funcție de nivelul lor de pregătire și, pe această bază, să le acordați note mai mari.
Întrebări cu răspuns lung- cel mai dificil din test. Aceste sarcini testează asimilarea următoarelor elemente de conținut: cantitatea unei substanțe, volumul molar și masa molară a unei substanțe, fracția de masă a unei substanțe dizolvate.
4.Repartizarea sarcinilor de testare în funcție de conținut, abilități și tipuri de activități testate.
La stabilirea conținutului sarcinilor de testare s-a ținut cont de volumul fiecărui bloc de conținut ocupat la cursul de chimie.
5. Timp de livrare
45 de minute sunt alocate pentru finalizarea testului (1 lecție)
Distribuția aproximativă a timpului alocat pentru îndeplinirea sarcinilor individuale:
pentru fiecare sarcină din partea A până la 2 minute.
pentru fiecare sarcină din partea B până la 5 minute.
pentru fiecare sarcină din partea C până la 10 minute.
6. Sistem de evaluare a sarcinilor individuale și a muncii în ansamblu
Finalizarea corectă a fiecărei sarcini din partea A are 1 punct.
Finalizarea corectă a fiecărei sarcini din partea B are 2 puncte;
S-a făcut o eroare la unul dintre elementele de răspuns - 1 punct.
Finalizarea sarcinilor din partea C este variabilă, îndeplinirea corectă și completă a sarcinii C1 - 4 puncte,
Punctele primite de elevi pentru îndeplinirea tuturor sarcinilor sunt însumate. Evaluarea este acordată pe o scară de cinci puncte.
7. Gradul de evaluare:
0% - 25% - din punctele marcate cu „1”
26% - 50% - din „2” puncte marcate
51% - 75% - din punctele marcate cu „3”
76% - 85% - din punctele marcate cu „4”
86% - 100% - din punctele marcate cu „5”
Tipuri de reacții chimice în chimia organică
Reactie chimica - aceasta este o modificare a substanțelor în care se rup vechile legături chimice și se formează noi legături chimice între particulele (atomi, ioni) din care sunt construite substanțele.
Reacțiile chimice sunt clasificate:
1. După numărul și compoziția reactivilor și a produselor
Acest tip de reacție poate include reacții de izomerizare, care apar fără a modifica nu numai compoziția calitativă, ci și cantitativă a moleculelor de substanțe.![]()
Reacțiile de descompunere din chimia organică, spre deosebire de reacțiile de descompunere din chimia anorganică, au propriile lor specificități. Ele pot fi considerate procese inverse adăugării, deoarece de cele mai multe ori duc la formarea de legături sau cicluri multiple.
CH3-CH2-C=-CH CH3-C=-C-CH3
etil acetilenă dimetil acetilenă



Pentru a intra într-o reacție de adiție, o moleculă organică trebuie să aibă o legătură (sau ciclu) multiplă, această moleculă va fi principala (substrat). O moleculă mai simplă (adesea o substanță anorganică, un reactiv) este adăugată la locul unde legătura multiplă este ruptă sau inelul se deschide. Cel mai adesea, se formează mai multe legături sau cicluri.![]()



![]()
Trăsătura lor distinctivă este interacțiunea unei substanțe simple cu una complexă. Conceptul de „substituție” în chimia organică este mai larg decât în chimia anorganică. Dacă în molecula substanței inițiale orice atom sau grupare funcțională este înlocuit cu un alt atom sau grup, acestea sunt și reacții de substituție.

Reacțiile de schimb sunt reacții care au loc între substanțe complexe în care părțile lor constitutive schimbă locuri. De obicei, aceste reacții sunt considerate ionice. Reacțiile dintre ionii din soluțiile de electroliți decurg aproape complet spre formarea de gaze, precipitare și electroliți slabi.![]()

2. Prin efect termic
Reacțiile exoterme apar odată cu eliberarea de energie.
Acestea includ aproape toate reacțiile compuse.
Reacțiile exoterme care apar odată cu eliberarea luminii sunt clasificate ca reacții de ardere. Hidrogenarea etilenei este un exemplu de reacție exotermă. Funcționează la temperatura camerei.
Reacțiile endoterme apar cu absorbția energiei.
Evident, acestea vor include aproape toate reacțiile de descompunere,
CH2 =CH2 + H2 → CH3-CH3

3. În funcție de utilizarea catalizatorului
Ele funcționează fără catalizator.
Deoarece toate reacțiile biochimice care au loc în celulele organismelor vii au loc cu participarea unor catalizatori biologici speciali de natură proteică - enzime, toate sunt catalitice sau, mai precis, enzimatice.


4. După direcție
Ele curg simultan în două direcții opuse.
Majoritatea covârșitoare a acestor reacții sunt.
În chimia organică, semnul reversibilității este reflectat de numele - antonime ale proceselor:
hidrogenare - dehidrogenare,
hidratare - deshidratare,
polimerizare – depolimerizare.
Toate reacțiile sunt reversibile esterificare (procesul opus, după cum știți, se numește hidroliză) și hidroliza proteinelor, esterilor, carbohidraților, polinucleotidelor. Reversibilitatea acestor procese stă la baza celei mai importante proprietăți a unui organism viu - metabolismul.
În aceste condiții, ele curg într-o singură direcție.
Acestea includ toate reacțiile de schimb însoțite de formarea unui precipitat, gaz sau substanță ușor disociabilă (apa) și toate reacțiile de ardere.
5. După starea de agregare
Reacții în care reactanții și produșii de reacție sunt în diferite stări de agregare (în faze diferite).
Reacții în care reactanții și produșii de reacție sunt în aceeași stare de agregare (în aceeași fază).


6. Prin modificarea stărilor de oxidare ale elementelor chimice formând substanţe
Reacții care apar fără modificarea stărilor de oxidare ale elementelor chimice. Acestea includ, de exemplu, toate reacțiile de schimb ionic, precum și multe reacții de îmbinare, multe reacții de descompunere, reacții de esterificare
Reacții care apar cu modificări ale stărilor de oxidare ale elementelor. Acestea includ multe reacții, inclusiv toate reacțiile de substituție, precum și acele reacții de combinare și descompunere în care este implicată cel puțin o substanță simplă.
HCOOH + CH3OH → HCOOH3 + H2O

7. După mecanismul curgerii.
Ele merg între radicalii și moleculele formate în timpul reacției.
După cum știți deja, în toate reacțiile legăturile chimice vechi sunt rupte și se formează legături chimice noi. Metoda de rupere a legăturii în moleculele substanței inițiale determină mecanismul (calea) reacției. Dacă o substanță este formată printr-o legătură covalentă, atunci pot exista două moduri de a rupe această legătură: hemolitică și heterolitică. De exemplu, pentru moleculele Cl2, CH4 etc., se realizează clivarea hemolitică a legăturilor; aceasta va duce la formarea de particule cu electroni nepereche, adică radicali liberi.
Ei merg între ionii care sunt deja prezenți sau formați în timpul reacției.
Reacțiile ionice tipice sunt interacțiunile dintre electroliții în soluție. Ionii se formează nu numai în timpul disocierii electroliților în soluții, ci și sub acțiunea descărcărilor electrice, a încălzirii sau a radiațiilor. Ŷ-Razele, de exemplu, transformă moleculele de apă și metan în ioni moleculari.
Conform unui alt mecanism ionic, au loc reacții de adăugare de halogenuri de hidrogen, hidrogen, halogeni la alchene, oxidarea și deshidratarea alcoolilor, înlocuirea alcoolului hidroxil cu halogen; reacţii care caracterizează proprietăţile aldehidelor şi acizilor. În acest caz, ionii sunt formați prin scindarea heterolitică a legăturilor covalente polare.

8. După tipul de energie care inițiază reacția.




Ele sunt inițiate de radiații de înaltă energie - raze X, radiații nucleare (raze Ý, particule a - He2+ etc.). Cu ajutorul reacțiilor de radiație se realizează radiopolimerizare foarte rapidă, radioliză (descompunere prin radiații) etc.
De exemplu, în loc de producerea în două etape a fenolului din benzen, acesta poate fi obținut prin reacția benzenului cu apă sub influența radiațiilor. În acest caz, radicalii [·OH] și [·H·] se formează din molecule de apă, cu care benzenul reacționează pentru a forma fenol:
C6H6 + 2[OH] -> C6H5OH + H20
Vulcanizarea cauciucului poate fi efectuată fără sulf folosind radiovulcanizare, iar cauciucul rezultat nu va fi mai rău decât cel tradițional.
Sunt inițiate de energia termică. Acestea includ toate reacțiile endoterme și multe reacții exoterme, a căror inițiere necesită o furnizare inițială de căldură, adică inițierea procesului.
Ele sunt inițiate de energia luminii. Pe lângă procesele fotochimice de sinteză a HCI sau reacția metanului cu clorul discutate mai sus, acestea includ producerea de ozon în troposferă ca poluant atmosferic secundar.
Cel mai important proces care are loc în celulele vegetale, fotosinteza, aparține și el acestui tip de reacție.Ele sunt inițiate de un curent electric. Pe lângă binecunoscutele reacții de electroliză, vom indica și reacții de electrosinteză, de exemplu, reacții pentru producția industrială de agenți oxidanți anorganici.
Sarcini de testare pentru clasa a IX-a
Opțiunea 1.
Partea A
A1. Ce modele corespund moleculelor de alchenă?

a) totul, cu excepția lui A
b) totul, cu excepția lui B
c) totul, cu excepția lui B
d) totul, cu excepția lui G
A2. Cu ce reactiv pot reacționa alcanii:
a) Br 2 (soluție)
b) Cl 2 (ușoară)
c) H2S04
d) NaOH
A3. În reacția 1,3-butadienei cu HCI nu se poate forma
a) 3-clorbuten-1 c) 1-clorbuten-2
b) 4-clorbuten-1 d) 2,3-diclorbutan
A4. Substanța cu care acidul formic, în condiții adecvate, intră într-o reacție redox este:
a) cupru;
b) hidroxid de cupru (II);
c) clorură de cupru (II);
d) sulfat de cupru (II).
A5. Interacțiunea unui ester cu apa poate fi numită:
a) hidratare;
b) deshidratare;
c) hidroliza;
d) hidrogenare.
A6. Într-un lanț de transformări
reacțiile „a” și, respectiv, „b” sunt:
a) hidratare si oxidare;
b) oxidare si hidratare;
c) hidratare si hidratare;
d) oxidare şi oxidare.
A7. Reacția cauzată de prezența unei duble legături în moleculele compușilor carbonilici este reacția:
a) aderare;
b) descompunere;
c) substituţie;
d) schimb.
A8. Folosind o soluție de amoniac de oxid de argint, este imposibil de recunoscut:
a) etanol și etanol;
b) propanal și propanonă;
c) propanal si glicerina;
d) butanal și 2-metilpropanal.
A9. Când propenala este expusă la exces de hidrogen, se formează eu:
a) limitarea consumului de alcool;
b) alcool nesaturat;
c) hidrocarbură nesaturată;
d) hidrocarbură saturată.
A10. Acetaldehida se formează în timpul hidratării:
a) etan;
b) etena;
c) etina;
d) etanol.
Partea B
ÎN 1. Potriviți tipul de reacție cu ecuația
TIP DE REACȚIE
LA 2. Acetilenă cântărind 10,4 g acid clorhidric adăugat cântărind 14,6 g. Formula produsului de reacție este _____.
LA 3. Din carbură tehnică de calciu cu o greutate de 1 kg s-a obţinut acetilenă cu un volum de 260 l (n.s.). Fracția de masă a impurităților (în %) conținută în proba de carbură de calciu este ____ _____. (Scrieți răspunsul la cea mai apropiată sutime).
Partea C.
C 1. Scrieți ecuațiile de reacție care pot fi folosite pentru a efectua următoarele
BaCl2
transformări: CO
Opțiunea 2.
Partea A Pentru fiecare dintre sarcinile A1-A10, sunt oferite patru opțiuni de răspuns,
dintre care doar unul este corect. Încercuiește numărul răspunsului.
A1. Reacția caracteristică alcanilor
a) aderare
b) substituţie
c) hidratare
d) schimb
A2. Ce hidrocarburi sunt caracterizate prin reacții de polimerizare?
a) CH
4b) C 2H4
c) C 6 H 6
DC 2H5OH
A3. Substanță cu care metanul suferă o reacție de deplasare.
a) CL 2 (lumina)
b) H 2 O
c) H 2 SO 4
d) NaOH
A4. Care substanță este ușor oxidată de permanganatul de potasiu.
a) C 2H6
b) C 2H2
c) C 2H5OH
DC 6 H 6
A5. Ce substanță poate fi supusă reacției de deshidratare.
a) C 2H4
b) C 2H5OH
c) CH 4
d) CH 3 COH
A6. Într-un lanț de transformări C 2 H 6 – reacții acetilenă – etan „a” și „b” - aceasta corespunde
a) hidratare şi hidrogenare
b) hidratare şi oxidare
c) dehidrogenare şi hidrogenare
d) oxidare şi hidratare
A7. Cum se numește reacția care produce esteri?
a) aderare
b) substituţie
c) esterificare
d) descompunere
A8. Când etilena reacţionează cu apa, se formează.
a) limitarea consumului de alcool
b) alcool nesaturat
c) hidrocarbură saturată
d) hidrocarbură nesaturată
A9. Acidul acetic este format din:
a) etan
b) etena
c) etina
d) etanol
A10. Ce reacție este tipică pentru grăsimi?
a) aderare
b) oxidare
c) hidroliza
d) substituţie
Partea BLa îndeplinirea sarcinilor B1, stabiliți corespondența. Q2 și Q3, faceți calcule și scrieți răspunsul.
ÎN 1. Potriviți tipul de reacție cu substanța
Tip de reacție
LA 2. Volumul de oxigen necesar pentru arderea completă este de 50 de litri. metanul (n.s.) este egal cu ___l.
LA 3. Hidrocarbura conține 16,28% hidrogen. Determinați formula unei hidrocarburi dacă densitatea sa de vapori pentru hidrogen este 43.
Partea C. Pentru răspunsurile la sarcina C1, utilizați un formular separat (foaie)
Notați numărul sarcinii și răspunsul la aceasta.
C1. Calculați volumul de dioxid de carbon eliberat în timpul arderii a 56 de litri de metan în 48 de litri de oxigen
RĂSPUNSURI
Opțiunea 1
Partea A
Partea B
Partea C
Scrieți ecuațiile de reacție care pot fi folosite pentru a efectua următoarele BaCl 2
transformări: CO 2 → Na 2 CO 3 → X → CO 2. Pentru al doilea proces, scrieți o ecuație ionică pentru reacție.
Răspuns
Opțiunea 2
Partea A
A1
Partea B
Partea C
Sarcini de testare pentru clasa a 11-a
Opțiunea 1.
Partea A Pentru fiecare dintre sarcinile A1-A10, sunt oferite patru opțiuni de răspuns,
dintre care doar unul este corect. Încercuiește numărul răspunsului.
A1. Reacția Wurtz corespunde descrierii:
1. hidratare cu acetilena
2. alungirea scheletului de carbon
3. reducerea derivaților nitro cu metale în mediu acid
4. deshidratarea și dehidrogenarea simultană a etanolului
A2. Glucoza și zaharoza se pot distinge prin:
1. acid azotic
2. soluție de amoniac de oxid de argint
3. apă
4. hidroxid de sodiu.
A3. Etanolul poate fi produs din etilenă prin reacție
1. hidratare
2. hidrogenare
3.Halogenare
4. Hidrohalogenare
A4. Reacția cu o soluție de amoniac de oxid de argint este caracteristică
1. propanol-1
2. propanală
3. propanol-2
4. dimetil eter
A5. Hidroliza alcalină a formiatului de etil produce
1. formaldehidă și etanol
2. acid formic și etanol
3. sare de acid formic și etanol
4. formaldehida si acidul formic
A6. O trăsătură distinctivă a reacției Kucherov este interacțiunea substanțelor cu
1. cu hidrogen
2. cu clor
3. cu apă
4. cu acid
A7. Reacția Zinin, caracteristică hidrocarburilor aromatice, are un alt nume
1. clorinare
2. bromurare
3. nitrare
4. hidrogenare
A8. O reacție calitativă la alcoolii polihidroxici este interacțiunea lor
1. cu oxid de cupru ( II)
2. cu hidroxid de cupru ( II)
3. cu cupru
4. cu oxid de cupru ( eu)
A9. În timpul reacției etanolului cu acidul clorhidric în prezența acidului sulfuric,
1. etilenă
2. cloretan
3. 1,2-dicloretan
4. clorură de vinil
A10. Spre deosebire de etanal, acidul acetic reacționează cu
1. magneziu
2. hidroxid de cupru ( II)
3. oxigen
4. hidrogen
Partea B
scrieți-le în ordine crescătoare
ÎN 1. Produşii hidrolizei esterilor de compoziţie C5H10O2 pot fi
1. pentanal și metanol
2. acid propanoic și etanol
3. etanol și butanal
4. acid butanoic și metanol
5. acid etanoic și propanol
6. formaldehidă și pentanol
LA 2. Reacționează cu acidul formic
1. N / A 2 CO 3
2.HCI
3.OH
4.H 2 S
5. CuSO 4
6. Cu(OH)2
LA 3. Substanțe cu care poate interacționa acidul α-aminopropanoic
1. etan
2. hidroxid de potasiu
3. clorura de potasiu
4. acid sulfuric
5. dimetil eter
6. acid clorhidric
Partea C. Pentru răspunsurile la sarcina C1, utilizați un formular separat (foaie)
Notați numărul sarcinii și răspunsul la aceasta.
C1. Ca rezultat al oxidării catalitice a propanului, s-a obţinut acid propionic cu o greutate de 55,5 g. Fracţia de masă a randamentului produsului de reacţie este de 60%. Calculați volumul de propan luat (nr.).
Opțiunea 2
Partea A Pentru fiecare dintre sarcinile A1-A10, sunt oferite patru opțiuni de răspuns,
dintre care doar unul este corect. Încercuiește numărul răspunsului.
A1. Fiecare dintre cele două substanțe reacționează cu apa cu brom în condiții normale:
1. benzen și toluen
2. ciclohexan și propenă
3. etilenă și benzen
4. fenol și acetilenă
A2. Etilena se formează ca rezultat al reacției:
1. hidratare cu acetilena
2. clormetan cu sodiu
3. acetilenă cu acid clorhidric
4. deshidratarea etanolului
A3. Etanolul poate fi produs din etilenă prin reacție
1. hidratare
2. hidrogenare
3. halogenare
4. hidrohalogenare
A4. Ca rezultat al reacției de trimerizare a acetilenei, se formează următoarele:
1. hexan
2. hexenă
3. etan
4. benzen
A5.În timpul oxidării etilenei cu o soluție apoasă de CM Nu 4 se formează:
1. etan
2. etanol
3. glicerol
4. etilen glicol
A6. Hidroliza alcalină a 2-clorbutanului produce în mod predominant:
1. butanol-2
2. butanol-1
3. butanal
4. butanona
A7. O reacție de substituție cu clor implică:
1. etena 2. etină 3 . butenă-2 4. butan
A8. O reacție caracteristică pentru alcoolii polihidroxilici este interacțiunea cu:
1. H 2
2. Cu
3. Ag2O (soluție de NH3)
4. Cu(OH)2
A9. Monomerul pentru producerea cauciucului artificial folosind metoda Lebedev este:
1. butenă-2
2. etan
3. etilenă
4. butadienă-1,3
A10. Butanol-2 și clorura de potasiu sunt formate prin interacțiune:
1. 1-clorbutan și 2-clorbutan
2. 2-clorbutan și soluție alcoolică de KOH
3. 1-clorbutan și soluție alcoolică de KOH
4. 2-clorbutan și soluție apoasă de KOH
Partea B Când finalizați sarcinile B1-B3, alegeți trei opțiuni de răspuns și
scrieți-le în ordine crescătoare
ÎN 1. Produşii hidrolizei esterilor de compoziţie C6H12O2 pot fi
1 . etanal și dimetil eter
2 . acid propanoic și propanol
3 . acetat de metil și butan
4 . acid etanoic și butanol
5. acid pentanoic și metanol
6. propanal și etanodiol
LA 2. Alchenele interacționează cu:
1 . [ Ag(NH3)2]OH
2 . H2O
3 . BR 2
4 . KMnO4(H+)
5 . Ca(OH)2
6 . Cu(OH)2
LA 3. Metiletilamina interacționează cu:
1 . etan
2 . hidroxid de potasiu
3. acid bromhidric
4 . oxigen
5 . propan
6 . apă
Partea C. Pentru răspunsurile la sarcina C1, utilizați un formular separat (foaie)
Notați numărul sarcinii și răspunsul la aceasta.
C1. Amoniac gazos eliberat atunci când 160 g dintr-o soluție de hidroxid de potasiu 7% sunt fierte cu 9,0 g. Clorura de amoniu, dizolvata in 75 g de apa. Determinați fracția de masă a amoniacului din soluția rezultată.
RĂSPUNSURI
Opțiunea 1
Partea A
A1
Partea B
ÎN 1
Partea C
Conținutul răspunsului corect și instrucțiuni pentru evaluare (este permisă o altă formulare a răspunsului care nu denaturează sensul acestuia)
Elemente de răspuns:
1. Ecuația reacției a fost compilată
3C2H2  C6H6
C6H6
2. S-au determinat cantitățile de acetilenă și benzen
n(C2H2) = 10,08/22,4 = 0,45 mol
conform ecuaţiei reacţiei n(C2H2): n(C6H6) = 3:1
n(C6H6) = 0,45/3 = 0,15 mol
3. Se calculează masa teoretică a benzenului
m(C6H6) = 0,15 mol * 78 g/mol = 11,7 g
4. Se calculează masa practică a benzenului
m(C6H6) pr = 0,7 * 11,7 = 8,19 g
Opțiunea 2
Partea A
Partea B
Partea C
C 1 1. Amoniac gazos eliberat când 160 g dintr-o soluție de hidroxid de potasiu 7% sunt fierte cu 9,0 g. Clorura de amoniu, dizolvata in 75 g de apa. Determinați fracția de masă a amoniacului din soluția rezultată.
Conținutul răspunsului corect și instrucțiuni de evaluare Elemente de răspuns:- Se intocmeste ecuatia reactiei:
- Se calculează masa și cantitatea de substanță alcalină din soluție, precum și cantitatea de substanță clorură de amoniu:
- Substanța care este în exces în soluție este indicată:
- S-au determinat masa de amoniac și fracția sa de masă din soluție
*Notă. Dacă răspunsul conține o eroare de calcul la unul dintre elementele de răspuns, care a condus la un răspuns incorect, scorul pentru îndeplinirea sarcinii este redus cu doar 1 punct.
Resurse informaționale.
Artemenko A.I. Lumea minunată a chimiei organice. – M.: Butarda, 2004.
Gabrielyan O.S., Ostroumov I.G. Manualul profesorului. Chimie. clasa a 10-a. – M.: Butarda, 2004.
Koroșcenko A.S., Medvedev Yu.N. Sarcini de testare standard GIA Chimie - M.: „Examen”, 2009.
Kuznetsova N.E., Levkina A.N., Cartea cu probleme de chimie, clasa a IX-a. – M.: Centrul de editură „Ventana – Graf”, 2004.
Kuznetsova N.E., Titova I.M., Gara N.N., Zhegin A.Yu. Chimie. - clasa a 9-a. – M.: Centrul de editură „Ventana – Graf”, 2002.
Potapov V.M. Chimie organica. – M.: Educație, 1976.
Dicționar enciclopedic al unui tânăr chimist. – M.: Pedagogie – Presă, 1997.
Pichugina G.V. Chimia și viața umană de zi cu zi. – M.: Dropia, 2005.
http://www.fipi.ru/
Reacțiile substanțelor organice pot fi împărțite formal în patru tipuri principale: substituție, adăugare, eliminare (eliminare) și rearanjare (izomerizare). Este evident că întreaga varietate de reacții ale compușilor organici nu poate fi redusă la cadrul clasificării propuse (de exemplu, reacții de ardere). Cu toate acestea, o astfel de clasificare va ajuta la stabilirea analogiilor cu clasificările reacțiilor care apar între substanțele anorganice care vă sunt deja familiare din cursul chimiei anorganice.
De obicei, principalul compus organic implicat într-o reacție se numește substrat, iar cealaltă componentă a reacției este considerată în mod convențional reactant.
Reacții de substituție
Reacțiile care au ca rezultat înlocuirea unui atom sau a unui grup de atomi din molecula originală (substrat) cu alți atomi sau grupuri de atomi se numesc reacții de substituție.
Reacțiile de substituție implică compuși saturați și aromatici, cum ar fi, de exemplu, alcani, cicloalcani sau arene.
Să dăm exemple de astfel de reacții.
Sub influența luminii, atomii de hidrogen dintr-o moleculă de metan pot fi înlocuiți cu atomi de halogen, de exemplu, atomii de clor:
CH4 + Cl2→ CH3CI + HCI
Un alt exemplu de înlocuire a hidrogenului cu halogen este conversia benzenului în bromobenzen:
Cu această formă de scriere, reactivii, catalizatorul și condițiile de reacție sunt scrise deasupra săgeții, iar produșii anorganici de reacție sunt înscriși sub ea.
Reacții de adaos
Reacțiile în care două sau mai multe molecule de substanțe care reacţionează se combină într-una singură se numesc reacții de adiție.
Compușii nesaturați, cum ar fi alchenele sau alchinele, suferă reacții de adiție. În funcție de moleculă care acționează ca reactiv, se disting hidrogenarea (sau reducerea), halogenarea, hidrohalogenarea, hidratarea și alte reacții de adiție. Fiecare dintre ele necesită anumite condiții.
1
. Hidrogenarea - reacția de adăugare a unei molecule de hidrogen printr-o legătură multiplă:CH3-CH = CH2 + H2 → CH3-CH2-CH3
propen propan
2
. Hidrohalogenare - reacția de adiție cu halogenură de hidrogen (de exemplu, clorurare):CH2=CH2 + HCI → CH3-CH2-Cl
eten cloretan
3
. Halogenare - reacție de adiție cu halogen (de exemplu, clorurare):CH2=CH2 + CI2 → CH2CI-CH2CI
eten 1,2-dicloretan
4
. Polimerizare - un tip special de reacție de adiție în care moleculele unei substanțe cu o greutate moleculară mică se combină între ele pentru a forma molecule ale unei substanțe cu o greutate moleculară foarte mare - macromolecule.Reacții de polimerizare
- acestea sunt procesele de combinare a multor molecule ale unei substanțe cu molecul scăzut (monomer) în molecule mari (macromolecule) ale unui polimer.Un exemplu de reacție de polimerizare este producerea de polietilenă din etilenă (etenă) sub acțiunea radiației ultraviolete și a unui inițiator de polimerizare radicalică R.
Tipuri de reacții chimice în chimia organică
Reacții de eliminare
Reacțiile care au ca rezultat formarea moleculelor mai multor substanțe noi dintr-o moleculă a compusului original se numesc reacții de eliminare sau eliminare.
Exemple de astfel de reacții includ producerea de etilenă din diferite substanțe organice.

Tipuri de reacții chimice în chimia organică
De o importanță deosebită printre reacțiile de eliminare este reacția de scindare termică a hidrocarburilor, pe care se bazează cracarea alcanilor - cel mai important proces tehnologic:

În cele mai multe cazuri, scindarea unei molecule mici dintr-o moleculă a substanței părinte duce la formarea unei legături n suplimentare între atomi. Reacțiile de eliminare apar în anumite condiții și cu anumiți reactivi. Ecuațiile date reflectă doar rezultatul final al acestor transformări.
Reacții de izomerizare
Reacțiile în urma cărora moleculele unei substanțe se formează din molecule ale altor substanțe cu aceeași compoziție calitativă și cantitativă, adică cu aceeași formulă moleculară, se numesc reacții de izomerizare.
Un exemplu de astfel de reacție este izomerizarea scheletului de carbon al alcanilor liniari în alcani ramificati, care are loc pe clorură de aluminiu la temperatură ridicată:
Tipuri de reacții chimice în chimia organică
1
. Ce tip de reacție este aceasta:a) obţinerea clormetanului din metan;
b) obţinerea de bromobenzen din benzen;
c) producerea de cloretan din etilenă;
d) producerea de etilenă din etanol;
e) conversia butanului în izobutan;
f) dehidrogenarea etanului;
g) conversia brometanului în etanol?
2
. Ce reacții sunt tipice pentru: a) alcani; b) alchene? Dați exemple de reacții.3
. Care sunt caracteristicile reacțiilor de izomerizare? Ce au ele în comun cu reacțiile care produc modificări alotropice ale unui element chimic? Dă exemple.4.
În care reacții (adăugare, substituție, eliminare, izomerizare) este greutatea moleculară a compusului inițial:a) crește;
b) scade;
c) nu se modifică;
d) crește sau scade în funcție de reactiv?