Cum a fost descoperit elementul chimic fosfor. Îmbogățirea din urină (despre istoria descoperirii fosforului). Cum arată apatita?
Structura fosforului negru
Mai mult de trei sute de ani ne despart de momentul în care alchimistul din Hamburg Genning Brand a descoperit un nou element - . Ca și alți alchimiști, Brand a încercat să găsească elixirul vieții sau piatra filosofală, cu ajutorul căruia bătrânii devin mai tineri, bolnavii se însănătoșesc, iar ignobilul se transformă în... Nu preocuparea pentru bunăstarea oamenilor, ci interesul propriu a ghidat Brand. Acest lucru este dovedit de fapte din istoria singurei descoperiri reale făcute de acest alchimist.
În timpul unuia dintre experimente, a evaporat urina, a amestecat reziduul cu cărbune și nisip și a continuat evaporarea. Curând, în replică s-a format o substanță care strălucea în întuneric. Adevărat, kaltes Feuer (focul rece) sau „focul meu”, așa cum l-a numit Brand, nu s-a transformat în sau nu a schimbat aspectul bătrânilor, dar faptul că substanța rezultată strălucea fără încălzire a fost neobișnuit și nou.
Brand s-a grăbit să profite de această nouă proprietate. A început să arate diverse persoane privilegiate, primind de la ei daruri și bani. Nu a fost ușor să păstrezi secretul obținerii fosforului, iar Brand l-a vândut în curând chimistului din Dresda I. Kraft. Numărul demonstranților de fosfor a crescut când rețeta pentru producerea lui a devenit cunoscută de I. Kunkel și K. Kirchmeyer. În 1680, indiferent de predecesorii săi, un nou element a fost obținut de celebrul fizician și chimist englez Robert Boyle. Dar Boyle a murit curând, iar studentul său A. Gankwitz a trădat știința pură și a reînviat „speculațiile cu fosfor”. Abia în 1743 A. Markgraf a găsit o metodă mai avansată de producere a fosforului și și-a publicat datele pentru informare publică. Acest eveniment a pus capăt afacerii Brandului și a servit drept începutul unui studiu serios al fosforului și al compușilor acestuia.
La prima etapă de cincizeci de ani a istoriei fosforului, pe lângă descoperirea lui Boyle, un singur eveniment a fost marcat de istoria științei: în 1715, Gensing a stabilit prezența fosforului în țesutul cerebral. După experimentele Markgrave, istoria elementului, care mulți ani mai târziu a dobândit numărul 15, a devenit istoria multor mari descoperiri.
Totul despre fosfor
În 1769, Yu. Gan a dovedit că oasele conțin mult fosfor. același lucru a fost confirmat doi ani mai târziu de celebrul chimist suedez K. Scheele, care a propus o metodă de obținere a fosforului din cenușa formată în timpul prăjirii oaselor.
Câțiva ani mai târziu, J. L. Proust și M. Klaproth, studiind diverși compuși naturali, au demonstrat că este răspândit în scoarța terestră, în principal sub formă de fosfat de calciu.
El a obținut un mare succes în studierea proprietăților fosforului la începutul anilor 70 ai secolului al XVIII-lea. marele chimist francez Antoine Laurent. Prin arderea fosforului cu alte substanțe într-un volum închis de aer, a demonstrat că fosforul este un element independent, iar aerul are o compoziție complexă și este compus din cel puțin două componente - oxigen și azot. „În acest fel, pentru prima dată, el a pus pe picioare toată chimia, care în forma ei flogistică stătea pe cap.” Așa a scris despre lucrare F. Engels în prefața celui de-al doilea volum din Kap-pitala.”
În 1709, Dondonald a dovedit că compușii de fosfor sunt necesari pentru dezvoltarea normală a plantelor.
În 1839, un alt englez, Laws, a fost primul care a obținut superfosfat - un îngrășământ cu fosfor care este ușor digerabil. plantelor.
În 1847, chimistul german Schrötter, încălzind fără acces la aer, a dezvoltat o nouă varietate (modificare alotropică) a elementului nr. 15 -, iar deja în secolul XX, în 1934, fizicianul american P. Bradjen, studiind efectul înaltei presiuni asupra diferitor, eliberat fosfor negru similar. Acestea sunt principalele repere din istoria elementului nr. 15. Acum să urmărim ce a urmat fiecare dintre aceste descoperiri.
„În 1715, Gensing a stabilit prezența fosforului în țesutul cerebral... În 1769, Hahn a demonstrat că oasele conțin mult fosfor”
Fosforul este un analog al azotului
Deși proprietățile fizice și chimice ale acestor elemente variază foarte mult, ele au. iar lucrul general, în special, este că ambele aceste elemente sunt absolut necesare pentru animale și plante. Academicianul A.E. Fersman a numit fosforul „un element al vieții și al gândirii”, dar această definiție cu greu poate fi clasificată drept exagerare literară. Fosforul se găsește literalmente în toate organele plantelor verzi: tulpini, rădăcini, frunze, dar mai ales în fructe și semințe. Plantele acumulează fosfor și îl furnizează animalelor.
La animale, fosforul este concentrat în principal în schelet, mușchi și țesut nervos.
Dintre produsele alimentare pentru oameni, gălbenușul de ouă de pui este deosebit de bogat în fosfor.
Corpul uman conține în medie aproximativ 1,5 kg de element nr. 15. Din această cantitate, 1,4 kg se află în oase, aproximativ 130 g în mușchi și 12 g în nervi și creier. Aproape toate cele mai importante procese fiziologice care au loc în corpul nostru sunt asociate cu transformările substanțelor organofosforice. Fosforul se găsește în oase în principal sub formă de fosfat de calciu. Smalțul dentar este, de asemenea, un compus de fosfor, care în compoziție și structură cristalină corespunde celui mai important mineral fosfor, apatita Ca5(P04)3(F, Cl).
Desigur, ca orice element vital, fosforul suferă un ciclu în natură. Plantele îl iau din sol, iar din plante acest element pătrunde în corpurile oamenilor și ale animalelor. Fosforul revine în sol cu excrementele și când cadavrele putrezesc. Fosforobacteriile transformă fosforul organic în compuși anorganici.
Cu toate acestea, pe unitatea de timp, din sol este eliminat semnificativ mai mult fosfor decât intră în sol. Acum, recolta mondială elimină anual peste 3 milioane de tone de fosfor din câmpuri.
Desigur, pentru a obține producții durabile, acest fosfor trebuie returnat în sol și, prin urmare, nu este surprinzător că producția mondială de rocă fosfatică este acum semnificativ mai mare de 100 de milioane de tone pe an.
„...Proust și Klaproth au demonstrat că fosforul este distribuit pe scară largă în scoarța terestră, în principal sub formă de fosfat de calciu”
În scoarța terestră, fosforul apare exclusiv sub formă de compuși. Acestea sunt în principal săruri slab solubile ale acidului ortofosforic; Cationul este cel mai adesea ion de calciu.
Fosforul reprezintă 0,08% din greutatea scoarței terestre. În ceea ce privește prevalența, se află pe locul 13 dintre toate elementele. Fosforul este continut in cel putin 190 de minerale, dintre care cele mai importante sunt: fluorapatita Ca5(P04)3F, hidroxilapatita Ca5(P04)3OH, fosforit Cae(P04)2 cu impuritati.
Fosforul este împărțit în primar și secundar. Dintre cele primare, apatitele sunt deosebit de frecvente, des întâlnite printre rocile de origine magmatică. Acestea s-au format în momentul formării scoarței terestre.
Spre deosebire de apatite, fosforiții apar printre rocile de origine sedimentară, formate ca urmare a morții ființelor vii. Acestea sunt secundare.
Fosforul se găsește în meteoriți sub formă de fosfuri de fier, cobalt și nichel. Desigur, acest element comun se găsește și în apa de mare (6 10-6%).
„Lavoisier a dovedit că fosforul este un element chimic independent...”
Fosforul este un nemetal (ceea ce anterior era numit metaloid) cu activitate medie. Orbita exterioară a atomului de fosfor conține cinci electroni, dintre care trei sunt nepereche. Prin urmare, poate prezenta valențe de 3-, 3+ și 5+.
Pentru ca fosforul să prezinte 5+, este necesar un anumit efect asupra atomului, care ar transforma cei doi electroni perechi ai ultimei orbite în cei nepereche.
Fosforul este adesea numit un element cu mai multe fațete. Într-adevăr, în diferite condiții se comportă diferit, prezentând fie proprietăți oxidative, fie proprietăți reducătoare. Versatilitatea fosforului include, de asemenea, capacitatea sa de a exista în mai multe modificări alotropice.
Poate cea mai faimoasă modificare a elementului nr. 15 este fosforul moale, ceros, alb sau galben. Brand a fost cel care l-a descoperit, iar datorită proprietăților sale elementul și-a primit numele: în greacă „fosfor” înseamnă luminos, luminifer. Molecula albă de fosfor este formată din patru atomi dispuși în formă de tetraedru. Densitate 1,83, punct de topire 44,1°C. otrăvitor, ușor de oxidat. Solubil în disulfură de carbon, amoniac lichid și SO2, benzen, eter. Aproape insolubil în apă.
Când este încălzit fără acces la aer peste 250 ° C, devine roșu. Acesta este deja un polimer, dar nu o structură foarte ordonată. Reactivitatea fosforului roșu este semnificativ mai mică decât a fosforului alb. Nu strălucește în întuneric, nu se dizolvă în disulfură de carbon și nu este otrăvitor. Densitatea sa este mult mai mare, structura sa este fin-cristalină.
Structura fosforului negru
Mai mult de trei sute de ani ne despart de momentul în care alchimistul din Hamburg Genning Brand a descoperit un nou element - . Ca și alți alchimiști, Brand a încercat să găsească elixirul vieții sau piatra filosofală, cu ajutorul căruia bătrânii devin mai tineri, bolnavii se însănătoșesc, iar ignobilul se transformă în... Nu preocuparea pentru bunăstarea oamenilor, ci interesul propriu a ghidat Brand. Acest lucru este dovedit de fapte din istoria singurei descoperiri reale făcute de acest alchimist.
În timpul unuia dintre experimente, a evaporat urina, a amestecat reziduul cu cărbune și nisip și a continuat evaporarea. Curând, în replică s-a format o substanță care strălucea în întuneric. Adevărat, kaltes Feuer (focul rece) sau „focul meu”, așa cum l-a numit Brand, nu s-a transformat în sau nu a schimbat aspectul bătrânilor, dar faptul că substanța rezultată strălucea fără încălzire a fost neobișnuit și nou.
Brand s-a grăbit să profite de această nouă proprietate. A început să arate diverse persoane privilegiate, primind de la ei daruri și bani. Nu a fost ușor să păstrezi secretul obținerii fosforului, iar Brand l-a vândut în curând chimistului din Dresda I. Kraft. Numărul demonstranților de fosfor a crescut când rețeta pentru producerea lui a devenit cunoscută de I. Kunkel și K. Kirchmeyer. În 1680, indiferent de predecesorii săi, un nou element a fost obținut de celebrul fizician și chimist englez Robert Boyle. Dar Boyle a murit curând, iar studentul său A. Gankwitz a trădat știința pură și a reînviat „speculațiile cu fosfor”. Abia în 1743 A. Markgraf a găsit o metodă mai avansată de producere a fosforului și și-a publicat datele pentru informare publică. Acest eveniment a pus capăt afacerii Brandului și a servit drept începutul unui studiu serios al fosforului și al compușilor acestuia.
La prima etapă de cincizeci de ani a istoriei fosforului, pe lângă descoperirea lui Boyle, un singur eveniment a fost marcat de istoria științei: în 1715, Gensing a stabilit prezența fosforului în țesutul cerebral. După experimentele Markgrave, istoria elementului, care mulți ani mai târziu a dobândit numărul 15, a devenit istoria multor mari descoperiri.
Totul despre fosfor
În 1769, Yu. Gan a dovedit că oasele conțin mult fosfor. același lucru a fost confirmat doi ani mai târziu de celebrul chimist suedez K. Scheele, care a propus o metodă de obținere a fosforului din cenușa formată în timpul prăjirii oaselor.
Câțiva ani mai târziu, J. L. Proust și M. Klaproth, studiind diverși compuși naturali, au demonstrat că este răspândit în scoarța terestră, în principal sub formă de fosfat de calciu.
El a obținut un mare succes în studierea proprietăților fosforului la începutul anilor 70 ai secolului al XVIII-lea. marele chimist francez Antoine Laurent. Prin arderea fosforului cu alte substanțe într-un volum închis de aer, a demonstrat că fosforul este un element independent, iar aerul are o compoziție complexă și este compus din cel puțin două componente - oxigen și azot. „În acest fel, pentru prima dată, el a pus pe picioare toată chimia, care în forma ei flogistică stătea pe cap.” Așa a scris despre lucrare F. Engels în prefața celui de-al doilea volum din Kap-pitala.”
În 1709, Dondonald a dovedit că compușii de fosfor sunt necesari pentru dezvoltarea normală a plantelor.
În 1839, un alt englez, Laws, a fost primul care a obținut superfosfat - un îngrășământ cu fosfor care este ușor digerabil. plantelor.
În 1847, chimistul german Schrötter, încălzind fără acces la aer, a dezvoltat o nouă varietate (modificare alotropică) a elementului nr. 15 -, iar deja în secolul XX, în 1934, fizicianul american P. Bradjen, studiind efectul înaltei presiuni asupra diferitor, eliberat fosfor negru similar. Acestea sunt principalele repere din istoria elementului nr. 15. Acum să urmărim ce a urmat fiecare dintre aceste descoperiri.
„În 1715, Gensing a stabilit prezența fosforului în țesutul cerebral... În 1769, Hahn a demonstrat că oasele conțin mult fosfor”
Fosforul este un analog al azotului
Deși proprietățile fizice și chimice ale acestor elemente variază foarte mult, ele au. iar lucrul general, în special, este că ambele aceste elemente sunt absolut necesare pentru animale și plante. Academicianul A.E. Fersman a numit fosforul „un element al vieții și al gândirii”, dar această definiție cu greu poate fi clasificată drept exagerare literară. Fosforul se găsește literalmente în toate organele plantelor verzi: tulpini, rădăcini, frunze, dar mai ales în fructe și semințe. Plantele acumulează fosfor și îl furnizează animalelor.
La animale, fosforul este concentrat în principal în schelet, mușchi și țesut nervos.
Dintre produsele alimentare pentru oameni, gălbenușul de ouă de pui este deosebit de bogat în fosfor.
Corpul uman conține în medie aproximativ 1,5 kg de element nr. 15. Din această cantitate, 1,4 kg se află în oase, aproximativ 130 g în mușchi și 12 g în nervi și creier. Aproape toate cele mai importante procese fiziologice care au loc în corpul nostru sunt asociate cu transformările substanțelor organofosforice. Fosforul se găsește în oase în principal sub formă de fosfat de calciu. Smalțul dentar este, de asemenea, un compus de fosfor, care în compoziție și structură cristalină corespunde celui mai important mineral fosfor, apatita Ca5(P04)3(F, Cl).
Desigur, ca orice element vital, fosforul suferă un ciclu în natură. Plantele îl iau din sol, iar din plante acest element pătrunde în corpurile oamenilor și ale animalelor. Fosforul revine în sol cu excrementele și când cadavrele putrezesc. Fosforobacteriile transformă fosforul organic în compuși anorganici.
Cu toate acestea, pe unitatea de timp, din sol este eliminat semnificativ mai mult fosfor decât intră în sol. Acum, recolta mondială elimină anual peste 3 milioane de tone de fosfor din câmpuri.
Desigur, pentru a obține producții durabile, acest fosfor trebuie returnat în sol și, prin urmare, nu este surprinzător că producția mondială de rocă fosfatică este acum semnificativ mai mare de 100 de milioane de tone pe an.
„...Proust și Klaproth au demonstrat că fosforul este distribuit pe scară largă în scoarța terestră, în principal sub formă de fosfat de calciu”
În scoarța terestră, fosforul apare exclusiv sub formă de compuși. Acestea sunt în principal săruri slab solubile ale acidului ortofosforic; Cationul este cel mai adesea ion de calciu.
Fosforul reprezintă 0,08% din greutatea scoarței terestre. În ceea ce privește prevalența, se află pe locul 13 dintre toate elementele. Fosforul este continut in cel putin 190 de minerale, dintre care cele mai importante sunt: fluorapatita Ca5(P04)3F, hidroxilapatita Ca5(P04)3OH, fosforit Cae(P04)2 cu impuritati.
Fosforul este împărțit în primar și secundar. Dintre cele primare, apatitele sunt deosebit de frecvente, des întâlnite printre rocile de origine magmatică. Acestea s-au format în momentul formării scoarței terestre.
Spre deosebire de apatite, fosforiții apar printre rocile de origine sedimentară, formate ca urmare a morții ființelor vii. Acestea sunt secundare.
Fosforul se găsește în meteoriți sub formă de fosfuri de fier, cobalt și nichel. Desigur, acest element comun se găsește și în apa de mare (6 10-6%).
„Lavoisier a dovedit că fosforul este un element chimic independent...”
Fosforul este un nemetal (ceea ce anterior era numit metaloid) cu activitate medie. Orbita exterioară a atomului de fosfor conține cinci electroni, dintre care trei sunt nepereche. Prin urmare, poate prezenta valențe de 3-, 3+ și 5+.
Pentru ca fosforul să prezinte 5+, este necesar un anumit efect asupra atomului, care ar transforma cei doi electroni perechi ai ultimei orbite în cei nepereche.
Fosforul este adesea numit un element cu mai multe fațete. Într-adevăr, în diferite condiții se comportă diferit, prezentând fie proprietăți oxidative, fie proprietăți reducătoare. Versatilitatea fosforului include, de asemenea, capacitatea sa de a exista în mai multe modificări alotropice.
Poate cea mai faimoasă modificare a elementului nr. 15 este fosforul moale, ceros, alb sau galben. Brand a fost cel care l-a descoperit, iar datorită proprietăților sale elementul și-a primit numele: în greacă „fosfor” înseamnă luminos, luminifer. Molecula albă de fosfor este formată din patru atomi dispuși în formă de tetraedru. Densitate 1,83, punct de topire 44,1°C. otrăvitor, ușor de oxidat. Solubil în disulfură de carbon, amoniac lichid și SO2, benzen, eter. Aproape insolubil în apă.
Când este încălzit fără acces la aer peste 250 ° C, devine roșu. Acesta este deja un polimer, dar nu o structură foarte ordonată. Reactivitatea fosforului roșu este semnificativ mai mică decât a fosforului alb. Nu strălucește în întuneric, nu se dizolvă în disulfură de carbon și nu este otrăvitor. Densitatea sa este mult mai mare, structura sa este fin-cristalină.
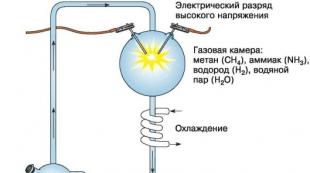
Data descoperirii fosforului este de obicei considerată a fi 1669, dar există unele indicii că era cunoscut mai devreme. Gepher, de exemplu, relatează că un manuscris alchimic dintr-o colecție stocată în Biblioteca din Paris afirmă că în jurul secolului al XII-lea. un anume Alchid Bekhil a obținut, prin distilarea urinei cu argilă și var, o substanță pe care a numit-o „escarbucul”. Poate că acesta era fosforul, care era marele secret al alchimiștilor. În orice caz, se știe că în căutarea pietrei filozofale, alchimiștii au supus tot felul de materiale la distilare și la alte operațiuni, inclusiv urină, excremente, oase etc. Din cele mai vechi timpuri, substanțele care pot străluci în întuneric au fost numite fosfori. În secolul al XVII-lea Se cunoștea fosforul bolognez - o piatră găsită în munții de lângă Bologna; După ce a tras pe cărbuni, piatra a dobândit capacitatea de a străluci. Este descris și „fosforul lui Baldwin”, preparat de maistrul volost Alduin dintr-un amestec calcinat de cretă și acid azotic. Strălucirea unor astfel de substanțe a provocat o surpriză extremă și a fost considerată un miracol.
În 1669, alchimistul amator din Hamburg, un comerciant falimentar care visa să-și îmbunătățească afacerile cu ajutorul alchimiei, a procesat o mare varietate de produse. Teoreticând că produsele fiziologice ar putea conține „materia primordială” despre care se crede că este baza pietrei filosofale, Brand a devenit interesat de urina umană.
A colectat aproximativ o tonă de urină din barăcile soldaților și a evaporat-o pentru a forma un lichid siropos. A distilat din nou acest lichid și a obținut un „ulei de urină” de culoare roșie. După ce a distilat din nou acest ulei, a descoperit în fundul replicii rămășițele unui „cap mort” (Caput mortuum), aparent inutil pentru nimic. Cu toate acestea, după ce a calcinat acest reziduu pentru o lungă perioadă de timp, a observat că în retortă a apărut praf alb, care s-a așezat încet pe fundul retortei și a strălucit clar. Brand a decis că a reușit să extragă foc elementar din „capul morții uleioase” și și-a continuat experimentele cu și mai mult zel. El, desigur, nu a reușit să transforme acest „foc” în aur, dar a păstrat totuși descoperirea fosforului (din greacă - lumină și „purtare”, adică aducător de lumină) un secret strict. Cu toate acestea, un anume Kunkel, care la acea vreme a servit ca alchimist și valet secret pentru Electorul Saxon, a aflat despre secretul lui Brand. Kunkel l-a rugat pe colegul său Kraft, care mergea la Hamburg, să afle de la Brand orice informații despre fosfor. Totuși, Kraft însuși a decis să folosească secretul lui Brand. El a cumpărat secretul de la el pentru 200 de taleri și, după ce a produs o cantitate suficientă de fosfor, a plecat într-o călătorie în Europa, unde a demonstrat strălucirea fosforului în fața oamenilor nobili cu mare succes. În special, în Anglia a arătat fosfor regelui Carol al II-lea și omului de știință Boyle. Între timp, Kunkel a reușit să pregătească el însuși fosforul într-un mod apropiat de metoda lui Brand și, spre deosebire de aceasta din urmă, a făcut publicitate pe scară largă pentru fosfor, dar a tăcut despre secretul producerii acestuia. În 1680, indiferent de predecesorii săi, un nou element a fost obținut de renumitul fizician și chimist englez Robert Boyle, care, la fel ca Kunkel, a publicat date despre proprietățile fosforului, dar a raportat metoda de preparare a acestuia într-un pachet închis doar către Royal Society of London (acest mesaj a fost publicat abia 12 ani mai târziu, după moartea lui Boyle), iar studentul lui Boise A. Gankwitz a trădat știința pură și a reînviat „speculația cu fosfor” sub forma unor activități extinse de producție pentru producerea acestei substanțe: pt. 50 de ani a comercializat pe scară largă fosfor la un preț foarte mare. În Olanda, de exemplu, o uncie (31,1 g) de fosfor costa 16 ducați la acel moment. Cele mai fantastice presupuneri au fost făcute cu privire la natura fosforului. În secolul al XVIII-lea Mulți oameni de știință de seamă au studiat fosforul, printre care și Marggraf, care a îmbunătățit metoda de obținere a fosforului din urină prin adăugarea de clorură de plumb la aceasta din urmă (1743).
În 1777, Scheele a stabilit prezența fosforului în oasele și coarnele animalelor sub formă de acid fosforic asociat cu var. Unii autori, însă, atribuie această descoperire unui alt chimist suedez, Hahn, dar Scheele a fost cel care a dezvoltat o metodă de obținere a fosforului din oase. Fosforul a fost recunoscut ca o substanță elementară de către Lavoisier pe baza celebrelor sale experimente privind arderea fosforului în oxigen. În tabelul corpurilor simple, Lavoisier a plasat fosforul în a doua grupă de corpuri simple, nemetalice, oxidante și producătoare de acizi. Din secolul al XIX-lea Fosforul este utilizat pe scară largă în principal sub formă de săruri folosite pentru fertilizarea solurilor.
Deci, mai bine de trei sute de ani ne despart de momentul în care alchimistul din Hamburg Genning Brand a descoperit un nou element - fosforul. Ca și alți alchimiști, Brand a încercat să găsească elixirul vieții sau piatra filosofală, cu ajutorul căreia bătrânii par mai tineri, bolnavii își revin, iar metalele comune se transformă în aur. Nu preocuparea pentru bunăstarea oamenilor, ci interesul propriu a ghidat Brand. Acest lucru este dovedit de fapte din istoria singurei descoperiri reale făcute de el. La prima etapă de cincizeci de ani a istoriei fosforului, pe lângă descoperirea lui Boyle, un singur eveniment a fost marcat de istoria științei: în 1715, Gensing a stabilit prezența fosforului în țesutul cerebral. După experimentele Markgrave, istoria elementului, care mulți ani mai târziu a dobândit numărul 15, a devenit istoria multor mari descoperiri.
Cronologia descoperirilor legate de fosfor
În 1715 Gensing a stabilit prezența fosforului în țesutul cerebral...
În 1743 Chimist german, membru de onoare al Academiei de Științe din Sankt Petersburg A.S. Marggraf a dezvoltat o nouă metodă de producere a fosforului.

În 1769 Yu.Gan a dovedit că oasele conțin mult fosfor. Același lucru a fost confirmat doi ani mai târziu de chimistul suedez K. Scheele, care a propus o metodă de obținere a fosforului din cenușa formată în timpul prăjirii oaselor. Câțiva ani mai târziu, J.L.Proust și M. Klaproth, studiind diverși compuși naturali, au demonstrat că fosforul este răspândit în scoarța terestră, în principal sub formă de fosfat de calciu.
1797În Rusia, A.A. Musin-Pushkin a obținut o varietate alotropică de fosfor - fosfor violet. Cu toate acestea, în literatură, descoperirea fosforului este atribuită în mod eronat lui I. Hittorf, care, folosind metoda lui A. A. Musin-Pușkin, l-a obținut abia în 1853.

În 1799 Dondonald a demonstrat că compușii de fosfor sunt necesari pentru dezvoltarea normală a plantelor.
În 1839 Un alt englez, Laws, a fost primul care a obținut superfosfat - un îngrășământ cu fosfor care este ușor absorbit de plante.
În 1842 Anglia a organizat prima producție industrială de superfosfat din lume. În Rusia, o astfel de producție a apărut în 1868 și 1871.

În 1848 Chimistul austriac A. Schrötter a descoperit o modificare alotropică a fosforului - fosforul roșu. El a obținut acest fosfor prin încălzirea fosforului alb la o temperatură de 250 de grade într-o atmosferă de CO (monoxid de carbon doi). Este interesant de observat că A. Schrötter a fost primul care a subliniat

posibilitatea folosirii fosforului rosu la fabricarea chibriturilor.
În 1926 A.E. Fersman și colegii săi au descoperit rezerve uriașe de apatit în Peninsula Kola.
În 1934, fizicianul american P. Bridgeman, studiind efectul presiunilor mari asupra diferitelor substanțe, a izolat fosfor negru, asemănător grafitului.
Fosforul este o componentă importantă a naturii vii și neînsuflețite. Se găsește în adâncurile Pământului, în apă și în corpul nostru, iar academicianul Fersman chiar l-a poreclit „elementul vieții și al gândirii”. În ciuda utilității sale, fosforul alb poate fi extrem de periculos și otrăvitor. Să vorbim mai detaliat despre caracteristicile sale.
Deschiderea unui element
Istoria descoperirii fosforului a început cu alchimia. Încă din secolul al XV-lea, oamenii de știință europeni au fost dornici să găsească piatra filosofală sau „marele elixir” cu care pot transforma orice metal în aur.
În secolul al XVII-lea, alchimistul Hennig Brand a decis că calea către „reactivul magic” era prin urină. Este galben, ceea ce înseamnă că conține aur sau este într-un fel legat de acesta. Omul de știință a colectat cu grijă materialul, l-a apărat și apoi l-a distilat. În loc de aur, a primit o substanță albă care strălucea în întuneric și ardea bine.
Brand a numit descoperirea „foc rece”. Mai târziu, alchimistul irlandez Robert Boyle și germanul Andreas Maggraf au venit cu ideea de a obține fosfor într-un mod similar. Acesta din urmă a adăugat cărbune, nisip și mineralul fosgenit în urină. Ulterior, substanța a fost numită phosphor mirabilis, care s-a tradus ca „purtător miraculos de lumină”.
Element luminos
Descoperirea fosforului a devenit o adevărată senzație printre alchimiști. Unii au încercat din când în când să cumpere secretul obținerii substanței de la Brand, alții au încercat să ajungă singuri acolo. În secolul al XVIII-lea, s-a dovedit că elementul era conținut în rămășițele osoase ale organismelor și în curând s-au deschis câteva fabrici pentru producerea lui.
Fizicianul francez Lavoisier a demonstrat că fosforul este o substanță simplă. În tabelul periodic este numărul 15. Împreună cu azotul, antimoniul, arsenul și bismutul, aparține grupului de pnictide și este caracterizat ca un nemetal.

Elementul este destul de comun în natură. În termeni procentuali, se află pe locul 13 în masa scoarței terestre. Fosforul interacționează activ cu oxigenul și nu se găsește în formă liberă. Există în numeroase minerale (mai mult de 190), precum fosforite, apatite etc.
Fosfor alb
Fosforul există sub mai multe forme sau alotropi. Ele diferă unele de altele prin densitate, culoare și proprietăți chimice. Există de obicei patru forme principale: fosfor alb, negru, roșu și metalic. Alte modificări sunt doar o combinație a celor de mai sus.

Fosforul alb este foarte instabil. În condiții normale de lumină, devine rapid roșu, dar presiunea ridicată îl face negru. Atomii săi sunt aranjați sub forma unui tetraedru. Are o rețea moleculară cristalină, cu formula moleculară P4.
Pun in evidenta si fosforul galben. Aceasta nu este o altă modificare a substanței, ci numele de fosfor alb nerafinat. Poate avea o nuanță maro deschis sau închis și se caracterizează printr-o toxicitate puternică.
Proprietățile fosforului alb
Consistența și aspectul substanței seamănă cu ceara. Are un miros de usturoi și este gras la atingere. Fosforul este moale (se poate tăia cu un cuțit fără prea mult efort) și este deformabil. După curățare devine incoloră. Cristalele sale transparente strălucesc irizate la soare și arată ca diamantele.
Se topește la 44 de grade. Activitatea substanței se manifestă chiar și la temperatura camerei. Principala caracteristică a fosforului este capacitatea sa de a chemiluminescentă sau strălucire. Oxidându-se în aer, emite o lumină alb-verde, iar în timp se aprinde spontan.

Substanța este practic insolubilă în apă, dar poate arde în ea la contact prelungit cu oxigenul. Se dizolvă bine în solvenți organici, cum ar fi disulfura de carbon, parafina lichidă și benzen.
Aplicarea fosforului
Omul a „îmblânzit” fosforul atât în scopuri pașnice, cât și în scopuri militare. Substanța este folosită pentru a produce acid fosforic, care este folosit pentru îngrășăminte. Anterior, a fost utilizat pe scară largă pentru vopsirea lânii și realizarea de emulsii fotosensibile.
Fosforul alb nu este utilizat pe scară largă. Valoarea sa principală este inflamabilitatea. Astfel, substanța este folosită pentru muniție incendiară. Acest tip de armă a fost relevant în timpul ambelor războaie mondiale. A fost folosit în războiul din Gaza în 2009, precum și în Irak în 2016.

Fosforul roșu este utilizat mai pe scară largă. Este folosit pentru a produce combustibil, lubrifianți, explozivi și capete de chibrit. Diferiți compuși ai fosforului sunt utilizați în industrie în dedurizatoarele de apă și adăugați agenților de pasivare pentru a proteja metalul de coroziune.
Conținut în organism și efect asupra oamenilor
Fosforul este unul dintre elementele vitale pentru noi. Sub formă de compuși cu calciu, este prezent în dinți și schelet, dând oaselor duritate și rezistență. Elementul este prezent în compușii ATP și ADN. Este esențială pentru funcționarea creierului. Fiind în celulele nervoase, favorizează transmiterea impulsurilor nervoase.
Fosforul se găsește în țesutul muscular. Este implicat în procesul de transformare a energiei din proteinele, grăsimile și carbohidrații care intră în organism. Elementul menține echilibrul acido-bazic în celule, iar diviziunea lor are loc. Promovează metabolismul și este esențial în timpul creșterii și refacerii corpului.
Cu toate acestea, fosforul poate fi periculos. Fosforul alb în sine este foarte toxic. Dozele de peste 50 de miligrame sunt fatale. Intoxicația cu fosfor este însoțită de vărsături, dureri de cap și dureri de stomac. Contactul substanței cu pielea provoacă arsuri care se vindecă foarte lent și dureros.
Excesul de fosfor în organism duce la oase fragile, boli cardiovasculare, sângerări și anemie. Ficatul și sistemul digestiv suferă, de asemenea, de suprasaturare cu fosfor.
"...Da! Era un câine, imens, negru. Dar niciunul dintre noi muritorii nu a văzut vreodată un astfel de câine. Flăcări au izbucnit din gura ei deschisă, ochii ei au aruncat scântei, iar focul pâlpâitor i-a strălucit pe bot și pe ceafă. În creierul febril al nimănui nu putea apărea o viziune mai teribilă, mai dezgustătoare decât această creatură infernală care a sărit din ceață asupra noastră... Un câine teribil, de mărimea unei leoaice tinere. Gura ei uriașă încă strălucea cu o flacără albăstruie, ochii sălbatici adânci erau înconjurați de cercuri de foc.
Am atins acest cap luminos și, luându-mi mâna, am văzut că și degetele mele străluceau în întuneric. Fosfor, am spus.
Învățat? Arthur conan doyle. "Câinele din Baskerville."
În asta a fost implicat o poveste urâtă Elementul nr. 15.
O altă poveste proastă
Peste trei sute de ani ne despart de momentul în care alchimistul din Hamburg Genning Brand a descoperit un nou element - fosforul. Ca și alți alchimiști, Brand a încercat să găsească elixirul vieții sau piatra filosofală, cu ajutorul căreia bătrânii par mai tineri, bolnavii își revin, iar metalele comune se transformă în aur. Nu preocuparea pentru bunăstarea oamenilor, ci interesul propriu a ghidat Brand. Acest lucru este dovedit de fapte din istoria singurei descoperiri reale făcute de el.
În timpul unuia dintre experimente, a evaporat urina, a amestecat reziduul cu cărbune și nisip și a continuat evaporarea. Curând, în replică s-a format o substanță care strălucea în întuneric. Adevărat, kaltes Feuer (focul rece) sau „focul meu”, așa cum l-a numit Brand, nu a transformat plumbul în aur și nu a schimbat aspectul bătrânilor, dar faptul că substanța rezultată strălucea fără încălzire a fost neobișnuit și nou. .
Brand nu a întârziat să profite de această proprietate a noii substanțe. A început să arate fosfor diferitelor persoane privilegiate, primind de la aceștia daruri și bani. Nu a fost ușor să păstrezi secretul obținerii fosforului, iar Brand l-a vândut în curând chimistului din Dresda I. Kraff. Numărul demonstranților de fosfor a crescut când rețeta pentru producerea lui a devenit cunoscută de I. Kunkel și K. Kirchmeyer. În 1680, indiferent de predecesorii săi, un nou element a fost obținut de celebrul fizician și chimist englez Robert Boyle. Dar Boyle a murit curând, iar studentul său A. Gankwitz a trădat știința pură și a reînviat „speculațiile cu fosfor”. Abia în 1743 A. Markgraf a găsit o metodă mai avansată de producere a fosforului și și-a publicat datele pentru informare publică. Acest eveniment a pus capăt afacerii Brandului și a servit drept începutul unui studiu serios al fosforului și al compușilor acestuia.
La prima etapă de cincizeci de ani a istoriei fosforului, pe lângă descoperirea lui Boyle, un singur eveniment a fost marcat de istoria științei: în 1715, Gensing a stabilit prezența fosforului în țesutul cerebral. După experimentele Markgrave, istoria elementului, care mulți ani mai târziu a dobândit numărul 15, a devenit istoria multor mari descoperiri.
Cronologia acestor descoperiri
În 1769, Yu. Gan a dovedit că oasele conțin mult fosfor. Același lucru a fost confirmat doi ani mai târziu de celebrul chimist suedez K. Scheele, care a propus o metodă de producere a fosforului din cenușa formată în timpul prăjirii oaselor.
Câțiva ani mai târziu, J.L. Proust și M. Klaproth, studiind diverși compuși naturali, au demonstrat că fosforul este răspândit în scoarța terestră, în principal sub formă de fosfat de calciu.
El a obținut un mare succes în studierea proprietăților fosforului la începutul anilor 70 ai secolului al XVIII-lea. marele chimist francez Antoine Laurent Lavoisier. Prin arderea fosforului cu alte substanțe într-un volum închis de aer, Lavoisier a demonstrat că fosforul este un element independent, iar aerul are o compoziție complexă și este compus din cel puțin două componente - oxigen și azot. „În acest fel, pentru prima dată, el a pus pe picioare toată chimia, care în forma ei flogistică stătea pe cap.” Așa a scris F. Engels despre lucrările lui Lavoisier în prefața celui de-al doilea volum al Capitalului.
În 1799, Dondonald a dovedit că compușii de fosfor sunt necesari pentru dezvoltarea normală a plantelor.
În 1839, un alt englez, Laws, a fost primul care a obținut superfosfat - un îngrășământ cu fosfor care este ușor absorbit de plante.
În 1847, chimistul german Schrötter, încălzind fosfor alb fără acces la aer, a obținut o nouă varietate (modificare alotropică) a elementului nr. 15 - fosfor roșu, iar deja în secolul XX, în 1934, fizicianul american P. Bridgman, studiind influența presiunii înalte asupra diferitelor substanțe, fosfor negru izolat, asemănător grafitului. Acestea sunt principalele repere din istoria elementului nr. 15. Acum să vedem ce a urmat fiecare dintre aceste descoperiri.
„În 1715, Gensing a stabilit prezența fosforului în țesutul cerebral... În 1769, Hahn a dovedit că oasele conțin mult fosfor.”
Fosforul este un analog al azotului. Deși proprietățile fizice și chimice ale acestor elemente sunt foarte diferite, ele au și ceva în comun, în special faptul că ambele elemente sunt absolut necesare animalelor și plantelor. Academicianul A.E. Fersman a numit fosforul „elementul vieții și al gândirii”, iar această definiție cu greu poate fi clasificată drept exagerare literară. Fosforul se găsește literalmente în toate organele plantelor verzi: tulpini, rădăcini, frunze, dar mai ales în fructe și semințe. Plantele acumulează fosfor și îl furnizează animalelor.
La animale, fosforul este concentrat în principal în schelet, mușchi și țesut nervos.
Dintre produsele alimentare pentru oameni, gălbenușul de ouă de pui este deosebit de bogat în fosfor.
Corpul uman conține în medie aproximativ 1,5 kg de element nr. 15. Din această cantitate, 1,4 kg sunt în oase, aproximativ 130 g în mușchi și 12 g în nervi și creier. Aproape toate cele mai importante procese fiziologice care au loc în corpul nostru sunt asociate cu transformările substanțelor organofosforice. Fosforul se găsește în oase în principal sub formă de fosfat de calciu. Smalțul dinților este, de asemenea, un compus de fosfor, care în compoziție și structură cristalină corespunde celui mai important mineral fosforic, apatita Ca 5 (PO 4) 3 (F, Cl).
Desigur, ca orice element vital, fosforul suferă un ciclu în natură. Plantele îl iau din sol, iar din plante acest element pătrunde în corpurile oamenilor și ale animalelor. Fosforul revine în sol cu excrementele și când cadavrele putrezesc. Fosforobacteriile transformă fosforul organic în compuși anorganici.
Cu toate acestea, pe unitatea de timp, din sol este eliminat semnificativ mai mult fosfor decât intră în sol. Acum, recolta mondială elimină anual peste 3 milioane de tone de fosfor din câmpuri.
Desigur, pentru a obține producții durabile, acest fosfor trebuie returnat în sol și, prin urmare, nu este de mirare că producția mondială de rocă fosfatică se ridică acum la peste 100 de milioane de tone pe an.
„...Proust și Klaproth au demonstrat că fosforul este distribuit pe scară largă în scoarța terestră, în principal sub formă de fosfat de calciu.”
În scoarța terestră, fosforul apare exclusiv sub formă de compuși. Acestea sunt în principal săruri slab solubile ale acidului ortofosforic; Cationul este cel mai adesea non-calciu.
Fosforul reprezintă 0,08% din greutatea scoarței terestre. În ceea ce privește prevalența, se află pe locul 13 dintre toate elementele. Fosforul este continut in cel putin 190 de minerale, dintre care cele mai importante sunt: fluorapatita - Ca 5 (PO 4) 3 F, hidroxiapatita Ca 5 (PO 4) 3 OH, fosforit Ca 3 (PO 4) 2 cu impuritati.
Mai puțin frecvente sunt vivianit Fe 3 (PO 4) 2 8H 2 O, monazit (Ce, La) PO 4, amblygonit LaAl(PO 4) F, trifilit Li(Fe, Mn) PO 4 și chiar mai rar xenotim YPO 4 și torbernitul Cu (UO2)2[P04]212H2O.
Mineralele de fosfor sunt împărțite în primare și secundare. Dintre cele primare, apatitele sunt deosebit de frecvente, des întâlnite printre rocile de origine magmatică. Aceste minerale s-au format în timpul formării scoarței terestre.
Spre deosebire de apatite, fosforiții apar printre rocile de origine sedimentară, formate ca urmare a morții ființelor vii. Acestea sunt minerale secundare.
Fosforul se găsește în meteoriți sub formă de fosfuri de fier, cobalt și nichel. Desigur, acest element comun se găsește și în apa de mare (6·10–6%).
„Lavoisier a dovedit că fosforul este un element chimic independent...”
Fosforul este un nemetal (ceea ce anterior era numit metaloid) cu activitate medie. Orbita exterioară a atomului de fosfor conține cinci electroni, dintre care trei sunt nepereche. Prin urmare, poate prezenta valențe de 3–, 3+ și 5+.
Pentru ca fosforul să prezinte o valență de 5+, este necesar un anumit efect asupra atomului, care ar transforma cei doi electroni perechi ai ultimei orbite în cei nepereche.
Fosforul este adesea numit un element cu mai multe fațete. Într-adevăr, în diferite condiții se comportă diferit, prezentând fie proprietăți oxidative, fie proprietăți reducătoare. Versatilitatea fosforului include, de asemenea, capacitatea sa de a exista în mai multe modificări alotropice.
Poate cea mai faimoasă modificare a elementului nr. 15 este fosforul moale, ceros, alb sau galben. Brand a fost cel care l-a descoperit, iar datorită proprietăților sale elementul și-a primit numele: în greacă „fosfor” înseamnă luminos, luminifer. Molecula albă de fosfor este formată din patru atomi dispuși în formă de tetraedru. Densitate 1,83, punct de topire 44,1°C. Fosforul alb este otrăvitor și se oxidează ușor. Solubil în disulfură de carbon, amoniac lichid și SO2, benzen, eter. Aproape insolubil în apă.
Când este încălzit fără acces la aer peste 250°C, fosforul alb se transformă în roșu. Acesta este deja un polimer, dar nu o structură foarte ordonată. Reactivitatea fosforului roșu este semnificativ mai mică decât a fosforului alb. Nu strălucește în întuneric, nu se dizolvă în disulfură de carbon și nu este otrăvitor (conține întotdeauna cantități mici de fosfor alb, ca urmare a căruia poate fi otrăvitor.). Densitatea sa este mult mai mare, structura sa este fin-cristalină.
Mai puțin cunoscute sunt alte modificări, chiar mai mari, ale fosforului - violet, maro și negru, care diferă unele de altele prin greutatea moleculară și gradul de ordine al macromoleculelor. Fosforul negru, obținut pentru prima dată de P. Bridgman în condiții de presiune ridicată (200 mii atm la o temperatură de 200°C), amintește mai mult de grafit decât de fosforul alb sau roșu. Aceste modificări sunt exotice de laborator și, spre deosebire de fosforul alb și roșu, nu și-au găsit încă aplicație practică.
Apropo, despre aplicațiile fosforului elementar; Principalii săi consumatori sunt producția de chibrituri, metalurgia și producția chimică. În trecutul recent, o parte din fosforul elementar rezultat a fost cheltuit la întreprinderile militare; a fost folosit pentru prepararea compozițiilor de fum și incendiare.
Metalurgiștii se străduiesc de obicei să scape de impuritățile de fosfor din metal - înrăutățește proprietățile mecanice, dar uneori fosforul este introdus în aliaje în mod deliberat. Acest lucru se face atunci când este necesar ca metalul să se extindă ușor la solidificare și să preia cu precizie conturul formei. Fosforul este, de asemenea, utilizat pe scară largă în chimie. O parte din ea este utilizată pentru prepararea clorurilor de fosfor necesare sintezei anumitor preparate organice; Etapa de producere a fosforului elementar este prezentă și în unele scheme tehnologice de producere a îngrășămintelor cu fosfor concentrat.
Acum despre conexiunile sale.
Anhidrida fosforică P 2 O 5 este un excelent desicant care absoarbe cu lăcomie apa din aer și alte substanțe. Conținutul de P 2 O 5 este criteriul principal pentru valoarea tuturor îngrășămintelor fosfatice.
Acizii fosforici, în primul rând acidul ortofosforic H 3 PO 4 , sunt utilizați în industria chimică de bază. Sărurile acizilor fosforici sunt în primul rând îngrășăminte cu fosfor (o discuție specială despre acestea) și fosfați de metale alcaline necesari pentru producerea detergenților.
Halogenurile de fosfor (în principal clorurile PCl 3 și PCl 5) sunt utilizate în industria sintezei organice.
Dintre compușii fosforului cu hidrogen, cel mai faimos este fosfina PH 3 - un gaz incolor extrem de otrăvitor, cu miros de usturoi.
Printre compușii fosforici, un loc aparte le revine compușilor organofosforici. Majoritatea au activitate biologică. Prin urmare, unii compuși organofosforici sunt utilizați ca medicamente, alții ca agenți de combatere a dăunătorilor.
O clasă independentă de substanțe a constat din cloruri de fosfonitril - compuși ai fosforului cu azot și clor. Monomerul clorură de fosfonitril este capabil de polimerizare. Odată cu creșterea greutății moleculare, proprietățile substanțelor din această clasă se modifică, în special, solubilitatea lor în lichide organice scade considerabil. Când greutatea moleculară a polimerului atinge câteva mii, se obține o substanță asemănătoare cauciucului - singurul cauciuc de până acum care nu conține carbon deloc. Creșterea suplimentară a greutății moleculare duce la formarea de substanțe asemănătoare plasticului dur. „Cauciucul fără carbon” are o rezistență semnificativă la căldură: începe să se descompună abia la 350°C.
„În 1839, Englishman Laws a fost primul care a obținut superfosfat - un îngrășământ cu fosfor care este ușor absorbit de plante.”
Pentru ca plantele să absoarbă fosforul, acesta trebuie să fie într-un compus solubil. Pentru a obține acești compuși, fosfatul de calciu și acidul sulfuric sunt amestecate în astfel de proporții încât există două molecule gram de acid pe moleculă gram de fosfat. Ca rezultat al interacțiunii, se formează sulfat și fosfat dihidrogen de calciu solubil: Ca 3 (PO 4) 2 + 2H 2 SO 4 → 2CaSO 4 + Ca (H 2 PO 4) 2. Un amestec din aceste două săruri este cunoscut sub numele de superfosfat. În acest amestec, sulfatul de calciu din punct de vedere al agrochimiei este balast, dar de obicei nu este separat, deoarece această operațiune este costisitoare și crește foarte mult costul îngrășământului. Superfosfatul simplu conține doar 14...20% P 2 O 5.
Un îngrășământ cu fosfor mai concentrat este superfosfatul dublu. Se obține prin reacția fosfatului de calciu cu acid fosforic:
Ca3 (P04)2 + 4H3P04 → 3Ca (H2P04) 2.
Superfosfatul dublu conține 40...50% P 2 O 5. De fapt, mai corect ar fi să-l numim triplu: este de trei ori mai bogat în fosfor decât superfosfatul simplu.
Uneori, precipitatul CaHPO 4 2H 2 O este folosit ca îngrășământ cu fosfor, care se obține prin reacția acidului fosforic cu hidroxid sau carbonat de calciu:
Ca(OH)2 + H3PO4 → CaHP042H2O.
2CaCO 3 + 2H 3 PO 4 → 2CaHPO 4 2H 2 O + 2CO 2.
Acest îngrășământ conține 30...35% P 2 O 5.
Cu rezervele explorate de materii prime fosforice din țara noastră, precum și din întreaga lume, situația nu este pe deplin favorabilă. Academicianul S.I. Volfkovich de la tribuna celui de-al IX-lea Congres Mendeleev de chimie generală și aplicată a declarat:
„Dacă baza de materie primă a industriei de azot - aerul oceanului, apa și gazele naturale - nu limitează amploarea noilor construcții, iar zăcămintele de săruri de potasiu explorate până în prezent asigură dezvoltarea producției de îngrășăminte cu potasiu pentru mai mult de un mileniu, atunci rezervele de materii prime interne de fosfor studiate până în prezent la volumele mari planificate de producție de îngrășăminte vor dura doar câteva decenii.”
Asta nu înseamnă deloc că omenirea este amenințată de foamete și că recoltele vor scădea de la an la an. Există rezerve. O mulțime de fosfor suplimentar poate fi obținut prin prelucrarea complexă a materiilor prime minerale, sedimentele de fundul mării și explorări geologice mai detaliate. În consecință, nu avem motive speciale pentru pesimism, mai ales că URSS se află pe primul loc în lume în ceea ce privește rezervele înregistrate de minereuri de fosfor. Avem cele mai mari zăcăminte de apatită din Peninsula Kola și fosforite din sudul Kazahstanului și în alte locuri.
Dar acum este necesar să se caute noi zăcăminte și să se dezvolte metode de producere a îngrășămintelor fosfatice din minereuri mai sărace. Acest lucru este necesar pentru viitor, deoarece fosforul - „elementul vieții și al gândirii” - va fi întotdeauna necesar pentru umanitate.
Izotopi ai fosforului
Fosforul natural, spre deosebire de marea majoritate a elementelor, constă dintr-un singur izotop 31 P. Mai mulți izotopi radioactivi de scurtă durată ai elementului nr. 15 au fost sintetizați în reacții nucleare. Unul dintre ei, fosforul-30, s-a dovedit a fi primul izotop obținut artificial. Acesta a fost obținut în 1934 de Frederic și Irene Joliot-Curie prin iradierea aluminiului cu particule alfa. Fosforul-30 are un timp de înjumătățire de 2,55 minute și, pe măsură ce se descompune, emite pozitroni ("electroni pozitivi"). Acum sunt cunoscuți șase izotopi radioactivi ai fosforului. Cel mai longeviv dintre ele, 33 P, are un timp de înjumătățire de 25 de zile. Izotopii de fosfor sunt utilizați în principal în cercetarea biologică.
Începutul industriei superfosfatului
Prima producție industrială de superfosfat din lume a fost organizată în 1842 în Anglia. În Rusia, întreprinderi similare au apărut în 1868 și 1871. Înainte de revoluție, în țara noastră erau construite doar șase fabrici de superfosfat, productivitatea lor totală nu depășea 50 de mii de tone pe an. În timpul Primului Război Mondial, intervenției străine și războiului civil, patru din șase fabrici au eșuat, iar în 1918 s-au produs în țara noastră doar 2,8 mii de tone de superfosfat. Și doar 20 de ani mai târziu, în 1938, Uniunea Sovietică a ocupat primul loc în Europa și locul al doilea în lume la producția de îngrășăminte fosfatice. Acum, ponderea țării noastre în producția mondială de rocă fosfatică și îngrășăminte fosfatice este de aproximativ un sfert.
Mărturie D.N. Pryanishnikov
„...Oricât de corect ar fi depozitat și folosit gunoiul de grajd, acesta nu poate returna în sol ceea ce însuși nu conține, adică. o mare parte a fosforului înstrăinat de la fermă în cereale vândute, oase de animale, lapte etc.; Astfel, solul își pierde treptat, dar constant fosforul (sau cel puțin partea asimilabilă), iar dincolo de o anumită limită, fosforul intră în poziția acelui „factor minim” care îi lipsește cel mai mult pentru a obține o recoltă bună, așa cum a fost destul de corect. a notat Liebig.” (Din articolul „Despre importanța fosforilor pentru agricultura noastră și despre extinderea posibilității utilizării directe a fosforiților”, 1924).
Apatia arcticii
În 1926 A.E. Fersman și colaboratorii săi au descoperit rezerve uriașe de apatită în Peninsula Kola. Mulți ani mai târziu, academicianul A.E. Fersman a scris despre acest depozit: „...apatita scânteietoare cu nefelină cenușie formează un perete continuu de 100 m. Această minunată centură de tundre Khibiny se întinde pe 25 km, aplecându-se în jurul lor într-un inel. Cercetările au arătat că minereul de apatită pătrunde adânc chiar și sub suprafața oceanului și aproximativ două miliarde de tone din aceste minerale valoroase s-au acumulat aici, în Munții Khibiny, de neegalat oriunde în lume. („Mineralogie distractivă”, 1937.) Pe baza acestui zăcământ s-a construit uzina minieră și chimică de Apatită. CM. Kirov. Cu puțin timp înainte de război, a fost descoperit un alt depozit foarte mare de materii prime fosforice - fosforiții Kara-Tau în Kazahstan. Fosforiții se găsesc și în alte regiuni ale țării noastre, în special în regiunea Moscovei. Dar cea mai bună materie primă pentru producția de îngrășăminte cu fosfat provine încă din „centrul tundrelor Khibiny” de apatită.
Cum arată apatita?
Să ne întoarcem din nou la „Mineralogie distractivă”. „Apatita este fosfat de calciu, dar aspectul său este atât de variat și ciudat, încât nu degeaba bătrânii mineralogi o numeau apatită, care înseamnă „înșelător” în greacă: fie acestea sunt cristale transparente, care amintesc minut de beril sau chiar de cuarț, fie sunt mase dense, care nu se pot distinge de calcarul simplu, apoi acestea sunt sfere radiale, apoi roca este granulată și strălucitoare, ca marmura cu granulație grosieră.”
Cine e primul?
Istoricul francez F. Gefer susține că opinia general acceptată conform căreia fosforul a fost obținut pentru prima dată de alchimistul G. Brand în 1669 este incorectă. Potrivit lui, ei au putut să obțină fosfor încă din secolul al XII-lea. Alchimiștii arabi și tehnologia lor pentru obținerea fosforului era aceeași cu cea a lui Brand: evaporarea urinei și încălzirea reziduului uscat cu cărbune și nisip. Dacă da, atunci omenirea a fost familiarizată cu elementul nr. 15 de aproape 800 de ani.
Roșu și violet
Cele mai faimoase modificări ale fosforului sunt alb și roșu, ambele fiind folosite în industrie. Alte soiuri de element nr. 15 - fosfor violet, maro, negru - pot fi găsite doar în laboratoare. Dar fosforul violet a devenit cunoscut oamenilor mult mai devreme decât fosforul roșu. Omul de știință rus A.A. Musin-Pușkin a primit-o pentru prima dată în 1797. În unele cărți puteți găsi afirmația că fosforul roșu și violet sunt unul și același. Dar aceste soiuri diferă nu numai prin culoare. Cristalele de fosfor violet sunt mai mari. Fosforul roșu se obține prin încălzirea fosforului alb într-un volum închis deja la 250°C, iar violet doar la 500°C.
„Călugărul strălucitor”
Din memoriile academicianului S.I. Volfkovich: „Fosforul a fost produs într-un cuptor electric instalat la Universitatea din Moscova pe strada Mokhovaya. Deoarece aceste experimente au fost efectuate pentru prima dată în țara noastră la acea vreme, nu am luat măsurile de precauție necesare atunci când lucrez cu fosfor gazos - un element otrăvitor, auto-aprindere și strălucitor albăstrui. În timpul multor ore de muncă la cuptorul electric, o parte din gazul fosfor eliberat mi-a saturat atât de mult hainele și chiar pantofii, încât când mergeam noaptea de la universitate pe străzile întunecate, apoi neluminate ale Moscovei, hainele mele emanau o strălucire albăstruie, iar de sub pantofii mei (cand ii frec) pe trotuar) au izbucnit scantei.
De fiecare dată se aduna în spatele meu o mulțime, printre care, în ciuda explicațiilor mele, erau mulți oameni care vedeau în mine un reprezentant „proaspăt apărut” al lumii celeilalte. Curând, printre locuitorii districtului Mokhovaya și în toată Moscova, poveștile fantastice despre „călugărul luminos” au început să fie transmise din gură în gură...
Miracole fără miracole
Biserica a folosit în repetate rânduri fosforul alb pentru a păcăli credincioșii. Sunt cunoscute cel puțin două tipuri de „miracole” în care este implicată această substanță. Minunea unu: o lumânare care se aprinde singură. Se procedează astfel: pe fitil se aplică o soluție de fosfor în sulfură de carbon, solventul se evaporă destul de repede, iar boabele de fosfor rămase pe fitil sunt oxidate de oxigenul atmosferic și se aprind spontan. A doua minune: inscripții „divine” care clipesc pe pereți. Aceeași soluție, aceleași reacții. Dacă soluția este suficient de saturată, inscripțiile strălucesc mai întâi, apoi clipesc și dispar.
Organofosforul și viața
S-au scris multe volume despre rolul compușilor organofosforici în cele mai importante reacții biochimice ale organismului. În orice manual de biochimie, aceste substanțe nu sunt doar menționate de multe ori, ci și descrise în detaliu. Fără compuși organofosforici, procesul de metabolism al carbohidraților în țesutul cerebral nu ar putea avea loc. Enzima fosforilaza care conține fosfor favorizează nu numai descompunerea, ci și sinteza polizaharidelor în creier. În procesul de oxidare a carbohidraților în țesutul cerebral, nucleotida difosfopiridină și fosfatul anorganic joacă un rol important. Un alt proces important – contracția musculară este susținută de energia eliberată în timpul reacțiilor care implică adenozini fosfați. Când un mușchi se contractă, molecula de adenozin trifosfat (ATP) se descompune în adenozin difosfat și acid fosforic anorganic. Aceasta eliberează multă energie (8...11 kcal/mol). Rolul cel mai important al acestor substanțe este evidențiat de faptul că un nivel constant de ATP este întotdeauna menținut în țesutul muscular.