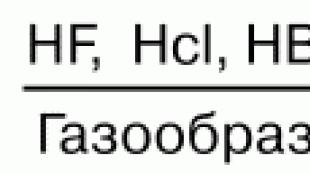Proprietățile fizice și chimice ale halogenilor aplicații ale compușilor. Halogeni și compușii lor. Compușii halogeni și rolul lor în corpul uman
Halogeni– Elemente din grupa VII – fluor, clor, brom, iod, astatin (astatina a fost puțin studiată datorită radioactivității sale). Halogenii sunt nemetale distincte. Doar iodul în cazuri rare prezintă unele proprietăți similare metalelor.
În starea neexcitată, atomii de halogen au o configurație electronică comună: ns2np5. Aceasta înseamnă că halogenii au 7 electroni de valență, cu excepția fluorului.
Proprietățile fizice ale halogenilor: F2 – gaz incolor, greu de lichefiat; Cl2 este un gaz galben-verzui, ușor lichefiat, cu un miros înțepător de sufocare; Br2 – lichid roșu-brun; I2 este o substanță cristalină violet.

Soluțiile apoase de halogenuri de hidrogen formează acizi. HF – acid fluorhidric (fluorura); HCl – clorhidric (sare); НBr—bromură de hidrogen; HI – iodură de hidrogen. Forța acizilor scade de sus în jos. Acidul fluorhidric este cel mai slab din seria acizilor halogenați, iar acidul iodhidric este cel mai puternic. Acest lucru se explică prin faptul că energia de legare a Hg scade de sus. Puterea moleculei NG scade în aceeași direcție, ceea ce este asociat cu o creștere a distanței internucleare. Solubilitatea sărurilor ușor solubile în apă scade, de asemenea:
De la stânga la dreapta, solubilitatea halogenurilor scade. AgF este foarte solubil în apă. Toți halogenii în stare liberă sunt agenți oxidanți. Puterea lor ca agenți oxidanți scade de la fluor la iod. În stare cristalină, lichidă și gazoasă, toți halogenii există sub formă de molecule individuale. Razele atomice cresc în aceeași direcție, ceea ce duce la creșterea punctelor de topire și de fierbere. Fluorul se disociază în atomi mai bine decât iodul. Potențialul electrodului scad la deplasarea în jos în subgrupul de halogen. Fluorul are cel mai mare potențial de electrod. Fluorul este cel mai puternic agent oxidant. Orice halogen liber superior îl va înlocui pe cel inferior, care se află în starea unui ion negativ încărcat individual în soluție.
20. Clorul. Acid clorhidric și acid clorhidric
clor (Cl) - se află în perioada a 3-a, în grupa VII a subgrupului principal al sistemului periodic, numărul de ordine 17, masa atomică 35.453; se referă la halogeni.
Proprietăți fizice: gaz galben-verzui cu miros înțepător. Densitate 3,214 g/l; punct de topire -101 °C; punctul de fierbere -33,97 °C, la temperatura obișnuită se lichefiază ușor sub o presiune de 0,6 MPa. Dizolvându-se în apă, formează apă clorură gălbuie. Este foarte solubil în solvenți organici, în special în hexan (C6H14) și tetraclorură de carbon.
Proprietățile chimice ale clorului: configuratie electronica: 1s22s22p63s22p5. Există 7 electroni la nivelul exterior. Pentru a finaliza nivelul, aveți nevoie de 1 electron, pe care clorul îl acceptă, prezentând o stare de oxidare de -1. Există și stări de oxidare pozitive ale clorului până la + 7. Se cunosc următorii oxizi de clor: Cl2O, ClO2, Cl2O6 și Cl2O7. Toate sunt instabile. Clorul este un agent oxidant puternic. Reacționează direct cu metale și nemetale:
Reacționează cu hidrogenul. În condiții normale, reacția decurge lent, cu încălzire sau iluminare puternică - cu o explozie, conform unui mecanism în lanț:
![]()
Clorul interacționează cu soluțiile alcaline, formând săruri - hipocloriți și cloruri:
Când clorul este trecut într-o soluție alcalină, se formează un amestec de soluții de clorură și hipoclorit:
Clorul este un agent reducător: Cl2 + 3F2 = 2ClF3.
Interacțiunea cu apa:
Clorul nu reacționează direct cu carbonul, azotul și oxigenul.
Chitanță: 2NaCl + F2 = 2NaF + Cl2.
Electroliză: 2NaCI + 2H2O = CI2 + H2 + 2NaOH.
Găsirea în natură: continut in urmatoarele minerale: halit (sare gema), silvita, bischofit; apa de mare conține cloruri de sodiu, potasiu, magneziu și alte elemente.
Acid clorhidric HCI. Proprietăți fizice: gaz incolor, mai greu decât aerul, foarte solubil în apă pentru a forma acid clorhidric.
Chitanță: in laborator:
În industrie: hidrogenul este ars într-un curent de clor. Apoi, clorura de hidrogen este dizolvată în apă pentru a forma acid clorhidric (vezi mai sus).
Proprietăți chimice: acidul clorhidric este puternic, monobazic, interactioneaza cu metalele din seria de tensiune pana la hidrogen: Zn + 2HCl = ZnCl2 + H2.
Ca agent reducător reacţionează cu oxizii şi hidroxizii multor metale.
Chimia Elementelor
Nemetale din subgrupa VIIA
Elementele subgrupului VIIA sunt nemetale tipice cu un nivel ridicat
electronegativitate, au un nume de grup - „halogeni”.
Principalele probleme abordate în prelegere
Caracteristicile generale ale nemetalelor din subgrupa VIIA. Structura electronică, cele mai importante caracteristici ale atomilor. Cel mai caracteristic ste-
penalități de oxidare. Caracteristici ale chimiei halogenilor.
Substanțe simple.
Compuși naturali.
Compuși halogeni
Acizi hidrohalici și sărurile lor. Sare și acid fluorhidric
sloturi, chitanță și cerere.
Complexe de halogenuri.
Compuși binari de oxigen ai halogenilor. Instabilitate cca.
Proprietățile redox ale substanțelor simple și co-
unități. Reacții de disproporționare. Diagrame latimer.
Executor testamentar: |
Evenimentul nr. |
||||||||||||||||

Chimia elementelor subgrupei VIIA
caracteristici generale
Mangan |
||||||||
Tehnețiu |
||||||||
Grupa VIIA este formată din elemente p: fluor F, clor
Cl, brom Br, iod I și astatin At.
Formula generală pentru electronii de valență este ns 2 np 5.
Toate elementele grupei VIIA sunt nemetale tipice.
După cum se vede din distribuție |
|||||||
electroni de valență |
|||||||
conform orbitalilor atomilor |
lipsește doar un electron |
||||||
pentru a forma o înveliș stabilă de opt electroni
cutii, de aceea au există o tendinţă puternică spre
adăugarea unui electron.
Toate elementele formează cu ușurință o singură încărcare simplă
anioni G – .
Sub formă de anioni simpli, elementele grupei VIIA se găsesc în apa naturală și în cristale de săruri naturale, de exemplu, halit NaCl, silvit KCl, fluorit
CaF2.
Denumirea generală a grupului de elemente VIIA-
grupul „halogeni”, adică „darea nașterii sărurilor”, se datorează faptului că majoritatea compușilor lor cu metale sunt pre-
este o sare tipică (CaF2, NaCl, MgBr2, KI), care
care poate fi obținută prin interacțiune directă
interacțiunea metalului cu halogenul. Halogenii liberi sunt obținuți din săruri naturale, așa că numele „halogeni” este tradus și ca „născut din săruri”.
Executor testamentar: |
Evenimentul nr. |
||||||||||||||||

Starea minimă de oxidare (–1) este cea mai stabilă
pentru toți halogenii.
Unele caracteristici ale atomilor elementelor din grupa VIIA sunt date în
Cele mai importante caracteristici ale atomilor elementelor grupei VIIA
Relativ- |
Afinitate |
||||||
electric |
|||||||
negativ |
ionizare, |
||||||
ness (conform |
|||||||
Sondaj) |
|||||||
creșterea numărului |
|||||||
straturi electronice; |
|||||||
creșterea dimensiunii |
|||||||
reducerea energiei electrice |
|||||||
triplă negativitate |
Halogenii au o afinitate electronică mare (maxim la
Cl) și energie de ionizare foarte mare (maxim la F) și maxim
electronegativitatea posibilă în fiecare perioadă. Fluorul este cel mai mult
electronegativ al tuturor elementelor chimice.
Prezența unui electron nepereche în atomii de halogen determină
reprezintă unirea atomilor din substanţe simple în molecule biatomice Г2.
Pentru substanțele simple, halogenii, cei mai caracteristici agenți oxidanți sunt
proprietăți, care sunt cele mai puternice în F2 și slăbesc atunci când treceți la I2.
Halogenii se caracterizează prin cea mai mare reactivitate dintre toate elementele nemetalice. Fluorul, chiar și printre halogeni, iese în evidență
are activitate extrem de mare.
Elementul din a doua perioadă, fluorul, diferă cel mai puternic de celălalt
alte elemente ale subgrupului. Acesta este un model general pentru toate nemetalele.
Executor testamentar: |
Evenimentul nr. |
||||||||||||||||
Fluorul, ca element cel mai electronegativ, nu arata sex
stari de oxidare rezidente. În orice legătură, inclusiv cu ki-
oxigen, fluorul este în stare de oxidare (-1).
Toți ceilalți halogeni prezintă grade de oxidare pozitive
leniya până la maximum +7.
Cele mai caracteristice stări de oxidare ale halogenilor:
F: -1, 0;
CI, Br, I: -1, 0, +1, +3, +5, +7.
Cl are oxizi cunoscuți în care se găsește în stări de oxidare: +4 și +6.
Cei mai importanți compuși halogeni, în stări pozitive,
Penalizările oxidării sunt acizii care conțin oxigen și sărurile acestora.
Toți compușii halogeni în stări pozitive de oxidare sunt
sunt agenți oxidanți puternici.
grad teribil de oxidare. Disproporționarea este promovată de un mediu alcalin.
Aplicarea practică a substanțelor simple și a compușilor oxigenului
Reducerea halogenilor se datorează în principal efectului lor oxidant.
Cele mai simple substanțe, Cl2, își găsesc cea mai largă aplicație practică.
și F2. Cea mai mare cantitate de clor și fluor este consumată în industrie
sinteza organica: in productia de materiale plastice, agenti frigorifici, solventi,
pesticide, medicamente. Cantități semnificative de clor și iod sunt folosite pentru obținerea metalelor și pentru rafinarea lor. Se folosește și clorul
pentru albirea celulozei, pentru dezinfectarea apei potabile și în producție
apă de înălbitor și acid clorhidric. Sărurile oxoacizilor sunt utilizate în producția de explozivi.
Executor testamentar: |
Evenimentul nr. |
||||||||||||||||

Acizii — acizi clorhidric și acizi topiți — sunt folosiți pe scară largă în practică.
Fluorul și clorul sunt printre cele mai comune douăzeci de elemente
acolo, există mult mai puțin brom și iod în natură. Toți halogenii apar în natură în starea lor de oxidare(-1). Numai iodul se găsește sub formă de sare KIO3,
care este inclus ca impuritate în salpetru chilian (KNO3).
Astatina este un element radioactiv produs artificial (nu există în natură). Instabilitatea lui At se reflectă în nume, care vine din greacă. „astatos” - „instabil”. Astatina este un emițător convenabil pentru radioterapia tumorilor canceroase.
Substanțe simple
Substanțele simple ale halogenilor sunt formate din molecule diatomice G2.
În substanțele simple, în timpul trecerii de la F2 la I2 cu creșterea numărului de electroni
straturile tronului și o creștere a polarizabilității atomilor, există o creștere
interacțiunea intermoleculară, conducând la o modificare a co-agregatelor
stând în condiții standard.
Fluorul (în condiții normale) este un gaz galben, la –181o C se transformă în
stare lichida.
Clorul este un gaz galben-verzui care se transformă în lichid la –34o C. Cu culoarea ha-
Numele Cl este asociat cu acesta, provine din grecescul „chloros” - „galben-
verde". O creștere bruscă a punctului de fierbere al Cl2 în comparație cu F2,
indică o interacțiune intermoleculară crescută.
Bromul este un lichid roșu închis, foarte volatil, fierbe la 58,8o C.
numele elementului este asociat cu mirosul neplăcut ascuțit de gaz și este derivat din
„bromos” – „miroase”.
Iod – cristale violet închis, cu un „metalic” slab
bulgări, care la încălzire se sublimă ușor, formând vapori violet;
cu răcire rapidă |
vapori până la 114°C |
se formează lichid. Temperatura |
|||||||||||||||||
Executor testamentar: |
Evenimentul nr. |
||||||||||||||||||
Punctul de fierbere al iodului este de 183 ° C. Numele său provine de la culoarea vaporilor de iod -
„iodos” - „violet”.
Toate substanțele simple au un miros înțepător și sunt otrăvitoare.
Inhalarea vaporilor lor provoacă iritarea membranelor mucoase și a organelor respiratorii, iar la concentrații mari - sufocare. În timpul Primului Război Mondial, clorul a fost folosit ca agent otrăvitor.
Fluorul gazos și bromul lichid provoacă arsuri ale pielii. Lucrul cu ha-
logens, trebuie luate măsuri de precauție.
Deoarece substanțele simple de halogeni sunt formate din molecule nepolare
se răcește, se dizolvă bine în solvenți organici nepolari:
alcool, benzen, tetraclorură de carbon etc. Clorul, bromul și iodul sunt puțin solubile în apă, soluțiile lor apoase se numesc clor, brom și apă iodată. Br2 se dizolvă mai bine decât altele, concentrația de brom în sat.
Soluția ajunge la 0,2 mol/l, iar clorul – 0,1 mol/l.
Fluorul descompune apa:
2F2 + 2H2O = O2 + 4HF
Halogenii prezintă activitate oxidativă ridicată și tranziție
în anioni halogenuri.
Г2 + 2e– 2Г–
Fluorul are activitate oxidativă deosebit de mare. Fluorul oxidează metalele nobile (Au, Pt).
Pt + 3F2 = PtF6
Interacționează chiar și cu unele gaze inerte (cripton,
xenon și radon), de exemplu,
Xe + 2F2 = XeF4
Mulți compuși foarte stabili ard într-o atmosferă F2, de ex.
apă, cuarț (SiO2).
SiO2 + 2F2 = SiF4 + O2
Executor testamentar: |
Evenimentul nr. |
||||||||||||||||

În reacțiile cu fluor, chiar și agenți oxidanți puternici precum azotul și sulful
acidul nic, acționează ca agenți reducători, în timp ce fluorul oxidează intrarea
conţinând O(–2) în compoziţia lor.
2HNO3 + 4F2 = 2NF3 + 2HF + 3O2 H2 SO4 + 4F2 = SF6 + 2HF + 2O2
Reactivitatea ridicată a F2 creează dificultăți în alegerea con-
materiale structurale pentru lucrul cu acesta. De obicei, în aceste scopuri folosim
Există nichel și cupru, care, atunci când sunt oxidate, formează pelicule protectoare dense de fluoruri pe suprafața lor. Numele F se datorează acțiunii sale agresive.
Mănânc, vine din greacă. „fluoros” – „distructiv”.
În seria F2, Cl2, Br2, I2, capacitatea de oxidare slăbește din cauza creșterii
creșterea dimensiunii atomilor și scăderea electronegativității.
În soluții apoase, proprietățile oxidative și reductive ale materiei
Substanțele sunt de obicei caracterizate folosind potențialele electrozilor. Tabelul prezintă potențialele standard ale electrodului (Eo, V) pentru semireacțiile de reducere
formarea de halogeni. Pentru comparație, valoarea Eo pentru ki-
carbonul este cel mai comun agent oxidant.
Potențialele standard ale electrodului pentru substanțe simple cu halogen
Eo, B, pentru reacție |
|||||||||||||
O2 + 4e– + 4H+ 2H2 O |
|||||||||||||
Eo, V |
|||||||||||||
pentru electrod |
|||||||||||||
2Г– +2е – = Г2 |
|||||||||||||
Activitate oxidativă redusă
După cum se vede din tabel, F2 este un agent oxidant mult mai puternic,
decât O2, prin urmare F2 nu există în soluții apoase , oxidează apa,
revenind la F–. Judecând după valoarea E®, capacitatea de oxidare a Cl2
Executor testamentar: |
Evenimentul nr. |
||||||||||||||||
de asemenea mai mare decât cea a O2. Într-adevăr, în timpul depozitării pe termen lung a apei cu clor, aceasta se descompune odată cu eliberarea de oxigen și formarea de HCl. Dar reacția este lentă (molecula Cl2 este vizibil mai puternică decât molecula F2 și
energia de activare pentru reacțiile cu clorul este mai mare), dispro-
portionare:
Cl2 + H2 O HCl + HOCl
În apă nu ajunge la capăt (K = 3,9 . 10–4), prin urmare Cl2 există în soluții apoase. Br2 și I2 se caracterizează printr-o stabilitate și mai mare în apă.
Disproporționarea este un oxidant foarte caracteristic
reacție de reducere pentru halogeni. Disproporționarea amplificării
se toarnă într-un mediu alcalin.
Disproporționarea Cl2 în alcali duce la formarea de anioni
Cl– și ClO–. Constanta de disproporționare este 7,5. 1015.
Cl2 + 2NaOH = NaCl + NaClO + H2O
Când iodul este disproporționat în alcalii, se formează I– și IO3–. Ana-
În mod logic, Br2 disproporționează iodul. Schimbarea produsului este disproporționată
națiune se datorează faptului că anionii GO– și GO2– din Br și I sunt instabili.
Reacția de disproporționare a clorului este utilizată în industrie
capacitatea de a obține un oxidant de hipoclorit puternic și cu acțiune rapidă,
var de albire, sare bertholet.
3Cl2 + 6 KOH = 5KCl + KClO3 + 3H2 O
Executor testamentar: |
Evenimentul nr. |
||||||||||||||||
Interacțiunea halogenilor cu metalele
Halogenii reacţionează puternic cu multe metale, de exemplu:
Mg + Cl2 = MgCl2 Ti + 2I2 TiI4
Halogenuri de Na +, în care metalul are o stare de oxidare scăzută (+1, +2),
- Acestea sunt compuși asemănătoare sărurilor cu legături predominant ionice. Cum să
Iată, halogenurile ionice sunt solide cu un punct de topire ridicat
Halogenuri metalice în care metalul are un grad ridicat de oxidare
ţiunile sunt compuşi cu legături predominant covalente.
Multe dintre ele sunt gaze, lichide sau solide fuzibile în condiții normale. De exemplu, WF6 este un gaz, MoF6 este un lichid,
TiCl4 este lichid.
Interacțiunea halogenilor cu nemetale
Halogenii interacționează direct cu multe nemetale:
hidrogen, fosfor, sulf etc. De exemplu:
H2 + Cl2 = 2HCl 2P + 3Br2 = 2PBr3 S + 3F2 = SF6
Legătura în halogenurile nemetalice este predominant covalentă.
De obicei, acești compuși au puncte de topire și de fierbere scăzute.
La trecerea de la fluor la iod, natura covalentă a halogenurilor crește.
Halogenurile covalente ale nemetalelor tipice sunt compuși acizi; atunci când interacționează cu apa, se hidrolizează pentru a forma acizi. De exemplu:
PBr3 + 3H20 = 3HBr + H3PO3
PI3 + 3H2O = 3HI + H3PO3
PCl5 + 4H20 = 5HCI + H3PO4
Executor testamentar: |
Evenimentul nr. |
||||||||||||||||

Primele două reacții sunt folosite pentru a produce brom și iodură de hidrogen.
acid noic.
Interhalogenuri. Halogenii, combinându-se între ei, formează inter-
Oportunitati. În acești compuși, halogenul mai ușor și mai electronegativ este în starea de oxidare (–1), iar cel mai greu este în stare pozitivă.
penalități de oxidare.
Datorită interacțiunii directe a halogenilor la încălzire se obțin următoarele: ClF, BrF, BrCl, ICl. Există, de asemenea, interhalogenuri mai complexe:
CIF3, BrF3, BrF5, IF5, IF7, ICl3.
Toate interhalogenurile în condiții normale sunt substanțe lichide cu puncte de fierbere scăzute. Interhalogenurile au o activitate oxidativă ridicată
activitate. De exemplu, substanțe stabile din punct de vedere chimic precum SiO2, Al2O3, MgO etc. ard în vapori de ClF3.
2Al2 O3 + 4ClF3 = 4 AlF3 + 3O2 + 2Cl2
Fluorura ClF 3 este un reactiv de fluorurare agresiv care acționează rapid
curte F2. Este utilizat în sinteze organice și pentru obținerea de pelicule de protecție pe suprafața echipamentelor cu nichel pentru lucrul cu fluor.
În apă, interhalogenurile se hidrolizează pentru a forma acizi. De exemplu,
CIF5 + 3H20 = HCI03 + 5HF
Halogeni în natură. Obținerea de substanțe simple
În industrie, halogenii sunt obținuți din compușii lor naturali. Toate
procesele de obţinere a halogenilor liberi se bazează pe oxidarea halogenului
Ioni Nid.
2Г – Г2 + 2e–
O cantitate semnificativă de halogeni se găsește în apele naturale sub formă de anioni: Cl–, F–, Br–, I–. Apa de mare poate conține până la 2,5% NaCl.
Bromul și iodul se obțin din apa puțului de petrol și apa de mare.
Executor testamentar: |
Evenimentul nr. |
||||||||||||||||
Halogenii fluor F, clor C1, brom Br, iod I sunt elemente din grupa VILA. Configurația electronică a învelișului de valență a atomilor de halogen în starea fundamentală ns 2 np 5 . Prezența a cinci electroni în orbitalul p exterior, inclusiv unul nepereche, este motivul afinității electronice ridicate a halogenilor. Adăugarea unui electron duce la formarea de anioni de halogenură (F-, Cl-, Br-, I-) cu o înveliș stabilă de 8 electroni a celui mai apropiat gaz nobil. Halogenii sunt nemetale distincte.
Cel mai electronegativ element, fluorul, are o singură stare de oxidare în compuși - 1, deoarece este întotdeauna un acceptor de electroni. Alți halogeni din compuși pot avea stări de oxidare cuprinse între -1 și +7. Stările de oxidare pozitive ale halogenilor sunt cauzate de tranziția electronilor lor de valență la orbitalii d liberi ai nivelului exterior (Secțiunea 2.1.3) la formarea de legături cu mai multe elemente electronegative.
Moleculele de halogen sunt biatomice: F 2, C1 2, Br 2, I 2. În condiții standard, fluorul și clorul sunt gaze, bromul este un lichid volatil (Tbp = 59 °C), iar iodul este un solid, dar se sublimează ușor (se transformă în stare gazoasă, ocolind starea lichidă).
Proprietăți redox. Halogenii sunt agenți oxidanți puternici, care reacționează cu aproape toate metalele și cu multe nemetale:
Fluorul prezintă o activitate chimică deosebit de mare, care, atunci când este încălzit, reacționează chiar și cu gazele nobile xenon, cripton și radon:
![]()
Activitatea chimică a halogenilor scade de la fluor la iod, deoarece odată cu creșterea razei atomice, capacitatea halogenilor de a atașa electroni scade:

Halogenul mai activ îl înlocuiește întotdeauna pe cel mai puțin activ din compușii săi cu metale. Astfel, fluorul înlocuiește toți ceilalți halogeni din halogenurile lor, iar bromul înlocuiește numai iodul din ioduri:
Diferitele proprietăți oxidative ale halogenilor se manifestă și prin efectul lor asupra organismului. Clorul gazos și fluorul, datorită proprietăților lor oxidante foarte puternice, sunt substanțe toxice puternice care provoacă leziuni severe plămânilor și mucoaselor ochilor, nasului și laringelui. Iodul este un agent oxidant mai blând care prezintă proprietăți antiseptice, deci este utilizat pe scară largă în medicină.
Diferențele în proprietățile redox ale halogenilor apar și atunci când aceștia interacționează cu apa. Fluorul oxidează apa, agentul reducător fiind atomul de oxigen al moleculei de apă:
Interacțiunea altor halogeni cu apa este însoțită de dismutarea redox a atomilor lor. Astfel, atunci când clorul reacţionează cu apa, unul dintre atomii moleculei de clor, câştigând un electron de la un alt atom, se reduce, iar celălalt atom de clor, renunţând la un electron, se oxidează. Aceasta creează apa cu clor, care conțin acid clorhidric (acid clorhidric) și acid hipocloros (hipocloros):
Reacția este reversibilă, iar echilibrul său este puternic deplasat spre stânga. Acidul hipocloros este instabil și se descompune ușor, mai ales la lumină, cu formarea unui agent oxidant foarte puternic - oxigenul atomic:
Astfel, apa cu clor conține în concentrații diferite trei agenți oxidanți cu abilități oxidante diferite: clor molecular, acid hipocloros și oxigen atomic, a căror sumă este adesea numită. "clor activ".
Oxigenul atomic rezultat înălbește coloranții și ucide microbii, ceea ce explică efectul de albire și bactericid al apei cu clor.
Acidul hipocloros este un agent oxidant mai puternic decât clorul gazos. Reacționează cu compușii organici RH atât ca agent oxidant, cât și ca reactiv de clorurare:
Prin urmare, atunci când apa potabilă care conține substanțe organice ca impurități este clorurată, acestea se pot transforma în compuși organoclorați mai toxici RC1. Acest lucru ar trebui să fie luat în considerare atunci când se dezvoltă metode de purificare a apei și aplicarea acestora.
Când se adaugă alcali în apa cu clor, echilibrul se deplasează spre dreapta datorită neutralizării acizilor hipocloros și clorhidric:
Soluția rezultată dintr-un amestec de săruri, numită apă de iavel, folosit ca albitor și dezinfectant. Aceste proprietăți se datorează faptului că hipocloritul de potasiu sub influența CO2 + H 2 0 și ca urmare a hidrolizei este transformat în acid hipocloros instabil, formând oxigen atomic. Drept urmare, apa Javel distruge coloranții și ucide microbii.
Când clorul gazos acționează asupra varului stins umed Ca(OH) 2, se obține un amestec de săruri CaCl 2 și Ca(0C1) 2, numit albire:
Clorura de var poate fi considerată ca o sare de calciu mixtă a acizilor clorhidric și hipocloros CaCl(OCl). În aerul umed, înălbitorul, interacționând cu apa și dioxidul de carbon, eliberează treptat acid hipocloros, care îi conferă proprietățile de albire, dezinfectare și degazare:
Când înălbitorul este expus la acid clorhidric, se eliberează clor liber:
Când este încălzit, acidul hipocloros se descompune ca urmare a disproporționării redox pentru a forma acizi clorhidric și percloric:
![]()
Când clorul este trecut printr-o soluție alcalină fierbinte, cum ar fi KOH, se formează clorură de potasiu și clorat de potasiu KClO 3 (sare Berthollet):
Capacitatea de oxidare a anionilor acizilor clor care conțin oxigen în soluții apoase din seria СlO - - СlO4(-) scade în ciuda creșterii gradului de oxidare a clorului în ei:
![]()
Acest lucru se explică printr-o creștere a stabilității anionilor din această serie datorită delocalizării crescute a sarcinii lor negative. În același timp, perclorații de LiC104 și KClO4 în stare uscată la temperaturi ridicate sunt agenți oxidanți puternici și sunt utilizați pentru mineralizarea diferitelor biomateriale la determinarea componentelor anorganice pe care le conțin.
Anionii halogen (cu excepția F-) sunt capabili să doneze electroni, deci sunt agenți reducători. Pe măsură ce raza lor crește, capacitatea de reducere a anionilor halogenuri crește de la anionul clorură la anionul iodură:

Astfel, acidul iodhidric este oxidat de oxigenul atmosferic deja la temperatura normala:
![]()
Acidul clorhidric nu este oxidat de oxigen și, prin urmare, anionul clor este stabil în condițiile corpului, ceea ce este foarte important din punct de vedere al fiziologiei și medicinei.
Proprietăți acido-bazice. Halogenurile de hidrogen HF, HC1, HBr, HI, datorită polarității moleculelor lor, sunt foarte solubile în apă. În acest caz, are loc hidratarea moleculelor, ducând la disocierea lor cu formarea de protoni hidratați și anioni halogenuri. Forța acizilor din seriile HF, HC1, HBr, HI crește datorită creșterii razei și a polarizabilității anionilor de la F- la I-.
Acidul clorhidric, ca componentă a sucului gastric, joacă un rol important în procesul de digestie. În principal datorită acidului clorhidric, a cărui fracțiune de masă în sucul gastric este de 0,3%, pH-ul său se menține în intervalul de la 1 la 3. Acidul clorhidric promovează tranziția enzimei pepsine la forma sa activă, ceea ce asigură digestia proteinelor. datorită clivajului hidrolitic a legăturilor peptidice cu formarea diferiților aminoacizi:
Determinarea conținutului de acid clorhidric și alți acizi din sucul gastric a fost discutată în secțiune. 8.3.3.
În seria de acizi ai clorului care conțin oxigen, pe măsură ce starea sa de oxidare crește, puterea acizilor crește.

Acest lucru se datorează unei creșteri a polarității legăturii O-H din cauza unei deplasări a densității sale de electroni către atomul de clor, precum și datorită creșterii stabilității anionilor.
Proprietăți de complexare. Anionii halogen tind să formeze complexe ca liganzi. Stabilitatea complecșilor de halogenuri scade de obicei în ordinea F- > Cl- > Br- > > I-. Este procesul de formare a complexului care explică efectul toxic al anionilor de fluor, care, prin formarea de complexe de fluor cu cationi metalici incluși în centrii activi ai enzimelor, le suprimă activitatea.
Molecula de iod prezintă proprietăți interesante de formare a complexului. Astfel, solubilitatea iodului molecular în apă crește brusc în prezența iodurii de potasiu, care este asociată cu formarea unui anion complex.
Stabilitatea scăzută a acestui ion complex asigură prezența iodului molecular în soluție. Prin urmare, în medicină, o soluție apoasă de iod cu adaos de KI este utilizată ca agent bactericid. În plus, iodul molecular formează complecși de incluziune cu amidon (secțiunea 22.3) și alcool polivinilic (iod albastru).În aceste complexe, moleculele de iod sau asociații lor cu anioni de iodură umplu canalele formate de structura elicoială a polimerilor polihidroxi corespunzători. Complecșii de incluziune nu sunt foarte stabili și sunt capabili să elibereze treptat iod molecular. Prin urmare, un medicament precum iodul albastru este un agent bactericid eficient, dar ușor, cu acțiune prelungită.
Rolul biologic și utilizarea halogenilor și a compușilor acestora în medicină. Halogenii sub formă de diferiți compuși fac parte din țesuturile vii. În organism, toți halogenii au o stare de oxidare de 1. În același timp, clorul și bromul există sub formă de anioni Cl- și Bran- hidratați, iar fluorul și iodul fac parte din biosubstratele insolubile în apă:
Compușii cu fluor sunt componente ale țesutului osos, unghiilor și dinților. Efectul biologic al fluorului este asociat în primul rând cu problema bolilor dentare. Anionul fluor, înlocuind ionul hidroxid în hidroxiapatită, formează un strat de smalț protector din fluorapatită solidă:
Fluorizarea apei potabile la o concentrație de ioni de fluor de 1 mg/l și adăugarea de fluorură de sodiu la pasta de dinți reduc semnificativ caria dentară în populație. Totodată, când concentrația de anion fluor din apa potabilă este peste 1,2 mg/l, fragilitatea oaselor și a smalțului dentar crește și apare epuizarea generală a organismului, numită fluoroza.
Anionii de clorură asigură fluxuri ionice prin membranele celulare, participă la menținerea homeostaziei osmotice și creează un mediu favorabil pentru acțiunea și activarea enzimelor protolitice ale sucului gastric.
Anionii de bromură din corpul uman sunt localizați în principal în glanda pituitară și alte glande endocrine. S-a stabilit prezența unei relații dinamice între conținutul de anioni de bromură și clorură din organism. Astfel, conținutul crescut de anioni de bromură din sânge favorizează eliberarea rapidă de anioni de clorură de către rinichi. Bromurile sunt localizate în principal în lichidul intercelular. Ele îmbunătățesc procesele inhibitoare în neuronii cortexului cerebral și, prin urmare, bromurile de potasiu, sodiu și bromocampfor sunt utilizate în farmacologie.
Iodul și compușii săi afectează sinteza proteinelor, grăsimilor și hormonilor. Mai mult de jumătate din cantitatea de iod se află în glanda tiroidă într-o stare legată sub formă de hormoni tiroidieni. Cu un aport insuficient de iod în organism, se dezvoltă gușa endemică. Pentru a preveni această boală, la sare de masă se adaugă NaI sau KI (1-2 g la 1 kg de NaCl). Astfel, toți halogenii sunt necesari pentru funcționarea normală a organismelor vii.
Capitolul 13
DEFINIȚIE
Halogeni– Elemente din grupa VIIA – fluor (F), clor (Cl), brom (Br) și iod (I).
Configurația electronică a nivelului de energie exterior al halogenilor ns 2 np 5. Deoarece halogenii nu au un singur electron înainte de a finaliza nivelul de energie, în ORR prezintă cel mai adesea proprietățile agenților oxidanți. Starile de oxidare ale halogenilor: de la „-1” la „+7”. Singurul element al grupului halogen, fluorul, prezintă o singură stare de oxidare „-1” și este cel mai electronegativ element.
Moleculele de halogen sunt diatomice: F 2, Cl 2, Br 2, I 2. Odată cu creșterea sarcinii nucleului unui atom al unui element chimic, adică la trecerea de la fluor la iod, capacitatea de oxidare a halogenilor scade, ceea ce este confirmat de capacitatea de a înlocui halogenii inferiori cu cei superiori din acizii hidrohalici și sărurile acestora:
Br2 + 2HI = I2 + 2HBr
CI2 + 2KBr = Br2 + 2KCI
Proprietățile fizice ale halogenilor
La nr. fluorul este un gaz galben deschis cu un miros înțepător. Otrăvitoare. Clorul este un gaz verde deschis, la fel ca fluorul, are un miros înțepător. Foarte otravitoare. La presiune ridicată și la temperatura camerei se transformă ușor într-o stare lichidă. Bromul este un lichid greu de culoare roșu-maro cu un miros neplăcut caracteristic. Bromul lichid, precum și vaporii săi, sunt foarte toxici. Bromul este slab solubil în apă și bine în solvenți nepolari. Iodul este un solid gri închis, cu o strălucire metalică. Vaporii de iod sunt violet. Iodul se sublimeaza usor, i.e. se transformă într-o stare gazoasă dintr-un solid, în timp ce ocolește starea lichidă.
Producția de halogeni
Halogenii pot fi obținuți prin electroliza soluțiilor sau topituri de halogenuri:
MgCl 2 = Mg + Cl 2 (topită)
Cel mai adesea, halogenii sunt obținuți prin reacția de oxidare a acizilor hidrohalici:
MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O
K 2 Cr 2 O 7 + 14HCl = 3Cl 2 + 2KCl +2CrCl 3 +7H 2 O
2KMnO 4 +16HCl = 2MnCl 2 +5Cl 2 +8H 2 O +2KCl
Proprietățile chimice ale halogenilor
Fluorul are cea mai mare activitate chimică. Majoritatea elementelor chimice, chiar și la temperatura camerei, interacționează cu fluorul, eliberând o cantitate mare de căldură. Chiar și apa arde în fluor:
2H2O + 2F2 = 4HF + O2
Clorul liber este mai puțin reactiv decât fluorul. Nu reacționează direct cu oxigenul, azotul și gazele nobile. Interacționează cu toate celelalte substanțe precum fluorul:
2Fe + Cl 2 = 2FeCl 3
2P + 5Cl2 = 2PCl5
Când clorul interacționează cu apa la rece, are loc o reacție reversibilă:
CI2 + H20↔HCl +HCIO
Amestecul de produse de reacție se numește apă cu clor.
Când clorul interacționează cu alcalii la rece, se formează amestecuri de cloruri și hipocloriți:
CI2 + Ca(OH)2 = Ca(Cl)OCl + H2O
Când clorul este dizolvat într-o soluție alcalină fierbinte, are loc următoarea reacție:
3Cl2 + 6KOH=5KCl +KClO3 +3H2O
Bromul, ca și clorul, se dizolvă în apă și, reacționând parțial cu acesta, formează așa-numita „apă cu brom”, în timp ce iodul este practic insolubil în apă.
Iodul diferă semnificativ în activitatea chimică de alți halogeni. Nu reacționează cu majoritatea nemetalelor și reacționează lent cu metalele numai atunci când este încălzit. Interacțiunea iodului cu hidrogenul are loc numai cu încălzire puternică; reacția este endotermă și foarte reversibilă:
H2 + I2 = 2HI - 53 kJ.
Exemple de rezolvare a problemelor
EXEMPLUL 1
| Exercițiu | Calculați volumul de clor (nr.) care a reacționat cu iodură de potasiu dacă s-a format iod cu o greutate de 508 g |
| Soluţie | Să scriem ecuația reacției: CI2 + 2KI = I2 + 2KCl Să aflăm cantitatea de iod formată: v(I 2)=m(I 2)/M(I 2) v(l2)=508/254=2 mol Conform ecuației reacției, cantitatea de substanță clor. Dintr-un manual de chimie, mulți oameni știu că halogenii includ elemente chimice ale sistemului periodic al lui Mendeleev din grupa 17 în tabel. Tradus din greacă ca naștere, origine. Aproape toate sunt foarte active, datorită cărora reacţionează violent cu substanţe simple, cu excepţia câtorva nemetale. Ce sunt halogenii și care sunt proprietățile lor? In contact cu Lista halogenilorHalogenii sunt buni agenți oxidanți; din acest motiv, în natură se găsesc doar în unii compuși. Cu cât numărul atomic este mai mare, cu atât activitatea chimică a elementelor din acest grup este mai mică. Grupul de halogen include următoarele elemente:
Acesta din urmă a fost dezvoltat la Institutul de Cercetări Nucleare, care se află în orașul Dubna. Fluorul este un gaz otrăvitor cu o culoare galben pal. Clorul este, de asemenea, otrăvitor. Acesta este un gaz care are un miros destul de înțepător și neplăcut de culoare verde deschis. Bromul are o culoare maro-roscat si este un lichid toxic care poate afecta chiar si simtul mirosului. Este foarte volatil, așa că se păstrează în fiole. Iodul este o substanță purpurie închisă, cristalină, ușor de sublimat. Astatina este radioactivă, culoarea cristalului: negru cu albastru, timpul de înjumătățire este de 8,1 ore.
Fluorul interacționează cu gazele inerte și este iradiat (Xe + F 2 = XeF 2 + 152 kJ). Când este încălzit, fluorul afectează alți halogeni, oxidându-i. Formula este valabilă: Hal 2 + F 2 = 2HalF, unde Hal = Cl, Br, I, At, în cazul în care stările de oxidare HalF ale clorului, bromului, iodului și astatinului sunt egale cu + 1. Fluorul interacționează destul de puternic și cu substanțele complexe. Consecința este oxidarea apei. În acest caz, are loc o reacție explozivă, care este scrisă pe scurt cu formula: 3F 2 + ZH 2 O = OF 2 + 4HF + H 2 O 2. ClorActivitatea clorului liber este puțin mai mică decât a fluorului, dar are și o bună capacitate de reacție. Acest lucru poate apărea atunci când interacționează cu multe substanțe simple, cu rare excepții sub formă de oxigen, azot și gaze inerte. El poate reactiona violent cu substante complexe, creând reacții de substituție, proprietatea de a adăuga hidrocarburi este și ea inerentă clorului. Când sunt încălzite, bromul sau iodul sunt înlocuiți din compușii cu hidrogen sau metale.
Cl2+ hν → 2Cl, Cl + H2 → HCl + H, H + Cl2 → HCl + Cl, Cl + H2 → HCl + H etc. Fotonii, atunci când sunt excitați, provoacă descompunerea moleculelor de Cl 2 în atomi și are loc o reacție în lanț, provocând apariția de noi particule care inițiază începutul etapei următoare. În istoria chimiei acest fenomen a fost studiat. Chimistul rus și laureat al Premiului Nobel N.N. Semenov. în 1956 a studiat reacția fotochimică în lanț și, prin urmare, a adus o mare contribuție la știință. Clorul reacționează cu multe substanțe complexe, acestea sunt reacții de substituție și adiție. Se dizolvă bine în apă. CI2 + H20 = HCI + HCIO - 25 kJ. Cu alcalii, când este încălzit, clorul poate disproporţionat.
Brom, iod și astatinActivitatea chimică a bromului este puțin mai mică decât cea a fluorului sau a clorului menționat mai sus, dar este și destul de mare. Bromul este adesea folosit sub formă lichidă. El, ca și clorul, se dizolvă foarte bine în apă. Are loc o reacție parțială cu acesta, permițând obținerea „apă cu brom”. Activitatea chimică a iodului este semnificativ diferită de alți reprezentanți ai acestei serii. Aproape că nu interacționează cu nemetale, ci cu Cu metalele reacția are loc foarte lent și numai atunci când sunt încălzite. În acest caz, are loc o absorbție mare de căldură (reacție endotermă), care este foarte reversibilă. in afara de asta Iodul nu poate fi dizolvat în apă în niciun fel, acest lucru nu se poate realiza nici măcar cu încălzire, motiv pentru care „apa cu iod” nu există în natură. Iodul poate fi dizolvat doar în soluție de iodură. În acest caz, se formează anioni complecși. În medicină, acest compus se numește soluție Lugol. Astatinul reacționează cu metalele și hidrogenul. În seria halogenilor, activitatea chimică scade în direcția de la fluor la astatin. Fiecare halogen din seria F - At este capabil să înlocuiască elementele ulterioare din compușii cu metale sau hidrogen. Astatinul este cel mai pasiv dintre aceste elemente. Dar se caracterizează prin interacțiunea cu metalele. AplicațieChimia este ferm înrădăcinată în viața noastră, pătrunzând în toate domeniile. Omul a învățat să folosească halogenii, precum și compușii acestora, în beneficiul său. Semnificația biologică a halogenilor este incontestabilă. Domeniile lor de aplicare sunt diferite:
Clorul a găsit cea mai răspândită utilizare în viața noastră. Domeniul de aplicare al acestuia este destul de divers. Exemple de utilizare:
Trebuie amintit că halogenii sunt substanțe foarte toxice. Această proprietate este deosebit de pronunțată în fluor. Halogenii pot provoca asfixiere, iritații respiratorii și pot afecta țesutul biologic. Vaporii de clor pot fi extrem de periculoși, la fel ca aerosolul de fluor, care are un miros slab și poate fi simțit în concentrații mari. O persoană poate experimenta un efect de sufocare. Când lucrați cu astfel de conexiuni, trebuie luate măsuri de precauție. Metodele de producere a halogenilor sunt complexe și variate. În industrie, acest lucru este abordat cu anumite cerințe, care sunt respectate cu strictețe. Mai multe despre subiect |
 Activitatea mare de oxidare a halogenilor scade de la fluor la iod. Cel mai activ dintre frații săi este fluorul, care are capacitatea de a reacționa cu orice metale, formând săruri, unele dintre ele se aprind spontan, eliberând o cantitate imensă de căldură. Fără încălzire, acest element reacționează cu aproape toate nemetalele, reacțiile sunt însoțite de degajarea unei anumite cantități de căldură (exotermă).
Activitatea mare de oxidare a halogenilor scade de la fluor la iod. Cel mai activ dintre frații săi este fluorul, care are capacitatea de a reacționa cu orice metale, formând săruri, unele dintre ele se aprind spontan, eliberând o cantitate imensă de căldură. Fără încălzire, acest element reacționează cu aproape toate nemetalele, reacțiile sunt însoțite de degajarea unei anumite cantități de căldură (exotermă). Acest element are o relație deosebită cu hidrogenul. La temperatura camerei și fără expunere la lumină, clorul nu reacționează în niciun fel la acest gaz, dar odată ce este încălzit sau îndreptat către lumină, va avea loc o reacție explozivă în lanț. Formula este dată mai jos:
Acest element are o relație deosebită cu hidrogenul. La temperatura camerei și fără expunere la lumină, clorul nu reacționează în niciun fel la acest gaz, dar odată ce este încălzit sau îndreptat către lumină, va avea loc o reacție explozivă în lanț. Formula este dată mai jos: Din compusul natural criolit, a cărui formulă chimică este următoarea: Na3AlF6, se obține aluminiu. Compușii cu fluor sunt utilizați pe scară largă în producție paste de dinti. Fluorul este cunoscut pentru a ajuta la prevenirea cariilor. Se folosește tinctură cu alcool de iod pentru dezinfecția și dezinfecția rănilor.
Din compusul natural criolit, a cărui formulă chimică este următoarea: Na3AlF6, se obține aluminiu. Compușii cu fluor sunt utilizați pe scară largă în producție paste de dinti. Fluorul este cunoscut pentru a ajuta la prevenirea cariilor. Se folosește tinctură cu alcool de iod pentru dezinfecția și dezinfecția rănilor.