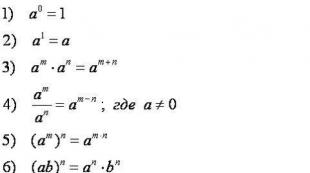Ce este transportul activ în biologie. Transport pasiv și activ. Pompa pentru sodiu și potasiu
Transportul activ se referă la procese în care o moleculă trebuie să se deplaseze printr-o membrană indiferent de direcția gradientului său de concentrație. Cel mai adesea, aceasta apare de la o regiune RF cu o concentrație mai mică la o regiune cu una mai mare și este însoțită de o creștere a energiei libere, care este de 5,71 lgC2 / C | kJ mol-1.
După cum sa menționat anterior, acesta este procesul de transfer al substanțelor din locuri cu o valoare mai mică a potențialului electrochimic în locuri cu valoarea sa mai mare.
Deoarece transportul activ în membrană este însoțit de o creștere a energiei Gibbs, acesta nu poate continua spontan, adică, pentru un astfel de proces, este necesar să interfațăm cu o reacție care continuă spontan. În ansamblu, acest lucru se poate face în două moduri: 1) împreună cu procesul de hidroliză ATP, adică datorită cheltuielilor de energie stocate în legături cu energie mare; 2) mediat de potențialul membranei și / sau de gradientul concentrației ionice în prezența și membrana purtătorilor specifici.
În primul caz, transportul se efectuează cu ajutorul pompelor de ioni electrogene care funcționează în detrimentul energiei libere a hidrolizei ATP. Acestea sunt denumite sisteme speciale de proteine integrale și se numesc ATPaze de transport. În prezent, sunt cunoscute trei tipuri de pompe ionice electrogene care efectuează transferul ionilor prin membrană: K + - Na + - ATPaza, datorită energiei eliberate în timpul hidrolizei fiecărei molecule ATP, doi ioni de potasiu sunt transferați în celulă și trei ioni de sodiu sunt pompați; în Ca2 + - ATPaza datorită energiei hidrolizei ATP, se transferă doi ioni de calciu; în pompa H + - doi protoni.
În cel de-al doilea caz, transportul substanțelor este secundar, pentru care au fost investigate în profunzime trei scheme.
Transferul ionic unidirecțional în combinație cu un purtător specific se numește uniport. În acest caz, o sarcină este transferată prin membrană fie de un complex dacă molecula purtătoare este neutră din punct de vedere electric, fie de un purtător gol dacă transportul este asigurat de un purtător încărcat. Rezultatul transferului va fi acumularea de ioni datorită unei scăderi a potențial de membrană... Acest efect se observă odată cu acumularea de ioni de potasiu în prezența valinomicinei în mitocondriile energizate.
Contra transferul ionilor cu participarea unei molecule purtătoare unice se numește antiport. În acest caz, se presupune că molecula purtătoare formează un complex puternic cu fiecare dintre ionii transportați. Transferul se efectuează în două etape: mai întâi, un ion traversează membrana de la stânga la dreapta, apoi al doilea ion - în direcția opusă. În acest caz, potențialul membranei nu se modifică. Aparent forta motriceîn acest proces este diferența de concentrație a unuia dintre ionii transportați. Dacă inițial nu a existat nicio diferență în concentrația celui de-al doilea ion, atunci rezultatul transferului va fi acumularea celui de-al doilea ion datorită unei scăderi a diferenței în concentrația primului. Un exemplu clasic de antiport este transferul ionilor de potasiu și hidrogen pe membrana celulară cu participarea antibioticului nigiricin. Trebuie remarcat faptul că majoritatea proteinelor purtătoare funcționează ca un antiport, adică mișcarea unei substanțe prin membrană devine posibilă doar în schimbul unei substanțe destul de specifice care are aceeași sarcină, dar se mișcă în direcția opusă.
Astfel, ieșirea oricărei componente principale a celulei de către gradient de concentrație, poate controla mișcarea unei substanțe care se îndreaptă spre ea împotriva gradientului ei și poate efectua „lucru” până când ambele forțe motrice sunt echilibrate.
Transferul comun unidirecțional de substanțe cu participarea unui purtător cu două locuri se numește simptom. Se presupune că membrana poate conține două particule neutre din punct de vedere electric: un purtător într-un complex cu un cation și anion și un purtător gol. Deoarece potențialul de membrană într-un astfel de sistem de transport nu se modifică, motivul transportului poate fi diferența de concentrație a unuia dintre ioni. Se crede că, conform schemei symport, rezultă că acest proces ar trebui să fie însoțit de o schimbare semnificativă a echilibrului osmotic, deoarece într-un ciclu două particule sunt transferate prin membrană în aceeași direcție.
Datorită prezenței suficient de bine dezvoltate (teorii, mecanisme de transport al ionilor și endogene materie organicăîn celulă, a devenit posibilă interpretarea datelor obținute în experimentele cu medicamente (secțiunea 6.3.3).
Prin analogie cu Fig. 6.10 transportul activ poate fi reprezentat așa cum se arată în Fig. 6.11.
În acest caz, purtătorul C formează un complex CA cu medicamentul (L) pe partea exterioară a membranei. Pătrunde în membrană, despărțind L de cealaltă parte. În cazul transportului activ, concentrația de L pe partea interioară a membranei poate fi mult mai mare decât concentrația pe partea exterioară. Spre deosebire de transportul pasiv (Fig. 6.10), complexul CA, folosind energia ATP, se transformă într-un complex C "A, care se desprinde cu ușurință de pe A (Fig. 6.11). Ținând cont de necesitatea cheltuielilor energetice pentru transportul CA către partea opusă a membranei, se poate presupune că / (, (constanta clivajului) pe partea interioară este mai mare decât K0. Aceasta este așa-numita scindare asimetrică a complexului purtător de medicamente.
Faza apoasă externă
Concentrație [L] 0 Activitate (L) 0
La organismele vii, mecanismele de transport active sunt răspândite și pot fi considerate una dintre funcțiile fundamentale ale celulei. De exemplu, celulele au o concentrație mare de potasiu și o concentrație scăzută de sodiu, spre deosebire de spațiul extracelular, unde acești ioni sunt în relație opusă. Membranele sunt liber accesibile pentru ambii ioni și distribuția asimetrică este menținută prin pomparea constantă a sodiului din celulă și a potasiului spre interior. .Secreția de HC1 în stomac este un real transport activ de H + și SG. Iodul este concentrat în glanda tiroidă printr-un mecanism similar. Zaharurile sunt transportate împotriva concentrațiilor mai mari în intestine și în tubulii renali proximali. Aminoacizii se comportă similar în intestine, rinichi, mușchi și creier. Secreția acizilor organici (napa-aminobenzoic, hipuric) de către tubii renali este un proces de transport activ.
Mecanismul de transport activ este extrem de specific, deoarece a fost creat de natură pentru a satisface nevoile biologice ale organismului pentru nutrienții necesari sau pentru a elimina din acesta produsele metabolismului lor. În ceea ce privește medicamentele care suferă un transport activ, în acest caz acestea ar trebui să fie apropiate în structura chimică de substanțele naturale ale corpului. Prin transportul activ în intestin, analogul pirimidinei ftorafur și fierul sunt absorbite. Folosind același mecanism, levodopa traversează bariera hematoencefalică. În tubulii renali, medicamentele legate de acizi organici și baze sunt secretate.
Rezumând luarea în considerare a mecanismelor de transport transmembranar al substanțelor, este necesar să subliniem încă o dată că, în procesul activității vitale, o varietate de substanțe traversează limitele celulare, ale căror fluxuri sunt efectiv reglementate. Această sarcină este gestionată de membrana celulară cu sisteme de transport încorporate în ea, inclusiv pompe de ioni, un sistem de molecule purtătoare și foarte selectiv canale ionice.
La prima vedere, o astfel de abundență de sisteme de transfer pare inutilă, deoarece funcționarea numai a pompelor de ioni face posibilă furnizarea trăsăturilor caracteristice transport biologic: selectivitate ridicată, transfer de substanțe împotriva forțelor de difuzie și câmpului electric. Paradoxul este, totuși, că numărul de debituri care trebuie reglat este infinit de mare, în timp ce există doar trei pompe. În acest caz, mecanismele conjugării ionice, numite transport activ secundar, în care procesele difuze joacă un rol important, sunt de o importanță deosebită. Astfel, combinația transportului activ al substanțelor cu fenomenele de transfer de difuzie în membrana celulară este baza care asigură activitatea vitală a celulei.
Proteinele de transport ale membranei sunt implicate în transportul ionilor prin plasmalemă. Aceste proteine pot conduce o substanță într-o singură direcție (uniport) sau mai multe substanțe simultan (symport) și, de asemenea, împreună cu importul unei substanțe, pot elimina o altă substanță din celulă (antiport). Glucoza, de exemplu, poate intra în celule simpatic împreună cu ionul Na +. Transportul ionului poate avea loc de-a lungul gradientului de concentrație, adică pasiv, fără consum suplimentar de energie. În cazul transportului pasiv, unele proteine de transport ale membranei formează complexe moleculare, canale prin care moleculele dizolvate trec prin membrană prin difuzie simplă de-a lungul gradientului de concentrație. Unele dintre aceste canale sunt deschise în mod constant, altele pot fi închise sau deschise ca răspuns fie la legarea moleculelor de semnalizare, fie la modificările concentrației intracelulare a ionilor. În alte cazuri, proteinele purtătoare de membrană speciale se leagă selectiv de unul sau alt ion și îl transportă pe membrană (difuzie facilitată). Concentrația ionilor în citoplasma celulelor diferă brusc nu numai de concentrația din mediul extern, ci chiar și de plasma sanguină care scaldă celulele din corpul animalelor superioare. Concentrația totală a cationilor monovalenți atât în interiorul celulelor, cât și în exterior este practic aceeași (150 mM), izotonică. Dar în citoplasmă, concentrația de K + este de aproape 50 de ori mai mare, iar Na + este mai mică decât în plasma sanguină, iar această diferență se menține doar într-o celulă vie: dacă o celulă este ucisă sau procesele metabolice sunt suprimate în ea, apoi după un timp diferențele ionice de ambele părți vor dispărea membrana plasmatică. Puteți pur și simplu să răciți celulele la +2 o С și, după un timp, concentrațiile de K + și Na + de pe ambele părți ale membranei vor deveni aceleași. Când celulele sunt încălzite, această diferență este restabilită. Acest fenomen se datorează faptului că există purtători de proteine de membrană în celule care acționează împotriva gradientului de concentrație, în timp ce cheltuiesc energie din cauza hidrolizei ATP. Acest tip de transfer de substanțe se numește transport activ și se efectuează cu ajutorul pompelor de ioni proteici. Membrana plasmatică conține o moleculă cu două subunități (K + + Na +) - o pompă, care este, de asemenea, o ATPază. Această pompă pompează 3 ioni Na + într-un singur ciclu și pompează 2 ioni K + în celulă împotriva gradientului de concentrație. În acest caz, se cheltuiește o moleculă de ATP, care merge la fosforilarea ATPazei, ca urmare a căreia Na + este transportat prin membrană din celulă, iar K + este capabil să se lege de o moleculă de proteină și apoi să fie transferat în celulă. Ca rezultat al transportului activ cu ajutorul pompelor cu membrană, concentrația cationilor bivalenți Mg 2+ și Ca + este, de asemenea, reglată în celulă, tot cu consumul de ATP. În combinație cu transportul activ al ionilor, diferite zaharuri, nucleotide și aminoacizi pătrund prin membrana plasmatică. Astfel, transportul activ al glucozei, care simultan (simultan) pătrunde în celulă împreună cu fluxul ionului Na + transportat pasiv, va depinde de activitatea pompei (K +, Na +). Dacă această pompă este blocată, atunci în curând diferența de concentrație de Na + pe ambele părți ale membranei va dispărea, în timp ce difuzia Na + în celulă va scădea și, în același timp, fluxul de glucoză în celulă se va opri. De îndată ce activitatea (K + + Na +) - ATPaza este restabilită și se creează o diferență în concentrația de ioni, atunci fluxul difuz de Na + și simultan transportul glucozei cresc imediat. Ca aceasta
se efectuează transportul aminoacizilor, care sunt transportați peste membrană de proteine purtătoare speciale care funcționează ca un sistem simport, transferând simultan ioni. Transportul activ al zaharurilor și aminoacizilor în celulele bacteriene se datorează gradientului ionilor de hidrogen. Participarea însăși a proteinelor de membrană speciale la transportul pasiv sau activ al compușilor cu greutate moleculară mică arată specificitatea ridicată a acestui proces. Chiar și în cazul transportului ionic pasiv, proteinele „recunosc” acest ion, interacționează cu acesta, se leagă în mod specific, își schimbă conformația și funcția. În consecință, chiar și pe exemplul transportului de substanțe simple, membranele acționează ca analizoare, ca receptori. Funcția receptor a membranei se manifestă în special atunci când biopolimerii sunt absorbiți de celulă.
Contacte intercelulare.
În organismele multicelulare, datorită interacțiunilor intercelulare, se formează ansambluri celulare complexe, a căror întreținere se efectuează în moduri diferite. În țesuturile embrionare, embrionare, în special în primele etape ale dezvoltării, celulele rămân în comunicare între ele datorită capacității suprafețelor lor de a se lipi între ele. Această proprietate adeziune(conexiunea, aderența) celulelor pot fi determinate de proprietățile suprafeței lor, care interacționează în mod specific între ele. Uneori, în special în epiteliile unilamelare, membranele plasmatice ale celulelor vecine formează invaginații multiple asemănătoare unei suturi de tâmplărie. Acest lucru creează o rezistență suplimentară pentru joncțiunea intercelulară. În plus față de o astfel de conexiune simplă adezivă (dar specifică), există o serie de structuri intercelulare speciale, contacte sau conexiuni care îndeplinesc funcții specifice. Acestea sunt blocarea, ancorarea și conexiunile de comunicații. Blocare sau strânsă, legătura este caracteristică epiteliului unilamelar. Aceasta este zona în care straturile exterioare ale celor două membrane plasmatice sunt cât mai aproape posibil. O membrană cu trei straturi este adesea văzută în acest contact: cele două straturi osmiofile exterioare ale ambelor membrane par să se îmbine într-un singur strat comun de 2 - 3 nm grosime. Pe preparatele plane ale fracturilor de membrană plasmatică în zona de contact strâns, folosind metoda de congelare și decolteu, s-a constatat că punctele de contact ale membranelor sunt globule (cel mai probabil, proteine integrale speciale ale membranei plasmatice) dispuse în rânduri. Astfel de rânduri de globule sau benzi se pot intersecta astfel încât să formeze o rețea sau o rețea pe suprafața de decolteare. Această structură este foarte caracteristică epiteliului, în special a celor glandulare și intestinale. În ultimul caz, contactul strâns formează o zonă continuă de fuziune a membranelor plasmatice, înconjurând celula în partea apicală (superioară, care privește lumenul intestinal) al acesteia. Astfel, fiecare celulă a stratului este, așa cum ar fi, înconjurată de o bandă a acestui contact. Astfel de structuri cu culori speciale pot fi văzute și la microscopul cu lumină. Au primit numele plăcilor de la morfologi. În acest caz, rolul contactului strâns de închidere nu este doar conexiunea mecanică a celulelor între ele. Această zonă de contact este slab permeabilă la macromolecule și ioni și, prin urmare, blochează, blochează cavitățile intercelulare, izolându-le (și împreună cu ele mediul intern al corpului) de mediul extern (în acest caz, lumenul intestinal ). Deși toate joncțiunile strânse sunt bariere în calea macromoleculelor, permeabilitatea lor la molecule mici este diferită în diferite epitelii. Ancorare (adeziune) conexiunile sau contactele sunt așa numite deoarece nu numai că conectează membranele plasmatice ale celulelor vecine, ci se leagă și de elementele fibrilare ale citoscheletului. Acest tip de compus se caracterizează prin prezența a două tipuri de proteine. Una dintre ele este reprezentată de proteinele linker transmembranare (de legare), care sunt implicate fie în joncțiunea intercelulară reală, fie în joncțiunea plasmalemei cu componentele matricei extracelulare (membrana bazală a epiteliilor, proteinele structurale extracelulare ale țesutului conjunctiv). Al doilea tip include proteine intracelulare care leagă sau ancorează elemente de membrană ale unui astfel de contact cu fibrilele citoplasmatice ale citoscheletului. Joncțiunile de aderență punct intercelulară se găsesc în multe țesuturi non-epiteliale, dar structura aderenței (adezivului) este descrisă mai clar. casete, sau curele, în epiteliu unilamelar. Această structură înconjoară întregul perimetru al celulei epiteliale, la fel ca în cazul unei joncțiuni strânse. Cel mai adesea, o astfel de centură sau bandă se află sub conexiunea strânsă. În acest loc, membranele plasmatice sunt reunite și chiar distanța de 25 - 30 nm este ușor îndepărtată și între ele este vizibilă o zonă cu densitate crescută. Acestea nu sunt altceva decât locuri de interacțiune a glicoproteinelor transmembranare, care, cu participarea ionilor de Ca ++, aderă în mod specific unul la altul și asigură o conexiune mecanică a membranelor a două celule vecine. Proteinele linker sunt caderine - proteine receptor care asigură recunoașterea specifică a membranelor omogene de către celule. Distrugerea stratului de glicoproteină duce la izolarea celulelor individuale și distrugerea stratului epitelial. Din partea citoplasmatică din apropierea membranei, o acumulare de materie densă, care este alăturat de un strat de filamente subțiri (6 - 7 nm) care se află de-a lungul membranei plasmatice sub forma unui fascicul care se desfășoară de-a lungul întregului perimetru al celulei. Filamentele subțiri sunt fibrile de actină; se leagă de membrana plasmatică prin intermediul proteinei vinculin, care formează un strat dens peri-membranar. Semnificația funcțională a conexiunii benzii nu constă doar în aderența mecanică a celulelor între ele: atunci când filamentele de actină din bandă se contractă, forma celulei se poate schimba. Contacte focale sau plăci de ambreiaj, se găsesc în multe celule și sunt studiate în special bine pe fibroblaste. Acestea sunt construite conform unui plan general cu benzi adezive, dar sunt exprimate sub formă de zone mici - plăci pe plasmalemă. În acest caz, proteinele linker transmembranare se leagă în mod specific de proteinele matricei extracelulare, cum ar fi fibronectina. Din partea citoplasmei, aceleași glicoproteine sunt asociate cu proteinele de membrană, care include vinculina, care la rândul ei este asociată cu un pachet de filamente de actină. Semnificația funcțională a contactelor focale rezidă atât în ancorarea celulei la structurile extracelulare, cât și în crearea unui mecanism care permite celulelor să se miște. Desmosome care arată ca niște plăci sau butoane conectează, de asemenea, celulele între ele. În spațiul intercelular, este de asemenea vizibil un strat dens, reprezentat de glicoproteine de membrană care interacționează - desmogleine, care, de asemenea, în funcție de ionii Ca ++, leagă celulele între ele. Pe partea citoplasmatică, un strat al proteinei desmoplakin este adiacent plasmolemei, cu care sunt conectate filamentele intermediare ale citoscheletului. Desmosomii se găsesc cel mai adesea în epiteliu, caz în care filamentele intermediare conțin cheratine. Celulele mușchiului cardiac, cardiomiocitele, conțin fibrile desmin ca parte a desmosomilor. În entoteliul vaselor, desmosomii includ filamente intermediare de vimentină. Semi-desmosomii au o structură similară cu cea a desmosomului, dar reprezintă o conexiune a celulelor cu structuri intercelulare. Rolul funcțional al desmosomilor și semi-desmosomilor este pur mecanic: ele leagă celulele între ele și de matricea extracelulară subiacentă. Spre deosebire de contactul strâns, toate tipurile contacte de cuplare sunt permeabile la soluțiile apoase și nu joacă niciun rol în limitarea difuziei. Contacte cu slot sunt considerate conexiuni de comunicare ale celulelor. Aceste structuri sunt implicate în transmisia în direct substanțe chimice din celulă în celulă. Acest tip de contacte se caracterizează prin convergența membranelor plasmatice a două celule vecine la o distanță de 2 - 3 nm. Folosind metoda de congelare-ciobire. S-a dovedit că, pe clivajul membranelor, zonele contactelor de spațiu (0,5 până la 5 μm) sunt presărate cu particule cu diametrul de 7 - 8 nm, situate hexagonal cu o perioadă de 8 - 10 nm și având aproximativ 2 godeuri în centrul canalului. Aceste particule se numesc conexoni. În zonele de contact gap, pot exista de la 10 la 20 până la câteva mii de conexoni, în funcție de caracteristicile funcționale ale celulelor. Conectiile au fost izolate în mod pregătitor. Acestea sunt compuse din șase subunități de proteină conectină. Unindu-se unele cu altele, conectinele formează un agregat cilindric - conexonul, în centrul căruia se află canalul. Conexiunile individuale sunt încorporate în membrana plasmatică astfel încât să o străpungă. Un conexon de pe membrana plasmatică a unei celule este exact opus de un conexon de pe membrana plasmatică a unei celule vecine, astfel încât canalele celor două conexoane formează un singur întreg. Conectiile joacă rolul canalelor intercelulare directe prin care ionii și substanțele cu greutate moleculară mică se pot difuza de la celulă la celulă. Conectiile pot fi închise, schimbând diametrul canalului intern și astfel participând la reglarea transportului moleculelor între celule. Nici veverițele, nici acizi nucleici nu poate trece prin contactele slotate. Capacitatea joncțiunilor gap de a trece compuși cu greutate moleculară mică stă la baza transmiterii rapide a unui impuls electric (undă de excitație) de la celulă la celulă fără participarea unui mediator nervos. Contact sinaptic (sinapse)... Sinapsele sunt zone de contact între două celule, specializate pentru transmiterea într-un sens a excitației sau inhibării de la un element la altul. Acest tip de contact este caracteristic țesutului nervos și apare atât între doi neuroni, cât și între neuroni și un alt element - un receptor sau efector. Terminalul neuromuscular este, de asemenea, un exemplu de contact sinaptic. Sinapsele interneuronale arată de obicei ca niște extensii (plăci) în formă de pară. Plăcile sinaptice pot contacta atât corpul unui alt neuron, cât și procesele sale. Procesele periferice ale celulelor nervoase (axoni) formează contacte specifice cu celulele efectoare (musculare sau glandulare) sau celulele receptoare. În consecință, o sinapsă este o structură specializată care se formează între regiunile a două celule (la fel ca desmosomul). La locul contactelor sinaptice, membranele celulare sunt separate printr-un spațiu intercelular - o despicătură sinaptică de aproximativ 20-30 nm lățime. Adesea, în lumenul fantei, este vizibil un material cu frunze subțiri situat perpendicular pe membrane. Membrana unei celule, care transmite excitare, în zona contactului sinaptic se numește presinaptică, membrana altei celule care primește impulsul se numește postsinaptică. În apropierea membranei presinaptice, o cantitate mare mici vacuole - vezicule sinaptice umplute cu mediatori. Conținutul veziculelor sinaptice în momentul trecerii impulsului nervos este eliberat prin exocitoză în fanta sinaptică. Membrana postsinaptică pare adesea mai groasă decât membranele obișnuite datorită acumulării multor fibrile subțiri în apropierea ei din citoplasmă. Plasmodesmata. Acest tip de comunicare intercelulară se găsește la plante. Plasmodesmele sunt canale citoplasmatice tubulare subțiri care leagă două celule adiacente. Diametrul acestor canale este de obicei de 20 - 40 nm. Membrana care limitează aceste canale trece direct în membranele plasmatice ale celulelor vecine. Plasmodesmele trec prin peretele celular care separă celulele. Elementele tubulare cu membrană care leagă cisternele reticulului endoplasmatic al celulelor învecinate pot pătrunde în interiorul plasmodesmelor. Plasmodesmele se formează în timpul divizării, când se construiește membrana celulară primară. În celulele nou divizate, numărul plasmodesmelor poate fi foarte mare (până la 1000 pe celulă). Odată cu îmbătrânirea celulelor, numărul acestora scade din cauza rupturilor cu creșterea grosimii peretelui celular. Picăturile de lipide se pot deplasa de-a lungul plasmodesmelor. Celulele sunt infectate cu virusuri vegetale prin plasmodesme.
O celulă este o unitate structurală a tuturor ființelor vii de pe planeta noastră și un sistem deschis. Aceasta înseamnă că, pentru viața sa, un schimb constant de substanțe și energie cu mediu inconjurator... Acest schimb are loc prin membrană - marginea principală a celulei, care este concepută pentru a-și păstra integritatea. Prin membrană se realizează schimbul celular și merge fie de-a lungul gradientului de concentrație al oricărei substanțe, fie împotriva. Transportul activ prin membrana citoplasmatică este un proces complex și consumator de energie.
Membrană - barieră și ecluză
Membrana citoplasmatică face parte din multe organite celulare, plastide și incluziuni. Știința modernă se bazează pe un model mozaic lichid al structurii membranei. Transportul activ al substanțelor prin membrană este posibil datorită structurii sale specifice. Baza membranelor este formată dintr-un strat strat lipidic - acestea sunt în principal fosfolipide, situate în conformitate cu principalele lor proprietăți ale stratului stratificat lipidic: fluiditatea (capacitatea de a încorpora și pierde zone), auto-asamblarea și asimetria. A doua componentă a membranelor este proteinele. Funcțiile lor sunt diverse: transport activ, recepție, fermentare, recunoaștere.
Proteinele sunt localizate atât pe suprafața membranelor, cât și în interior, iar unele dintre ele o pătrund de mai multe ori. Proprietatea proteinelor din membrană este capacitatea de a se deplasa de la o parte a membranei la cealaltă (saltul "flip-flop"). Și ultima componentă este lanțurile zaharidelor și polizaharidelor de carbohidrați de pe suprafața membranei. Funcțiile lor sunt și astăzi controversate.

Tipuri de transport activ al substanțelor prin membrană
Un astfel de transfer de substanțe prin membrana celulară va fi activ, care este controlat, are loc cu cheltuirea energiei și merge împotriva gradientului de concentrație (substanțele sunt transferate dintr-o zonă de concentrație scăzută într-o zonă de concentrație mare) . În funcție de sursa de energie utilizată, se disting următoarele tipuri de transport:
- În primul rând activ (sursă de energie - hidroliză la ADP adenozinică difosforică).
- Activ secundar (furnizat de energia secundară creată ca rezultat al activității mecanismelor de transport activ primar al substanțelor).

Proteine ajutatoare
Atât în primul, cât și în al doilea caz, transportul este imposibil fără proteine purtătoare. Aceste proteine de transport sunt foarte specifice și sunt concepute pentru a transporta anumite molecule și, uneori, chiar un anumit tip de moleculă. Acest lucru a fost dovedit experimental pe gene bacteriene mutante, ceea ce a dus la imposibilitatea transportului activ al unui anumit carbohidrat prin membrană. Proteinele purtătoare transmembranare pot fi de fapt purtători (interacționează cu moleculele și o transportă direct prin membrană) sau formează canale (formează pori în membrane deschise substanțelor specifice).

Pompa pentru sodiu și potasiu
Cel mai studiat exemplu de transport activ primar al substanțelor prin membrană este pompa Na + -, K +. Acest mecanism oferă o diferență în concentrațiile ionilor Na + și K + de pe ambele părți ale membranei, care este necesară pentru menținerea presiunii osmotice în celulă și alte procese metabolice. Proteina purtătoare transmembranară, sodiu-potasiu ATP-ase, constă din trei părți:
- La exteriorul membranei, proteina are doi receptori pentru ionii de potasiu.
- Pe partea interioară a membranei există trei receptori pentru ioni de sodiu.
- Partea interioară a proteinei este caracterizată de activitate ATP.
Când doi ioni de potasiu și trei ioni de sodiu se leagă de receptorii de proteine de pe ambele părți ale membranei, activitatea ATP este activată. Molecula ATP este hidrolizată în ADP odată cu eliberarea de energie, care este cheltuită pe transferul ionilor de potasiu către interior și a ionilor de sodiu către exteriorul membranei citoplasmatice. Se estimează că eficiența unei astfel de pompe este de peste 90%, ceea ce în sine este destul de surprinzător.
De referință: eficiența unui motor cu ardere internă este de aproximativ 40%, una electrică - până la 80%. Interesant este că pompa poate funcționa în direcția opusă și poate servi ca donator de fosfat pentru sinteza ATP. Pentru unele celule (de exemplu, neuroni), până la 70% din toată energia este cheltuită pentru îndepărtarea sodiului din celulă și pomparea ionilor de potasiu în interior. Pompele pentru calciu, clor, hidrogen și alți cationi (ioni cu sarcină pozitivă) funcționează conform aceluiași principiu al transportului activ. Nu s-au găsit astfel de pompe pentru anioni (ioni încărcați negativ).

Co-transportul glucidelor și aminoacizilor
Un exemplu de transport activ secundar este transferul de glucoză, aminoacizi, iod, fier și acid uric în celule. Ca rezultat al funcționării pompei de potasiu-sodiu, se creează un gradient de concentrație de sodiu: concentrația este mare la exterior și scăzută la interior (uneori cu un factor de 10-20). Sodiul tinde să se difuzeze în celulă și energia acestei difuzii poate fi utilizată pentru transportul substanțelor în exterior. Acest mecanism se numește cotransport sau transport activ conjugat. În acest caz, proteina purtătoare are doi receptori în exterior: unul pentru sodiu și celălalt pentru elementul transportat. Abia după activarea ambilor receptori, proteina suferă modificări conformaționale, iar energia de difuzie a sodiului introduce substanța transportată în celulă împotriva gradientului de concentrație.

Valoarea transportului activ pentru celulă
Dacă difuzia obișnuită a substanțelor prin membrană s-ar desfășura pentru o perioadă de timp arbitrară, concentrațiile lor în afara și în interiorul celulei s-ar egaliza. Și aceasta este moartea pentru celule. La urma urmei, toate procesele biochimice trebuie să aibă loc într-un mediu cu diferențe de potențial electric. Fără activ, împotriva transportului de substanțe, neuronii nu ar putea transmite impuls nervos... Iar celulele musculare ar pierde capacitatea de a se contracta. Celula nu ar fi capabilă să mențină presiunea osmotică și s-ar aplatiza. Iar produsele metabolice nu ar fi excretate. Iar hormonii nu ar intra niciodată în sânge. La urma urmei, chiar și o amibă cheltuie energie și creează o diferență de potențial pe membrana sa folosind aceleași pompe ionice.
Transport pasiv include difuzie simplă și ușoară - procese care nu necesită aport de energie. Difuzie- transportul moleculelor și ionilor de-a lungul membranei dintr-o zonă cu un nivel ridicat către o zonă cu o concentrație scăzută, aceia. substanțele vin de-a lungul unui gradient de concentrație. Se numește difuzie a apei prin membrane semipermeabile osmoză. Apa este, de asemenea, capabilă să treacă prin porii membranei formate din proteine și să transporte molecule și ioni de substanțe dizolvate în ea. Mecanismul difuziei simple este transferul de molecule mici (de exemplu, O2, H2O, CO2); acest proces nu este foarte specific și se desfășoară cu o rată proporțională cu gradientul de concentrație al moleculelor transportate de ambele părți ale membranei.
Difuzie facilitată se efectuează prin canale și (sau) proteine purtătoare care sunt specifice moleculelor transportate. Canalele ionice sunt proteine transmembranare care formează pori mici de apă prin care moleculele și ionii solubili în apă sunt transportați de-a lungul unui gradient electrochimic. Proteinele purtătoare sunt, de asemenea, proteine transmembranare care suferă modificări conformaționale reversibile care asigură transportul unor molecule specifice prin plasmolemă. Acestea funcționează atât în mecanisme de transport pasive, cât și active.
Transport activ este un proces care consumă multă energie datorită căruia transferul de molecule se realizează folosind proteine purtătoare împotriva gradient electrochimic... Un exemplu de mecanism care asigură transportul activ al ionilor în direcție opusă este pompa de sodiu-potasiu (reprezentată de proteina purtătoare Na + -K + -ATPaza), datorită căreia ionii Na + sunt eliminați din citoplasmă, iar ionii K + sunt transferate simultan în el. Concentrația de K + în interiorul celulei este de 10-20 de ori mai mare decât în exterior, iar concentrația de Na este invers. O astfel de diferență în concentrația de ioni este asigurată de lucru (pompa Na * -K *>. Pentru a menține această concentrație, trei ioni Na sunt transferați din celulă pentru fiecare doi ioni K * în celulă. În acest proces, o proteină în participă membrana, care acționează ca o enzimă care descompune ATP, eliberând energia necesară pentru funcționarea pompei.
Participarea proteinelor de membrană specifice la transportul pasiv și activ indică specificitatea ridicată a acestui proces. Acest mecanism asigură menținerea constanței volumului celulei (prin reglarea presiunii osmotice), precum și a potențialului membranei. Transportul activ al glucozei în celulă este efectuat de o proteină purtătoare și este combinat cu transferul unidirecțional al ionului Na +.
Transport ușor ionii sunt mediați de proteine transmembranare speciale - canale ionice care asigură transferul selectiv al anumitor ioni. Aceste canale constau din sistemul de transport în sine și un mecanism de poartă care deschide canalul pentru o perioadă de timp ca răspuns la o schimbare a potențialului membranei, (b) acțiune mecanică (de exemplu, în celulele de păr ale urechii interne), legarea unui ligand (moleculă de semnalizare sau ion).
De asemenea, transportul de substanțe prin membrană diferă în direcția mișcării lor și a cantității de substanțe transportate de acest purtător:
- Uniport - transportul unei substanțe într-o singură direcție, în funcție de gradient
- Symport este transportul a două substanțe într-o singură direcție printr-un singur purtător.
- Antiport - mișcare a două substanțe în direcții diferite printr-un singur purtător.
Uniport implementează, de exemplu, un canal de sodiu dependent de tensiune, prin care ionii de sodiu se deplasează în celulă în timpul generării potențialului de acțiune.
Symport efectuează un transportor de glucoză situat pe partea exterioară (orientată în lumenul intestinal) a celulelor epiteliale intestinale. Această proteină captează simultan o moleculă de glucoză și un ion de sodiu și, schimbând conformația, transferă ambele substanțe în celulă. În acest caz, se folosește energia unui gradient electrochimic, care, la rândul său, este creat datorită hidrolizei ATP cu ATPaza sodiu-potasiu.
Antiport efectuează, de exemplu, ATPaza sodiu-potasiu (sau ATPaza dependentă de sodiu). Transferă ioni de potasiu în celulă. iar din celulă - ioni de sodiu. Inițial, acest purtător atașează trei ioni de partea interioară a membranei N / A+. Acești ioni modifică conformația centrului activ al ATPazei. După o astfel de activare, ATPaza este capabilă să hidrolizeze o moleculă de ATP, iar ionul fosfat este fixat pe suprafața purtătorului din partea interioară a membranei.
Energia eliberată este cheltuită pentru schimbarea conformației ATPazei, după care trei ioni N / A+ și ionul (fosfatul) se află la exteriorul membranei. Aici ionii N / A+ sunt împărțite și înlocuite cu doi ioni K+. Apoi, conformația purtătorului se schimbă la cea originală și la ioni K+ apar pe partea interioară a membranei. Aici ionii K+ despărțit, iar transportatorul este din nou gata de lucru
În membrană, există 2 tipuri de sisteme proteice integrale specializate care asigură transportul ionilor peste membrana celulară: pompe ioniceși canale ionice... Adică, există 2 tipuri principale de transport ionic prin membrană: pasiv și activ.
Pompele de ioni și gradienții de ioni transmembranari
Pompe de ioni (pompe)- proteine integrale care asigură transportul activ al ionilor împotriva gradientului de concentrație. Energia pentru transport este energia hidrolizei ATP. Distingeți între pompa Na + / K + (pompează Na + din celulă în schimbul K +), pompa Ca ++ (pompează Ca ++ din celulă), Cl– pompă (pompează Cl - din celulă) .
Ca rezultat al funcționării pompelor de ioni, se creează și se mențin gradienți de ioni transmembranari:
- concentrația de Na +, Ca ++, Cl - în interiorul celulei este mai mică decât în exterior (în fluidul intercelular);
- concentrația de K + în interiorul celulei este mai mare decât în exterior.
Mecanismul de funcționare al pompei de sodiu-potasiu.Într-un ciclu, NKH transferă 3 ioni Na + din celulă și 2 ioni K + în celulă. Acest lucru se datorează faptului că molecula de proteină integrală poate fi în 2 poziții. Molecula de proteină care formează canalul are un sit activ care leagă fie Na +, fie K +. În poziția (conformația) 1, se îndreaptă spre celulă și poate atașa Na +. Se activează enzima ATPaza, care descompune ATP în ADP. Ca rezultat, molecula se transformă în conformația 2. În poziția 2, se îndreaptă spre exteriorul celulei și poate atașa K +. Apoi conformația se schimbă din nou și ciclul se repetă.
Canalele ionice
Canalele ionice- proteine integrale care asigură transportul pasiv al ionilor de-a lungul gradientului de concentrație. Energia pentru transport este diferența de concentrație de ioni pe ambele părți ale membranei (gradient ionic transmembranar).
Canalele neselective au următoarele proprietăți:
- trec de toate tipurile de ioni, dar permeabilitatea pentru ioni K + este mult mai mare decât pentru alți ioni;
- sunt întotdeauna deschise.
Canalele selective au următoarele proprietăți:
- este trecut un singur tip de ioni; fiecare tip de ion are tipul său de canale;
- poate fi într-una din cele 3 stări: închis, activat, inactivat.
Permeabilitatea selectivă a canalului selectiv este asigurată filtru selectiv, care este format dintr-un inel de atomi de oxigen încărcați negativ, care este situat în cel mai îngust punct al canalului.
Schimbarea stării canalului este asigurată de lucrare mecanism de poartă, care este reprezentată de două molecule proteice. Aceste molecule proteice, așa-numitele porți de activare și porți de inactivare, prin schimbarea conformației lor, pot bloca canalul ionic.
În repaus, poarta de activare este închisă, poarta de inactivare este deschisă (canalul este închis). Când un semnal acționează asupra sistemului de poartă, poarta de activare se deschide și începe transportul ionilor prin canal (canalul este activat). Cu o depolarizare semnificativă a membranei celulare, poarta de inactivare se închide și transportul ionilor se oprește (canalul este inactivat). Când se restabilește nivelul potențial de odihnă, canalul revine la starea inițială (închisă).
În funcție de semnalul care determină deschiderea porții de activare, canalele ionice selective sunt împărțite în:
- canale chimiosensibile- un semnal pentru deschiderea porții de activare este o modificare a conformației receptorului de proteină asociat canalului ca urmare a atașării ligandului la acesta;
- canale sensibile la tensiune- semnalul de deschidere a porții de activare este o scădere a potențialului de repaus (depolarizare) membrana celulara la un anumit nivel, care se numește nivel critic depolarizare(KUD).