ХИЧЭЭЛИЙН ХИЧЭЭЛИЙН ДЕМО-г ашиглах. Бүтэц ким eger
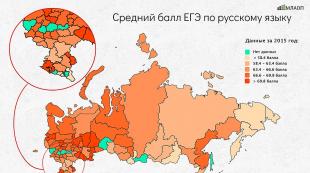
Ege-ийн үр дүн Химийн хамгийн бага тоо, хамгийн бага цэгээс доогуур оноо авах нь дээд түвшний дээд сургуулиудад дээд сургуулиудад элсэлтийн тестийн сэдвийг оруулах эрхтэй.
Их дээд сургуулиуд 36 оноос доош насны хамгийн бага химийн босгыг суулгах эрхгүй байна. Дүрэм, дүрмийн хувьд нэр хүндтэй их дээд сургуулиуд, хамгийн бага босгыг нь илүү өндөр болгох. Суралцахын тулд эхний жилийн оюутнуудын талаар маш сайн мэдлэгтэй байх ёстой.
FII-ийн албан ёсны вэбсайт дээр, жил бүр химийн хичээлийн сонголтууд хэвлэгдсэн: жагсаал, эрт үе. Энэ сонголтууд нь ирээдүйн шалгалт, даалгаврын нарийн төвөгтэй байдлын талаархи ойлголтын талаархи ойлголтыг өгдөг бөгөөд энэ нь ашиглахад бэлтгэхдээ найдвартай мэдээллийн эх сурвалж юм.
Химийн урд талын хэсгүүд 2017 он
| Жил | Эхлэх сонголтыг татаж авах |
| 2017 | variant Po hechii. |
| 2016 | татаж авах |
Хими улсын 7-р шалгалтыг Химигийн хувилбарыг FIPI-ээс
| Сонголтууд + хариултууд | Demo сонголтыг татаж авах |
| Лал дох үйл | demo Variant hiyiya ege |
| Кодлогч | kodifikator. |
-Аар / -оор элчинс дэлгэрүүлэх 2017 оны химийн хичээлд Ким 2016-тай харьцуулахад өөрчлөлт гарсан тул одоогийн хувилбарын дагуу бэлтгэхэд тохиромжтой, сүүлийн жилийн хувилбаруудыг ашиглах нь зүйтэй бөгөөд өнгөрсөн жилийн сонголтыг ашиглахад тохиромжтой.
Нарий материал, тоног төхөөрөмж
Дараах материалыг шалгалтын шалгалтын ажлын хувилбарыг химийн шинжилгээний хувилбар бүрт хавсаргасан болно.
- үе үе систем химийн элементүүд Ди. Mendeleev;
- давс, хүчил, хүчил, савыг усанд уусдаг хүснэгт;
- металл хүчдэлийн цахилгаан шугам.
Шалгалтын ажлыг гүйцэтгэх явцад энэ нь UNINPRAMADERY тооцоолуур ашиглахыг зөвшөөрнө. Нэмхээг ашиглаж байгаа материал, материал, тэдгээр Оросын боловсролын яамны иргэдэд батална.
Ахлах сургуулиа үргэлжлүүлэхийг хүсч буй хүмүүст зориулсан сонголтын сонголт нь сонгосон тусгай тусгай тестийн жагсаалтаас хамаарна
(бэлтгэх чиглэл).
Орын бүх мэргэжлээр бүх мэргэжилтнүүдийн тестийн жагсаалт (Бэлтгэл ажил хийх чиглэлийг (Бэлтгэх чиглэл) нь Оросын боловсрол, шинжлэх ухааны яамны захиалгаар тодорхойлно. Их сургууль тус бүр нь тэдний хүлээн авах дүрмийн дагуу эдгээр жагсаалтаас сонгодог. Сонгосон зүйлсийн жагсаалтад оролцох өргөдөл гаргахаас өмнө сонгосон их дээд сургуулиудад энэ мэдээлэлтэй танилцах хэрэгтэй.
11/14/2016 зар сурталчилгаа FII вэбсайт дээр нийтлэгдсэн жагсаалын сонголтууд, хяналтын материалыг хяналтын хэмжих материалын тодорхойлолт, тодорхойлолтууд тоос хэмжшил 2017 оны хамгийн гол улсын шалгалт, түүний дотор химийн чиглэлээр.
DEVEROVYY ENGE AGE-т 2017 оны Хими бүхий 2017 он
| Сонголтууд + хариултууд | Демо хувилбарыг татаж авах |
| Лал дох үйл | demo Variant hiyiya ege |
| Кодлогч | kodifikator. |
Хими Демо шалгалт 2016-2015 он
| Хими | Демо + Хариултуудыг татаж авах |
| 2016 | ege 2016. |
| 2015 | ege 2015. |
2017 онд Ким хотод 2017 онд Химийн хувьд 2017 онд, иймээс хойшхи өөрчлөлт, тиймээс өнгөрсөн жилүүд өөрсдийгөө танихад хүргэдэг.
ХИМЭЭ - АЖИЛЛАГААНЫ АЖИЛЛАГАА: Шалгалтын ажлын бүтцийг оновчтой болгож байна:
1. Кимийн 1-р хэсгийн бүтэц нь үндсэндээ өөрчлөгдсөн: Даалгавруудыг нэг хариу үйлдэл хийхээр сонгоно; Даалгавруудыг тусад нь сэдэвчилсэн сэдэвчилсэн блокоор бүлэглэнэ, тус бүр нь суурь, өндөр түвшний нарийн төвөгтэй байдлын даалгавартай байдаг.
2. 40-ээс (2016 онд) -ээс 34-ээс 34-ийн даалгаврыг бууруулсан.
3. Тооцооллын хэмжүүрийг (1-ээс 2-оос дээш оноо) -ийн мэдлэгтэй, органик түвшний мэдлэг чадвартай, органик бодисын талаархи мэдлэгийг шалгаж,
4. Ажлын гүйцэтгэлийн хамгийн дээд хэмжээ нь бүхэлдээ 60 оноо (2016 оны 64 оноо биш).
Химийн шалгалтын хугацаа
Шалгалтын ажлын нийт хугацаа 3.5 цаг (210 минут).
Хувь хүний \u200b\u200bдаалгаврыг биелүүлэхэд хуваарилагдсан ойролцоо хугацаа нь:
1) 1-р хэсгийн нарийн төвөгтэй байдлын үндсэн түвшний даалгавар бүрийн хувьд; 2-3 минут;
2) 1-р хэсгийн өндөрлөгийн нарийн төвөгтэй байдал тус бүрт 1 - 5-7 минут;
3) даалгавар бүрийн хувьд өндөр түвшин 2-р хэсгийн нарийн төвөгтэй байдал нь 10-15 минут байна.
Даалгаврыг 1-3 хийхийн тулд дараахь цуврал химийн элементүүдийг ашиглана уу. Даалгавар дахь хариулт 1-3 нь энэ цуврал элементүүд нь энэ цувралын хэмжээнд заасан тоонуудын дараалал юм.
1) na 2) k 3) si 4) мг 5) c
Даалгаврын дугаар 1
Элементүүдийн эгнээнд заасан агентуудын аль нь гадаад эрчим хүчний түвшинд дөрвөн электроныг тодорхойлно.
Хариулт: 3; тав
Гол дэд бүлгийн элементүүдийн гаднах эрчим хүчний түвшин (электрон давхаргын) -ийн электронуудын тоо нь дугаарын дугаартай тэнцүү байна.
Тиймээс, Силикон, нүүрстөрөгч нь төлөөлж буй хариултаас тохиромжтой, учир нь Тэд Дөрөв дэх хүснэгтийн үндсэн дэд бүлэгт байдаг. D.I. Mendeleeva (iva бүлэг), I.E. Зөв хариулт 3, 5.
Даалгаврын дугаар 2.
Хэд хэдэн химийн элементүүдэд заасан эдгээрээс гурван зүйлийг сонгоно уу Дараах тогтоол Химийн элемент d.i. Mendeleev нь нэг хугацаанд байдаг. Сонгосон зүйлсийг металл шинж чанарыг нэмэгдүүлэх дарааллаар нь байрлуул.
Хүссэн дарааллаар сонгосон зүйлсийн хариуд бичнэ үү.
Хариулт: 3; Дөрөв; нэг
нэг хугацаанд ирүүлсэн элементийн гурван байдаг - энэ нь натрийн Na, цахиурын Si, магни MG юм.
Тоглоомын нэг хугацаанд жолоодох үед D.I. Зүүн талд байрлах Mendeleev (хэвтээ шугамууд) нь гаднах давхарга дээр байрладаг электронуудыг буцааж өгдөг бөгөөд I.E. Элементүүдийн металл шинж чанар сайжирна. Тиймээс натрийн төмөр шинж чанар, силикон, магни, магни нь SI эгнээнд эрчимтэй байдаг Даалгаврын дугаар 3. Хэд хэдэн зүйлд заасан хүмүүсийн дунд, -4-тэй тэнцүү исэлдэлтийн доод хэмжээг харуулсан хоёр элементүүдийг сонгоорой. Сонгосон зүйлсийн хариуд тэмдэглэнэ. Хариулт: 3; тав Октетын дүрмийн дагуу, химийн элементийн атомын атомууд нь гадаад электрон түвшний 8 электрон түвшинд байх хандлагатай байдаг. Энэ нь сүүлийн түвшний электронуудыг буцааж өгөх замаар хүрч болно, дараа нь 8 электрон, эсвэл эсрэгээр нь найман электронуудаас гадна гадаадаас гадна нэмэлт юм. Натри, кали нь шүлтлэг металлын металлуудад хамаардаг бөгөөд эхний бүлгийн үндсэн дэд бүлэгт байрладаг. Энэ нь тэдний атомын гадна талын электрон давхаргад нэг электрон юм гэсэн үг юм. Энэ талаар, нэг электрон алдагдах нь дахиад долоон долоон удаа нөгөөгөөсөө илүү ашигтай байдаг. магни нь, нөхцөл байдал зөвхөн хоёр дахь бүлэг, гадаад электрон хэмжээнд тэр хоёр электрон байгаа үед нь гол дэд бүлгийн байна, төстэй юм. Энэ нь натри, кали, магни металлын холбоотой гэдгийг тэмдэглэх хэрэгтэй ба металлын зарчмын хувьд, исэлдэлтийн сөрөг зэрэг боломжгүй юм. Аливаа металлын исэлдэлтийн хамгийн бага зэрэг нь тэг бөгөөд энгийн бодисуудад ажиглагддаг. Химийн элемент нүүрстөрөгч нүүрс C ба Silicon SI нь металл биш бөгөөд дөрөв дэх бүлгийн үндсэн дэд бүлэгт байрладаг. Энэ нь тэдний гадаад цахим давхарга дээр 4 электрон байдаг гэсэн үг юм. Энэ шалтгааны улмаас эдгээр элементүүд эдгээр элементүүд эдгээр элементүүдийн өгөөжийг аль аль нь буцаах боломжтой бөгөөд нийт дүнгийн нийт дүнгээс 4м-ийн нийт дүнгээс гадна дөрвөн минутын дотор нэмэгдэх боломжтой. 4-ээс дээш цахиур, нүүрстөрөгчийн атомыг хавсаргаж чадахгүй тул тэдний хувьд хамгийн бага исэлдэлт байх болно. Даалгаврын дугаар 4. Санал болгож буй жагсаалтаас Ionic химийн бонд байгаа хоёр нэгдлийг сонгоно уу. Хариулт: 1; 3. ИНОСИКИЙН ИНМЕГИЙН НЭГДСЭН НЭГДСЭН НЭГДСЭН НЭГДСЭН НЭГДСЭН НЭГДСЭН НЭГДСЭН НЭГДСЭН НЭГДСЭН НЭГДСЭН НЭГДСЭН ХОРООЛОЛТОЙ БОЛОМЖТОЙ. Энэ үндсэн дээр бид Ионы харилцаа холбоог 1-р тоогоор зарж борлуулдаг бөгөөд 1 - CA (Clo 2) 2, учир нь Формула дотор та ердийн кальцийн металл ба металлововын атомыг харж болно - хүчилтөрөгч ба хлор. Гэсэн хэдий ч заасан жагсаалтын нэгэнт ижил хэмжээний атом агуулсан, бусад нэгдлүүд, заасан жагсаалтад багтсан болно. Дээрх функцээс гадна бүтцийн нэгжийн INONDALS-ийн оршихуйн орц нь Alkylammonium Cations нь Alkylammonium Cations нь ammammonium Cations and and and and and and and and and and and and and and and and and and and and and and and and supplamonia r 2 nh nh 2 + , Туршилтын ковераммони r 3 NH + ба Tetraalklammonium R 4 N +, ХӨГЖИЛТЭЙ ХАМГИЙН ХӨГЖИЛ. Жишээлбэл, ионы төрөл нь категорын хоорондох харилцаа холбоо (ch 3) 4 + ба cl cl cl lelor-is. Даалгаварт заасан нэгдлүүдийн дунд Ammonium Chloride нь Ammonium chloride нь nh 4 + lel and and and and and and and and and and and and aon. Даалгаврын дугаар 5. Энэ бодисын томъёоны томъёолол ба энэ бодисын хоорондох харилцааны хоорондох захидал ба энэ бодисыг харьяалагдах байрлалд тохируулна уу: Үсэгтнүүд тус бүрт заасан байрлал бүрт тохирсон байрлалаас тохирох байрлалыг сонгоно уу. Хариултын талбарт сонгосон холболтын тоог тэмдэглэ. Хариулт: A-4; B-1; 3-д 3 Тайлбар: Хонины давстай устөрөгч нь метал ус, аммоним, алкиатмони эсвэл аммониммони, аммониммони, аммониммони, аммиакммониум дээр давс гэж нэрлэдэг. Сургуулийн хөтөлбөрийн хөтөлбөрийн хүрээнд оролцож байгаа нь бүх устөрөгчийн хүрээнд дамждаг, бүх устөрөгчийн атомууд хөдлөх боломжтой бөгөөд энэ нь метагаар сольж болно. Үзүүлсэн жагсаалтуудын хоорондох хүчиллэг оруулан давсны жишээ нь аммони Бикарбонат НҮГЭЭР НҮГЭЭР НҮГЭЭР НҮГЭЭР НҮГЭЭР НЭГДҮГЭЭР НЭГДСЭН НЭГДСЭН НЭГДСЭН НЭГДСЭН НЭГДСЭН НОГООН АТОМ-ийн үр дүн юм. Үндсэндээ хүчиллэг давс нь ердийн (дунд) давс, хүчил хоёрын хоорондох бага зэрэг утгатай байдаг. NH 4 HCO 3-ийн хувьд 3-ийн давс (NH 4) 2 CO 3 ба CORBOME COLD H 2 CO 3. Органик бодисуудад зөвхөн устөрөгчийн бүлэгт (oforogen ormock (ofsool) эсвэл гидоль (o -oh) эсвэл гидроксил бүлэгт багтсан. Органик бодисыг солих чадвартай. Жишээ нь, натрийн ацетат Ч 3 Коулат, бүх устөрөгчийн actorate-ийн хувьд металлын атомыг металл категд орлуулаагүй боловч дундаж хүчиллэг давс биш юм. Нотландын устөрөгчийн бодисыг шууд нүүрстөрөгчийн атомууд нь төмөр атомууд нь төмөр атомын тусламжаас бусад тохиолдолд устөрөгчийн атомуудаар орлож чадахгүй. Ослолтыг огтлох - давс эсвэл давс ба тархины үйлдвэр эсвэл суурь зүйл үүсгэдэггүй төмөр OFLOR EMILE нь (ихэвчлэн (ихэвчлэн өөр) буюу тэдгээр нь өөр бусад бүтээгдэхүүн (давсгүй / давсгүй / / давсгүй / / давсгүй) урвалдох байх болно. Энэ нь ихэвчлэн үүсгэдэггүй хүмүүлэл нь суурь биш харин суурин, үндсэн исэлтэй харьцдаггүй металл исэл юм. Гэсэн хэдий ч энэ нь ox-ийг үүсгэхгүй байхын тулд үргэлж ажилладаггүй. Жишээлбэл, CO, CO-г үүсгэхгүй, исэл бол төмрийн Генозын үндсэн оксид (II), гэхдээ давс, чөлөөт металлаар хариу үйлдэл үзүүлдэг. CO + FEO \u003d CO 2 + FE Сургуулийн ханшаас цомгүй исэл нь +1 ба +2-ийн түвшинд тодорхойгүй Excides багтсан болно. Нийтдээ тэд шалгалтанд хамрагдаж байна 4 - Энэ бол CO, N 2 O, N 2 ON, SIO Бичлэгийг хэзээ ч туулж байгаагүй. Даалгаврын дугаар 6. Санал болгож буй бодисын санал болгож буй жагсаалтаас хоёр бодисыг сонго, төмрийг халаахгүйгээр өөр хүн болгоно. Хариулт: 2; дөрөв Цайрын хлорид нь давс, төмөрлөгт хамаардаг. Металл давстай харьцуулахад илүү идэвхтэй байвал зөвхөн давстай харьцдаг. Металлын харьцангуй үйл ажиллагаа нь хэд хэдэн металлын үйл ажиллагааг тодорхойлогддог (өөр өөр, металлын хүчдэлийн мөр). Металл үйл ажиллагааны мөрөнд төмөр нь цайрын эрх нь цайрын эрх биш, энэ нь бага идэвхтэй бөгөөд энэ нь бага зүйл бөгөөд энэ нь бага идэвхтэй бөгөөд энэ нь бага идэвхтэй бөгөөд энэ нь бага идэвхтэй бөгөөд энэ нь бага идэвхтэй бөгөөд энэ нь идэвхтэй бөгөөд энэ нь идэвхтэй бөгөөд энэ нь бага зүйл юм. Энэ нь 1-р төрлийн төмрийн хариу үйлдэл COVO 4 SULFATE (II) CUSO 4 нь төмрийн 4-т хариу үйлдэл үзүүлэх нь зэсийн зүүн талд хариу үйлдэл үзүүлэх болно. Төвлөрсөн азот, түүнчлэн агууламжтай хүдэр, хөнгөн цагаан, хромийг ингэснээр идэвхжүүлсэн, эдгээр металлын гадаргууг халаах чадваргүй, эдгээр металлын гадаргууг халаахад халаах чадваргүй байдаг. хамгаалалтын бүрхүүл болгон ашигладаг. Халаасан нь тэр үед хамгаалалтын бүрхүүлийн задал хамгаалах, урвал нь боломжгүй нь болно. Тэдгээртэй. Үүний улмаас халаалт нь үгүй \u200b\u200bгэсэн үг биш бөгөөд төмрийн хариу урвалыг хариу үйлдэл үзүүлдэг. HNO 3 үргэлжлүүлэхгүй. Тусгаар тогтнолоос тусгаарлах салон нунтаг хүчил нь исэлддэггүй хүчиллэгийг хэлдэг. Устөрөгчийн бус хүчил бүхий устөрөгчийн бус хүчилтэй, металлууд нь устөрөгчийн зүүн талд хариу үйлдэл үзүүлдэг. Энэ металууд нь үнэн юм. Дүгнэлт: Гидрохлорын хүчлийн урсац бүхий төмөр урвал. Металл, металл исэл, үргэлжилж байгаа тохиолдолд үр давстай, үргэлжилсэн тохиолдолд, ҮНЭГҮЙ металл нь Оксидын найрлагад илүү идэвхтэй байдаг. Fe, al-ээс бага хэмжээний металлын үйл ажиллагааны дагуу. Энэ нь fe 2 o 3-тай хамт хариу үйлдэл үзүүлэхгүй гэсэн үг юм. Даалгаврын дугаар 7. Санал болгож буй жагсаалтаас хоёр оксидыг сонго, гэхдээ давсны хүчил хариулах хэрэггүй
натрийн гидроксидын уусмалаар. Сонгосон бодисын хариуг бичнэ үү. Хариулт: 3; дөрөв CO - ALKALI-ийн усан уусмал уусмалаар, сул тал нь Alkali-ийн усан уусмалаар хариу үйлдэл үзүүлэхгүй. (Гэсэн хэдий ч үүнийг санаж байх ёстой, хатуу нөхцөл байдал - өндөр даралт, температур - энэ нь хатуу алкали, үүсэх нь форматтай, форматын хүчиллэгээр дамждаг.) Тиймээс 3 - Сульфур Оксид (VI) нь хүхрийн хүчиллэг хүчиллэг нь хүчилтөрөгчийн хүчиллэг юм. Хүчиллэг хүчил, хүчил, бусад хүчил, бусад хүчиллэг хүчиллэг хүчиллэгүүд урвалд ордоггүй. Ингэснээр 3 нь давсны хүчилтэй урвалд орж, суурь нь садарчаалтай урвалд ордог. Натрийн гидроксидэд хариу үйлдэл үзүүлдэггүй. Тохиромжгүй. Cuo - зэс Овид (II) - Гол шинж чанаруудтай ижил төстэй Excide-тай холбоотой. HCL-тэй хариу үйлдэл үзүүлээд натрийн гидроксидын уусмалаар хариу үйлдэл үзүүлдэггүй. Таарсан MGO - Magnesium Oxide - ердийн үндсэн үхэрт хандана уу. HCL-тэй хариу үйлдэл үзүүлээд натрийн гидроксидын уусмалаар хариу үйлдэл үзүүлдэггүй. Таарсан ZNO - АМЕРИКИЙН ТӨЛӨВЛӨГӨӨГҮЙ АМЬДРАЛЫГ АВТОМАШИНГИЙН АЖИЛЛАГАА - Хүчтэй суурь, хүчиллэг, үндсэн хүчиллэг, Тохиромжгүй. Даалгаврын дугаар 8. Хариулт: 4; 2. Идорьган хүчлийн хоёр давсны давсны хоорондох урвалын хоорондох, аммони ба аммонигийн давсыг зөвхөн аммони ба Аммони ба аммонигийн давсыг холих үед үүсдэг. Жишээлбэл, Nh 4 cl + + kno 2 \u003d t o \u003d t o \u003d\u003e n 2 + 2 + 2 o + kcl Гэсэн хэдий ч жагсаалт, аммонигийн давс дахь нитрит байхгүй байна. Тиймээс, гурван давстай (CU (CU (CU (NO 3) 2, k 2, 3-р 2 ба NA 2) хүчил (HCL) нь хүчил (HCL) эсвэл ALCALIE (HCL) эсвэл ALCALI (NAOH) -тай харьцдаг. Ориланжийн хүчлийн давс, зөвхөн аммиакийн давс нь зөвхөн Alkalis-тай харьцахдаа хий ялгардаг. NH 4 + + OH \u003d NH \u003d NH 3 + H 2 O Аммиакийн давс, бид аль хэдийн хэлсэнчлэн, жагсаалтад байхгүй. Зөвхөн хүчилтэй давстай харьцах харьцааны хувилбар. Эдгээр бодисуудын хоорондох давс нь CU (NO 3) 2, k 2, 3-р 2, NA 2 SOIRTROR-ийн эсрэг талбайн урвал нь үргэлжлүүлдэггүй. Учир нь Хий, тунадас, бага татаас олгох агент (ус эсвэл сул хүчил) -ийг (ус эсвэл сул хүчил) үүсгэхгүй. Соликат нилийн хүчил хүртсэн, харин Derdliclortimlic anx oyenendendentic Eitendiencoren Тасал тунинас ялгарсан цооног, мөн хийг биш NA 2 SIO 3 + 2 + 2HCL \u003d 2NACL + H 2 SHIO 3 ↓ Сүүлчийн хувилбарууд хэвээр байна - калийн сульфит ба гидрохлорлорын харилцан үйлчлэл. Үнэхээр Сульфит, бараг аливаа хүчил ба бараг аливаа хүчил, тогтворгүй хүчил, идэмхий хүчил, идэмхий хүчил, усгүй хийн исэл (iv), усаар задалдаг. Даалгаврын дугаар 9. Зохих үсгүүдийн доор сонгосон материалын тоог сонгоно уу. Хариулт: 2; тав CO 2 нь хүчил хүчилдөрөгчийг хэлээд давс руу эргүүлж, давс руу шилжүүлэх нь үндсэн оксид эсвэл суурийн аль алинд нь нөлөөлөх хэрэгтэй. Тэдгээртэй. CO 2 PotArium Cockate-аас авахын тулд калийн оксид эсвэл калийн гидроксид нөлөөлөх шаардлагатай. Ийнхүү, бодис x нь калийн Оксид юм. K 2 o + CO + CO 2 \u003d K 2 CO 3 Калийн бикарбонат Хько 3, түүнчлэн нүүрс карбонат, Горсусны хүчил, нүүрскийн хүчил нь нүүрсний хүчилдөрөгчийн давстай бөгөөд цоргоны хүчилтөрөгчийн давс юм. Энгийн (дунд) давстай давс уухын тулд энэ давс үүссэн бөгөөд энэ давстай ижил хүчиллэгээр үйлчлэх, эсвэл өгөгдсөн хүчиллэгээр үйлчлэх, эсхүл өгөгдсөн хүчиллэгээр ажиллах хэрэгтэй ус. Тиймээс y reegent бол нүүрстөрөгчийн давхар исэл юм. Усан валанкийн карбонатын уусмалаар дамжин өнгөрөх үед сүүлийнх нь калийн бикарбонатад орно: K 2 CO 3 + H 2 O + CO + CO 2 \u003d 2KHCO 3 Даалгаврын дугаар 10. Энэхүү урвалын хоорондох харилцааны талаар харилцааг суулгаж, энэ урвалын үлдэгдэл ба энэ урвалын өмчийг суулгаж, энэ урвалын үл хөдлөх хөрөнгийн үл хөдлөх хөрөнгийг аль нь ч бай, үсэгнээс зааж өгсөн байрлал бүрт тохирсон байрлалыг сонгоно уу. Зохих үсгүүдийн доор сонгосон материалын тоог сонгоно уу. Хариулт: A-4; B-2; 2 цагт; Ноён A) NH 4 HCO 3 - Давс, давс, Ammonium Catch NH 4 + + + ince. Аммонигийн катион дээр азотын хувьд -3-тэй тэнцүү исэлдэлт байдаг. Урвалын үр дүнд энэ нь аммиакийн NH 3 болж хувирдаг. Устөрөгчийн бараг үргэлж (металлаар түүний нэгдлийг бусад) байдаг +1 тэнцүү исэлдэлтийн зэрэгтэй байна. Тэгэхээр, аммонины Эрчим лимекул бичиг Бологч нь электронек нөөцөлдөг, азотын ёс бус исэлдэлттэй байх ёстой. Тиймээс азотын исэлдэлтийн түвшин өөрчлөгдөхгүй, I.E. Энэ нь Redox шинж чанарыг харуулдаггүй. Б) аль хэдийн Дээр харуулснаар, аммиак NH 3 дахь азотын исэлдэлт нь зэрэгтэй -3. Cuo-ийн урвалын үр дүнд аммиак, аммиак нь энгийн бодис болж хувирдаг. Ямар ч энгийн бодис дээр үүссэн элементийг exentation-ийн зэрэглэл нь тэг болно. Тиймээс, азотын атом нь сөрөг цэнэг алдаж, электрон сөрөг эрхэлсэн, урвалын үр дүнд азотын атомын тэдний алдагдлыг хэлнэ тохирох оноос хойш. Урвалын үр дүнд байгаа электронуудын хэсгийг алдагдсан элемент нь бууруулах бодис гэж нэрлэдэг. C) азотын исэлдэлтийн зэрэг нь NH 3 урвалын үр дүнд нь -3 тэнцүү, азотын исэл NO болж хувирна. Хүчилтөрөгч бараг үргэлж -2-тэй тэнцүү исэлдэлттэй байдаг. Тиймээс, азотын исэл болохын тулд электрений молекулыг цахим хэлбэрээр цахим хэлбэрээр, азотын атом нь +2 зэрэгтэй байх ёстой. Энэ арга урвалын үр дүнд Азотын атом нь -3 +2 нь исэлдэлт, түүний зэрэг өөрчлөгдсөн байна. Энэ нь 5 электронын азотын атомыг алдахыг илтгэнэ. Энэ бол азотынх, энэ нь b, буурах тусам буурах явдал юм. D) n 2 бол энгийн бодис юм. бүх энгийн бодис, тэдгээрийг исэлдэлтийн зэрэгтэй байгаа хэлбэр гэсэн элемент нь азотын урвалын үр дүнд 0-тэй тэнцүү, LI3N лити nitride хөрвүүлсэн байна. Тэгээс гадна алкали металл исэлдцийн цорын ганц зэрэг (0 нь expidation-ийн зэрэг), +1-тэй тэнцүү. Ийм бүтцийн нэгж LI3N цахим цахимаар цахим цахим, азотын цахим нь -3-тэй тэнцүү исэлдэлттэй байх ёстой. Урвалын үр дүнд энэ нь нитроген нь сөрөг цэнэгийг сөргөөр олж авав. Энэ исэлдүүлэгчийн хариу урвал дахь азот. Даалгаврын дугаар 11. Эдгээр бодисын томъёо, урвалжнуудын хоорондох захидал харилцааг суулгаж, энэ бодисыг харилцан тохиролцох болно. Захидалд заасан байрлал бүрт заасан байрлал бүрт тохирсон байрлалыг сонгоно уу. D) ZNBR 2 (R-P) 1) Agno 3, NA 3 PO 4, CL 2 2) BAO, H 2 O, KOH 3) H 2, CL 2, O 2 4) hbr, lioh, ch 3 cooh 5) H 3 PO 4, BACL 2, CUO Зохих үсгүүдийн доор сонгосон материалын тоог сонгоно уу. Хариулт: А-3; B-2; 4 цагт; Ноён А) Гидроусын устөрөгч нь хүхрийн болон устөрөгчийн сульфидын хайлмалаар дамждаг. H 2 + s \u003d t o \u003d\u003e h 2 s Хлорыг газар дээр нь дамжуулж байхад сульфур Дичиорид нь өрөөний температурт үүсдэг. S + CL 2 \u003d SCL 2 Төлөө surchase ege Хлореинтай хамт хүхэр хэрхэн хариу үйлдэл үзүүлдэг, зохих ёсоор хэрхэн яаж хандах, энэ тэгшитгэлийг бүртгэх шаардлагагүй болно. Гол зүйл нь үндсэн түвшинд байгаа нь хлоре бүхий хүхийг санахыг санаж байна. Хлор бол хүчтэй исэлдүүлэгч бөгөөд сульфур, хүхэр нь ихэвчлэн хос функцийг харуулдаг. Энэ бол хүчирхэг исэлдүүлэгч агент нь хүхрийн chlorine cl 2, энэ нь молорул cl 2, ox or orldize болно. Хүхрийн зууханд шатахуун дөл шатааж, хурц үнэртэй хий үүсгэдэг. Сульфур Дио-д 2: Б) тиймээс 3 - сульфур Оксид (vi) нь хүчиллэг шинж чанарыг илэрхийлсэн. Ийм исээр, үүнтэй харьцах урвал нь устай харьцах урвал, мөн амфотерик исэл, гидрейз, гидроксидуудтай холбоотой. Жагсаалтад 2-р жагсаалтад бид зүгээр л харагдаж байна, бид зүгээр л харагддаг, ус, гол боок, koh koh koh-ийн гидроксид. Хүчиллэг ислийн хувьд үндсэн оксид, тохиромжтой хүчил, тохиромжтой хүчил, металл үүсдэг бөгөөд энэ нь үндсэн ислийн нэг хэсэг юм. Хүчиллэг хүчиллэг хүчилтэй хүчиллэг хүчилтэй, хүчиллэг хэлбэртэй элемент нь оксидтай ижил хэмжээтэй байдаг. Тиймээс 3 ичимхий хүчил нь сульфурик хүчилт H 2-тэй тохирч байна. 4 (мөн тэнд, сульфурын исэл +6). Тиймээс, металлын исний хүмүүнлэгийн харилцан үйлчлэл нь хүхрийн хүчилтөрөгчийг хүхрийн хүчлийг авах болно. Тэгэхээр 3 + bao \u003d baso 4 Устай харьцахдаа хүчиллэг оксид нь зохих хүчиллэг болж хувирдаг: Тэгэхээр 3 + H 2 O \u003d H 2 SO 4 Мөн Metall Eassides-ийн хүчиллэг исний хүчилтөрөгчийн харилцан үйлчлэл, давстай тохирох хүчил, усаар дамждаг. Тэгэхээр 3 + 2koh \u003d k 2 SO 4 + H 2 O C) Цайруулагч гидроксид zn (өө) 2 нь ердийн амфотик шинж чанартай, энэ нь ердийн амфотерик шинж чанартай бөгөөд энэ нь хүчиллэг иос, хүчиллэг, хүчиллэг, хүчиллэг, хүчиллэг, хүчиллэг, хүчиллэг, хүчиллэг, хүчиллэг, хүчиллэг, хүчиллэг, хүчиллэг, хүчиллэг, хүчиллэг, хүчиллэг, хүчиллэг, хүчиллэг, хүчиллэг, хүчиллэг, хүчиллэг, алим юм. Жагсаалтад 4-т, бид хүчил гэж үздэг - Бромомрогийн hbr, acomogrogened hbr ба acetic болон Alkali - lioh. Шүлтлэгийг усалдаг усны гидроксид нь усанд уусдаг. Zn (өө) 2 + 2hbr \u003d znbr 2 + 2h 2 + 2 O ZN (OH) 2 + 2CH 3 COOH \u003d ZN (CH 3 CO) 2 + 2 + 2 + 2 O ZN (өө) 2 + 2lioh \u003d li 2 Г) цайрын бромид znbr 2 бол давс, усанд уусдаг. Уусдаг давс, ион солилцооны урвал хамгийн түгээмэл байдаг. Давс нь өөр давстай урвалд орж, давс нь уусдаг, тунадас үүсэх нь үүсдэг. Бас znbr 2 нь бромидын ионыг агуулдаг. Металлын хувьд Халлеальт 2 галогенуудтай хариу үйлдэл үзүүлэх боломжтой бөгөөд энэ нь mendeleev хүснэгтэд өндөр байдаг. Энэ замаар? Тодорхойлсон төрлийн урвал нь жагсаалтын 1-ийн бүх бодисыг үргэлжлүүлнэ. ZNBR 2 + 2GNO 3 \u003d 2AGBR + + ZN (NO 3) 2 3znbr 2 + 2NA 3 PO 4 \u003d ZN 3 \u003d ZN 3 (PO 4) 2 + 6 + 6 + 6/0ABR Znbr 2 + C CL 2 \u003d ZNCL 2 + BR 2 Даалгаврын дугаар 12. Энэ бодисын нэр, ангийн нэр ба ангийн нэрсийн хоорондох харилцагчийг тохируулах: Энэ бодисын нэр: Захидалд заасан байрлал бүрт хамаарч, тоогоор тэмдэглэсэн тохирох байрлалыг сонгоно уу. Зохих үсгүүдийн доор сонгосон материалын тоог сонгоно уу. Хариулт: A-4; B-2; 1-д Тайлбар: A) метил Бензол бол толуол бөгөөд бүтцийн томъёотой: Энэ бодисыг харж болох бөгөөд энэ бодисын молекулууд нь зөвхөн нүүрстөрөгч, устөрөгчөөс бүрдэнэ Б) анилиний бүтцийн томъёо (Аминобензен) дараах байдалтай байна. Анилины молекулын бүтцийн томъёосоос харахад анхилуун үнэрт уснаас бүрдэх бөгөөд amino and aminin (-nh 2), aminine (-nh 2), aminine (aminine нь aminine (aminine нь aminin and aminine нь Зөв хариулт нь 2 байна. В) 3-метилбутанал. AL-ийн төгсгөл нь "бодис нь Aldehydam гэсэн утгатай болохыг санал болгож байна. Энэ бодисын бүтцийн томъёо: Даалгаврын дугаар 13. Санал болгож буй жагсаалтаас, Bouthen-1-ийн бүтцийн имомерууд-1 бодисыг сонгоно уу. Сонгосон бодисын хариуг бичнэ үү. Хариулт: 2; тав Тайлбар: Изомерууд ижил молекулын томъёо, өөр бүтэц, өөр бүтэцтэй бодисыг дууддаг. Ижил төстэй бодисын дагуу ялгаатай бодис, гэхдээ молекулуудын ижил найрлагатай ижил төстэй бодисууд. Даалгаврын дугаар 14. Санал болгож буй жагсаалтаас хоёр бодисыг сонго, калийн перманжанатын шийдэл нь шийдлийн өнгөний өнгөөр \u200b\u200bөөрчлөгдөх болно. Сонгосон бодисын хариуг бичнэ үү. Хариулт: 3; тав Тайлбар: Alkans, түүнчлэн CYCLOLOKLANK нь 5-р ба түүнээс дээш нүүрстөрөгчийн орон сууцны хэмжээтэй циклканкатууд нь маш дотно, калоригийн kmnoce kmnoce kn and of and of and of and of and of and of and of and and of and of and and Байна уу. Тиймээс, 1 ба 4-р хувилбар нь алга болсон - Cyclexeexane эсвэл Cotassium Permanganate-ийн усан сангийн нэмэлт, өнгөт өөрчлөлт гарахгүй. Хонологийн цуврал цувралын гидрокарын дунд исэлдүүлэгч бодисын уусмал, бусад бүх гомзоль, эсвэл Карбоксилийн хүчил эсвэл холбогдох давснаас хамаарч исэлддэг. Тиймээс 2-р сонголт алга болно (Бензол). Зөв хариултууд - 3 (толуол) ба 5 (Propylene). Хоёулаа урвалын урсгалын улмаас Potasium Permanganate-ийн Valasium Pernet-ийн давталтыг өнгөгтгөнө. Ch 3 -CH \u003d ch 2 + 2kno 4 + 2 + 2 oh → ch 3 ove (өө) 2 + 2 oh + 2 + 2 + 2 + 2koh Даалгаврын дугаар 15. Санал болгож буй жагсаалтаас, формальдегидефид хоёр бодисыг сонгоно уу. Сонгосон бодисын хариуг бичнэ үү. Хариулт: 3; дөрөв Тайлбар: Формальдегид нь Альдегидегийн ангиллыг хэлдэг - Молекулын төгсгөлд aldehyde бүлэг бүхий органик бүлэгт багтдаг органик нэгдэл. Ердийн Aldehyde урвал нь функциональ бүлгээр дамждаг исэлдэлт, сэргээх урвал юм. Формальдегидегийн жагсаалтын жагсаалтын жагсаалтын жагсаалтын жагсаалтын жагсаалтын жагсаалтын жагсаалтын жагсаалтын дундуур бол устөрөгч (PD, PD, PD, PD), исэлдэлт. Никель Катализатор дээр устөрөгчийг сэргээх үед формальдегид Метанол руу шилждэг: Мөнгөн толины урвал нь мөнгөн эдгэрэх урвал юм туузны ший шийдэл Мөнгөн исэл. Усанд орох уусмалд аммиакийг ууссан тохиолдолд мөнгөн исэл нь нарийн төвөгтэй нийлмэл нийлбэрээр хөрвүүлдэг - DIMONMINEMINBRA HEDROXINE (I) OH OO. Formenddeehyde-ийг нэмж оруулсны дараа Redox-ийн урвалын хариу үйлдэл нь мөнгө сэргээгддэг: Даалгаврын дугаар 16. Санал болгож буй жагсаалтаас, метиламинтай хоёр бодисыг сонгоно уу. Сонгосон бодисын хариуг бичнэ үү. Хариулт: 2; тав Тайлбар: Метюфин нь ангийн аминүүдийн органик нэгдлүүдийг танилцуулах хамгийн энгийн юм. Амингийн онцлог шинж чанар нь Нитроген атомын шинж чанар бөгөөд энэ нь Нитроген атомын шинж чанартай бөгөөд энэ нь Нитроген атомын хувьд үндсэн, урвалын шинж чанарыг агуулдаг бөгөөд урвалын шинж чанарууд бөгөөд урвалын шинж чанарыг нуман хаалга юм. Ийгээр Метиламиныг суурийн болон нумайлан, Хлороман, гидрофиль, гидроглорлорын тусламжтайгаар хариулсан сонголтуудаас хариу үйлдэл үзүүлдэг. Ch 3 nh 2 + ch 3 ch ch 3 cl → (ch 3) 2 NH 2 NH 2 + CL - Ch 3 nh 2 + hcl → ch 3 nh 3 nh 3 + cl - Даалгаврын дугаар 17. Бодисын хувиргах схемийг дараахь байдлаар өгдөг. Эдгээр бодисын аль нь x ба x бодисуудтай болохыг тодорхойлох. Зохих үсгүүдийн доор сонгосон материалын тоог сонгоно уу. Хариулт: 4; 2. Тайлбар: Архи, согтууруулах ундаа олж авах урвалын нэг нь гидролизийн галоген алхмайн урвал юм. Ийнхүү, Хлореетраны спиртийг Хлоройн-аас спиртээс зайлуулах боломжтой бөгөөд энэ тохиолдолд naoh. Ch 3 ch 2 cl + cl + naoh (архи.) → ch 3 ch 3 ch 2 oh + o + + naacl Дараагийн хариу үйлдэл нь этилийн архины исэлдэлтийн урвал юм. Архи согтууруулах ундааны исэлдэлт нь зэс казалист эсвэл cuo ашиглан хийдэг: Даалгаврын дугаар 18. Багцын нэр, бүтээгдэхүүний хоорондох захидал ба бүтээгдэхүүний хоорондох харилцааны хоорондох харилцааны хоорондох харилцааг тохируулах, үсэгнээс бүрдсэн байрлал бүрт; бичсэн байрлал бүрт заасан тохирох байрлалыг сонгоно уу. Хариулт: 5; 2; 3; 6. Тайлбар: Алканын хувьд хамгийн онцлог шинж чанар нь устөрөгчийн атомыг галоген атомаар сольсон чөлөөт радикал орлуулах урвал юм. Ийн учраас бромий угсаа авах боломжтой бөгөөд брометаныг Брометрийн авч болно. Циклопропани ба циклопани Молекулууд эдгээр молекулуудаас циклүүдийн мөчлөг нь тогтвортой хэвээр байгаа тул холболтын урвалын хариу урвал гарч ирнэ. Циклопропийн мөчлөгийн цикл ба циклобутаны циклехекал, циклехеэрийн циклексик циклехникийн циклийг Брэндин атомаар сольсон. Даалгавар №19. Хариуцагч бодисын хоорондох захидал ба нүүрстөрөгчийн агуулсан бүтээгдэхүүний хооронд байгуулагдсан, эдгээр бодисын харилцан үйлчлэлийн хооронд байгуулагдсан, эдгээр бодисын харилцан үйлчлэлийн хооронд байгуулагдсан, эдгээр бодисын хооронд хэлбэлзлээс бүрдэх байрлал бүрт заасан байрлал бүрт тохирсон байрлалыг сонгоно уу. Ширээн дээрээс сонгосон тоонуудыг зохих үсгээр бичнэ үү. Хариулт: 5; Дөрөв; 6; 2. Даалгаврын дугаар 20. Санал болгож буй үйлдлийн төрлөөс эхлэн Alkali металлын харилцан үйлчлэлийн хоёр төрлийн урвалыг сонгож болно. Сонгосон урвалын төрлүүдийн хариуд бичнэ үү. Хариулт: 3; дөрөв Alkali Metals (li, ya, k, k, k, rb, cs, cs, cs, cs, cs, fr) нь ширээний бүлгийн бүлгийн бүлгийн Mainb бүлэгт байрладаг. Менделеев бөгөөд гадаад түвшинд байрладаг электроныг хялбаршуулдаг. Хэрэв та шүлтлэг металл үсгийг томилсон бол, дараа нь amkali металлын урвал нь дараахь зүйл шиг харагдах болно. 2M + 2H 2 O → 2MOH + H 2 Alkali металлууд устай маш идэвхтэй байдаг. Урвал их хэмжээний дулааныг сулруулж, эргэлт буцалтгүй, эргэлт буцалтгүй бөгөөд энэ нь Catalyst-ийг ашиглахыг шаарддаг бөгөөд урвалын хэрэглээний бүтээгдэхүүнийг ашиглахыг шаарддаг. Бүх экзотермик урвал нь катализаторыг ашиглахыг шаарддаггүй бөгөөд энэ нь катализаторыг ашиглахыг шаарддаггүй гэдгийг тэмдэглэх нь зүйтэй. Металл, ус нь янз бүрийн агрегат мужид байдаг тул энэ урвал нь фазын хуваалтын хэсгээс эхэлдэг тул гетерогени юм. Энэ урвалын төрөл - Орлуулах. Органик бус бодисын хоорондын урвал нь цогцолбор, бусад энгийн, нарийн төвөгтэй бодисын бусад энгийн бодис үүсгэдэг урвалын хариу урвал үүсгэдэг. (Эдгээр бодисууд нь саармаг ба суурийн хоорондох саармаг ба суурийн хоорондох үр дүн нь интеграл ба давс, давс, бага зэрэг татдаг бодис үүсдэг). Дээр дурдсанчлан Alkali металууд нь агентууд буурч байгаа тул гаднах давхаргад электрон өгч, ингэснээр хариу үйлдэл үзүүлдэг. Даалгаврын дугаар 27. Гадаад нөлөөллийн жагсаалтаас устөрөгчтэй эптиленийн эптилений хариу урвал буурах хоёр нөлөөллийг сонго. Сонгосон гадаад нөлөөнүүдийн тоонуудын тоонд бичнэ үү. Хариулт: 1; дөрөв Дараах хүчин зүйлүүд нь химийн урвалын ханш нөлөөлдөг: урвалж эмгэгийн температур, температурын температур, концентрацийн концентрациас гадна. 10 градусын эмпирик дүрмийн дагуу, 10 градусын температурт температурыг нэмэгдүүлдэг, нэг төрлийн төрлийн урвал температурыг нэмэгдүүлдэг. 2-4 удаа нэмэгддэг. Үүний улмаас, температур буурах нь урвалын хурд буурахад хүргэдэг. Эхний хариулт тохиромжтой. Дээр дурдсанчлан нь хариу үйлдэл үзүүлэхэд нөлөөлж, урвалын агууламжийн хэмжээ, дараа нь этиленийн концентрациас болж, хэрэв та Этиленийн концентрацийг нэмэгдүүлбэл энэ нь даалгаврыг биелүүлж байгаа бол энэ нь даалгаврыг биелүүлээгүй тохиолдолд. Устөрөгчийн агууламж буурах нь эсрэгээр нь эх сурвалжийн бүрэлдэхүүн хэсэг бөгөөд эсрэгээрээ, хариу урвалыг бууруулдаг. Үүний улмаас хоёр дахь сонголт нь тохиромжгүй, гэхдээ дөрөв дэх нь тохирохгүй. Катализатор бол химийн урвалын хурдыг хурдасгаж байгаа бодис юм. Гэхдээ бүтээгдэхүүний нэг хэсэг биш юм. Catalyst ашиглах нь эфирентийн устөрөгчийн урсгалыг хурдасгаж байгаа тул асуудлын нөхцөлтэй тохирч байгаа тул энэ нь зөв хариулт биш юм. Устөрөгчийн харилцан үйлчлэл нь устөрөгчтэй (Catalysts Ni, PD, PD, PD, PD дээр PD) -ийн харилцан үйлчлэлтэй байх үед Этан үүсдэг. Ch 2 \u003d ch 2 (g) + h 2 (g) → ch 3 -C 3 (g) Урвалд оролцсон бүх бүрэлдэхүүн хэсгүүд, бүтээгдэхүүн нь gasous бодис юм, тиймээс, тиймээс систем дэх даралт нь хариу үйлдэлд нөлөөлөх болно. Этилен, устейн хоёр боть, устөрөгчийн хоёр эзэлхүүнийг бий болгож, учир нь угсаа үүсдэг тул уг систем дэх даралтыг бууруулах явдал юм. Даралтыг сайжруулах замаар бид хариу урвал хурдасгах болно. Тав дахь хариулт тохирохгүй байна. Даалгавар №22. Давсны томъёололтын хоорондох захидал харилцааг суулгаж, энэ давсны уусмалын уусмалын хоорондох цахиурын электролизийн бүтээгдэхүүнүүд: Soloi томъёо Электролизийн бүтээгдэхүүн Ширээн дээрээс сонгосон тоонуудыг зохих үсгээр бичнэ үү. Хариулт: 1; Дөрөв; 3; 2. Электролиз бол шийдэл эсвэл электролитоор дамжин өнгөрөх үеэр электрод дээр гардаг Redox үйл явц юм. Катод дээр, энэ нь хамгийн том исэлдүүлэгч үйл ажиллагаатай эдгээр категорийг сэргээх нь зүйтэй юм. Хамгийн их сэргээн босголтын чадварыг хамгийн их сэргээн босгосон чадвар нь эхлээд анодоор исэлддэг. Усан уусмалын электролиз 1) катод дээрх усан уусмалын электролиз хийх үйл явц нь католизаторийн материалаас хамаардаггүй, гэхдээ стрессээс хамааран стрессийн мөрөнд хамаарна. Мөр дэх катионуудын хувьд Li + - al 3+ сэргээх үйл явц: 2h 2 o + 2e → h 2 → h 2oh - (катод h 2 зогсож байна) ZN 2+ - PB 2+ Сэргээх үйл явц: Me n + + + ne → me me 0 ба 2 цаг \u003d h 2e → h 2o → h 2, надад хуваарилах болно. Cu 2+ - AU 3+ Сэргээх үйл явц намайг n + + ne → me me 0 (намайг катод дээр зогсож байна) 2) Анод дээрх усан уусгааны электролизийн электролизийн явц нь анодны материалын материалаас хамаарна. Хэрэв анод ууж чадахгүй бол I.E. инерц (Платинум, алт, алтан, Геррит), дараа нь энэ нь зөвхөн сургалтын шинж чанараас хамаарна. Elenion for-ийн хувьд 4 2 2-, үгүй, 3 -, of 3 3-, Өө, өө - исэлдүүлэх үйл явц: 4OH - - 4E → → O 2 + 2 o 2 o эсвэл 2 цаг → ove → ove ove overge-ыг сулруулж байна. Халагогууд тодруулсан) Органик хүчил исэлжүүлэх үйл явц: 2RCOO - - 2E → R-R + 2CO 2 Нийт электролизийн тэгшитгэл: A) NA 3 PO 4 Шийдэл 2H 2 O → 2h 2 (катод дээр) + O 2 (анод дээр) Б) kcl шийдэл 2kcl + 2H 2 O → H 2 (катод дээр) + 2koode) + 2ko + cl 2 (анод дээр) В) Cubr2 шийдэл Cubr 2 → CU (катод дээр) + br 2 (анод дээр) D) CU шийдэл (NO3) 2 2cu (3) 2 + 2 цаг → 2 → 2cu (катод (катод) + 4 цаг + 3 + o 2 + oode дээр (ovode дээр) Даалгаврын дугаар 23. Давс ба давс ба энэ давсны нэрийн хоорондох захидал харилцааг гидролизийн хооронд тохируулна уу: Захидалд заасан байрлал бүрт тохирох байрлал бүрт тохирсон байрлалыг сонгоно уу. Ширээн дээрээс сонгосон тоонуудыг зохих үсгээр бичнэ үү. Хариулт: 1; 3; 2; дөрөв Давсны гидролиз - Усны давсыг зохицуулах, устөрөгчийн эмчилгээний харилцан үйлчлэл, + ус молекул нь металл категор, металл категор руу шилжихэд хүргэдэг. Гидролиз нь сул хүчилд тохирох когдож, англи хэл дээр тохирсон катезоор үүсдэг. A) Аммони хлорид (NH 4 CL) - Хүчтэй давс, аммайн хүчил, аммоли (сул бааз), катлитийн хүчээр үүссэн. NH 4 CL → NH 4 + + CL - NH 4 + + + H 2 O → NH 3 · H 2 + H 2 + H 2 O + (Аммиакийг усаар уусдаг) SYCOLA Шийдэлийн дунд (PH< 7). Б) калийн сульфат (k 2 so 4) нь хүчтэй хүхрийн хүчил, калийн гидроксид (хүчтэй бааз), гидролизийн давс юм. K 2 so 4 → 2k + + + + тийм 4- C) Натрийн карбонат (NA 2 CO 3) нь сул нүүрсний хүчил, натрийн гидроксид (Alkali, i.e..e.ce.ce.calizysizy нь анион дээрээс хамгаалдаг. CO 3 2 2- + H 2 O → HCO 3 - + OH - OH - (BICOINE BICBONEATE ION-ийг бүртгэх) Шүлтлэгийн шийдэл дунд (PH\u003e 7). Г) Хөнгөн цагаан сульфид (ALTERENERESESER (ALPERERESESER SEAR нь ХӨДӨЛГӨӨН, ХӨДӨЛГӨӨНИЙ ХӨДӨЛГӨӨН, ХӨДӨЛГӨӨНИЙ ХӨДӨЛМӨР (СОНГОЛТ, ХӨДӨЛМӨР) AL 2 S 3 + 6H 2 O → 2 → ӨГ (ӨГ) 3 + 3 цаг Дунд нь төвийг сахисан (PH ~ 7) -д ойрхон байна. Даалгаврын дугаар 24. Систем дэх даралтыг нэмэгдүүлснээр химийн урвалын тэгшитгэлийн хоорондох захидал харилцааг суулгаж, ХИМИЙН ТУХАЙ ХАМГИЙН ХАМГИЙН ХАМГААЛАХ ХАМГААЛАХ: ТУСГАЙ ХУУДАСНЫ ТУХАЙ ХУУДАСНЫ ТУХАЙ ХУУДАСНЫ ТУХАЙ ХУУДАСНЫ ТУХАЙ ХУУДАСЫГ ЗОРИУЛЖ БАЙНА. Илтгэл гаргах A) n 2 (g) + 3h 2 (g) ↔ 2 (g 2nh 3 (g) B) 2H 2 (G) + O 2 (G) ↔ 2 (G) ↔ 2H 2 O (G) C) h 2 (g) + cl 2 (g) ↔ 2 (g 2hcl (g) D) Тиймээс 2 (G) + C CL 2 (G) ↔ 2 (G 2 Cl 2 (g) Химийн тэнцвэрийн нүүлгэн шилжүүлэх чиглэл 1) Шууд хариу урвал руу шилждэг 2) урвуу урвал руу шилждэг 3) Тэнцвэржүүлэх нүүлгэн шилжүүлэлт байхгүй Ширээн дээрээс сонгосон тоонуудыг зохих үсгээр бичнэ үү. Хариулт: A-1; B-1; 3-т; Ноён Урвал нь шууд урвалын хурд нь урвуу хурдны хурдтай тэнцэх хэмжээний химийн тэнцвэрт байдалд байна. Хүссэн чиглэлд байрлах тэнцвэрийг шилжүүлэх нь урвалын нөхцөл байдлыг өөрчлөх замаар биелэгддэг. Тэнцвэрийн байрлалыг тодорхойлж буй хүчин зүйлүүд: - даралт: Хэсэгчилсэн даралт нэмэгдэж буй байдал нь эзлэхүүний бууралтад хүргэдэг урвалыг шилжүүлэхэд чиглэсэн урвалыг шилжүүлдэг. - температур: Температурыг нэмэгдүүлэх нь тэнцвэрийг нэмэгдүүлдэг. Элзеотермик урвалын үлдэгдэл нь үлдэгдэл нь үлдэгдэлд шилждэг (эсрэгээрээ, температурын үр дагавар нь экзотермигийн урвалд тэнцэнэ.) - эх сурвалжийн бодис ба урвалын бүтээгдэхүүний концентрац: Урвалын чиглэлээр дамжуулж буй материалыг нэмэгдүүлж, урвалын концентрацийг нэмэгдүүлэх нь үлгэрийг шууд хариу үйлдэл үзүүлэх, урвалын концентрацийг өөрчлөх, эсрэг талын концентрацийг буцаахад хүргэдэг. - catalysts нь тэнцвэрийн нүүлгэн шилжүүлэлтэд нөлөөлөхгүй, гэхдээ зөвхөн өөрийн амжилтыг хурдасгадаг. A) Эхний тохиолдолд хариу үйлдэл нь хэмжээ буурч байна. V (n 2) + 3V (H 2)\u003e 2v (NH 3). Систем дэх даралтыг сайжруулах замаар тэнцвэрт байдал нь жижиг чиглэлээр бага хэмжээгээр шилжих болно. Тиймээс шууд чиглэл (шууд хариуд (шууд хариуд) шилжих болно. Б) Хоёрдахь тохиолдолд хариу үйлдэл нь 2В (H 2) + v (o 2)\u003e 2v (H 2) Систем дэх даралтыг сайжруулах замаар тэнцвэржүүлэх замаар мөн шууд хариу урвал руу шилжих болно. В) Гурав дахь тохиолдолд, хариу урвал өөрчлөгдөхгүй даралт өөрчлөгдөхгүй, учир нь V (H 2) + V (CL 2) \u003d 2V (HCL) \u003d 2V (HCL), тиймээс тэнцвэржүүлэх нүүлгэн шилжүүлэлт гардаггүй. D) Дөрөв дэх тохиолдолд хариу үйлдэл нь v (тийм 2) + v (cl 2)\u003e v (тиймээс 2)\u003e v (тиймээс 2 CL 2). Систем дэх даралтыг нэмэгдүүлэх замаар үлдэгдэл нь бүтээгдэхүүн (шууд урвал) үүсэх болно. Даалгавар №25 Мэргэжлийн томъёоллын болон урвалжийн хоорондох захидал ба урвалын хоорондох харилцааг тохируулж болох бөгөөд үсгүүдийг ялгаж салгаж чаддаг: Захидалд заасан байрлал бүрт заасан байрлал бүрт тохирсон байрлалыг сонгоно уу. Бодисын томъёо A) hno 3 ба h 2 o В) NACL ба BACL 2 D) ALCL 3 ба MGCL 2 Ширээн дээрээс сонгосон тоонуудыг зохих үсгээр бичнэ үү. Хариулт: A-1; B-3; 3-т; М-2. A) Өргөх хүчил ба усыг давс ялгаж салгаж болно - кальцийн карбонатын CACONAL CACO 3. Кальцийн карбон карбонат бодис уусахгүй бөгөөд азотын хүчилтэй давс үүсэхгүй. Урвалын давс нь өнгөт нүүрсхүчлийн салстыг дагалддаг. CACO 3 + 2HNO 3 → CA (NO 3) 2 + CO 2 + H 2 O Б) Полдас хлорид хлорид kcl болон Alkali naoh-ийг зэсийн сульфатын уусмалаар сонгож болно. Зэсийн сультефат (II) -ийг KCL-ийн харилцан үйлчлэлээр дамжуулан солилцох, солилцох урвал нь урсахгүй, k + +, cu ex any any andy any-д байдаг. Зэс (II) SULFATE-ийн харилцан үйлчлэл, зэс (II) WELION (II) -ийг зэс (II) гидроксид (суурь суурь) үр дүнд хүрдэг. В) натри хлори хлоридууд NACL, BARIEDS BACL BACL 2 - Зэсийн тусгаарлаггүй (II) давсалж, давс (II) нарийсч, давс (II) нарийсч, давсалж, давс эсвэл шарсан талх (II) юм. Зэсийн (II) SULFATE-ийн харилцан үйлчлэлийг SULFATE-тэй харьцахдаа NACLESED-ийн хариу үйлдэл хийгдээгүй бөгөөд NA +, CL, CL, CU 2+ бөгөөд бие биендээ жижиг бүлгийн бодис үүсгэдэггүй. BACL (II) SULFATE нь BACL 2-ийн үрэвсэл, Бакл 2 орлоготой, солилцооны урвалын үрэвсэл, бари барийн сульфатын үр дүнд D) ALCL 3 ба Magne Menger хөнгөн цагаан хлорид хлоридууд mgclide mgclides mgclium Hydroxide-тэй харьцахдаа өөр өөрөөр хийдэг. ALKALI-ийн МАГИНГИЙН ХӨДӨЛГӨӨНИЙ ХЛОРООРДОР: MGCL 2 + 2KOH → MG (OH) 2 ↓ 2 + 2KCL Хөнгөн цагаан хлоридын харилцан үйлчлэлийн харилцан үйлчлэл, тунадасны харилцан үйлчлэл нь хамгийн түрүүнд үүссэн бөгөөд энэ нь нарийн төвөгтэй давс үүсгэдэг - калийн театридрозайкайкяналт. ALCL 3 + 4KOH → K + 3KCL Даалгаврын дугаар 26. Бодис ба програмын хоорондох захидал болон програмын хэсгийн хоорондох захидал: Захидалд заасан байрлал бүрт заасан байрлал бүрт тохирсон байрлалыг сонгоно уу. Ширээн дээрээс сонгосон тоонуудыг зохих үсгээр бичнэ үү. Хариулт: A-4; B-2; 3-т; Ноён A) Аммиак гэдэг нь химийн үйлдвэрлэлийн зайлшгүй бүтээгдэхүүн юм. Түүний үйлдвэрлэл, түүний үйлдвэрлэл жилд 130 сая гаруй тонн байдаг. Ихэнхдээ аммиакийг азот бордоо бэлтгэхэд ашигладаг (нитроген бордоцой, urtreium, urea, urea, urea, нитрат, нитратал, нитратал, натриц, натри. Санал болгож буй хариултуудын сонголтуудын дунд, аммиакийн талбай нь бордооны талбай юм. Б) метан нь хамгийн энгийн нүүрсустоускарбон, хамгийн дулаахан хязгаарлагдмал тооны хязгаарлагдмал нэгдлүүдийн хамгийн дулааны тогтвортой төлөөлөгч юм. Энэ нь дотоодын болон үйлдвэрлэлийн түлш болгон ашигладаг бөгөөд энэ нь салбарын түүхий эд (хоёр дахь хариултын сонголт) -д ашиглагддаг. Метан нь 90-98% нь байгалийн хийн нэг хэсэг юм. C) Материал гэдэг резинэн гэж нэрлэдэг резинэн, бид нэгтгэсэн нэгдлүүдийн полимержилтыг олж авах. ISOPRONE нь энэ төрлийн нэгдлүүдийг дагаж мөрдөж байгаа бөгөөд резинэн төрлийг олж авахад ашигладаг. Г) Бага молекулийн жингийн алкенийг хуванцараар олж авахад хуванцар, этиленийг хуванцараар авахад ашигладаг. н.Ch 2 \u003d ch 2 → (-ch 2 -C 2 - 2 -) n Даалгаврын дугаар 27. Калийн нитратыг (грамм) -рж (грамм) -ийн массыг 120 гризийн тусламжтайгаар татан авах боломжтой. (Дугаарыг аравдугаар сар хүртэл тэмдэглэ.) Хариулт: 3.4 гр Тайлбар: X go go нь калийн нейратыг 150 гр-ийн уусмалаар уусгана. Бид калийн нитратыг 150 гр-ийн уусмалаар уусдаг. m (kno 3) \u003d 150 гр \u003d 150 гр 0.1 \u003d 15 гр Давсны массыг масстай болгохын тулд 12%, x g калийн нитрат нэмж оруулсан. Уусмалын масс (150 + x) байсан, тэгшитгэл нь маягт дахь тэгшитгэлийг бичих болно. (Дугаарыг аравдугаар сар хүртэл тэмдэглэ.) Хариулт: 14.4 гр Тайлбар: Устөрөгчийн сульфидын нийт шатсаны үр дүнд сульфур Диоксид үүсгэдэг. 2H 2 S + 3O 2 → 2so 2 → 2 + 2H 2 O Авогадро хуулийн үр дагавар нь ижил нөхцөлд байгаа хийн хэмжээ нь бие биентэйгээ холбоотой бөгөөд эдгээр хийн хэмжээнээс хамаарна. Тиймээс, урвалын тэгшитгэлийн дагуу: ν (ν (o 2) \u003d 3 / 2ν (H 2 S), тиймээс, устөрөгчийн сульфид, хүчилтөрөгчийн хэмжээ, хүчилтөрөгч нь хоорондоо ижил аргаар харьцдаг: V (o 2) \u003d 3 / 2V (H 2 S), V (o 2) \u003d 3/2 · 6.72 l \u003d 10.08 L \u003d 10.08 L / 22.4 L / 22.4 L / 22.4 MOL \u003d 0.45 MOL Нийт устөрөгчийн сульфидын нийт шатаахад шаардлагатай хүчилтөрөгчийн массыг тооцдог: m (o 2) \u003d 0.45 mol · 32 г / mol \u003d 14.4 гр Даалгаврын дугаар 30. Цахим үлдэгдэл аргыг ашиглан урвалын тэгшитгэлийг ашиглан: Na 2 so 3 + ... + koh → ko → k 2 mno 4 + ... + h 2 o Исэлдүүлэгч бодисыг тодорхойлох, агентийг багасгах. MN +7 + 1E → MN + MN +6 +6 │2 сэргээх урвал S +4 - 2e → s +6 │1 │1 exidation урвал Mn +7 (kmno 4) - oxidizer, s +4 (NA 2 SO 3) - сэргээх NA 2 тэгэхээр 3 + 2kmno 4 + 2koh → 2k 2 MNO 4 MNO 4 MNO 4 + NA 2 + + H 2 O Даалгаврын дугаар 31. Төмөр халуун төвлөрсөн хүдрийг уусгасан. Үүссэн давс нь натрийн гидроксидын илүүдэл уусмалаар эмчилсэн байв. Үүний үр дүнд хүрэн хур тунадасыг шүүж, тооцов. Үүний үр дүнд үүссэн бодисыг төмрөөр халаана. Дөрвөн тайлбарласан урвалын тэгшитгэлийг бичнэ үү. 1) Төмрөг, хөнгөн цагаан, хром шиг, хамгаалалтын хүчил, хамгаалалтын хүчил, хамгаалалтын исэл Урвал зөвхөн хүхрийн хий ялгаж салгахад л нөлөөлдөг. 2FE + 6H 2 SO 4 → Fe 2 (SO 4) 2 + 3SO 2 + 6H 2 + 6 + 2 o) 2) төмрийн сульфат (III) - Усанд ууссан давс (III) -ийг ус (III холболт) -ийн үр дүнд (III холболт). 2 2 (тийм 4) 3 + 3naoh → 2fe (Өө) 2fe (Өө) 3 + + 3na 2 SO 4 3) Металлын гидроксидыг тооцоолох нь зохих исэл, устай харьцуулахад ялзралын дэгдээхэйг уусгана. 2fe (өө) 3 → fe 2 o 3 o 3 + 3h 2 o 4) Төмөр (III) Оксидыг төмөр төмөр, төмөр (II) халаана (FEI холболт нь дундуур нь дундуур). Fe 2 O 3 + FE → 3FEO (халаах үед) Даалгаврын дугаар 32. Дараах өөрчлөлтийг дараахь зүйлийг хийж болох урвалын тэгшитгэлийг бичнэ үү. Урвалын тэгшитгэлийг бичихдээ органик бодисын бүтцийн томъёог ашиглах үед. 1) Дотоод intramolecular dehydration нь 140 o C-ээс дээш температурт гардаг. Энэ нь согтууруулах ундааны нүүрстөрөгчийн атомыг нэг нь архины гидроксилээс (β байрлалд) наалддаг. Ch 3 -CH 2 -OH 2 -OH → Ch-ch 2 \u003d CH-Ch-CH 3 + H 2 O (NOTERST - NEMANT - N 2, 180 O CH 2, 180 O C) Дулаан хүчлийн хүчилтөрөгчийн үйл ажиллагааны улмаас offololecular алдалт нь 140 o c-ээс доош температурт байдаг бөгөөд эцсийн эцэст нэг архины молекулаас нэг усны молекулыг бууруулдаг. 2) Projectenen нь тэгш бус үг хэллэгийг хэлдэг. Халлог устөрог устөрөгч, усыг нэмж, устөрөгчийн атом нь олон тооны устөрөгчийн атомтай холбоотой олон тооны харилцаанд оролцдог. Ch 2 \u003d ch-ch-ch 3 + hcl → ch 3 -Chcl-ch 3 3) NAOH-ийн 2-chloRopropane-ийн усан уусмалыг 2-chlorpropane-тэй ажиллах, галоген атомыг гидроксилийн бүлгээр солино. Ch 3 -CHCL-ch 3 + 3 + NAOH (AQ) → CH 3-CH 3-CHOH-Ch 3 + NACLE 4) Зөвхөн пропиленийг зөвхөн пропилен-1-ээс авах боломжгүй, гэхдээ incamolecul-2-оос дээш температурт сийрэгжүүлэлтийн шингэний хариу үйлдэл. Ch 3 -CH (өө) -Чат 3 → ch 2 \u003d ch-ch 2 \u003d ch-ch eve 3 oh 2 o 2 o (5, 180 O C) 5) Амталин дунд зэргийн дунд зэргийн дунд, кали Перманжанат, алет гидроксилизаци нь Diols-ийг боловсруулдаг. 3ч 2 \u003d ch-ch-ch 3 + 2kmno 4 + 4 цаг → 3 цаг → 3 + 2 + 2 + 2 + 2 + 23 Даалгаврын дугаар 33. Массер фракцуудыг (II) SURFATE, MEADEAL SURFINE-ийг (II) SURFATE, ХАМГИЙН ХОЛБООНЫ ХАМГИЙН ХОЛБОГДОГДАГДАХ ЗЭЭЛИЙН ХОЛБОГДОГДОГДОГДОГДОГДОГДОГДОГДОЖ БАЙНА. II). Хариуд нь ажлын нөхцөлд зааж өгсөн урвалын тэгшитгэлийг бичээд шаардлагатай бүх тооцоогоо авчирна уу (хүссэн хэмжээгээ хэмжих нэгжийг зааж өгнө үү) физик хэмжээс). Хариулт: ω (Al 2 S 3) \u003d 40%; Ω (cuse 4) \u003d 60% Төмөр материал (II) ургамал (Ii) Хөндлөнхийн хагас нь нэвтэрсэн орчим нь шаргуу цахилгаан нь дууссан, Эрдэнэт нь нэвчин шавхадаг бөгөөд хувьсгал нь асардаг, цагаан ус түржүү, тугалалт ба биеэр хуульч (iii), устөрөгчийн гидроклиг (III), устөрөгчийн гидроклиг юм. AL 2 S 3 + 6H 2 O → 2AL (OH) 3 ↓ 3 00 + 3 S (I) Устөрөгчийн сульфид нь зэс (II) Sulfate-ийн уусмалаар дамжин өнгөрөх үед зэс (II) уналт: CUSO 4 + H 2 S → CUS ↓ + H 2 SO 4 (II) Бид массыг тооцож, зэс (II) -ийн уусмалыг тооцоолоход массыг тооцдог бөгөөд m (cuso 4) \u003d m (p-ra) \u003d m (p-ra) · ω (CUSO 4) \u003d 960 G \u003d 0.05 \u003d 48 гр; ν (cuse 4) \u003d m (cuso 4) / m (cuso 4) / m (cuso 4) \u003d 48 гр \u003d 080 г \u003d 0.3 моль Урвалын тэгшитгэлийн дагуу (II) ν (II) ν (cuso 4) \u003d ν (cuse 4) \u003d ν (ν (ν) \u003d 0.3 моль (III 2 S) \u003d 0.3 MOL (ALIEH) \u003d 0.3 MOL (ALIEH) \u003d 0.3 MOL (ALIEH) \u003d 0.3 MOL (ALIE) \u003d 0.3 MOL (ALIET) \u003d 0.3 MOL (III) \u003d 0.3 mol (al 2 s) \u003d 0/3 MOL (III) \u003d 1/3) \u003d 1/3 MOL 0, 1 моль Хөнгөн цагаан сульфид, зэс сульфат (II) массыг тооцоолох (II): м (al 2 s 3) \u003d 0.1 mol · 150 г / mol \u003d 15 гр; M (cuso4) \u003d 25 G - 15 G \u003d 10 гр Ω (al 2 s 3) \u003d 15 г / 25G · 100% \u003d 60% \u003d 60%; Ω (cuse 4) \u003d 10 г / 25G · 100% \u003d 40% Даалгаврын дугаар 34. Зарим нь дээжийг шатаахдаа органик нэгдэл Халаг 14.8 грийг 35.8 гоксаль диоксид, 18.2 грайкид хийсэн. Устөрөгчийн дагуу энэ бодисын уурын харьцангуй нягтрал нь 37-тэй тэнцүү гэдгийг мэддэг химийн шинж чанарууд Энэ бодисыг зэс (II) oxide-тай харилцан үйлчлэлийн харилцан үйлчлэлээр уг бодисын харилцан үйлчлэл, Кетон үүссэн. Даалгаврын эдгээр нөхцлөөс сэдэвлэсэн: 1) молекулын томъёог гаргахад шаардлагатай тооцоо ийн оршил (Хүссэн физик хэмжигдэхүүнийг хэмжих нэгжийг зааж өгөх); 2) Анхны органик бодисын молекулын томъёог бичнэ; 3) Энэ бодисын бүтцийн томъёог нь атомын холболтын харилцааг илэрхийлдэг. 4) Энэхүү бодисын бүтцийн томъёог ашиглан бодисын oxide (II) -ийг зэсийн exide (II) бич. Туршилтын ердийн тестийн даалгавар нь 2017 онд нэгдсэн Улсын шалгалтын бүх шинж чанар, шаардлагыг харгалзан үзсэн ажлын багцыг харгалзан үзэхэд 10 сонголтыг багтаасан болно. Гарын авлагын зорилго нь Уншигчдын бүтэц, агуулгын талаархи мэдээллийг химийн бүтэц, агуулга, даалгаврыг биелүүлэхэд хэцүү байдаг. Жишээ. Санал болгож буй бодисын жагсаалтаас нь зэс хариу үйлдэл үзүүлдэг хоёр бодисыг сонгоно уу. Сэтгэл ханамжтай Лал дох үйл 1. KIM EGE-г томилох НЭГДСЭН ТӨЛБӨРИЙН ШАЛГАЛТ (ENGINE-д хандсан, стандарт боловсруулсан мэдээллийн технологийн сургалтын хөтөлбөрийг (Хэмжих хэмжих материалыг ашиглан олон тооны ерөнхий боловсролын хөтөлбөрийн чанарын хөтөлбөрийг ашигласан. EGE-ийн 2012 оны 12-р сарын 29-ний өдөр, 2012 оны 2-р сарын 27-ны өдөр, 2012 оны 2-р сарын 273-FERING-ийн ХУУЛЬД ЗОРИУЛЖ БАЙНА. Хэмжих хэмжих материалууд нь Холбооны бүрэлдэхүүн хэсгийн төгсөгчдийн түвшинг тогтоох боломжийг танд олгоно улсын стандарталын Дунд (бүтэн) Химийн ерөнхий боловсрол, үндсэн болон профайлын түвшин. Химийн нэгдсэн улсын тогтоолыг хүлээн зөвшөөрсөн үр дүнг хүлээн зөвшөөрдөг ажлын албан байгууллаг ХИМИЙН ТӨЛӨВЛӨГӨӨНИЙ АЖИЛЛАГАА, МЭДЭЭЛЭЛИЙН ЗАСГИЙН АЖИЛЛАГАА. 2. KIM EGE-ийн агуулгыг тодорхойлох баримт бичиг 3. Ким ege-ийн бүтцийг боловсруулж, боловсруулахад хандах хандлагатай байна Ким ege-ийн үндэслэл нь өмнөх жилийн туршид шалгалтын загварыг боловсруулж байсан ерөнхий арга зүйн үүднээс тогтоогджээ. Эдгээр тохиргооны мөн чанар нь дараах байдалтай байна. 4. Cim ege rege бүтэц Шалгалтын ажлын хувилбар бүрт нэгдсэн төлөвлөгөөний дагуу баригдсан болно 1-р хэсэг нь 35 даалгаврыг богино хугацаанд 35 даалгаврыг агуулсан, үүнд 26 даалгаврыг багтаасан (эдгээр ажлын хэсгүүдийн тоонууд) ба ... 26, 26) ба Эдгээр даалгаврын дарааллын тоо: 27, 28, 29, ... 35). 2-р хэсэг нь маш нарийн төвөгтэй, нарийвчилсан хариу урвалын нарийвчлал, нарийвчилсан хариу үйлдэл (эдгээр ажлын талбаруудын дэс дараалсан). 36, 37, 39, 39, 40, 40).Бодисын томъёо
Урвалжууд
Цуглуулгад бүх тестийн сонголтууд, шийдлийн бүх сонголтуудын аль нэг нь өгөгдсөн бүх даалгаврыг өгдөг. Нэмж дурдахад, ашиглахад ашигласан маягтуудын дээжүүд нь хариу, шийдлийг бүртгүүлэхэд хүргэдэг.
Даалгаврын зохиогч бол тэргүүлэгч эрдэмтэн, багш, ege-ийн хяналтын материалыг удирдан зохион байгуулдаг арга, арга барил юм.
Гарын авлагыг багш нарыг химийн шалгалтанд бэлтгэхэд зориулж багш нарыг сурч, ахлах сургуулийн сурагч, төгсөх, өөрийгөө хянах зорилгоор.
Аммони хлорид дахь химийн холболтууд байдаг.
1) ионик
2) Ковалентент туйл
3) Тавиургүй туйлшрал
4) устөрөгч
5) металл
1) цайр хлорид (R-P)
2) Натрийн сульфат (RR)
3) Шилжүүлэгч шинэхэн хүчил
4) төвлөрсөн хүхрийн хүчил
5) Хөнгөн цагаан туяанд
Удиртгал
Ажил гүйцэтгэх заавар
Сонголт 1
1-р хэсэг
2-р хэсэг
Сонголт 2.
1-р хэсэг
2-р хэсэг
Сонголт 3.
1-р хэсэг
2-р хэсэг
Сонголт 4.
1-р хэсэг
2-р хэсэг
Сонголт 5.
1-р хэсэг
2-р хэсэг
Сонголт 6.
1-р хэсэг
2-р хэсэг
Сонголт 7.
1-р хэсэг
2-р хэсэг
Сонголт 8.
1-р хэсэг
2-р хэсэг
Сонголт 9.
1-р хэсэг
2-р хэсэг
Сонголт 10.
1-р хэсэг
2-р хэсэг
Хариултууд ба шийдлүүд
1-р хэсгийн даалгаврын хариулт
2-р хэсгийн даалгавруудын дагуу шийдэл, хариултууд
Сонголтын 10-ийн даалгаврыг шийдвэрлэх
1-р хэсэг
2-р хэсэг.
Үнэгүй татах ц задуу ном Тохиромжтой форматаар үзэх, үзэх, унших:
Book eee 2017, Хими, Хими, ердийн туршилт, Mededevev yu.n. - Fileskkachat.com, хурдан, үнэгүй татаж авах.
хэмжих материалыг хянах
2017 онд нэг улсын шалгалтанд хамрагдахын тулд
химийн