លក្ខណៈដើមកំណើតនៃប្រូតេអ៊ីនត្រូវបានកំណត់ដោយរចនាសម្ព័ន្ធរបស់វា។ រចនាសម្ព័ន្ធទីបី។ មូលដ្ឋានទ្រឹស្តីនៃមេរៀន
អត្ថិភាពនៃរចនាសម្ព័ន្ធ ៤ កម្រិតនៃម៉ូលេគុលប្រូតេអ៊ីនត្រូវបានបង្ហាញឱ្យឃើញ។
រចនាសម្ព័ន្ធប្រូតេអ៊ីនបឋម- លំដាប់នៃទីតាំងនៃសំណល់អាស៊ីតអាមីណូនៅក្នុងខ្សែសង្វាក់ប៉ូលីភីបទីត នៅក្នុងប្រូតេអ៊ីនអាស៊ីតអាមីណូនីមួយៗមានទំនាក់ទំនងគ្នាទៅវិញទៅមក ចំណង peptideកើតឡើងពីអន្តរកម្មនៃក្រុមអា-ខាបូស៊ីលនិងអា-អាមីណូនៃអាស៊ីដអាមីណូ
មកដល់ពេលនេះរចនាសម្ព័ន្ធបឋមនៃប្រូតេអ៊ីនផ្សេងៗគ្នារាប់ម៉ឺនត្រូវបានបកស្រាយ។ ដើម្បីកំណត់រចនាសម្ព័ន្ធបឋមនៃប្រូតេអ៊ីនសមាសភាពអាស៊ីតអាមីណូត្រូវបានកំណត់ដោយវិធីសាស្ត្រអ៊ីដ្រូលីស្យូស។ បន្ទាប់មកធម្មជាតិគីមីនៃអាស៊ីតអាមីណូស្ថានីយត្រូវបានកំណត់។ ជំហានបន្ទាប់គឺកំណត់លំដាប់អាស៊ីដអាមីណូនៅក្នុងសង្វាក់ប៉ូលីភីភីត ចំពោះបញ្ហានេះការប្រើអ៊ីដ្រូលីស្យូមដែលជ្រើសរើសដោយផ្នែក (គីមីនិងអង់ស៊ីម) ត្រូវបានប្រើ។ វាអាចប្រើការវិភាគរចនាសម្ព័ន្ធកាំរស្មីអ៊ិចក៏ដូចជាទិន្នន័យស្តីពីលំដាប់នុយក្លេអូទីតបំពេញបន្ថែមនៃ DNA ។
រចនាសម្ព័ន្ធប្រូតេអ៊ីនបន្ទាប់បន្សំការកំណត់រចនាសម្ព័ន្ធខ្សែសង្វាក់ polypeptide ពោលគឺឧ។ វិធីសាស្រ្តនៃការវេចខ្ចប់ខ្សែសង្វាក់ polypeptide ទៅក្នុងរចនាសម្ព័ន្ធជាក់លាក់។ ដំណើរការនេះមិនដំណើរការវឹកវរទេប៉ុន្តែស្របតាមកម្មវិធីដែលបានកំណត់នៅក្នុងរចនាសម្ព័ន្ធបឋម។
ស្ថេរភាពនៃរចនាសម្ព័ន្ធបន្ទាប់បន្សំត្រូវបានផ្តល់ជូនជាចម្បងដោយចំណងអ៊ីដ្រូសែនទោះយ៉ាងណាការរួមចំណែកជាក់លាក់មួយត្រូវបានធ្វើឡើងដោយចំណង covalent - peptide និង disulfide ។
ប្រភេទរចនាសម្ព័នដែលអាចធ្វើទៅបានបំផុតនៃប្រូតេអ៊ីនរាងពងក្រពើត្រូវបានគេពិចារណា a-helix... ការបង្វិលខ្សែសង្វាក់ប៉ូលីភីភីតកើតឡើងតាមទ្រនិចនាឡិកា។ ប្រូតេអ៊ីននីមួយៗត្រូវបានកំណត់ដោយកម្រិតជាក់លាក់មួយនៃការតំរៀបស្លឹក។ ប្រសិនបើសង្វាក់អេម៉ូក្លូប៊ីនត្រូវបានតំរៀបស្លឹក ៧៥%នោះប៉េបស៊ីនមានត្រឹមតែ ៣០%ប៉ុណ្ណោះ។
ប្រភេទនៃការកំណត់រចនាសម្ព័ន្ធនៃខ្សែសង្វាក់ polypeptide ដែលមាននៅក្នុងប្រូតេអ៊ីនសក់សូត្រសាច់ដុំត្រូវបានគេហៅថា ខ-រចនាសម្ព័ន្ធ... ផ្នែកនៃខ្សែសង្វាក់ peptide ត្រូវបានរៀបចំនៅក្នុងស្រទាប់មួយបង្កើតជាតួលេខស្រដៀងទៅនឹងស្លឹកឈើដែលបត់នៅអាដហុក។ ស្រទាប់អាចត្រូវបានបង្កើតឡើងដោយពីរឬ ចំនួនធំខ្សែសង្វាក់ peptide ។
នៅក្នុងធម្មជាតិមានប្រូតេអ៊ីនដែលរចនាសម្ព័ន្ធរបស់វាមិនត្រូវគ្នានឹងរចនាសម្ព័ន្ធβឬរចនាសម្ព័ន្ធឧទាហរណ៍កូឡាជែនដែលជាប្រូតេអ៊ីន fibrillar ដែលបង្កើតបានភាគច្រើននៃជាលិកាភ្ជាប់នៅក្នុងមនុស្សនិងសត្វ។
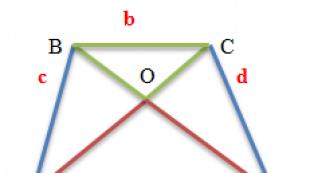
រចនាសម្ព័ន្ធប្រូតេអ៊ីនទីបី- ការតំរង់ទិសលំហនៃអេលីបប៉ូប៉ីតទីដឬវិធីនៃការបត់ខ្សែសង្វាក់ប៉ូលីភីតទីតក្នុងបរិមាណជាក់លាក់មួយ។ ប្រូតេអ៊ីនដំបូងដែលជារចនាសម្ព័ន្ធទីបីដែលត្រូវបានបកស្រាយដោយការវិភាគរចនាសម្ព័ន្ធកាំរស្មីអ៊ិចគឺមេក្លូប៊ីនត្រីបាឡែនមេជីវិតឈ្មោល (រូបភាព ២) ។
នៅក្នុងស្ថេរភាពនៃរចនាសម្ព័នលំហអាកាសនៃប្រូតេអ៊ីនបន្ថែមពីលើចំណង covalent តួនាទីសំខាន់ត្រូវបានលេងដោយមូលបត្រមិនមែនកូវែល (អ៊ីដ្រូសែនអន្តរកម្មអេឡិចត្រូលីតនៃក្រុមដែលមានបន្ទុកកម្លាំងអន្តរវ៉ាលែនវ៉ាលវ៉ាលអន្តរកម្មអ៊ីដ្រូហ្វីប។ ល។ )
យោងតាមគំនិតទំនើបរចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីនបន្ទាប់ពីការបញ្ចប់នៃការសំយោគរបស់វាត្រូវបានបង្កើតឡើងដោយឯកឯង។ មូលដ្ឋាន កម្លាំងជំរុញអន្តរកម្មនៃរ៉ាឌីកាល់អាស៊ីតអាមីណូជាមួយម៉ូលេគុលទឹក។ ក្នុងករណីនេះរ៉ាឌីកាល់អាស៊ីតអាមីណូដែលមិនមែនជាប៉ូលត្រូវបានជ្រមុជនៅក្នុងម៉ូលេគុលប្រូតេអ៊ីនហើយរ៉ាឌីកាល់ប៉ូលត្រូវបានតម្រង់ឆ្ពោះទៅរកទឹក។ ដំណើរការនៃការបង្កើតរចនាសម្ពន្ធ័លំហអាកាសដើមនៃខ្សែសង្វាក់ប៉ូលីភីប៉ីតត្រូវបានគេហៅថា ផ្នត់... ប្រូតេអ៊ីនត្រូវបានញែកចេញពីកោសិកាដែលគេហៅថា អ្នករួមភេទ។ពួកគេចូលរួមក្នុងការបត់។ ជំងឺតំណពូជមួយចំនួនត្រូវបានពិពណ៌នាដែលការវិវត្តនៃជំងឺនេះត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងការរំលោភបំពានដោយសារតែការផ្លាស់ប្តូរនៅក្នុងដំណើរការបត់ (សារធាតុពណ៌, ជំងឺ fibrosis ជាដើម) ។
អត្ថិភាពនៃកម្រិតនៃរចនាសម្ព័ន្ធរចនាសម្ព័ន្ធនៃម៉ូលេគុលប្រូតេអ៊ីនកម្រិតមធ្យមរវាងរចនាសម្ព័ន្ធអនុវិទ្យាល័យនិងអនុវិទ្យាល័យត្រូវបានបង្ហាញដោយវិធីសាស្រ្តនៃការវិភាគភាពខុសគ្នានៃកាំរស្មីអ៊ិច។ ដែនគឺជារាងមូលតូចចង្អៀត អង្គភាពរចនាសម្ព័ន្ធនៅខាងក្នុងខ្សែសង្វាក់ polypeptide (រូបភាពទី ៣) ។ ប្រូតេអ៊ីនជាច្រើន (ឧទាហរណ៍អេនម៉ូក្លូប៊ីលីន) ត្រូវបានគេរកឃើញដែលមានដែននៃរចនាសម្ព័ន្ធនិងមុខងារផ្សេងៗគ្នាដែលត្រូវបានអ៊ិនកូដដោយហ្សែនផ្សេងៗគ្នា។
លក្ខណៈជីវសាស្ត្រទាំងអស់នៃប្រូតេអ៊ីនត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងការអភិរក្សរចនាសម្ព័ន្ធទីបីរបស់វាដែលត្រូវបានគេហៅថា ជនជាតិដើម... ប្រូតេអ៊ីនប្រូតេអ៊ីនមិនមែនជារចនាសម្ព័ន្ធតឹងរឹងទេ៖ ចលនាបញ្ច្រាសនៃផ្នែកនៃខ្សែសង្វាក់ peptide គឺអាចធ្វើទៅបាន។ ការផ្លាស់ប្តូរទាំងនេះមិនរំលោភលើការបង្កើតរួមនៃម៉ូលេគុលទេ។ ការបង្កើតម៉ូលេគុលប្រូតេអ៊ីនត្រូវបានជះឥទ្ធិពលដោយ pH នៃឧបករណ៍ផ្ទុកកម្លាំងអ៊ីយ៉ុងនៃដំណោះស្រាយនិងអន្តរកម្មជាមួយសារធាតុផ្សេងទៀត។ ឥទ្ធិពលណាមួយដែលនាំឱ្យមានការរំលោភលើការបង្កើតជនជាតិដើមនៃម៉ូលេគុលត្រូវបានអមដោយការបាត់បង់ផ្នែកខ្លះឬពេញលេញនៃលក្ខណៈជីវសាស្ត្ររបស់ប្រូតេអ៊ីន។
រចនាសម្ព័ន្ធប្រូតេអ៊ីន Quaternary- វិធីសាស្រ្តនៃការបញ្ឈប់ខ្សែសង្វាក់ប៉ូលីភីប៉ីតនីមួយៗដែលមានរចនាសម្ព័ន្ធបឋមអនុវិទ្យាល័យឬទីបីដូចគ្នាឬខុសគ្នានិងការបង្កើតម៉ូលេគុលម៉ូលេគុលតែមួយនៅក្នុងលក្ខខណ្ឌរចនាសម្ព័ន្ធនិងមុខងារ។
ម៉ូលេគុលប្រូតេអ៊ីនដែលមានខ្សែសង្វាក់ប៉ូលីភីតប៉ីដជាច្រើនត្រូវបានគេហៅថា អូលីហ្គោមឺរហើយខ្សែសង្វាក់នីមួយៗរួមបញ្ចូលនៅក្នុងវា - ប្រូតូម៉ែត្រ... ប្រូតេអ៊ីន Oligomeric ជារឿយៗត្រូវបានបង្កើតឡើងពីចំនួនប្រូតូមេមឧទាហរណ៍ម៉ូលេគុលអេម៉ូក្លូប៊ីនមានខ្សែសង្វាក់អេ- និងប៊ី- ប៉ូលីភីតទីបចំនួន ២ (រូបភាព ៤) ។
ប្រហែល ៥% នៃប្រូតេអ៊ីនរួមទាំងអេម៉ូក្លូប៊ីននិងអេម៉ូក្លូប៊ីនបូលីនមានរចនាសម្ព័ន្ធត្រីមាស។ រចនាសម្ព័ន្ធរងគឺជាលក្ខណៈនៃអង់ស៊ីមជាច្រើន។
ម៉ូលេគុលប្រូតេអ៊ីនដែលបង្កើតជាប្រូតេអ៊ីនដែលមានរចនាសម្ព័នត្រីមាសត្រូវបានបង្កើតឡើងនៅលើរីបូស្យូមដាច់ដោយឡែកពីគ្នាហើយមានតែបន្ទាប់ពីការបញ្ចប់នៃការសំយោគបង្កើតបានជារចនាសម្ព័នស៊ុលប្រូមូលេគុលធម្មតា។ ប្រូតេអ៊ីនទទួលបានសកម្មភាពជីវសាស្រ្តតែនៅពេលប្រូតូមេនដែលជាធាតុផ្សំរបស់វាបញ្ចូលគ្នា។ ប្រភេទដូចគ្នានៃអន្តរកម្មត្រូវបានចូលរួមនៅក្នុងស្ថេរភាពនៃរចនាសម្ព័ន្ធត្រីមាសដូចនៅក្នុងស្ថេរភាពនៃទីបី។
អ្នកស្រាវជ្រាវខ្លះទទួលស្គាល់ពីអត្ថិភាពនៃរចនាសម្ព័ន្ធរចនាសម្ព័ន្ធកម្រិតទី ៥ នៃប្រូតេអ៊ីន។ វា មេតាប៉ូលីស -ស្មុគស្មាញម៉ូលេគុលម៉ូលេគុលពហុមុខងារនៃអង់ស៊ីមផ្សេងៗដែលជំរុញផ្លូវទាំងមូលនៃការផ្លាស់ប្តូរស្រទាប់ខាងក្រោម (សំយោគអាស៊ីតខ្លាញ់ខ្ពស់ភីរ៉ូវ៉ាតឌីអ៊ីដ្រូហ្សែនស្មុគ្រស្មាញខ្សែសង្វាក់ផ្លូវដង្ហើម) ។
ចំណង peptide កំណត់ឆ្អឹងខ្នង (ឆ្អឹងជំនី) នៃរចនាសម្ព័ន្ធបឋមនៃម៉ូលេគុលប្រូតេអ៊ីននិងផ្តល់ឱ្យវានូវភាពរឹង។
មូលដ្ឋានទ្រឹស្តីនៃមេរៀន
រចនាសម្ព័ន្ធម៉ូលេគុលប្រូតេអ៊ីន
គោលបំណងនៃមេរៀន៖ដើម្បីសិក្សាពីប្រភេទនៃការរៀបចំម៉ាក្រូម៉ូលេគុលនៃម៉ូលេគុលប្រូតេអ៊ីន។
រចនាសម្ព័ន្ធចម្បងនៃប្រូតេអ៊ីន- លំដាប់នៃអាស៊ីដអាមីណូនៅក្នុងខ្សែសង្វាក់ប៉ូលីភីតទីដ (ឬច្រវ៉ាក់) និងទីតាំងនៃចំណងឌីអុកស៊ីត (ប្រសិនបើមាន) ។
រចនាសម្ព័នចម្បងត្រូវបានធ្វើឱ្យមានស្ថេរភាពដោយចំណង covalent: peptide និងនៅក្នុង peptides មួយចំនួននិង disulfide ។
ការបំផ្លាញចំណង covalent នៃរចនាសម្ព័ន្ធបឋម - អ៊ីដ្រូលីកលីសៈ ១) អាស៊ីត - ក្នុង ៦ អិន។ HCl, ១០០-១១០ ០ С, ២៤ ម៉ោង; 2) អង់ស៊ីម - ដោយមានជំនួយពីអង់ស៊ីម proteolytic នៅក្នុងក្រពះនៅ pH 1.5-5.0 - pepsin; trypsin, chymotrypsin, carboxypeptidases - នៅក្នុង duodenum; dipeptidases, tripeptidases និង aminopeptidases - នៅក្នុងពោះវៀនតូចនៅ pH ៨.៦ ។
លក្ខណៈនៃចំណង peptide... ចំណង peptide គឺរាបស្មើ (coplanar) ។ មូលបត្របំណុលស៊ី-អិនប្រហាក់ប្រហែលនឹងចំណងទ្វេ (ការបង្វិលមិនអាចទៅរួចទេ) ដោយសារតែភី, π - ការភ្ជាប់គ្នា (ការផ្សំអេឡិចត្រុងឥតគិតថ្លៃពីរគូជាមួយអាតូមអេឡិចត្រុងនៃចំណងទ្វេរ C = O) ។
លំដាប់នៃអាស៊ីដអាមីណូនៅក្នុងរចនាសម្ព័ន្ធបឋមនៃប្រូតេអ៊ីនគឺ លក្ខណៈពិសេសនៃប្រភេទប្រូតេអ៊ីន។
រចនាសម្ព័ន្ធចម្បងនៃប្រូតេអ៊ីន កំណត់ហ្សែននិងបង្កើតឡើងវិញនៅក្នុងដំណើរការចម្លងនិងបកប្រែ។
រចនាសម្ព័ន្ធចម្បងនៃប្រូតេអ៊ីនគឺ មូលដ្ឋានសម្រាប់ការបង្កើតរចនាសម្ព័ន្ធប្រូតេអ៊ីនជាបន្តបន្ទាប់ដោយសារតែអន្តរកម្មនៃរ៉ាឌីកាល់នៃសំណល់អាស៊ីតអាមីណូនៃខ្សែសង្វាក់ប៉ូលីភីប៉ីត
ការជំនួសអាស៊ីដអាមីណូស៊េរី L ជាមួយអាស៊ីដអាមីណូស៊េរី D ឬការជំនួសអាស៊ីដអាមីណូអាមេរិចមួយទៅមួយទៀតអាចនាំឱ្យបាត់ខ្លួនទាំងស្រុង សកម្មភាពជីវសាស្រ្ត peptide ។
peptides សកម្មខាងសរីរវិទ្យាមានសំណល់អាស៊ីតអាមីណូពី ៣ ទៅ ១០០ (មេហ្គាវ៉ាត់ក្រោម ៦០០០ ដា) មិនដូចប្រូតេអ៊ីនទេ polypeptides អាចមានអាស៊ីតអាមីណូដែលមិនមានប្រូតេអ៊ីនឬប្រូតេអ៊ីនដែលបានកែប្រែ។ ឧទាហរណ៍:
១. Bradykinin និង kallidin បណ្តាលឱ្យសាច់ដុំរលោងនិងជាផលិតផលនៃការបង្កើតប្រូតូលីស្យូសជាក់លាក់ -globulins ជាក់លាក់នៅក្នុងប្លាស្មាហេតុដូច្នេះ peptides ទាំងនេះមានផ្ទុកតែអាស៊ីតអាមីណូប្រូតេអ៊ីនប៉ុណ្ណោះ៖
ប្រេឌីគីនីន៖ អាហ្គ-ប្រូ-ប្រូ-ប្រូ-ហ្គីល-ភេន-សេ-ប្រូ-ភីន-អាក
ខាលីដិន៖ លីហ្ស-អាក-ប្រូ-ប្រូ-ហ្គី-ហ្វេន-សេ-ប្រូ-ហ្វេន-អាក។
2. Glutathione (γ-glu-cis-gly) មាននៅក្នុងកោសិកាទាំងអស់។ វាចាំបាច់សម្រាប់ការដឹកជញ្ជូនអាស៊ីដអាមីណូឆ្លងកាត់ភ្នាសសម្រាប់ការងាររបស់អង់ស៊ីមមួយចំនួន។ រក្សាចំណង disulfide មានចំណង peptide atypical នៅពេល glutamate ត្រូវបានភ្ជាប់ទៅនឹង cysteine មិនឆ្លងកាត់ក្រុមα-amino ។
ពហុប្រូតេអ៊ីននេះគឺជាអត្ថិភាពនៃប្រូតេអ៊ីនដូចគ្នានៅក្នុងទំរង់ម៉ូលេគុលជាច្រើនដែលខុសគ្នានៅក្នុងរចនាសម្ព័ន្ធបឋមរាងកាយ លក្ខណៈគីមីនិងការបង្ហាញពីសកម្មភាពជីវសាស្ត្រ។
មូលហេតុនៃភាពពហុប្រូតេអ៊ីនគឺការបង្កើតហ្សែនឡើងវិញនិងការផ្លាស់ប្តូរហ្សែន។ Isoproteins គឺជាទម្រង់ម៉ូលេគុលជាច្រើននៃប្រូតេអ៊ីនដែលមាននៅក្នុងសារពាង្គកាយតែមួយ ប្រភេទជីវសាស្ត្រជាលទ្ធផលនៃវត្តមានហ្សែនរចនាសម្ព័ន្ធច្រើនជាងមួយនៅក្នុងអាងហ្សែននៃប្រភេទសត្វមួយ។ ហ្សែនច្រើនអាចត្រូវបានតំណាងជាអាឡែលច្រើនឬហ្សែនពហុហ្សែន។
ឧទាហរណ៍នៃភាពពហុប្រូតេអ៊ីន។
1. ពហុប្រូតេអ៊ីននៅក្នុង phylogenesis - អត្ថិភាពនៃប្រូតេអ៊ីនដូចគ្នានៅក្នុងប្រភេទផ្សេងគ្នា។ នៅក្នុងប្រូតេអ៊ីនទាំងនេះតំបន់នៃរចនាសម្ព័ន្ធបឋមដែលទទួលខុសត្រូវចំពោះមុខងាររបស់វានៅតែរក្សាដដែល (មិនផ្លាស់ប្តូរ) ។ ដើម្បីជំនួសប្រូតេអ៊ីនដែលបាត់បង់នៅក្នុងខ្លួនមនុស្សប្រូតេអ៊ីនដែលមានលក្ខណៈដូចគ្នានៃសត្វត្រូវបានគេប្រើនៅក្នុងរចនាសម្ព័ន្ធបឋមដែលមានភាពខុសគ្នាតិចតួច (អាំងស៊ុយលីនពីសត្វគោជ្រូកត្រីបាឡែនមេជីវិតឈ្មោល) ។
2. ភាពខុសគ្នានៃប្រូតេអ៊ីននៅក្នុង ontogenesis - អត្ថិភាពនៃប្រូតេអ៊ីនដូចគ្នានៅក្នុងផ្នែកផ្សេងៗនៃវដ្តជីវិតនៃសារពាង្គកាយមួយ។ ទារកមានអេម៉ូក្លូប៊ីនអេហ្វ (អេម៉ូក្លូប៊ីនរបស់ទារកα ២ γ ២ មានទំនាក់ទំនងអុកស៊ីសែនខ្ពស់) ។ បន្ទាប់ពីកំណើតវាត្រូវបានជំនួសដោយអេម៉ូក្លូប៊ីន A1 (a 2 b 2) ។
3. ជាលិកាពហុប្រូតេអ៊ីននៃប្រូតេអ៊ីន។ អង់ហ្ស៊ីមដូចគ្នានៅក្នុងកោសិកាផ្សេងគ្នាធ្វើឱ្យមានប្រតិកម្មដូចគ្នាប៉ុន្តែមានភាពខុសគ្នានៅក្នុងរចនាសម្ព័ន្ធបឋមគឺអ៊ីសូហ្សីម។ ការកំណត់អ៊ីសូហ្សីមក្នុងឈាមជួយធ្វើរោគវិនិច្ឆ័យការខូចខាតជាលិកាជាក់លាក់។
4. ពហុប្រូតេអ៊ីននៅក្នុងរោគវិទ្យា។ សូមពិចារណាឧទាហរណ៍នៃទម្រង់ជាច្រើននៃការផ្លាស់ប្តូរតំណពូជ។ ក្នុងករណីនេះការជំនួសអាស៊ីតអាមីណូអាសុីតដែលមានមូលដ្ឋានឬអព្យាក្រឹតកើតឡើងញឹកញាប់បំផុត៖
នៅក្នុងអេសប៊ីស៊ីការជំនួស glu 6 នៅក្នុងខ្សែសង្វាក់ with ជាមួយ lysis;
នៅក្នុង HbE ការជំនួស Glu 26 នៅក្នុងសង្វាក់ by ដោយ lysis;
នៅក្នុងអេប៊ីប៊ីការជំនួសលីស ១៦ នៅក្នុងខ្សែសង្វាក់ with ជាមួយអេស។
នៅក្នុងអេសប៊ីអេសការជំនួសហ្គូល ៦ នៅក្នុងខ្សែសង្វាក់ by ដោយអ័ក្ស។
ក្នុងករណីចុងក្រោយជំងឺដូចជាភាពស្លកសាំងកោសិកាស្លសកើតឡើង។ អេម៉ូក្លូប៊ីនខុសពីធម្មតាខុសពីធម្មតាក្នុងចំនួននៃការគិតថ្លៃនិងការចល័តអេឡិចត្រូលីត។ ការផ្លាស់ប្តូរគីមីសាស្ត្រក្នុងអេម៉ូក្លូប៊ីនត្រូវបានអមដោយការដឹកជញ្ជូនអុកស៊ីសែនខ្សោយ។
រចនាសម្ព័ន្ធប្រូតេអ៊ីនបន្ទាប់បន្សំ- ការរៀបចំជាទៀងទាត់នៃខ្សែសង្វាក់ polypeptide ដែលមានស្ថេរភាពដោយចំណងអ៊ីដ្រូសែន មូលបត្របំណុលអ៊ីដ្រូសែនត្រូវបានបង្កើតឡើងរវាងក្រុម NH និង CO នៃចំណង peptide ។ បែងចែករវាង a-helix, b-structure និង disordered conform (coil) ។
អេ-វង់។ ការបង្វិលខ្សែសង្វាក់ polypeptide គឺតាមទ្រនិចនាឡិកា (វង់ខាងស្តាំ) ដែលបណ្តាលមកពីរចនាសម្ព័ន្ធអាស៊ីដអាមីណូ។ មានសំណល់អាស៊ីតអាមីណូចំនួន ៣.៦ សម្រាប់វេននីមួយៗនៃជំហាននីមួយៗ។ ជម្រាល helix គឺ ០.៥៤ nm ដែលមាន ០.១៥ nm ក្នុងមួយសំណល់អាស៊ីតអាមីណូ។ មុំឡើងនៃវង់គឺ ២៦០ ។ រៀងរាល់ ៥ វេននៃ helix (សំណល់អាស៊ីតអាមីណូចំនួន ១៨) រចនាសម្ព័ននៃខ្សែសង្វាក់ polypeptide ត្រូវបានធ្វើម្តងទៀត។ ចំណងអ៊ីដ្រូសែនគឺស្របទៅនឹងអ័ក្ស helix ហើយកើតឡើងរវាងសំណល់អាស៊ីដអាមីណូទី ១ និងទី ៥ នីមួយៗ។ ការបង្កើតអេ-ហេលត្រូវបានរារាំងដោយប្រូលីននិងអាស៊ីតអាមីណូជាមួយនឹងរ៉ាឌីកាល់សំពីងសំពោងនិងបន្ទុក។
-រចនាសម្ព័ន្ធ។ នៅក្នុងប្រូតេអ៊ីន fibrillar ខ្សែសង្វាក់ polypeptide លីនេអ៊ែរពីរឬច្រើនត្រូវបានចងភ្ជាប់យ៉ាងតឹងរ៉ឹងដោយចំណងអ៊ីដ្រូសែនកាត់កែងទៅអ័ក្សម៉ូលេគុល (បត់ស្រទាប់ខ) ។ ប្រសិនបើខ្សែសង្វាក់ polypeptide ពីរដែលរត់ក្នុងទិសដៅដូចគ្នាពី N- ទៅ C-terminus ត្រូវបានតភ្ជាប់ដោយចំណងអ៊ីដ្រូសែន interchain នោះនេះគឺជារចនាសម្ព័ន្ធប៉ារ៉ាឡែលប៉ារ៉ាឡែល។ ប្រសិនបើចុង N និង C នៃច្រវាក់ផ្ទុយគ្នានោះនេះគឺជារចនាសម្ព័ន្ធខ ប្រសិនបើខ្សែសង្វាក់ polypeptide មួយពត់ហើយដំណើរការស្របទៅនឹងខ្លួនវានោះនេះគឺជារចនាសម្ព័ន្ធប្រឆាំងនឹងប៉ារ៉ាឡែល ចំណុចពត់នៃសង្វាក់ត្រូវបានកំណត់ដោយប្រូ, ហ្គី, អេន-ប៊ី-ពត់។
ការមិនចុះសម្រុងគ្នា។ តំបន់នៃម៉ូលេគុលប្រូតេអ៊ីនដែលមិនមែនជាកម្មសិទ្ធិរបស់រចនាសម្ព័ន្ធ helical ឬបត់ត្រូវបានគេហៅថាមិនប្រក្រតី។ នៅក្នុងការបង្ហាញក្រាហ្វិកផ្នែកវង់ត្រូវបានបង្ហាញជាស៊ីឡាំងនិងរចនាសម្ព័ន្ធបត់ - ដោយព្រួញ។ គំនិតនៃរចនាសម្ព័នអនុវិទ្យាល័យត្រូវបានសម្គាល់ដែលជាការជំនួសជាទៀងទាត់នៃផ្នែកអេលីយ៉ូមនិងរចនាសម្ព័ន្ធខ។
រចនាសម្ព័ន្ធទីបី- ការបង្កើតសង្វាក់ប៉ូលីភីភីតទាំងមូល (ឧទាហរណ៍ទីតាំងនៅក្នុងលំហបីវិមាត្រ) ។ រចនាសម្ព័នទីបីត្រូវបានធ្វើឱ្យមានស្ថិរភាពដោយចំណងនិងអន្តរកម្មរវាងរ៉ាឌីកាល់នៃសំណល់អាស៊ីតអាមីណូនៃខ្សែសង្វាក់ប៉ូលីភីតទីតៈ covalent - ចំណង disulfide ក៏ដូចជាអ៊ីដ្រូសែនចំណងអ៊ីយ៉ុងនិងអន្តរកម្មអ៊ីដ្រូហ្វីប។ ប្រភេទប្រូតេអ៊ីនដែលមានរចនាសម្ព័ន្ធទីបី៖
ប្រូតេអ៊ីនដែលត្រូវបានគ្របដណ្តប់ដោយតំបន់អេលីលីកមានទំរង់ globules (ប្រូតេអ៊ីនរាងជារង្វង់) និងដំណើរការ មុខងារថាមវន្ត;
ប្រូតេអ៊ីនដែលរចនាសម្ព័ន្ធនៃស្រទាប់ខដែលមានរាងមូលមានរាងជាសរសៃ (ប្រូតេអ៊ីនសរសៃ) និងបំពេញមុខងាររចនាសម្ព័ន្ធ។
កូឡាជែនគឺជាប្រូតេអ៊ីនដែលមានច្រើនបំផុតនៅក្នុងពិភពសត្វ (រហូតដល់ ២៥% នៃប្រូតេអ៊ីនរាងកាយទាំងអស់) មានរចនាសម្ព័ន្ធពិសេស។ ម៉ូលេគុល collagen (tropocollagen) ត្រូវបានបង្កើតឡើងដោយខ្សែសង្វាក់ polypeptide ចំនួនបី។ ខ្សែសង្វាក់ប៉ូលីភីតទីតនីមួយៗមានសំណល់អាស៊ីតអាមីណូប្រហែល ១០០០ (គ្លីសេរីន ៣៥%, ប្រូលីន ២១% និងអ៊ីដ្រូហ្សីប្រូលីន ១១% អាឡានីន) ។ ខ្សែសង្វាក់ polypeptide នីមួយៗមានរចនាសម្ព័ន្ធរាងស្វ៊ែរតឹង (សំណល់អាស៊ីតអាមីណូ ៣ ក្នុងមួយវេន) ។ នៅក្នុងម៉ូលេគុល tropocollagen ជំនួយទាំងបីត្រូវបានទាក់ទងគ្នាបង្កើតជាបាច់។ មូលបត្របំណុលអ៊ីដ្រូសែនត្រូវបានបង្កើតឡើងរវាងអេលីសដោយសារតែក្រុម peptide ។ រចនាសម្ព័ន្ធនេះផ្តល់នូវភាពរឹងមាំនៃសរសៃ collagen ។
រចនាសម្ព័ន្ធប្រូតេអ៊ីនដើមកំណើត។
ប្រូតេអ៊ីនជាច្រើននៅក្នុងរចនាសម្ព័នទីបីបានបង្កើតជាផ្នែកដែលបត់បែនបត់និងមិនមានសណ្តាប់ធ្នាប់។ ទន្ទឹមនឹងនេះនៅក្នុងលក្ខខណ្ឌមុខងារនិងរចនាសម្ព័ន្ធវាមានសារៈសំខាន់ ការរៀបចំទៅវិញទៅមករ៉ាឌីកាល់អាស៊ីតអាមីណូ ពាក្យខាងក្រោមត្រូវបានប្រើ៖
ដែន – តំបន់ដែលសម្គាល់ដោយកាយវិភាគសាស្ត្រនៃរចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីនដែលទទួលខុសត្រូវចំពោះដំណើរការមុខងារជាក់លាក់នៃប្រូតេអ៊ីន;
ហោប៉ៅអ៊ីដ្រូហ្វីប – បែហោងធ្មែញនៅក្នុងរចនាសម្ព័ន្ធទីបីដែលមានជួរជាមួយរ៉ាឌីកាល់នៃអាស៊ីដអាមីណូអ៊ីដ្រូហ្វីប បម្រើឱ្យជ្រមុជលីហ្គីនអ៊ីដ្រូហ្វីបក្នុងម៉ូលេគុលប្រូតេអ៊ីន។
ចង្កោម hydrophobic – តំបន់នៃផ្ទៃប្រូតេអ៊ីនដែលរ៉ាឌីកាល់នៃអាស៊ីតអាមីណូ hydrophobic ត្រូវបានប្រមូលផ្តុំ។ បម្រើដើម្បីធ្វើអន្តរកម្មជាមួយចង្កោមអ៊ីដ្រូហ្វីបនៃម៉ូលេគុលផ្សេងទៀត។
ដើម្បីបំពេញមុខងារមួយប្រូតេអ៊ីនត្រូវតែមានរចនាសម្ព័ន្ធជាក់លាក់និងជាញឹកញាប់ (រចនាសម្ព័ន្ធ) - រចនាសម្ព័ន្ធដើម។
វាបណ្តាលមកពីអន្តរកម្មនៃសំណល់អាស៊ីតអាមីណូដែលនៅឆ្ងាយពីគ្នាក្នុងលំដាប់លីនេអ៊ែរ។ កត្តាថែទាំ៖
មូលបត្របំណុលអ៊ីដ្រូសែន
អន្តរកម្មអ៊ីដ្រូហ្វីប (ត្រូវការសម្រាប់រចនាសម្ព័ន្ធនិងមុខងារជីវសាស្ត្រនៃប្រូតេអ៊ីន)
ស្ពាន disulfide និងអំបិល
មូលបត្របំណុលអ៊ីយ៉ុងនិងវ៉ានឌឺវ៉ាល
នៅក្នុងប្រូតេអ៊ីនភាគច្រើនផ្ទៃម៉ូលេគុលមានសំណល់នៃរ៉ាឌីកាល់អាស៊ីតអាមីណូដែលមានលក្ខណៈសម្បត្តិអ៊ីដ្រូហ្វីលីក។ អេចស៊ី - រ៉ាឌីកាល់ដែលមិនជ្រាបទឹកហើយស្ថិតនៅខាងក្នុងម៉ូលេគុល។ ការបែងចែកនេះមានសារៈសំខាន់ក្នុងការបង្កើតរចនាសម្ព័ន្ធដើមកំណើតនិងលក្ខណៈសម្បត្តិរបស់ប្រូតេអ៊ីន។
ជាលទ្ធផលប្រូតេអ៊ីនមានសំបកផ្តល់ជាតិទឹកហើយស្ថេរភាពនៃរចនាសម្ព័ន្ធទីបីគឺភាគច្រើនដោយសារតែអន្តរកម្មអ៊ីដ្រូហ្វីប។ ឧទាហរណ៍សំណល់អាស៊ីតអាមីណូ ២៥-៣០% នៅក្នុងម៉ូលេគុលគ្លូប៊ូលីនបានបញ្ចេញរ៉ាឌីកាល់អ៊ីដ្រូហ្វីប ៤៥-៥០% មានក្រុមរ៉ាឌីកាល់អ៊ីយ៉ុងនិងប៉ូល។
សង្វាក់ចំហៀងនៃសំណល់អាស៊ីតអាមីណូដែលទទួលខុសត្រូវចំពោះរចនាសម្ព័ន្ធប្រូតេអ៊ីនត្រូវបានសម្គាល់ដោយទំហំរូបរាងបន្ទុកនិងសមត្ថភាពក្នុងការបង្កើតចំណងអ៊ីដ្រូសែនក៏ដូចជាដោយប្រតិកម្មគីមី៖
ខ្សែសង្វាក់ចំហៀង aliphatic ដូចជាវ៉ាលីន, អាឡានីន។ វាគឺជាសំណល់ទាំងនេះដែលបង្កើតអន្តរកម្មអ៊ីដ្រូហ្វីប។
hydroxylated aliphatic (ស៊េរី, threonine) ។ សំណល់អាស៊ីតអាមីណូទាំងនេះត្រូវបានចូលរួមនៅក្នុងការបង្កើតចំណងអ៊ីដ្រូសែនក៏ដូចជាអេស្ត្ររឧទាហរណ៍ជាមួយអាស៊ីតស៊ុលហ្វួរីក។
ក្រអូប - ទាំងនេះគឺជាសំណល់នៃផេននីឡាឡានីន, ធូរ៉ូស៊ីន, ទ្រីប៉ូតូផាន។
សំណល់អាស៊ីតអាមីណូដែលមានលក្ខណៈជាមូលដ្ឋាន (លីសស៊ីន, អាហ្គីននីន, អ៊ីស្តាឌីន) ។ ភាពលេចធ្លោនៃអាស៊ីដអាមីណូបែបនេះនៅក្នុងខ្សែសង្វាក់ប៉ូលីភីបទីតផ្តល់ឱ្យប្រូតេអ៊ីននូវលក្ខណៈសម្បត្តិជាមូលដ្ឋាន។
សំណល់ដែលមានលក្ខណៈអាស៊ីត (អាស៊ីត aspartic និង glutamic)
អាមីដ (អាស្ពីរីនហ្គីតាមីន)
ប្រូតេអ៊ីនដែលមានខ្សែសង្វាក់ polypeptide ជាច្រើនមានរចនាសម្ព័ន្ធត្រីមាស។ នេះសំដៅទៅលើរបៀបដែលខ្សែសង្វាក់ត្រូវបានដាក់ទាក់ទងគ្នាទៅវិញទៅមក។ អង់ស៊ីមទាំងនេះត្រូវបានគេហៅថាអនុ។ បច្ចុប្បន្ននេះវាជាទម្លាប់ក្នុងការប្រើពាក្យ“ ដែន” ដែលបង្ហាញពីឯកតារាងមូលតូចមួយនៃម៉ូលេគុលប្រូតេអ៊ីន។ ប្រូតេអ៊ីនជាច្រើនត្រូវបានផ្សំឡើងដោយឯកតាជាច្រើនដែលមានម៉ាស់ពី ១០ ទៅ ២០ kDa ។ នៅក្នុងប្រូតេអ៊ីនដែលមានទំងន់ម៉ូលេគុលខ្ពស់ដែននីមួយៗត្រូវបានតភ្ជាប់ដោយតំបន់ដែលអាចបត់បែនបាននៃ PCP ។ នៅក្នុងរាងកាយរបស់សត្វនិងមនុស្សមានអង្គការរចនាសម្ព័ន្ធស្មុគស្មាញជាងនេះទៅទៀតដែលជាឧទាហរណ៍ដែលអាចជាប្រព័ន្ធពហុមេហ្សីមជាពិសេសស្មុគស្មាញភីរុវ៉េតដាកាបូលីស។
គំនិតនៃប្រូតេអ៊ីនដើមកំណើត
តាមកំរិត pH និងសីតុណ្ហភាពជាក់លាក់ PCP មានតាមក្បួនតែមួយគត់ដែលត្រូវបានគេហៅថាដើមកំណើតហើយដែលប្រូតេអ៊ីននៅក្នុងរាងកាយបំពេញមុខងារជាក់លាក់របស់វា។ ស្ទើរតែជានិច្ចកាលការតំរែតំរង់តែមួយនេះមានថាមពលលើសពីដប់និងរាប់រយនៃការប្រែប្រួលផ្សេងៗ។
ចំណាត់ថ្នាក់។ លក្ខណៈជីវសាស្ត្រនិងគីមីនៃប្រូតេអ៊ីន
មិនមានការបែងចែកប្រូតេអ៊ីនដែលគួរឱ្យពេញចិត្តនោះទេពួកគេត្រូវបានចាត់ថ្នាក់តាមរចនាសម្ព័នតាមលក្ខណៈលំហភាពរលាយមុខងារជីវសាស្ត្រលក្ខណៈរូបវិទ្យាគីមីនិងលក្ខណៈផ្សេងទៀត។
បើនិយាយពីរចនាសម្ព័ន្ធនិងរូបរាងរបស់ម៉ូលេគុលប្រូតេអ៊ីនត្រូវបានបែងចែកជា៖
រាងមូល (ស្វ៊ែរ)
fibrillar (សរសៃ)
2. សមាសធាតុគីមីត្រូវបានបែងចែកជាៈ
សាមញ្ញ ៗ ដែលមានតែសំណល់អាស៊ីតអាមីណូប៉ុណ្ណោះ
ស្មុគស្មាញមានសមាសធាតុដែលមិនមានប្រូតេអ៊ីននៅក្នុងម៉ូលេគុលរបស់វា។ ការបែងចែកប្រភេទប្រូតេអ៊ីនស្មុគស្មាញគឺផ្អែកលើលក្ខណៈគីមីនៃសមាសធាតុដែលមិនមែនជាប្រូតេអ៊ីន។
មួយក្នុងចំណោមប្រភេទសំខាន់ៗនៃការធ្វើចំណាត់ថ្នាក់៖
យោងតាមមុខងារជីវសាស្រ្តដែលបានអនុវត្ត៖
ការរំលាយអាហារអង់ស៊ីម។ នៅក្នុងប្រព័ន្ធជីវសាស្ត្រប្រតិកម្មគីមីទាំងអស់ត្រូវបានជំរុញដោយប្រូតេអ៊ីនជាក់លាក់អង់ស៊ីម។ ស្គាល់ជាង ២០០០ នាក់
អង់ស៊ីម។ អង់ស៊ីមគឺជាជីវឧស្ម័នដ៏មានឥទ្ធិពលដែលបង្កើនល្បឿនប្រតិកម្មយ៉ាងហោចណាស់ ១ លានដង។
ការប្រមូលនិងការដឹកជញ្ជូន
ការផ្ទេរម៉ូលេគុលតូចៗជាច្រើននិងអ៊ីយ៉ុងផ្សេងៗត្រូវបានអនុវត្តដោយប្រូតេអ៊ីនជាក់លាក់ឧទាហរណ៍អេម៉ូក្លូប៊ីនអេម៉ូក្លូប៊ីនដែលផ្ទុកអុកស៊ីសែន។ ឧទាហរណ៍នៃការប្រមូលផ្តុំ៖ ហ្វ័រីទីនកកកុញនៅក្នុងថ្លើម។
ចលនាសម្របសម្រួល។ ប្រូតេអ៊ីនគឺជាសមាសធាតុសំខាន់នៃសាច់ដុំដែលចុះកិច្ចសន្យា (សរសៃ actin និង myosin) ។ ចលនានៅកម្រិតមីក្រូទស្សន៍គឺការបំបែកក្រូម៉ូសូមក្នុងកំឡុងពេល mitosis ចលនារបស់មេជីវិតឈ្មោលដោយសារតែ flagella ។
ការគាំទ្រមេកានិច ការបត់បែនខ្ពស់នៃស្បែកនិងឆ្អឹងគឺដោយសារតែមានប្រូតេអ៊ីន fibrillar - collagen ។
ការការពារភាពស៊ាំ។ អង់ទីករគឺជាប្រូតេអ៊ីនជាក់លាក់ខ្ពស់ដែលអាចស្គាល់និងភ្ជាប់មេរោគបាក់តេរីនិងកោសិកានៃសារពាង្គកាយដទៃទៀត។
ការបង្កើតនិងការបញ្ជូនកម្លាំងជំរុញ។ ការឆ្លើយតបរបស់កោសិកាប្រសាទទៅនឹងកម្លាំងត្រូវបានសម្របសម្រួលដោយប្រូតេអ៊ីនទទួល
បទបញ្ជានៃកំណើននិងភាពខុសគ្នា។ បទបញ្ជាតឹងរ៉ឹងនៃលំដាប់នៃការបញ្ចេញព័ត៌មានហ្សែនគឺចាំបាច់សម្រាប់ការលូតលាស់នៃភាពខុសគ្នានៃកោសិកា។ នៅពេលណាមួយក្នុងជីវិតរបស់សារពាង្គកាយមានតែផ្នែកតូចមួយនៃហ្សែនរបស់កោសិកាប៉ុណ្ណោះ។ ឧទាហរណ៍នៅក្រោមសកម្មភាពនៃស្មុគស្មាញប្រូតេអ៊ីនជាក់លាក់បណ្តាញណឺរ៉ូនត្រូវបានបង្កើតឡើងនៅក្នុងសារពាង្គកាយខ្ពស់ជាង។
មុខងារផ្សេងទៀតរបស់ peptides និងប្រូតេអ៊ីនរួមមានអរម៉ូន។ បន្ទាប់ពីមនុស្សបានរៀនសំយោគអរម៉ូនប៉េប៉ីដពួកគេបានចាប់ផ្តើមមានសារៈសំខាន់ផ្នែកជីវសាស្ត្រយ៉ាងសំខាន់។ Peptides គឺជាអង់ទីប៊ីយ៉ូទិកផ្សេងៗដូចជាវ៉ាលីណូមីស៊ីនថ្នាំប្រឆាំងមហារីកប្លាស្ទិច។ លើសពីនេះប្រូតេអ៊ីនអនុវត្តមុខងារការពារមេកានិច (សរសៃសក់ keratin ឬភ្នាសរំអិលនៅលើក្រពះពោះវៀនឬបែហោងធ្មែញមាត់) ។
ការបង្ហាញសំខាន់នៃអត្ថិភាពនៃសារពាង្គកាយមានជីវិតណាមួយគឺការបន្តពូជនៃប្រភេទផ្ទាល់ខ្លួនរបស់វា។ នៅទីបំផុតព័ត៌មានតំណពូជគឺជាការសរសេរកូដនៃលំដាប់អាស៊ីដអាមីណូនៃប្រូតេអ៊ីនទាំងអស់នៅក្នុងរាងកាយ។ ជាតិពុលប្រូតេអ៊ីនប៉ះពាល់ដល់សុខភាពមនុស្ស។
ទំងន់ម៉ូលេគុលនៃប្រូតេអ៊ីនត្រូវបានវាស់ជាដាលតុន (ដា) - វាគឺជាឯកតាម៉ាស់ដែលស្ទើរតែស្មើនឹងម៉ាស់អ៊ីដ្រូសែន (១០០០) ។ ពាក្យថាដាល់តុននិងទម្ងន់ម៉ូលេគុលត្រូវបានបញ្ចូលគ្នាទៅវិញទៅមក។ ប្រូតេអ៊ីនភាគច្រើនមានចាប់ពី ១០ ទៅ ១០០.០០០ ។
បាយ។ ៣.៩ ។ រចនាសម្ព័នទីបីនៃ lactoglobulin-ប្រូតេអ៊ីន a / p ធម្មតា (យោងតាម PDB-200I) (Brownlow, S. , Marais Cabral, JH, Cooper, R. , Flower, DR, Yewdall, SJ, Polikarpov, I. , North, អេស៊ី, សាវីយឺ, អិលៈរចនាសម្ព័ន្ធទី ៥ ទំព័រ ៤៨១.១៩៩៧)
រចនាសម្ព័នលំហមិនអាស្រ័យលើប្រវែងនៃខ្សែសង្វាក់ប៉ូលីភីប៉ីតនោះទេប៉ុន្តែអាស្រ័យលើលំដាប់នៃសំណល់អាស៊ីតអាមីណូជាក់លាក់ចំពោះប្រូតេអ៊ីននីមួយៗក៏ដូចជារ៉ាឌីកាល់ចំហៀងលក្ខណៈនៃអាស៊ីដអាមីណូដែលត្រូវគ្នា។ រចនាសម្ពន្ធ័បីវិមាត្រនៃលំហឬការបង្កើតម៉ាក្រូម៉ូលេគុលប្រូតេអ៊ីនត្រូវបានបង្កើតឡើងជាបឋមដោយចំណងអ៊ីដ្រូសែនក៏ដូចជាអន្តរកម្មអ៊ីដ្រូហ្វីបរវាងរ៉ាឌីកាល់ចំហៀងដែលមិនមែនជាប៉ូលនៃអាស៊ីដអាមីណូ។ មូលបត្របំណុលអ៊ីដ្រូសែនដើរតួយ៉ាងសំខាន់ក្នុងការបង្កើតនិងថែរក្សារចនាសម្ព័នលំហនៃប្រូតេអ៊ីនម៉ូលេគុលម៉ូលេគុល។ ចំណងអ៊ីដ្រូសែនត្រូវបានបង្កើតឡើងរវាងអាតូមអេឡិចត្រុងពីរតាមរយៈអ៊ីដ្រូសែនប្រូតុងដែលភ្ជាប់គ្នាជាមួយអាតូមមួយក្នុងចំណោមអាតូមទាំងនេះ។ នៅពេលអេឡិចត្រុងតែមួយនៃអាតូមអ៊ីដ្រូសែនចូលរួមក្នុងការបង្កើតគូអេឡិចត្រុងប្រូតុងត្រូវបានទាក់ទាញដោយអាតូមជិតខាងបង្កើតជាចំណងអ៊ីដ្រូសែន។ តម្រូវការជាមុនសម្រាប់ការបង្កើតចំណងអ៊ីដ្រូសែនគឺវត្តមានអេឡិចត្រុងយ៉ាងហោចណាស់មួយគូពីអាតូមអេឡិចត្រូនិច ចំពោះអន្តរកម្មអ៊ីដ្រូហ្វីបពួកគេកើតឡើងដោយសារទំនាក់ទំនងរវាងរ៉ាឌីកាល់ដែលមិនមែនជាប៉ូលដែលមិនអាចបំបែកចំណងអ៊ីដ្រូសែនរវាងម៉ូលេគុលទឹកដែលត្រូវបានផ្លាស់ទីលំនៅនៅលើផ្ទៃនៃប្រូតេអ៊ីនប្រូតេអ៊ីន។ ដោយសារប្រូតេអ៊ីនត្រូវបានសំយោគក្រុមគីមីដែលមិនមានរាងប៉ូលត្រូវបានប្រមូលនៅខាងក្នុង globule ហើយកោសិកាប៉ូលត្រូវបានផ្លាស់ទីលំនៅនៅលើផ្ទៃរបស់វា។ ដូច្នេះម៉ូលេគុលប្រូតេអ៊ីនអាចមានអព្យាក្រឹត្យគិតថ្លៃវិជ្ជមានឬអវិជ្ជមានអាស្រ័យលើ pH នៃក្រុមសារធាតុរំលាយនិងអ៊ីយ៉ុងនៅក្នុងប្រូតេអ៊ីន។ អន្តរកម្មខ្សោយក៏រួមបញ្ចូលចំណងអ៊ីយ៉ុងនិងអន្តរកម្មវ៉ានឌឺវ៉ាល លើសពីនេះការបង្កើតប្រូតេអ៊ីនត្រូវបានរក្សាដោយ covalent តំណភ្ជាប់អេសអេសបង្កើតឡើងរវាងសំណល់ cysteine ពីរ។ ជាលទ្ធផលនៃអន្តរកម្មអ៊ីដ្រូហ្វីបនិងអ៊ីដ្រូហ្វីលីកម៉ូលេគុលប្រូតេអ៊ីនដោយឯកឯងសន្មតថាការអនុលោមតាមទ្រឹស្តីឌីម៉ូនិកឌីជីថលមួយឬច្រើនហើយប្រសិនបើជាលទ្ធផលនៃឥទ្ធិពលខាងក្រៅណាមួយការផ្លាស់ប្តូរកំណើតត្រូវបានរំខានការស្តារពេញលេញឬស្ទើរតែពេញលេញរបស់វាគឺអាចធ្វើទៅបាន។ នេះត្រូវបានបង្ហាញជាលើកដំបូងដោយខេអេនហ្វីនសិនដោយប្រើប្រូតេអ៊ីនកាបូអ៊ីដ្រាតដែលមានសារធាតុសកម្មជាឧទាហរណ៍។ វាបានបង្ហាញថានៅពេលដែលប៉ះពាល់ទៅនឹងអ៊ីយ៉ូដឬភី-មេរ៉ាផាតូអេតាណុលការផ្លាស់ប្តូររបស់វាហើយជាលទ្ធផលការថយចុះយ៉ាងខ្លាំងនៃសកម្មភាពកាតាលីករ។ ការដកអ៊ុយនាំឱ្យមានការផ្លាស់ប្តូរនៃការបង្កើតប្រូតេអ៊ីនទៅជាស្ថានភាពដើមរបស់វាហើយសកម្មភាពកាតាលីករត្រូវបានស្តារឡើងវិញ។
ដូច្នេះការបង្កើតប្រូតេអ៊ីនគឺជារចនាសម្ព័ន្ធបីវិមាត្រហើយជាលទ្ធផលនៃការបង្កើតរបស់វាអាតូមជាច្រើនដែលមានទីតាំងនៅតំបន់ឆ្ងាយនៃខ្សែសង្វាក់ប៉ូលីភីតទីដចូលទៅជិតគ្នាហើយធ្វើសកម្មភាពជាមួយគ្នាទទួលបាននូវលក្ខណៈថ្មីៗដែលមិនមាននៅក្នុងអាមីណូនីមួយៗ។ អាស៊ីតឬប៉ូលីភីតទីតតូច។ នេះគឺជាអ្វីដែលគេហៅថា រចនាសម្ព័ន្ធទីបីដែលត្រូវបានកំណត់ដោយការតំរង់ទិសនៃខ្សែសង្វាក់ polypeptide នៅក្នុងលំហ (រូបភាព ៣.៩) ។ រចនាសម្ព័នទីបីនៃប្រូតេអ៊ីនរាងមូលនិងសរសៃ fibrillar មានភាពខុសគ្នាយ៉ាងខ្លាំងពីគ្នាទៅវិញទៅមក។ ទម្រង់ម៉ូលេគុលប្រូតេអ៊ីនដែលត្រូវបានអនុម័តត្រូវបានកំណត់ដោយសូចនាករដូចជាកម្រិតនៃភាពមិនស្មើគ្នា (សមាមាត្រនៃអ័ក្សវែងនៃម៉ូលេគុលទៅខ្លី) ។ នៅក្នុងប្រូតេអ៊ីនសកលកម្រិតនៃភាពមិនស្មើគ្នាគឺ ៣-៥ ដូចប្រូតេអ៊ីន fibrillar តម្លៃនេះខ្ពស់ជាងច្រើន (ពី ៨០ ទៅ ១៥០) ។
បើដូច្នេះតើរចនាសម្ព័ន្ធដែលលាតត្រដាងបឋមនិងអនុវិទ្យាល័យត្រូវបានផ្លាស់ប្តូរទៅជាទំរង់ដែលដួលរលំមានស្ថេរភាពយ៉ាងដូចម្តេច? ការគណនាបង្ហាញថាចំនួនទ្រឹស្តីដែលអាចធ្វើទៅបាននៃការបង្កើតរចនាសម្ព័ន្ធបីវិមាត្រនៃប្រូតេអ៊ីនគឺធំជាងចំនួនដែលមានស្រាប់នៅក្នុងធម្មជាតិ។ ជាក់ស្តែងទម្រង់អំណោយផលដ៏ស្វាហាប់បំផុតគឺជាកត្តាចម្បងនៃស្ថិរភាពស្រប។
សម្មតិកម្ម globule រលាយ។ វិធីមួយដើម្បីសិក្សាពីការបត់ខ្សែសង្វាក់ប៉ូលីភីប៉ីតទៅជារចនាសម្ព័នដែលមានបីវិមាត្រគឺការធ្វើឱ្យមានភាពទ្រុឌទ្រោមនិងការតិត្ថិភាពជាបន្តបន្ទាប់នៃម៉ូលេគុលប្រូតេអ៊ីន។
ការពិសោធន៍របស់អិនអានហ្វីនសិនជាមួយបូបូណូគុសូមបញ្ជាក់យ៉ាងច្បាស់ពីលទ្ធភាពនៃការតំឡើងរចនាសម្ព័ន្ធជាក់លាក់ដែលត្រូវបានរំខានដោយសារលទ្ធផលនៃភាពមិនត្រឹមត្រូវ (រូបភាព ៣.១០) ។
ក្នុងករណីនេះការស្ដារឡើងវិញនូវទម្រង់ដើមមិនត្រូវការរចនាសម្ព័ន្ធបន្ថែមទេ។ តើគំរូអ្វីខ្លះនៃការបត់ខ្សែសង្វាក់ប៉ូលីភីប៉ីតទៅក្នុងរចនាសម្ព័ន្ធដែលត្រូវគ្នាគឺទំនងបំផុត? សម្មតិកម្មដែលរីករាលដាលបំផុតមួយនៃការរៀបចំប្រូតេអ៊ីនដោយខ្លួនឯងគឺសម្មតិកម្មគ្លុយកូសរលាយ។ នៅក្នុងក្របខ័ណ្ឌនៃគំនិតនេះដំណាក់កាលជាច្រើននៃការប្រមូលផ្តុំប្រូតេអ៊ីនដោយខ្លួនឯងត្រូវបានសម្គាល់។
- 1. នៅក្នុងខ្សែសង្វាក់ប៉ូលីភីតទីបដែលបានលាតត្រដាងដោយមានជំនួយពីចំណងអ៊ីដ្រូសែននិងអន្តរកម្មអ៊ីដ្រូហ្វីបផ្នែកដាច់ដោយឡែកនៃរចនាសម្ព័ន្ធបន្ទាប់បន្សំត្រូវបានបង្កើតឡើងដែលបម្រើជាគ្រាប់ពូជសម្រាប់ការបង្កើតរចនាសម្ព័ន្ធអនុវិទ្យាល័យនិងអនុវិទ្យាល័យពេញលេញ។
- ២. នៅពេលដែលចំនួននៃគេហទំព័រទាំងនេះឈានដល់កំរិតកំណត់ជាក់លាក់មួយមានការតំរែតំរង់រ៉ាឌីកាល់ចំហៀងនិងការផ្លាស់ប្តូរខ្សែសង្វាក់ប៉ូលីភីតទីបទៅជាទម្រង់ថ្មីដែលមានលក្ខណៈតូចជាងមុននិងចំនួនមូលបត្រដែលមិនមែនកូវែល

បាយ។ ៣.១០ ។
កើនឡើងគួរឱ្យកត់សម្គាល់។ លក្ខណៈពិសេសមួយនៃដំណាក់កាលនេះគឺការបង្កើតទំនាក់ទំនងជាក់លាក់រវាងអាតូមដែលមានទីតាំងស្ថិតនៅក្នុងតំបន់ឆ្ងាយនៃខ្សែសង្វាក់ប៉ូលីភីតទីដប៉ុន្តែត្រូវបានគេរកឃើញថានៅជិតគ្នាដោយសារការបង្កើតរចនាសម្ព័ន្ធទីបី។
3. នៅដំណាក់កាលចុងក្រោយការបង្កើតដើមកំណើតនៃម៉ូលេគុលប្រូតេអ៊ីនត្រូវបានបង្កើតឡើងដែលត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងការបិទនូវចំណង disulfide និងស្ថេរភាពចុងក្រោយនៃការបង្កើតប្រូតេអ៊ីន។ វាក៏អាចមានផងដែរថាការប្រមូលផ្តុំដែលមិនជាក់លាក់ត្រូវបានបត់ដោយផ្នែក។
សង្វាក់ប៉ូលីស្ទីដដែលអាចត្រូវបានចាត់ថ្នាក់ជាកំហុសក្នុងការបង្កើតប្រូតេអ៊ីនកំណើត។ ខ្សែសង្វាក់ polypeptide បត់ដោយផ្នែក (ជំហាន 2) ត្រូវបានគេហៅថា globule រលាយនិងដំណាក់កាល 3 យឺតបំផុតក្នុងការបង្កើតប្រូតេអ៊ីនចាស់ទុំ។
នៅក្នុងរូបភព។ ៣.១១ បង្ហាញពីបំរែបំរួលនៃការបង្កើតម៉ាក្រូម៉ូលេគុលប្រូតេអ៊ីនដែលបានអ៊ិនកូដដោយហ្សែនតែមួយ។ ទោះយ៉ាងណាក៏ដោយវាត្រូវបានគេដឹងថាចំនួនប្រូតេអ៊ីនដែលមានដែន

បាយ។ ៣.១១ ។
(យោងតាម NK Nagradova) រចនាសម្ព័ន្ធត្រូវបានបង្កើតឡើងជាលទ្ធផលនៃការចម្លងហ្សែនហើយការបង្កើតទំនាក់ទំនងរវាងដែនដាច់ដោយឡែកត្រូវការការខិតខំបន្ថែម។ វាបានបង្ហាញថាកោសិកាមានយន្តការពិសេសសម្រាប់ធ្វើនិយ័តកម្មការបត់ប្រូតេអ៊ីនដែលបានសំយោគថ្មីៗ។ បច្ចុប្បន្នអង់ស៊ីមពីរត្រូវបានគេរកឃើញដែលពាក់ព័ន្ធនឹងការអនុវត្តយន្តការទាំងនេះ។ ប្រតិកម្មយឺតមួយនៃដំណាក់កាលទីបីនៃការបត់ខ្សែសង្វាក់ប៉ូលីភីតទីដគឺ * 
បាយ។ ៣.១២ ។
លើសពីនេះកោសិកាមានប្រូតេអ៊ីនអសកម្មកាតាលីករមួយចំនួនដែលបានរួមចំណែកយ៉ាងធំដល់ការបង្កើតរចនាសម្ព័ន្ធលំហនៃប្រូតេអ៊ីន។ ទាំងនេះគឺជាអ្វីដែលគេហៅថា chaperones និង chaperonins (រូបភាព 3.12) ។ អ្នករកឃើញមួយនៃអង្គធាតុរាវម៉ូលេគុលអិលអេលលីសហៅពួកគេថាជាថ្នាក់មុខងារនៃក្រុមគ្រួសារប្រូតេអ៊ីនដែលមិនទាក់ទងគ្នាដែលជួយដល់ការជួបប្រជុំគ្នាដែលមិនមានកូវែលត្រឹមត្រូវនៃរចនាសម្ព័ន្ធដែលមានផ្ទុកប៉ូលីភីតទីតផ្សេងទៀតនៅក្នុងវីយូប៉ុន្តែមិនមែនជាផ្នែកនៃរចនាសម្ព័ន្ធដែលបានជួបប្រជុំគ្នានិងមិនពាក់ព័ន្ធ នៅក្នុងការអនុវត្តមុខងារសរីរវិទ្យាធម្មតារបស់ពួកគេ។
Chaperones ជួយក្នុងការជួបប្រជុំគ្នាយ៉ាងត្រឹមត្រូវនៃការបង្កើតប្រូតេអ៊ីនបីវិមាត្រដោយបង្កើតឱ្យមានភាពស្មុគស្មាញដែលមិនមែនជា covalent ដែលអាចបញ្ច្រាស់បានជាមួយនឹងខ្សែសង្វាក់ polypeptide ដែលបត់បានមួយផ្នែកខណៈពេលដំណាលគ្នារារាំងចំណងមិនប្រក្រតីដែលនាំឱ្យមានការបង្កើតរចនាសម្ព័ន្ធប្រូតេអ៊ីនដែលមិនដំណើរការ។ បញ្ជីនៃមុខងារដែលមាននៅក្នុងការផ្លាស់ប្តូររួមមានការការពារជាតិស្កររលាយពីការប្រមូលផ្តុំក៏ដូចជាការផ្ទេរប្រូតេអ៊ីនដែលបានសំយោគថ្មីៗទៅកោសិកាផ្សេងៗ។ Chaperones គឺជាប្រូតេអ៊ីនកំដៅដែលភាគច្រើនត្រូវបានគេសំយោគដែលត្រូវបានកើនឡើងយ៉ាងខ្លាំងនៅក្រោមការប៉ះពាល់សីតុណ្ហភាពស្ត្រេសដូច្នេះពួកវាត្រូវបានគេហៅផងដែរថាអេសអេស (ប្រូតេអ៊ីនឆក់កំដៅ) ។ គ្រួសារនៃប្រូតេអ៊ីនទាំងនេះមាននៅក្នុងកោសិកាមីក្រូជីរុក្ខជាតិនិងសត្វ។ ការចាត់ថ្នាក់នៃភាពជាដៃគូគឺផ្អែកលើរបស់ពួកគេ ទម្ងន់ម៉ូលេគុលដែលប្រែប្រួលពី ១០ ទៅ ៩០ kDa ។ ជាទូទៅមុខងាររបស់ chaperones និង chaperonins ខុសគ្នាទោះបីជាទាំងពីរគឺជាប្រូតេអ៊ីនដែលជួយក្នុងការបង្កើតរចនាសម្ព័ន្ធបីវិមាត្រនៃប្រូតេអ៊ីនក៏ដោយ។ Chaperones រក្សាខ្សែសង្វាក់ polypeptide ដែលត្រូវបានសំយោគថ្មីនៅក្នុងស្ថានភាពដែលបានលាតសន្ធឹងដោយការពារវាពីការបត់ចូលទៅក្នុងទម្រង់ខុសពីទម្រង់ដើមហើយ chaperonins ផ្តល់លក្ខខណ្ឌសម្រាប់ការបង្កើតរចនាសម្ព័ន្ធប្រូតេអ៊ីនដើមកំណើតត្រឹមត្រូវ (រូបភាព ៣.១៣) ។

បាយ។ ៣.១៣ ។
Chaperones / ត្រូវបានផ្សារភ្ជាប់ទៅនឹងខ្សែសង្វាក់ polypeptide ដែលគ្មានជាតិពណ៌ដែលចុះពីឆ្អឹងជំនី។ បន្ទាប់ពីការបង្កើតខ្សែសង្វាក់ polypeptide និងការបញ្ចេញវាពី ribosome, chaperones ភ្ជាប់ទៅវានិងការពារការប្រមូលផ្តុំ។ 2. បន្ទាប់ពីបត់នៅក្នុងស៊ីតូផ្លាសប្រូតេអ៊ីនត្រូវបានបំបែកចេញពី chaperone ហើយត្រូវបានផ្ទេរទៅ chaperonin ដែលត្រូវគ្នាដែលការបង្កើតចុងក្រោយនៃរចនាសម្ព័ន្ធទីបីកើតឡើង។ 3. ដោយមានជំនួយពីស៊ីតូតូស្យូលីនប្រូសេស្តេរ៉ូនប្រូតេអ៊ីនរំកិលទៅភ្នាសខាងក្រៅនៃមីតូឆុនទ្រៀជាកន្លែងដែលមេអំបៅទ្រុងមាន់ទាញពួកវាចូលទៅក្នុងមីតូឆុនទ្រៀហើយ“ ផ្ទេរ” ពួកវាទៅមេតូឆុនទ្រូលីនឆឺរ៉ូនីនដែលជាកន្លែងដែលមានផ្នត់កើតឡើង។ 4, a5 គឺស្រដៀងគ្នា 4 ប៉ុន្តែទាក់ទងទៅនឹងសរសៃប្រសាទ endoplasmic ។
រចនាសម្ព័នទីបីនៃប្រូតេអ៊ីនគឺជាវិធីដែលខ្សែសង្វាក់ polypeptide ត្រូវបានបត់នៅក្នុងលំហបីវិមាត្រ។ ការសម្របសម្រួលនេះកើតឡើងដោយសារតែការបង្កើត មូលបត្រគីមីរវាងរ៉ាឌីកាល់អាស៊ីតអាមីណូដែលនៅឆ្ងាយពីគ្នា។ ដំណើរការនេះត្រូវបានអនុវត្តដោយមានការចូលរួមពីយន្តការម៉ូលេគុលនៃកោសិកានិងដើរតួនាទីយ៉ាងធំក្នុងការផ្តល់មុខងារមុខងារដល់ប្រូតេអ៊ីន។
លក្ខណៈពិសេសនៃរចនាសម្ព័ន្ធទីបី
អន្តរកម្មគីមីប្រភេទខាងក្រោមគឺជាលក្ខណៈនៃរចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីន៖
- អ៊ីយ៉ុង;
- អ៊ីដ្រូសែន;
- hydrophobic;
- វ៉ាន់ឌឺវ៉ាល
- disulfide ។
មូលបត្របំណុលទាំងអស់នេះ (លើកលែងតែចំណង covalent disulfide bond) មានភាពទន់ខ្សោយប៉ុន្តែដោយសារតែចំនួនវាមានស្ថេរភាពរូបរាងលំហរបស់ម៉ូលេគុល។
តាមពិតកម្រិតទី ៣ នៃការបត់ច្រវ៉ាក់ប៉ូលីភីតទីដគឺជាការរួមបញ្ចូលគ្នានៃធាតុផ្សេងៗគ្នានៃរចនាសម្ព័ន្ធបន្ទាប់បន្សំ (α-ជំនួយ; ស្រទាប់និងរង្វិលជុំបត់) ដែលតម្រង់ទិសក្នុងលំហដោយសារអន្តរកម្មគីមីរវាងរ៉ាឌីកាល់អាស៊ីតអាមីណូចំហៀង។ ចំពោះការរចនាគ្រោងការណ៍នៃរចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីនα-helices ត្រូវបានចង្អុលបង្ហាញដោយស៊ីឡាំងឬបន្ទាត់ដែលមានរាងជារង្វង់វិលបត់ដោយព្រួញនិងរង្វិលជុំដោយបន្ទាត់សាមញ្ញ។

ធម្មជាតិនៃការតំរែតំរង់ថ្នាក់ទីបីត្រូវបានកំណត់ដោយលំដាប់នៃអាស៊ីដអាមីណូនៅក្នុងសង្វាក់ដូច្នេះម៉ូលេគុលពីរដែលមានរចនាសម្ព័ន្ធបឋមដូចគ្នានៅក្រោមលក្ខខណ្ឌស្មើគ្នានឹងត្រូវគ្នាទៅនឹងវ៉ារ្យ៉ង់ដូចគ្នានៃការបត់បែនតាមលំហ។ ការរៀបចំនេះផ្តល់នូវមុខងារមុខងាររបស់ប្រូតេអ៊ីនហើយត្រូវបានគេហៅថាដើមកំណើត។

នៅក្នុងដំណើរការនៃការបត់ម៉ូលេគុលប្រូតេអ៊ីនសមាសធាតុនៃមជ្ឈមណ្ឌលសកម្មខិតជិតគ្នាដែលនៅក្នុងរចនាសម្ព័ន្ធបឋមអាចត្រូវបានដកចេញយ៉ាងសំខាន់ពីគ្នាទៅវិញទៅមក។
ចំពោះប្រូតេអ៊ីនដែលមានខ្សែតែមួយរចនាសម្ព័ន្ធទីបីគឺជាទម្រង់មុខងារចុងក្រោយ។ ប្រូតេអ៊ីនពហុអនុរងស្មុគស្មាញបង្កើតជារចនាសម្ព័ន្ធត្រីមាសដែលបង្ហាញពីការរៀបចំសង្វាក់ជាច្រើនដែលទាក់ទងគ្នា។
លក្ខណៈពិសេសនៃចំណងគីមីនៅក្នុងរចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីន
ការបត់ខ្សែសង្វាក់ប៉ូលីភីប៉ីតភាគច្រើនដោយសារសមាមាត្រអ៊ីដ្រូហ្វីលីកនិងរ៉ាឌីកាល់អ៊ីដ្រូហ្វីប។ អតីតទំនោរធ្វើអន្តរកម្មជាមួយអ៊ីដ្រូសែន (សមាសធាតុទឹក) ហើយដូច្នេះនៅលើផ្ទៃខណៈតំបន់អ៊ីដ្រូហ្វីបផ្ទុយទៅវិញប្រញាប់ទៅកណ្តាលម៉ូលេគុល។ ការសម្របសម្រួលនេះគឺអំណោយផលបំផុត។ ជាលទ្ធផលដុំទឹកកកដែលមានស្នូលអ៊ីដ្រូហ្វីបត្រូវបានបង្កើតឡើង។
រ៉ាឌីកាល់អ៊ីដ្រូហ្វីលីកដែលធ្លាក់ចូលទៅក្នុងកណ្តាលនៃម៉ូលេគុលធ្វើអន្តរកម្មជាមួយគ្នាដើម្បីបង្កើតចំណងអ៊ីយ៉ុងឬអ៊ីដ្រូសែន។ ចំណងអ៊ីយ៉ុងអាចកើតឡើងរវាងរ៉ាឌីកាល់អាស៊ីតអាមីណូដែលមានបន្ទុកផ្ទុយគ្នាដែលមាន៖
- ក្រុមស៊ីអ៊ីធីននៃអាហ្គីននីនលីសស៊ីនឬអ៊ីស្តាឌីន (មានបន្ទុកវិជ្ជមាន);
- ក្រុម carboxyl នៃរ៉ាឌីកាល់អាស៊ីត glutamic និង aspartic (មានបន្ទុកអវិជ្ជមាន) ។

មូលបត្របំណុលអ៊ីដ្រូសែនត្រូវបានបង្កើតឡើងដោយអន្តរកម្មនៃក្រុមដែលមិនបញ្ចូលថ្ម (OH, SH, CONH 2) និងក្រុមអ៊ីដ្រូហ្វីលីកដែលមានបន្ទុក។ មូលបត្របំណុល Covalent (ខ្លាំងបំផុតនៅក្នុងការតំរែតំរង់ថ្នាក់ទី ៣) កើតឡើងរវាងក្រុមអេសអេសនៃសំណល់ស៊ីស្ទីនបង្កើតជាអ្វីដែលគេហៅថាស្ពានឌីហ្វាលហ្វីដ។ ជាធម្មតាក្រុមទាំងនេះគឺនៅឆ្ងាយពីគ្នានៅក្នុងខ្សែសង្វាក់លីនេអ៊ែរនិងវិធីសាស្រ្តតែក្នុងកំឡុងពេលដំណើរការជង់។ មូលបត្របំណុល disulfide មិនមែនជាធម្មតាសម្រាប់ប្រូតេអ៊ីនក្នុងកោសិកាភាគច្រើនទេ។
ភាពបត់បែនតាមការសម្របសម្រួល
ដោយសារចំណងដែលបង្កើតជារចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីនមានភាពទន់ខ្សោយចលនាប្រោនៀននៃអាតូមនៅក្នុងខ្សែសង្វាក់អាស៊ីតអាមីណូអាចនាំឱ្យមានការបែកបាក់និងការបង្កើតនៅកន្លែងថ្មី។ នេះនាំឱ្យមានការផ្លាស់ប្តូរបន្តិចបន្តួចនៅក្នុងរូបរាងលំហនៃតំបន់នីមួយៗនៃម៉ូលេគុលប៉ុន្តែមិនរំលោភលើការបង្កើតប្រូតេអ៊ីនដើមកំណើត។ បាតុភូតនេះត្រូវបានគេហៅថា lability ស្រប។ ក្រោយមកទៀតដើរតួនាទីយ៉ាងធំនៅក្នុងសរីរវិទ្យានៃដំណើរការកោសិកា។
ការបង្កើតប្រូតេអ៊ីនត្រូវបានជះឥទ្ធិពលដោយអន្តរកម្មរបស់វាជាមួយម៉ូលេគុលផ្សេងទៀតឬការផ្លាស់ប្តូរប៉ារ៉ាម៉ែត្រគីមីវិទ្យានៃបរិស្ថាន។
របៀបដែលរចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីនត្រូវបានបង្កើតឡើង
ដំណើរការនៃការបត់ប្រូតេអ៊ីនទៅជាទម្រង់ដើមរបស់វាត្រូវបានគេហៅថាបត់។ បាតុភូតនេះត្រូវបានផ្អែកលើបំណងប្រាថ្នារបស់ម៉ូលេគុលក្នុងការទទួលយកការតំរែតំរង់ជាមួយនឹងតម្លៃអប្បបរមានៃថាមពលសេរី។
គ្មានប្រូតេអ៊ីនត្រូវការអន្តរការីគ្រូបង្រៀនដើម្បីកំណត់រចនាសម្ព័ន្ធថ្នាក់ទីបី។ លំនាំបត់ដំបូងត្រូវបាន "សរសេរ" តាមលំដាប់អាស៊ីដអាមីណូ។
ទោះយ៉ាងណាក៏ដោយស្ថិតក្រោមលក្ខខណ្ឌធម្មតាវានឹងចំណាយពេលជាងមួយសែនកោដិឆ្នាំសម្រាប់ម៉ូលេគុលប្រូតេអ៊ីនដ៏ធំមួយដើម្បីសន្មតការផ្លាស់ប្តូរដើមកំណើតរបស់វាតាមរចនាសម្ព័ន្ធចម្បងរបស់វា។ ទោះយ៉ាងណាក៏ដោយនៅក្នុងកោសិកាដែលមានជីវិតដំណើរការនេះមានរយៈពេលតែពីរបីនាទីប៉ុណ្ណោះ។ ការកាត់បន្ថយពេលវេលាដ៏សំខាន់បែបនេះត្រូវបានធានាដោយការចូលរួមនៃប្រូតេអ៊ីនជំនួយឯកទេសផ្នេកឃីហ្សេននិងភេភើរុនក្នុងការបត់។
ការបត់បែននៃម៉ូលេគុលប្រូតេអ៊ីនតូចៗ (រហូតដល់ ១០០ អាស៊ីដអាមីណូក្នុងខ្សែសង្វាក់) កើតឡើងយ៉ាងឆាប់រហ័សនិងដោយគ្មានការចូលរួមពីអន្តរការីដូចដែលបានបង្ហាញដោយការសាកល្បងក្នុងវីតូ។

កត្តាបត់
ប្រូតេអ៊ីនជំនួយដែលពាក់ព័ន្ធនឹងការបត់ត្រូវបានបែងចែកជាពីរក្រុម៖
- ផូលែស - មានសកម្មភាពកាតាលីករត្រូវបានទាមទារក្នុងបរិមាណទាបជាងការផ្តោតអារម្មណ៍នៃស្រទាប់ខាងក្រោម (ដូចអង់ស៊ីមផ្សេងទៀត);
- chaperones - ប្រូតេអ៊ីនដែលមានយន្តការផ្សេងៗគ្នានៃសកម្មភាពត្រូវបានគេត្រូវការនៅក្នុងកំហាប់ដែលអាចប្រៀបធៀបទៅនឹងបរិមាណនៃស្រទាប់ខាងក្រោមដែលបត់។
កត្តាទាំងពីរប្រភេទត្រូវបានចូលរួមនៅក្នុងការបត់ប៉ុន្តែមិនមែនជាផ្នែកនៃផលិតផលចុងក្រោយទេ។
ក្រុម foldase ត្រូវបានតំណាងដោយអង់ស៊ីមចំនួន ២៖
- ប្រូតេអ៊ីន disulfide isomerase (PDI) - គ្រប់គ្រងការបង្កើតត្រឹមត្រូវនៃចំណង disulfide នៅក្នុងប្រូតេអ៊ីនដែលមានសំណល់ស៊ីអ៊ីស្ទីនមួយចំនួនធំ។ មុខងារនេះមានសារៈសំខាន់ខ្លាំងណាស់ពីព្រោះអន្តរកម្ម covalent មានភាពរឹងមាំហើយក្នុងករណីមានការតភ្ជាប់ខុសប្រូតេអ៊ីនមិនអាចរៀបចំឡើងវិញដោយឯករាជ្យនិងសន្មតការផ្លាស់ប្តូរកំណើតបានទេ។
- Peptidyl-prolyl-cis-trans-isomerase-ផ្តល់នូវការផ្លាស់ប្តូរការកំណត់រចនាសម្ព័ន្ធរ៉ាឌីកាល់ដែលស្ថិតនៅផ្នែកម្ខាងនៃប្រូលីនដែលផ្លាស់ប្តូរលក្ខណៈនៃការបត់នៃសង្វាក់ប៉ូលីភីតទីដនៅកន្លែងនេះ។
ដូច្ន្រះផ្ន្រកដ្រលដើរតួនាទីកែតម្រូវក្នុងការបង្កើតទ្រឹស្តីបទទីបីនៃម៉ូលេគុលប្រូតេអ៊ីន។
Chaperones
Chaperones ត្រូវបានគេហៅថាឬភាពតានតឹង។ នេះបណ្តាលមកពីការកើនឡើងយ៉ាងខ្លាំងនៃការសំងាត់របស់ពួកគេជាមួយនឹងផលប៉ះពាល់អវិជ្ជមានលើកោសិកា (សីតុណ្ហភាពវិទ្យុសកម្មលោហធាតុធ្ងន់។ ល។ ) ។
Chaperones ជាកម្មសិទ្ធិរបស់ក្រុមគ្រួសារប្រូតេអ៊ីនបី៖ hsp60, hsp70 និង hsp90 ។ ប្រូតេអ៊ីនទាំងនេះបម្រើមុខងារជាច្រើនរួមមាន៖
- ការការពារប្រូតេអ៊ីនពីភាពមិនប្រក្រតី;
- ការមិនរាប់បញ្ចូលអន្តរកម្មនៃប្រូតេអ៊ីនសំយោគថ្មីជាមួយគ្នា។
- ការការពារការបង្កើតចំណងទន់ខ្សោយមិនត្រឹមត្រូវរវាងរ៉ាឌីកាល់និងការធ្វើឱ្យសកម្មរបស់វា (ការកែតម្រូវ) ។

ដូច្ន្រះ chaperones រួមចំណែកដល់ការទទួលបានយ៉ាងឆាប់រហ័សនូវការកែតម្រូវថាមពលដោយមិនរាប់បញ្ចូលការប៉ាន់ស្មានដោយចៃដន្យនូវវ៉ារ្យ៉ង់ជាច្រើននិងការពារម៉ូលេគុលប្រូតេអ៊ីនមិនទាន់ពេញវ័យពីអន្តរកម្មដែលមិនចាំបាច់ជាមួយគ្នា។ លើសពីនេះការផ្តល់ជូនអាចមានៈ
- ប្រភេទខ្លះនៃការដឹកជញ្ជូនប្រូតេអ៊ីន;
- ការត្រួតពិនិត្យឡើងវិញ (ការស្តាររចនាសម្ព័ន្ធទីបីបន្ទាប់ពីការបាត់បង់របស់វា);
- រក្សាស្ថានភាពនៃការបត់ដែលមិនទាន់បានបញ្ចប់ (សម្រាប់ប្រូតេអ៊ីនខ្លះ) ។
ក្នុងករណីចុងក្រោយម៉ូលេគុល chaperone នៅតែជាប់នឹងប្រូតេអ៊ីននៅពេលបញ្ចប់ដំណើរការបត់។
ភាពមិនប្រក្រតី
ការរំលោភលើរចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីនក្រោមឥទ្ធិពលនៃកត្តាណាមួយត្រូវបានគេហៅថា denaturation ។ ការបាត់បង់ការបង្កើតជនជាតិដើមកើតឡើងនៅពេលដែលមូលបត្របំណុលខ្សោយមួយចំនួនធំដែលធ្វើឱ្យម៉ូលេគុលមានស្ថិរភាពត្រូវបានបំផ្លាញ។ ក្នុងករណីនេះប្រូតេអ៊ីនបាត់បង់មុខងារជាក់លាក់របស់វាប៉ុន្តែរក្សារចនាសម្ព័ន្ធចម្បងរបស់វា (ចំណង peptide មិនត្រូវបានបំផ្លាញក្នុងកំឡុងពេលកំណត់) ។

ក្នុងកំឡុងពេល denaturation ការកើនឡើងចន្លោះនៅក្នុងម៉ូលេគុលប្រូតេអ៊ីនកើតឡើងហើយតំបន់អ៊ីដ្រូហ្វីបមកលើផ្ទៃម្តងទៀត។ ខ្សែសង្វាក់ polypeptide ទទួលបាននូវទម្រង់នៃឧបករណ៏ដែលមិនមានរាងដែលរូបរាងអាស្រ័យលើចំណងដែលរចនាសម្ព័ន្ធប្រូតេអ៊ីនទីបីត្រូវបានខូច។ នៅក្នុងទម្រង់នេះម៉ូលេគុលងាយនឹងធ្វើសកម្មភាពអង់ស៊ីម proteolytic ។
កត្តាដែលរំខានដល់រចនាសម្ព័ន្ធទីបី
មានឥទ្ធិពលរាងកាយនិងគីមីមួយចំនួនដែលអាចបណ្តាលឱ្យមានភាពមិនប្រក្រតី។ ទាំងនេះរួមបញ្ចូលទាំង:
- សីតុណ្ហាភាពលើសពី 50 ដឺក្រេ;
- វិទ្យុសកម្ម;
- ការផ្លាស់ប្តូរ pH នៃបរិស្ថាន;
- អំបិលលោហៈធ្ងន់;
- ខ្លះ សមាសធាតុសរីរាង្គ;
- សាប៊ូបោកខោអាវ។
បន្ទាប់ពីការបញ្ចប់នៃផលប៉ះពាល់ប្រូតេអ៊ីនអាចស្តាររចនាសម្ព័ន្ធទីបីឡើងវិញ។ ដំណើរការនេះត្រូវបានគេហៅថា renaturation ឬ refolding ។ នៅក្នុងវីរ៉ូតូនេះអាចធ្វើទៅបានតែចំពោះប្រូតេអ៊ីនតូចៗប៉ុណ្ណោះ។ នៅក្នុងកោសិកាដែលមានជីវិត chaperones ផ្តល់នូវការធ្វើឱ្យត្រជាក់ឡើងវិញ។