Амонячна буферна система. Буферни разтвори. Класификация на буферните разтвори. Механизмът на тяхното действие. Механизмът на действие на буферите
Определение.
В лабораторната практика често се налага да се работи с разтвори, които имат определена стойност на pH. Такива разтвори се наричат буферни разтвори.
Буферни разтвори- разтвори, чието pH на практика не се променя при добавяне към тях големи количествакиселини и основи или при разреждане.
Буферните разтвори могат да бъдат четири вида:
1. Слаба киселина и нейната сол.Например, ацетатен буферен разтвор CH 3 COOH + CH 3 COONa (рН = 4,7).
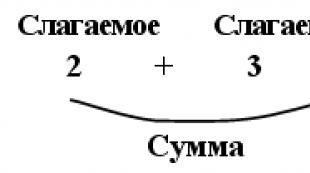
2... Слаба основа и нейната сол.Например, амонячен буферен разтвор NH 4 OH + NH 4 Cl (рН = 9,2).
3. Разтвор на две киселинни соли.Например, фосфатен буферен разтвор NaH 2 PO 4 + Na 2 HPO 4 (рН = 8). В този случай солта играе ролята на слаба киселина.
Аминокиселинни и протеинови буфери.
Механизъм на действие.
Действието на буферните разтвори се основава на факта, че йони или буферни молекули свързват Н + или ОН йони - въведени в тях киселини или основи, с образуването на слаби електролити. Например, ако солна киселина се добави към ацетатния буферен разтвор CH 3 COOH + CH 3 COON, реакцията ще настъпи:
CH 3 COONa + HCl = CH 3 COOH + NaCl
CH 3 COO - + H + = CH 3 COOH
CH 3 COO - йони, взаимодействащи с H + катиони на солна киселина, образуват молекули на оцетна киселина, H + не се натрупва в разтвора, поради което концентрацията им практически не се променя и следователно стойността на pH на разтвора не се променя.
Когато към ацетатния буферен разтвор се добави алкали (например NaOH), се получава реакцията:
CH 3 COOH + NaOH = CH 3 COONa + H 2 O
CH 3 COOH + OH - = CH 3 COO - + H 2 O
Н + катионите на оцетната киселина се комбинират с ОН - алкални йони, за да образуват вода. Концентрацията на киселината намалява. Вместо изразходваните H + катиони, в резултат на дисоциацията на оцетната киселина CH 3 COOH, отново се появяват H + катиони и предишната им концентрация се възстановява и стойността на pH на разтвора не се променя.
Буферен капацитет.
Всеки буферен разтвор практически поддържа постоянно рН само докато се добави определено количество киселина или алкали, т.е. буферен резервоар.
Буферен капацитет -Това е ограниченото количество (mol) силна киселина или алкали, което може да се добави към 1 литър буферен разтвор, така че рН да се промени с не повече от един.
готвене.
Буферните свойства са много слаби, ако концентрацията на един компонент е 10 пъти или повече различна от концентрацията на другия. Следователно буферните разтвори често се приготвят чрез смесване на разтвори с еднаква концентрация на двата компонента или чрез добавяне на подходящо количество реагент към разтвора на един компонент, което води до образуването на равна концентрация на конюгираната форма.
За да приготвите амонячна буферна смес, смесете 100 ml разтвор на NH 4 Cl с масова част 10% и 100 ml разтвор на NH 4 OH с масова част 10% и разредете получената смес с дестилирана вода до 1 литър.
Приложение.
Буферните разтвори се използват широко в химичния анализ, биохимичен анализза създаване и поддържане на определена стойност на рН на средата по време на реакции.
Например, Ва 2+ йони се отделят от Са 2+ йони чрез утаяване с Cr 2 O 7 2- дихроматни йони в присъствието на ацетатен буферен разтвор; При определяне на много метални катиони с помощта на Trilon B чрез комплексометрия се използва амонячен буферен разтвор.
Буферните разтвори осигуряват консистенцията на биологичните течности и тъкани. Основните буферни системи в организма са хидрокарбонат, хемоглобин, фосфат и протеин. Освен това действието на всички буферни системи е взаимосвързано. Водородните йони, получени отвън или образувани в процеса на метаболизма, се свързват с един от компонентите на буферните системи. Въпреки това, при някои заболявания може да настъпи промяна в pH стойността на кръвта. Изместването на стойността на pH на кръвта към киселинната област от нормалната стойност на pH от 7,4 се нарича ацидоза, към алкалната област - алкалоза.Ацидозата се проявява при тежки форми на захарен диабет, продължителна физическа работа и възпалителни процеси. Алкалозата може да възникне, ако бъбречно или чернодробно увреждане е тежко или ако дишането е нарушено.
Биологични течности, тъкани и органи.
Това се изразява в сравнително постоянни стойности на pH биологични среди(кръв, слюнка, стомашен сок и др.) и способността на организма да възстановява нормалните стойности на pH, когато е изложен на протолити. Поддържаща система протолитична хомеостаза,включва не само физиологични механизми (белодробна и бъбречна компенсация), но и физикохимични: буфериране, йонен обмен и дифузия.
Осигуряването на постоянство на pH на кръвта и другите органи и тъкани е едно от най-важните условия за нормалното съществуване на организма. Тази разпоредба се постига чрез наличието в тялото на множество регулаторни системи, най-важните от които са буферните системи. Последните играят основна роля в поддържането на KOR в тялото.
Освен това материалът по тази тема е необходим за изучаване на следващите теми от предмета (потенциометрия, свойства на разтвори на спирала и др.) и дисциплини като биохимия, микробиология, хистология, хигиена, физиология, в практическата дейност на лекар при оценка на вида и тежестта на нарушенията на КРС.
Буферни разтвориса наречени разтвори, които поддържат непроменени стойности на pH, когато се разреждат или добавят с малко количество силна киселина или основа.Протолитичните буферни разтвори са смеси от електролити, съдържащи едноименни йони.
Има основно два вида протолитични буферни разтвори:
Киселинен т.е. състояща се от слаба киселина и излишък от конюгирана с нея основа (солта, образувана от силна основа и аниона на тази киселина). Например: CH 3 COOH и CH 3 COONa - ацетатен буфер
CH 3 COOH + H 2 O ↔ H 3 O + + CH 3 COO - излишък от конюгирани
основна киселина
CH 3 COONa → Na + + CH 3 COO -
Основен, т.е. състояща се от слаба основа и излишък от конюгирана киселина (т.е. сол, образувана от силна киселина и катион на тази основа). Например: NH 4 OH и NH 4 Cl - амонячен буфер.
NH 3 + H 2 O ↔ OH - + NH 4 + излишък от конюгирани
киселинна основа
NH 4 Cl → Cl - + NH 4 +
Уравнението на буферната система се изчислява по формулата на Хендерсън-Хаселбах:
pH = pK + log, pOH = pK + log,
където pK = -lg K D.
C - моларна или еквивалентна концентрация на електролит (C = V N)
Механизмът на действие на буферите
Нека го разгледаме на примера с ацетатен буфер: CH 3 COOH + CH 3 COONa
Високата концентрация на ацетатни йони се дължи на пълната дисоциация на силен електролит - натриев ацетат, а оцетната киселина в присъствието на едноименния анион съществува в разтвор в почти нейонизирана форма.
1. Когато се добави малко количество солна киселина, йоните Н + се свързват с конюгираната основа CH 3 COO - присъстваща в разтвора, в слаб електролит CH 3 COOH.
CH 3 COO‾ + H + ↔ CH 3 COOH (1)
Уравнение (1) показва, че силната киселина HCl е заменена с еквивалентно количество слаба киселина CH3COOH. Количеството на CH 3 COOH се увеличава и според закона за разреждане на V. Ostwald степента на дисоциация намалява. В резултат на това концентрацията на H + йони в буфера се увеличава, но много незначително. pH се поддържа постоянно.
Когато към буфера се добави киселина, рН се определя по формулата:
pH = pK + lg
2. Когато се добави малко количество алкали към буфера, той реагира с CH3COOH. Молекулите на оцетната киселина ще реагират с хидроксидни йони, за да образуват H 2 O и CH 3 COO ‾:
CH 3 COOH + OH ‾ ↔ CH 3 COO‾ + H 2 O (2)
В резултат на това алкалата се заменя с еквивалентно количество слабо основна сол CH 3 COONa. Количеството на CH 3 COOH намалява и според закона за разреждане на V. Ostwald степента на дисоциация се увеличава поради потенциалната киселинност на останалите недисоциирани CH 3 COOH молекули. Следователно концентрацията на H + йони практически не се променя. pH остава постоянно.
Когато се добави алкали, pH се определя по формулата:
pH = pK + lg
3. Когато буферът се разреди, pH също не се променя, т.к константата на дисоциация и съотношението на компонентите остават непроменени.
По този начин рН на буфера зависи от: константи на дисоциация и съотношения на концентрация на компонентите. Колкото по-високи са тези стойности, толкова по-високо е pH на буфера. pH на буфера ще бъде най-високо, когато съотношението на компонентите е равно на едно.
За количествено характеризиране на буфера се въвежда понятието буферен резервоар.
Размер: px
Започнете да показвате от страница:
Препис
2 Основни въпроси: 1. Буферни системи, състав и механизъм на тяхното действие 2. Ацетатни, фосфатни, амонячни, хидрокарбонатни, хемоглобинови буфери 3. Изчисляване на pH на буферните разтвори. 4. Буферен капацитет и фактори, влияещи върху него 5. Стойността на буферните системи за химия и биология, медицина и фармация
3 В процеса на обмяната на веществата в нашето тяло се отделят много солна, пировиноградна и млечна киселини. Но в организма той е строго запазен. Постоянството на pH на биологичните среди се поддържа не само с помощта на физиологични механизми (белодробна и бъбречна компенсация), но и с помощта на физикохимично буферно действие, йонообмен и дифузия. Поддържането на киселинно-алкалния баланс на дадено ниво се осигурява на молекулярно ниво чрез действието на буферни системи.
4 Разтвори, които поддържат постоянна стойност на рН при добавяне на малки количества силни киселини и основи, както и при разреждане, се наричат протолитични буферни системи. Способността на някои разтвори да поддържат концентрацията на водородните йони непроменена се нарича буферно действие, което е основният механизъм на протолитичната хомеостаза. Буферните разтвори са смеси от слаба основа или слаба киселина и техните соли. В буферните разтвори, според теорията на Бронстед Лоури, основните "активни" компоненти са донорните рецепторни протони.
5 Буферни разтвори могат да се приготвят по два начина: 1. Частична неутрализация на слаб електролит със силен електролит: CH 3 COOH (излишък) + NaOH; NaOH (излишък) + HCl 2. Чрез смесване на разтвори на слаби електролити с техните соли (или две соли): CH 3 COOH и CH 3 COONa; NH3 и NH4Cl; NaH2PO4 и Na2HPO4
6 Причината за появата на ново качество на буферно действие в разтворите е комбинацията от няколко протолитични равновесия B (основа) + H + HB + (копринова киселина) HA (киселина) H + + A - (конюгирана основа) Конюгирана киселина -основни двойки HB + / Vi HA / A - се наричат буферни системи, които представляват комбинирани равновесия на процесите на йонизация и хидролиза.
7 Така протолитичните буферни системи се състоят от: два компонента. I. слаб конюгат. киселинна основа II. конюгат със слаба база. киселина Единият от компонентите свързва Н + на силна киселина, другият ОН - на силна алкална основа.
8 КЛАСИФИКАЦИЯ НА БУФЕРНИ СИСТЕМИ I. Киселинни буферни системи. Те са смес от слаба киселина HA (протонен донор) и нейните соли A - (акцепторпротон). q ацетат: CH 3 COOH + CH 3 COONa CH CH 3 3 COOH COO q хидрокарбонат: Слаба киселина Конюгирана основа H 2 CO HCO 3 3
9 II. Основни буферни системи. Те са смес от слаба основа (акцептор на протони) и нейната сол (донорен протон). Амонячна буферна система: смес от слаба основа NH 3 H 2 O (акцептор на протони) и неговата силна електролитна сол NH + 4 (донор на протони). Буферна зона prirn 8.2-10.2 NH 4 NH OH + 4 Слаба основа Конюгирана киселина
10 III. Буферни системи за физиологичен разтвор. KH 2 PO 4 + K 2 HPO 4 вътреклетъчен NaH 2 PO 4 + Na 2 HPO 4 извън клетъчната хидрофосфатна буферна система (зона на буферно действие рН 6,2 8,2). Представлява смес от слаба киселина Н 2 РО - 4 (протонен донор) и езолинро 2-4 (акцепторпротон) Н 2РО НРО Слаба киселина Конюгирана основа
11 IV. Системи за буфериране на аминокиселини и протеини. Буферният ефект на тези буферни системи започва да се проявява, когато към тях се добави определено количество киселина или алкали. Образува се смес от две форми на протеин: а) слаба "протеин-киселина" + сол на тази слаба киселина б) слаба "протеин-база" + сол на тази слаба основа
12 Изчисляване на рН буферни системи (уравнение на Хендерсън-Хаселбах) Като използвате примера на ацетатен буферен разтвор, разгледайте изчисляването на буферните системи. CH COOH CH COONa Натриевият ацетат практически 3 се разлага напълно на йони: CH 3 COONa CH 3 COO - + H + 3 оцетната киселина дисоциира само в малка степен: CH 3 COOH CH 3 COO - + H + Приложете закона за масовото действие към уравнението на дисоциация на оцетната киселина:
13 В присъствието на натриев ацетат дисоциационното равновесие на оцетната киселина е силно изместено наляво в съответствие с принципа на Льо Шателие. Почти цялата киселина в такъв разтвор е недисоциирана и само малко количество от нея се дисоциира, образувайки Н + йони и осигурявайки кисел разтвор. Следователно, равновесната концентрация на недисоциирана киселина в този разтвор е практически равна на нейната обща концентрация, т.е. C (CH3COOH) равно. C (киселина). Концентрацията на ацетатните йони в буферната смес е практически равна на първоначалната концентрация на солта: C (CH 3 COO -) C (сол).
14 В уравнението на константата на дисоциация на оцетната киселина заместваме общата концентрация на киселината и солта, получаваме K d = C C k you. lgcd = pk киселина, след това + = K d C C k вие сол
15 ph = pk за вас lg С С за вас соли или ph = pk за вас + log С С киселинни соли Това уравнение се нарича уравнение на Хендерсън-Хеселбах. Това е основното уравнение, което се използва за описване на киселинно-алкалното равновесие в биологичните системи.
16 След подобно заключение за основните буферни системи: poh ph = = 14 pk основно pk + основно log С log С (соли) (основи) С С (соли) (основи) естеството на слаб електролит (pk (киселина) , pk (основа), върху съотношението на концентрациите на сол и киселина (основа) и температурата.
17 Трябва да се отбележи, че буферните системи ефективно поддържат pH в диапазона: pk (киселини) ± 1 за киселинни системи; 14 (pk (бази) ± 1) за основни системи. Механизмът на действие на буферните системи. 1. Разреждане. Когато се разрежда с вода, концентрацията на киселина и сол намалява с вода и същия брой пъти, съотношението lg C (сол) / C (киселина) не се променя, следователно pH на буферния разтвор практически не се променя. Освен това рк на киселината или рк на основата не зависи от разреждането. 2.Добавяне на киселини и основи. Когато малко количество силен кисел йон + (образуван по време на дисоциацията) се добавя към ацетатния буфер
18 се свързват от сататни йони, които присъстват в излишък, с образуването на слабо дисоцииращи CH 3 COOH молекули. Степента на дисоциация на CH 3 COOH е малка и концентрацията на [H +] практически не се променя, рН на буферния разтвор ще намалее, но незначително. CH 3 COOH CH 3 COONa + HCl CH 3 COOH + NaCl x x x буфер phfl ph = pk за вас + log C С соли за вас x + x
19 Когато се добави малко количество NaOH, йони OH - се неутрализират от киселинния компонент на буферния разтвор, образувайки водни молекули. CH 3 COOH + NaOH CH 3 COONa + H 2 O xxx CH 3 COONa буфер В резултат на това добавената силна база се заменя с еквивалентно количество слаба конюгирана основа CH 3 COO -, което влияе върху реакцията на средата към малка степен. pH на буферния разтвор се повишава, но не значително.
20 pH pH = pk за вас + log C С сол за вас + x x Пример: сравнете промяната в pH при пропускане на 0,01 mol хлороводород през 1 литър: ацетатен буферен разтвор, съдържащ 0,1 mol/l сол и киселина; v Дестилирана вода Началната стойност на pH на буферния разтвор е равна на pH = rxn 3 COOH = 4,75, тъй като C към вас = C сол След добавяне на HCl: pH = 4,75 + log 0,1 0,01 0,1 + 0,01 pH = 4,66; ΔрН = 4, = 0,09 pH единици
21 v ph = 7 за дестилирана вода. След преминаване през 0,01 mol HCl ph = -lg 0,01 = 2; ΔрН = 7 2 = 5 pH единици Способността на буферния разтвор да поддържа pH при добавяне на силна киселина или силна алкална основа при приблизително постоянно ниво далеч не е неограничена и е ограничена от стойността на т.нар. буферен капацитет.
22 БУФЕРЕН КАПАЦИТЕТ Буферният капацитет (B) е броят на моловете силна киселина или алкален еквивалент, който трябва да се добави към 1 L от буферния разтвор, за да се измести неговото pH с единица. Буферният капацитет на системата се определя спрямо добавената киселина (В киселина) или основа (алкал) (В алкална) и се изчислява по формулите: В киселина. = C H (HA) ph - ph 0 V (HA), V (b.p.) H In main. =, ph - ph V (B) V (b.p.), където V (HA), V (B) - обеми на добавена киселина или алкали, l; C n = (HA), C n (B) моларни концентрации на еквивалента на киселина и алкали, съответно; V (б.р.) - обем на изходния буферен разтвор, l; ph около, ph - стойностите на рН на буферния разтвор преди и след добавяне на киселина или алкали; ph-ph o - разлика по модул. C (B) 0
23 Буферен капацитет по отношение на киселината (In acid) се определя от концентрацията (брой еквиваленти) на свойствата на компонента бор; буферният капацитет по отношение на докосването (В основен) се определя от концентрацията (брой еквиваленти) на компонента и киселинните свойства в буферния разтвор.
24 Буферен капацитет зависи от съотношението на компонентите и тяхната концентрация а) съотношението на компонентите сол киселина 90 mmol 10 mmol = = = mmol HCl + 10 mmol HCl = = log4 = 0,60 log0,67 = -0,17 = 0,67 Буферен капацитет е максимално, когато съотношението на компонентите е равно на единица, докато B main = B киселина, arn = pk
Б) концентрация на компоненти. Колкото по-висока е концентрацията, толкова по-голям е буферният капацитет. солена киселина 20 mmol 50 = 1 = 1 20 mmol mmol HCl + 10 mmol HCl = 0,33 = 0, log0,33 = 0,48 log0,67 = -0,17
26 Използването на всяка буферна система е ограничено до определена площ на pH: за киселинни системи = pk киселина ± 1; за основни системи, pH = 14 - (pk база ± 1). ЗАКЛЮЧЕНИЕ: буферният капацитет зависи основно от съотношението на концентрациите на компонентите и техните абсолютни концентрации и следователно от разреждането. Буферни системи за постоянство на рН на кръвта течни средиТялото се поддържа от буферни системи: хидрокарбонат, хемоглобин, фосфат, протеин. Действието на всички буферни системи в организма е взаимосвързано, което осигурява биологични течности с постоянна стойност на pH. При хората и животните буферните системи се намират в кръвта (плазма и еритроцити), в клетките и междуклетъчните пространства на други тъкани.
27 Буферните системи на кръвта са представени от буферни системи от плазма и буферни системи от еритроцити. Буферни системи от кръвна плазма Хидрокарбонат 35% Протеин. 7% Фосфат 2% pH = 7,4 44% Ролята на последния е незначителна. Те представляват 44% от буферния капацитет на кръвта. Буферни системи на еритроцитите pH = 7,25 хемоглобин 35% хидрокарбонат 18% 56% Система от органични фосфати 3% Техният дял представлява 56% от буферния капацитет на кръвта.
28 ХИДРОКАРБОНАТНА БУФЕРНА СИСТЕМА Бикарбонатната буферна система представлява 53% от общия буферен капацитет на кръвта (35% в плазмата, 18% в еритроцитите). Почти невъзможно е директно да се измери концентрацията на въглеродна киселина в кръвта. Следователно, вместо да въвежда концентрацията на въглероден диоксид в уравнението на Хендерсън-Хаселбах, това уравнение приема следната форма: pH = 6,1 + log, където pk = log (n 2 CO 3) = 6,1
29 Парциалното налягане на CO 2 въглероден диоксид на практика се измерва в кръвта Концентрацията на CO 2 , разтворен в плазмата, се изчислява като се умножи по константата на разтворимост на CO 2. Ако е изразена в килопаскали (kPa), текущата константа е 0,23 , ако в мм. rt. Изкуство. 0,03 Следователно, ако Р СО 2 е изразено в kPa, уравнението приема следния вид: рн = 6,1 + log Парциалното налягане на СО 2 в кръвната плазма е нормално ~ 5,3 kPa (40 mm Hg), което съответства на концентрацията CO 2 ~ 1,2 mmol / l.
30 Парциалното налягане на CO 2 в кръвната плазма е нормално ~ 5,3 kPa (40 mm Hg), което съответства на концентрация на CO 2 от ~ 1,2 mmol/L. Концентрацията на бикарбонатни йони в извънклетъчната течност при Р СО 2 = 5,3 kPa е равна на 24 mmol / l. Съотношението в извънклетъчната течност [HCO - 3] / [CO 2] (и двете стойности в mmol / l) е 20: 1. Според уравнението на Хендерсън-Хаселбах това съотношение съответства на рН на кръвната плазма, равно на 7,4: рН = 6,1 + log24 / 1,2 = 6,1 + log20 = 6,1 + 1,3 = 7,4 Така активната реакция на плазмата на артериалната кръвта при здрави хора отговаря на pH = 7,40.
31 Тъй като в кръвта има повече бикарбонати, буферната система на кръвта е много по-висока за киселини, отколкото за основи. Има страхотно биологично значениеот в процеса на метаболизма се образуват повече киселини, отколкото основи. Концентрацията определя резервната алкалност на кръвта. Алкалния резерв на кръвта се определя от обема въглероден диоксид, който се абсорбира от 100 cm 3 кръв при контакт с газова смес, съдържаща 5,5% CO 2 при налягане от 40 mm Hg, което съответства на налягането на въглеродния диоксид в дробовете. В кръвта алкалния резерв е 50-65% (обемно) CO 2.
32 Намаляване на съотношението:< 20 является причиной ацидоза. Различают газовый инегазовый ацидоз. Ацидоз газовый возникает при высокой концентрации СО 2 во вдыхаемом воздухе, заболевании органов дыхания (пневмония), угнетение дыхательного центра (анестетики, седативные препараты). Негазовый ацидоз возникает при накоплении нелетучих продуктов обмена, при ожогах и воспалительных процессах. Повышение соотношения [НСО 3- ]/ [СО 2 ]>20 води до алкалоза.
33 Газова алкалоза Пневмония, астма Последица от хипервентилация, включително при интензивна вентилация на белите дробове (намалена концентрация на CO 2). Негазова алкалоза Загуба на големи количества HCl по време на повръщане Екскреция на големи количества H + при прием на диуретици Приложение на големи количества NaHCO 3 Дългосрочен прием на минерална вода с голяма сода. алкали
34 Основни клинични прояви при ацидоза и алкалоза Ацидоза: Инхибиране на централната нервна система, при рН под 7, инхибирането достига такава степен, при която се губи ориентация; лицето изпада в кома; Повишено дишане с цел отстраняване на въглеродния диоксид, като адаптивна реакция Алкалоза: свръхвъзбуждане нервна система, което е придружено от тетонични (конвулсивни) контракции; смърт може да настъпи от тетонично свиване на дихателните мускули
35 Корекция на киселинно-алкалното състояние на тялото. Като спешна помощ при ацидоза се използва интравенозна инфузия на разтвори на натриев бикарбонат, но когато се прилага, в резултат на неутрализиране на to-you се отделя CO 2, което намалява ефективността на агента. Този недостатък е лишен от тризамин, който свързва излишните протони: H 2 N-C (CH 2 OH) 3 + H + H 3 N + -C (CH 2 OH) 3. Натриевият лактат се използва и като средство за коригиране на ацидозата. За да се елиминират явленията на алкалоза, разтворът на аскорбинова киселина се използва като една от временните мерки.
36 Промяна в pH е възможна и в други среди на тялото, например в различни части на храносмилателния тракт, особено в стомаха. При ниска киселинност на стомашния сок се предписва разредена солна киселина, с повишени различни антиацидни препарати: основен магнезиев карбонат Mg (OH) 2 4 MgCO 3 H 2 O, магнезиев оксид, калциев карбонат и калмагин (гранули, съдържащи основен магнезиев карбонат и натриев бикарбонат ) ... Фармакологичното действие на всички изброени средства се основава на р-неутрализация
37 Хемоглобинова буферна система Хемоглобиновата буферна система се намира само в еритроцитите. Механизмът му на действие е свързан с добавянето и освобождаването на кислород. В тази връзка хемоглобинът (Hb) е окисил HHBO 2 и редуцира HHB форми. ННв + О 2 ННвО 2 Н + + HbO - 2 киселина ННв Н + + Нв киселинно конюгирана основа Механизъм на действие въз основа на реакции: конюгирана основа
38 HbO - 2+ H + HHbO 2 HHb + O 2 основа HHbO 2 киселина HHb + OH HbO H 2 O + OH HB + H 2 O киселина Hb + H + HHb основа силна алкална основа предизвиква защитна реакция на буферната система за поддържане постоянна стойност на рН на средата, което се обяснява със свързването на добавените Н + и ОН и образуването на слабо дисоцииращи електролити.
39 Хемоглобиновата буферна система в тялото функционира ефективно само в комбинация с хидрокарбонатната система. 1. Кръвна плазма В кръвната плазма, благодарение на хидрокарбонатната буферна система, протичат редица реакции, в резултат на които се образува въглероден диоксид. H 2 CO 3 + OH - H 2 O + HCO 3 - HCO 3 + H + H 2 CO 3 CO 2 H 2 O От кръвната плазма CO 2 дифундира в еритроцитите, където ензимът карбоанхидраза катализира взаимодействието си с вода, образувайки карбонова киселина. 2. Еритроцити H 2 O + CO 2 H 2 CO 3
40 В еритроцитите концентрацията на бикарбонатните йони нараства по схемата: Нв - + Н 2 СО 3 ННв + НСО - 3 Получените хидрокарбонатни йони дифундират в извънклетъчната течност. Венозната кръв се връща в белите дробове, хемоглобинът реагира с кислород и се образува оксихемоглобин. 3. Бели дробове Оксихемоглобинът реагира с хидрокарбонатни йони ННв + О 2 ННвО 2; ННвО 2 + НСО 3- НвО 2- + Н 2 СО 3 Н 2 СО 3 Н 2 О + СО 2 От белите дробове СО 2 се отстранява в атмосферата поради белодробна вентилация. Това по принцип е механизмът за поддържане на киселинно-алкалния баланс.
41 Протеинови буферни системи Протеиновите буферни системи са амфолитични, т.к те са съставени от α аминокиселини, съдържащи групи с киселинни свойства (COOH и NH + 3) и основни свойства (COO и NH 2). Механизмът на действие на такава буферна система може да бъде представен по следния начин: киселинна буферна система a) H 3 N + R COOH + OH H 3 N + R COO + H 2 O протеинова киселина b) H 3 N + R COO + H + H 3 N + R COOH киселина протеинова сол (конюгирана основа)
42 основна буферна система а) H 2 NR COO + H + H 3 N + R COO протеинова база б) H 3 N + R COO + OH H 2 NR COO + H 2 O протеинова сол на основата (конюгирана киселина), където R е макромолекулен остатък катерица. Ролята на протеините в кръвната плазма в хомеостазата на водородните йони е много малка. Фосфатна буферна система Фосфатната буферна система се намира както в кръвта, така и в клетъчната течност на други тъкани, особено в бъбреците.
43 В клетките той е представен от KH 2 PO 4 и 2 HPO 4, в кръвната плазма и междуклетъчното пространство - NaH 2 PO 4 и Na 2 HPO 4. Основна роля в механизма на действие на тази система играе йонът H 2 PO - 4: H 2 PO - 4 H + + H 2 PO 2-4 киселина рез. база Увеличаването на концентрацията на Н + води до изместване на реакцията наляво, т.е. до образуване на киселина: HPO 2-4 H + + H 2 PO - 4 acid res. база Фосфатен буфер на кръвта е в тясна връзка с бикарбонат. Н 2 СО 3 + НРО 2-4 Na НСО 3 + Н 2 РО - 4 в кръвта в урината
44 Амониева буферна система Образува се в бъбреците от глутамин под въздействието на глутаминаза в реакцията на окислително дезаминиране. NH 3 H + NH + 4 poh = pk + lg NH 4 OH + R COOH R COONH 4
45 Използването на BS в други области Буферни разтворипочвите предотвратяват прекомерното повишаване на киселинността или алкалността, като по този начин създават и поддържат условия за живот на растенията. Създаване на среда с определена pH стойност в научни изследвания в много технологични производствени процеси. За поддържане на постоянството на стойностите на електрохимичния потенциал на системите се използват BS, чиито действия са в равновесие.
Основни въпроси: 1. Буферни системи, състав и механизъм на тяхното действие 2. Ацетатни, фосфатни, амонячни, хидрокарбонатни, хемоглобинови буфери 3. Изчисляване на pH на буферните разтвори. 4. Буферен капацитет и фактори
БУФЕРНИ СИСТЕМИ. 1. Дефиниция, класификация, състав на буферната система. 2. Механизмът на буферно действие. 3. Извеждане на формулата за pH буферни системи. 4. Свойства на буферните системи: влияние върху съотношението на pH
РУСКИ НАЦИОНАЛЕН ИЗСЛЕДОВАТЕЛСКИ МЕДИЦИНСКИ УНИВЕРСИТЕТ Обща и биоорганична химия Лекционен курс за студенти от медицински, педиатрични, московски и дентални факултети Тема 6
ЛЕКЦИИ 910. Буферни системи. 1 Буферни системи съвкупност от няколко вещества в разтвор, които го дават буферни свойства, т.е. способността да издържат на промяна в активната реакция на средата (ph) при разреждане,
Федерална държавна бюджетна образователна институция висше образованиеВОРОНЕЖКИ ДЪРЖАВЕН АГРАРЕН УНИВЕРСИТЕТ НА ИМЕТО НА ИМПЕРАТОР ПЕТЪР I Катедра по химия Референтен доклад за неорганични
Тема на урока: БУФЕРНИ РЕШЕНИЯ. Целта на урока. Да овладее представите за състава, класификацията и механизма на действие на буферните системи. Научете се да прилагате теоретичния материал за изчисляване на pH и буфер
Държавно бюджетно образователно заведение за висше професионално образование "Иркутски ДЪРЖАВЕН МЕДИЦИНСКИ УНИВЕРСИТЕТ" на Министерството на здравеопазването Руска федерацияотдел
МИНИСТЕРСТВО НА ОБРАЗОВАНИЕТО И НАУКАТА НА РУСКАТА ФЕДЕРАЦИЯ НОВОСИБИРСКИ ДЪРЖАВЕН УНИВЕРСИТЕТ СПЕЦИАЛИЗИРАН УЧЕБНО-НАУЧЕН ЦЕНТЪР Химическо равновесие в разтворите Новосибирск 01 КИСЕЛИНО-ОСНОВНА
4. Концепцията за буферни разтвори. Определение на буферните системи и тяхната класификация Много реакции в разтвора протичат в правилната посока само при определена концентрация на Н+ йони. Промяна на това
Пример .. Изградете диаграма на разпределение за разтвор на фосфорна киселина в диапазона на рН, 0,0. Изчислете моларните фракции на частиците при pH =, 5, 9 ,. Равновесие в разтвор на фосфорна киселина:
Федерална държавна бюджетна образователна институция за висше образование ВОРОНЕЖСКИЯ ДЪРЖАВЕН АГРАРЕН УНИВЕРСИТЕТ НА ИМЕТО НА ИМПЕРАТОР ПЕТЪР I Катедра по химия Абстрактен доклад Биологичен
ХИДРОЛИЗА Общи понятия Хидролизата е обменна реакция на взаимодействието на вещества с вода, водеща до тяхното разлагане. Неорганични и органична материяразлични класове.
2 3 ВЪВЕДЕНИЕ Високо нивознания, академична и социална мобилност, професионализъм на специалистите, готовност за самообразование и самоусъвършенстване е изискване на днешния ден. Относно
МИНИСТЕРСТВО НА ЗДРАВЕОПАЗВАНЕТО НА УКРАЙНА НАЦИОНАЛЕН МЕДИЦИНСКИ УНИВЕРСИТЕТ ХАРКИВ БУФЕРНИ СИСТЕМИ, ТЕХНАТА БИОЛОГИЧНА РОЛЯ Насоки за самостоятелна работаСтуденти 1-ви курс по дисциплината
Индивидуален домашна работа 5. ВОДОРОДЕН ИНДИКАТОР НА ОКОЛНАТА СРЕДА. ХИДРОЛИЗА НА СОЛИ ТЕОРЕТИЧНА ЧАСТ Електролитите са вещества, които провеждат електрически ток. Процесът на разлагане на вещество на йони под действието на разтворител
Държавно бюджетно образователно заведение за висше професионално образование МОСКОВСКИЙ ДЪРЖАВЕН МЕДИЦИНСКИ ЗЪЕМАТЕЛЕН УНИВЕРСИТЕТ на Министерството на здравеопазването и социалното развитие
Семинар 1. Равновесие в хомогенна система, киселинно-алкален баланс, използване в титриметрия (авт. д-р Моногарова О.В.). Аналитична химия е науката за определяне на химичния състав на веществата
Урок 5 ВОДОРОДЕН ИНДИКАТОР НА ОКОЛНАТА СРЕДА. ХИДРОЛИЗА НА СОЛИ Тема на уроците 1. Въвеждащ контрол по тема „Водороден индикатор на околната среда. Хидролиза на соли". 2. Семинар на тема „Метаболитни реакции на електролитите. водород
Буферни системи на кръвта (от англ. buffer, buff за смекчаване на въздействието) физиологични системи и механизми, които осигуряват киселинно-алкална. 43765414836 Буферни системи, буферни разтвори, буферни смеси, системи,
УРОК 5 ВОДОРОДЕН ИНДИКАТОР НА ОКОЛНАТА СРЕДА. ХИДРОЛИЗА НА СОЛИ ТЕОРЕТИЧНА ЧАСТ Електролитите са вещества, които провеждат електрически ток. Процесът на разлагане на вещество на йони под действието на разтворител се нарича електролитен
Обща химия Студент: Група: Дата на доставка: Цел на работата: Лабораторна работа 8 ЕЛЕКТРОЛИТНИ РАЗТВОРИ Опит 1. Зависимост на електропроводимостта на разтворите от степента на дисоциация на електролитите Основни понятия:
МИНИСТЕРСТВО НА ОБЩЕСТВЕННОТО ЗДРАВЕОПАЗВАНЕ НА УКРАЙНА
3 Електролитни разтвори Течните разтвори се разделят на електролитни разтвори, способни да провеждат електрически ток, и неелектролитни разтвори, които не са електропроводими. В неелектролити, разтвореното
Лекция 6 Киселинно-алкални равновесия 1 План на лекцията 1. Общи свойства на химичното равновесие. 2. Електролитна дисоциация. Киселини и основи според Арениус. 3. Киселинност на разтворите. тел. Константи
Хидролиза. Продуктът на разтворимостта Тема 11 Условия за реакция между електролити Реакциите в електролитни разтвори са реакции между йони Предпоставкапротичането на реакциите в разтворите
Лекция 5 Протолитични равновесия в солеви разтвори (хидролиза). Буферни разтвори. Равновесие на седиментния разтвор. Продукт на разтворимост. ПРОТОЛИТНО РАВНОВЕСИЕ В СОЛЕНИ РАЗТВОРИ ВЗАИМОДЕЙСТВИЕ ХИДРОЛИЗА
Какво представляват КИСЕЛИНА и БАЗА? ОСНОВНИ КИСЕЛИНИ БАЛАНСИ Животът не е борба срещу греха, не срещу силата на парите, а срещу водородните йони Arrhenius, 1894 Bronsted-Lowry, 1923 Lewis, 1923
1. Теоретична основаметод Лекция 2 Киселинно-алкален метод Методът се основава на реакцията на неутрализация: H + + OH - H 2 O Методът се използва за количествено определяне на киселини и основи, както и
Задачи за изпита по дисциплина "Обща и неорганична химия" Начини за изразяване на концентрацията на разтворите. Киселинно-алкално титруване. 1. В медицинската практика често се използва 0,9% разтвор на NaCl
РУСКИ ИКОНОМИЧЕСКИ УНИВЕРСИТЕТ на името на Г. В. ПЛЕХАНОВ Неорганична химия ТЕМА: Електролитна дисоциация
1. Доцент в катедра Обща и неорганична химия, НИТУ "МИСиС", к.х.н. Марина Нораировна Тер-Хакобян 2. Местообитание на киселини и основи - вода Водата е най-важна Химическо веществона
18. Йонни реакции в разтвори Електролитна дисоциация. Електролитната дисоциация е разграждането на молекули в разтвор за образуване на положително и отрицателно заредени йони. Пълнотата на разпадането зависи
1. Какъв е зарядът на ядрото на въглероден атом? 1) 0 2) +6 3) +12 4) -1 2. Какво общо имат атомите 12 6C и 11 6C? 1) Масово число 2) Брой протони 3) Брой неутрони 4) Радиоактивни свойства
ЗАДАЧИ ОТ I (КВАЛИФИКАЦИОНЕН) ЗАПОДЕН ЕТАП НА ОЛИМПИАДАТА „МЛАДИТЕ ТАЛАНТИТЕ НА КАМИЯТА. ХИМИЯ „2008/2009 УЧЕБНА ГОДИНА Трябва да отговорите на задачите във файла с отговори! В задачи 1-19 трябва да изберете една или повече
Теоретични основи на дисциплината "Структурна биохимия" Преподавател Светлана Бобкова, д.х.н. Тема: Структурата на водата. Физически свойствавода. Дисоциация на водата. Йонен продукт на водата.
Разтвори (3) Равновесия в електролитни разтвори. pH и PR Лекция от курса "Обща и неорганична химия" за 11 клас на SUNC Киселинно-алкални равновесия в разтвори Според Арениус: Електролитът се нарича киселина,
Неорганична химия Цел на работата: Студент: Група: Дата на работа: Лабораторна работа ЕЛЕКТРОЛИТНИ РАЗТВОРИ Опит 1. Електропроводимост на разтвори на силни и слаби електролити Основни
РАЗДЕЛ II. АНАЛИТИЧНА ХИМИЯ Задача 1 (от PV Chulkin) 1. За да опростим решението, изразяваме състава на амофоса чрез един параметър a: a (nh) 2 HPO (1 a) (nh) H 2 PO. Моларната маса е M = 132a 115 (1 a)
Решение на вариант 2 1. Електронната конфигурация на O 2 аниона (1s 2 2s 2 2p 6) има катиони Na, Mg 2. 2. Моларна маса на просто вещество Просто вещество силиций Si. M = ρ V m = 2,33 12,1 = 28 g / mol. 3.
Хидролиза на соли Работата е извършена от учителя от най-висока категория В. Б. Тимофеева. Какво е хидролиза Хидролизата е процес на метаболитно взаимодействие на сложни вещества с вода Хидролиза Взаимодействието на солта с водата, като резултат
СВОЙСТВА НА РАЗТВОРИТЕ Разтворите са хомогенни (хомогенни) системи, състоящи се от два или повече компонента (компоненти), чиито количества могат да варират в широки граници. Разтворът се състои от разтворени
Ахинович Олга Владимировна Доктрината за разтворите Разтворите са разтворителят е разтворено вещество - Пример: Водата е разтворител, ако разтворите твърдо вещество (глюкоза) или газ (CO 2). - И ако
Федерална агенция по образованието Ярослав Мъдри Новгородски държавен университет Катедра по химия и екология Буфер с Методологични указания за лабораторни работи Велики Новгород 2006 г.
Негребецки 2008 2010 Лекция 5 Процеси в решения. Протолитични равновесия ВАЖНИ КОНЦЕПЦИИ Процеси в разтвори 5.1 Негребецки 2008 2010 1. Равновесия във водни разтвори. Хидратация на йони. полярност
ЛЕКЦИЯ 5 План на лекцията :. Протолитични равновесия в солеви разтвори (хидролиза на соли) .. Групов реагент за третата аналитична група и неговия механизъм на действие .. Групов реагент за втора аналитична група.
Въпроси на диференциалния кредит по медицинска химия за студенти от медицински и дентални факултети 1. Киселинно-алкални равновесия и комплексообразуване в биологични разтвори. 1. Биогенен
Решение на вариант 1 1. Електронната конфигурация на катиона Al 3+ (1s 2 2s 2 2p 6) се притежава от аниони F, O 2. 2. Моларна маса на просто вещество Просто вещество злато Au. 3. ClCH 2 CH 2 CH 2 CH 2 CH 2 CH 3;
1 Теория. Йоно-молекулярни уравнения на йонообменните реакции Йонообменните реакции се наричат реакции между електролитни разтвори, в резултат на които те обменят своите йони. Йонни реакции
Министерство на здравеопазването на Република Молдова държавен университетМедицина и фармация Николае Тестемитану Факултет по фармация обща химияГ. В. БУДУ, С. В. МЕЛНИК АНАЛИТИЧЕСКА
ФЕДЕРАЛНА АГЕНЦИЯ ЗА ОБРАЗОВАНИЕ Държавно учебно заведение за висше професионално образование "ТОМСКИЙ ПОЛИТЕХНИЧЕСКИ УНИВЕРСИТЕТ" ОДОБРЕН Декан HTF VM_Pogrebenkov 2007г.
Основните положения на теорията на електролитната дисоциация Фарадей Майкъл 22. IX.1791 25.VIII. 1867 английски физик и химик. През първата половина на 19 век. въвежда понятието електролити и неелектролити. Вещества
1. Основните свойства се проявяват от външния оксид на елемента: 1) сяра 2) азот 3) барий 4) въглерод 2. Коя от формулите отговаря на израза за степента на дисоциация на електролитите: 1) α = n \ n 2) V m = V \ n 3) n =
1 МОДУЛ 1 ОБЩИ ТЕОРЕТИЧНИ ОСНОВИ НА АНАЛИТИЧНАТА ХИМИЯ. ТЕМА ЗА КАЧЕСТВЕН АНАЛИЗ: КИСЕЛИНО-ОСНОВНОТО РАВНОВЕСИЕ И РОЛЯТА ИМ В АНАЛИТИЧНАТА ХИМИЯ (В АНАЛИТИКАТА). БУФЕРНИ СИСТЕМИ ЛЕКЦИЯ 5 ЦЕЛ: ДА ОФОРМАТ
1. Кое от изброените е най-типичното неметално? 1) Кислород 2) Сяра 3) Селен 4) Телур 2. Кой от изброените елементи има най-голяма електроотрицателност? 1) Натрий
Министерство на образованието на Руската федерация Източносибирски държавен технологичен университет Комплексни тестови задачи по обща и неорганична химия Методическа разработказа себе си
1 Лекция 14 Йонни реакции Химичните реакции в електролитни разтвори се свеждат до обмен на йони. Тези реакции се характеризират с много висока честота. В хода на йонообменните реакции окислителни състояния
1 ЛЕКЦИЯ План на лекцията: 1. Основни положения на теорията на електролитните разтвори. Общата (аналитична) концентрация и активност на йони в разтвор, тяхната връзка .. Скоростта на химичната реакция и химичното равновесие.
ДЪРЖАВНА ИНСТИТУЦИЯ ЗА ВИСШЕ ПРОФЕСИОНАЛНО ОБРАЗОВАНИЕ "БЕЛОРУСКО-РУСКИ УНИВЕРСИТЕТ" Катедра "Метални технологии" ХИМИЯ Насокина практическо обучение за студенти
ЛЕКЦИЯ 3 План на лекцията: 1. Поведение на силни и слаби едноосновни киселини във водни разтвори. 2. Поведение на силни и слаби еднокисели основи във водни разтвори. 3. Поведение на силни и слаби многоосновни
Лекция 14 Метаболитни реакции в електролитни разтвори. Продукт на разтворимост. Дисоциация на водата. Хидролиза на соли Основни понятия: йонообменни реакции, йонно-молекулярни уравнения, продукт на разтворимост
РЕШЕНИЯ на олимпиадата "БЪДЕЩЕТО НА КУЗБАС" по химия 1. Извършете трансформациите: Mg MgO MgSO 4 Mg (OH) 2 Mg (OH) Cl MgCl 2 Li Li 2 O LiOH LiH 2 PO 4 Li 2 HPO 4 Li 3 PO 4 La La 2 O 3 La (OH) 2 NO 3 La (OH) 3
1 ЛЕКЦИЯ 5 КЛИНИЧНА ПАТОФИЗИОЛОГИЯ НАРУШАВАНЕ НА СЪДЪРЖАНИЕТО НА КИСЕЛИННО-ОСНОВНО СЪДЪРЖАНИЕ 1. ВЪВЕДЕНИЕ 2. ОБЩА ИНФОРМАЦИЯ ЗА ACV 3. ЗНАЧЕНИЕ НА КИСЕЛИННАТА КОНСТАНТА ЗА ОРГАНИЗАЦИЯ 4. ПОСЛЕДСТВИЯ ОТ ПОСЛЕДСТВИЯ
ХИМИЯ. ОБЩА И НЕОРГАНИЧНА ХИМИЯ. ХИДРОЛИЗА НА СОЛИ ХИДРОЛИЗА НА СОЛИ При изследване на ефекта на универсален индикатор върху разтворите на някои соли може да се отбележи следното: Както виждаме, средата на първия
Водороден индекс ph Показатели Същност на хидролизата Видове соли Алгоритъм за съставяне на уравнения за хидролиза на соли Хидролиза на различни видове соли Методи за потискане и засилване на хидролизата Тест разтвор B4 Водород
1. Дайте примери за използване на реакции на комплексообразуване в киселинно-алкалния метод за анализ. Запишете уравненията на реакцията. Използват се реакциите на комплексообразуване на киселинно-алкалния метод за анализ
Етап на пълен работен ден. 11 клас. Решения. Задача 1. Смес от три газове A, B, Cима водородна плътност 14. Порция от 168 g от тази смес се прекарва през излишък от бромен разтвор в инертен разтворител
ТИТРОВАНА КРИВА е графика на зависимостта на системен параметър, свързан с концентрацията на титруваното вещество, титрант или реакционен продукт, от степента на процеса на титруване (например от количеството
Сборник със задачи по химия за 9-ти медицински клас, съставен от И.А. Московски образователен център 109 2012 Масова част на разтворено вещество. 1. 250 g разтвор съдържа 50 g натриев хлорид. Определете
Класифицирайтенеговия състав и естество на компонентите.
Моля посочетедиапазонът от стойности на pH, в който тази система има буферен капацитет.
пишетереакционни уравнения, отразяващи механизма на неговото действие (йонна форма).
Обяснетезащо амонячната буферна система не е част от кръвта
1. Състав и естество на компонентите:
A) NH 4 OH (NH 3 x H 2 O) -амониев хидроксид, слаб електролит
Б) NH 4 C1 - сол, амониев хлорид, силен електролит.
Амониевият хидроксид е слаб електролит; в разтвор той частично се дисоциира на йони:
NH4OH<=>NH 4 + + OH-
Когато амониев хлорид се добави към разтвора на амониев хидроксид, солта като силен електролит почти напълно се дисоциира на йони:
NH 4 C1> NH 4 + + C1-
и потиска дисоциацията на основата, чието равновесие се измества към обратната реакция.
- Диапазонът от стойности на pH, в който разглежданата система има буферен капацитет, се изчислява по формулата:
където KB е константата на дисоциация на NH 4 OH = 1,8 * 10 -5, C 0 е основната концентрация, Cc е концентрацията на сол.
pH = 14-4,74 + log (C0/Cc) = 9,26 + log (C0/Cc). В зависимост от съотношението C 0 / Cc, диапазонът на pH е 8,26-10,26.
- Способността на амонячния буфер да поддържа почти постоянно pH на разтвора се основава на факта, че компонентите, включени в тях, свързват H + и OH- йони, въведени в разтвора или образувани в резултат на реакцията, протичаща в този разтвор . Когато към амонячната буферна смес се добави силна киселина, йони H + ще се свържат с молекули или амониев хидроксид, а не ще увеличат концентрацията на H + йони и ще намалят pH на разтвора:
NH4OH + H + = NH4 + + H2O
Когато се добави алкали, йони OH - ще свържат NH 4 + йони, като по този начин образуват леко дисоциирано съединение, а не повишават pH на разтвора:
NH4 + + OH - = NH4OH
- Амонячната буферна система не е включена в състава на кръвта TOP RT, тъй като диапазонът от стойности на pH, в който ще има буферен капацитет, е в алкалната област (pH по-голямо от 8). Нормалното рН на кръвната плазма е 7,40 ± 0,05, тоест под буферната зона.
1. 3)пишетесхемата на реакцията на взаимодействието на етанал с метиламин.
Описваммеханизъм на тази реакция.
Оправдавамролята на киселинния катализатор.
Обяснетевъзможността за реакция на хидролиза на получения имин в кисела и алкална среда.

2. Механизмът на тази реакция е нуклеофилно добавяне, последвано от елиминиране на водна молекула

3. Ролята на киселинния катализатор - протониране в етап а)
4. В присъствието на разредени киселини имините се хидролизират с вода до образуване на карбонилни съединения и амини, тази реакция е обратната на реакцията за синтеза на имини:

В присъствието на алкали хидролизата не се извършва
Билет 4.
Термодинамична система (ТМ) -това е всеки реален обект, изолиран от околната среда с цел изучаване на процесите на обмен на енергия и енергия между съставните му части, както и между него и околната среда с помощта на термодинамични методи
Класификация на термодинамичните системи
3. Отвориобменяйте както материя, така и енергия с ОС (организъм, открит съд с вряща вода)
4. Затворен- обменя с ОС само енергия под формата на топлина или работа (газ в затворен цилиндър)
5. изолиран- не обменяйте нищо или енергия. В природата няма абсолютно изолирани хора.
Чрез наличието на интерфейс вътре в превозното средство
1.Хомогенна- няма интерфейс, всички компоненти са във водна фаза, всички физични и химични вещества във всяка част от обема са еднакви (смес от газове)
2. Хетерогенен-съдържа интерфейса, разделящите части на системата (фази) са различни според sv-you (кръв)
Параметри- количества, които определят състоянието на МПС
Възможно директно измерване
Основните параметри са параметри, които могат да бъдат измерени с помощта на подходящи устройства (m, V, C, плътност, обем)
Функции на състоянието - вътрешна енергия E (U); енталпия (H); ентропия (S); енергия на Гибс (G); свободна енергия или енергия на Хелмхолц
Можете да дефинирате промяната в стойностите на функцията за състояние
∆X (X 2 -X 1), КЪДЕТО X-U, H, S, G, H
Термодинамично състояние-набор от стойности на определен брой физически. стойности, характеризиращи всички физически и hm sv-va системи
Видове състояния:
Неравновесие - параметрите се променят спонтанно (чаша гореща вода)
Параметрите на равновесието не се променят без външни влияния
Постоянен = постоянство на параметрите, дължащи се на външни параметри (присъщи на живите организми)
процес-преход на системата от едно състояние в друго, придружено от промени в термодинамичните параметри.
класификация-
според постоянството на параметрите:
А) изохоричен (v = const)
B) Изобарна (налягане - const)
C) изотермичен (температура = const)
По знака на топлинния ефект:екзотермични и ендотермични
По разход на енергия: спонтанен, неспонтанен
По естество на курса:-реверсивен - поток в посоки напред и назад през едни и същи етапи, без промени в околната среда. заобикаляща среда.
Необратимо - всички процеси не могат да протичат в права и обратна посока през едни и същи етапи.
Буферен механизъм (например амонячен буфер)
Нека разгледаме механизма на действие на буферната система, като използваме примера на амонячна буферна система: NH 4 OH (NH 3 x H 2 O) + NH 4 C1.
Амониевият хидроксид е слаб електролит; в разтвор той частично се дисоциира на йони:
NH4OH<=>NH 4 + + OH -
Когато амониев хлорид се добави към разтвора на амониев хидроксид, солта, като силен електролит, почти напълно се дисоциира на йони NH 4 C1> NH 4 + + C1 - и потиска дисоциацията на основата, равновесието на която се измества към обратната реакция. Следователно, C (NH4OH)? C (база); и С (NH4+)? C (сол).
Ако в буферен разтвор C (NH 4 OH) = C (NH 4 C1), тогава pH = 14 - pKosn. = 14 + log 1.8.10-5 = 9.25.
Способността на буферните смеси да поддържат почти постоянно pH на разтвора се основава на факта, че компонентите, включени в тях, свързват H + и OH- йони, въведени в разтвора или образувани в резултат на реакцията, протичаща в този разтвор. Когато към амонячната буферна смес се добави силна киселина, йони H + ще се свържат с молекули на амоняк или амониев хидроксид, а не ще увеличат концентрацията на H + йони и ще намалят pH на разтвора.
Когато се добави алкали, йони OH - ще свържат NH 4 + йони, като по този начин ще образуват слабо дисоциирано съединение и няма да повишат pH на разтвора.
Буферното действие се прекратява веднага щом една от съставните части на буферния разтвор (конюгирана основа или конюгирана киселина) се изразходва напълно.
За количествено определяне на способността на буферния разтвор да устои на влиянието на силни киселини и основи се използва количество, наречено буферен капацитет. С увеличаване на концентрацията на буфера, способността му да устои на промени в рН поради добавяне на киселини или основи се увеличава.
Свойството на разтворите да поддържат стойността на pH в определени граници при добавяне на малки количества киселина или алкали се нарича буфериране. Буфериращите решения се наричат буфери.
За случая на титруване: оксалова киселина и калиев хидроксид, начертайте кривата на титруване, посочете случая на титруване, скок на титруване, точка на еквивалентност, използвани индикатори
Скок на титруване: pH = 4-10. Максималната грешка в % е по-малка от 0,4.
Показатели - тимолфталеин, фенолфталеин.
Редуктор, какви елементи периодична системаелементите могат да бъдат редуктори и защо?
Редуциращ агент е вещество, което дарява електрони по време на реакцията, т.е. окислява.
Редуциращите агенти могат да бъдат неутрални атоми, отрицателно заредени йони на неметали, положително заредени метални йони в най-ниско окислително състояние, комплексни йони и молекули, съдържащи атоми в междинно окислително състояние.
Неутрални атоми. Типичните редуциращи агенти са атоми с 1 до 3 електрона на външно енергийно ниво. Тази група редуциращи агенти включва метали, т.е. s-, d - и f-елементи. Неметали като водород и въглерод също проявяват редуциращи свойства. При химичните реакции те даряват електрони.
Атомите с нисък йонизационен потенциал са силни редуциращи агенти. Те включват атомите на елементите от първите две основни подгрупи на периодичната таблица на елементите на D.I. Менделеев (алкални и алкалоземни метали), както и Al, Fe и др.
В основните подгрупи на периодичната таблица редуцируемостта на неутралните атоми се увеличава с увеличаване на радиуса на атомите. Така, например, в серията Li - Fr, по-слабият редуктор е Li, а най-силният е Fr, който обикновено е най-силният редуктор от всички елементи на периодичната таблица.
Отрицателно заредени йони на неметали. Отрицателно заредените йони се образуват чрез прикрепване на един или повече електрони към неутрален неметален атом:
Така, например, неутралните атоми на сярата, йода, имащи 6 и 7 електрона на външните нива, могат да прикрепят съответно 2 и 1 електрона и да се превърнат в отрицателно заредени йони.
Отрицателно заредените йони са силни редуциращи агенти, тъй като при подходящи условия те могат да даряват не само слабо задържаните излишни електрони, но и електрони от външното си ниво. Освен това, колкото по-активен е неметалът като окислител, толкова по-слаба е неговата редукционна способност в състояние на отрицателен йон. Обратно, колкото по-малко активен е неметалът като окислител, толкова по-активен е той в състояние на отрицателен йон като редуциращ агент.
Редукционната способност на отрицателно заредените йони при същия заряд се увеличава с увеличаване на радиуса на атома. Следователно, например, в групата на халогените йодният йон има по-голяма редукционна способност от бромните и хлорните йони, а флуорът не проявява никакви редукционни свойства.
Положително заредени метални йони в най-ниско окислително състояние. Металните йони в най-ниско окислително състояние се образуват от неутрални атоми в резултат на връщането само на част от електроните от външната обвивка. Така, например, атомите на калай, хром, желязо, мед и церий, взаимодействайки с други вещества, могат първо да дадат минимален брой електрони.
Металните йони в най-ниско окислително състояние могат да проявят редуциращи свойства, ако са възможни по-високите им степени на окисление.
В уравнението на ORP подредете коефициентите, като използвате метода на електронния баланс. Посочете окислителя и редуктора.
K 2 Cr 2 O 7 + 6FeSO 4 + 7H 2 SO 4 = K 2 SO 4 + Cr 2 (SO 4) 3 + 3Fe 2 (SO 4) 3 + 7H 2 O
1 Cr 2 +6 + 3е x 2 Cr 2 +3 окислител
6 Fe +2 - 1e Fe +3 редуциращ агент
2KMnO 4 + 5H 2 S + 3H 2 SO 4 = K 2 SO 4 + 2MnSO4 + 5S + 8H 2 O
2 Mn +7 + 5е Mn +2 окислител
5 S -2 - 2e S 0 редуциращ агент