Tashqi energiya darajasi qanday aniqlanadi? Tashqi energiya darajalari: strukturaviy xususiyatlar va ularning atomlar orasidagi o'zaro ta'sirdagi roli. Mustaqil hal qilish uchun vazifalar
dan javob Kseniya Gareeva[guru]
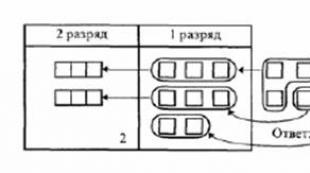
davr raqami
dan javob Slava Mikailov[yangi]
dan javob Gambling[guru]
Energiya darajasi
Vikipediyadan, bepul ensiklopediya
Energiya darajasi - kvant tizimlari, ya'ni mikrozarralardan (elektronlar, protonlar va boshqa elementar zarralar, atom yadrolari, atomlar, molekulalar va boshqalar) tashkil topgan va kvant mexanikasi qonunlariga bo'ysunadigan tizimlar energiyasining mumkin bo'lgan qiymatlari. U mikrozarrachaning ma'lum bir holatini tavsiflaydi. Elektron va yadro ichidagi energiya darajalari mavjud.
[tahrir]
Elektron energiya darajalari
Atomning orbital modelining zamonaviy kontseptsiyasi, bunda elektronlar bir energiya darajasidan ikkinchisiga o'tadi va energiya darajalari orasidagi farq chiqariladigan yoki so'rilgan kvantning hajmini belgilaydi. Bunday holda, elektronlar energiya darajalari orasidagi bo'shliqlarda bo'lolmaydi. Ushbu bo'shliqlar taqiqlangan energiya zonasi deb ataladi.
Masalan, atomning orbital modelidagi elektron - bosh kvant soni n va orbital kvant soni l qiymatlariga qarab, elektron ega bo'lgan energiya darajasi o'zgaradi. Shunga ko'ra, n va l raqamlarining har bir juft qiymatlari ma'lum bir energiya darajasiga to'g'ri keladi.
[tahrir]
Yadro ichidagi energiya darajalari
Bu atama radioaktivlikni o'rganish tufayli paydo bo'lgan. Radiatsiya uch qismga bo'linadi: alfa nurlari, beta nurlari va gamma nurlari. Tadqiqotlar shuni ko'rsatdiki, alfa-nurlanish geliy atomlaridan iborat, beta-nurlanish - tez harakatlanuvchi elektronlar oqimi va gamma nurlarini o'rganish elektron darajalarning energiyasi ularning paydo bo'lishi uchun etarli emasligini ko'rsatdi. Radioaktiv nurlanish manbasini (gamma nurlar) atom yadrosi ichidan izlash kerakligi, ya'ni energiya gamma nurlanish fotonlariga aylanadigan yadro ichidagi energiya darajalari mavjudligi aniq bo'ldi. Gamma nurlari ma'lum elektromagnit to'lqinlar spektrini kengaytirdi va 0,01 nm dan qisqa barcha to'lqinlar gamma nurlari hisoblanadi.
Ushbu misolda atomlarning molekulalarning o'lchamlari bilan qanchalik kichikligini tasavvur qilishga harakat qiling.
Keling, to'ldiramiz rezina to'p gaz. Agar sekundiga million molekula yupqa teshilish orqali to'pdan chiqadi deb faraz qilsak, barcha molekulalarning to'pdan qochishi uchun 30 milliard yil kerak bo'ladi. Ammo bitta molekulada ikki, uchta yoki bir necha o'nlab yoki hatto bir necha ming atom bo'lishi mumkin!
Zamonaviy texnologiyalar maxsus mikroskop yordamida molekulani ham, atomni ham suratga olish imkonini berdi. Molekula 70 million marta, atom esa 260 million marta kattalashtirishda suratga olingan.
Uzoq vaqt davomida olimlar atomning bo'linmas ekanligiga ishonishgan. Hatto bir so'z atom dan tarjima qilingan yunoncha anglatadi "bo'linmas". Biroq, uzoq muddatli tadqiqotlar shuni ko'rsatdiki, kichik o'lchamlariga qaramay, atomlar undan ham kichikroq qismlardan iborat ( elementar zarralar).
To'g'ri, atomning tuzilishi o'xshaydi quyosh sistemasi ?
IN atom markazi - yadro, uning atrofida elektronlar ma'lum masofada harakatlanadi
Yadro- atomning eng og'ir qismi, u atomning massasini o'z ichiga oladi.
Yadro va elektronlar bir-biriga qarama-qarshi bo'lgan, lekin kattaligi teng bo'lgan elektr zaryadlariga ega.
Yadro musbat zaryadga ega, elektronlar manfiy zaryadga ega, shuning uchun butun atom zaryadlanmaydi.
Eslab qoling
Barcha atomlar yadro va elektronga ega. Atomlar bir-biridan farq qiladi: yadroning massasi va zaryadi bilan; elektronlar soni.
Vazifa
Alyuminiy, uglerod, vodorod atomlaridagi elektronlar sonini hisoblang. Jadvalni to'ldiring.
|
· Atom nomi |
Atomdagi elektronlar soni |
|
alyuminiy atomi |
|
|
uglerod atomi |
|
|
vodorod atomi |
Atomning tuzilishi haqida ko'proq bilishni xohlaysizmi? Keyin o'qing.
Atom yadrosining zaryadi elementning tartib raqami bilan aniqlanadi.
Misol uchun , vodorodning seriya raqami 1 ga teng (Mendeleyev davriy sistemasidan aniqlanadi), bu atom yadrosining zaryadi +1 ekanligini bildiradi.
Kremniyning seriya raqami 14 (davriy jadval bo'yicha aniqlanadi), ya'ni kremniy atomi yadrosining zaryadi +14 ga teng.
Atomning elektr neytral bo'lishi uchun atomdagi musbat va manfiy zaryadlar soni bir xil bo'lishi kerak.
(nolga yig'ish).
Elektronlar soni (manfiy zaryadlangan zarralar) yadro zaryadiga (musbat zaryadlangan zarrachalar) teng va elementning tartib raqamiga teng.
Vodorod atomida 1 ta elektron, kremniyda 14 ta elektron mavjud.
Atomdagi elektronlar energiya sathidan o'tadi.
Atomdagi energiya darajalari soni davr soni bilan belgilanadi, qaysi element joylashgan (Mendeleyev davriy tizimidan ham aniqlangan)
Masalan, vodorod birinchi davrning elementi bo'lib, u bor degan ma'noni anglatadi
1 energiya darajasi, kremniy esa uchinchi davr elementidir, shuning uchun 14 ta elektron uchta energiya darajasida taqsimlanadi. Kislorod va uglerod uchinchi davrning elementlari, shuning uchun elektronlar uchta energiya darajasi bo'ylab harakatlanadi.
Vazifa
1. Atomlardagi yadroning zaryadi qanday kimyoviy elementlar rasmda ko'rsatilgan?
2. Alyuminiy atomida nechta energiya darajasi bor?
1 (2 ball). Kaliy atomidagi energiya darajalari bo'yicha elektronlarning taqsimlanishi:A. 2e, 8e, 8e, 1e B.. 2, 8,
18, 8, 1
B. 2e, 1e D. 2e, 8e, 1e
2 (2 ball). Alyuminiy atomining tashqi elektron qatlamidagi elektronlar soni:
A. 1 B. 2 C. 3 D.4
3 (2 ball). Eng aniq metall xususiyatlarga ega oddiy modda:
A. Kaltsiy B. Bariy C. Stronsiy G. Radiy
4 (2 ball). Ko'rinish kimyoviy bog'lanish oddiy moddada - alyuminiy:
A. Ion B. Kovalent qutbli
C. Metall D. Kovalent qutbsiz
5 (2 ball). Yuqoridan pastgacha bir kichik guruh elementlari uchun energiya darajalari soni:
A. Vaqti-vaqti bilan o'zgarib turadi. B. O'zgarmaydi.
B. Oshadi. G. kamayadi.
6 (2 ball). Litiy atomi litiy ionidan farq qiladi:
A. 3 yadro yonida. B. Tashqi energiya darajasidagi elektronlar soni.
B. Protonlar soni. D. Neytronlar soni.
7 (2 ball). Suv bilan eng kam kuchli reaksiyaga kirishadi:
A. Bariy. B. Magniy.
B. Kaltsiy. G. Stronsiy
8 (2 ball). Sulfat kislota eritmasi bilan o'zaro ta'sir qilmaydi:
A. Alyuminiy. B. natriy
B. Magniy. G. Mis
9 (2 ball). Kaliy gidroksid formulasi quyidagi moddalar bilan o'zaro ta'sir qilmaydi:
A. Na2O B. AlCl3
B. R2O5 D. Zn(NO3)2
10 (2 ball). Barcha moddalar temir bilan reaksiyaga kirishadigan seriya:
A. Hcl, CO2, CO
B. CO2, HCl, S
B. H2, O2, CaO
G. O2, CuSO4, H2SO4
11 (9 ball). Natriy gidroksid olishning uchta usulini taklif qiling. Javobingizni reaktsiya tenglamalari bilan tasdiqlang.
12 (6 ball). Molekulyar va ionli shakldagi reaksiya tenglamalarini tuzib, kimyoviy transformatsiyalar zanjirini bajaring, reaksiya mahsulotlarini nomlang:
FeCl2 → Fe(OH)2 → FeSO4 → Fe(OH)2
13 (6 ball). Qanday qilib har qanday reagentlar (moddalar) va rux yordamida uning oksidi, asosi, tuzi olinadi? Reaksiya tenglamalarini molekulyar shaklda yozing.
14 (4 ball). Litiy va azot oʻrtasidagi kimyoviy reaksiya tenglamasini yozing. Bu reaksiyada qaytaruvchi va oksidlovchini aniqlang
tomonidan aniqlang:
A. guruh raqami;
B. davr raqami;
B. seriya raqami.
4. Kimyoviy elementlarning qaysi belgilari asosiy kichik guruhlarda o'zgarmaydi?
Va atomning radiusi;
B tashqi darajadagi elektronlar soni;
B. energiya darajalari soni.
5. Seriya raqamlari 7 va 15 bo'lgan elementlar atomlarining umumiy tuzilishi:
A. tashqi sathdagi elektronlar soni, B. yadro zaryadi;
B. energiya darajalari soni.
Kimyoviy element belgisi (berilgan tartibda) va uning atomining tashqi energiya darajasidagi elektronlar soni o'rtasidagi muvofiqlikni o'rnating.Harflardan.To'g'ri javoblarga mos ravishda siz o'rnatish nomini tuzasiz, bu insoniyatga atom tuzilishini yanada chuqurroq bilish imkonini beradi (9 harf).
Har bir element belgisi uchun e raqami
Energiya
Mg Si I F C Ba Sn Ca Br
2 ta qopqoq o l s e m
4 a o v k a t d h i
7 v y l l n g o l r
1 (3 ball). Elektronlarning natriy atomidagi energiya darajasi bo'yicha taqsimlanishiA. 2 ē, 1 ē B. 2 ē, 4 ē C. 2 ē, 8 ē, 1 ē. G. 2 ē, 8 ē, 3 ē.
2 (4 ball) Davr raqami in Davriy tizim D. I. Mendeleyev, unda kimyoviy elementlar-metallar mavjud emas: A. 1. B. 2. C. 3. D. 4.
3 (3 ball). Oddiy kaltsiy moddasidagi kimyoviy bog'lanish turi:
A. Ionik. B. Kovalent qutbli. B. Kovalent qutbsiz. G. Metall.
4 (3 ball). Eng aniq metall xususiyatlarga ega oddiy modda:
A. Alyuminiy. B. Kremniy. B. Magniy. G. Natriy.
5 (3 ball). Yadro zaryadining ishqoriy metalldan galogengacha ortishi bilan 2-davr elementlari atomlarining radiusi: A. Vaqti-vaqti bilan o'zgarib turadi. B. O'zgarmaydi. B. Oshadi. G. kamayadi.
6 (3 ball). Magniy atomi magniy ionidan farq qiladi:
A. Yadroning zaryadi. B. Zarrachaning zaryadi. B. Protonlar soni. D. Neytronlar soni.
7 (3 ball). Suv bilan eng kuchli reaksiyaga kirishadi:
A. Kaliy. B. Litiy. B. Natriy. G. Rubidiy.
8 (3 ball). Suyultirilgan sulfat kislota bilan reaksiyaga kirishmaydi:
A. Alyuminiy. B. Bariy. B. Temir. G. Merkuriy.
9 (3 ball). Beriliy gidroksid formulasi quyidagi moddalar bilan o'zaro ta'sir qilmaydi:
A. NaOH(p p). B. NaCl(p_p). B. HC1 (r_r). D. H2SO4.
10 (3 ball). Barcha moddalar kaltsiy bilan reaksiyaga kirishadigan seriyalar:
A. CO2, H2, HC1. B. NaOH, H2O, HC1. B. C12, H2O, H2SO4. G. S, H2SO4, SO3.
B QISM. Erkin javobli topshiriqlar
11 (9 ball). Temir (II) sulfat olishning uchta usulini taklif qiling. Javobingizni reaktsiya tenglamalari bilan tasdiqlang.
12 (6 ball). X, Y, Z moddalarni aniqlang, ularning kimyoviy formulalarini yozing.
Fe(OH)3(t)= X(+HCl)= Y(+NaOH)=Z(t) Fe2O3
13 (6 ball). Oksid, amfoter gidroksidni olish uchun qanday qilib har qanday reagentlar (moddalar) va alyuminiydan foydalanish kerak? Reaksiya tenglamalarini molekulyar shaklda yozing.
14 (4 ball). Metalllarni: mis, oltin, alyuminiy, qo'rg'oshinni zichligini oshirish tartibida joylashtiring.
15 (5 ball). 160 g mis (II) oksiddan olingan metallning massasini hisoblang.
Guruch. 7. Tasvir shakllari va yo‘nalishlari
s-,p-,d-, chegara sirtlari yordamida orbitallar.
Kvant sonim l chaqirdi magnit . U atom orbitalining fazoviy joylashishini aniqlaydi va butun son qiymatlarni oladi - l ga + l nol orqali, ya'ni 2 l+ 1 qiymat (27-jadval).
Xuddi shu darajadagi orbitallar ( l= const) bir xil energiyaga ega. Bunday davlat deyiladi energiyada degeneratsiya. Shunday qilib p-orbital - uch marta, d- besh marta va f yetti marta yomonlashgan. Chegara sirtlari s-,p-,d-, orbitallar rasmda ko'rsatilgan. 7.
s -orbitallar har qanday uchun sferik simmetrik n va bir-biridan faqat sharning kattaligi bilan farqlanadi. Ularning maksimal nosimmetrik shakli at l= 0 va m l = 0.
27-jadval
Energiya pastki sathlaridagi orbitallar soni
|
Orbital kvant soni |
Magnit kvant soni |
Berilgan qiymatga ega orbitallar soni l |
|
m l | ||
|
–2, –1, 0, +1, +2 | ||
|
–3, –2, –1, 0, +1, +2, +3 |
p -orbitallar da mavjud n≥ 2 va l= 1, shuning uchun kosmosda uchta mumkin bo'lgan yo'nalish mavjud: m l= -1, 0, +1. Barcha p-orbitallar orbitalni ikki mintaqaga ajratuvchi tugun tekisligiga ega, shuning uchun chegara sirtlari gantel shaklida bo'lib, kosmosda bir-biriga nisbatan 90 ° burchak ostida yo'naltirilgan. Ular uchun simmetriya o'qlari koordinata o'qlari bo'lib, ular belgilanadi p x , p y , p z .
d -orbitallar kvant soni bilan aniqlanadi l = 2 (n≥ 3), bunda m l= –2, –1, 0, +1, +2, ya’ni ular fazoda orientatsiyaning beshta varianti bilan tavsiflanadi. d-koordinata o'qlari bo'ylab pichoqlar bilan yo'naltirilgan orbitallar belgilanadi d z² va d x ²– y² va pichoqlar tomonidan koordinata burchaklarining bissektrisalari bo'ylab yo'naltirilgan - d xy , d yz , d xz .
Yetti f -orbitallar mos keladigan l = 3 (n≥ 4) chegara sirtlari sifatida ko'rsatilgan.
kvant raqamlari n, l Va m atomdagi elektronning holatini to'liq tavsiflamaydi. Eksperimental ravishda elektronning yana bir xususiyati - spin borligi aniqlandi. Oddiy qilib aytganda, spinni elektronning o'z o'qi atrofida aylanishi sifatida ifodalash mumkin. Spin kvant soni m s faqat ikkita ma'noga ega m s= ±1/2, bu elektronning tanlangan o'qdagi burchak momentumining ikkita proyeksiyasi. elektronlar har xil m s yuqoriga va pastga qaragan strelkalar bilan ko'rsatilgan.
Atom orbitallarini to'ldirish ketma-ketligi
Elektronlar bilan atom orbitallarining populyatsiyasi (AO) eng kam energiya printsipi, Pauliya printsipi, Hund qoidasi va ko'p elektronli atomlar uchun Klechkovskiy qoidasi bo'yicha amalga oshiriladi.
Eng kam energiya printsipi Bu orbitallarda elektron energiyasini oshirish tartibida elektronlar AO ni to'ldirishni talab qiladi. Bu umumiy qoidani aks ettiradi - tizimning maksimal barqarorligi uning energiyasining minimaliga to'g'ri keladi.
Prinsip pauli (1925) bir xil kvant sonlari to'plamiga ega bo'lgan elektronlarning ko'p elektronli atomda bo'lishini taqiqlaydi. Bu shuni anglatadiki, atom (yoki molekula yoki ion)dagi har qanday ikkita elektron kamida bitta kvant sonining qiymati bilan bir-biridan farq qilishi kerak, ya'ni atomda (juftlangan elektronlar) har xil spinli ikkitadan ortiq elektron bo'lishi mumkin emas. bitta orbital. Har bir kichik daraja 2 tadan iborat l+ 2 tadan ko'p bo'lmagan 1 orbital (2 l+ 1) elektronlar. Bundan kelib chiqadiki, sig'im s-orbitallar - 2, p-orbitallar - 6, d-orbitallar - 10 va f-orbitallar - 14 elektron. Agar berilgan uchun elektronlar soni l yig'indisi 0 dan n– 1, keyin formulani olamiz Bora -Dafn qilmoq, bu berilgan bilan bir darajadagi elektronlarning umumiy sonini aniqlaydi n:
Ushbu formula elektronlararo o'zaro ta'sirni hisobga olmaydi va qachon o'z kuchini yo'qotadi n ≥ 3.
Bir xil energiyaga ega bo'lgan orbitallar (degeneratsiya) ga muvofiq to'ldiriladi qoida Gunda : maksimal spinli elektron konfiguratsiyasi eng kam energiyaga ega. Bu shuni anglatadiki, agar p-orbitalda uchta elektron bo'lsa, u holda ular quyidagicha joylashtirilgan: , va umumiy spin S=3/2, bunday emas: , S=1/2.
Klechkovskiy hukmronligi (eng kam energiya printsipi). Ko'p elektronli atomlarda, vodorod atomida bo'lgani kabi, elektronning holati bir xil to'rtta kvant sonining qiymatlari bilan belgilanadi, ammo bu holda elektron nafaqat yadro maydonida, balki maydonda ham bo'ladi. boshqa elektronlar. Shuning uchun ko'p elektronli atomlardagi energiya nafaqat asosiy, balki orbital kvant soni, aniqrog'i, ularning yig'indisi bilan ham aniqlanadi: atom orbitallarining energiyasi yig'indisi oshgani sayin ortadin + l; bir xil miqdorda, kichikroq bo'lgan daraja birinchi bo'lib to'ldiriladinva kattal. Atom orbitallarining energiyasi qatorga qarab ortadi:
|
1s<2s<2p<3s<3p<4s≈3d<4p<5s≈4d<5p<6s≈4f≈5d<6p<7s≈5f≈6d<7p. |
Shunday qilib, to'rtta kvant soni atomdagi elektronning holatini tavsiflaydi va elektronning energiyasini, spinini, elektron bulutining shaklini va uning kosmosdagi yo'nalishini tavsiflaydi. Atom bir holatdan ikkinchi holatga o'tganda, elektron buluti qayta tuziladi, ya'ni kvant sonlarining qiymatlari o'zgaradi, bu atom tomonidan energiya kvantlarining yutilishi yoki chiqarilishi bilan birga keladi.
Kimyoviy reaktsiyalar paytida elementlarning atomlari bilan nima sodir bo'ladi? Elementlarning xossalari qanday? Bu ikkala savolga bitta javob berish mumkin: sababi tashqi tuzilishida yotadi Bizning maqolamizda biz metallar va metall bo'lmaganlar elektronini ko'rib chiqamiz va tashqi darajadagi struktura va xususiyatlar o'rtasidagi bog'liqlikni bilib olamiz. elementlardan.
Elektronlarning maxsus xossalari
Ikki yoki undan ortiq reagent molekulalari o'rtasida kimyoviy reaksiya sodir bo'lganda, atomlarning elektron qobiqlari tuzilishida o'zgarishlar sodir bo'ladi, ularning yadrolari esa o'zgarishsiz qoladi. Birinchidan, atomning yadrodan eng uzoq sathlarida joylashgan elektronlarning xarakteristikalari bilan tanishamiz. Manfiy zaryadlangan zarralar qatlamlar bo'lib yadrodan va bir-biridan ma'lum masofada joylashgan. Yadro atrofidagi elektronlar eng ko'p topiladigan bo'shliq elektron orbitali deyiladi. Unda manfiy zaryadlangan elektron bulutining 90% ga yaqini kondensatsiyalangan. Atomdagi elektronning o'zi ikkilik xususiyatini namoyon qiladi, u bir vaqtning o'zida ham zarracha, ham to'lqin sifatida harakat qilishi mumkin.
Atomning elektron qobig'ini to'ldirish qoidalari
Zarrachalar joylashgan energiya darajalari soni element joylashgan davrning soniga teng. Elektron kompozitsiya nimani bildiradi? Ma'lum bo'lishicha, tashqi energiya darajasida kichik va katta davrlarning asosiy kichik guruhlari s- va p-elementlari uchun guruh soni mos keladi. Masalan, ikkita qatlamga ega bo'lgan birinchi guruhning litiy atomlari tashqi qobiqda bitta elektronga ega. Oltingugurt atomlari oxirgi energiya darajasida oltita elektronni o'z ichiga oladi, chunki element oltinchi guruhning asosiy kichik guruhida joylashgan va hokazo. Agar d-elementlar haqida gapiradigan bo'lsak, ular uchun quyidagi qoida mavjud: tashqi salbiy zarralar soni 1 (xrom va mis uchun) yoki 2. Bu atomlar yadrosining zaryadi ortishi bilan birinchi navbatda ichki d-pastki daraja to'lishi va tashqi energiya darajalari o'zgarishsiz qolishi bilan izohlanadi.
Nima uchun kichik davrlar elementlarining xossalari o'zgaradi?
1, 2, 3 va 7 davrlar kichik hisoblanadi. Yadro zaryadlari ortishi bilan elementlar xossalarining bir tekis oʻzgarishi faol metallardan boshlab inert gazlar bilan yakunlanishi tashqi darajadagi elektronlar sonining bosqichma-bosqich koʻpayishi bilan izohlanadi. Bunday davrlardagi birinchi elementlar atomlari yadrodan osongina ajralib chiqadigan bir yoki ikkita elektronga ega bo'lgan elementlardir. Bunday holda, musbat zaryadlangan metall ioni hosil bo'ladi.

Alyuminiy yoki rux kabi amfoter elementlar tashqi energiya darajalarini oz miqdordagi elektronlar bilan to'ldiradi (sink uchun 1 ta, alyuminiy uchun 3 ta). Kimyoviy reaksiya sharoitlariga qarab, ular metallarning ham, metall bo'lmaganlarning ham xossalarini ko'rsatishi mumkin. Kichik davrlarning metall bo'lmagan elementlari o'z atomlarining tashqi qobig'ida 4 dan 7 gacha manfiy zarralarni o'z ichiga oladi va uni boshqa atomlardan elektronlarni o'ziga tortadigan oktetgacha yakunlaydi. Masalan, elektromanfiylik indeksi eng yuqori bo'lgan metall bo'lmagan - ftor, oxirgi qatlamda 7 ta elektronga ega va har doim bir elektronni nafaqat metallardan, balki faol metall bo'lmagan elementlardan ham oladi: kislorod, xlor, azot. Kichik davrlar, shuningdek, yirik davrlar inert gazlar bilan tugaydi, ularning monotomik molekulalari 8 elektrongacha tashqi energiya darajasini to'liq yakunladi.
Katta davrlar atomlari tuzilishining xususiyatlari
4, 5 va 6 davrlarning juft qatorlari tashqi qobiqlarida faqat bitta yoki ikkita elektron bo'lgan elementlardan iborat. Yuqorida aytib o'tganimizdek, ular oxirgi qatlamning d- yoki f- pastki sathlarini elektronlar bilan to'ldiradilar. Odatda bu odatiy metallardir. Ularning fizik va kimyoviy xossalari juda sekin o'zgaradi. Toq qatorlar shunday elementlarni o'z ichiga oladi, ularda tashqi energiya darajalari quyidagi sxema bo'yicha elektronlar bilan to'ldiriladi: metallar - amfoter element - metall bo'lmaganlar - inert gaz. Biz barcha kichik davrlarda uning namoyon bo'lishini allaqachon kuzatganmiz. Misol uchun, 4 davrning toq qatorida mis metall, rux amfoteren, keyin galiydan bromgacha, metall bo'lmagan xususiyatlar kuchayadi. Davr kripton bilan tugaydi, uning atomlari to'liq elektron qobig'iga ega.

Elementlarning guruhlarga bo'linishini qanday tushuntirish mumkin?
Har bir guruh - va jadvalning qisqa shaklida sakkiztasi bor, shuningdek, asosiy va ikkinchi darajali deb ataladigan kichik guruhlarga bo'linadi. Ushbu tasnif elementlar atomlarining tashqi energiya darajasida elektronlarning turli pozitsiyalarini aks ettiradi. Ma'lum bo'lishicha, asosiy kichik guruhlarning elementlari, masalan, litiy, natriy, kaliy, rubidiy va seziy, oxirgi elektron s-kichik sathda joylashgan. Asosiy kichik guruhning 7-guruh elementlari (galogenlar) o'zlarining p-kichik darajasini manfiy zarrachalar bilan to'ldiradi.
Xrom kabi yon kichik guruhlar vakillari uchun d-kichik darajani elektronlar bilan to'ldirish odatiy bo'ladi. Va oilaga kiritilgan elementlar uchun salbiy zaryadlarning to'planishi oxirgi energiya darajasining f-kichik darajasida sodir bo'ladi. Bundan tashqari, guruh raqami, qoida tariqasida, kimyoviy bog'lanishlarni yaratishga qodir elektronlar soniga to'g'ri keladi.

Maqolamizda kimyoviy elementlar atomlarining tashqi energiya darajalari qanday tuzilishga ega ekanligini bilib oldik va ularning atomlararo o'zaro ta'sirdagi rolini aniqladik.