Chiqarilgan brom qutbsiz erituvchilar yoki bug 'distilliyasi bilan ekstraktsiya yo'li bilan ajratiladi. Boshqa lug'atlarda "brom" nima ekanligini ko'ring Brom - bu suyuqlik
Bromning kashf etilishi frantsuz kimyogari A. Balardning tadqiqotlariga olib keldi, u 1825 yilda dengiz o'tlari kulini yuvgandan keyin olingan suvli eritmada xlor bilan ta'sir qilib, to'q jigarrang, yomon hidli suyuqlikni ajratib oldi. U bu suyuq muridni (lotincha muria - sho'r suv) deb atagan va Parij Fanlar akademiyasiga o'zining kashfiyoti haqida xabar yuborgan. Komissiya yangi elementni brom deb nomladi, chunki brom og'ir, yoqimsiz bug' hidiga ega (yunonchadan. brwmoz- hid).
Tabiatda bo'lish, qabul qilish:
Yer qobig'idagi brom miqdori (1,6*l0 -4% massasi) 10 15 -10 16 t deb baholanadi Brom xlorning doimiy hamrohidir. Bromid tuzlari (NaBr, KBr, MgBr 2) xlorid tuzlari konlarida (osh tuzida 0,03% gacha, kaliy tuzlarida - silvit va karnallitda - 0,3% gacha), shuningdek dengiz suvida (0,065%) uchraydi. , sho'r ko'llarning sho'r suvlari (0,2% gacha) va er osti sho'rlari odatda tuz va neft konlari bilan bog'liq (0,1% gacha).
Bromni sanoat ishlab chiqarish uchun boshlang'ich materiallar dengiz suvi, ko'l suvi va er osti suvlari bo'lib, bromid ioni shaklida brom mavjud. Brom xlor yordamida ajratib olinadi va eritmadan suv bug'i yoki havo bilan chiqariladi. Olingan brom-havo aralashmasidan kimyoviy changni yutish vositalari yordamida brom chiqariladi. Shu maqsadda temir bromid eritmalari qo'llaniladi. Brom hosil bo'lgan oraliq mahsulotlardan xlor yoki kislota ta'sirida ajratib olinadi. Keyinchalik, brom suvdan ajratiladi va distillash orqali xlor aralashmalaridan tozalanadi.
Laboratoriyalarda bromid oksidlanishiga asoslangan jarayonlar ham qo'llaniladi:
6KBr + K 2 Cr 2 O 7 + 7H 2 SO 4 = 3Br 2 + Cr 2 (SO 4) 3 + 4K 2 SO 4 + 7H 2 O
Jismoniy xususiyatlar:
Brom xona haroratida suyuq bo'lgan yagona metall bo'lmagan metalldir. Oddiy modda - yoqimsiz hidli og'ir qizil-jigarrang suyuqlik (zichligi 20 ° C - 3,1 g / sm 3, qaynash harorati +59,82 ° S), brom bug'i sariq-jigarrang rangga ega. -7,25°C haroratda brom qotib qotib, qizil-jigarrang igna shaklidagi kristallarga aylanadi, yaltiroq metall porlaydi. Brom suvda boshqa halogenlarga qaraganda yaxshiroq eriydi (20 ° C da 3,58 g / 100 g H 2 O) - " bromli suv"Biz bromni suvli eritmalardan ajratib olishdan ko'ra organik erituvchilarda ancha yaxshi eritamiz.
Kimyoviy xossalari:
Brom kuchli oksidlovchi vosita bo'lib, u deyarli barcha metall bo'lmaganlar (asli gazlar, kislorod, azot va ugleroddan tashqari) va ko'plab metallar bilan bevosita reaksiyaga kirishadi:
2P + 3Br 2 = 2PBr 3; 2Al + 3Br 2 = 2AlBr 3
Suvli muhitda brom nitritlarni nitratlarga, ammiakni azotga, yodidlarni erkin yodga, oltingugurtni va sulfitlarni sulfat kislotaga oksidlaydi:
2NH 3 + 6Br 2 = N 2 + 6HBr; 3Br 2 + S + 4H 2 O = 6HBr + H 2 SO 4
Brom gidroksidi eritmalar bilan reaksiyaga kirishganda, tegishli bromidlar va gipobromitlar (sovuqda) yoki bromatlar hosil bo'ladi:
Br 2 + 2NaOH = NaBr + NaBrO + H 2 O (t da Brom toq oksidlanish darajasiga ega birikmalar bilan tavsiflanadi: -1, +1, +3, +5, +7.
Eng muhim aloqalar:
Vodorod bromidi HBr- suv bug'lari bilan o'zaro ta'sir qilish natijasida havoda bug'lanadigan o'tkir hidli zaharli rangsiz gaz. U suvda yaxshi eriydi: 0°C da bir hajm suvda 612 hajm brom vodorod eriydi. Yechim - kuchli monobazik gidrobromik kislota. Tuzlar - bromidlar rangsiz kristallar, suvda yaxshi eriydi (erimaydigan AgBr, och sariq).
Brom (I) oksidi Br 2 O., jigarrang gaz. CCl 4 da HgO ga brom ta'siridan hosil bo'ladi. Xususiyatlari...
Hipobrom kislotasi HBrO- kuchli oksidlovchi vosita. Brom suvda eritilganda hosil bo'ladi, yorug'lik ta'sirida HBr va kislorodga parchalanadi; zaif kislotali xususiyatlarga ega va faqat eritmada mavjud. Tuzlar - gipobromitlar, KBrO, NaBrO - erkin holatda kristall gidratlar shaklida olinadi. Ularning barchasi juda beqaror, qizdirilganda (yoki kislotali eritmalarda) bromid va bromatga parchalanadi:
3KBrO = 2KBr + KBrO 3
Bromitlar, HBrO 2 tuzlari - brom kislotasi eritmasida ham noma'lum gipobromitlarning brom bilan ishqoriy muhitda oksidlanishida hosil bo'ladi: Ba(BrO) 2 + 2Br 2 + 4KOH = Ba(BrO 2) 2 + 4KBr + 2H 2 O
Bromik kislota, HBrO 3 - konsentrlangan eritma rangsiz siropli suyuqlikdir. Tuzlar - bromatlar. Bromik kislota va bromatlar kuchli oksidlovchi moddalardir:
2S + 2NaBrO 3 = Na 2 SO 4 + Br 2 + SO 2
Bromik kislota HBrO 4 konsentratsiyasi 6 mol/l dan oshmaydigan suvli eritmalarda mavjud. HBrO 4 brom kislorodli kislotalar orasida eng kuchli oksidlovchi vosita bo'lishiga qaramay, uning ishtirokidagi reaktsiyalar juda sekin davom etadi.
Brom triflorid, BrF 3 - bp bilan qizil suyuqlik. 126°C, bromning ftor bilan bevosita reaksiyasi natijasida hosil bo'ladi. Suv va organik moddalar bilan portlovchi reaksiyaga kirishadi. Noorganik birikmalarga nisbatan u kuchli ftorlashtiruvchi vosita sifatida ishlaydi.
Ilova:
Brom va uning birikmalari asosiy organik sintezda keng qo'llaniladi. Kumush bromid AgBr fotosensitiv modda sifatida fotografiyada ishlatiladi. Brom birikmalari yong'inga qarshi vositalarni yaratish uchun ishlatiladi - plastmassa, yog'och va to'qimachilik materiallariga yong'inga qarshilik ko'rsatadigan qo'shimchalar. Brom pentaflorid ba'zan juda kuchli raketa yoqilg'isi oksidlovchi sifatida ishlatiladi. 1,2-dibromoetan motor yoqilg'ida taqillatishga qarshi qo'shimcha sifatida ishlatiladi. Bromid eritmalari neft ishlab chiqarishda ishlatiladi. Tibbiyotda natriy va kaliy bromid sedativ sifatida ishlatiladi.
Biologik roli va toksikligi:
Brom oddiy shaklda zaharli hisoblanadi. Suyuq brom davolash qiyin bo'lgan kuyishlarni keltirib chiqaradi. Brom bug'i 1 mg/m3 konsentratsiyada shilliq pardalarning tirnash xususiyati, yo'tal, bosh aylanishi va bosh og'rig'iga sabab bo'ladi va undan yuqori konsentratsiyada (>60 mg / m3) bo'g'ilish va o'limga olib keladi.
Inson tanasida brom, bromid ionlari shaklida, qalqonsimon bezni tartibga solishda ishtirok etadi, chunki u yodning raqobatbardosh inhibitori hisoblanadi.
Petrova M.A., Puxova M.S.
HF Tyumen davlat universiteti, 572 guruh.
"Dunyo bo'ylab" entsiklopediyasi:
Brom
BROM-ay); m.[yunon tilidan bromos - yomon hid]
1. Kimyoviy element (Br), havoda bug'lanadigan og'ir qizil-jigarrang zaharli suyuqlik (kimyoviy ishlab chiqarishda, tuzlar shaklida - tibbiyotda va fotosuratda ishlatiladi). Brom tuzlari. Brom bilan iksir.
2. Ushbu moddani yoki uning birikmalarini o'z ichiga olgan dorivor mahsulot (sedativ yoki gipnoz sifatida ishlatiladi). Belgilamoq, qabul qilmoq b. Brom (brom) qo'shing.
◁ Brom, oh, oh. B dorilar. Bth suv(bromning suvli eritmasi). Brom, oh, oh. B dorilar. Bromid, oh, oh. B-tuzlar, metallar. Kaliy bromid eritmasi(tinchlantiruvchi tomchilar).
bromDavriy sistemaning VII guruhi kimyoviy elementi (lat. Bromum) galogenlarga kiradi. Yunoncha ism. bromos - badbo'y hid. Havoda bug'lanib, o'tkir yoqimsiz hidga ega bo'lgan og'ir qizil-jigarrang suyuqlik; zichligi 3,1 g/sm 3, t pl -7,25 ° C, t harorat 59,2 ° S. Analitik kimyoda bromidlar, organik va boshqa brom birikmalarini olish uchun bromlashtiruvchi vosita sifatida ishlatiladi. Brom zaharli hisoblanadi.
BROMBROMIN (lat. Bromum), Br ("brom" deb o'qing), atom raqami 35, atom og'irligi 79,904 bo'lgan kimyoviy element. Bu nom bromning og'ir, yoqimsiz bug' hidiga ega ekanligidan kelib chiqqan (yunoncha bromos - badbo'y hid).
Tabiiy brom ikki nuklidning aralashmasidir (sm. NUCLIDE) massa raqamlari bilan 79 (massa bo'yicha 50,56% aralashmada) va 81. Tashqi elektron qatlam konfiguratsiyasi 4 s 2
p 5
. Birikmalarda u -1, +1, +3, +5 va +7 (valentlik I, III, V va VII) oksidlanish darajalarini ko'rsatadi, eng xarakterli oksidlanish darajasi -1 va +5.
Mendeleyev elementlari davriy sistemasining VIIA guruhida toʻrtinchi davrda joylashgan, galogenlarga tegishli. (sm. HALOGEN).
Neytral brom atomining radiusi 0,119 nm, Br -, Br 3+, Br 5+ va Br 7+ ning ion radiuslari mos ravishda 0,182, 0,073, 0,045 va 0,039 nm. Neytral brom atomining ketma-ket ionlanish energiyalari mos ravishda 11,84, 21,80, 35,9, 47,3 va 59,7 eV ni tashkil qiladi. Elektron yaqinligi 3,37 eV. Pauling shkalasi bo'yicha bromning elektr manfiyligi 2,8 ga teng.
Kashfiyot tarixi
Bromning ochilishiga fransuz kimyogari A. Balardning tadqiqotlari sabab bo'ldi (sm. BALARD Antuan Jerom), 1825 yilda dengiz o'tlari kulini yuvgandan keyin olingan suvli eritmada xlor bilan harakat qilib, quyuq jigarrang, yomon hidli suyuqlikni chiqardi. U dengiz suvidan ham olinadigan bu suyuqlikni murid (lotincha muria - sho'r eritma, sho'r) deb atagan va Parij Fanlar akademiyasiga o'z kashfiyoti haqida xabar yuborgan. Ushbu xabarni tekshirish uchun tuzilgan komissiya Balar nomini qabul qilmadi va yangi elementni brom deb nomladi. Bromning kashf etilishi yosh va kam taniqli olimni mashhur qildi. Balarning maqolasi paydo bo'lgandan so'ng, xuddi shunday moddaga ega shishalar nemis kimyogarlari K. Levig va J. Libig tomonidan tadqiqotni kutayotgani ma'lum bo'ldi. (sm. LIBICH Justus). Yangi elementni kashf qilish imkoniyatini qo'ldan boy bergan Libig shunday dedi: "Bromni Balar emas, balki Balarni ochgan brom".
Tabiatda bo'lish
Brom er qobig'idagi juda kam uchraydigan elementdir. Undagi miqdori 0,37·10 -4% (taxminan 50-o'rin) deb baholanadi.
Kimyoviy jihatdan brom juda faol va shuning uchun tabiatda erkin holda uchramaydi. Bu natriy, kaliy va magniy xloridlari bilan birga keladigan ko'p miqdordagi turli xil birikmalarning (natriy, kaliy, magniy bromidlari va boshqalar) bir qismidir. Bromning o'ziga xos minerallari - bromargirit (kumush bromid AgBr) va embolit (aralash xlorid va kumush bromid) juda kam uchraydi (qarang: Tabiiy bromidlar (sm. TABIY BROMLAR)). Brom manbai achchiq koʻllarning suvlari, neft va turli tuz konlari bilan birga keladigan shoʻr suvlar, dengiz suvlari (65·10–4%), Oʻlik dengiz bromga boyroq. Hozirgi vaqtda brom odatda ba'zi achchiq ko'llarning suvlaridan olinadi, ulardan biri, xususan, mamlakatimizda Kulunda cho'lida (Oltoyda) joylashgan.
Fizikaviy va kimyoviy xossalari
Oddiy sharoitda brom og'ir (zichligi 3,1055 g/sm3), qizil-jigarrang, o'tkir hidli quyuq suyuqlikdir. Brom oddiy sharoitda suyuq bo'lgan oddiy moddalardan biridir (bromdan tashqari simob ham shunday moddadir). Bromning erish nuqtasi -7,25 °C, qaynash nuqtasi +59,2 °C. Standart elektrod potentsiali Br 2 / Br - suvli eritmada +1,065 V.
Erkin shaklda u Br 2 diatomik molekulalar shaklida mavjud. Molekulalarning atomlarga sezilarli dissotsiatsiyasi 800 °C haroratda kuzatiladi va haroratning yanada oshishi bilan tez ortadi. Br 2 molekulasining diametri 0,323 nm, bu molekulada yadrolararo masofa 0,228 nm.
Brom ozroq, lekin suvda boshqa galogenlarga qaraganda koʻproq eriydi (20°C da 100 g suvda 3,58 g), eritma bromli suv deb ataladi. Bromli suvda gidrobromik va beqaror gipobrom kislotalarning hosil bo'lishi bilan reaktsiya sodir bo'ladi:
Br 2 + H 2 O = HBr + HBrO.
Brom ko'pchilik organik erituvchilar bilan har jihatdan aralashib ketadi va organik erituvchi molekulalarining bromlanishi ko'pincha sodir bo'ladi.
Kimyoviy faollik nuqtai nazaridan brom xlor va yod o'rtasida oraliq o'rinni egallaydi. Brom yodidlar eritmalari bilan reaksiyaga kirishganda erkin yod ajralib chiqadi:
Br 2 + 2KI = I 2 + 2KBr.
Aksincha, xlor suvli eritmalardagi bromidlarga ta'sir qilganda, erkin brom ajralib chiqadi:
Cl 2 + 2NaBr = Br 2 + 2NaCl.
Brom oltingugurt bilan reaksiyaga kirishganda S 2 Br 2, brom fosfor bilan reaksiyaga kirishganda PBr 3 va PBr 5 hosil bo`ladi. Brom metall bo'lmagan selen bilan ham reaksiyaga kirishadi (sm. SELENIY) va tellur (sm. TELLURIY) .
Bromning vodorod bilan reaksiyasi qizdirilganda sodir bo'ladi va vodorod bromid HBr hosil bo'lishiga olib keladi. HBr ning suvdagi eritmasi gidrobromik kislota bo'lib, uning kuchi bo'yicha HCl xlorid kislotasiga o'xshaydi. Hidrobromik kislota tuzlari - bromidlar (NaBr, MgBr 2, AlBr 3 va boshqalar). Eritmada bromid ionlari mavjudligiga sifatli reaksiya suvda ham, nitrat kislota eritmasida ham amalda erimaydigan Ag+ ionlari bilan och sariq rangli AgBr choʻkma hosil boʻlishidir.
Brom kislorod va azot bilan bevosita reaksiyaga kirishmaydi. Brom boshqa galogenlar bilan ko'p sonli turli birikmalar hosil qiladi. Masalan, ftor bilan brom beqaror BrF 3 va BrF 5, yod bilan - IBr hosil qiladi. Ko'pgina metallar bilan o'zaro ta'sirlashganda brom bromidlar hosil qiladi, masalan, AlBr 3, CuBr 2, MgBr 2 va boshqalar. Tantal va platina bromga, kamroq darajada kumush, titan va qo'rg'oshinga chidamli.
Brom kuchli oksidlovchi moddadir, u sulfit ionini sulfatga, nitrit ionini nitratga va boshqalarga oksidlaydi.
Qo'sh bog'langan organik birikmalar bilan o'zaro ta'sirlashganda, brom qo'shib, tegishli dibromo hosilalarini beradi:
C 2 H 4 + Br 2 = C 2 H 4 Br 2.
Brom, shuningdek, uchlik bog'lanishni o'z ichiga olgan organik molekulalarga birikadi. Bromli suvdan gaz o'tkazilganda yoki unga suyuqlik qo'shilganda rangi o'zgarishi gaz yoki suyuqlikda to'yinmagan birikma mavjudligini ko'rsatadi.
Katalizator ishtirokida qizdirilganda brom benzol bilan reaksiyaga kirishib, bromobenzol C 6 H 5 Br (almashtirish reaksiyasi) hosil qiladi.
Brom gidroksidi eritmalar va natriy yoki kaliy karbonat eritmalari bilan reaksiyaga kirishganda, tegishli bromidlar va bromatlar hosil bo'ladi, masalan:
Br 2 + 3Na 2 CO 3 = 5NaBr + NaBrO 3 + 3CO 2.
Ilova
Brom analitik kimyoda bir qator noorganik va organik moddalarni olishda ishlatiladi. Brom birikmalari yonilg'i qo'shimchalari, pestitsidlar, olovni to'xtatuvchi moddalar sifatida va fotosuratda qo'llaniladi. Brom o'z ichiga olgan dorilar keng tarqalgan. Shuni ta'kidlash kerakki, "shifokor ovqatdan keyin bir osh qoshiq brom buyurdi" degan umumiy ibora, albatta, sof brom emas, balki natriy (yoki kaliy) bromidning suvli eritmasi buyurilganligini anglatadi. Bromid preparatlarining tinchlantiruvchi ta'siri ularning inhibisyon jarayonlarini kuchaytirish qobiliyatiga asoslanadi (sm. tormozlash) markaziy asab tizimida.
Brom bilan ishlash xususiyatlari
Brom bilan ishlashda siz himoya kiyim, gaz niqobi va qo'lqopdan foydalanishingiz kerak. Brom bug'ining MPC 0,5 mg/m3 ni tashkil qiladi. Havoda brom miqdori taxminan 0,001% (hajm bo'yicha) kontsentratsiyasida shilliq qavatlarning tirnash xususiyati, bosh aylanishi va yuqori konsentratsiyalarda - nafas olish yo'llarining spazmlari, bo'g'ilish kuzatiladi. Yutilgan bo'lsa, zaharli dozasi 3 g, o'ldiradigan - 35 g dan Brom bug'lari bilan zaharlanganda jabrlanuvchini darhol toza havoga olib borish kerak; Nafas olishni tiklash uchun siz ammiak bilan namlangan tampondan foydalanishingiz mumkin, vaqti-vaqti bilan uni qisqa vaqt davomida jabrlanuvchining burniga olib boring. Keyingi davolanish shifokor nazorati ostida amalga oshirilishi kerak. Suyuq brom teriga tegsa, og'riqli kuyishga olib keladi.
Brom bug'ining ham, suyuq bromning ham yuqori kimyoviy faolligi va zaharliligi tufayli uni shisha, mahkam yopiq, qalin devorli idishda saqlash kerak. Bromli butilkalar qum solingan idishlarga joylashtiriladi, bu shishalarni chayqalganda vayron bo'lishdan himoya qiladi. Bromning zichligi yuqori bo'lganligi sababli, uni o'z ichiga olgan idishlarni hech qachon bo'yin bilan olmaslik kerak (bo'yin chiqib ketishi mumkin, keyin zaharli suyuqlik polga tushadi).
To'kilgan bromni zararsizlantirish uchun u bilan sirt darhol nam soda Na 2 CO 3 bilan qoplanishi kerak.
ensiklopedik lug'at. 2009 .
Sinonimlar:Boshqa lug'atlarda "brom" nima ekanligini ko'ring:
brom- brom, a va y... Rus imlo lug'ati
brom- brom/… Morfemik-imlo lug'ati
BROM- BROM, Bromum (yunoncha bromos hididan), suyuq metalloid, halogen guruhi, kimyoviy bilan. Vg belgisi; da. V. 79,92; elementlar davriy sistemasida tartib boʻyicha 35-oʻrinni, VII guruhda 4-oʻrinni egallaydi. To'q qizil-jigarrang suyuqlik, spetsifikatsiya. vazni 3,188 ... ... Buyuk tibbiy ensiklopediya
- (yunoncha bromos fetid). Qizil rangli oddiy suyuqlik tanasi, juda yoqimsiz hid; Balard tomonidan 1726 yilda dengiz suvi va tuzli buloqlarda kashf etilgan. Rus tiliga kiritilgan xorijiy so'zlarning lug'ati. Chudinov A.N., 1910. BROME... ... Rus tilidagi xorijiy so'zlar lug'ati
BROM, brom, er. (yunoncha: bromos, yomon hid). Kimyoviy element, kuchli hidli (kimyoviy) jigarrang-qizil rangli kaustik suyuqlik. Brom tibbiyot, fotografiya va texnologiyada qo'llaniladi. || Bromid birikmalari, ishlatiladi. tibbiyotda (ap.). Shifokor buyurdi ...... Ushakovning izohli lug'ati
- (Br belgisi), HALOGEN guruhining uchuvchi, suyuq elementi (davriy jadvalning ettinchi guruhi). Birinchi marta 1826 yilda izolyatsiya qilingan. Bu xona haroratida suyuqlik bo'lib qoladigan yagona metall bo'lmagan element. U eruvchan moddalardan olinadi ... Ilmiy-texnik entsiklopedik lug'at
Brom? Mavjudligi inson tanasidagi iz elementlari juda oz miqdorda hisoblangan, chunki bular bizning tanamizda 0,015 g dan kam bo'lgan moddalardir.A'zo yoki to'qima massasining mingdan bir qismi yoki undan kam (10 -2 dan 10 -7%) , shuning uchun ular ham deyiladi iz elementlari. Ammo, bunday kam miqdorda bo'lishiga qaramay, ushbu moddalarning etarli miqdori barcha tizimlar va organlarning to'liq ishlashi uchun muhim shartdir. Ushbu minerallardan biri . U haqida xususiyatlari va salomatlik ahamiyati ushbu maqolada muhokama qilinadi, uning asosiy yo'nalishlari terapevtik va profilaktik maqsadlarda foydalanish.
Brom: kashfiyot tarixi
Qiziqarli bromning kashf etilishi tarixi, halogenlar orasida qolgan oxirgi oq nuqta. Shu bilan birga, ikki kimyogar uni turli moddalardan ajratib olishdi: 1825 yilda Geydelberg universiteti talabasi K. Levig mineral suv va frantsuz ustida xlor ta'sirida kimyogar A. Balar, botqoq o'simliklarini o'rgangan, - xlorli suvning suv o'tlari kuli bilan reaktsiyasi paytida. Biroq, Levig ko'proq miqdorda yangi moddani olishga harakat qilganda, Balard 1826 yilda o'zining kashfiyoti to'g'risida hisobot e'lon qilgan va buning natijasida u butun dunyo bo'ylab shuhrat qozongan. Balar hosil bo'lgan moddani lotincha "murid" so'zi deb atamoqchi bo'ldi, bu "sho'r" degan ma'noni anglatadi. Biroq, xlorid kislotani murik kislotasi, undan olingan tuzlar esa muriatlar deb atalgan va ilmiy jamoatchilikda terminologik chalkashliklarga yo'l qo'ymaslik uchun kashf etilgan mineral bromni qadimgi yunon tilidan "xush hid" deb atashga qaror qilingan. ”. Brom haqiqatan ham bo'g'uvchi, yoqimsiz hidga ega. 19-asr davomida rus kimyo fanida bu mikroelement vrom, vromid va murid sifatida belgilangan.
Brom Optimal tabiiy shaklda va dozada asalarichilik mahsulotlarida - gulchanglar, shohona jele va drone zoti kabilar mavjud bo'lib, ular Parapharm kompaniyasining ko'plab tabiiy vitamin va mineral komplekslarining bir qismidir: Leveton P, Elton P, Leveton Forte ", "Apitonus P. ", "Osteomed", "Osteo-Vit", "Eromax", "Memo-Vit" va "Kardioton". Shuning uchun biz har bir tabiiy moddaga juda katta e'tibor beramiz, uning ahamiyati va tana salomatligi uchun foydalari haqida gapiramiz.
Kimyoviy va fizik
bromning xossalari
Haqida hikoya bromning kimyoviy va fizik xossalari Keling, uni Mendeleyevning kimyoviy elementlarning davriy tizimidagi o'rnini tavsiflash bilan boshlaylik. Unda u ostida joylashgan ramziBr (Lotin Bromumdan) 17-guruhda 35-raqamda, bu erda halogenlar mavjud(ftor, xlor, brom, yod va astatin). Bu metall bo'lmaganlar va faol oksidlovchi moddalar, tabiatda mustaqil ravishda mavjud emas, balki faqat birikmalarning bir qismi sifatida, chunki ular yuqori kimyoviy reaktivlik bilan ajralib turadi, deyarli barcha oddiy moddalar bilan birlashadi. Oddiy sharoitda oddiy moddalar suyuq holatda mavjud bo'lgan faqat 2 ta element mavjud - simob va brom va faqat bittasi. suyuq metall bo'lmagan - brom, qizil-jigarrang, tutunli jigarrang bug', zaharli suyuqlik. Brom faqat -7,25 °C haroratda kristallanadi va +59 °C da qaynaydi. U H 2 O (brom deb ataladigan suv olinadi), lekin yaxshiroq - organik erituvchilarda eriydi.
Toza brom 2 atomli molekula bilan ifodalanadi - BR 2, Lekin yuqori kimyoviy faollik tabiatda erkin holatda bo'lishiga yo'l qo'ymaydi, shuning uchun u ichida topiladi bromid tarkibi(metallar bilan birikmalar). Yerning ichki qismidagi va jinslardagi tarkibi bo'yicha u 50-o'rinni egallaydi, shuning uchun uning tabiiy manbai asosan sho'r ko'llar va dengizlardir; neft bilan birga er osti suvlari. U havoda ham mavjud, ko'proq qirg'oqbo'yi hududlarida. Biroq, sanoat qochqin bo'lsa, brom bug'lari odamlarga zaharli va asfiksiyali ta'sir ko'rsatadi.
Bromning xossalari uni yoqilg'i qo'shimchalari, qishloq xo'jaligida pestitsidlar, yonishni to'xtatuvchi moddalar, fotosensitiv agent kumush bromid va dori-darmonlarni ishlab chiqarishda keng qo'llash imkonini beradi. Ushbu mikroelement bilan ishlash juda ehtiyotkorlik va xavfsizlik choralariga rioya qilishni talab qiladi. Qo'lqoplar, kombinezonlar va gaz niqobi ushbu modda bilan ishlashda sizning eng yaxshi ittifoqchilaringizdir.
Brom qiymati
tana uchun odam
Toza brom- juda zaharli modda! Faqat 3 gramm elementar brom yutilgan taqdirda zaharlanishni keltirib chiqaradi, va 35 gramm o'limga olib keladi. bilan aloqa suyuq brom og'riqli, yomon davolanadigan kuyish bilan to'la. Havodagi 0,001% brom yo'talish, bo'g'ilish, bosh aylanishi, burundan qon ketishni keltirib chiqaradi va bu ko'rsatkichdan oshib ketish nafas olish spazmlari va o'limga olib kelishi mumkin. Biroq, zaharliligiga qaramay, organizm uchun bromning ahamiyati insonni kamsitish qiyin. U bizning organlar va to'qimalarda mavjud bo'lgan iz element: miya, qon, jigar va buyraklar, qalqonsimon bez, mushak to'qimalari va suyaklar ... Bizga oz miqdorda kerak!
Brom ta'sir qiladi markaziy asab tizimida. Miya yarim korteksida to'planib, qo'zg'alish va inhibisyon reaktsiyalari o'rtasidagi muvozanat uchun javobgar bo'lgan neyronlarning faoliyatini tartibga soladi. Agar kerak bo'lsa, u membrana fermentlari orqali inhibisyonni kuchaytiradi, bu uning tinchlantiruvchi ta'siri uchun javobgardir.
Ushbu mikroelement endokrin tizim uchun ham muhimdir, chunki u yodga o'ziga xos muqobil bo'lib ishlaydi va qalqonsimon bezning yodga bo'lgan ehtiyojini kamaytiradi, uning o'sishini oldini oladi - endemik guatr paydo bo'lishi.
Bromning roli oshqozon-ichak traktining ishida faollashishi tufayli ovqat hazm qilish fermentlariga ta'siri:
- pepsin (oqsillarning parchalanishi uchun zarur);
- amilaza (uglevodlarni parchalaydi);
- lipaz (hazm qilish jarayonida yog'larni eritadi va saralaydi).
Savol O brom ta'siri erkak jinsiy faoliyati haqida afsonalar bilan qoplangan. Xususan, ilgari qamoqxonalardagi mahbuslar, kasalxonalarning psixiatriya bo'limidagi bemorlar va armiyadagi askarlar erektil funktsiyasini susaytirish uchun ushbu mineral bilan oziq-ovqatga qo'shilgan. Uzoq vaqt davomida bromning generalga ega ekanligiga ishonishgan tanaga tinchlantiruvchi ta'sir ko'rsatadi, jinsiy sohani susaytiradi. Biroq, keyingi tadqiqotlar qabul qilishdan butunlay teskari ta'sir ko'rsatdi bromid preparatlari, erkaklarda reproduktiv tizimni barqarorlashtirishga hissa qo'shish, seminal suyuqlikning ko'payishi va undagi sperma soni.
Brom tanadan chiqariladi siydik va terlash bilan. Shuning uchun uni tashqaridan oziq-ovqat orqali (va agar kerak bo'lsa, farmakologik preparatlarda) olish kerak. Biroq, uni olib tashlash uzoq jarayondir, shuning uchun uning organlar va to'qimalarda kontsentratsiyasi oshishi mumkin, bu sog'liq uchun juda xavflidir.
Qanday ta'sir qiladi brom etishmovchiligi
inson salomatligi haqida?
Brom etishmovchiligi bir qator jiddiy funktsional buzilishlarga olib kelishi mumkin. Bolalik va o'smirlik davrida uning etishmasligi o'sishning sekinlashishiga, kattalar uchun esa umr ko'rish davomiyligining pasayishiga olib kelishi mumkin. Uxlab qolish bilan bog'liq muammolar, nevrastenik va isterik ko'rinishlar, gemoglobin darajasining pasayishi natijasida kelib chiqadigan anemiya, homilador ayollarda spontan tushish xavfi ortishi, jinsiy funktsiyalarning zaiflashishi, kislotalikning pasayishi tufayli ovqat hazm qilish muammolari - bularning barchasi ovqat hazm qilish tizimining etishmasligining natijasi bo'lishi mumkin. bu mineral. Ushbu holatning sabablari metabolik anomaliyalar yoki diuretiklarni suiiste'mol qilish targ‘ib qilish demakdir bromni olib tashlash tanadan. Tashxis qo'ying brom etishmasligi va davolanish mutaxassis tomonidan belgilanishi kerak va bu holatda shifokor bilan maslahatlashmasdan o'z-o'zidan davolanish qat'iyan tavsiya etilmaydi.
Bromning haddan tashqari dozasi
Bundan kam xavfli emas bromning haddan tashqari dozasi, faqat farmakologik preparatlarni qo'llash bilan bog'liq holda paydo bo'ladi. Uning xarakterli belgilari allergik teri toshmasi, terida yallig'lanish namoyon bo'lishi, oshqozon-ichak traktidagi buzilishlar, depressiya va energiya yo'qolishi, uyqu muammolari, letargiya, bronxit va rinit bo'ladi bromning toksik ta'siriga reaktsiya. Asab tizimi va idrok organlari (ko'rish va eshitish) azoblanadi, aqliy jarayonlar va kognitiv (idrok bilan bog'liq) funktsiyalar yomonlashadi.
Bromning ortiqcha miqdori o'limga olib kelishi mumkin, shuning uchun agar siz haddan tashqari dozadan shubhalansangiz, darhol foydalanishni to'xtatishingiz kerak brom o'z ichiga oladi dori-darmonlarni qabul qiling va ularni bekor qilish yoki dozani sozlash uchun shifokor bilan maslahatlashing.
Brom preparatlarini qabul qilish V
terapevtik va profilaktika maqsadida
O'qish bromidga ta'sir qilish inson salomatligi to'g'risida va ularni tibbiy amaliyotga joriy etish deyarli darhol boshlangan bromning kashf etilishi- 19-asrda, shuning uchun brom preparatlarini qabul qilish- klinik tibbiyotda tasdiqlangan vosita.
Rus fiziologi I. P. Pavlov ta'siri bo'yicha tadqiqotlarga katta hissa qo'shgan brom o'z ichiga olgan birikmalar asabiy faoliyat bo'yicha. Uning itlar ustida o'tkazgan tajribalari samarali bo'ldi nevrozlar uchun brom, va tayinlangan bromid dozalari yuqori asabiy faoliyat turi bilan bog'liq bo'lishi kerak (kuchli turi bilan, yuqori dozalar talab qilinadi).
Bromidlar sedativ sifatida nevropsik kasalliklar, uyqusizlik, qo'zg'aluvchanlikning kuchayishi, isteriya va nevrasteniya, konvulsiyalar uchun ishlatiladi., ammo ular epilepsiyani davolash uchun deyarli qo'llanilmaydi. Bugungi kunda shifokorlar odatda ehtiyotkor bromidlar buyuriladi tanadan sekin chiqarib yuborilishi va bromizm rivojlanish xavfi tufayli - surunkali brom bilan zaharlanish. Ushbu ko'rsatma o'z kuchini saqlab qoladi brom o'z ichiga oladi dori-darmonlar, gipertenziya rivojlanishining dastlabki bosqichida ko'pincha oshqozon va o'n ikki barmoqli ichak yaralari bilan yuzaga keladigan miya yarim korteksi va organlar, tizimlar o'rtasidagi muvofiqlashtirishning buzilishi sifatida.
Oddiylar orasida brom o'z ichiga olgan dorilar, – kaliy bromidi, natriy bromidi, “Adonis-brom”, “Bromcamphor” va boshqalar, ham kukun va eritmalar shaklida og'iz orqali, va tomir ichiga. Natriy bromid qo'llaniladi elektroforez uchun - og'riqli yallig'lanish jarayonlari, herpes zoster uchun. Bromid dozasi kuniga uch marta 0,1-1 gramm olishni o'z ichiga oladi.
Bromga kunlik ehtiyoj
Oshqozon shirasining kislotaliligini oshirish va jinsiy funktsiyani faollashtirish erkaklarda, asab kasalliklarining oldini olish uchun shifokorlar qabul qilishni tavsiya etadilar 3-8 mg. Bu bromga kunlik ehtiyoj sog'lom odam uchun. Ko'pgina xun takviyeleri bu iz elementni boshqa minerallar bilan birga o'z ichiga oladi. O'rtacha 1 mg tanamizga oziq-ovqat bilan kiradi.
Brom tarkibi
mahsulotlarda oziqlanish
Bu qanday ekanligini bilish mahsulotlardagi brom miqdori ovqatlanish, siz farmakologik preparatlardan foydalanmasdan uning iste'molini oshirishingiz mumkin. Bu iz element ko'plab o'simliklarda to'planadi, ular uni chuqurlikdan olib, organik toksik bo'lmagan birikmalar va tuzlarga bog'laydi.
Ular ayniqsa quyidagilarga boy:
- no'xat,
- dukkaklilar,
- yasmiq,
- turli yong'oqlar va
- don ekinlari (arpa, bug'doy va boshqalar).
Uning tarkibiga dengiz suvidan olinadi
- kelp va boshqa suv o'tlari,
- dengiz baliqlari.
Tosh tuzidan ham brom olishimiz mumkin. Bundan tashqari, qattiq bug'doydan tayyorlangan sut mahsulotlari, makaron va non mahsulotlarida mavjud.
Tabiiy brom massa raqamlari 79 (massa bo'yicha 50,56% aralashmada) va 81 bo'lgan ikkita nuklidning aralashmasidir. Tashqi elektron qatlamining konfiguratsiyasi 4s 2 p 5. Birikmalarda u oksidlanish darajasi 1, +1, +3, +5 va +7 (valentlik I, III, V va VII), eng xarakterli oksidlanish darajalari 1 va +5 namoyon bo'ladi.
Mendeleyev elementlar davriy sistemasining VIIA guruhida toʻrtinchi davrda joylashgan.
Neytral brom atomining radiusi 0,119 nm, Br , Br 3+, Br 5+ va Br 7+ ning ion radiuslari mos ravishda 0,182 ga teng; 0,073; 0,045 va 0,039 nm. Neytral brom atomining ketma-ket ionlanish energiyalari mos ravishda 11,84; 21,80; 35,9; 47,3 va 59,7 eV. Elektron yaqinligi 3,37 eV. Pauling shkalasi bo'yicha bromning elektr manfiyligi 2,8 ga teng.
Nomi: brom og'ir, yoqimsiz bug' hidiga ega bo'lganligi sababli (yunoncha bromos hididan).
Kashfiyot tarixi: Bromning kashfiyoti fransuz kimyogari A. Balardning tadqiqotlari bilan olib borildi, u 1825 yilda dengiz o'tlari kulini yuvgandan keyin olingan suvli eritmada xlor bilan ta'sir qilib, to'q jigarrang, yomon hidli suyuqlikni ajratib oldi. U dengiz suvidan ham olinadigan bu suyuqlikni murid (lotincha muriya tuzi eritmasidan, sho'r suv) deb atadi va Parij Fanlar akademiyasiga o'z kashfiyoti haqida xabar yuboradi. Ushbu xabarni tekshirish uchun tuzilgan komissiya Balar nomini qabul qilmadi va yangi elementni brom deb nomladi. Bromning kashf etilishi yosh va kam taniqli olimni mashhur qildi. Balarning maqolasi paydo bo'lgandan so'ng, xuddi shunday moddaga ega shishalar nemis kimyogarlari K. Levig va J. Liebig tomonidan tadqiqotni kutayotgani ma'lum bo'ldi. Yangi elementni kashf qilish imkoniyatini qo'ldan boy bergan Libig shunday dedi: "Bromni Balar emas, balki Balarni ochgan brom".
Xususiyatlari: normal sharoitda brom o'tkir hidli og'ir (zichligi 3,1055 g / sm3) qizil-jigarrang qalin suyuqlikdir. Brom oddiy sharoitda suyuq bo'lgan oddiy moddalardan biridir (bromdan tashqari yana bir shunday modda). Bromning erish nuqtasi 7,25 ° S, qaynash nuqtasi + 59,2 ° S. Suvli eritmada standart elektrod potentsiali Br 2 / Br +1,065 V ni tashkil qiladi.
Erkin shaklda u Br 2 diatomik molekulalar shaklida mavjud. Molekulalarning atomlarga sezilarli dissotsiatsiyasi 800 ° S haroratda kuzatiladi va haroratning yanada oshishi bilan tez ortadi. Br 2 molekulasining diametri 0,323 nm, bu molekulada yadrolararo masofa 0,228 nm.
Brom ozroq, lekin suvda boshqa galogenlarga nisbatan koʻproq eriydi (20°C da 100 g suvda 3,58 g), eritma bromli suv deb ataladi. Bromli suvda gidrobromik va beqaror gipobrom kislotalarning hosil bo'lishi bilan reaktsiya sodir bo'ladi:
Br 2 + H 2 O = HBr + HBrO.
Brom ko'pchilik organik erituvchilar bilan har jihatdan aralashib ketadi va organik erituvchi molekulalarining bromlanishi ko'pincha sodir bo'ladi.
Kimyoviy faollik nuqtai nazaridan brom xlor (Cl) va yod (I) o'rtasida oraliq pozitsiyani egallaydi. Brom yodidlar eritmalari bilan reaksiyaga kirishganda erkin yod (I) ajralib chiqadi:
Br 2 + 2KI = I 2 + 2KBr.
Brom kuchli oksidlovchi moddadir, u sulfit ionini sulfatga, nitrit ionini nitratga va boshqalarga oksidlaydi.
Qo'sh bog'langan organik birikmalar bilan o'zaro ta'sirlashganda, brom qo'shib, tegishli dibromo hosilalarini beradi:
C 2 H 4 + Br 2 = C 2 H 4 Br 2.
Brom, shuningdek, uchlik bog'lanishni o'z ichiga olgan organik molekulalarga birikadi. Bromli suvdan gaz o'tkazilganda yoki unga suyuqlik qo'shilganda rangi o'zgarishi gaz yoki suyuqlikda to'yinmagan birikma mavjudligini ko'rsatadi.
Katalizator ishtirokida qizdirilganda brom benzol bilan reaksiyaga kirishib, bromobenzol C 6 H 5 Br (almashtirish reaksiyasi) hosil qiladi.
Brom gidroksidi eritmalari va natriy (Na) yoki kaliy (K) karbonat eritmalari bilan reaksiyaga kirishganda, tegishli bromidlar va bromatlar hosil bo'ladi, masalan:
Br 2 + 3Na 2 CO 3 = 5NaBr + NaBrO 2 + 3CO 2.
Tabiatda topish: Brom er qobig'idagi juda kam uchraydigan elementdir. Undagi tarkibi 0,37·10 4% (taxminan 50-o'rin) deb baholanadi.
Kimyoviy jihatdan brom juda faol va shuning uchun tabiatda erkin holda uchramaydi. Bu natriy, kaliy va magniy xloridlari bilan birga keladigan ko'p miqdordagi turli xil birikmalarning (natriy (Na), kaliy (K), magniy (Mg) bromidlari) tarkibiga kiradi. Bromargirit (kumush bromidi (Ag) AgBr) va embolit (aralash xlorid va kumush (Ag) bromidi) o'ziga xos brom minerallari juda kam uchraydi. Brom manbai achchiq koʻllarning suvlari, neft va turli tuz konlari bilan birga keladigan shoʻr suvlar va dengiz suvlari (65·10 4%), Oʻlik dengiz bromga boy. Hozirgi vaqtda brom odatda ba'zi achchiq ko'llarning suvlaridan olinadi, ulardan biri, xususan, mamlakatimizda Kulunda cho'lida (Oltoyda) joylashgan.
Ilova: brom analitik kimyoda bir qator noorganik va organik moddalarni olishda ishlatiladi. Brom birikmalari yonilg'i qo'shimchalari, pestitsidlar, olovni to'xtatuvchi moddalar sifatida va fotosuratda qo'llaniladi. Brom o'z ichiga olgan dorilar keng tarqalgan. Shuni ta'kidlash kerakki, "shifokor ovqatdan keyin bir osh qoshiq brom buyurdi" degan umumiy ibora, albatta, sof brom emas, balki natriy (yoki kaliy) bromidning suvli eritmasi buyurilganligini anglatadi. Bromid preparatlarining tinchlantiruvchi ta'siri ularning markaziy asab tizimidagi inhibisyon jarayonlarini kuchaytirish qobiliyatiga asoslanadi.
Brom bilan ishlash xususiyatlari: Brom bilan ishlashda siz himoya kiyim, gaz niqobi va qo'lqopdan foydalanishingiz kerak. Brom bug'ining MPC 0,5 mg/m3 ni tashkil qiladi. Havoda brom miqdori taxminan 0,001% (hajm bo'yicha) kontsentratsiyasida shilliq qavatlarning tirnash xususiyati, bosh aylanishi va yuqori konsentratsiyalarda - nafas olish yo'llarining spazmlari, bo'g'ilish kuzatiladi. Yutilgan bo'lsa, zaharli doza 3 g, 35 g dan o'limga olib keladi. Brom bug'lari bilan zaharlanganda jabrlanuvchini darhol toza havoga olib chiqish kerak; nafas olishni tiklash uchun siz qisqa vaqt ichida ammiak bilan namlangan tampondan foydalanishingiz mumkin, vaqti-vaqti bilan. qisqa vaqt davomida jabrlanuvchining burniga olib kelish. Keyingi davolanish shifokor nazorati ostida amalga oshirilishi kerak. Suyuq brom teriga tegsa, og'riqli kuyishga olib keladi.
TA'RIF
Brom davriy sistemaning asosiy (A) kichik guruhi VII guruhining toʻrtinchi davrida joylashgan.
Elementlarga ishora qiladi p- oilalar. Metall bo'lmagan. Belgilash - Br. Seriya raqami - 35. Nisbiy atom massasi - 79,904 amu.
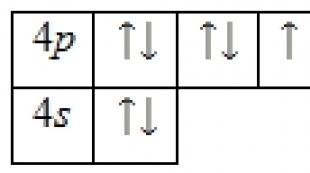
Brom atomining elektron tuzilishi
Brom atomi musbat zaryadlangan yadrodan (+35) iborat bo'lib, uning ichida 35 ta proton va 45 neytron bo'lib, 35 ta elektron to'rtta orbita bo'ylab harakatlanadi.
1-rasm. Brom atomining sxematik tuzilishi.
Elektronlarning orbitallar orasida taqsimlanishi quyidagicha:
35Br) 2) 8) 18) 7 ;
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5 .
Brom atomining tashqi energiya darajasida valentlik elektronlari bo'lgan 7 ta elektron mavjud. Asosiy holatning energiya diagrammasi quyidagi shaklni oladi:

Brom atomining har bir valent elektroni to'rtta kvant sonlar to'plami bilan tavsiflanishi mumkin: n(asosiy kvant), l(orbital), m l(magnit) va s(aylantirish):
|
Pastki daraja |
||||
Bitta juftlashtirilmagan elektronning mavjudligi bromning oksidlanish darajasi -1 yoki +1 bo'lishi mumkinligini ko'rsatadi. Chunki to'rtinchi darajada bo'sh orbitallar mavjud 4 d-pastki daraja, keyin brom atomi qo'zg'atilgan holatning mavjudligi bilan tavsiflanadi:

Shuning uchun brom ham +3 oksidlanish darajasiga ega. Ma'lumki, uning birikmalarida brom +5 va +7 oksidlanish darajasini ham ko'rsatishga qodir.
Muammoni hal qilishga misollar
MISOL 1
| Mashq qilish | Element 12,5% vodorodni o'z ichiga olgan vodorod bilan gazsimon birikma hosil qiladi. Ushbu elementning eng yuqori oksidi RO 2 formulasiga ega. Ushbu element atomining elektron qobig'idagi elektronlar sonini ko'rsating. |
| Yechim | RO 2 tarkibining yuqori oksidlari davriy sistemaning IV guruhida joylashgan elementlarni hosil qiladi. Bu guruh elementlari RH 4 tarkibidagi vodorod bilan uchuvchi birikmalar hosil qiladi. Kerakli elementni X deb belgilaymiz. U holda uning vodorod birikmasi tarkibidagi massa ulushi teng bo'ladi: ō(X)=100 - 12,5 = 87,5%. Ushbu elementning nisbiy atom massasini topamiz: A r (X) = ō(X)× n(H)/ō(H) = 87,5×4/12,5 = 28. Kremniy (Si) bu atom massasiga ega. Masala bayonida ko'rsatilgan birikmalarning formulalari quyidagicha ko'rinadi: SiO 2 va SiH 4. Kremniy atomining elektron qobig'idagi elektronlarning umumiy soni uning davriy jadvalidagi seriya raqamiga teng, ya'ni. 14. |
| Javob | Kremniy atomining elektron qavatidagi elektronlarning umumiy soni 14 ta. |