Кинетика на ензимните реакции. Зависимост на скоростта на ензимните реакции от концентрацията на субстрати, ензими, температура. Какъв е редът на ензимната реакция по ензим
Скоростта на ензимните реакции зависи от концентрацията на суб-
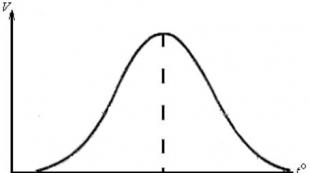
прослойка Тази зависимост е сложна, която за определени ензими се описва с параболична крива (фиг. 29).
Фигура 29 – Зависимост на скоростта на ензимната реакция
върху концентрацията на субстрата
Параболичният характер на зависимостта се обяснява с факта, че при взаимодействие на ензима със субстрата се образува ензимно-субстратен комплекс. Първоначално с увеличаване на концентрацията на субстрата концентрацията на ензим-субстратните комплекси в реакционната смес се увеличава, което се проявява в паралелно увеличаване на скоростта на реакцията. При определена концентрация на субстрата (насищане) настъпва вид "насищане" на всички активни центрове на ензимните молекули в реакционната смес. Скоростта на ензимната реакция при насищаща концентрация става максимална. При по-нататъшно увеличаване на съдържанието на субстрата в реакционната смес, то не се променя.
От графиката на зависимостта на скоростта на ензимната реакция от концентрацията на субстрата се изчисляват два важни показателя:
1. Максимална скорост на реакция (Vмакс). Определя се като скорост на реакцията при насищаща концентрация на субстрата. Стойността на максималната скорост отразява каталитичната сила на ензима. По-големи ензими Vмакс са по-мощни катализатори. Те катализират трансформацията на по-голям брой субстратни молекули за единица време. Максималната скорост се изразява с броя на оборотите на ензима. Броят на оборотите се оценява чрез броя на субстратните молекули, преобразувани от ензима за единица време (s -1). За повечето ензими числото на оборот е в рамките на 10 4. В същото време има ензими, за които скоростзначително повече (600 000 за карбанхидраза) или по-малко от тази стойност (100 за химотрипсин).
2. Константа на Михаелис (ДА СЕм). Константата на Михаелис е концентрацията на субстрата, при която скоростта на реакцията е наполовина максимална. величина ДА СЕ m отразява афинитета на ензима към субстрата. Колкото по-голяма е тази стойност, толкова по-малък афинитет има ензимът към субстрата. ДА СЕ m се изразява в молове субстрат. И така, стойността ДА СЕ m по отношение на глюкозата за ензима глюкокиназа е 10 mmol, а за хексокиназата - 0,01 mmol. Хексокиназата проявява по-голям афинитет към глюкозата от глюкокиназата; при същата концентрация на субстрата, тя катализира фосфорилирането на глюкозата с по-висока скорост.
Въз основа на математически анализ на кривата на зависимостта на скоростта на ензимната реакция от концентрацията на субстрата, L. Michaelis и M. Menten (1913) извеждат формула, която позволява да се оцени връзката между скоростта на реакцията, максималната скорост и константата на Михаелис. Понастоящем се определя като уравнението на Михаелис-Ментен.
V o = Vмакс [ С]/К m + [ С],
Където V o – скорост на реакция, С– концентрация на субстрата.
Общи свойства на ензимите
Въпреки наличието на някои различия в структурата, функцията и вътреклетъчната локализация, ензимите се характеризират с редица общи свойства. Те включват зависимостта на проявата на тяхната каталитична активност от температурата (термолабилност) и рН на околната среда, както и специфичността на субстрата.
Характерно свойство на ензимите е термолабилност. Това явление може да се илюстрира с графика на скоростта на ензимната реакция спрямо температурата на реакционната смес (фиг. 30).

Фигура 30 – Зависимост на скоростта на ензимната реакция от температурата
реакционна среда ( T opt – оптимална температура; V- бърза реакция)
Както се вижда от представената графика, при температура, близка до 4 o C, ензимни реакции практически не протичат. Поради тази причина биологичните обекти могат да се съхраняват на студено за определено време преди провеждане на биохимични изследвания. Именно студът позволява хранителните продукти да се запазят от автолиза (самосмилане).
Повишаването на температурата е придружено от увеличаване на скоростта на ензимната реакция. Причината за това е увеличаването на кинетичната енергия на молекулите на субстрата и ензима, което увеличава скоростта на взаимодействие между тях. Подобно явление се наблюдава до температура, която съответства на температурния оптимум на ензима. Температурен оптимум на ензимасъответства на температурата, при която скоростта на ензимната реакция е максимална. За ензимите на топлокръвните животни обикновено е 28 o C или 37 o C.
По-нататъшното повишаване на температурата на реакционната смес води до постепенно намаляване на скоростта на ензимната реакция. Това явление се дължи на процеса на термична денатурация на протеиновата полипептидна верига. Денатурацията е придружена от промяна в структурата на активния център на ензима, което води до намаляване на афинитета на ензима към субстрата. При температури над 55 o C повечето ензими губят напълно своите каталитични свойства (инактивират се). В тази връзка загряването до 55–56 o C се използва широко за процедурата на пастьоризация, което увеличава срока на годност на хранителните продукти (мляко и др.).
pH на околната среда оказва голямо влияние върху скоростта на ензимната реакция. Както се вижда от показаната фигура. 31 графика, тя прилича по форма на графика на зависимостта на скоростта на ензимната реакция от температурата.

Фигура 31 – Зависимост от скоростта ( V) ензимна реакция
върху pH на околната среда (pH opt – pH оптимум на ензима)
Рязкото намаляване на скоростта на ензимната реакция при екстремни стойности на pH се свързва с феномена на денатурация на полипептидната верига на протеинова молекула под въздействието на киселини и основи. Ензимът проявява максимална каталитична сила при стойност на pH, която се определя от термина pH оптималноензим. Повечето известни ензими имат оптимално рН в диапазона от 5,0 до 7,5. В същото време има много примери за ензими, при които оптималната стойност на pH е изместена към областта на киселинни или алкални стойности на pH. Тези ензими включват:
Причината за съществуването на зависимост на скоростта на ензимните реакции от pH се дължи на факта, че стойността на pH на средата има изразен ефект върху степента на йонизация на функционалните групи на субстрата. Характеристики на йонизацията на молекулата на янтарната киселина при различна киселинност на околната среда (pH):

В същото време pH на околната среда също влияе върху степента на йонизация на аминокиселинните радикали, които съставляват активния център на ензима:

Ако образуването на ензим-субстратния комплекс се стабилизира поради електростатични взаимодействия, тогава става ясна ролята на рН за осигуряване на оптимални условия за протичане на ензимната реакция (фиг. 24).
Скоростта на реакциите, катализирани от ензими, при взаимодействието на които със субстрати електростатичните взаимодействия не са значими, зависи в по-малка степен от рН на средата. На фиг. Фигура 32 показва зависимостта на скоростта на протеинова хидролиза от папаин. При взаимодействието на този ензим със субстрата първостепенно значение придобиват хидрофобните взаимодействия. Както може да се види от представената графика, папаинът обикновено няма ясно дефиниран рН оптимум.

Фигура 32 - Ефект на рН върху скоростта на протеинова хидролиза от папаин.
Ензимите имат определен специфичностпо отношение на субстратите. Специфичността се отнася до способността на ензимите да катализират трансформацията на един или група от структурно подобни субстрати. Има няколко вида ензимна специфичност.
· Абсолютна конкретност.Отнася се до способността на ензима да катализира трансформацията само на един субстрат. Ензимите с абсолютна специфичност включват аргиназа, уриказни рестрикционни ензими и др.
· Относителна специфичност. Това означава способността на ензима да катализира трансформацията на група субстрати, сходни по структура (така наречените протеолитични ензими хидролизират различни протеини, липазни естери на глицерол и висши мастни киселини, хексокиназата фосфорилира различни монозахариди). В този случай специфичността се определя от факта, че ензимът засяга само определен тип връзка (протеолитичните ензими хидролизират пептидната връзка, липазата хидролизира естерната връзка и т.н.).
· Стереоспецифичност . Този термин се отнася до способността на ензима да катализира превръщането на един стереоизомер на субстрат. По този начин ензимите, участващи в превръщането на монозахаридите, проявяват специфичност по отношение на техните д-стереоизомери, а ензимите, участващи в трансформацията на аминокиселините – към тех Л-стерео-изомери.
Ензимна активност
Особеността на ензимите като катализатори е, че те могат да променят своите каталитични свойства под въздействието на различни външни фактори. Мярка за силата на каталитичното действие на ензимите е тяхната дейност. Способността на ензимите да променят активността си при различни условия има голям биологичен смисъл. Това свойство позволява на живата клетка да адаптира състоянието на метаболитните процеси към непосредствените нужди на клетките, които могат да се променят значително под въздействието на различни външни фактори.
Определянето на ензимната активност играе важна роля в тяхното характеризиране. Има някои общи принципи за количествено определяне на ензимната активност. Ензимната активност може да се определи, както следва:
· или чрез скоростта на натрупване в реакционната смес, където се намира ензимът на реакционния продукт;
· или от скоростта на изчезване на субстрата на ензимната реакция от реакционната смес.
И двата подхода са еквивалентни и могат да се използват на практика. Въпреки това, когато се определя ензимната активност, трябва да се спазват следните условия: в реакционната смес, в която се определя ензимната активност,
· температурата трябва да съответства на температурния оптимум на ензима;
· рН на средата трябва да съответства на рН оптимума на този ензим;
· концентрацията на субстрата трябва да бъде не по-малка от насищащата;
· трябва да присъстват кофактори, ако този ензим ги има;
Трябва да присъстват ензимни активатори.
Така активността на ензима се определя при оптимални условия. При тези условия активността на ензима е пропорционална на съдържанието му в тестовата проба и следователно може да се използва за индиректна оценка на концентрацията му.
Ензимната активност се изразява количествено в единици дейност. Една единица ензимна активност (U) е ензимната активност, при която под нейно въздействие се образува 1 µmol от реакционния продукт (или 1 µmol от субстрата изчезва) на минута.. В системата SI единицата за ензимна активност е катал (кат). 1 катал отговаря на ензимна активност, при която се образува един мол реакционен продукт (един мол субстрат изчезва) за секунда.
Стойността на специфичната активност също се използва за характеризиране на ензими. Тази единица отразява активността на ензима на единица маса и се изразява в µmol/min mg протеин. Единиците за специфична активност се използват за оценка на чистотата на ензимните препарати. Колкото по-висока е специфичната активност, толкова по-чист е ензимният препарат.
Ензимната кинетика изучава влиянието на различни фактори (концентрации на S и E, pH, температура, налягане, инхибитори и активатори) върху скоростта на ензимните реакции. Основната цел на изучаването на кинетиката на ензимните реакции е да се получи информация, която позволява по-задълбочено разбиране на механизма на действие на ензимите.
Кинетична крива ви позволява да определите началната скорост на реакция V 0 .
Крива на насищане на субстрата.
Зависимост на скоростта на реакцията от концентрацията на ензима.
Зависимост на скоростта на реакцията от температурата.
Зависимост на скоростта на реакцията от pH.
|
|
Оптималното pH за действието на повечето ензими е във физиологичния диапазон 6,0-8,0. Пепсинът е активен при pH 1,5-2,0, което съответства на киселинността на стомашния сок. Аргиназата, специфичен за черния дроб ензим, е активен при 10,0. Влиянието на pH върху скоростта на ензимната реакция е свързано със състоянието и степента на йонизация на йоногенните групи в ензима и субстратните молекули. Този фактор определя конформацията на протеина, състоянието на активния център и субстрата, образуването на ензимно-субстратния комплекс и самия процес на катализа. |
Математическо описание на кривата на насищане на субстрата, константа на Михаелис .
|
|
Уравнението, описващо кривата на насищане на субстрата, е предложено от Михаелис и Ментън и носи техните имена (уравнение на Михаелис-Ментен): V = (V МАКС *[ С])/(Км+[ С]) , където Km е константата на Михаелис. Лесно е да се изчисли, че когато V = V MAX /2 Km = [S], т.е. Km е концентрацията на субстрата, при която скоростта на реакцията е ½ V MAX. За да се опрости определянето на V MAX и Km, уравнението на Михаелис-Ментен може да бъде преизчислено. 1/V = (Km+[S])/(V МАКС *[С]), 1/V = Km/(V МАКС *[S]) + 1/V МАКС , |
|
|
1/ V = Км/ V МАКС *1/[ С] + 1/ V МАКСУравнение на Лайнуивър-Бърк. Уравнението, описващо графиката на Lineweaver-Burk, е уравнението на права линия (y = mx + c), където 1/V MAX е пресечната точка на правата линия на оста y; Km/V MAX - тангенс на правата; пресечната точка на правата с абсцисната ос дава стойността 1/Km. Графиката на Lineweaver-Burk ви позволява да определите km от сравнително малък брой точки. Тази графика се използва и при оценка на ефекта на инхибиторите, което ще бъде обсъдено по-долу. Стойността на Km варира в широки граници: от 10 -6 mol/l за много активни ензими, до 10 -2 за ниско активни ензими. |
Оценките за км имат практическа стойност. При концентрации на субстрата 100 пъти по-големи от Km, ензимът ще работи с почти максимална скорост, така че максималната скорост V MAX ще отразява количеството на наличния активен ензим. Това обстоятелство се използва за оценка на ензимното съдържание в препарата. В допълнение, Km е характеристика на ензим, който се използва за диагностициране на ензимопатии.
Инхибиране на ензимната активност.
Изключително характерна и важна особеност на ензимите е тяхното инактивиране под въздействието на определени инхибитори.
инхибитори - това са вещества, които причиняват частично или пълно инхибиране на реакции, катализирани от ензими.
Инхибирането на ензимната активност може да бъде необратимо или обратимо, конкурентно или неконкурентно.
Необратимо инхибиране - това е постоянно инактивиране на ензима, в резултат на ковалентно свързване на инхибиторна молекула в активния център или в друг специален център, който променя конформацията на ензима. Дисоциацията на такива стабилни комплекси с регенерацията на свободния ензим е практически изключена. За да преодолее последствията от такова инхибиране, тялото трябва да синтезира нови ензимни молекули.
Обратимо инхибиране – характеризира се с равновесно комплексообразуване на инхибитора с ензима поради нековалентни връзки, в резултат на което такива комплекси са способни да се дисоциират с възстановяване на ензимната активност.
Класификацията на инхибиторите на конкурентни и неконкурентни се основава на това дали са отслабени ( конкурентно инхибиране ) или не е отслабена ( неконкурентно инхибиране ) техния инхибиращ ефект, когато концентрацията на субстрата се увеличи.
Конкурентни инхибитори - това са, като правило, съединения, чиято структура е подобна на структурата на субстрата. Това им позволява да се свързват в същото активно място като субстратите, предотвратявайки взаимодействието на ензима със субстрата още на етапа на свързване. След свързване инхибиторът може да се превърне в продукт или да остане в активното място, докато настъпи дисоциация.
Обратимо конкурентно инхибиране може да се представи като диаграма:
E↔ E-I → E + P 1
S (неактивен)
Степента на инхибиране на ензима се определя от съотношението на концентрациите на субстрата и ензима.
Класически пример за този тип инхибиране е инхибирането на активността на сукцинат дехидрогеназата (SDH) от малат, който измества сукцината от мястото на субстрата и предотвратява превръщането му във фумарат:

Ковалентното свързване на инхибитора към активното място води до инактивиране на ензима (необратимо инхибиране). Пример необратимо конкурентно инхибиране може да служи като инактивиране на триозофосфат изомераза с 3-хлороацетол фосфат. Този инхибитор е структурен аналог на субстрата, дихидроксиацетон фосфат, и се свързва необратимо с остатъка от глутаминова киселина в активното място:
Някои инхибитори действат по-малко селективно, взаимодействайки със специфична функционална група в активния център на различни ензими. По този начин свързването на йодоацетат или неговия амид към SH групата на аминокиселината цистеин, разположена в активния център на ензима и участваща в катализата, води до пълна загуба на ензимна активност:
R-SH + JCH 2 COOH → HJ + R-S-CH 2 COOH
Следователно тези инхибитори инактивират всички ензими, които имат SH групи, участващи в катализата.
Необратимото инхибиране на хидролазите под действието на нервнопаралитични газове (зарин, зоман) се дължи на ковалентното им свързване със сериновия остатък в активния център.
Методът на конкурентното инхибиране намери широко приложение в медицинската практика. Сулфонамидни лекарства, антагонисти на р-аминобензоената киселина, могат да служат като пример за метаболизирани конкурентни инхибитори. Те се свързват с дихидроптерат синтетазата, бактериален ензим, който превръща р-аминобензоата във фолиева киселина, необходима за бактериалния растеж. Бактерията умира в резултат на това, че свързаният сулфаниламид се превръща в друго съединение и не се образува фолиева киселина.
Неконкурентни инхибитори обикновено се свързват с ензимната молекула на място, различно от мястото на свързване на субстрата, и субстратът не се конкурира директно с инхибитора. Тъй като инхибиторът и субстратът се свързват с различни центрове, е възможно образуването както на E-I комплекс, така и на S-E-I комплекс. Комплексът S-E-I също се разгражда, за да образува продукт, но с по-бавна скорост от E-S, така че реакцията ще се забави, но няма да спре. По този начин могат да възникнат следните паралелни реакции:
E↔ E-I ↔ S-E-I → E-I + P
Обратимото неконкурентно инхибиране е относително рядко.
Нар. неконкурентни инхибитори алостеричен за разлика от конкурентните ( изостеричен ).
Обратимото инхибиране може да бъде количествено изследвано с помощта на уравнението на Михаелис-Ментен.
При конкурентно инхибиране V MAX остава постоянен и Km се увеличава.
|
|
|
При неконкурентно инхибиране V MAX намалява, докато Km остава непроменен.
|
|
|
Ако реакционният продукт инхибира ензима, който катализира образуването му, този метод на инхибиране се нарича ретроинхибиране или инхибиране на обратната връзка . Например, глюкозата инхибира глюкозо-6-фосфатазата, която катализира хидролизата на глюкозо-6-фосфата.
Биологичното значение на това инхибиране е регулирането на определени метаболитни пътища (вижте следващия урок).
ПРАКТИЧЕСКА ЧАСТ
Задача за ученици
1. Изследвайте денатурацията на протеини под въздействието на разтвори на минерални и органични киселини и при нагряване.
2. Открийте коензим NAD в дрожди.
3. Определете активността на амилазата в урината (кръвен серум).
9. СТАНДАРТИ ЗА ОТГОВОРИ НА ПРОБЛЕМИ, тестови въпроси, използвани за контрол на знанията в час (може да се използва като приложение)
10. СЪЩНОСТ И ОБХВАТ НА ВЪЗМОЖНАТА ОБРАЗОВАТЕЛНА И ИЗСЛЕДОВАТЕЛСКА РАБОТА ПО ТЕМАТА
(Посочете конкретно естеството и формата на UIRS: изготвяне на абстрактни презентации, провеждане на независими изследвания, симулационни игри, попълване на медицинска история с използване на монографична литература и други форми)
Ензимната кинетика изучава скоростта на реакциите, катализирани от ензими, в зависимост от различни условия (концентрация, температура, рН и др.) на тяхното взаимодействие със субстрата.
Ензимите обаче са протеини, които са чувствителни към влиянието на различни външни влияния. Следователно, когато изучават скоростта на ензимните реакции, те отчитат главно концентрациите на реагиращите вещества и се опитват да сведат до минимум влиянието на температурата, pH на околната среда, активаторите, инхибиторите и други фактори и да създадат стандартни условия. Първо, това е pH стойността на околната среда, която е оптимална за даден ензим. Второ, препоръчва се да се поддържа температура от 25°C, където е възможно. На трето място се постига пълно насищане на ензима със субстрата. Тази точка е особено важна, тъй като при ниски концентрации на субстрата не всички ензимни молекули участват в реакцията (фиг. 6.5, А), което означава, че резултатът ще бъде далеч от максимално възможния. Най-голямата мощност на катализираната реакция при равни други условия се постига, ако всяка ензимна молекула участва в трансформацията, т.е. при висока концентрация на ензимно-субстратния комплекс (фиг. 6.5, V).Ако концентрацията на субстрата не гарантира пълно насищане на ензима (фиг. 6.5, b), тогава скоростта на реакцията не достига максималната си стойност.
Ориз. 65.
А -при ниска концентрация на субстрата; 6 - с недостатъчна концентрация на субстрата; V -когато ензимът е напълно наситен със субстрат
Скоростта на ензимната реакция, измерена при горните условия и пълното насищане на ензима със субстрата, се нарича максимална скорост на ензимната реакция (V).
Скоростта на ензимната реакция, определена, когато ензимът не е напълно наситен със субстрата, се обозначава v.
Ензимната катализа може да се опрости чрез следната диаграма:

където F е ензим; S - субстрат; FS - ензим-субстратен комплекс.
Всеки етап от този процес се характеризира с определена скорост. Единицата за измерване на скоростта на ензимна реакция е броят молове субстрат, преобразувани за единица време(същата като скоростта на нормална реакция).
Взаимодействието на ензима със субстрата води до образуването на ензимно-субстратен комплекс, но този процес е обратим. Скоростите на правата и обратната реакция зависят от концентрациите на реагентите и се описват със съответните уравнения:
В състояние на равновесие уравнението (6.3) е валидно, тъй като скоростите на правата и обратната реакция са равни.
Замествайки стойностите на скоростта на предните (6.1) и обратните (6.2) реакции в уравнение (6.3), получаваме равенството:
Състоянието на равновесие се характеризира с подходящ равновесна константа K p,равно на отношението на константите на правата и обратната реакция (6.5). Реципрочната стойност на равновесната константа се нарича константа на субстрата Ks,или константата на дисоциация на комплекса ензим-субстрат:

От уравнение (6.6) става ясно, че субстратната константа намалява при високи концентрации на ензим-субстратния комплекс, т.е. с голяма стабилност. Следователно, субстратната константа характеризира афинитета на ензима и субстрата и съотношението на константите на скоростта за образуване и дисоциация на ензим-субстратния комплекс.
Феноменът на насищане на ензима със субстрат е изследван от Леонор Михаелис и Мод Мептен. Въз основа на математическа обработка на резултатите те извеждат уравнение (6.7), което получава имената си, от което става ясно, че при висока концентрация на субстрата и ниска стойност на константата на субстрата скоростта на ензимната реакция клони към максимума . Това уравнение обаче е ограничено, тъй като не взема предвид всички параметри:
Ензим-субстратният комплекс по време на реакцията може да претърпи трансформации в различни посоки:
- дисоциират на изходни вещества;
- се превръща в продукт, от който ензимът се отделя непроменен.
Следователно, за да се опише цялостното действие на ензимния процес, концепцията константи на Михаелис Kt,което изразява връзката между скоростните константи на всичките три реакции на ензимна катализа (6.8). Ако двата члена се разделят на константата на скоростта на реакцията за образуване на ензимно-субстратния комплекс, получаваме израз (6.9):

Важно следствие следва от уравнение (6.9): константата на Михаелис винаги е по-голяма от константата на субстрата с количеството k 2 /k v
Числено K tравна на концентрацията на субстрата, при която скоростта на реакцията е половината от максималната възможна скорост и съответства на насищането на ензима със субстрата, както на фиг. 6.5, b.Тъй като на практика не винаги е възможно да се постигне пълно насищане на ензима със субстрата, то именно K tизползвани за сравнителна характеристика на кинетичните характеристики на ензимите.
Скоростта на ензимната реакция, когато ензимът не е напълно наситен със субстрата (6.10), зависи от концентрацията на ензим-субстратния комплекс. Коефициентът на пропорционалност е константата на реакцията за освобождаване на ензима и продукта, тъй като това променя концентрацията на ензим-субстратния комплекс:
След трансформации, като се вземат предвид горните зависимости, скоростта на ензимната реакция, когато ензимът не е напълно наситен със субстрата, се описва с уравнение (6.11), т.е. зависи от концентрациите на ензима, субстрата и техния афинитет K s:
Графичната зависимост на скоростта на ензимната реакция от концентрацията на субстрата не е линейна. Както е очевидно от фиг. 6.6, с увеличаване на концентрацията на субстрата се наблюдава повишаване на ензимната активност. Въпреки това, когато се постигне максимално насищане на ензима със субстрата, скоростта на ензимната реакция става максимална. Следователно факторът, ограничаващ скоростта на реакцията, е образуването на ензимно-субстратен комплекс.
Практиката показва, че концентрациите на субстрата, като правило, се изразяват в стойности, много по-малки от единица (10 6 -10 3 mol). Доста е трудно да се работи с такива количества в изчисленията. Ето защо G. Lineweaver и D. Burke предложиха да изразят графичната зависимост на скоростта на ензимната реакция не в директни координати, а в обратни. Те изхождат от предположението, че за равни количества техните обратни също са равни:

Ориз. 6.6.
След трансформиране на израз (6.13) получаваме израз, наречен Уравнение на Лайнуивър-Бърк (6.14):
Графичната зависимост на уравнението на Lineweaver-Burk е линейна (фиг. 6.7). Кинетичните характеристики на ензима се определят, както следва:
- сегментът, отсечен върху ординатната ос, е равен на 1/V;
- сегментът, отсечен по абсцисната ос, е равен на -1 /Към t.

Ориз. 6.7.
Смята се, че методът на Lineweaver-Burk позволява да се определи максималната скорост на реакция по-точно, отколкото в преките координати. Ценна информация относно ензимното инхибиране също може да бъде извлечена от тази графика.
Има и други начини за трансформиране на уравнението на Михаелис-Ментен. Графичните зависимости се използват за изследване на влиянието на различни външни въздействия върху ензимния процес.
Този дял от ензимологията изучава влиянието на различни фактори върху скоростта на ензимната реакция. Като се има предвид общото уравнение за ензимна катализа на обратимата реакция на превръщане на един субстрат в един продукт (1),
Трябва да се назоват основните фактори, влияещи върху скоростта на ензимната реакция: концентрация на субстрат [S], концентрация на ензим [E] и концентрация на реакционния продукт [P].
Взаимодействието на някои ензими с техния субстрат може да се опише чрез хиперболична крива на зависимостта на скоростта на ензимната реакция V от концентрацията на субстрата [S] (фиг. 19):

Фиг. 19. Зависимост на скоростта на ензимната реакция от концентрацията на субстрата.
На тази крива могат да се разграничат три участъка, които могат да се обяснят с разпоредбите на механизма на взаимодействие на ензима със субстрата: OA - участък на пряко пропорционална зависимост на V от [S], активните центрове на ензима постепенно се запълват със субстратни молекули с образуването на нестабилен комплекс ES; участък AB - криволинейна зависимост на V от [S], все още не е постигнато пълно насищане на активните центрове на ензима със субстратни молекули. Комплексът ES е нестабилен преди да достигне преходното състояние; вероятността за обратна дисоциация до E и S е все още висока; сечение BC - зависимостта се описва с уравнение от нулев ред, сечението е успоредно на оста [S], постигнато е пълно насищане на активните ензими със субстратни молекули, V=V max.
Характерната форма на кривата се описва математически от уравнението на Бригс-Халдейн:
V=V max ● [S]/ Km + [S] (2),
където Km е константата на Михаелис-Ментен, числено равна на концентрацията на субстрата, при която скоростта на ензимната реакция е равна на половината V max.
Колкото по-ниско е K m на ензима, толкова по-висок е афинитетът на ензима към субстрата, толкова по-бързо се достига преходно състояние за субстрата и той се превръща в реакционен продукт. Намирането на стойности на Km за всеки специфичен за групата ензимен субстрат е важно за определяне на биологичната роля на този ензим в клетката.
За повечето ензими е невъзможно да се построи хиперболична крива (фиг. 19).В този случай се използва методът на двойните реципрочни величини (Lineweaver-Burk), т.е. е начертана графична зависимост на 1/[V] от 1/[S] (фиг. 20). Методът за конструиране на такива криви в експеримент е много удобен при изследване на ефекта на различни видове инхибитори върху ензимната активност (виж по-нататък в текста).

Фиг.20. Графика на 1/[V] спрямо 1/[S] (метод на Lineweaver-Burk),
където y е граничната част - и x е граничната част -  , тангенс на ъгъл α - .
, тангенс на ъгъл α - .
Зависимост на скоростта на ензимната реакция V от концентрацията на ензима [E].
Тази графична зависимост (фиг. 21) се разглежда при оптимална температура и pH на средата, при концентрации на субстрата, значително по-високи от концентрацията на насищане на активните центрове на ензима.

Ориз. 21. Влиянието на концентрацията на ензима върху скоростта на ензимната реакция.
Зависимост на скоростта на ензимната реакция от концентрацията на кофактор или коензим.За комплексните ензими трябва да се има предвид, че дефицитът на коензимни форми на витамини в случай на хиповитаминоза и нарушение на приема на метални йони в тялото задължително води до намаляване на концентрацията на съответните ензими, необходими за протичането на на метаболитните процеси. Следователно трябва да се заключи, че активността на ензима е в пряка зависимост от концентрацията на кофактора или коензима.
Влиянието на концентрацията на продукта върху скоростта на ензимната реакция.За обратими реакции, протичащи в човешкото тяло, трябва да се има предвид, че продуктите от директната реакция могат да бъдат използвани от ензима като субстрати за обратната реакция. Следователно посоката на потока и моментът на достигане на Vmax зависят от съотношението на концентрациите на изходните субстрати и реакционните продукти. Например, активността на аланин аминотрансферазата, която катализира трансформацията:
Аланин + Алфа-кетоглутарат ↔ Пируват + Глутамат
зависи в клетката от съотношението на концентрация:
[аланин + алфа-кетоглутарат] / [пируват + глутамат].
МЕХАНИЗЪМ НА ДЕЙСТВИЕ НА ЕНЗИМА. ТЕОРИИ ЗА ЕНЗИМНАТА КАТАЛИЗА
Ензимите, подобно на непротеиновите катализатори, увеличават скоростта на химичната реакция поради способността им да намаляват енергията на активиране на тази реакция. Енергията на активиране на ензимната реакция се изчислява като разликата между енергийната стойност в системата на протичащата реакция, която е достигнала преходното състояние, и енергията, определена в началото на реакцията (вижте графичната зависимост на фиг. 22).

Ориз. 22. Графична зависимост на енергийното състояние на химична реакция без ензим (1) и в присъствието на ензим (2) от времето на реакцията.
Работата на V. Henry и по-специално на L. Michaelis, M. Menten върху изучаването на механизма на моносубстратните обратими ензимни реакции направи възможно постулирането, че ензим Е първо обратимо и сравнително бързо се комбинира със своя субстрат S, за да образува ензим- субстратен комплекс (ES):
E+S<=>ES (1)
Образуването на ES се дължи на водородни връзки, електростатични, хидрофобни взаимодействия, в някои случаи ковалентни, координационни връзки между страничните радикали на аминокиселинните остатъци на активния център и функционалните групи на субстрата. При сложните ензими функцията за контакт със субстрата може да се изпълнява и от небелтъчната част на структурата.
След това комплексът ензим-субстрат се разпада във втора, по-бавна, обратима реакция, за да се получи реакционен продукт P и свободен ензим E:
ES<=>ЕП<=>E+P (2)
Понастоящем, благодарение на работата на гореспоменатите учени, както и на Keilin D., Chance B., Koshland D. (теорията за „индуцирана кореспонденция“), има теоретични положения за четири основни точки в механизма на действие на ензим върху субстрат, които определят способността на ензимите да ускоряват химичните реакции:
1. Ориентация и подход . Ензимът е в състояние да свърже субстратна молекула по такъв начин, че връзката, атакувана от ензима, е не само разположена в непосредствена близост до каталитичната група, но и правилно ориентирана по отношение на нея. Вероятността ES комплексът да достигне преходното състояние чрез ориентация и близост е значително увеличена.
2. Стрес и напрежение : индуцирана кореспонденция. Прикрепването на субстрат може да причини конформационни промени в ензимната молекула, което води до напрежение в структурата на активния център, а също така до известна степен деформира свързания субстрат, като по този начин улеснява постигането на преходно състояние от ES комплекса. Между молекулите E и S възниква така нареченото индуцирано съответствие.
Скоростта на ензимните реакции зависи от концентрацията на ензима, субстрата, температурата, pH и наличието на активатори и инхибитори.
При условия на излишък на субстрат скоростта на реакцията право-пропорционален ензимна концентрация (фиг. 3.2).
Ориз. 3.2. Зависимост на скоростта на реакцията от концентрацията на ензима.
Зависимост на скоростта на реакция от концентрация на субстрата представени на фигура 3.3.
Ориз. 3.3. Зависимост на скоростта на реакцията от концентрацията на субстрата.
На графиката има 3 секции. При ниска концентрация на субстрат (раздел А) скоростта на реакцията е право пропорционална на концентрацията на субстрата и се подчинява на кинетиката от първи ред. Местоположение на b(реакция от смесен ред) тази зависимост е нарушена. Местоположение на ° Сскоростта на реакцията е максимална и не зависи от концентрацията на субстрата.
Ензимната реакция се характеризира с образуването на ензимно-субстратен комплекс, който се разпада, за да образува свободния ензим и реакционния продукт.
В това уравнение k 1 е константата на скоростта за образуване на ензим-субстратния комплекс, k 2 е константата на дисоциация на ензим-субстратния комплекс за образуване на свободен ензим и субстрат и k 3 е константата на скоростта на дисоциацията на ензим-субстратния комплекс до свободния ензим и реакционния продукт.
Михаелис и Ментен предложиха уравнение, което описва зависимостта на скоростта на реакцията от концентрацията на субстрата.
v е скоростта на реакцията при дадена концентрация на субстрата; Ks – константа на дисоциация на ензим-субстратния комплекс; Vmax – максимална скорост на реакция.
Ks=k -2 /k 1 т.е. съотношението на константата на обратната реакция към константата на правата реакция.
Това уравнение обаче описва само секцията Ана графиката и не отчита влиянието на реакционните продукти върху скоростта на ензимния процес.
Халдейн и Бригс замениха константата на дисоциация в уравнението с константата на Михаелис (Km).
Константа на Михаелисчислено равна на концентрацията на субстрата, при което скоростта на реакцията е половината от максималната. Константата на Михаелис характеризира афинитета на ензима и субстрата. Високият афинитет на ензим към субстрат се характеризира с ниска стойност на Km и обратно.
Използването на графиката, предложена от Михаелис и Ментен, е неудобно. За по-удобно графично представяне G. Lineweaver и D. Burke трансформират уравнението на Haldane и Briggs, използвайки метода на двойните реципрочни величини, базиран на принципа, че ако има равенство между две величини, тогава реципрочните величини също ще бъдат равни.
Графично представяне на зависимостта на скоростта на реакцията от pH има форма на камбана. Стойността на pH, при която ензимът проявява максимална активност, се нарича оптимално pH(Фиг. 5.4 A) . За повечето ензими оптималното pH е 6-8. Изключение прави пепсинът, чийто оптимум е 2,0. Когато рН се промени в една или друга посока от оптималното, скоростта на реакцията намалява поради йонизацията на функционалните групи на ензима и субстрата, което нарушава образуването на ензимно-субстратния комплекс.
Ориз. 3.4. Зависимост на скоростта на реакцията от рН (А) и температура (В).
Скоростта на химичната реакция се увеличава 2 пъти с увеличаване температура с 10°C. Въпреки това, поради протеиновата природа на ензима, при по-нататъшно повишаване на температурата настъпва денатурация на ензима. Температурата, при която скоростта на реакцията е максимална, се нарича температурен оптимум(Фиг. 3.4. B) . За повечето ензими оптималната температура е 37-40°C. Изключение прави мускулната миокиназа, която издържа на нагряване до 100°C.
Ензимни активатори– това са вещества 1) образуващи активния център на ензима (Co 2+, Mg 2+, Zn 2+, Fe 2+, Ca 2+); 2) улесняване на образуването на ензим-субстратния комплекс (Mg 2+); 3) редуциращи SH групи (глутатион, цистеин, меркаптоетанол); 4) стабилизиране на нативната структура на протеиновия ензим. Ензимните реакции обикновено се активират от катиони (в периодичната таблица от 19 до 30). Анионите са по-малко активни, въпреки че хлорните йони и анионите на някои други халогени могат да активират пепсин, амилаза и аденилатциклаза. Протеините могат да бъдат активатори: апопротеин A-I (LCAT), апопротеин C-II (LPL).
Механизъм на действие на активаторите:
1) участват в образуването на активния център на ензимите;
2) улесняват свързването на субстрата и ензима;
3) участват в образуването на естествената структура на ензима.
инхибитори– вещества, които причиняват частично или пълно инхибиране на реакции, катализирани от ензими.
Инхибиторите се класифицират в неспецифичниИ специфичен. Действието на неспецифичните инхибитори не е свързано с механизма на действие на ензимите. Тези инхибитори причиняват денатурация на ензимния протеин (топлина, киселини, основи, соли на тежки метали и др.).
Специфичните инхибитори влияят върху механизма на действие на ензимите. Специфичните инхибитори се разделят на 2 групи: обратими и необратими. Необратимите инхибитори причиняват постоянна, необратима промяна или модификация на функционалните групи на ензима чрез плътно или ковалентно свързване. Тази група включва: 1) метални инхибиториензими (HCN, RCN, HF, CO и др.). Тези съединения се свързват с метали с променлива валентност (Cu или Fe), в резултат на което се нарушава процесът на пренос на електрони по дихателната верига на ензимите. Следователно тези инхибитори се наричат респираторни отрови. 2) инхибитори на ензими, съдържащи SH групи(моноидоацетат, дийодоацетат, йодоацетамид, съединения на арсен и живак). 3) инхибитори на ензими, съдържащи ОН група в активния център (органофосфорни съединения, инсектициди). Тези инхибитори инхибират преди всичко активността на холинестеразата, ензим, който играе основна роля в дейността на нервната система.
Реверсивнаинхибирането може да се определи количествено с помощта на уравнението на Михаелис-Ментен. Обратимите инхибитори се делят на състезателни и несъстезателни.
Конкурентни инхибитори- Това са вещества, подобни по структура на субстрата. Инхибиторът се свързва с активния център на ензима и предотвратява образуването на ензим-субстратния комплекс.
Класически пример за конкурентно инхибиране е инхибирането на сукцинат дехидрогеназата от малонова киселина. Сукцинат дехидрогеназата катализира окислението на янтарна киселина (сукцинат) чрез дехидрогениране до фумарова киселина.
Ако към средата се добави малонова киселина (инхибитор), тогава, в резултат на нейното структурно сходство с истинския субстратен сукцинат, тя ще реагира с активното място, за да образува комплекс ензим-инхибитор, но реакцията няма да настъпи.
Ефектът на инхибитора се елиминира от увеличаване на концентрацията на субстрата. При конкурентно инхибиране кинетиката на ензимните реакции се променя: Km нараства, V max остава постоянен(фиг. 3.5).
Ориз. 3.5. Ефект на конкурентни инхибитори върху скоростта на ензимната реакция
Методът на конкурентното инхибиране е намерил приложение в медицинската практика като антиметаболити.
Например, сулфонамидни лекарства се използват за лечение на някои инфекциозни заболявания, причинени от бактерии. Тези лекарства са структурно подобни на пара-аминобензоената киселина, която бактериалната клетка използва, за да синтезира фолиева киселина, която е необходима за живота на бактериите. Поради това структурно сходство сулфонамидът блокира действието на ензима, като измества пара-аминобензоената киселина от комплекса с ензима, който синтезира фолиевата киселина.
Неконкурентни инхибитори –вещества, които не са структурно подобни на субстратите. Неконкурентните инхибитори се свързват не с активното място, а с друго място в ензимната молекула, например в алостеричния център. Това променя конформацията на активния център по такъв начин, че взаимодействието на субстрата с него се нарушава.
За неконкурентно инхибиране: V max намалява, но K m не се променя(фиг. 3.6).