Кислород химия. Кислород – характеристика элемента, распространённость в природе, физические и химические свойства, получение. Токсические производные кислорода
Разделы: Химия
«Свободный кислород – самый могущественный деятель из всех известных нам химических тел земной коры».
В.И.Вернадский
Цели и задачи :
- Знать значение кислорода
- Знать историю открытия кислорода
- Знать свойства кислорода и его применение
- Уметь давать характеристику кислороду как химическому элементу и как простому веществу.
- Уметь составлять уравнения реакций взаимодействия кислорода с металлами и неметаллами.
- Закрепить умения расстановки коэффициентов в уравнениях реакций.
Оборудование и реактивы :
Для опыта «Получение кислорода разложением пероксида водорода в присутствии катализатора»: металлический штатив, перекись водорода (3%-ный раствор), оксид марганца (IV), колба, воронка с краном, газоотводная трубка, химический стаканчик для собирания кислорода методом вытеснения воздуха, лучинка, спички.
Для опыта «Несгораемый платок»: спирт, вода, щипцы, носовой платок, два маленьких кристаллизатора, спички.
Т.С.О.
- Коллекция «Минералы»
- Справочник по минералогии
- Компьютер, мультимедиа-приставка.
- Презентация урока с использованием материалов «Образовательной коллекции» (Приложение 1 )
- Таблица «Кислород в природе»
Ход урока
1) Значение кислорода
(слайды 3-4)
Кислород – это сознание человека. Он особенно необходим мозгу. Клетки мозга разлагаются и умирают без кислорода гораздо быстрее других клеток организма.
62% массы человека – это масса всех атомов кислорода, входящих в состав тела.
Кислород входит в состав органических соединений: белков, жиров, углеводов, витаминов, ферментов, гормонов.
Высокая окислительная способность кислорода лежит в основе горения всех видов топлива.
2) Характеристика кислорода как химического элемента
(слайды 5-8)
- Химический знак – О,
- латинское название – Оxygenium,
- А r (O) = 16;
- валентность – II,
- степень окисления в соединениях: – 2;
- содержание в земной коре – I место – более 49% ,
- самые распространённые оксиды: оксид водорода (вода) – H 2 O, оксид кремния – SiO 2 , оксид алюминия – Al 2 O 3 .
Демонстрация минералов:
- кварц – SiO 2 – эту устойчивую при низких температурах модификацию обычно называют просто кварцем; происхождение названия остается неизвестным. Кварц является одним из наиболее распространенных в земной коре.
- аметист –SiO 2
- горный хрусталь – SiO 2
- агат – SiO 2
- рубин – А l 2 О 3 – одна из разновидностей корунда
- изумруд – Be 3 Al 2 [ Si 6 O 18 ] – одна из разновидностей берилла. Химический состав:SiO 2 66,9%.Al 2 O 3 19,0 %, BeO 14,1%, в виде примесей содержатся Na 2 O, K 2 O, Li 2 O , иногда Rb 2 O, Cs 2 O .
- александрит – BeAl 2 O 4 – р азновидность хризоберилла "хризос" по гречески – золото. Химический состав. Al 2 O 3 80,2 %. BeO 19,8 %, Всегда присутствуют примеси: FeO (3,5-6%), иногда TiO 2 (до 3%) и Cr 2 O 3 (до 0,4%), с чем связана окраска александрита. Цветалександрита изумрудно-зеленый, а при электрическом освещении – фиолетово-красный.
3) Характеристика кислорода как простого вещества
- Химическая формула – О 2 , M r =32; М = 32 г / моль.
- В составе атмосферы около 21 % кислорода, (1/5 часть).
- Ежегодно в результате фотосинтеза в атмосферу Земли поступает 3000 млрд. тонн кислорода.
- Основные поставщики кислорода – тропические леса и фитопланктон океана.
- Человек в сутки вдыхает примерно 750 литров кислорода.
- Полное прохождение атмосферного кислорода через систему биологического круговорота составляет 2000 лет!
4) Физические свойства кислорода
(слайд 10)
- бесцветный газ, без вкуса, без запаха,
- малорастворим в воде,
- немного тяжелее воздуха, (М возд. = 29 г/моль)
- t сжижения = -183°C, голубая жидкость,
- t замерзания = -218,8°C, синие кристаллы,
5) История открытия кислорода
(слайды 11-14)
- Древние греки: «Воздух – сложное тело».
- VIII век, Китай, Мао Хоа: «Воздух состоит из «полного воздуха» (азота) и «неполного воздуха» (кислорода).
- Карл Шееле, Швеция, опыты с 1768 по 1773: «Исследования воздуха являются в настоящее время важнейшим предметом химии». Получил кислород при нагревании селитры.
1772 год: «Атмосферный воздух состоит из двух частей: «огненный воздух» – поддерживает дыхание и горение, «испорченный воздух» – не поддерживает горения». - Джозеф Пристли, Англия, 1774 год: «Но что поразило меня больше всего – это то, что свеча горела в этом воздухе удивительно блестящим пламенем».
При нагревании оксида ртути Дж.Пристли получил бесцветный газ, который мало растворялся в воде и поддерживал горение свечи. - Антуан Лоран Лавуазье, Франция, 1777 год
Подлинная природа этого газа была установлена во Франции: Лавуазье выяснил, что кислород - простое вещество и какую роль он играет в процессах окисления. Название Oxygenium – «рождающий кислоту», предложено Лавуазье.
6) Получение в лаборатории
Демонстрационный опыт (слайд 15): получить кислород способом разложения перманганата калия при нагревании; собрать его методом вытеснения воздуха, подтвердить наличие кислорода тлеющей лучинкой:
2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2
Демонстрационный опыт: получить кислород способом разложения перекиси водорода в присутствии катализатора оксида марганца (IV); собрать его методом вытеснения воды, подтвердить наличие кислорода тлеющей лучинкой:
2 H 2 O 2 = 2H 2 O + O 2
7) Получение в промышленности
сжижение воздуха.
8) Химические свойства кислорода
(слайд 16)
- облегчает дыхание;
- поддерживает горение;
- повышает температуру пламени;
- ускоряет химические реакции;
Где и как человек использует эти свойства кислорода?
- взаимодействует с металлами (слайды 17-19)
Записать уравнения реакций, расставить коэффициенты, назвать образующиеся вещества. Что такое оксиды?
Оксиды – бинарные соединения металлов и неметаллов с кислородом. На первом месте в формуле оксида пишут химический знак элемента, на втором – химический знак кислорода.
4Fe + 3O 2 =2Fe 2 O 3
3Fe + 2O 2 =Fe 3 O 4
2Mg + O 2 = 2MgO
Fe 2 O 3 – оксид железа (III), FeO - оксид железа (II), (Fe 2 O 3 и FeO) – Fe 3 O 4 – железная окалина, MgO – оксид магния.
- взаимодействует с неметаллами; (слайды 20-21)
Записать уравнения реакций, расставить коэффициенты, назвать образующиеся вещества
4P + 5O 2 = 2 P 2 O 5
2H 2 + O 2 = 2H 2 O
- взаимодействует со сложными веществами, (слайд 22) демонстрационный опыт: «несгораемый платок»:
C 2 H 6 O + 3O 2 = 2CO 2 + 3H 2 O
Реакции взаимодействия простых и сложных веществ с кислородом называются реакциями окисления.
9) Закрепление изученного материала
(слайды 23-25)
(химический тест):
Кто назвал кислород «огненным», а азот « испорченным» воздухом?
Какие вещества образует химический элемент кислород?
А) только простые вещества, В) простые и сложные вещества, С) только сложные вещества.
Как называются бинарные соединения, молекулы которых образованы атомами какого-либо химического элемента и кислорода:
А) сульфиды, В) хлориды, С) оксиды.
В 1774 году один учёный после проведённого эксперимента написал: «Но что поразило меня больше всего – это то, что свеча горела в этом воздухе удивительно блестящим пламенем…» Это был:
А) Лавуазье, В) Пристли, С) Шееле.
Название «Оxygenium» предложил:
А) Лавуазье, В) Пристли, С) Шееле.
Кислород в воде:
А) хорошо растворим, В)малорастворим, С)вообще не растворяется.
При вдувании кислорода в пламя температура пламени:
А) не изменяется, В) понижается, С) повышается.
Оксид железа (III) имеет формулу:
А) Fe 2 O 3 , В) FeO, С) FeO 2 .
В каком уравнении коэффициенты расставлены правильно:
А) 2P + O 2 = P 2 O 5 ; В) 2P + 5O 2 = P 2 O 5 , С) 4P + 5O 2 = 2P 2 O 5
В каком ряду все три формулы написаны правильно:
А) P 2 O 5 , Al 2 O, H 2 O; В) MgO, Al 2 O 3 , CO 2 ; С) CO 2 , FeO 2 , P 2 O 5
Проверка диктанта. (слайд 26-27)
| Номер вопроса | Буква ответа | Правильно + Неправильно - |
| 1 | С | |
| 2 | В | |
| 3 | С | |
| 4 | В | |
| 5 | А | |
| 6 | В | |
| 7 | С | |
| 8 | А | |
| 9 | С | |
| 10 | В |
Итого:
Оценка:
Критерии оценки:
- «5» – 10-9 правильных ответов
- «4» – 8-7 правильных ответов
- «3» – 6-5 правильных ответов
Введение
Каждый день мы вдыхаем такой необходимый нам воздух. А вы никогда не задумывались о том, из чего, точнее из каких веществ, состоит воздух? Больше всего в нем азота (78%), далее идет кислород (21%) и инертные газы (1%). Хоть кислород и не составляет самую основную часть воздуха, но без него атмосфера была бы непригодной для жизни. Благодаря ему на Земле существует жизнь, ведь азот и вместе и по отдельности губительны для человека. Давайте рассмотрим свойства кислорода.
Физические свойства кислорода
В воздухе кислород просто так не различишь, так как в обычных условиях он является газом без вкуса, цвета и запаха. Но кислород можно искусственным путем перевести в другие агрегатные состояния. Так, при -183 о С он становится жидким, а при -219 о С твердеет. Но твердый и жидкий кислород может получить только человек, а в природе он существует лишь в газообразном состоянии. выглядит так (фото). А твердый похож на лед.
Физические свойства кислорода - это еще и строение молекулы простого вещества. Атомы кислорода образуют два таких вещества: кислород (О 2) и озон (О 3). Ниже показана модель молекулы кислорода.

Кислород. Химические свойства
Первое, с чего начинается химическая характеристика элемента - его положение в Д. И. Менделеева. Итак, кислород находится во 2 периоде 6 группе главной подгруппе под номером 8. Его атомная масса - 16 а.е.м, он является неметаллом.
В неорганической химии его бинарные соединения с другими элементами объединили в отдельный - оксиды. Кислород может образовывать химические соединения как с металлами, так и с неметаллами.
Поговорим о его получении в лабораториях.
Химическим путем кислород можно получить с помощью разложения перманганата калия, пероксида водорода, бертолетовой соли, нитратов активных металлов и оксидов тяжелых металлов. Рассмотрим уравнения реакций при применении каждого из этих способов.
1. Электролиз воды:
Н 2 О 2 = Н 2 О + О 2
5. Разложение оксидов тяжелых металлов (например, оксида ртути):
2HgO = 2Hg + O 2
6. Разложение нитратов активных металлов (например, нитрата натрия):
2NaNO 3 = 2NaNO 2 + O 2
Применение кислорода
С химическими свойствами мы закончили. Теперь пора поговорить о применении кислорода в жизни человека. Он нужен для сжигания топлива в электрических и тепловых станциях. Его используют для получения стали из чугуна и металлолома, для сварки и резки металла. Кислород нужен для масок пожарных, для баллонов водолазов, применяется в черной и цветной металлурги и даже в изготовлении взрывчатых веществ. Также в пищевой промышленности кислород известен как пищевая добавка Е948. Кажется, нет отрасли, где бы он не использовался, но самую важную роль он играет в медицине. Там он так и называется - "кислород медицинский". Для того чтобы кислород был пригоден для использования, его предварительно сжимают. Физические свойства кислорода способствуют тому, что его можно сжать. В подобном виде он хранится внутри баллонов, похожих на такие.

Его используют в реанимации и на операциях в аппаратуре для поддержания жизненных процессов в организме больного пациента, а также при лечении некоторых болезней: декомпрессионной, патологий желудочно-кишечного тракта. С его помощью врачи каждый день спасают множество жизней. Химические и физические свойства кислорода способствуют тому, что его используют так широко.
>>
Химические свойства кислорода. Оксиды
В этом параграфе речь идет:
> о реакциях кислорода с простыми и сложными веществами;
> о реакциях соединения;
> о соединениях, которые называют оксидами.
Химические свойства каждого вещества проявляются в химических реакциях при его участии.
Кислород - один из наиболее активных неметаллов. Ho в обычных условиях он реагирует с немногими веществами. Его реакционная способность существенно возрастает с повышением температуры.
Реакции кислорода с простыми веществами.
Кислород реагирует, как правило, при нагревании, с большинством неметаллов и почти со всеми металлами.
Реакция с углем (углеродом). Известно, что уголь, нагретый на воздухе до высокой температуры, загорается. Это свидетельствует о протекании химической реакции вещества с кислородом. Теплоту, которая выделяется при этом, используют, например, для обогрева домов в сельской местности.
Основным продуктом сгорания угля является углекислый газ. Его химическая формула - CO 2 . Уголь - смесь многих веществ. Массовая доля Карбона в нем превышает 80 % . Считая, что уголь состоит только из атомов Карбона, напишем соответствующее химическое уравнение:
t
С + O 2 = CO 2 .
Карбон образует простые вещества - графит и алмаз. Они имеют общее название - углерод - и взаимодействуют с кислородом при нагревании согласно приведенному химическому уравнению 1 .
Реакции, при которых из нескольких веществ образуется одно, называют реакциями соединения.
Реакция с серой.
Это химическое превращение осуществляет каждый, когда зажигает спичку; сера входит в состав ее головки. В лаборатории реакцию серы с кислородом проводят в вытяжном шкафу. Небольшое количество серы (светло-желтый порошок или кристаллы) нагревают в железной ложке. Вещество
сначала плавится, потом загорается в результате взаимодействия с кислородом воздуха и горит едва заметным синим пламенем (рис. 56, б). Появляется резкий запах продукта реакции - сернистого газа (этот запах мы ощущаем в момент загорания спички). Химическая формула сернистого газа - SO 2 , а уравнение реакции -
t
S + O 2 = SO 2 .
Рис. 56. Сера (а) и ее горение на воздухе (б) и в кислороде (в)
1 В случае недостаточного количества кислорода образуется другое соединение Карбона с Оксигеном
- угарный газ
t
CO: 2С + O 2 = 2СО.

Рис. 57. Красный фосфор (а) и его горение на воздухе (б) и в кислороде (в)
Если ложку с горящей серой поместить в сосуд с кислородом, то сера будет гореть более ярким пламенем, чем на воздухе (рис. 56, в). Это можно объяснить тем, что молекул O 2 в чистом кислороде больше, чем в воздухе.
Реакция с фосфором. Фосфор, как и сера, горит в кислороде интенсивнее, чем на воздухе (рис. 57). Продуктом реакции является белое твердое вещество - фосфор(\/) оксид (его мелкие частицы образуют дым):
t
P + O 2 -> P 2 0 5 .
Превратите схему реакции в химическое уравнение.
Реакция с магнием.
Раньше эту реакцию использовали фотографы
для создания яркого освещения («магниевая вспышка») при фотосъемке. В химической лаборатории соответствующий опыт проводят так. Металлическим пинцетом берут магниевую ленту и поджигают на воздухе. Магний сгорает ослепительно-белым пламенем (рис. 58, б); смотреть на него нельзя! В результате реакции образуется белое твердое вещество. Это соединение Магния с Оксигеном; его название - магний оксид.

Рис. 58. Магний (а) и его горение на воздухе (б)
Составьте уравнение реакции магния с кислородом.
Реакции кислорода со сложными веществами. Кислород может взаимодействовать с некоторыми оксигенсодержащими соединениями. Например, угарный газ CO горит на воздухе с образованием углекислого газа:
t
2СО + O 2 = 2С0 2 .
Немало реакций кислорода со сложными веществами мы осуществляем в повседневной жизни, сжигая природный газ (метан), спирт, древесину, бумагу, керосин и др. При их горении образуются углекислый газ и водяной пар:
t
CH 4 + 20 2 = CO 2 + 2Н 2 О;
метан
t
C 2 H 5 OH + 30 2 = 2С0 2 + 3H 2 О.
спирт
Оксиды.
Продуктами всех реакций, рассмотренных в параграфе, являются бинарные соединения элементов с Оксигеном.
Соединение, образованное двумя элементами, одним из которых является Оксиген, называют оксидом.
Общая формула оксидов - EnOm.
Каждый оксид имеет химическое название, а некоторые - еще и традиционные, или тривиальные 1 , названия (табл. 4). Химическое название оксида состоит из двух слов. Первым словом является название соответствующего элемента, а вторым - слово «оксид». Если элемент имеет переменную валентность, то он может образовывать несколько оксидов. Их названия должны отличаться. Для этого после названия элемента указывают (без отступа) римской цифрой в скобках значение его валентности в оксиде. Пример такого названия соединения: купрум(II) оксид (читается « купрум-два-оксид »).
Таблица 4

1 Термин происходит от латинского слова trivialis - обыкновенный.
Выводы
Кислород - химически активное вещество. Он взаимодействует с большинством простых веществ, а также со сложными веществами. Продуктами таких реакций являются соединения элементов с Оксигеном - оксиды.
Реакции, при которых из нескольких веществ образуется одно, называют реакциями соединения.
?
135. Чем различаются реакции соединения и разложения?
136. Превратите схемы реакций в химические уравнения:
а) Li + O 2 -> Li 2 O;
N2 + O 2 -> NO;
б) SO 2 + O 2 -> SO 3 ;
CrO + O 2 -> Cr 2 O 3 .
137. Выберите среди приведенных формул те, которые отвечают оксидам:
O 2 , NaOH, H 2 O, HCI, I 2 O 5 , FeO.
138. Дайте химические названия оксидам с такими формулами:
NO, Ti 2 O 3 , Cu 2 O, MnO 2 , CI 2 O 7 , V 2 O 5 , CrO 3 .
Примите во внимание, что элементы, которые образуют эти оксиды, имеют переменную валентность.
139. Запишите формулы: а) плюмбум(I\/) оксида; б) хром(III) оксида;
в) хлор(I) оксида; г) нитроген(I\/) оксида; д) осмий(\/III) оксида.
140. Допишите формулы простых веществ в схемах реакций и составьте химические уравнения:
а) ... + ... -> CaO;
б) NO + ... -> NO 2 ; ... + ... -> As 2 O 3 ; Mn 2 O 3 + ... -> MnO 2 .
141. Напишите уравнения реакций, с помощью которых можно осуществить такие «цепочки» превращений, т. е. из первого вещества получить второе, из второго - третье:
а) С -> CO -> CO 2 ;
б) P -> P 2 0 3 -> P 2 0 5 ;
в) Cu -> Cu 2 O -> CuO.
142.. Составьте уравнения реакций, которые происходят при горении на воздухе ацетона (CH 3) 2 CO и эфира (C 2 H 5) 2 O. Продуктами каждой реакции являются углекислый газ и вода.
143. Массовая доля Оксигена в оксиде EO 2 равна 26 %. Определите элемент Е.
144. Две колбы заполнены кислородом. После их герметизации в одной колбе сожгли избыток магния, а в другой - избыток серы. В какой колбе образовался вакуум? Ответ объясните.
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. - К.: ВЦ «Академія», 2008. - 136 с.: іл.
Содержание урока конспект урока и опорный каркас презентация урока интерактивные технологии акселеративные методы обучения Практика тесты, тестирование онлайн задачи и упражнения домашние задания практикумы и тренинги вопросы для дискуссий в классе Иллюстрации видео- и аудиоматериалы фотографии, картинки графики, таблицы, схемы комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты Дополнения рефераты шпаргалки фишки для любознательных статьи (МАН) литература основная и дополнительная словарь терминов Совершенствование учебников и уроков исправление ошибок в учебнике замена устаревших знаний новыми Только для учителей календарные планы учебные программы методические рекомендацииОдним из важнейших элементов на нашей планете является кислород. Химические свойства этого вещества позволяют ему участвовать в биологических процессах, а повышенная активность делает кислород значимым участником всех известных химических реакций. В свободном состоянии это вещество имеется в атмосфере. В связанном состоянии кислород входит в состав минералов, горных пород, сложных веществ, из которых состоят различные живые организмы. Общее количество кислорода на Земле оценивается в 47% общей массы нашей планеты.
Обозначение кислорода
В периодической системе кислород занимает восьмую ячейку этой таблицы. Его международное название oxigenium. В химических записях он обозначается латинской литерой «О». В естественной среде атомарный кислород не встречается, его частички соединяются, образуя парные молекулы газа, молекулярная масса которого равна 32 г/моль.
Воздух и кислород
Воздух представляет смесь нескольких распространенных на Земле газов. Больше всего в воздушной массе азота - 78,2% по объему и 75,5 % по массе. Кислород занимает лишь второе место по объему - 20,9%, а по массе - 23,2%. Третье место закреплено за благородными газами. Остальные примеси - углекислый газ, водяной пар, пыль и прочее - занимают лишь доли процента в общей воздушной массе.
Вся масса естественного кислорода является смесью трех изотопов - 16 О, 17 О, 18 О. Процентное содержание этих изотопов в общей массе кислорода равно 99,76%, 0,04% и 0,2% соответственно.
Физические и химические свойства кислорода
Один литр воздуха при нормальных условиях весит 1,293 г. При понижении температуры до -140⁰С воздух становится бесцветной прозрачной жидкостью. Несмотря на низкую температуру кипения воздух можно сохранять в жидком состоянии даже при комнатной температуре. Для этого жидкость нужно поместить в так называемый сосуд Дьюара. Погружение в жидкий кислород коренным образом меняет обычные свойства предметов.

Кислород растворяется в воде, хотя и в небольших количествах - морская вода содержит 3-5% кислорода. Но даже такое небольшое количество этого газа положило начало существованию рыб, моллюсков и различных морских организмов, которые получают кислород из воды для поддержания процессов собственного жизнеобеспечения.
Строение атома кислорода
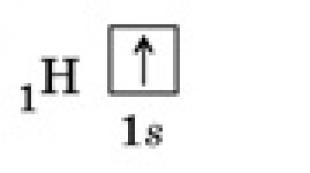
Описанные свойства кислорода в первую очередь объясняются внутренним строением этого элемента.

Кислород относится к главной подгруппе шестой группы элементов периодической системы. Во внешнем электронном облаке элемента находятся шесть электронов, четыре из которых занимают p-орбитали, а оставшиеся два располагаются на s-орбиталях. Такое внутреннее строение обуславливает большие энергетические затраты, направленные на разрывание электронных связей - атому кислорода проще заимствовать два недостающих электрона на внешнюю орбиталь, чем отдать свои шесть. Поэтому ковалентность кислорода в большинстве случаев равна двум. Благодаря двум свободным электронам кислород легко образует двухатомные молекулы, которые характеризуются высокой прочностью связи. Лишь при прилагаемой энергии свыше 498 Дж/моль молекулы распадаются, и образуется атомарный кислород. Химические свойства этого элемента позволяют ему вступать в реакции со всеми известными веществами, исключая гелий, неон и аргон. Скорость взаимодействия зависит от температуры реакции и от природы вещества.

Химические свойства кислорода
С различными веществами кислород вступает в реакции образования оксидов, причем эти реакции характерны и для металлов, и для неметаллов. Соединения кислорода с металлами называют основными оксидами - классическим примером служит оксид магния и оксид кальция. Взаимодействие оксидов металлов с водой приводит к образованию гидроксидов, подтверждающих активные химические свойства кислорода. С неметаллами это вещество образует кислотные оксиды - например, триоксид серы SO 3. При взаимодействии этого элемента с водой получается серная кислота.
Химическая активность
С подавляющим большинством элементов кислород взаимодействует непосредственно. Исключение составляют золото, галогены и платина. Взаимодействие кислорода с некоторыми веществами значительно ускоряется при наличии катализаторов. Например, смесь водорода и кислорода в присутствии платины вступает в реакцию даже при комнатной температуре. С оглушительным взрывом смесь превращается в обычную воду, важной составной частью которой является кислород. Химические свойства и высокая активность элемента объясняют выделение большого количества света и теплоты, поэтому химические реакции с кислородом часто называются горением.

Горение в чистом кислороде происходит гораздо интенсивнее, чем в воздухе, хотя количество теплоты, выделяемой при реакции, будет приблизительно одинаковым, но процесс из-за отсутствия азота протекает гораздо быстрее, а температура горения становится выше.
Получение кислорода
В 1774 году английский ученый Д. Пристли выделил неизвестный газ из реакции разложения оксида ртути. Но ученый не связал выделенный газ с уже известным веществом, входящим в состав воздуха. Лишь несколько лет спустя великий Лавуазье изучил физико-химические свойства кислорода, полученного в данной реакции, и доказал его идентичность с газом, входящим в состав воздуха. В современном мире кислород получают из воздуха. В лабораториях использую промышленный кислород, который поставляется баллонами под давлением около 15 Мпа. Чистый кислород можно получить и в лабораторных условиях, стандартным способом его получения является термическое разложение перманганата калия, которое протекает по формуле:
Получение озона
Если через кислород или воздух пропустить электричество, то в атмосфере появится характерный запах, предвещающий появление нового вещества - озона. Озон можно получить и из химически чистого кислорода. Образование этого вещества можно выразить формулой:
Данная реакция самостоятельно протекать не может - для ее успешного завершения необходима внешняя энергия. Зато обратное превращение озона в кислород происходит самопроизвольно. Химические свойства кислорода и озона разнятся во многом. Озон отличается от кислорода плотностью, температурой плавления и кипения. При нормальных условиях этот газ имеет голубой цвет и обладает характерным запахом. Озон обладает большей электропроводностью и лучше растворяется в воде, чем кислород. Химические свойства озона объясняются процессом его распада - при разложении молекулы этого вещества образуется двухатомная молекула кислорода плюс один свободный атом этого элемента, который агрессивно реагирует с другими веществами. Например, известна реакция взаимодействия озона и кислорода: 6Ag+O 3 =3Ag 2 O
А вот обычный кислород не соединяется с серебром даже при высокой температуре.

В природе активный распад озона чреват образованием так называемых озоновых дыр, которые подвергают угрозе жизненные процессы на нашей планете.
Разделы: Химия
«Свободный кислород – самый могущественный деятель из всех известных нам химических тел земной коры».
В.И.Вернадский
Цели и задачи :
- Знать значение кислорода
- Знать историю открытия кислорода
- Знать свойства кислорода и его применение
- Уметь давать характеристику кислороду как химическому элементу и как простому веществу.
- Уметь составлять уравнения реакций взаимодействия кислорода с металлами и неметаллами.
- Закрепить умения расстановки коэффициентов в уравнениях реакций.
Оборудование и реактивы :
Для опыта «Получение кислорода разложением пероксида водорода в присутствии катализатора»: металлический штатив, перекись водорода (3%-ный раствор), оксид марганца (IV), колба, воронка с краном, газоотводная трубка, химический стаканчик для собирания кислорода методом вытеснения воздуха, лучинка, спички.
Для опыта «Несгораемый платок»: спирт, вода, щипцы, носовой платок, два маленьких кристаллизатора, спички.
Т.С.О.
- Коллекция «Минералы»
- Справочник по минералогии
- Компьютер, мультимедиа-приставка.
- Презентация урока с использованием материалов «Образовательной коллекции» (Приложение 1 )
- Таблица «Кислород в природе»
Ход урока
1) Значение кислорода
(слайды 3-4)
Кислород – это сознание человека. Он особенно необходим мозгу. Клетки мозга разлагаются и умирают без кислорода гораздо быстрее других клеток организма.
62% массы человека – это масса всех атомов кислорода, входящих в состав тела.
Кислород входит в состав органических соединений: белков, жиров, углеводов, витаминов, ферментов, гормонов.
Высокая окислительная способность кислорода лежит в основе горения всех видов топлива.
2) Характеристика кислорода как химического элемента
(слайды 5-8)
- Химический знак – О,
- латинское название – Оxygenium,
- А r (O) = 16;
- валентность – II,
- степень окисления в соединениях: – 2;
- содержание в земной коре – I место – более 49% ,
- самые распространённые оксиды: оксид водорода (вода) – H 2 O, оксид кремния – SiO 2 , оксид алюминия – Al 2 O 3 .
Демонстрация минералов:
- кварц – SiO 2 – эту устойчивую при низких температурах модификацию обычно называют просто кварцем; происхождение названия остается неизвестным. Кварц является одним из наиболее распространенных в земной коре.
- аметист –SiO 2
- горный хрусталь – SiO 2
- агат – SiO 2
- рубин – А l 2 О 3 – одна из разновидностей корунда
- изумруд – Be 3 Al 2 [ Si 6 O 18 ] – одна из разновидностей берилла. Химический состав:SiO 2 66,9%.Al 2 O 3 19,0 %, BeO 14,1%, в виде примесей содержатся Na 2 O, K 2 O, Li 2 O , иногда Rb 2 O, Cs 2 O .
- александрит – BeAl 2 O 4 – р азновидность хризоберилла "хризос" по гречески – золото. Химический состав. Al 2 O 3 80,2 %. BeO 19,8 %, Всегда присутствуют примеси: FeO (3,5-6%), иногда TiO 2 (до 3%) и Cr 2 O 3 (до 0,4%), с чем связана окраска александрита. Цветалександрита изумрудно-зеленый, а при электрическом освещении – фиолетово-красный.
3) Характеристика кислорода как простого вещества
- Химическая формула – О 2 , M r =32; М = 32 г / моль.
- В составе атмосферы около 21 % кислорода, (1/5 часть).
- Ежегодно в результате фотосинтеза в атмосферу Земли поступает 3000 млрд. тонн кислорода.
- Основные поставщики кислорода – тропические леса и фитопланктон океана.
- Человек в сутки вдыхает примерно 750 литров кислорода.
- Полное прохождение атмосферного кислорода через систему биологического круговорота составляет 2000 лет!
4) Физические свойства кислорода
(слайд 10)
- бесцветный газ, без вкуса, без запаха,
- малорастворим в воде,
- немного тяжелее воздуха, (М возд. = 29 г/моль)
- t сжижения = -183°C, голубая жидкость,
- t замерзания = -218,8°C, синие кристаллы,
5) История открытия кислорода
(слайды 11-14)
- Древние греки: «Воздух – сложное тело».
- VIII век, Китай, Мао Хоа: «Воздух состоит из «полного воздуха» (азота) и «неполного воздуха» (кислорода).
- Карл Шееле, Швеция, опыты с 1768 по 1773: «Исследования воздуха являются в настоящее время важнейшим предметом химии». Получил кислород при нагревании селитры.
1772 год: «Атмосферный воздух состоит из двух частей: «огненный воздух» – поддерживает дыхание и горение, «испорченный воздух» – не поддерживает горения». - Джозеф Пристли, Англия, 1774 год: «Но что поразило меня больше всего – это то, что свеча горела в этом воздухе удивительно блестящим пламенем».
При нагревании оксида ртути Дж.Пристли получил бесцветный газ, который мало растворялся в воде и поддерживал горение свечи. - Антуан Лоран Лавуазье, Франция, 1777 год
Подлинная природа этого газа была установлена во Франции: Лавуазье выяснил, что кислород - простое вещество и какую роль он играет в процессах окисления. Название Oxygenium – «рождающий кислоту», предложено Лавуазье.
6) Получение в лаборатории
Демонстрационный опыт (слайд 15): получить кислород способом разложения перманганата калия при нагревании; собрать его методом вытеснения воздуха, подтвердить наличие кислорода тлеющей лучинкой:
2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2
Демонстрационный опыт: получить кислород способом разложения перекиси водорода в присутствии катализатора оксида марганца (IV); собрать его методом вытеснения воды, подтвердить наличие кислорода тлеющей лучинкой:
2 H 2 O 2 = 2H 2 O + O 2
7) Получение в промышленности
сжижение воздуха.
8) Химические свойства кислорода
(слайд 16)
- облегчает дыхание;
- поддерживает горение;
- повышает температуру пламени;
- ускоряет химические реакции;
Где и как человек использует эти свойства кислорода?
- взаимодействует с металлами (слайды 17-19)
Записать уравнения реакций, расставить коэффициенты, назвать образующиеся вещества. Что такое оксиды?
Оксиды – бинарные соединения металлов и неметаллов с кислородом. На первом месте в формуле оксида пишут химический знак элемента, на втором – химический знак кислорода.
4Fe + 3O 2 =2Fe 2 O 3
3Fe + 2O 2 =Fe 3 O 4
2Mg + O 2 = 2MgO
Fe 2 O 3 – оксид железа (III), FeO - оксид железа (II), (Fe 2 O 3 и FeO) – Fe 3 O 4 – железная окалина, MgO – оксид магния.
- взаимодействует с неметаллами; (слайды 20-21)
Записать уравнения реакций, расставить коэффициенты, назвать образующиеся вещества
4P + 5O 2 = 2 P 2 O 5
2H 2 + O 2 = 2H 2 O
- взаимодействует со сложными веществами, (слайд 22) демонстрационный опыт: «несгораемый платок»:
C 2 H 6 O + 3O 2 = 2CO 2 + 3H 2 O
Реакции взаимодействия простых и сложных веществ с кислородом называются реакциями окисления.
9) Закрепление изученного материала
(слайды 23-25)
(химический тест):
Кто назвал кислород «огненным», а азот « испорченным» воздухом?
Какие вещества образует химический элемент кислород?
А) только простые вещества, В) простые и сложные вещества, С) только сложные вещества.
Как называются бинарные соединения, молекулы которых образованы атомами какого-либо химического элемента и кислорода:
А) сульфиды, В) хлориды, С) оксиды.
В 1774 году один учёный после проведённого эксперимента написал: «Но что поразило меня больше всего – это то, что свеча горела в этом воздухе удивительно блестящим пламенем…» Это был:
А) Лавуазье, В) Пристли, С) Шееле.
Название «Оxygenium» предложил:
А) Лавуазье, В) Пристли, С) Шееле.
Кислород в воде:
А) хорошо растворим, В)малорастворим, С)вообще не растворяется.
При вдувании кислорода в пламя температура пламени:
А) не изменяется, В) понижается, С) повышается.
Оксид железа (III) имеет формулу:
А) Fe 2 O 3 , В) FeO, С) FeO 2 .
В каком уравнении коэффициенты расставлены правильно:
А) 2P + O 2 = P 2 O 5 ; В) 2P + 5O 2 = P 2 O 5 , С) 4P + 5O 2 = 2P 2 O 5
В каком ряду все три формулы написаны правильно:
А) P 2 O 5 , Al 2 O, H 2 O; В) MgO, Al 2 O 3 , CO 2 ; С) CO 2 , FeO 2 , P 2 O 5
Проверка диктанта. (слайд 26-27)
| Номер вопроса | Буква ответа | Правильно + Неправильно - |
| 1 | С | |
| 2 | В | |
| 3 | С | |
| 4 | В | |
| 5 | А | |
| 6 | В | |
| 7 | С | |
| 8 | А | |
| 9 | С | |
| 10 | В |
Итого:
Оценка:
Критерии оценки:
- «5» – 10-9 правильных ответов
- «4» – 8-7 правильных ответов
- «3» – 6-5 правильных ответов