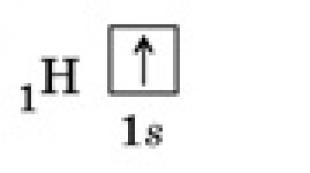
Типы химических связей. Хлорид аммония Примеры решения задач
Применение хлорида аммония в фармации
Аммония хлорид оказывает диуретическое действие; вместе с тем как кислотообразующее средство аммония хлорид является эффективным средством для коррекции алкалоза.
Как диуретическое средство аммония хлорид назначают иногда при отеках сердечного происхождения.
Аммония хлорид оказывает также отхаркивающее действие и применяется при бронхите, пневмонии и т.п.
Гравиметрический анализ
Последовательность выполнения работы: 1. Осаждение: 1. В чистый химический стакан берут для анализа раствор FeCl3. 2. Подкисляют его 3-5 мл 2 н. раствора HNO3 и осторожно нагревают, не допуская кипения. 3...
Железо в почвах. Методы определения железа
Навеску воздушно-сухой почвы 5 г, просеянной через сито с отверстиями 1 мм, помещают в колбу и приливают 250 мл 0,2 Н раствора HCL, перемешивают и настаивают в течение суток. Суспензии фильтруют...
Определение диацетила и ацетоина в алкогольных напитках
Для стандартизации раствора хлорида железа (III) было проведено комплексонометрическое титрование. Аликвотную часть 1,00 приготовленного раствора хлорида железа (III) помещали в мерную колбу вместимостью 100,0...
Комплексные (координационные) соединения чрезвычайно широко распространены в живой и неживой природе, применяются в промышленности, сельском хозяйстве, науке, медицине. Так, хлорофилл - это комплексное соединение магния с порфиринами...
Получение тетрахлороцинката аммония и изучение его свойств
тетрахлороцинкат аммоний химический приготовление Тетрахлороцинкат аммония применяются в гальваностегии и при пайке, входит в состав флюсов. Пайка -- технологическая операция...
Получение тетрахлороцинката аммония и изучение его свойств
Существуют несколько способов получения тетрахлороцинката аммония. 1. Первый метод основан на изначальном получении хлорида цинка и дальнейшем взаимодействии его с хлоридом аммония, до растворения осадка...
Процесс алкилирования на примере получения этилбензола в присутствии катализатора хлорида алюминия
Производительность стадии алкилирования по 100% этилбензолу составляет: или где 10000 - производительность в расчете на 100%-й этилбензол, т/год; 8000 - число рабочих часов; 4 - потери этилбензола на стадиях выделения, %; 106 - молярная масса этилбензола...
Получение товарного хлорида кальция из дистиллерной жид-кости содового производства заключается в последовательном выпаривании дистиллерной жидкости от концентрации ~ 10% СаС12 до 67%, требуемой условиями ГОСТ на плавленый продукт...
Свойства и получение хлорида кальция
Получение плавленого хлорида кальция из маточного щелока хлоратного производства, содержащего в 4 - 5 раз больше СаС12, чем дистиллерная жидкость, является значительно более эконо-мичным. Здесь, однако...
Свойства и получение хлорида кальция
Гидрооксихлорид кальция образуется при смешении в стехиометрическом отношении хлорида кальция, молотой извести и воды. Его можно выделить из дистиллерной жидкости без выпарки ее или на определенной стадии ее выпари-вания...
Свойства и получение хлорида кальция
Получение хлорида кальция этим методом заключается в растворении известняка в соляной кислоте, в очистке образующегося «сырого» (неочищенного) раствора СаС12 от примесей и в обезвоживании его. Продукт получается более чистым...
Лекция по общей химии №3
Конспект лекции по общей химии составлен в соответствии с программой учебной дисциплины Химия, которая является частью программы среднего (полного) общего образования, реализуемого в рамках СПО с учетом профиля получаемого профессионального образования.
Конспект лекций по органической химии предназначен для использования учащимися с целью самостоятельного изучения предмета, коррекции знаний, при повторении и подготовке к итоговой контрольной работе.
Тема: Химическая связь – ионная и ковалентная.
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную.
1.Ионная химическая связь
Ионная химическая связь – это связь, образовавшаяся за счет электростатического притяжения к .
Атомы, присоединившие «чужие» электроны, превращаются в отрицательные ионы, или . Атомы, отдавшие свои электроны, превращаются в положительные ионы, или . Понятно, что между и возникают силы электростатического притяжения, которые и будут удерживать их друг около друга, осуществляя тем самым ионную химическую связь.
Так как образуют в основном атомы металлов, а – атомы неметаллов, логично сделать вывод, что этот тип связи характерен для соединений типичных металлов (элементы главных подгрупп I и II групп, кроме магния Mg и бериллия Be ) с типичными неметаллами (элементы главной подгруппы VII группы). Классическим примером является образование галогенидов щелочных металлов (фторидов, хлоридов и др.). Например, рассмотрим схему образования ионной связи в хлориде натрия:
Два разноименно заряженных иона, связанные силами притяжения, не теряют способности взаимодействовать с противоположно заряженными ионами, вследствие чего образуются соединения с ионной кристаллической решеткой. Ионные соединения представляют собой твердые, прочные, тугоплавкие вещества с высокой температурой плавления.Растворы и расплавы большинства ионных соединений – электролиты. Такой тип связи характерен для гидроксидов типичных металлов и многих солей кислородсодержащих кислот. Однако при образовании ионной связи не происходит идеального (полного) перехода электронов. Ионная связь является крайним случаем ковалентной полярной связи
Рисунок 1 .
Кристаллическая решетка хлорида натрия, состоящая из противоположно заряженных ионов натрия и хлорид-ионов
В ионном соединении ионы представлены как бы в виде электрических зарядов со сферической симметрией электрического поля, одинаково убывающего с увеличением расстояния от центра заряда (иона) в любом направлении (рис. 1). Поэтому взаимодействие ионов не зависит от направления, то есть ионная связь, в отличие от ковалентной, будет ненаправленной.
Ионная связь существует также в солях аммония, где нет атомов металлов (их роль играет аммония – NH 4 Cl , (NH 4 ) 2 SO 4 , и в солях, образованных органическими – (например, в хлориде метиламмония – + Cl – и т. д.).
2. Ковалентная химическая связь
Ковалентная химическая связь – это связь, возникающая между атомами за счет образования общих электронных пар.
Механизм образования такой связи может быть обменный или донорно-акцепторный.
Обменный механизм действует, когда атомы образуют общие электронные пары за счет объединения неспаренных электронов.
Например:
Н 2 – водород:

Связь возникает благодаря образованию общей электронной пары s -электронами атомов водорода (перекрыванию s -орбиталей):

HCl – хлороводород:

Связь возникает за счет образования общей электронной пары из s - и p -электронов (перекрывания s – p -орбиталей):

Cl 2 – в молекуле хлора ковалентная связь образуется за счет непарных p -электронов (перекрывания p – p -орбиталей):
N 2 – в молекуле азота между атомами образуются три общие электронные пары:

По способу перекрывания электронных орбиталей различают σ- и π-ковалентные связи (сигма- и пи-) .
В молекуле азота одна общая электронная пара образуется за счет σ-связи (электронная плотность находится в одной области, расположенной на линии, соединяющей ядра атомов; связь прочная).

Две другие общие электронные пары образуются за счет π-связей, то есть бокового перекрывания p -орбиталей в двух областях; π-связь менее прочна, чем σ-связь.

В молекуле азота между атомами существует одна σ-связь и две π-связи, которые находятся во взаимно перпендикулярных плоскостях (так как взаимодействуют 3 неспаренных p -электрона каждого атома).
Следовательно, σ-связи могут образовываться за счет перекрывания электронных орбиталей:
а также за счет перекрывания «чистых» и гибридных орбиталей. По числу общих электронных пар, связывающих атомы, то есть по кратности , различают ковалентные связи: одинарные : двойные : тройные :По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть неполярной и полярной. При неполярной ковалентной связи общие электронные пары не смещены ни к одному из атомов, так как эти атомы имеют одинаковую (ЭО) – свойство оттягивать к себе валентные электроны от других атомов.
Ковалентную химическую связь, образующуюся между атомами с одинаковой , называют неполярной .
Например:
то есть посредством ковалентной неполярной связи образованы молекулы простых веществ-неметаллов.Значения относительной фосфора и водорода практически одинаковы: ЭО (Н ) = 2,1; ЭО ( Р ) = 2,1, поэтому в молекуле фосфина PH 3 связи между атомом фосфора и атомами водорода ковалентные неполярные.
Ковалентную химическую связь между атомами элементов, которых различаются, называют полярной .
Например: аммиак
Азот – более электроотрицательный элемент, чем водород, поэтому общие электронные пары смещаются к его атому.
В CH 3 OH : ЭО( O ) > ЭО( C ) > ЭО( H )ОПРЕДЕЛЕНИЕ
Хлорид аммония представляет собой малоустойчивый мелкокристаллический порошок белого цвета. Летуч. Он хорошо растворяется в воде (гидролизуется). Кристаллогидратов не образует.
Рис. 1. Хлорид аммония. Внешний вид.
Основные характеристики хлорида аммония приведены в таблице ниже:
Получение хлорида аммония
Получение хлорида аммония в промышленных масштабах заключается в упаривании маточного раствора, остающегося после отделения гидрокарбоната натрия, образующегося по следующей реакции:
NaCl + H 2 O + CO 2 + NH 3 = NaHCO 3 ↓ + NH 4 Cl.
В лабораторных условиях эту соль получают, используя такие реакции, как
8NH 3 + 3Cl 2 = 6NH 4 Cl + N 2 ;
NH 3 + HCl = NH 4 Cl.
Химические свойства хлорида аммония
Хлорид аммония - это средняя соль, образованная слабым основанием - гидроксидом аммония (NH 4 OH) и сильной кислотой - соляной (хлороводородной) (HCl). В водном растворе гидролизуется. Гидролиз протекает по катиону. Наличие катионов Н + свидетельствует о кислом характере среды.
NH 4 Cl ↔NH 4 + + Cl — ;
NH 4 + + HOH ↔ NH 4 OH + H + ;
NH 4 + + Cl — + HOH ↔ NH 4 OH + Cl — + H + ;
NH 4 Cl + H 2 O ↔ NH 4 OH +HCl.
При нагревании хлорид аммония как бы возгоняется - разлагается на аммиак и хлороводород, которые на холодных частях сосуда вновь соединяются в хлорид аммония:
NH 4 Cl↔ NH 3 + HCl.
Хлорид аммония разлагается концентрированной серной кислотой и щелочами:
2NH 4 Cl + H 2 SO 4 (conc) = (NH 4) 2 SO 4 + 2HCl;
NH 4 Cl + NaOH = NaCl + NH 3 + H 2 O;
2NH 4 Cl + Ca(OH) 2 = 2NH 3 + CaCl 2 + 2H 2 O (t = 200 o C).
Он реагирует с хлором (1), типичными металлами (2), оксидами (3) и нитритами металлов (4):
NH 4 Cl + 3Cl 2 = Cl 3 N + 4HCl (t = 60 - 70 o C) (1);
2NH 4 Cl + Mg = MgCl 2 + H 2 + 2NH 3 (2);
2NH 4 Cl + 4CuO = N 2 + 4H 2 O + CuCl 2 + 3Cu (t = 300 o C) (3);
NH 4 Cl + KNO 2 = N 2 + KCl + 2H 2 O (4).
Применение хлорида аммония
Хлорид аммония, или нашатырь, применяется в красильном деле, в ситцепечатании, при паянии и лужении, а также в гальванических элементах. Применение хлорида аммония при паянии основано на том, что он способствует удалению с поверхности металла оксидных пленок, благодаря чему припой хорошо пристает к металлу. При соприкосновении сильно нагретого металла с хлоридом аммония оксиды, находящиеся на поверхности металла, либо восстанавливаются, либо переходят в хлориды. Последние, будучи более летучи, чем оксиды, удаляются с поверхности металла. Для случая меди и железа основные происходящие при этом процессы можно выразить такими уравнениями:
4CuO + NH 4 Cl = 3Cu + CuCl 2 + N 2 + 4H 2 O;
Fe 3 O 4 + 8NH 4 Cl = FeCl 2 + 2FeCl 3 + 8NH 3 + 4H 2 O.
Примеры решения задач
ПРИМЕР 1
| Задание | Какую массу хлорида аммония можно получить при взаимодействии 17,7 г хлороводорода и 12 л аммиака (н.у.)? Какой объем 0,06М раствора можно приготовить из этой массы соли? |
| Решение | Запишем уравнение реакции:
NH 3 + HCl = NH 4 Cl. Найдем количество моль хлороводорода (молярная масса - 36,5 г/моль) и аммиака, вступивших в реакцию используя данные указанные в условии задачи: n(HCl) = m (HCl) / M (HCl); n (HCl) = 17,7 / 36,5 = 0,5моль. n(NH 3) = V (NH 3) / V m ; n (NH 3) = 12 / 22,4 = 0,54 моль. Согласно уравнению задачи n (HCl):n (NH 3) = 1:1. Это означает, что аммиак находится в избытке и все дальнейшие расчеты следует вести по хлороводороду. Найдем количество вещества и массу образовавшегося хлорида аммония (молярная масса 53,5 г/моль): n (HCl): n (NH 4 Cl) = 1:1; n (NH 4 Cl) = n (HCl) = 0,5моль. m (NH 4 Cl)= n (NH 4 Cl)×M (NH 4 Cl); m (NH 4 Cl)=0,5×53,5 = 26,75 г. Рассчитаем объем 0,06М раствора, который можно получить из 26,75 г хлорида аммония: V(NH 4 Cl) = n (NH 4 Cl)/ c (NH 4 Cl); V (NH 4 Cl)=0,5/ 0,06= 8,33 л. |
| Ответ | Масса хлорида аммония равна 26,75 г, объем 0,06М раствора - 8,33 л (833 мл). |
ОПРЕДЕЛЕНИЕ
Аммоний – положительно заряженный полиатомный ион.
Химическая формула NH 4 +
Ион аммония NH 4 + является правильным тетраэдром с в центре и атомами в вершинах тетраэдра.
В молекуле аммиака NH 3 три электронные пары образуют три связи N – H, четвертая, прина длежащая атому азота электронная пара является неподеленной. С помощью этой электронной пары образуется связь с ионом водорода, который имеет свободную орбиталь:

Таким образом, в ионе аммония три ковалентные связи образуются по обменному механизму, а одна – по донорно-акцепторному. Механизм образования не оказывает слияния на характеристики связи, все связи в катионе аммония равноценны.
Соединения аммония
Катион аммония может образовывать с различными противоионами аммонивые соединения, в которых положительно заряженный атом азота, ковалентно связан с ионами водорода и (или) с органическими радикалами, а ионно – с каким-либо анионом.
Неорганические соединения аммония
Гидрат аммиака (гидроксид аммония, аммиачная вода, едкий аммоний, едкий аммиак). Формула: NH 3 ·H 2 O
Образуется при взаимодействии аммиака с водой. Слабое основание, диссоциирует в воде с образованием катионов аммония и гидроксид-ионов:
Реакция обратима, поэтому водные растворы гидроксида аммония всегда имеют характерный резкий запах аммиака.
Соли аммония
Все соли аммония по своим свойствам похожи на соответствующие соли натрия. Хорошо растворяются в воде, полностью диссоциируют в водном растворе, при нагревании разлагаются:
В растворе гидролизуются по катиону:
Органические аммониевые соединения разделяют по количеству органических радикалов, связанных с атомом азота на первичные (R 1 NH 3) + X – , вторичные (R 1 R 2 NH 2) + X – , третичные (R 1 R 2 R 3 NH) + X – , и четвертичные (R 1 R 2 R 3 R 4 N) + X – .
Первичные, вторичные и третичные аммониевые соединения можно рассматривать как соли соответствующих аминов, их можно получить взаимодействием этих аминов с кислотами:
где R 1 ,R 2 , R 3 - органические радикалы или водород, X - анион кислотного остатка.
Качественная реакция на ионы аммония – взаимодействие со щелочами с выделением аммиака:
Примеры решения задач
ПРИМЕР 1
| Задание | Какое значение рН (больше или меньше 7) имеет водный раствор хлорида аммония? Запишите молекулярное и ионно-молекулярное уравнения гидролиза. |
| Решение | NH 4 Cl – соль слабого основания и сильной кислоты, поэтому гидролиз протекает по катиону.
Молекулярное уравнение: Полное ионное уравнение: Краткое ионное уравнение: В процессе гидролиза образовались водорода (H +), поэтому раствор имеет кислую среду (pH |
| Ответ | рН раствора хлорида аммония меньше 7. |
ПРИМЕР 2
| Задание | Какая масса соли образуется при взаимодействии 44,8 л аммиака и 33,6 литров хлороводорода (нормальные условия)? | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Решение | Запишем уравнение реакции:
Молярные массы аммиака, хлороводорода и образующейся соли – хлорида аммония (NH 4 Cl) равны. 1. Наиболее полярными являются связи в молекуле: а)НС1 б)AsH 3 в)РН 3 r)H 2 S 2. Линейную форму имеет молекула: а)Н 2 О б)H 2 S в)ВеС1 2 г) OF 2 3. Геометрическая форма молекулы метана СН 4: а) угловая в) пирамидальная б) треугольная г) тетраэдрическая 4. Пирамидальную форму имеет молекула: а)ВС1 3 б)SiBr 4 в)А1Вг 3 г) РС1 3 5. Полярной молекулой является: а)СО 2 б)СН 4 b)NH 3 r)N 2 6. Число σ-связей в три раза больше числа π-связей в молекуле: а) хлористой кислоты б) ортофосфорной кислоты в) сернистой кислоты г) хлорноватой кислоты 7. В каком ряду представлены формулы соединений только с ковалентной связью? а) ВаС1 2 , CdC1 2 , LiF в) NaCl, CuSO 4 , Fe(OH) 3 б) H 2 O, SiO 2 , CH3COOH г) N 2 , HNO 3 , NaNO 3 8. Химические связи какого типа отсутствуют в хлориде аммония? а) ковалентные полярные б) ковалентные неполярные в) донорно-акцепторные г) ионные 9. Химическая связь, образующаяся между атомами элементов с порядковыми номерами 3 и 9: а) ковалентная полярная б) металлическая в) ковалентная неполярная г) ионная 10. Сколько электронов, содержащихся в молекуле этилена, не участвуют в образовании химических связей? а) 4 б) 8 в) 12 г) 16 11. Число электронов, участвующих в образовании химических связей, наибольшее в молекуле: а)Н 2 О б)С1 2 b)H 2 S r)N 2 12. Атомную кристаллическую решетку имеет: а) гидроксид натрия в) железо б) алмаз г) лед 13. Какой тип кристаллической решетки характерен для соединений s-металлов с р-элементами, имеющими большую электроотрицательность? а) металлическая в) атомная б) ионная г) молекулярная 14. В каком ряду перечислены вещества соответственно с атомной, молекулярной и ионной кристаллическими решетками в твердом состоянии? а) алмаз, хлорид натрия, графит б) белый фосфор, вода, мел в) оксид кремния (IV), медь, азот г) алмаз, углекислый газ, фторид калия 15. Что изменяется при образовании хлорида аммония из аммиака и хлороводорода? а) степень окисления атома азота б) степень окисления и валентность атома азота в) валентность атома азота г) степень окисления атома водорода 16. Какая из следующих частиц образовалась по донорно-акцепторному механизму? a)F 2 б)HF в)BF 4 – г)BF 3 17. В каком веществе степень окисления и валентность азота равны по абсолютной величине? a)N 2 б)NH 3 b)HNO 3 г) NH 4 C1 18. Какая из молекул наименее устойчива? а)Н 2 О 6)H 2 S B)H 2 Se г) Н 2 Те 19. Какая химическая связь наименее прочная? а) металлическая в) водородная б) ионная г) ковалентная 20. Атом какого элемента проявляет наибольшую склонность к образованию ионных связей? а) С б) Si в)F г)P 21. Как изменяется полярность и прочность связи в ряду молекул HF → НС1 → HI? а) как полярность, так и прочность связи увеличиваются б) полярность увеличивается, прочность уменьшается в) как полярность, так и прочность связи уменьшаются г) полярность уменьшается, прочность увеличивается 22. Орбитали какого типа атомов водорода и хлора соответственно перекрываются при образовании молекулы хлороводорода? a) s и s б) s и р в) р и р г) p и s 23. В какой молекуле все связи являются ковалентными полярными? а)Н 2 О 2 б)С 2 Н 4 в)С 2 Н 2 г)СО 2 24. Какой элемент имеет наибольшее алгебраическое значение высшей степени окисления? а) фтор б) хром в) углерод г) хлор 25. Какой элемент имеет наименьшее алгебраическое значение низшей степени окисления? а) азот б) сера в) водород г) бром 26. В каком соединении водород имеет отрицательную степень окисления? a)NH 4 Cl б)СаН 2 в) Н 2 О 2 г) HF 27. В соединениях ВС1 3 , Ве1 2 и SiBr 4 валентные орбитали центральных атомов находятся соответственно в следующих гибридных состояниях: a) sp, sp 2 , sp 3 в) sp, sp 3 , sp 2 б) sp 2 ,sp, sp 3 г) sp 3 , sp 2 ,sp 28. Валентность азота в следующих соединениях: N 2 , NH 3 , NH 4 + , CH 3 NН 2, HNO 3 - равна соответственно: а) 0, III, IV, V, V в) III, III, IV, III, IV б) I, III, III, IV, IV r) III, III, III, IV, V 29.Правильной характеристикой ионной связи является: б) направленная, ненасыщаемая в) направленная, насыщаемая г) ненаправленная, насыщаемая 30.Правильной характеристикой ковалентной связи является: а) ненаправленная, ненасыщаемая б) направленная, ненасыщаемая в) направленная, насыщаемая г) ненаправленная, насыщаемая 31.Двойные связи между атомами существуют в каждом соединении, входящем в группу: а) СО, СО 2 в) S 8 , C 2 H 4 б) С 2 Н 2 , SO 2 г) СО 2 , С 2 Н 4 32.Тройные связи между атомами существуют в каждом соединении, входящем в группу: а) СО, N 2 б) N 2 , SO 2 в) S 8 , С 2 Н 2 г) СО 2 , С 2 Н 4 33.Для какого элемента высшая степень окисления больше номера группы, в которой он находится в периодической системе? а) марганец б) золото в) бор г) азот 34.Количественная характеристика элементов, которая позволяет судить о типе химической связи между атомами этих элементов, - это: а) радиус атомов в) электроотрицательность б) заряд ядра г) атомная масса 35.Одинарная полярная, двойная неполярная, одинарная неполярная, тройная полярная связи существуют в молекулах соответственно следующих веществ: а) HF, С 2 Н 4 , Вг 2 , СО в) Н 2 , СО 2 , НС1, N 2 б) HBr, SO 3 , N 2 , С 2 Н 2 г) С1 2 , О 2 , С 2 Н 6 , СО 36.Общее σ- числои π-связей в молекуле дихромовой кислоты равно соответственно: а) 10 и 4 б) 4 и 10 в) 6 и 2 г) 2 и 6 37.Даны вещества: хлорид цезия, медь, алмаз, ромбическая сера, лед, оксид натрия, йод, «сухой лед» (твердый СО 2), графит, платина, гидрид калия. Среди них число веществ с атомной кристаллической решеткой равно: а) 4 б)3 в) 2 г)1 38. Даны вещества: хлорид цезия, медь, алмаз, ромбическая сера, лед, оксид натрия, йод, «сухой лед» (твердый СО 2), графит, платина, гидрид калия. Среди них число веществ с молекулярной кристаллической решеткой равно: а) 4 б) 3 в) 2 г) 1 39.Даны вещества: хлорид цезия, медь, алмаз, ромбическая сера, лед, оксид натрия, йод, «сухой лед» (твердый СО 2), графит, платина, гидрид калия. Среди них число веществ с ионной кристаллической решеткой равно: а) 4 б) 3 в) 2 г) 1 40.Даны вещества: хлорид цезия, медь, алмаз, ромбическая сера, лед, оксид натрия, йод, «сухой лед» (твердый СО 2), графит, платина, гидрид калия. Среди них число веществ с металлической кристаллической решеткой равно: а) 4 б) 3 в) 2 г) 1
Еще на тему |