Kinetika e reaksioneve enzimatike. Varësia e shpejtësisë së reaksioneve enzimatike nga përqendrimi i substrateve, enzimave, temperatura.Cili është radha e reaksionit enzimatik sipas enzimës
Shpejtësia e reaksioneve enzimatike varet nga përqendrimi i nën-
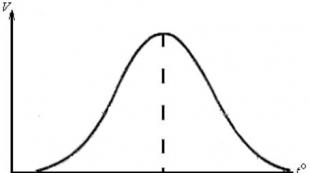
shtresa Kjo varësi është komplekse, e cila për enzima të caktuara përshkruhet nga një kurbë parabolike (Fig. 29).
Figura 29 – Varësia e shpejtësisë së reaksionit enzimatik
në përqendrimin e substratit
Natyra parabolike e varësisë shpjegohet me faktin se kur enzima ndërvepron me substratin, formohet një kompleks enzimë-substrat. Fillimisht, me rritjen e përqendrimit të substratit, rritet përqendrimi i komplekseve enzimë-substrat në përzierjen e reaksionit, gjë që manifestohet në një rritje paralele të shpejtësisë së reagimit. Në një përqendrim të caktuar të substratit (ngopje), ndodh një lloj "ngopjeje" e të gjitha qendrave aktive të molekulave të enzimës në përzierjen e reaksionit. Shpejtësia e reaksionit enzimatik në përqendrimin e ngopjes bëhet maksimale. Me një rritje të mëtejshme të përmbajtjes së substratit në përzierjen e reaksionit, ajo nuk ndryshon.
Nga grafiku i varësisë së shpejtësisë së një reaksioni enzimatik nga përqendrimi i substratit, llogariten dy tregues të rëndësishëm:
1. Shpejtësia maksimale e reagimit (V max). Përkufizohet si shpejtësia e reagimit në përqendrimin e ngopjes së substratit. Vlera maksimale e shpejtësisë pasqyron fuqinë katalitike të enzimës. Enzima më të mëdha V max janë katalizatorë më të fuqishëm. Ata katalizojnë transformimin e një numri më të madh të molekulave të substratit për njësi të kohës. Shpejtësia maksimale shprehet me numrin e rrotullimeve të enzimës. Numri i qarkullimit vlerësohet nga numri i molekulave të substratit të konvertuara nga enzima për njësi të kohës (s -1). Për shumicën e enzimave, numri i qarkullimit është brenda 10 4. Në të njëjtën kohë, ekzistojnë enzima për të cilat shpejtësia dukshëm më shumë (600 000 për karbanhidrazën) ose më pak se kjo vlerë (100 për kimotripsinën).
2. Michaelis konstante (TE m). Konstanta e Michaelis është përqendrimi i substratit në të cilin shpejtësia e reagimit është gjysma e maksimumit. Madhësia TE m pasqyron afinitetin e enzimës për substratin. Sa më e madhe kjo vlerë, aq më pak afinitet ka enzima për substratin. TE m shprehet në mol substrate. Pra, vlera TE m në lidhje me glukozën për enzimën e glukokinazës është 10 mmol, dhe për heksokinazën - 0,01 mmol. Heksokinaza shfaq një afinitet më të madh për glukozën sesa glukokinaza; në të njëjtin përqendrim të substratit, ajo katalizon fosforilimin e glukozës me një shpejtësi më të lartë.
Bazuar në një analizë matematikore të kurbës së varësisë së shpejtësisë së një reaksioni enzimatik nga përqendrimi i substratit, L. Michaelis dhe M. Menten (1913) nxorrën një formulë që lejon të vlerësohet marrëdhënia midis shpejtësisë së reaksionit, norma maksimale dhe konstanta e Michaelis. Aktualisht përkufizohet si ekuacioni Michaelis-Menten.
V o = V maksimumi [ S]/K m + [ S],
Ku V o – shpejtësia e reagimit, S– përqendrimi i substratit.
Vetitë e përgjithshme të enzimave
Pavarësisht nga ekzistenca e disa dallimeve në strukturë, funksion dhe lokalizim ndërqelizor, enzimat karakterizohen nga një numër i vetive të përbashkëta. Këto përfshijnë varësinë e manifestimit të aktivitetit të tyre katalitik nga temperatura (termolueshmëria) dhe pH e mjedisit, si dhe specifika e substratit.
Një veti karakteristike e enzimave është termolabiliteti. Ky fenomen mund të ilustrohet nga një grafik i shpejtësisë së një reaksioni enzimatik kundrejt temperaturës së përzierjes së reaksionit (Fig. 30).

Figura 30 – Varësia e shpejtësisë së reaksionit enzimatik nga temperatura
mjedisi i reagimit ( t opt – temperatura optimale; V- reagimi i shpejtësisë)
Siç shihet nga grafiku i paraqitur, në një temperaturë afër 4 o C, reaksionet enzimatike praktikisht nuk ndodhin. Për këtë arsye, objektet biologjike mund të ruhen në të ftohtë për një kohë të caktuar përpara se të kryhen studime biokimike. Është i ftohti ai që lejon që produktet ushqimore të ruhen nga autoliza (vetëtretja).
Një rritje e temperaturës shoqërohet me një rritje të shpejtësisë së reaksionit enzimatik. Arsyeja për këtë është një rritje në energjinë kinetike të substratit dhe molekulave të enzimës, gjë që rrit shkallën e ndërveprimit midis tyre. Një fenomen i ngjashëm vërehet deri në një temperaturë që korrespondon me temperaturën optimale të enzimës. Temperatura optimale e enzimës korrespondon me temperaturën në të cilën shpejtësia e reaksionit enzimatik është maksimale. Për enzimat e kafshëve me gjak të ngrohtë zakonisht është 28 o C ose 37 o C.
Një rritje e mëtejshme e temperaturës së përzierjes së reaksionit çon në një ulje graduale të shpejtësisë së reaksionit enzimatik. Ky fenomen është për shkak të procesit të denatyrimit termik të zinxhirit polipeptid proteinik. Denatyrimi shoqërohet me një ndryshim në strukturën e qendrës aktive të enzimës, gjë që rezulton në një ulje të afinitetit të enzimës për substratin. Në temperaturat mbi 55 o C, shumica e enzimave humbasin plotësisht vetitë e tyre katalitike (inaktivizohen). Në këtë drejtim, ngrohja në 55-56 o C përdoret gjerësisht për procedurën e pasterizimit, e cila rrit jetëgjatësinë e produkteve ushqimore (qumësht, etj.).
PH i mjedisit ka një ndikim të madh në shpejtësinë e reaksionit enzimatik. Siç shihet nga figura e treguar. 31 grafik, ai i ngjan në formë një grafiku të varësisë së shpejtësisë së një reaksioni enzimatik nga temperatura.

Figura 31 – Varësia nga shpejtësia ( V) reaksioni enzimatik
në pH të mjedisit (pH opt – pH optimale e enzimës)
Një rënie e mprehtë e shkallës së reaksionit enzimatik në vlerat ekstreme të pH shoqërohet me fenomenin e denatyrimit të zinxhirit polipeptid të një molekule proteine nën ndikimin e acideve dhe alkaleve. Enzima shfaq fuqi maksimale katalitike në një vlerë pH, e cila përcaktohet nga termi pH optimale enzimë. Shumica e enzimave të njohura kanë një pH optimal në rangun nga 5.0 në 7.5. Në të njëjtën kohë, ka shumë shembuj të enzimave në të cilat vlera optimale e pH zhvendoset në rajonin e vlerave të pH acidike ose alkaline. Këto enzima përfshijnë:
Arsyeja për ekzistencën e një varësie të shpejtësisë së reaksioneve enzimatike nga pH është për faktin se vlera e pH e mediumit ka një efekt të theksuar në shkallën e jonizimit të grupeve funksionale të substratit. Karakteristikat e jonizimit të molekulës së acidit succinic në aciditet të ndryshëm të mjedisit (pH):

Në të njëjtën kohë, pH e mjedisit ndikon gjithashtu në shkallën e jonizimit të radikalëve të aminoacideve që përbëjnë qendrën aktive të enzimës:

Nëse formimi i kompleksit enzimë-substrat stabilizohet për shkak të ndërveprimeve elektrostatike, atëherë bëhet i qartë roli i pH në sigurimin e kushteve optimale për rrjedhën e reaksionit enzimatik (Fig. 24).
Shpejtësia e reaksioneve të katalizuara nga enzimat, në bashkëveprimin e të cilave me substratet, ndërveprimet elektrostatike nuk janë të rëndësishme, varet në një masë më të vogël nga pH e mediumit. Në Fig. Figura 32 tregon varësinë e shkallës së hidrolizës së proteinave nga papaina. Në bashkëveprimin e kësaj enzime me substratin, ndërveprimet hidrofobike marrin rëndësi parësore. Siç mund të shihet nga grafiku i paraqitur, papaina në përgjithësi nuk ka një pH optimale të përcaktuar qartë.

Figura 32 - Efekti i pH në shkallën e hidrolizës së proteinave nga papaina.
Enzimat kanë një të caktuar specifika në lidhje me nënshtresat. Specifikimi i referohet aftësisë së enzimave për të katalizuar transformimin e një ose një grupi substratesh strukturore të ngjashme. Ekzistojnë disa lloje të specifikave të enzimës.
· Specifikimi absolut. I referohet aftësisë së një enzime për të katalizuar transformimin e vetëm një substrati. Enzimat me specifikë absolute përfshijnë arginazën, enzimat kufizuese të urikazës etj.
· Specifikimi relativ. Do të thotë aftësia e një enzime për të katalizuar transformimin e një grupi substratesh të ngjashëm në strukturë (të ashtuquajturat enzima proteolitike hidrolizojnë proteina të ndryshme, estere lipazë të glicerinës dhe acide yndyrore më të larta, heksokinaza fosforilon monosakaride të ndryshme). Në këtë rast, specifika përcaktohet nga fakti se enzima prek vetëm një lloj lidhjeje të caktuar (enzimat proteolitike hidrolizojnë lidhjen peptide, lipaza hidrolizon lidhjen esterike, etj.).
· Stereospecifiteti . Ky term i referohet aftësisë së një enzime për të katalizuar shndërrimin e një stereoizomeri të një substrati. Kështu, enzimat e përfshira në shndërrimin e monosakarideve shfaqin specifikë në lidhje me to D-stereoizomeret, dhe enzimat e përfshira në transformimin e aminoacideve - në të tyre L-stereo-izomerë.
Aktiviteti i enzimës
E veçanta e enzimave si katalizatorë është se ato janë të afta të ndryshojnë vetitë e tyre katalitike nën ndikimin e faktorëve të ndryshëm të jashtëm. Një masë e fuqisë së veprimit katalitik të enzimave është e tyre aktivitet. Aftësia e enzimave për të ndryshuar aktivitetin e tyre në kushte të ndryshme ka kuptim të madh biologjik. Kjo veti i lejon qelizës së gjallë të përshtatë gjendjen e proceseve metabolike me nevojat imediate të qelizave, të cilat mund të ndryshojnë ndjeshëm nën ndikimin e faktorëve të ndryshëm të jashtëm.
Përcaktimi i aktivitetit të enzimës luan një rol të rëndësishëm në karakterizimin e tyre. Ekzistojnë disa parime të përgjithshme për përcaktimin sasior të aktivitetit të enzimës. Aktiviteti i enzimës mund të përcaktohet si më poshtë:
· qoftë nga shpejtësia e akumulimit në përzierjen e reaksionit ku ndodhet enzima e produktit të reaksionit;
· ose nga shpejtësia e zhdukjes së substratit të reaksionit enzimatik nga përzierja e reaksionit.
Të dyja këto qasje janë ekuivalente dhe mund të përdoren në praktikë. Megjithatë, gjatë përcaktimit të aktivitetit të enzimës, duhet të respektohen kushtet e mëposhtme: në përzierjen e reaksionit në të cilën përcaktohet aktiviteti i enzimës,
· temperatura duhet të korrespondojë me temperaturën optimale të enzimës;
· pH e mjedisit duhet të korrespondojë me pH optimale të kësaj enzime;
· përqendrimi i substratit duhet të jetë jo më i vogël se ai ngopjes;
· Kofaktorët duhet të jenë të pranishëm nëse kjo enzimë ka ndonjë;
Aktivizuesit enzimë duhet të jenë të pranishëm.
Kështu, aktiviteti i enzimës përcaktohet në kushte optimale. Në këto kushte, aktiviteti i enzimës është në proporcion me përmbajtjen e saj në kampionin e provës dhe për këtë arsye mund të përdoret për të vlerësuar në mënyrë indirekte përqendrimin e saj.
Aktiviteti i enzimës shprehet në mënyrë sasiore në njësitë e veprimtarisë. Një njësi e aktivitetit të enzimës (U) është aktiviteti i enzimës në të cilin, nën ndikimin e saj, formohet 1 μmol e produktit të reaksionit (ose 1 μmol e substratit zhduket) në minutë.. Në sistemin SI, njësia e aktivitetit enzimatik është katal (kat). 1 katal korrespondon me aktivitetin e enzimës në të cilin formohet një mol produkt i reaksionit (një mol substrat zhduket) në sekondë.
Vlera specifike e aktivitetit përdoret gjithashtu për të karakterizuar enzimat. Kjo njësi pasqyron aktivitetin e enzimës për njësi masë dhe shprehet në μmol/min mg proteinë. Njësitë specifike të aktivitetit përdoren për të vlerësuar pastërtinë e preparateve enzimë. Sa më i lartë të jetë aktiviteti specifik, aq më i pastër është përgatitja e enzimës.
Kinetika e enzimave studion ndikimin e faktorëve të ndryshëm (përqendrimet S dhe E, pH, temperatura, presioni, frenuesit dhe aktivizuesit) në shpejtësinë e reaksioneve enzimatike. Qëllimi kryesor i studimit të kinetikës së reaksioneve enzimatike është marrja e informacionit që lejon një kuptim më të thellë të mekanizmit të veprimit të enzimave.
Kurba kinetike ju lejon të përcaktoni shpejtësinë fillestare të reagimit V 0.
Kurba e ngopjes së substratit.
Varësia e shpejtësisë së reaksionit nga përqendrimi i enzimës.
Varësia e shpejtësisë së reaksionit nga temperatura.
Varësia e shpejtësisë së reaksionit nga pH.
|
|
PH optimale për veprimin e shumicës së enzimave qëndron brenda intervalit fiziologjik 6,0-8,0. Pepsina është aktive në pH 1.5-2.0, që korrespondon me aciditetin e lëngut gastrik. Arginaza, një enzimë specifike për mëlçinë, është aktive në 10.0. Ndikimi i pH në shpejtësinë e një reaksioni enzimatik shoqërohet me gjendjen dhe shkallën e jonizimit të grupeve jonogjene në molekulat e enzimës dhe substratit. Ky faktor përcakton konformimin e proteinës, gjendjen e qendrës aktive dhe substratit, formimin e kompleksit enzimë-substrat dhe vetë procesin e katalizimit. |
Përshkrimi matematikor i lakores së ngopjes së substratit, konstante Michaelis .
|
|
Ekuacioni që përshkruan lakoren e ngopjes së substratit u propozua nga Michaelis dhe Menton dhe mban emrat e tyre (ekuacioni Michaelis-Menten): V = (V MAX *[ S])/(Km+[ S]) , ku Km është konstanta Michaelis. Është e lehtë të llogaritet se kur V = V MAX /2 Km = [S], d.m.th. Km është përqendrimi i substratit në të cilin shpejtësia e reagimit është ½ V MAX. Për të thjeshtuar përcaktimin e V MAX dhe Km, ekuacioni Michaelis-Menten mund të rillogaritet. 1/V = (Km+[S])/(V MAX *[S]), 1/V = Km/(V MAX *[S]) + 1/V MAX , |
|
|
1/ V = Km/ V MAX *1/[ S] + 1/ V MAX Ekuacioni Lineweaver-Burk. Ekuacioni që përshkruan grafikun Lineweaver-Burk është ekuacioni i një drejtëze (y = mx + c), ku 1/V MAX është ndërprerja e vijës së drejtë në boshtin y; Km/V MAX - tangjente e drejtëzës; kryqëzimi i drejtëzës me boshtin e abshisave jep vlerën 1/Km. Grafiku Lineweaver-Burk ju lejon të përcaktoni Km nga një numër relativisht i vogël pikash. Ky grafik përdoret gjithashtu kur vlerësohet efekti i frenuesve, siç do të diskutohet më poshtë. Vlera e Km ndryshon shumë: nga 10 -6 mol/l për enzimat shumë aktive, në 10 -2 për enzimat me aktivitet të ulët. |
Vlerësimet e km kanë vlerë praktike. Në përqendrime të substratit 100 herë më të mëdha se Km, enzima do të funksionojë me shpejtësinë afër maksimale, kështu që shpejtësia maksimale V MAX do të pasqyrojë sasinë e enzimës aktive të pranishme. Kjo rrethanë përdoret për të vlerësuar përmbajtjen e enzimës në preparat. Përveç kësaj, Km është një karakteristikë e një enzime që përdoret për të diagnostikuar enzimopatitë.
Frenimi i aktivitetit të enzimës.
Një tipar jashtëzakonisht karakteristik dhe i rëndësishëm i enzimave është inaktivizimi i tyre nën ndikimin e frenuesve të caktuar.
Frenuesit - këto janë substanca që shkaktojnë frenim të pjesshëm ose të plotë të reaksioneve të katalizuara nga enzimat.
Frenimi i aktivitetit enzimatik mund të jetë i pakthyeshëm ose i kthyeshëm, konkurrues ose jo konkurrues.
Frenim i pakthyeshëm - ky është inaktivizimi i vazhdueshëm i enzimës, si rezultat i lidhjes kovalente të një molekule frenuese në zonën aktive ose në një qendër tjetër të veçantë që ndryshon konformimin e enzimës. Disociimi i komplekseve të tilla të qëndrueshme me rigjenerimin e enzimës së lirë është praktikisht i përjashtuar. Për të kapërcyer pasojat e një frenimi të tillë, trupi duhet të sintetizojë molekula të reja enzimash.
Frenim i kthyeshëm - karakterizohet nga kompleksimi ekuilibër i frenuesit me enzimën për shkak të lidhjeve jokovalente, si rezultat i të cilave komplekse të tilla janë të afta të shkëputen me rivendosjen e aktivitetit të enzimës.
Klasifikimi i frenuesve në konkurrues dhe jo konkurrues bazohet në faktin nëse ai është i dobësuar ( frenimi konkurrues ) ose jo i dobësuar ( frenim jo konkurrues ) efekti i tyre frenues kur rritet përqendrimi i substratit.
Frenuesit konkurrues - këto janë, si rregull, komponime, struktura e të cilave është e ngjashme me strukturën e substratit. Kjo i lejon ata të lidhen në të njëjtin vend aktiv si substratet, duke parandaluar që enzima të ndërveprojë me substratin tashmë në fazën e lidhjes. Pas lidhjes, frenuesi mund të shndërrohet në një produkt ose të mbetet në vendin aktiv derisa të ndodhë disociimi.
Frenim i kthyeshëm konkurrues mund të paraqitet si një diagram:
E↔ E-I → E + P 1
S (joaktive)
Shkalla e frenimit të enzimës përcaktohet nga raporti i përqendrimeve të substratit dhe enzimës.
Një shembull klasik i këtij lloji të frenimit është frenimi i aktivitetit të dehidrogjenazës suksinate (SDH) nga malati, i cili zhvendos suksinatin nga vendi i substratit dhe parandalon shndërrimin e tij në fumarat:

Lidhja kovalente e inhibitorit në zonën aktive rezulton në inaktivizimin e enzimës (frenim i pakthyeshëm). Shembull frenim i pakthyeshëm konkurrues mund të shërbejë si inaktivizim i izomerazës triosefosfat me 3-kloroacetol fosfat. Ky frenues është një analog strukturor i substratit, fosfatit dihidroksiaceton, dhe lidhet në mënyrë të pakthyeshme me mbetjen e acidit glutamik në zonën aktive:
Disa frenues veprojnë më pak në mënyrë selektive, duke ndërvepruar me një grup funksional specifik në zonën aktive të enzimave të ndryshme. Kështu, lidhja e jodoacetatit ose amidit të tij me grupin SH të aminoacidit cisteinë, i vendosur në qendrën aktive të enzimës dhe që merr pjesë në katalizë, çon në një humbje të plotë të aktivitetit të enzimës:
R-SH + JCH 2 COOH → HJ + R-S-CH 2 COOH
Prandaj, këta frenues inaktivizojnë të gjitha enzimat që kanë grupe SH të përfshira në katalizë.
Frenimi i pakthyeshëm i hidrolazave nën veprimin e gazeve nervore (sarin, soman) është për shkak të lidhjes së tyre kovalente me mbetjen e serinës në qendrën aktive.
Metoda e frenimit konkurrues ka gjetur aplikim të gjerë në praktikën mjekësore. Ilaçet sulfonamide, antagonistët e acidit p-aminobenzoik, mund të shërbejnë si një shembull i frenuesve konkurrues të metabolizuar. Ato lidhen me sintetazën dihidropterate, një enzimë bakteriale që konverton p-aminobenzoatin në acid folik, i nevojshëm për rritjen e baktereve. Bakteri vdes si rezultat i faktit se sulfanilamidi i lidhur shndërrohet në një përbërje tjetër dhe acidi folik nuk formohet.
Frenues jo konkurrues zakonisht lidhet me molekulën e enzimës në një vend të ndryshëm nga vendi i lidhjes së substratit dhe substrati nuk konkurron drejtpërdrejt me frenuesin. Meqenëse inhibitori dhe substrati lidhen me qendra të ndryshme, formimi i kompleksit E-I dhe kompleksit S-E-I është i mundur. Kompleksi S-E-I gjithashtu shpërbëhet për të formuar një produkt, por me një ritëm më të ngadaltë se E-S, kështu që reagimi do të ngadalësohet, por nuk do të ndalet. Kështu, reagimet e mëposhtme paralele mund të ndodhin:
E↔ E-I ↔ S-E-I → E-I + P
Frenimi i kthyeshëm jo konkurrues është relativisht i rrallë.
Frenuesit jo konkurrues quhen alosterike ndryshe nga ato konkurruese ( izosterike ).
Inhibimi i kthyeshëm mund të studiohet në mënyrë sasiore duke përdorur ekuacionin Michaelis-Menten.
Me frenimin konkurrues, V MAX mbetet konstante dhe Km rritet.
|
|
|
Me frenim jo konkurrues, V MAX zvogëlohet ndërsa Km mbetet i pandryshuar.
|
|
|
Nëse një produkt reaksioni pengon enzimën që katalizon formimin e saj, kjo metodë e frenimit quhet retroinhibimi ose frenimi i reagimeve . Për shembull, glukoza pengon glukozë-6-fosfatazën, e cila katalizon hidrolizën e glukozës-6-fosfatit.
Rëndësia biologjike e këtij frenimi është rregullimi i disa rrugëve metabolike (shih mësimin vijues).
PJESA PRAKTIKE
Detyrë për nxënësit
1. Studioni denatyrimin e proteinave nën ndikimin e tretësirave të acideve minerale dhe organike dhe me ngrohje.
2. Zbuloni koenzimën NAD në maja.
3. Përcaktoni aktivitetin e amilazës në urinë (serumi i gjakut).
9. STANDARDET E PËRGJIGJEVE PËR PROBLEMET, pyetjet e testit të përdorura për të kontrolluar njohuritë në klasë (mund të përdoren si shtojcë)
10. NATYRA DHE FUSHA E PUNËS TË MUNDSHME EDUKIMORE DHE KËRKIMORE MBI TEMËN
(Tregoni në mënyrë specifike natyrën dhe formën e UIRS: përgatitja e prezantimeve abstrakte, kryerja e kërkimit të pavarur, lojërat simuluese, përgatitja e një historie mjekësore duke përdorur literaturë monografike dhe forma të tjera)
Kinetika e enzimave studion shpejtësinë e reaksioneve të katalizuara nga enzimat në varësi të kushteve të ndryshme (përqendrimi, temperatura, pH, etj.) të ndërveprimit të tyre me substratin.
Megjithatë, enzimat janë proteina që janë të ndjeshme ndaj ndikimit të ndikimeve të ndryshme të jashtme. Prandaj, kur studiojnë shpejtësinë e reaksioneve enzimatike, ata kryesisht marrin parasysh përqendrimet e substancave reaguese dhe përpiqen të minimizojnë ndikimin e temperaturës, pH të mjedisit, aktivizuesve, frenuesve dhe faktorëve të tjerë dhe krijojnë kushte standarde. Së pari, kjo është vlera e pH e mjedisit që është optimale për një enzimë të caktuar. Së dyti, rekomandohet të ruhet një temperaturë prej 25°C, kur është e mundur. Së treti, arrihet ngopja e plotë e enzimës me substratin. Kjo pikë është veçanërisht e rëndësishme sepse në përqendrime të ulëta të substratit, jo të gjitha molekulat e enzimës marrin pjesë në reaksion (Fig. 6.5, A), që do të thotë se rezultati do të jetë larg nga maksimumi i mundshëm. Fuqia më e madhe e reaksionit të katalizuar, duke qenë të barabarta gjërat e tjera, arrihet nëse secila molekulë enzime merr pjesë në transformim, d.m.th. në një përqendrim të lartë të kompleksit enzimë-substrat (Fig. 6.5, V). Nëse përqendrimi i substratit nuk siguron ngopje të plotë të enzimës (Fig. 6.5, b), atëherë shpejtësia e reaksionit nuk e arrin vlerën e saj maksimale.
Oriz. 65.
A - në përqendrim të ulët të substratit; 6 - me përqendrim të pamjaftueshëm të substratit; V - kur enzima është plotësisht e ngopur me substrat
Shpejtësia e një reaksioni enzimatik të matur në kushtet e mësipërme dhe ngopja e plotë e enzimës me substratin quhet shpejtësia maksimale e reaksionit enzimatik (V).
Shpejtësia e reaksionit enzimatik, e përcaktuar kur enzima nuk është plotësisht e ngopur me substratin, shënohet v.
Kataliza e enzimës mund të thjeshtohet nga diagrami i mëposhtëm:

ku F është një enzimë; S - substrate; FS - kompleks enzimë-substrat.
Çdo fazë e këtij procesi karakterizohet nga një shpejtësi e caktuar. Njësia matëse për shpejtësinë e një reaksioni enzimatik është numri i moleve të substratit të konvertuar për njësi të kohës(e njëjtë me shpejtësinë e një reaksioni normal).
Ndërveprimi i enzimës me substratin çon në formimin e një kompleksi enzimë-substrat, por ky proces është i kthyeshëm. Shpejtësia e reaksioneve të përparme dhe të kundërta varen nga përqendrimet e reaktantëve dhe përshkruhen nga ekuacionet përkatëse:
Në një gjendje ekuilibri, ekuacioni (6.3) është i vlefshëm, pasi shpejtësia e reaksioneve të përparme dhe të kundërta janë të barabarta.
Duke zëvendësuar vlerat e shpejtësisë së reaksioneve të përparme (6.1) dhe të kundërt (6.2) në ekuacionin (6.3), marrim barazinë:
Gjendja e ekuilibrit karakterizohet nga një e përshtatshme konstanta e ekuilibrit K p, e barabartë me raportin e konstanteve të reaksioneve të përparme dhe të kundërta (6.5). Reciproku i konstantës së ekuilibrit quhet Ks konstante e substratit, ose konstanta e disociimit të kompleksit enzimë-substrat:

Nga ekuacioni (6.6) shihet qartë se konstanta e substratit zvogëlohet në përqëndrime të larta të kompleksit enzimë-substrat, d.m.th. me stabilitet të madh. Për rrjedhojë, konstanta e substratit karakterizon afinitetin e enzimës dhe substratit dhe raportin e konstanteve të shpejtësisë për formimin dhe shpërbërjen e kompleksit enzimë-substrat.
Fenomeni i ngopjes së enzimës me substrat u studiua nga Leonor Michaelis dhe Maud Mepten. Bazuar në përpunimin matematikor të rezultateve, ata kanë nxjerrë ekuacionin (6.7), i cili ka marrë emrat e tyre, nga i cili është e qartë se në një përqendrim të lartë të substratit dhe një vlerë të ulët të konstantës së substratit, shpejtësia e reaksionit enzimatik priret në maksimum. . Megjithatë, ky ekuacion është i kufizuar sepse nuk merr parasysh të gjithë parametrat:
Kompleksi enzimë-substrat gjatë reaksionit mund të pësojë transformime në drejtime të ndryshme:
- ndahet në substanca mëmë;
- shndërrohen në një produkt nga i cili enzima ndahet e pandryshuar.
Prandaj, për të përshkruar veprimin e përgjithshëm të procesit enzimatik, koncepti Konstantet e Michaelis Kt, që shpreh marrëdhënien ndërmjet konstanteve të shpejtësisë së të tre reaksioneve të katalizimit enzimatik (6.8). Nëse të dy termat ndahen me konstanten e shpejtësisë së reagimit për formimin e kompleksit enzimë-substrat, marrim shprehjen (6.9):

Një rrjedhim i rëndësishëm rrjedh nga ekuacioni (6.9): konstanta e Michaelis është gjithmonë më e madhe se konstanta e substratit për nga sasia k 2 /k v
Numerikisht K t e barabartë me përqendrimin e substratit në të cilin shpejtësia e reagimit është gjysma e shpejtësisë maksimale të mundshme dhe korrespondon me ngopjen e enzimës me substratin, si në Fig. 6.5, b. Meqenëse në praktikë nuk është gjithmonë e mundur të arrihet ngopja e plotë e enzimës me substratin, është pikërisht K t përdoret për karakterizimin krahasues të karakteristikave kinetike të enzimave.
Shpejtësia e reaksionit enzimatik kur enzima nuk është plotësisht e ngopur me substratin (6.10) varet nga përqendrimi i kompleksit enzimë-substrat. Koeficienti i proporcionalitetit është konstanta e reagimit për çlirimin e enzimës dhe produktit, pasi kjo ndryshon përqendrimin e kompleksit enzimë-substrat:
Pas transformimeve, duke marrë parasysh varësitë e mësipërme, shpejtësia e reaksionit enzimatik kur enzima nuk është plotësisht e ngopur me substratin përshkruhet nga ekuacioni (6.11), d.m.th. varet nga përqendrimet e enzimës, substratit dhe afiniteti i tyre K s:
Varësia grafike e shpejtësisë së një reaksioni enzimatik nga përqendrimi i substratit nuk është lineare. Siç është e qartë nga Fig. 6.6, me rritjen e përqendrimit të substratit, vërehet një rritje e aktivitetit të enzimës. Megjithatë, kur arrihet ngopja maksimale e enzimës me substratin, shpejtësia e reaksionit enzimatik bëhet maksimale. Prandaj, faktori kufizues i shpejtësisë për reaksionin është formimi i një kompleksi enzimë-substrat.
Praktika ka treguar se përqendrimet e substratit, si rregull, shprehen në vlera shumë më të vogla se uniteti (10 6 -10 3 mol). Është mjaft e vështirë të operosh me sasi të tilla në llogaritje. Prandaj, G. Lineweaver dhe D. Burke propozuan të shprehin varësinë grafike të shpejtësisë së një reaksioni enzimatik jo në koordinata të drejtpërdrejta, por në ato të anasjellta. Ata dolën nga supozimi se për sasi të barabarta inverset e tyre janë gjithashtu të barabarta:

Oriz. 6.6.
Pas transformimit të shprehjes (6.13), marrim një shprehje të quajtur Ekuacioni Lineweaver-Burk (6.14):
Varësia grafike e ekuacionit Lineweaver-Burk është lineare (Fig. 6.7). Karakteristikat kinetike të enzimës përcaktohen si më poshtë:
- segmenti i prerë në boshtin e ordinatave është i barabartë me 1/V;
- segmenti i prerë në boshtin e abshisës është i barabartë me -1 /Për t.

Oriz. 6.7.
Besohet se metoda Lineweaver-Burk bën të mundur përcaktimin e shkallës maksimale të reagimit më saktë sesa në koordinatat e drejtpërdrejta. Informacione të vlefshme në lidhje me frenimin e enzimës mund të nxirren gjithashtu nga ky grafik.
Ka mënyra të tjera për të transformuar ekuacionin Michaelis-Menten. Varësitë grafike përdoren për të studiuar ndikimin e ndikimeve të ndryshme të jashtme në procesin enzimatik.
Kjo degë e enzimologjisë studion ndikimin e faktorëve të ndryshëm në shpejtësinë e një reaksioni enzimatik. Duke marrë parasysh ekuacionin e përgjithshëm për katalizën enzimatike të reaksionit të kthyeshëm të shndërrimit të një substrati në një produkt (1),
Faktorët kryesorë që ndikojnë në shpejtësinë e një reaksioni enzimatik duhet të emërtohen: përqendrimi i substratit [S], përqendrimi i enzimës [E] dhe përqendrimi i produktit të reaksionit [P].
Ndërveprimi i disa enzimave me substratin e tyre mund të përshkruhet nga një kurbë hiperbolike e varësisë së shpejtësisë së reaksionit enzimatik V nga përqendrimi i substratit [S] (Fig. 19):

Fig. 19. Varësia e shpejtësisë së reaksionit enzimatik nga përqendrimi i substratit.
Në këtë kurbë, mund të dallohen tre seksione, të cilat mund të shpjegohen me dispozitat e mekanizmit të ndërveprimit të enzimës me substratin: OA - një seksion i varësisë drejtpërdrejt proporcionale të V nga [S], qendrat aktive të enzimës. mbushen gradualisht me molekula substrate me formimin e një kompleksi të paqëndrueshëm ES; seksioni AB - varësia lakorike e V nga [S], ngopja e plotë e qendrave aktive të enzimës me molekula substrate nuk është arritur ende. Kompleksi ES është i paqëndrueshëm përpara se të arrijë në gjendjen e tranzicionit; probabiliteti i disociimit të kundërt në E dhe S është ende i lartë; seksioni BC - varësia përshkruhet me një ekuacion të rendit zero, seksioni është paralel me boshtin [S], është arritur ngopja e plotë e enzimave aktive me molekula të substratit, V=V max.
Forma karakteristike e kurbës përshkruhet matematikisht nga ekuacioni Briggs-Haldane:
V=V max ● [S]/ Km + [S] (2),
ku Km është konstanta Michaelis-Menten, numerikisht e barabartë me përqendrimin e substratit në të cilin shpejtësia e reaksionit enzimatik është e barabartë me gjysmën V max.
Sa më i ulët të jetë K m i enzimës, aq më i lartë është afiniteti i enzimës për substratin, aq më shpejt arrihet gjendja e tranzicionit për substratin dhe ai shndërrohet në produkt reaksioni. Gjetja e vlerave Km për çdo substrat enzimë specifike për grupin është e rëndësishme në përcaktimin e rolit biologjik të kësaj enzime në qelizë.
Për shumicën e enzimave është e pamundur të ndërtohet një kurbë hiperbolike (Fig. 19) Në këtë rast përdoret metoda e dyfishtë reciproke (Lineweaver-Burk), d.m.th. është paraqitur një varësi grafike prej 1/[V] nga 1/[S] (Fig. 20). Metoda e ndërtimit të kthesave të tilla në një eksperiment është shumë e përshtatshme kur studiohet efekti i llojeve të ndryshme të frenuesve në aktivitetin e enzimës (shih më tej në tekst).

Fig.20. Grafiku i 1/[V] kundrejt 1/[S] (metoda Lineweaver-Burk),
ku y është seksioni prerës - , dhe x është seksioni prerës -  , tangjentja e këndit α - .
, tangjentja e këndit α - .
Varësia e shpejtësisë së reaksionit enzimatik V nga përqendrimi i enzimës [E].
Kjo varësi grafike (Fig. 21) konsiderohet në temperaturën dhe pH optimale të mjedisit, në përqendrime të substratit dukshëm më të larta se përqendrimi i ngopjes së qendrave aktive të enzimës.

Oriz. 21. Ndikimi i përqendrimit të enzimës në shpejtësinë e reaksionit enzimatik.
Varësia e shpejtësisë së një reaksioni enzimatik nga përqendrimi i një kofaktori ose koenzime. Për enzimat komplekse, duhet të merret parasysh se mungesa e formave koenzimë të vitaminave në rast të hipovitaminozës dhe një shkelje e marrjes së joneve metalike në trup çojnë domosdoshmërisht në një ulje të përqendrimit të enzimave përkatëse të nevojshme për kursin. e proceseve metabolike. Prandaj, duhet të konkludohet se aktiviteti i enzimës varet drejtpërdrejt nga përqendrimi i kofaktorit ose koenzimës.
Ndikimi i përqendrimit të produktit në shpejtësinë e reaksionit enzimatik. Për reaksionet e kthyeshme që ndodhin në trupin e njeriut, duhet të merret parasysh që produktet e reaksionit të drejtpërdrejtë mund të përdoren nga enzima si substrate për reaksionin e kundërt. Prandaj, drejtimi i rrjedhjes dhe momenti i arritjes së Vmax varen nga raporti i përqendrimeve të substrateve fillestare dhe produkteve të reaksionit. Për shembull, aktiviteti i alaninës aminotransferazës, e cila katalizon transformimin:
Alanine + Alfa-ketoglutarat ↔ Piruvat + Glutamat
varet në qelizë nga raporti i përqendrimit:
[alanine + alfa-ketoglutarat] / [piruvat + glutamat].
MEKANIZMI I VEPRIMIT TË ENZIMËS. TEORITË E KATALIZËS SË ENZIMËS
Enzimat, si katalizatorët joproteinikë, rrisin shpejtësinë e një reaksioni kimik për shkak të aftësisë së tyre për të reduktuar energjinë e aktivizimit të këtij reaksioni. Energjia e aktivizimit të një reaksioni enzimatik llogaritet si diferencë midis vlerës së energjisë në sistemin e reaksionit në vazhdim që ka arritur gjendjen e tranzicionit dhe energjisë së përcaktuar në fillim të reaksionit (shih varësinë grafike në Fig. 22).

Oriz. 22. Varësia grafike e gjendjes energjetike të një reaksioni kimik pa enzimë (1) dhe në prani të një enzime (2) nga koha e reaksionit.
Puna e V. Henry dhe, në veçanti, L. Michaelis, M. Menten për studimin e mekanizmit të reaksioneve enzimatike të kthyeshme monosubstrate bëri të mundur që të supozohet se enzima E së pari në mënyrë të kthyeshme dhe relativisht shpejt kombinohet me substratin e saj S për të formuar një enzimë- Kompleksi i substratit (ES):
E+S<=>ES (1)
Formimi i ES ndodh për shkak të lidhjeve hidrogjenore, ndërveprimeve elektrostatike, hidrofobike, në disa raste kovalente, lidhjeve koordinuese midis radikaleve anësore të mbetjeve aminoacide të qendrës aktive dhe grupeve funksionale të substratit. Në enzimat komplekse funksionin e kontaktit me substratin mund ta kryejë edhe pjesa joproteinike e strukturës.
Kompleksi enzimë-substrat më pas shpërbëhet në një reaksion të dytë, më të ngadalshëm, të kthyeshëm për të prodhuar produktin e reaksionit P dhe enzimën e lirë E:
ES<=>EP<=>E+P (2)
Aktualisht, falë punës së shkencëtarëve të lartpërmendur, si dhe Keilin D., Chance B., Koshland D. (teoria e "korrespondencës së induktuar"), ekzistojnë dispozita teorike rreth katër pikave kryesore në mekanizmin e veprimit. të një enzime në një substrat, të cilat përcaktojnë aftësinë e enzimave për të përshpejtuar reaksionet kimike:
1. Orientimi dhe qasja . Enzima është në gjendje të lidhë një molekulë substrati në atë mënyrë që lidhja e sulmuar nga enzima të jetë jo vetëm e vendosur në afërsi të grupit katalitik, por edhe e orientuar saktë në lidhje me të. Mundësia që kompleksi ES të arrijë në gjendjen e tranzicionit përmes orientimit dhe afërsisë është rritur shumë.
2. Stresi dhe tendosja : korrespondencë e nxitur. Lidhja e një substrati mund të shkaktojë ndryshime konformacionale në molekulën e enzimës, të cilat çojnë në tension në strukturën e qendrës aktive, dhe gjithashtu deformojnë disi substratin e lidhur, duke lehtësuar kështu arritjen e një gjendjeje kalimtare nga kompleksi ES. Një e ashtuquajtur korrespondencë e induktuar lind midis molekulave E dhe S.
Shpejtësia e reaksioneve enzimatike varet nga përqendrimi i enzimës, substrati, temperatura, pH dhe prania e aktivizuesve dhe inhibitorëve.
Në kushte të substratit të tepërt, shpejtësia e reagimit drejtpërpjesëtimore përqendrimi i enzimës (Fig. 3.2).
Oriz. 3.2. Varësia e shpejtësisë së reaksionit nga përqendrimi i enzimës.
Varësia e shpejtësisë së reagimit nga përqendrimi i substratit paraqitur në figurën 3.3.
Oriz. 3.3. Varësia e shpejtësisë së reaksionit nga përqendrimi i substratit.
Ka 3 seksione në grafik. Në përqendrim të ulët të substratit (seksioni A) shpejtësia e reaksionit është drejtpërdrejt proporcionale me përqendrimin e substratit dhe i bindet kinetikës së rendit të parë. Vendndodhja është ndezur b(reagimi i rendit të përzier) shkelet kjo varësi. Vendndodhja është ndezur c shpejtësia e reagimit është maksimale dhe nuk varet nga përqendrimi i substratit.
Një reaksion enzimatik karakterizohet nga formimi i një kompleksi enzimë-substrat, i cili zbërthehet për të formuar enzimën e lirë dhe produktin e reaksionit.
Në këtë ekuacion, k 1 është konstanta e shpejtësisë për formimin e kompleksit enzimë-substrat, k 2 është konstanta e disociimit të kompleksit enzimë-substrat për të formuar një enzimë dhe substrat të lirë, dhe k 3 është konstanta e shpejtësisë për disociimin të kompleksit enzimë-substrat ndaj enzimës së lirë dhe produktit të reaksionit.
Michaelis dhe Menten propozuan një ekuacion që përshkruan varësinë e shpejtësisë së reagimit nga përqendrimi i substratit.
v është shpejtësia e reagimit në një përqendrim të caktuar të substratit; Ks – konstanta e disociimit të kompleksit enzimë-substrat; Vmax - shpejtësia maksimale e reagimit.
Ks=k -2 /k 1 d.m.th. raporti i konstantës së reaksionit të kundërt me konstantën e reagimit përpara.
Megjithatë, ky ekuacion përshkruan vetëm seksionin A në grafik dhe nuk merr parasysh ndikimin e produkteve të reaksionit në shpejtësinë e procesit enzimatik.
Haldane dhe Briggs zëvendësuan konstantën e disociimit në ekuacion me konstanten Michaelis (Km).
Michaelis konstante numerikisht e barabartë me përqendrimin e substratit, në të cilën shpejtësia e reagimit është gjysma e maksimumit. Konstanta Michaelis karakterizon afinitetin e enzimës dhe substratit. Një afinitet i lartë i një enzime për një substrat karakterizohet nga një vlerë e ulët Km dhe anasjelltas.
Përdorimi i grafikut të propozuar nga Michaelis dhe Menten është i papërshtatshëm. Për një paraqitje grafike më të përshtatshme, G. Lineweaver dhe D. Burke transformuan ekuacionin Haldane dhe Briggs duke përdorur metodën e dyfishtë reciproke, bazuar në parimin se nëse ka barazi midis dy madhësive, atëherë edhe reciprokalët do të jenë të barabartë.
Paraqitja grafike e varësisë së shpejtësisë së reaksionit nga pH ka një formë zile. Vlera e pH në të cilën enzima shfaq aktivitet maksimal quhet pH optimale(Fig. 5.4 A) . Për shumicën e enzimave, pH optimale është 6-8. Përjashtim bën pepsina, optimale e së cilës është 2.0. Kur pH ndryshon në një drejtim ose në një tjetër nga optimali, shpejtësia e reagimit zvogëlohet për shkak të jonizimit të grupeve funksionale të enzimës dhe substratit, gjë që prish formimin e kompleksit enzimë-substrat.
Oriz. 3.4. Varësia e shpejtësisë së reaksionit nga pH (A) dhe temperatura (B).
Shpejtësia e një reaksioni kimik rritet me 2 herë me rritjen temperatura me 10°C. Sidoqoftë, për shkak të natyrës proteinike të enzimës, me një rritje të mëtejshme të temperaturës, ndodh denatyrimi i enzimës. Temperatura në të cilën shpejtësia e reaksionit është maksimale quhet temperatura optimale(Fig. 3.4. B) . Për shumicën e enzimave, temperatura optimale është 37-40°C. Përjashtim bën miokinaza e muskujve, e cila mund të përballojë ngrohjen deri në 100°C.
Aktivizuesit e enzimës– këto janë substanca 1) që formojnë qendrën aktive të enzimës (Co 2+, Mg 2+, Zn 2+, Fe 2+, Ca 2+); 2) lehtësimi i formimit të kompleksit enzimë-substrat (Mg 2+); 3) reduktimi i grupeve SH (glutathione, cisteinë, mercaptoetanol); 4) stabilizimi i strukturës amtare të protein-enzimës. Reaksionet enzimatike zakonisht aktivizohen nga kationet (në tabelën periodike nga 19 në 30). Anionet janë më pak aktive, megjithëse jonet e klorit dhe anionet e disa halogjeneve të tjerë mund të aktivizojnë pepsinën, amilazën dhe adenilate ciklazën. Proteinat mund të jenë aktivizues: apoproteina A-I (LCAT), apoproteina C-II (LPL).
Mekanizmi i veprimit të aktivizuesve:
1) marrin pjesë në formimin e qendrës aktive të enzimave;
2) lehtësojnë lidhjen e substratit dhe enzimës;
3) marrin pjesë në formimin e strukturës amtare të enzimës.
Frenuesit– substanca që shkaktojnë frenim të pjesshëm ose të plotë të reaksioneve të katalizuara nga enzimat.
Frenuesit klasifikohen në jospecifike Dhe specifike. Veprimi i frenuesve jospecifik nuk lidhet me mekanizmin e veprimit të enzimave. Këta frenues shkaktojnë denatyrim të proteinës enzimë (nxehtësia, acidet, alkalet, kripërat e metaleve të rënda, etj.).
Frenuesit specifikë ndikojnë në mekanizmin e veprimit të enzimave. Frenuesit specifikë ndahen në 2 grupe: e kthyeshme dhe e pakthyeshme. Frenuesit e pakthyeshëm shkaktojnë një ndryshim ose modifikim të përhershëm, të pakthyeshëm të grupeve funksionale të enzimës nëpërmjet lidhjes së ngushtë ose kovalente. Ky grup përfshin: 1) frenuesit e metaleve enzimat (HCN, RCN, HF, CO, etj.). Këto komponime lidhen me metale me valencë të ndryshueshme (Cu ose Fe), si rezultat i të cilave procesi i transferimit të elektroneve përgjatë zinxhirit respirator të enzimave është ndërprerë. Prandaj, këta frenues quhen helme të frymëmarrjes. 2) frenuesit e enzimave që përmbajnë grupe SH(monoidoacetate, diiodoacetate, jodoacetamide, arseniku dhe komponimet e merkurit). 3) frenuesit e enzimave që përmbajnë një grup OH në qendrën aktive (përbërjet organofosforike, insekticide). Këta frenues pengojnë, para së gjithash, aktivitetin e kolinesterazës, një enzimë që luan një rol parësor në aktivitetin e sistemit nervor.
E kthyeshme frenimi mund të matet duke përdorur ekuacionin Michaelis-Menten. Frenuesit e kthyeshëm ndahen në konkurruese dhe jokonkurruese.
Frenuesit konkurrues- Këto janë substanca të ngjashme në strukturë me substratin. Inhibitori lidhet me vendin aktiv të enzimës dhe parandalon formimin e kompleksit enzimë-substrat.
Një shembull klasik i frenimit konkurrues është frenimi i dehidrogjenazës suksinate nga acidi malonik. Succinate dehydrogenaza katalizon oksidimin e acidit succinic (succinate) nga dehidrogjenimi në acid fumarik.
Nëse në mjedis shtohet acid malonik (një frenues), atëherë, si rezultat i ngjashmërisë së tij strukturore me suksinatin e vërtetë të substratit, ai do të reagojë me zonën aktive për të formuar një kompleks enzimë-frenues, por reagimi nuk do të ndodhë.
Efekti i frenuesit eliminohet nga rritja e përqendrimit të substratit. Me frenimin konkurrues, kinetika e reaksioneve enzimatike ndryshon: Km rritet, V max mbetet konstante(Fig. 3.5).
Oriz. 3.5. Efekti i frenuesve konkurrues në shpejtësinë e reaksionit enzimatik
Metoda e frenimit konkurrues ka gjetur aplikim në praktikën mjekësore si antimetabolitët.
Për shembull, ilaçet sulfonamide përdoren për të trajtuar disa sëmundje infektive të shkaktuara nga bakteret. Këto barna janë strukturalisht të ngjashme me acidin para-aminobenzoik, të cilin qeliza bakteriale e përdor për të sintetizuar acidin folik, i cili është i nevojshëm për jetën e baktereve. Për shkak të kësaj ngjashmërie strukturore, sulfonamidi bllokon veprimin e enzimës duke zhvendosur acidin para-aminobenzoik nga kompleksi me enzimën që sintetizon acidin folik.
Frenuesit jo konkurrues - substanca që nuk janë strukturalisht të ngjashme me substratet. Frenuesit jo konkurrues nuk lidhen me vendin aktiv, por me një vendndodhje tjetër në molekulën e enzimës, për shembull, në qendrën alosterike. Kjo ndryshon konformimin e qendrës aktive në atë mënyrë që ndërveprimi i substratit me të ndërpritet.
Për frenimin jo konkurrues: V max zvogëlohet, por K m nuk ndryshon(Fig. 3.6).