Kinetika enzymatických reakcií. Závislosť rýchlosti enzymatických reakcií od koncentrácie substrátov, enzýmov, teploty Aké je poradie enzymatickej reakcie podľa enzýmu
Rýchlosť enzymatických reakcií závisí od koncentrácie sub-
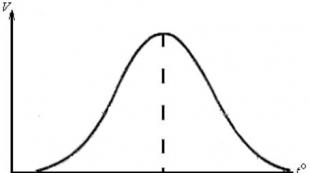
stratum Táto závislosť je komplexná, čo je pre určité enzýmy opísané parabolickou krivkou (obr. 29).
Obrázok 29 – Závislosť rýchlosti enzymatickej reakcie
na koncentrácii substrátu
Parabolický charakter závislosti sa vysvetľuje skutočnosťou, že pri interakcii enzýmu so substrátom sa vytvorí komplex enzým-substrát. Spočiatku, keď sa koncentrácia substrátu zvyšuje, koncentrácia komplexov enzým-substrát v reakčnej zmesi stúpa, čo sa prejavuje paralelným zvýšením rýchlosti reakcie. Pri určitej koncentrácii substrátu (saturácia) dochádza k akejsi „saturácii“ všetkých aktívnych centier molekúl enzýmov v reakčnej zmesi. Rýchlosť enzymatickej reakcie pri saturačnej koncentrácii sa stáva maximálnou. S ďalším zvýšením obsahu substrátu v reakčnej zmesi sa nemení.
Z grafu závislosti rýchlosti enzymatickej reakcie od koncentrácie substrátu sa vypočítajú dva dôležité ukazovatele:
1. Maximálna rýchlosť reakcie (V max). Je definovaná ako rýchlosť reakcie pri nasýtenej koncentrácii substrátu. Maximálna hodnota rýchlosti odráža katalytickú silu enzýmu. Väčšie enzýmy V max sú výkonnejšie katalyzátory. Katalyzujú transformáciu väčšieho počtu molekúl substrátu za jednotku času. Maximálna rýchlosť je vyjadrená počtom otáčok enzýmu. Počet obratu sa odhaduje podľa počtu molekúl substrátu premenených enzýmom za jednotku času (s -1). Pre väčšinu enzýmov je číslo obratu do 104. Zároveň existujú enzýmy, pre ktoré rýchlosť významne viac (600 000 pre karbanhydrázu) alebo menej ako táto hodnota (100 pre chymotrypsín).
2. Michaelis konštanta (TO m). Michaelisova konštanta je koncentrácia substrátu, pri ktorej je rýchlosť reakcie polovičná. Rozsah TO m odráža afinitu enzýmu k substrátu. Čím väčšia je táto hodnota, tým menšiu afinitu má enzým k substrátu. TO m je vyjadrené v móloch substrátu. Takže hodnota TO m vo vzťahu ku glukóze pre enzým glukokinázu je 10 mmol a pre hexokinázu - 0,01 mmol. Hexokináza vykazuje väčšiu afinitu ku glukóze ako glukokináza; pri rovnakej koncentrácii substrátu katalyzuje fosforyláciu glukózy vyššou rýchlosťou.
Na základe matematickej analýzy krivky závislosti rýchlosti enzymatickej reakcie od koncentrácie substrátu odvodili L. Michaelis a M. Menten (1913) vzorec, ktorý umožňuje vyhodnotiť vzťah medzi rýchlosťou reakcie, maximálna rýchlosť a Michaelisova konštanta. V súčasnosti je definovaná ako rovnica Michaelis-Menten.
V o = V max [ S]/K m + [ S],
Kde V o – rýchlosť reakcie, S– koncentrácia substrátu.
Všeobecné vlastnosti enzýmov
Napriek existencii určitých rozdielov v štruktúre, funkcii a intracelulárnej lokalizácii sa enzýmy vyznačujú množstvom spoločných vlastností. Patrí medzi ne závislosť prejavu ich katalytickej aktivity od teploty (termolability) a pH prostredia, ako aj substrátovej špecifickosti.
Charakteristickou vlastnosťou enzýmov je termolabilita. Tento jav možno ilustrovať grafom rýchlosti enzymatickej reakcie v závislosti od teploty reakčnej zmesi (obr. 30).

Obrázok 30 – Závislosť rýchlosti enzymatickej reakcie od teploty
reakčné médium ( t opt – optimálna teplota; V- rýchlosť reakcie)
Ako vidno z prezentovaného grafu, pri teplote blízkej 4 o C enzymatické reakcie prakticky neprebiehajú. Z tohto dôvodu môžu byť biologické objekty pred vykonaním biochemických štúdií určitý čas skladované v chlade. Je to chlad, ktorý umožňuje zachovať potravinové produkty pred autolýzou (samotrávením).
Zvýšenie teploty je sprevádzané zvýšením rýchlosti enzymatickej reakcie. Dôvodom je zvýšenie kinetickej energie molekúl substrátu a enzýmu, čo zvyšuje rýchlosť interakcie medzi nimi. Podobný jav sa pozoruje až do teploty, ktorá zodpovedá teplotnému optimu enzýmu. Teplotné optimum enzýmu zodpovedá teplote, pri ktorej je rýchlosť enzymatickej reakcie maximálna. Pre enzýmy teplokrvných živočíchov je to zvyčajne 28 o C alebo 37 o C.
Ďalšie zvýšenie teploty reakčnej zmesi vedie k postupnému znižovaniu rýchlosti enzymatickej reakcie. Tento jav je spôsobený procesom tepelnej denaturácie proteínového polypeptidového reťazca. Denaturácia je sprevádzaná zmenou štruktúry aktívneho centra enzýmu, čo má za následok zníženie afinity enzýmu k substrátu. Pri teplotách nad 55 o C väčšina enzýmov úplne stráca svoje katalytické vlastnosti (inaktivuje sa). V tomto ohľade sa zahrievanie na 55–56 o C široko používa na pasterizáciu, čo zvyšuje trvanlivosť potravinárskych výrobkov (mlieka atď.).
Na rýchlosť enzymatickej reakcie má veľký vplyv pH prostredia. Ako je možné vidieť na obrázku. 31, tvarom pripomína graf závislosti rýchlosti enzymatickej reakcie od teploty.

Obrázok 31 – Závislosť od rýchlosti ( V) enzymatická reakcia
na pH prostredia (pH opt – pH optimum enzýmu)
Prudký pokles rýchlosti enzymatickej reakcie pri extrémnych hodnotách pH je spojený s javom denaturácie polypeptidového reťazca proteínovej molekuly pod vplyvom kyselín a zásad. Enzým vykazuje maximálnu katalytickú silu pri hodnote pH, ktorá je určená termínom pH optimum enzým. Väčšina známych enzýmov má optimálne pH v rozsahu od 5,0 do 7,5. Zároveň existuje mnoho príkladov enzýmov, v ktorých je optimálna hodnota pH posunutá do oblasti kyslých alebo zásaditých hodnôt pH. Tieto enzýmy zahŕňajú:
Dôvodom existencie závislosti rýchlosti enzymatických reakcií od pH je skutočnosť, že hodnota pH média má výrazný vplyv na stupeň ionizácie funkčných skupín substrátu. Vlastnosti ionizácie molekuly kyseliny jantárovej pri rôznej kyslosti prostredia (pH):

Zároveň pH prostredia ovplyvňuje aj stupeň ionizácie radikálov aminokyselín, ktoré tvoria aktívne centrum enzýmu:

Ak sa vďaka elektrostatickým interakciám stabilizuje tvorba komplexu enzým-substrát, potom sa vyjasní úloha pH pri zabezpečení optimálnych podmienok pre priebeh enzymatickej reakcie (obr. 24).
Rýchlosť reakcií katalyzovaných enzýmami, pri ktorých interakcii so substrátmi nie sú elektrostatické interakcie významné, závisí v menšej miere od pH média. Na obr. Obrázok 32 ukazuje závislosť rýchlosti hydrolýzy proteínu papaínom. Pri interakcii tohto enzýmu so substrátom nadobúdajú prvoradý význam hydrofóbne interakcie. Ako je možné vidieť z prezentovaného grafu, papaín vo všeobecnosti nemá jasne definované pH optimum.

Obrázok 32 - Vplyv pH na rýchlosť hydrolýzy proteínu papaínom.
Enzýmy majú určité špecifickosťčo sa týka substrátov. Špecifickosť sa týka schopnosti enzýmov katalyzovať transformáciu jedného alebo skupiny štruktúrne podobných substrátov. Existuje niekoľko typov enzýmovej špecifickosti.
· Absolútna špecifickosť. Vzťahuje sa na schopnosť enzýmu katalyzovať transformáciu iba jedného substrátu. Medzi enzýmy s absolútnou špecifickosťou patria argináza, reštrikčné enzýmy urikázy atď.
· Relatívna špecifickosť. Znamená schopnosť enzýmu katalyzovať premenu skupiny štruktúrne podobných substrátov (tzv. proteolytické enzýmy hydrolyzujú rôzne proteíny, lipázové estery glycerolu a vyšších mastných kyselín, hexokináza fosforyluje rôzne monosacharidy). V tomto prípade je špecifickosť určená tým, že enzým ovplyvňuje len určitý typ väzby (proteolytické enzýmy hydrolyzujú peptidovú väzbu, lipáza hydrolyzuje esterovú väzbu atď.).
· Stereošpecifickosť . Tento výraz sa týka schopnosti enzýmu katalyzovať konverziu jedného stereoizoméru substrátu. Enzýmy zapojené do premeny monosacharidov teda vykazujú špecifickosť vzhľadom na ich D-stereoizoméry, a enzýmy podieľajúce sa na premene aminokyselín - na ich L-stereo-izoméry.
Enzýmová aktivita
Zvláštnosťou enzýmov ako katalyzátorov je, že sú schopné meniť svoje katalytické vlastnosti pod vplyvom rôznych vonkajších faktorov. Meradlom sily katalytického pôsobenia enzýmov je ich činnosť. Schopnosť enzýmov meniť svoju aktivitu za rôznych podmienok dáva veľký biologický zmysel. Táto vlastnosť umožňuje živej bunke prispôsobiť stav metabolických procesov okamžitým potrebám buniek, ktoré sa môžu pod vplyvom rôznych vonkajších faktorov výrazne meniť.
Pri ich charakterizácii hrá dôležitú úlohu stanovenie enzýmovej aktivity. Existuje niekoľko všeobecných princípov na kvantifikáciu enzýmovej aktivity. Aktivitu enzýmu možno určiť nasledovne:
· buď rýchlosťou akumulácie v reakčnej zmesi, kde sa nachádza enzým reakčného produktu;
· alebo rýchlosťou vymiznutia substrátu enzymatickej reakcie z reakčnej zmesi.
Oba tieto prístupy sú ekvivalentné a možno ich použiť v praxi. Pri určovaní aktivity enzýmu je však potrebné dodržať tieto podmienky: v reakčnej zmesi, v ktorej sa zisťuje aktivita enzýmu,
· teplota musí zodpovedať teplotnému optimu enzýmu;
· pH média musí zodpovedať optimu pH tohto enzýmu;
· koncentrácia substrátu nesmie byť menšia ako nasýtená;
· ak tento enzým nejaký má, musia byť prítomné kofaktory;
Musia byť prítomné aktivátory enzýmov.
Aktivita enzýmu sa teda určuje za optimálnych podmienok. Za týchto podmienok je aktivita enzýmu úmerná jeho obsahu v testovanej vzorke, a preto sa môže použiť na nepriamy odhad jeho koncentrácie.
Enzýmová aktivita je kvantitatívne vyjadrená v jednotky činnosti. Jedna jednotka aktivity enzýmu (U) je aktivita enzýmu, pri ktorej sa pod jej vplyvom vytvorí 1 µmol reakčného produktu (alebo zmizne 1 µmol substrátu) za minútu.. V sústave SI je jednotkou enzymatickej aktivity katal (kat). 1 katal zodpovedá aktivite enzýmu, pri ktorej sa vytvorí jeden mól reakčného produktu (jeden mól substrátu zmizne) za sekundu.
Hodnota špecifickej aktivity sa tiež používa na charakterizáciu enzýmov. Táto jednotka odráža aktivitu enzýmu na jednotku hmotnosti a je vyjadrená v umol/min mg proteínu. Na hodnotenie čistoty enzýmových prípravkov sa používajú jednotky špecifickej aktivity. Čím vyššia je špecifická aktivita, tým je enzýmový prípravok čistejší.
Enzýmová kinetika študuje vplyv rôznych faktorov (koncentrácie S a E, pH, teplota, tlak, inhibítory a aktivátory) na rýchlosť enzymatických reakcií. Hlavným cieľom štúdia kinetiky enzymatických reakcií je získať informácie umožňujúce hlbšie pochopenie mechanizmu účinku enzýmov.
Kinetická krivka umožňuje určiť počiatočnú rýchlosť reakcie V 0 .
Krivka nasýtenia substrátu.
Závislosť rýchlosti reakcie od koncentrácie enzýmu.
Závislosť rýchlosti reakcie od teploty.
Závislosť rýchlosti reakcie od pH.
|
|
Optimálne pH pre pôsobenie väčšiny enzýmov leží vo fyziologickom rozmedzí 6,0-8,0. Pepsín je aktívny pri pH 1,5-2,0, čo zodpovedá kyslosti žalúdočnej šťavy. Argináza, pečeňovo špecifický enzým, je aktívna pri 10,0. Vplyv pH na rýchlosť enzymatickej reakcie je spojený so stavom a stupňom ionizácie ionogénnych skupín v molekulách enzýmu a substrátu. Tento faktor určuje konformáciu proteínu, stav aktívneho centra a substrátu, tvorbu komplexu enzým-substrát a samotný proces katalýzy. |
Matematický popis krivky nasýtenia substrátu, Michaelisova konštanta .
|
|
Rovnicu popisujúcu krivku nasýtenia substrátu navrhli Michaelis a Menton a nesie ich mená (rovnica Michaela-Mentena): V = (V MAX *[ S])/(Km+[ S]) , kde Km je Michaelisova konštanta. Je ľahké vypočítať, že keď V = V MAX /2 Km = [S], t.j. Km je koncentrácia substrátu, pri ktorej je rýchlosť reakcie ½ V MAX. Pre zjednodušenie určenia V MAX a Km je možné prepočítať Michaelis-Mentenovu rovnicu. 1/V = (Km+[S])/(V MAX *[S]), 1/V = Km/(V MAX *[S]) + 1/V MAX , |
|
|
1/ V = Km/ V MAX *1/[ S] + 1/ V MAX Lineweaver-Burk rovnica. Rovnica opisujúca Lineweaver-Burkov graf je rovnica priamky (y = mx + c), kde 1/V MAX je priesečník priamky na osi y; Km/V MAX - dotyčnica priamky; priesečník priamky s osou x dáva hodnotu 1/Km. Lineweaver-Burk graf vám umožňuje určiť km z relatívne malého počtu bodov. Tento graf sa používa aj pri hodnotení účinku inhibítorov, o ktorom bude reč nižšie. Hodnota Km sa veľmi líši: od 10 -6 mol/l pre veľmi aktívne enzýmy do 10 -2 pre nízkoaktívne enzýmy. |
Odhady km majú praktickú hodnotu. Pri koncentráciách substrátu 100-krát vyšších ako Km bude enzým pracovať pri maximálnej rýchlosti, takže maximálna rýchlosť V MAX bude odrážať množstvo prítomného aktívneho enzýmu. Táto okolnosť sa používa na odhad obsahu enzýmu v prípravku. Okrem toho je Km charakteristikou enzýmu, ktorý sa používa na diagnostiku enzymopatií.
Inhibícia aktivity enzýmov.
Mimoriadne charakteristickou a dôležitou vlastnosťou enzýmov je ich inaktivácia vplyvom určitých inhibítorov.
Inhibítory - sú to látky, ktoré spôsobujú čiastočnú alebo úplnú inhibíciu reakcií katalyzovaných enzýmami.
Inhibícia enzymatickej aktivity môže byť ireverzibilná alebo reverzibilná, kompetitívna alebo nekompetitívna.
Ireverzibilná inhibícia - ide o pretrvávajúcu inaktiváciu enzýmu, ktorá je výsledkom kovalentnej väzby molekuly inhibítora v aktívnom mieste alebo v inom špeciálnom centre, ktoré mení konformáciu enzýmu. Disociácia takýchto stabilných komplexov s regeneráciou voľného enzýmu je prakticky vylúčená. Aby telo prekonalo následky takejto inhibície, musí syntetizovať nové molekuly enzýmov.
Reverzibilná inhibícia – charakterizované rovnovážnou komplexáciou inhibítora s enzýmom v dôsledku nekovalentných väzieb, v dôsledku čoho sú takéto komplexy schopné disociácie s obnovením aktivity enzýmu.
Klasifikácia inhibítorov na konkurenčné a nekonkurenčné je založená na tom, či je oslabený ( kompetitívna inhibícia ) alebo nie je oslabená ( nekonkurenčná inhibícia ) ich inhibičný účinok pri zvýšení koncentrácie substrátu.
Konkurenčné inhibítory - sú to spravidla zlúčeniny, ktorých štruktúra je podobná štruktúre substrátu. To im umožňuje viazať sa na rovnaké aktívne miesto ako substráty, čím sa bráni interakcii enzýmu so substrátom už v štádiu väzby. Po naviazaní sa môže inhibítor premeniť na produkt alebo zostať v aktívnom mieste, kým nedôjde k disociácii.
Reverzibilná kompetitívna inhibícia možno znázorniť ako diagram:
E↔ E-I → E + P 1
S (neaktívne)
Stupeň inhibície enzýmu je určený pomerom koncentrácií substrátu a enzýmu.
Klasickým príkladom tohto typu inhibície je inhibícia aktivity sukcinátdehydrogenázy (SDH) malátom, ktorý vytesňuje sukcinát z miesta substrátu a zabraňuje jeho premene na fumarát:

Kovalentná väzba inhibítora na aktívne miesto vedie k inaktivácii enzýmu (ireverzibilná inhibícia). Príklad ireverzibilná kompetitívna inhibícia môže slúžiť ako inaktivácia triózafosfátizomerázy 3-chlóracetolfosfátom. Tento inhibítor je štrukturálnym analógom substrátu, dihydroxyacetónfosfátu, a ireverzibilne sa viaže na zvyšok kyseliny glutámovej v aktívnom mieste:
Niektoré inhibítory pôsobia menej selektívne, interagujú so špecifickou funkčnou skupinou v aktívnom mieste rôznych enzýmov. Väzba jódacetátu alebo jeho amidu na SH skupinu aminokyseliny cysteínu, ktorá sa nachádza v aktívnom centre enzýmu a podieľa sa na katalýze, teda vedie k úplnej strate aktivity enzýmu:
R-SH + JCH2COOH → HJ + R-S-CH2COOH
Preto tieto inhibítory inaktivujú všetky enzýmy, ktoré majú SH skupiny zapojené do katalýzy.
Ireverzibilná inhibícia hydroláz pôsobením nervových plynov (sarín, soman) je spôsobená ich kovalentnou väzbou na serínový zvyšok v aktívnom centre.
Metóda kompetitívnej inhibície našla široké uplatnenie v lekárskej praxi. Sulfónamidové liečivá, antagonisty kyseliny p-aminobenzoovej, môžu slúžiť ako príklad metabolizovaných kompetitívnych inhibítorov. Viažu sa na dihydropterátsyntetázu, bakteriálny enzým, ktorý premieňa p-aminobenzoát na kyselinu listovú potrebnú pre rast baktérií. Baktéria odumiera v dôsledku toho, že sa naviazaný sulfanilamid premení na inú zlúčeninu a nevzniká kyselina listová.
Nekompetitívne inhibítory sa zvyčajne viažu na molekulu enzýmu v mieste odlišnom od väzbového miesta substrátu a substrát priamo nesúťaží s inhibítorom. Pretože sa inhibítor a substrát viažu na rôzne centrá, je možná tvorba komplexu E-I aj komplexu S-E-I. Komplex S-E-I sa tiež rozkladá za vzniku produktu, ale pomalšie ako E-S, takže reakcia sa spomalí, ale nezastaví sa. Môžu sa teda vyskytnúť nasledujúce paralelné reakcie:
E↔ E-I ↔ S-E-I → E-I + P
Reverzibilná nekompetitívna inhibícia je relatívne zriedkavá.
Nekompetitívne inhibítory sa nazývajú alosterický na rozdiel od konkurenčných ( izosterický ).
Reverzibilnú inhibíciu možno kvantitatívne študovať pomocou Michaelis-Mentenovej rovnice.
Pri kompetitívnej inhibícii zostáva V MAX konštantná a km sa zvyšuje.
|
|
|
Pri nekompetitívnej inhibícii sa V MAX znižuje, zatiaľ čo km zostáva nezmenené.
|
|
|
Ak reakčný produkt inhibuje enzým, ktorý katalyzuje jeho tvorbu, tento spôsob inhibície sa nazýva retroinhibícia alebo inhibícia spätnej väzby . Napríklad glukóza inhibuje glukózo-6-fosfatázu, ktorá katalyzuje hydrolýzu glukóza-6-fosfátu.
Biologický význam tejto inhibície spočíva v regulácii určitých metabolických dráh (pozri ďalšiu lekciu).
PRAKTICKÁ ČASŤ
Zadanie pre študentov
1. Študujte denaturáciu bielkovín pod vplyvom roztokov minerálnych a organických kyselín a pri zahrievaní.
2. Zistite koenzým NAD v kvasinkách.
3. Stanovte aktivitu amylázy v moči (krvnom sére).
9. ŠTANDARDY ODPOVEDÍ NA PROBLÉMY, testové otázky slúžiace na kontrolu vedomostí na hodine (možno použiť ako prílohu)
10. CHARAKTER A ROZSAH MOŽNÝCH VZDELÁVACÍCH A VÝSKUMNÝCH PRÁC K TÉME
(Uveďte konkrétne povahu a formu UIRS: príprava abstraktných prezentácií, vykonávanie nezávislého výskumu, simulačné hry, vypĺňanie anamnézy pomocou monografickej literatúry a iných foriem)
Enzýmová kinetika študuje rýchlosť reakcií katalyzovaných enzýmami v závislosti od rôznych podmienok (koncentrácia, teplota, pH atď.) ich interakcie so substrátom.
Enzýmy sú však bielkoviny, ktoré sú citlivé na vplyv rôznych vonkajších vplyvov. Preto pri štúdiu rýchlosti enzymatických reakcií berú do úvahy najmä koncentrácie reagujúcich látok a snažia sa minimalizovať vplyv teploty, pH prostredia, aktivátorov, inhibítorov a iných faktorov a vytvárať štandardné podmienky. Po prvé, je to hodnota pH prostredia, ktorá je optimálna pre daný enzým. Po druhé, tam, kde je to možné, sa odporúča udržiavať teplotu 25 °C. Po tretie, dosiahne sa úplné nasýtenie enzýmu substrátom. Tento bod je obzvlášť dôležitý, pretože pri nízkych koncentráciách substrátu sa na reakcii nezúčastňujú všetky molekuly enzýmu (obr. 6.5, A), čo znamená, že výsledok bude ďaleko od maximálneho možného. Najväčšia sila katalyzovanej reakcie, pričom ostatné veci sú rovnaké, sa dosiahne, ak sa každá molekula enzýmu zúčastní transformácie, t.j. pri vysokej koncentrácii komplexu enzým-substrát (obr. 6.5, V). Ak koncentrácia substrátu nezabezpečí úplné nasýtenie enzýmu (obr. 6.5, b), potom rýchlosť reakcie nedosiahne svoju maximálnu hodnotu.
Ryža. 65.
A - pri nízkej koncentrácii substrátu; 6 - s nedostatočnou koncentráciou substrátu; V - keď je enzým úplne nasýtený substrátom
Rýchlosť enzymatickej reakcie meraná za vyššie uvedených podmienok a úplné nasýtenie enzýmu substrátom sa nazýva maximálna rýchlosť enzymatickej reakcie (V).
Označuje sa rýchlosť enzymatickej reakcie, stanovená, keď enzým nie je úplne nasýtený substrátom v.
Enzýmovú katalýzu je možné zjednodušiť pomocou nasledujúceho diagramu:

kde F je enzým; S - substrát; FS - komplex enzým-substrát.
Každá fáza tohto procesu sa vyznačuje určitou rýchlosťou. Jednotkou merania rýchlosti enzymatickej reakcie je počet mólov substrátu prevedených za jednotku času(rovnaká ako rýchlosť normálnej reakcie).
Interakcia enzýmu so substrátom vedie k vytvoreniu komplexu enzým-substrát, ale tento proces je reverzibilný. Rýchlosti priamych a spätných reakcií závisia od koncentrácií reaktantov a sú opísané zodpovedajúcimi rovnicami:
V rovnovážnom stave platí rovnica (6.3), pretože rýchlosti priamych a spätných reakcií sú rovnaké.
Dosadením hodnôt rýchlosti doprednej (6.1) a spätnej (6.2) reakcie do rovnice (6.3) dostaneme rovnosť:
Rovnovážny stav je charakterizovaný primeraným rovnovážna konštanta Kp, rovná pomeru konštánt priamej a spätnej reakcie (6.5). Prevrátená hodnota rovnovážnej konštanty sa nazýva substrátová konštanta Ks, alebo disociačná konštanta komplexu enzým-substrát:

Z rovnice (6.6) je zrejmé, že substrátová konštanta pri vysokých koncentráciách komplexu enzým-substrát klesá, t.j. s veľkou stabilitou. Substrátová konštanta teda charakterizuje afinitu enzýmu a substrátu a pomer rýchlostných konštánt pre tvorbu a disociáciu komplexu enzým-substrát.
Fenomén nasýtenia enzýmov substrátom študovali Leonor Michaelis a Maud Mepten. Na základe matematického spracovania výsledkov odvodili rovnicu (6.7), ktorá dostala svoje názvy, z ktorej je zrejmé, že pri vysokej koncentrácii substrátu a nízkej hodnote substrátovej konštanty má rýchlosť enzymatickej reakcie tendenciu k max. . Táto rovnica je však obmedzená, pretože neberie do úvahy všetky parametre:
Komplex enzým-substrát môže počas reakcie prejsť transformáciou v rôznych smeroch:
- disociovať na materské látky;
- transformovať na produkt, z ktorého sa enzým oddelí nezmenený.
Preto, aby sme opísali celkové pôsobenie enzymatického procesu, koncept Michaelisove konštanty Kt, ktorý vyjadruje vzťah medzi rýchlostnými konštantami všetkých troch reakcií enzymatickej katalýzy (6.8). Ak sú oba členy delené konštantou reakčnej rýchlosti pre tvorbu komplexu enzým-substrát, dostaneme výraz (6.9):

Z rovnice (6.9) vyplýva dôležitý dôsledok: Michaelisova konštanta je vždy väčšia ako substrátová konštanta o množstvo k 2 /k v
Číselne K t rovná koncentrácii substrátu, pri ktorej je reakčná rýchlosť polovičná oproti maximálnej možnej rýchlosti a zodpovedá nasýteniu enzýmu substrátom, ako na obr. 6,5, b. Pretože v praxi nie je vždy možné dosiahnuť úplné nasýtenie enzýmu substrátom, je to presne tak K t používa sa na porovnávaciu charakterizáciu kinetických charakteristík enzýmov.
Rýchlosť enzymatickej reakcie, keď enzým nie je úplne nasýtený substrátom (6.10), závisí od koncentrácie komplexu enzým-substrát. Koeficient proporcionality je reakčná konštanta pre uvoľňovanie enzýmu a produktu, pretože to mení koncentráciu komplexu enzým-substrát:
Po transformáciách, berúc do úvahy vyššie uvedené závislosti, je rýchlosť enzymatickej reakcie, keď enzým nie je úplne nasýtený substrátom, opísaná rovnicou (6.11), t.j. závisí od koncentrácií enzýmu, substrátu a ich afinity K s:
Grafická závislosť rýchlosti enzymatickej reakcie od koncentrácie substrátu nie je lineárna. Ako je zrejmé z obr. 6.6, so zvyšujúcou sa koncentráciou substrátu sa pozoruje zvýšenie aktivity enzýmu. Keď sa však dosiahne maximálna saturácia enzýmu substrátom, rýchlosť enzymatickej reakcie sa stane maximálnou. Faktorom limitujúcim rýchlosť reakcie je preto tvorba komplexu enzým-substrát.
Prax ukázala, že koncentrácie substrátu sú spravidla vyjadrené v hodnotách oveľa menších ako jednota (106 -103 mol). Vo výpočtoch je dosť ťažké operovať s takýmito veličinami. Preto G. Lineweaver a D. Burke navrhli vyjadriť grafickú závislosť rýchlosti enzymatickej reakcie nie v priamych súradniciach, ale v inverzných. Vychádzali z predpokladu, že pre rovnaké množstvá sú rovnaké aj ich inverzné hodnoty:

Ryža. 6.6.
Po transformácii výrazu (6.13) získame výraz tzv Lineweaver-Burk rovnica (6.14):
Grafická závislosť Lineweaver-Burkovej rovnice je lineárna (obr. 6.7). Kinetické charakteristiky enzýmu sa určujú takto:
- segment odrezaný na zvislej osi sa rovná 1/V;
- segment odrezaný na osi x sa rovná -1 /Do t.

Ryža. 6.7.
Predpokladá sa, že metóda Lineweaver-Burk umožňuje určiť maximálnu rýchlosť reakcie presnejšie ako v priamych súradniciach. Z tohto grafu možno tiež získať cenné informácie týkajúce sa inhibície enzýmov.
Existujú aj iné spôsoby transformácie rovnice Michaelis-Menten. Grafické závislosti sa využívajú na štúdium vplyvu rôznych vonkajších vplyvov na enzymatický proces.
Toto odvetvie enzymológie študuje vplyv rôznych faktorov na rýchlosť enzymatickej reakcie. Berúc do úvahy všeobecnú rovnicu pre enzymatickú katalýzu reverzibilnej reakcie premeny jedného substrátu na jeden produkt (1),
Hlavné faktory ovplyvňujúce rýchlosť enzymatickej reakcie by mali byť menované: koncentrácia substrátu [S], koncentrácia enzýmu [E] a koncentrácia reakčného produktu [P].
Interakciu niektorých enzýmov s ich substrátom možno opísať hyperbolickou krivkou závislosti rýchlosti enzymatickej reakcie V od koncentrácie substrátu [S] (obr. 19): Obr.

Obr. 19. Závislosť rýchlosti enzymatickej reakcie od koncentrácie substrátu.
Na tejto krivke možno rozlíšiť tri úseky, ktoré možno vysvetliť ustanoveniami mechanizmu interakcie enzýmu so substrátom: OA - úsek priamo úmernej závislosti V na [S], aktívnych centrách enzýmu. sa postupne plnia molekulami substrátu za vzniku nestabilného komplexu ES; úsek AB - krivočiara závislosť V na [S], ešte nebolo dosiahnuté úplné nasýtenie aktívnych centier enzýmu molekulami substrátu. Komplex ES je pred dosiahnutím prechodného stavu nestabilný, pravdepodobnosť spätnej disociácie na E a S je stále vysoká; úsek BC - závislosť je opísaná rovnicou nultého rádu, rez je rovnobežný s osou [S], dosiahlo sa úplné nasýtenie aktívnych enzýmov molekulami substrátu, V=V max.
Charakteristický tvar krivky je matematicky opísaný Briggsovou-Haldaneovou rovnicou:
V=V max ● [S]/Km + [S] (2),
kde Km je Michaelis-Mentenova konštanta, číselne rovná koncentrácii substrátu, pri ktorej sa rýchlosť enzymatickej reakcie rovná polovici V max.
Čím nižšia je Km enzýmu, tým vyššia je afinita enzýmu k substrátu, tým rýchlejšie sa dosiahne prechodný stav pre substrát a ten sa zmení na reakčný produkt. Nájdenie hodnôt Km pre každý enzýmový substrát špecifický pre skupinu je dôležité pri určovaní biologickej úlohy tohto enzýmu v bunke.
Pre väčšinu enzýmov je nemožné zostrojiť hyperbolickú krivku (obr. 19), v tomto prípade sa používa metóda dvojitých recipročných hodnôt (Lineweaver-Burk), t.j. vykreslí sa grafická závislosť 1/[V] od 1/[S] (obr. 20). Spôsob konštrukcie takýchto kriviek v experimente je veľmi vhodný pri štúdiu účinku rôznych typov inhibítorov na aktivitu enzýmov (pozri ďalej v texte).

Obr.20. Graf 1/[V] oproti 1/[S] (Lineweaver-Burk metóda),
kde y je medzný úsek - a x je medzný úsek -  , dotyčnica uhla α - .
, dotyčnica uhla α - .
Závislosť rýchlosti enzymatickej reakcie V od koncentrácie enzýmu [E].
Táto grafická závislosť (obr. 21) sa uvažuje pri optimálnej teplote a pH prostredia, pri koncentráciách substrátu výrazne vyšších ako je saturačná koncentrácia aktívnych centier enzýmu.

Ryža. 21. Vplyv koncentrácie enzýmu na rýchlosť enzymatickej reakcie.
Závislosť rýchlosti enzymatickej reakcie od koncentrácie kofaktora alebo koenzýmu. Pri komplexných enzýmoch je potrebné vziať do úvahy, že nedostatok koenzýmových foriem vitamínov v prípade hypovitaminózy a narušenie príjmu kovových iónov do tela nevyhnutne vedie k zníženiu koncentrácie zodpovedajúcich enzýmov potrebných na priebeh. metabolických procesov. Preto treba konštatovať, že aktivita enzýmu je priamo závislá od koncentrácie kofaktora alebo koenzýmu.
Vplyv koncentrácie produktu na rýchlosť enzymatickej reakcie. Pri reverzibilných reakciách vyskytujúcich sa v ľudskom tele je potrebné vziať do úvahy, že produkty priamej reakcie môžu byť enzýmom použité ako substráty pre reverznú reakciu. Preto smer prúdenia a okamih dosiahnutia Vmax závisia od pomeru koncentrácií počiatočných substrátov a reakčných produktov. Napríklad aktivita alanínaminotransferázy, ktorá katalyzuje transformáciu:
Alanín + Alfa-ketoglutarát ↔ Pyruvát + Glutamát
závisí v bunke od pomeru koncentrácií:
[alanín + alfa-ketoglutarát] / [pyruvát + glutamát].
MECHANIZMUS PÔSOBENIA ENZÝMU. TEÓRIE KATALYZY ENZÝMOV
Enzýmy, podobne ako neproteínové katalyzátory, zvyšujú rýchlosť chemickej reakcie vďaka svojej schopnosti znižovať aktivačnú energiu tejto reakcie. Aktivačná energia enzymatickej reakcie sa vypočíta ako rozdiel medzi hodnotou energie v systéme prebiehajúcej reakcie, ktorá dosiahla prechodový stav, a energiou určenou na začiatku reakcie (pozri grafickú závislosť na obr. 22).

Ryža. 22. Grafická závislosť energetického stavu chemickej reakcie bez enzýmu (1) a za prítomnosti enzýmu (2) od reakčného času.
Práca V. Henryho a najmä L. Michaelisa, M. Mentena o štúdiu mechanizmu monosubstrátových reverzibilných enzymatických reakcií umožnila predpokladať, že enzým E sa najskôr reverzibilne a pomerne rýchlo spája so svojim substrátom S za vzniku enzýmu- substrátový komplex (ES):
E+S<=>ES (1)
K tvorbe ES dochádza v dôsledku vodíkových väzieb, elektrostatických, hydrofóbnych interakcií, v niektorých prípadoch kovalentných, koordinačných väzieb medzi bočnými radikálmi aminokyselinových zvyškov aktívneho centra a funkčnými skupinami substrátu. V komplexných enzýmoch môže funkciu kontaktu so substrátom vykonávať aj neproteínová časť štruktúry.
Komplex enzým-substrát sa potom rozpadne v druhej, pomalšej, reverzibilnej reakcii za vzniku reakčného produktu P a voľného enzýmu E:
ES<=>EP<=>E+P (2)
V súčasnosti, vďaka práci vyššie uvedených vedcov, ako aj Keilin D., Chance B., Koshland D. (teória „indukovanej korešpondencie“), existujú teoretické ustanovenia o štyroch hlavných bodoch mechanizmu účinku enzýmu na substráte, ktoré určujú schopnosť enzýmov urýchliť chemické reakcie:
1. Orientácia a prístup . Enzým je schopný viazať molekulu substrátu takým spôsobom, že väzba napadnutá enzýmom je nielen umiestnená v tesnej blízkosti katalytickej skupiny, ale je aj voči nej správne orientovaná. Pravdepodobnosť, že komplex ES dosiahne prechodný stav prostredníctvom orientácie a blízkosti, sa výrazne zvyšuje.
2. Stres a záťaž : vyvolaná korešpondencia. Pripojenie substrátu môže spôsobiť konformačné zmeny v molekule enzýmu, ktoré vedú k napätiu v štruktúre aktívneho centra, a tiež trochu deformovať viazaný substrát, čím sa uľahčí dosiahnutie prechodného stavu komplexom ES. Medzi molekulami E a S vzniká takzvaná indukovaná korešpondencia.
Rýchlosť enzymatických reakcií závisí od koncentrácie enzýmu, substrátu, teploty, pH a prítomnosti aktivátorov a inhibítorov.
V podmienkach prebytku substrátu rýchlosť reakcie priamo úmerné koncentrácia enzýmu (obr. 3.2).
Ryža. 3.2. Závislosť rýchlosti reakcie od koncentrácie enzýmu.
Závislosť rýchlosti reakcie na koncentrácia substrátu znázornené na obrázku 3.3.
Ryža. 3.3. Závislosť rýchlosti reakcie od koncentrácie substrátu.
Na grafe sú 3 sekcie. Pri nízkej koncentrácii substrátu (oddiel A) reakčná rýchlosť je priamo úmerná koncentrácii substrátu a riadi sa kinetikou prvého poriadku. Poloha zapnutá b(reakcia zmiešaného poriadku) je táto závislosť porušená. Poloha zapnutá c reakčná rýchlosť je maximálna a nezávisí od koncentrácie substrátu.
Enzymatická reakcia je charakterizovaná tvorbou komplexu enzým-substrát, ktorý sa rozkladá za vzniku voľného enzýmu a reakčného produktu.
V tejto rovnici je k 1 rýchlostná konštanta pre tvorbu komplexu enzým-substrát, k 2 je disociačná konštanta komplexu enzým-substrát za vzniku voľného enzýmu a substrátu a k 3 je rýchlostná konštanta pre disociáciu. komplexu enzým-substrát na voľný enzým a reakčný produkt.
Michaelis a Menten navrhli rovnicu, ktorá popisuje závislosť rýchlosti reakcie od koncentrácie substrátu.
v je reakčná rýchlosť pri danej koncentrácii substrátu; Ks – disociačná konštanta komplexu enzým-substrát; Vmax – maximálna rýchlosť reakcie.
Ks=k-2/k1 t.j. pomer reverznej reakčnej konštanty k priamej reakčnej konštante.
Táto rovnica však opisuje iba úsek A na grafe a nezohľadňuje vplyv reakčných produktov na rýchlosť enzymatického procesu.
Haldane a Briggs nahradili disociačnú konštantu v rovnici Michaelisovou konštantou (Km).
Michaelis konštantačíselne rovná koncentrácii substrátu, pri ktorej je rýchlosť reakcie polovičná. Michaelisova konštanta charakterizuje afinitu enzýmu a substrátu. Vysoká afinita enzýmu k substrátu je charakterizovaná nízkou hodnotou Km a naopak.
Použitie grafu, ktorý navrhli Michaelis a Menten, je nepohodlné. Pre pohodlnejšie grafické znázornenie G. Lineweaver a D. Burke transformovali Haldanovu a Briggsovu rovnicu metódou dvojitých reciprokálií na základe princípu, že ak je rovnosť medzi dvoma veličinami, potom sa budú rovnať aj recipročné hodnoty.
Grafické znázornenie závislosti rýchlosti reakcie na pH má zvonovitý tvar. Hodnota pH, pri ktorej enzým vykazuje maximálnu aktivitu, sa nazýva optimálne pH(Obr. 5.4 A) . Pre väčšinu enzýmov je optimálne pH 6-8. Výnimkou je pepsín, ktorého optimum je 2,0. Keď sa pH zmení jedným alebo druhým smerom od optima, rýchlosť reakcie sa zníži v dôsledku ionizácie funkčných skupín enzýmu a substrátu, čo naruší tvorbu komplexu enzým-substrát.
Ryža. 3.4. Závislosť rýchlosti reakcie od pH (A) a teploty (B).
Rýchlosť chemickej reakcie sa zvyšuje dvakrát teplota o 10 °C. V dôsledku proteínovej povahy enzýmu však s ďalším zvýšením teploty dochádza k denaturácii enzýmu. Teplota, pri ktorej je rýchlosť reakcie maximálna, sa nazýva teplotné optimum(Obr. 3.4. B) . Pre väčšinu enzýmov je optimálna teplota 37-40°C. Výnimkou je svalová myokináza, ktorá znesie zahriatie až na 100°C.
Enzýmové aktivátory– ide o látky 1) tvoriace aktívne centrum enzýmu (Co 2+, Mg 2+, Zn 2+, Fe 2+, Ca 2+); 2) uľahčenie tvorby komplexu enzým-substrát (Mg2+); 3) redukcia SH skupín (glutatión, cysteín, merkaptoetanol); 4) stabilizácia prirodzenej štruktúry proteín-enzýmu. Enzymatické reakcie sú zvyčajne aktivované katiónmi (v periodickej tabuľke od 19 do 30). Anióny sú menej aktívne, hoci ióny chlóru a anióny niektorých iných halogénov môžu aktivovať pepsín, amylázu a adenylátcyklázu. Proteíny môžu byť aktivátory: apoproteín A-I (LCAT), apoproteín C-II (LPL).
Mechanizmus účinku aktivátorov:
1) podieľať sa na tvorbe aktívneho centra enzýmov;
2) uľahčiť väzbu substrátu a enzýmu;
3) podieľať sa na tvorbe prirodzenej štruktúry enzýmu.
Inhibítory– látky, ktoré spôsobujú čiastočnú alebo úplnú inhibíciu reakcií katalyzovaných enzýmami.
Inhibítory sú rozdelené do nešpecifické A konkrétne. Účinok nešpecifických inhibítorov nesúvisí s mechanizmom účinku enzýmov. Tieto inhibítory spôsobujú denaturáciu enzýmového proteínu (teplo, kyseliny, zásady, soli ťažkých kovov atď.).
Špecifické inhibítory ovplyvňujú mechanizmus účinku enzýmov. Špecifické inhibítory sú rozdelené do 2 skupín: reverzibilné a nezvratné. Ireverzibilné inhibítory spôsobujú trvalú, ireverzibilnú zmenu alebo modifikáciu funkčných skupín enzýmu prostredníctvom pevnej alebo kovalentnej väzby. Táto skupina zahŕňa: 1) inhibítory kovov enzýmy (HCN, RCN, HF, CO atď.). Tieto zlúčeniny sa viažu na kovy s premenlivou mocnosťou (Cu alebo Fe), v dôsledku čoho je narušený proces prenosu elektrónov pozdĺž dýchacieho reťazca enzýmov. Preto sa tieto inhibítory nazývajú respiračné jedy. 2) inhibítory enzýmov obsahujúcich SH skupiny(monoidoacetát, dijódacetát, jódacetamid, zlúčeniny arzénu a ortuti). 3) inhibítory enzýmov obsahujúcich OH skupinu v aktívnom centre (organofosforové zlúčeniny, insekticídy). Tieto inhibítory inhibujú predovšetkým aktivitu cholínesterázy, enzýmu, ktorý hrá primárnu úlohu v aktivite nervového systému.
Reverzibilné inhibíciu možno kvantifikovať pomocou Michaelis-Mentenovej rovnice. Reverzibilné inhibítory sa delia na konkurenčné a nesúťažné.
Konkurenčné inhibítory- Ide o látky podobné štruktúre ako substrát. Inhibítor sa viaže na aktívne miesto enzýmu a zabraňuje tvorbe komplexu enzým-substrát.
Klasickým príkladom kompetitívnej inhibície je inhibícia sukcinátdehydrogenázy kyselinou malónovou. Sukcinátdehydrogenáza katalyzuje oxidáciu kyseliny jantárovej (sukcinátu) dehydrogenáciou na kyselinu fumarovú.
Ak sa do média pridá kyselina malónová (inhibítor), potom v dôsledku svojej štruktúrnej podobnosti so skutočným substrátom sukcinátom bude reagovať s aktívnym miestom za vzniku komplexu enzým-inhibítor, ale reakcia neprebehne.
Účinok inhibítora je eliminovaný o zvýšenie koncentrácie substrátu. Pri kompetitívnej inhibícii sa kinetika enzymatických reakcií mení: Km sa zvyšuje, V max zostáva konštantná(obr. 3.5).
Ryža. 3.5. Vplyv kompetitívnych inhibítorov na rýchlosť enzymatickej reakcie
Metóda kompetitívnej inhibície našla uplatnenie v lekárskej praxi ako antimetabolity.
Napríklad sulfónamidové lieky sa používajú na liečbu niektorých infekčných ochorení spôsobených baktériami. Tieto lieky sú štrukturálne podobné kyseline para-aminobenzoovej, ktorú bakteriálna bunka využíva na syntézu kyseliny listovej, ktorá je nevyhnutná pre život baktérií. Vďaka tejto štruktúrnej podobnosti sulfónamid blokuje pôsobenie enzýmu vytesnením kyseliny para-aminobenzoovej z komplexu s enzýmom, ktorý syntetizuje kyselinu listovú.
Nekompetitívne inhibítory - látky, ktoré nie sú štruktúrne podobné substrátom. Nekompetitívne inhibítory sa neviažu na aktívne miesto, ale na iné miesto v molekule enzýmu, napríklad v alosterickom centre. Tým sa zmení konformácia aktívneho centra takým spôsobom, že sa naruší interakcia substrátu s ním.
Pre nekompetitívnu inhibíciu: V max klesá, ale K m sa nemení(obr. 3.6).