Степень окисления. Как определить степень окисления атома химического элемента Что значит степень окисления 1
ОПРЕДЕЛЕНИЕ
Степень окисления - это количественная оценка состояния атома химического элемента в соединении, основанная на его электроотрицательности.
Она принимает как положительные, так и отрицательные значения. Чтобы указать степень окисления элемента в соединении нужно поставить сверху над его символом арабскую цифру с соответствующим знаком («+» или «-»).
Следует помнить, что степень окисления — величина, не имеющая физического смысла, так как не отражает реальный заряд атома. Однако это понятие весьма широко используется в химии.
Таблица степени окисления химических элементов
Максимальную положительную и минимальную отрицательную степень окисления можно определить с помощью Периодической таблицы Д.И. Менделеева. Они равны номеру группы, в которой расположен элемент, и разнице между значением «высшей» степени окисления и числом 8, соответственно.
Если рассматривать химические соединения более конкретно, то в веществах с неполярными связями степень окисления элементов равна нулю (N 2 , H 2 , Cl 2).
Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного атома к другому: Na +1 I -1 , Mg +2 Cl -1 2 , Al +3 F -1 3 , Zr +4 Br -1 4 .
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Существуют элементы, для которых характерно только одно значение степени окисления (фтор, металлы IA и IIA групп и т.д.). Фтор, характеризующийся наибольшим значением электроотрицательности, в соединениях всегда имеет постоянную отрицательную степень окисления (-1).
Щелочные и щелочноземельные элементы, для которых свойственно относительно невысокое значение электроотрицательности, всегда имеют положительную степень окисления, равную соответственно (+1) и (+2).
Однако, имеются и такие химические элементы, для которых характерны несколько значений степени окисления (сера - (-2), 0, (+2), (+4), (+6) и др.).
Для того, чтобы легче было запомнить сколько и какие степени окисления характерны для конкретного химического элемента используют таблицы степеней окисления химических элементов, которые выглядят следующим образом:
|
Порядковый номер |
Русское / англ. название |
Химический символ |
Степень окисления |
|
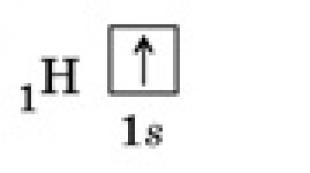
Водород / Hydrogen |
|||
|
Гелий / Helium |
|||
|
Литий / Lithium |
|||
|
Бериллий / Beryllium |
|||
|
(-1), 0, (+1), (+2), (+3) |
|||
|
Углерод / Carbon |
(-4), (-3), (-2), (-1), 0, (+2), (+4) |
||
|
Азот / Nitrogen |
(-3), (-2), (-1), 0, (+1), (+2), (+3), (+4), (+5) |
||
|
Кислород / Oxygen |
(-2), (-1), 0, (+1), (+2) |
||
|
Фтор / Fluorine |
|||
|
Натрий / Sodium |
|||
|
Магний / Magnesium |
|||
|
Алюминий / Aluminum |
|||
|
Кремний / Silicon |
(-4), 0, (+2), (+4) |
||
|
Фосфор / Phosphorus |
(-3), 0, (+3), (+5) |
||
|
Сера / Sulfur |
(-2), 0, (+4), (+6) |
||
|
Хлор / Chlorine |
(-1), 0, (+1), (+3), (+5), (+7), редко (+2) и (+4) |
||
|
Аргон / Argon |
|||
|
Калий / Potassium |
|||
|
Кальций / Calcium |
|||
|
Скандий / Scandium |
|||
|
Титан / Titanium |
(+2), (+3), (+4) |
||
|
Ванадий / Vanadium |
(+2), (+3), (+4), (+5) |
||
|
Хром / Chromium |
(+2), (+3), (+6) |
||
|
Марганец / Manganese |
(+2), (+3), (+4), (+6), (+7) |
||
|
Железо / Iron |
(+2), (+3), редко (+4) и (+6) |
||
|
Кобальт / Cobalt |
(+2), (+3), редко (+4) |
||
|
Никель / Nickel |
(+2), редко (+1), (+3) и (+4) |
||
|
Медь / Copper |
+1, +2, редко (+3) |
||
|
Галлий / Gallium |
(+3), редко (+2) |
||
|
Германий / Germanium |
(-4), (+2), (+4) |
||
|
Мышьяк / Arsenic |
(-3), (+3), (+5), редко (+2) |
||
|
Селен / Selenium |
(-2), (+4), (+6), редко (+2) |
||
|
Бром / Bromine |
(-1), (+1), (+5), редко (+3), (+4) |
||
|
Криптон / Krypton |
|||
|
Рубидий / Rubidium |
|||
|
Стронций / Strontium |
|||
|
Иттрий / Yttrium |
|||
|
Цирконий / Zirconium |
(+4), редко (+2) и (+3) |
||
|
Ниобий / Niobium |
(+3), (+5), редко (+2) и (+4) |
||
|
Молибден / Molybdenum |
(+3), (+6), редко (+2), (+3) и (+5) |
||
|
Технеций / Technetium |
|||
|
Рутений / Ruthenium |
(+3), (+4), (+8), редко (+2), (+6) и (+7) |
||
|
Родий / Rhodium |
(+4), редко (+2), (+3) и (+6) |
||
|
Палладий / Palladium |
(+2), (+4), редко (+6) |
||
|
Серебро / Silver |
(+1), редко (+2) и (+3) |
||
|
Кадмий / Cadmium |
(+2), редко (+1) |
||
|
Индий / Indium |
(+3), редко (+1) и (+2) |
||
|
Олово / Tin |
(+2), (+4) |
||
|
Сурьма / Antimony |
(-3), (+3), (+5), редко (+4) |
||
|
Теллур / Tellurium |
(-2), (+4), (+6), редко (+2) |
||
|
(-1), (+1), (+5), (+7), редко (+3), (+4) |
|||
|
Ксенон / Xenon |
|||
|
Цезий / Cesium |
|||
|
Барий / Barium |
|||
|
Лантан / Lanthanum |
|||
|
Церий / Cerium |
(+3), (+4) |
||
|
Празеодим / Praseodymium |
|||
|
Неодим / Neodymium |
(+3), (+4) |
||
|
Прометий / Promethium |
|||
|
Самарий / Samarium |
(+3), редко (+2) |
||
|
Европий / Europium |
(+3), редко (+2) |
||
|
Гадолиний / Gadolinium |
|||
|
Тербий / Terbium |
(+3), (+4) |
||
|
Диспрозий / Dysprosium |
|||
|
Гольмий / Holmium |
|||
|
Эрбий / Erbium |
|||
|
Тулий / Thulium |
(+3), редко (+2) |
||
|
Иттербий / Ytterbium |
(+3), редко (+2) |
||
|
Лютеций / Lutetium |
|||
|
Гафний / Hafnium |
|||
|
Тантал / Tantalum |
(+5), редко (+3), (+4) |
||
|
Вольфрам / Tungsten |
(+6), редко (+2), (+3), (+4) и (+5) |
||
|
Рений / Rhenium |
(+2), (+4), (+6), (+7), редко (-1), (+1), (+3), (+5) |
||
|
Осмий / Osmium |
(+3), (+4), (+6), (+8), редко (+2) |
||
|
Иридий / Iridium |
(+3), (+4), (+6), редко (+1) и (+2) |
||
|
Платина / Platinum |
(+2), (+4), (+6), редко (+1) и (+3) |
||
|
Золото / Gold |
(+1), (+3), редко (+2) |
||
|
Ртуть / Mercury |
(+1), (+2) |
||
|
Талий / Thallium |
(+1), (+3), редко (+2) |
||
|
Свинец / Lead |
(+2), (+4) |
||
|
Висмут / Bismuth |
(+3), редко (+3), (+2), (+4) и (+5) |
||
|
Полоний / Polonium |
(+2), (+4), редко (-2) и (+6) |
||
|
Астат / Astatine |
|||
|
Радон / Radon |
|||
|
Франций / Francium |
|||
|
Радий / Radium |
|||
|
Актиний / Actinium |
|||
|
Торий / Thorium |
|||
|
Проактиний / Protactinium |
|||
|
Уран / Uranium |
(+3), (+4), (+6), редко (+2) и (+5) |
Примеры решения задач
ПРИМЕР 1
- Степень окисления фосфора в фосфине равна (-3), а в ортофосфорной кислоте - (+5). Изменение степени окисления фосфора: +3 → +5, т.е. первый вариант ответа.
- Степень окисления химического элемента в простом веществе равна нулю. Степень окисления фосфора в оксиде состава P 2 O 5 равна (+5). Изменение степени окисления фосфора: 0 → +5, т.е. третий вариант ответа.
- Степень окисления фосфора в кислоте состава HPO 3 равна (+5), а H 3 PO 2 — (+1). Изменение степени окисления фосфора: +5 → +1, т.е. пятый вариант ответа.
ПРИМЕР 2
| Задание | Степень окисления (-3) углерод имеет в соединении: а) CH 3 Cl; б) C 2 H 2 ; в) HCOH; г) C 2 H 6 . |
| Решение | Для того, чтобы дать верный ответ на поставленный вопрос будем поочередно определять степень окисления углерода в каждом из предложенных соединений.
а) степень окисления водорода равна (+1), а хлора - (-1). Примем за «х» степень окисления углерода: x + 3×1 + (-1) =0; Ответ неверный. б) степень окисления водорода равна (+1). Примем за «у» степень окисления углерода: 2×у + 2×1 = 0; Ответ неверный. в) степень окисления водорода равна (+1), а кислорода - (-2). Примем за «z» степень окисления углерода: 1 + z + (-2) +1 = 0: Ответ неверный. г) степень окисления водорода равна (+1). Примем за «a» степень окисления углерода: 2×а + 6×1 = 0; Верный ответ. |
| Ответ | Вариант (г) |
Для характеристики окислительно-восстановительной способности частиц важное значение имеет такое понятие, как степень окисления. СТЕПЕНЬ ОКИСЛЕНИЯ – это заряд, который мог бы возникнуть у атома в молекуле или ионе, если бы все его связи с другими атомами оказались разорваны, а общие электронные пары ушли с более электроотрицательными элементами.
В отличие от
реально существующих зарядов у ионов,
степень окисления показывает лишь
условный заряд атома в молекуле. Она
может быть отрицательной, положительной
и нулевой. Например, степень окисления
атомов в простых веществах равна «0»
(, ,
, ,
, ).
В химических соединениях атомы могут
иметь постоянную степень окисления или
переменную. У металлов главных подгруппI,
II
и III
групп Периодической системы в химических
соединениях степень окисления, как
правило, постоянна и равна соответственно
Ме +1 ,
Ме +2
и Ме +3
(Li + ,
Ca +2 ,
Al +3).
У атома фтора всегда -1. У хлора в
соединениях с металлами всегда -1. В
подавляющем числе соединений кислород
имеет степень окисления -2 (кроме
пероксидов, где его степень окисления
-1), а водород +1(кроме гидридов металлов,
где его степень окисления -1).
).
В химических соединениях атомы могут
иметь постоянную степень окисления или
переменную. У металлов главных подгруппI,
II
и III
групп Периодической системы в химических
соединениях степень окисления, как
правило, постоянна и равна соответственно
Ме +1 ,
Ме +2
и Ме +3
(Li + ,
Ca +2 ,
Al +3).
У атома фтора всегда -1. У хлора в
соединениях с металлами всегда -1. В
подавляющем числе соединений кислород
имеет степень окисления -2 (кроме
пероксидов, где его степень окисления
-1), а водород +1(кроме гидридов металлов,
где его степень окисления -1).
Алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле равна нулю, а в ионе – заряду иона. Эта взаимосвязь позволяет рассчитывать степени окисления атомов в сложных соединениях.
В молекуле серной
кислоты H 2 SO 4
атом водорода имеет степень окисления
+1, а атом кислорода -2. Так как атомов
водорода два, а атомов кислорода четыре,
то мы имеем два «+» и восемь «-». До
нейтральности не хватает шесть «+».
Именно это число и является степенью
окисления серы -
 .
Молекула дихромата калияK 2 Cr 2 O 7
состоит из двух атомов калия, двух атомов
хрома и семи атомов кислорода. У калия
степень окисления всегда +1, у кислорода
-2. Значит, мы имеем два «+» и четырнадцать
«-». Оставшиеся двенадцать «+» приходятся
на два атома хрома, у каждого из которых
степень окисления равна +6 (
.
Молекула дихромата калияK 2 Cr 2 O 7
состоит из двух атомов калия, двух атомов
хрома и семи атомов кислорода. У калия
степень окисления всегда +1, у кислорода
-2. Значит, мы имеем два «+» и четырнадцать
«-». Оставшиеся двенадцать «+» приходятся
на два атома хрома, у каждого из которых
степень окисления равна +6 ( ).
).
Типичные окислители и восстановители
Из определения процессов восстановления и окисления следует, что, в принципе, в роли окислителей могут выступать простые и сложные вещества, содержащие атомы, которые находятся не в низшей степени окисления и поэтому могут понижать свою степень окисления. Аналогично в роли восстановителей могут выступать простые и сложные вещества, содержащие атомы, которые находятся не в высшей степени окисления и поэтому могут повышать свою степень окисления.
К наиболее сильным окислителям относятся:
1) простые вещества, образуемые атомами, имеющими большую электроотрицательность, т.е. типичные неметаллы, расположенные в главных подгруппах шестой и седьмой групп периодической системы: F, O, Cl, S (соответственно F 2 , O 2 , Cl 2 , S);
2) вещества, содержащие элементы в высших и промежуточных
положительных степенях окисления, в том числе в виде ионов, как простых, элементарных (Fe 3+), так и кислородосодержащих, оксоанионов (перманганат-ион - MnO 4 -);
3) перекисные соединения.
Конкретными
веществами, применяемыми на практике
в качестве окислителей, являются кислород
и озон, хлор, бром, перманганаты, дихроматы,
кислородные кислоты хлора и их соли
(например,
 ,
, ,
, ),
азотная кислота (
),
азотная кислота ( ),
концентрированная серная кислота
(
),
концентрированная серная кислота
( ),
диоксид марганца (
),
диоксид марганца ( ),
пероксид водорода и пероксиды металлов
(
),
пероксид водорода и пероксиды металлов
( ,
, ).
).
К наиболее сильным восстановителям относятся:
1)простые вещества, атомы которых имеют низкую электроотрицательность («активные металлы»);
2) катионы металлов в низжих степенях окисления (Fe 2+);
3) простые элементарные анионы, например, сульфид-ион S 2- ;
4) кислородосодержащие
анионы (оксоанионы), соответствующие
низшим положительным степеням окисления
элемента (нитрит
 ,
сульфит
,
сульфит ).
).
Конкретными
веществами, применяемыми на практике
в качестве восстановителей, являются,
например, щелочные и щелочноземельные
металлы, сульфиды, сульфиты, галогенводороды
(кроме HF),
органические вещества – спирты,
альдегиды, формальдегид, глюкоза,
щавелевая кислота, а также водород,
углерод, моноксид углерода ( )
и алюминий при высоких температурах.
)
и алюминий при высоких температурах.
В принципе, если в состав вещества входит элемент в промежуточной степени окисления, то эти вещества могут проявлять как окислительные, так и восстановительные свойства. Все зависит от
«партнера» по реакции: с достаточно сильным окислителем оно может реагировать как восстановитель, а с достаточно сильным восстановителем – как окислитель. Так, например, нитрит-ион NO 2 - в кислой среде выступает в роли окислителя по отношению к иону I - :
2 +
2
+
2 + 4HCl→
+ 4HCl→
 +
2
+
2 + 4KCl
+ 2H 2 O
+ 4KCl
+ 2H 2 O
и в роли восстановителя по отношению к перманганат-иону MnO 4 -
5 +
2
+
2 + 3H 2 SO 4
→ 2
+ 3H 2 SO 4
→ 2 +
5
+
5 +K 2 SO 4
+ 3H 2 O
+K 2 SO 4
+ 3H 2 O
Во многих школьных учебниках и пособиях учат составлять формулы по валентностям, даже для соединений с ионными связями. Для упрощения процедуры составления формул это, на наш взгляд, допустимо. Но нужно понимать, что это не совсем корректно ввиду вышеизложенной причины.
Более универсальным понятием является понятие о степени окисления. По значениям степеней окисления атомов так же как и по значениям валентности можно составлять химические формулы и записывать формульные единицы.
Степень окисления - это условный заряд атома в частице (молекуле, ионе, радикале), вычисленный в приближении того, что все связи в частице являются ионными.
Прежде чем определять степени окисления, необходимо сравнить электроотрицательности связуемых атомов. Атом с большим значением электроотрицательности имеет отрицательную степень окисления, а с меньшим положительную.
С целью объективного сравнения значений электроотрицательности атомов при расчёте степеней окисления, в 2013 году IUPAC дал рекомендацию использовать шкалу Аллена.
* Так, например, по шкале Аллена электроотрицательность азота 3,066, а хлора 2,869.
Проиллюстрируем данное выше определение на примерах. Составим структурную формулу молекулы воды.

Ковалентные полярные связи O-H обозначены синим цветом.
Представим, что обе связи являются не ковалентными, а ионными. Если бы они были ионными, то с каждого атома водорода на более электроотрицательный атом кислорода перешло бы по одному электрону. Обозначим эти переходы синими стрелками.
*В этом примере, стрелка служит для наглядной иллюстрации полного перехода электронов, а не для иллюстрации индуктивного эффекта.

Легко заметить, что число стрелок показывает количество перешедших электронов, а их направление - направление перехода электронов.
На атом кислорода направлено две стрелки, это значит, что к атому кислорода переходит два электрона: 0 + (-2) = -2. На атоме кислорода образуется заряд равный -2. Это и есть степень окисления кислорода в молекуле воды.
С каждого атома водорода уходит по одному электрону: 0 - (-1) = +1. Значит, атомы водорода имеют степень окисления равную +1.

Сумма степеней окисления всегда равняется общему заряду частицы.
Например, сумма степеней окисления в молекуле воды равна: +1(2) + (-2) = 0. Молекула - электронейтральная частица.
Если мы вычисляем степени окисления в ионе, то сумма степеней окисления, соответственно, равна его заряду.
Значение степени окисления принято указывать в верхнем правом углу от символа элемента. Причём, знак пишут впереди числа . Если знак стоит после числа - то это заряд иона.
Например, S -2 - атом серы в степени окисления -2, S 2- - анион серы с зарядом -2.
S +6 O -2 4 2- - значения степеней окисления атомов в сульфат-анионе (заряд иона выделен зелёным цветом).
Теперь рассмотрим случай, когда соединение имеет смешанные связи: Na 2 SO 4 . Связь между сульфат-анионом и катионами натрия - ионная, связи между атомом серы и атомами кислорода в сульфат-ионе - ковалентные полярные. Запишем графическую формулу сульфата натрия, а стрелками укажем направление перехода электронов.
*Структурная формула отображает порядок ковалентных связей в частице (молекуле, ионе, радикале). Структурные формулы применяют только для частиц с ковалентными связями. Для частиц с ионными связями понятие структурной формулы не имеет смысла. Если в частице имеются ионные связи, то применяют графическую формулу.

Видим, что от центрального атома серы уходит шесть электронов, значит степень окисления серы 0 - (-6) = +6.
Концевые атомы кислорода принимают по два электрона, значит их степени окисления 0 + (-2) = -2
Мостиковые атомы кислорода принимают по два электрона, их степень окисления равна -2.
Определить степени окисления возможно и по структурно-графической формуле, где черточками указывают ковалентные связи, а у ионов указывают заряд.
В этой формуле мостиковые атомы кислорода уже имеют единичные отрицательные заряды и к ним дополнительно приходит по электрону от атома серы -1 + (-1) = -2, значит их степени окисления равны -2.
Степень окисления ионов натрия равна их заряду, а т.е. +1.

Определим степени окисления элементов в надпероксиде (супероксиде) калия. Для этого составим графическую формулу супероксида калия, стрелочкой покажем перераспределение электронов. Связь O-O является ковалентной неполярной, поэтому в ней перераспределение электронов не указывается.
* Надпероксид-анион является ион-радикалом. Формальный заряд одного атома кислорода равен -1, а другого, с неспаренным электроном, 0.

Видим, что степень окисления калия равна +1. Степень окисления атома кислорода, записанного в формуле напротив калия, равна -1. Степень окисления второго атома кислорода равна 0.
Точно также можно определить степени окисления и по структурно-графической формуле.

В кружочках указаны формальные заряды иона калия и одного из атомов кислорода. При этом значения формальных зарядов совпадают со значениями степеней окисления.
Так как оба атома кислорода в надпероксид-анионе имеют разные значения степени окисления, то можно вычислить средне-арифметическую степень окисления кислорода.
Она будет равна / 2 = - 1/2 = -0,5.
Значения среднеарифметических степеней окисления обычно указывают в брутто-формулах или формульных единицах, чтобы показать что сумма степеней окисления равна общему заряду системы.
Для случая с надпероксидом: +1 + 2(-0,5) = 0

Легко определить степени окисления используя электронно-точечные формулы, в которых указывают точками неподеленные электронные пары и электроны ковалентных связей.

Кислород - элемент VIА - группы, следовательно в его атоме 6 валентных электронов. Представим, что в молекуле воды связи ионные, в этом случае атом кислорода получил бы октет электронов.
Степень окисления кислорода соответственно равна: 6 - 8 = -2.
А атомов водорода: 1 - 0 = +1
Умение определять степени окисления по графическим формулам бесценно для понимания сущности этого понятия, так же это умение потребуется в курсе органической химии. Если же мы имеем дело с неорганическими веществами, то необходимо уметь определять степени окисления по молекулярным формулам и формульным единицам.
Для этого прежде всего нужно понять, что степени окисления бывают постоянными и переменными. Элементы, проявляющие постоянную степень окисления необходимо запомнить.

Любой химический элемент характеризуется высшей и низшей степенями окисления.
Низшая степень окисления - это заряд, который приобретает атом в результате приёма максимального количества электронов на внешний электронный слой.
Ввиду этого, низшая степень окисления имеет отрицательное значение, за исключением металлов, атомы которых электроны никогда не принимают ввиду низких значений электроотрицательности. Металлы имеют низшую степень окисления равную 0.
Большинство неметаллов главных подгрупп старается заполнить свой внешний электронный слой до восьми электронов, после этого атом приобретает устойчивую конфигурацию (правило октета ). Поэтому, чтобы определить низшую степень окисления, необходимо понять сколько атому не хватает валентных электронов до октета.
Например, азот - элемент VА группы, это значит, что в атоме азота пять валентных электронов. До октета атому азота не хватает трёх электронов. Значит низшая степень окисления азота равна: 0 + (-3) = -3
При изучении ионной и ковалентной полярной химических связей вы знакомились со сложными веществами, состоящими из двух химических элементов. Такие вещества называют бинарными (от лат. би - два) или двухэлементными.
Вспомним типичные бинарные соединения, которые мы приводили в качестве примера для рассмотрения механизмов образования ионной и ковалентной полярной химической связи: NaCl - хлорид натрия и НСl - хлороводород.
В первом случае связь ионная: атом натрия передал свой внешний электрон атому хлора и превратился при этом в ион с зарядом +1, а атом хлора принял электрон и превратился в ион с зарядом -1. Схематически процесс превращения атомов в ионы можно изобразить так:
В молекуле же хлороводорода НС1 химическая связь образуется за счёт спаривания неспаренных внешних электронов и образования общей электронной пары атомов водорода и хлора:
Правильнее представлять образование ковалентной связи в молекуле хлороводорода как перекрывание одноэлектронного s-облака атома водорода с одноэлектронным р-облаком атома хлора:
При химическом взаимодействии общая электронная пара смещена в сторону более электроотрицательного атома хлора: , т. е. электрон не полностью перейдёт от атома водорода к атому хлора, а частично, обусловливая тем самым частичный заряд атомов 5 (см. § 12): . Если же представить, что и в молекуле хлороводорода НСl, как и в хлориде натрия NaCl, электрон полностью перешёл от атома водорода к атому хлора, то они получили бы заряды +1 и -1: . Такие условные заряды называют степенью окисления. При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных ионов.
Степень окисления может иметь отрицательное, положительное или нулевое значения, которые обычно ставятся над символом элемента сверху, например:
Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов или к которым смещены общие электронные пары, т. е. атомы более электроотрицательных элементов. Фтор всегда имеет степень окисления -1 во всех соединениях. Кислород, второй после фтора по значению электроотрицательности элемент, почти всегда имеет степень окисления -2, кроме соединений со фтором, например:
![]()
Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, т. е. атомы менее электроотрицательных элементов. Металлы в соединениях всегда имеют положительную степень окисления. У металлов главных подгрупп: I группы (IA группы) во всех соединениях степень окисления равна +1, II группы (IIA группы) равна +2, III группы (IIIA группы) - +3, например:
![]()
![]()
но в соединениях с металлами у водорода степень окисления -1:
![]()
Нулевое значение степени окисления имеют атомы в молекулах простых веществ и атомы в свободном состоянии, например:
К понятию «степень окисления» близко понятие «валентность», с которым вы знакомились, рассматривая ковалентную химическую связь. Однако это не одно и то же.
Понятие «валентность» применимо для веществ, имеющих молекулярное строение. Подавляющее большинство органических веществ, с которыми вы будете знакомиться в 10 классе, имеет именно такое строение. В курсе основной школы вы изучаете неорганическую химию, предметом которой являются вещества как молекулярного, так и немолекулярного, например ионного, строения. Поэтому предпочтительнее использовать понятие «степень окисления».
Чем же отличается валентность от степени окисления?
Часто валентность и степень окисления численно совпадают, но валентность не имеет знака заряда, а степень окисления - имеет. Например, одновалентный водород имеет следующие степени окисления в различных веществах:
![]()
Казалось бы, что одновалентный фтор - самый электроотрицательный элемент - должен иметь полное совпадение значений степени окисления и валентности. Ведь его атом способен образовывать лишь одну-единственную ковалентную связь, так как ему недостаёт до завершения внешнего электронного слоя одного электрона. Однако и здесь наблюдается различие:
Ещё более различаются между собой валентность и степень окисления, если они численно не совпадают. Например:
В соединениях суммарная степень окисления всегда равна нулю. Зная это и степень окисления одного из элементов, можно найти степень окисления другого элемента по формуле, например бинарного соединения. Так, найдём степень окисления хлора в соединении С1 2 O 7 .
Обозначим степень окисления кислорода: . Следовательно, семь атомов кислорода будут иметь общий отрицательный заряд (-2) × 7 = -14. Тогда общий заряд двух атомов хлора будет равен +14, а одного атома хлора: (+14) : 2 = +7. Следовательно, степень окисления хлора равна .
Аналогично, зная степени окисления элементов, можно составить формулу соединения, например карбида алюминия (соединения алюминия и углерода).
Нетрудно заметить, что аналогично вы работали с понятием «валентность», когда выводили формулу ковалентного соединения или определяли валентность элемента по формуле его соединения.
Названия бинарных соединений образуют из двух слов - названий входящих в их состав химических элементов. Первое слово обозначает электроотрицательную часть соединения - неметалл, его латинское название с суффиксом -ид стоит всегда в именительном падеже. Второе слово обозначает электроположительную часть - металл или менее электроотрицательный элемент, его название всегда стоит в родительном падеже:
Например: NaCl - хлорид натрия, MgS - сульфид магния, КН - гидрид калия, СаО - оксид кальция. Если же электроположительный элемент проявляет разные степени окисления, то это отражают в названии, обозначив степень окисления римской цифрой, которую ставят в конце названия, например: - оксид железа (II) (читают «оксид железа два»), - оксид железа (III) (читают «оксид железа три»).
Если соединение состоит из двух элементов-неметаллов, то к названию более электроотрицательного из них прибавляют суффикс -ид, второй компонент ставится после этого в родительном падеже. Например: - фторид кислорода (II), - оксид серы (IV) и - оксид серы (VI).
В некоторых случаях число атомов элементов обозначают при помощи названий числительных на греческом языке - моно, ди, три, тетра, пента, гекса и т. д. Например: - монооксид углерода, или оксид углерода (II), - диоксид углерода, или оксид углерода (IV), - тетрахлорид свинца, или хлорид свинца (IV).
Чтобы химики разных стран понимали друг друга, потребовалось создание единой терминологии и номенклатуры веществ. Принципы химической номенклатуры были впервые разработаны французскими химиками А. Лавуазье, А. Фуркруа, Л. Гитоном де Мерво и К. Бертолле в 1785 г. В настоящее время Международный союз теоретической и прикладной химии (ИЮПАК) координирует деятельность учёных разных стран и издаёт рекомендации по номенклатуре веществ и терминологии, используемой в химии.
Ключевые слова и словосочетания
- Бинарные, или двухэлементные, соединения.
- Степень окисления.
- Химическая номенклатура.
- Определение степеней окисления элементов по формуле.
- Составление формул бинарных соединений по степеням окисления элементов.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока - сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- Запишите формулы оксидов азота (II), (V), (I), (III), (IV).
- Дайте названия бинарных соединений, формулы которых: а) С1 2 0 7 , С1 2 O, С1O 2 ; б) FeCl 2 , FeCl 3 ; в) MnS, MnO 2 , MnF 4 , MnO, MnCl 4 ; r) Cu 2 O, Mg 2 Si, SiCl 4 , Na 3 N, FeS.
- Найдите по справочникам и словарям всевозможные названия веществ с формулами: а) СO 2 и СО; б) SO 2 и SO 3 . Объясните их этимологию. Дайте по два названия этих веществ по международной номенклатуре в соответствии с правилами, изложенными в параграфе.
- Какое ещё название можно дать аммиаку H 3 N?
- Найдите объём, который имеют при н. у. 17 г сероводорода.
- Сколько молекул его содержится в этом объёме?
- Вычислите массу 33,6 м3 метана СН 2 при н. у. и определите число его молекул, содержащееся в этом объёме.
- Определите степень окисления углерода и запишите структурные формулы следующих веществ, зная, что углерод в органических соединениях всегда четырёхвалентен: метана СН 4 , тетрахлорметана СС1 4 , этана С 2 Н 4 , ацетилена С 2 Н 2 .
Умение находить степень окисления химических элементов является необходимым условием для успешного решения химический уравнений, описывающих окислительно-восстановительные реакции. Без него вы не сможете составить точную формулу вещества, получившегося в результате реакции между различными химическими элементами. В результате решение химических задач, построенных на подобных уравнениях, будет либо невозможным, либо ошибочным.
Понятие степени окисления химического элементаСтепень окисления – это условная величина, с помощью которой принято описывать окислительно-восстановительные реакции. Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
В окислительно-восcтановительных реакциях понятие степень окисления используется для определения химических формул соединений элементов, получающихся в результате взаимодействия нескольких веществ.
На первый взгляд может показаться, что степень окисления эквивалентна понятию валентности химического элемента, но это не так. Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Как определить степень окисления конкретного химического элемента
Определение степени окисления для конкретного химического элемента подчиняется следующим правилам:
- Степень окисления простых веществ всегда равна нулю.
- Щелочные металлы, которые находятся в первой группе периодической таблицы, имеют степень окисления +1.
- Щелочноземельные металлы, занимающие в периодической таблице вторую группу, имеют степень окисления +2.
- Водород в соединениях с различными неметаллами всегда проявляет степень окисления +1, а в соединениях с металлами +1.
- Степень окисления молекулярного кислорода во всех соединениях, рассматриваемых в школьном курсе неорганической химии, равна -2. Фтора -1.
- При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
- Алюминий во всех соединениях проявляет степень окисления равную +3.
Различают высшую, низшую и промежуточную степени окисления. Высшая степень окисления, как и валентность, соответствует номеру группы химического элемента в периодической таблице, но имеет при этом положительное значение. Низшая степень окисления численно равна разности между числом 8 группой элемента. Промежуточной степенью окисления будет любой число в диапазоне от низшей степени окисления до высшей.
Чтобы помочь вам сориентироваться в многообразии степеней окисления химических элементов предлагаем вашему вниманию следующую вспомогательную таблицу. Выберите в ней интересующий вас элемент и вы получите значения его возможных степеней окисления. В скобках будут указаны редко встречающиеся значения.