Fizička i hemijska svojstva halogena u primeni jedinjenja. Halogeni i njihova jedinjenja. Halogeni spojevi i njihova uloga u ljudskom tijelu
Halogeni– Elementi VII grupe – fluor, hlor, brom, jod, astatin (astatin je malo proučavan zbog svoje radioaktivnosti). Halogeni su različiti nemetali. Samo jod u rijetkim slučajevima pokazuje neka svojstva slična metalima.
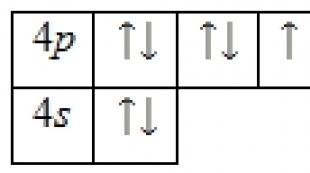
U nepobuđenom stanju, atomi halogena imaju zajedničku elektronsku konfiguraciju: ns2np5. To znači da halogeni imaju 7 valentnih elektrona, osim fluora.
Fizička svojstva halogena: F2 – bezbojni gas koji se teško topi u tečnost; Cl2 je žuto-zeleni, lako ukapljeni gas oštrog zagušljivog mirisa; Br2 – crveno-braon tečnost; I2 je ljubičasta kristalna supstanca.

Vodeni rastvori halogenovodonika formiraju kiseline. HF – fluorovodonik (fluorid); HCl – hlorovodonična (sol); NBr—bromovodonik; HI – vodonik jodid. Snaga kiselina opada od vrha prema dolje. Fluorovodonična kiselina je najslabija u nizu halogeniranih kiselina, a jodovodonična kiselina je najjača. Ovo se objašnjava činjenicom da se energija vezivanja Hg smanjuje odozgo. Snaga NG molekula opada u istom smjeru, što je povezano s povećanjem međunuklearne udaljenosti. Smanjuje se i rastvorljivost slabo rastvorljivih soli u vodi:
S lijeva na desno, rastvorljivost halogenida se smanjuje. AgF je visoko rastvorljiv u vodi. Svi halogeni u slobodnom stanju su oksidanti. Njihova snaga kao oksidansa opada od fluora do joda. U kristalnom, tekućem i gasovitom stanju, svi halogeni postoje u obliku pojedinačnih molekula. Atomski radijusi rastu u istom smjeru, što dovodi do povećanja tačaka topljenja i ključanja. Fluor se bolje disocira na atome od joda. Potencijali elektroda se smanjuju pri pomicanju niz halogenu podgrupu. Fluor ima najveći elektrodni potencijal. Fluor je najjači oksidant. Svaki viši slobodni halogen će istisnuti niži, koji je u stanju negativnog jednostruko nabijenog jona u otopini.
20. Hlor. Hlorovodonik i hlorovodonična kiselina
Hlor (Cl) – stoji u 3. periodu, u VII grupi glavne podgrupe periodnog sistema, redni broj 17, atomska masa 35.453; odnosi se na halogene.
Fizička svojstva:žuto-zeleni gas oštrog mirisa. Gustina 3,214 g/l; tačka topljenja -101 °C; tačka ključanja -33,97 °C, na običnoj temperaturi lako se ukapljuje pod pritiskom od 0,6 MPa. Rastvarajući se u vodi, stvara žućkastu hlornu vodu. Vrlo je rastvorljiv u organskim rastvaračima, posebno u heksanu (C6H14) i tetrahloridu ugljenika.
Hemijska svojstva hlora: elektronska konfiguracija: 1s22s22p63s22p5. Na vanjskom nivou nalazi se 7 elektrona. Da biste završili nivo, potreban vam je 1 elektron, koji hlor prihvata, pokazujući oksidaciono stanje od -1. Postoje i pozitivna oksidaciona stanja hlora do +7. Poznati su sledeći oksidi hlora: Cl2O, ClO2, Cl2O6 i Cl2O7. Svi su nestabilni. Klor je jako oksidaciono sredstvo. Direktno reaguje sa metalima i nemetalima:
Reaguje sa vodonikom. U normalnim uslovima, reakcija se odvija sporo, uz jako zagrevanje ili osvetljenje - uz eksploziju, prema lančanom mehanizmu:
![]()
Klor stupa u interakciju s alkalnim otopinama, formirajući soli - hipohlorite i kloride:
Kada se hlor prenese u alkalnu otopinu, nastaje mješavina otopina klorida i hipoklorita:
Hlor je redukciono sredstvo: Cl2 + 3F2 = 2ClF3.
Interakcija sa vodom:
Klor ne reagira direktno s ugljikom, dušikom i kisikom.
Potvrda: 2NaCl + F2 = 2NaF + Cl2.
elektroliza: 2NaCl + 2H2O = Cl2 + H2 + 2NaOH.
Pronalaženje u prirodi: sadržani u sljedećim mineralima: halit (kamena sol), silvit, bišofit; morska voda sadrži kloride natrijuma, kalija, magnezija i drugih elemenata.
Hlorovodonik HCl. Fizička svojstva: bezbojni gas, teži od vazduha, veoma rastvorljiv u vodi i formira hlorovodoničnu kiselinu.
Potvrda: u laboratoriji:
U industriji: vodonik se spaljuje u struji hlora. Zatim, hlorovodonik se rastvara u vodi da bi se formirala hlorovodonična kiselina (vidi gore).
Hemijska svojstva: hlorovodonična kiselina je jaka, jednobazna, reaguje sa metalima u naponskom nizu do vodonika: Zn + 2HCl = ZnCl2 + H2.
Kao redukcijsko sredstvo reagira sa oksidima i hidroksidima mnogih metala.
Hemija elemenata
Nemetali VIIA podgrupe
Elementi VIIA podgrupe su tipični nemetali sa visokim
elektronegativnosti, imaju naziv grupe - "halogeni".
Glavna pitanja obrađena u predavanju
Opće karakteristike nemetala VIIA podgrupe. Elektronska struktura, najvažnije karakteristike atoma. Najkarakterističniji ste-
oksidacijske kazne. Karakteristike hemije halogena.
Jednostavne supstance.
Prirodna jedinjenja.
Halogena jedinjenja
Halovodične kiseline i njihove soli. Sol i fluorovodonična kiselina
slotovi, račun i aplikacija.
Halogeni kompleksi.
Binarna jedinjenja kiseonika halogena. Nestabilnost cca.
Redox svojstva jednostavnih supstanci i ko-
jedinstva. Reakcije disproporcionalnosti. Latimerovi dijagrami.
Izvršilac: |
Događaj br. |
||||||||||||||||

Hemija elemenata VIIA podgrupe
opšte karakteristike
Mangan |
||||||||
Tehnecij |
||||||||
VIIA-grupu čine p-elementi: fluor F, hlor
Cl, brom Br, jod I i astat At.
Opšta formula za valentne elektrone je ns 2 np 5.
Svi elementi grupe VIIA su tipični nemetali.
Kao što se vidi iz distribucije |
|||||||
valentnih elektrona |
|||||||
prema orbitalama atoma |
nedostaje samo jedan elektron |
||||||
da formiraju stabilnu ljusku od osam elektrona
kutije, zato i imaju postoji snažna tendencija ka
dodavanje elektrona.
Svi elementi jednostavno formiraju jednostruko punjenje
ny anioni G – .
U obliku jednostavnih aniona, elementi grupe VIIA nalaze se u prirodnoj vodi i u kristalima prirodnih soli, na primjer, halit NaCl, silvit KCl, fluorit
CaF2.
Opšti naziv grupe elemenata VIIA-
grupa “halogeni”, odnosno “rađaju soli”, nastaje zbog činjenice da je većina njihovih spojeva s metalima pre-
je tipična so (CaF2, NaCl, MgBr2, KI), koja
koji se mogu dobiti direktnom interakcijom
interakcija metala sa halogenom. Slobodni halogeni se dobijaju iz prirodnih soli, pa se naziv "halogeni" prevodi i kao "rođeni iz soli".
Izvršilac: |
Događaj br. |
||||||||||||||||

Minimalno oksidaciono stanje (–1) je najstabilnije
za sve halogene.
Date su neke karakteristike atoma elemenata VIIA grupe
Najvažnije karakteristike atoma elemenata VIIA grupe
relativno- |
Afinitet |
||||||
električni |
|||||||
negativan |
jonizacija, |
||||||
nosti (prema |
|||||||
glasanje) |
|||||||
povećanje broja |
|||||||
elektronski slojevi; |
|||||||
povećanje veličine |
|||||||
smanjenje električne |
|||||||
trostruka negativnost |
Halogeni imaju visok afinitet prema elektronima (maksimalno pri
Cl) i vrlo visoku energiju jonizacije (maksimalno na F) i maksimum
moguća elektronegativnost u svakom periodu. Najviše je fluora
elektronegativnost svih hemijskih elemenata.
Prisustvo jednog nesparenog elektrona u atomima halogena određuje
predstavlja spajanje atoma u jednostavnim supstancama u dvoatomske molekule G2.
Za jednostavne tvari, halogeni, najkarakterističniji su oksidanti
svojstva, koja su najjača u F2 i slabe kada pređu u I2.
Halogeni se odlikuju najvećom reaktivnošću od svih nemetalnih elemenata. Fluor se, čak i među halogenima, ističe
ima izuzetno visoku aktivnost.
Element drugog perioda, fluor, najjače se razlikuje od drugog
ostali elementi podgrupe. Ovo je opći obrazac za sve nemetale.
Izvršilac: |
Događaj br. |
||||||||||||||||
Fluor, kao najelektronegativniji element, ne pokazuje seks
rezidentna oksidaciona stanja. U bilo kojoj vezi, uključujući i ki-
kiseonika, fluor je u oksidacionom stanju (-1).
Svi ostali halogeni pokazuju pozitivne stupnjeve oksidacije
lenija do maksimalno +7.
Najkarakterističnija oksidaciona stanja halogena:
F: -1, 0;
Cl, Br, I: -1, 0, +1, +3, +5, +7.
Cl ima poznate okside u kojima se nalazi u oksidacionim stanjima: +4 i +6.
Najvažnija jedinjenja halogena, u pozitivnom stanju,
Kazne oksidacije su kiseline koje sadrže kisik i njihove soli.
Sva jedinjenja halogena u pozitivnim oksidacionim stanjima su
su jaki oksidanti.
užasan stepen oksidacije. Alkalna sredina podstiče disproporciju.
Praktična primjena jednostavnih tvari i kisikovih spojeva
Smanjenje halogena je uglavnom zbog njihovog oksidativnog učinka.
Najjednostavnije supstance, Cl2, nalaze najširu praktičnu primenu.
i F2. Najveća količina hlora i fluora se troši u industriji
organska sinteza: u proizvodnji plastike, rashladnih sredstava, rastvarača,
pesticida, lekova. Značajne količine hlora i joda koriste se za dobijanje metala i za njihovu rafinaciju. Koristi se i hlor
za izbjeljivanje celuloze, za dezinfekciju vode za piće iu proizvodnji
voda od izbjeljivača i hlorovodonične kiseline. Soli oksokiselina koriste se u proizvodnji eksploziva.
Izvršilac: |
Događaj br. |
||||||||||||||||

Kiseline - hlorovodonične i rastaljene kiseline - se široko koriste u praksi.
Fluor i hlor su među dvadeset najčešćih elemenata
tamo je u prirodi znatno manje broma i joda. Svi halogeni se javljaju u prirodi u svom oksidacionom stanju(-1). Samo jod se javlja u obliku soli KIO3,
koji je uključen kao nečistoća u čileansku salitru (KNO3).
Astatin je umjetno proizveden radioaktivni element (ne postoji u prirodi). Nestabilnost At se ogleda u imenu, koje dolazi iz grčkog. "astatos" - "nestabilan". Astatin je pogodan emiter za radioterapiju tumora raka.
Jednostavne supstance
Jednostavne supstance halogena formiraju dvoatomski molekuli G2.
U jednostavnim supstancama, tokom prijelaza iz F2 u I2 sa povećanjem broja elektrona
tronskih slojeva i povećanja polarizabilnosti atoma, dolazi do povećanja
međumolekularna interakcija, što dovodi do promjene u agregatnom ko-
stoje pod standardnim uslovima.
Fluor (u normalnim uslovima) je žuti gas, na -181o C se pretvara u
tečno stanje.
Hlor je žutozeleni gas koji na –34o C prelazi u tečnost. Boje ha-
Ime Cl je povezano s njim, dolazi od grčkog "chloros" - "žuto-
zeleno". Oštar porast tačke ključanja Cl2 u poređenju sa F2,
ukazuje na povećanu međumolekularnu interakciju.
Brom je tamnocrvena, vrlo isparljiva tečnost, ključa na 58,8o C.
naziv elementa povezan je s oštrim neugodnim mirisom plina i izveden je iz
"bromos" - "smrdljiv".
Jod - tamno ljubičasti kristali, sa slabim "metalnim"
grudvice, koje se zagrijavanjem lako sublimiraju, stvarajući ljubičaste pare;
sa brzim hlađenjem |
pare do 114o C |
formira se tečnost. Temperatura |
|||||||||||||||||
Izvršilac: |
Događaj br. |
||||||||||||||||||
Tačka ključanja joda je 183 °C. Njegovo ime potiče od boje jodnih para -
"jodos" - "ljubičasta".
Sve jednostavne tvari imaju oštar miris i otrovne su.
Udisanje njihovih para izaziva iritaciju sluzokože i dišnih organa, a pri visokim koncentracijama - gušenje. Tokom Prvog svetskog rata hlor je korišćen kao otrovno sredstvo.
Plin fluor i tekući brom uzrokuju opekotine kože. Rad sa ha-
logens, potrebno je poduzeti mjere opreza.
Budući da su jednostavne tvari halogena formirane od nepolarnih molekula
hladi, dobro se otapaju u nepolarnim organskim rastvaračima:
alkohol, benzen, ugljen-tetrahlorid itd. Klor, brom i jod su slabo rastvorljivi u vodi, a njihove vodene rastvore nazivaju se hlor, brom i jodna voda. Br2 se rastvara bolje od ostalih, koncentracija broma u zas.
Rastvor dostiže 0,2 mol/l, a hlor – 0,1 mol/l.
Fluorid razlaže vodu:
2F2 + 2H2 O = O2 + 4HF
Halogeni pokazuju visoku oksidativnu aktivnost i prelaz
u halogenidne anjone.
G2 + 2e– 2G–
Fluor ima posebno visoku oksidativnu aktivnost. Fluor oksidira plemenite metale (Au, Pt).
Pt + 3F2 = PtF6
Čak je u interakciji sa nekim inertnim gasovima (kriptonom,
ksenon i radon), na primjer,
Xe + 2F2 = XeF4
Mnoga vrlo stabilna jedinjenja sagorevaju u atmosferi F2, npr.
voda, kvarc (SiO2).
SiO2 + 2F2 = SiF4 + O2
Izvršilac: |
Događaj br. |
||||||||||||||||

U reakcijama s fluorom, čak i jaki oksidanti kao što su dušik i sumpor
nikalne kiseline, djeluju kao redukcioni agensi, dok fluor oksidira ulaz
koji sadrže O(–2) u svom sastavu.
2HNO3 + 4F2 = 2NF3 + 2HF + 3O2 H2 SO4 + 4F2 = SF6 + 2HF + 2O2
Visoka reaktivnost F2 stvara poteškoće pri izboru kon-
konstrukcijski materijali za rad s njim. Obično u te svrhe koristimo
Postoje nikal i bakar, koji, kada se oksidiraju, na svojoj površini formiraju guste zaštitne filmove fluorida. Ime F je zbog njegovog agresivnog djelovanja.
Ja jedem, dolazi iz grčkog. “fluoros” – “destruktivan”.
U serijama F2, Cl2, Br2, I2 oksidaciona sposobnost slabi zbog povećanja
povećanje veličine atoma i smanjenje elektronegativnosti.
U vodenim otopinama, oksidativna i reduktivna svojstva tvari
Supstance se obično karakterišu pomoću elektrodnih potencijala. U tabeli su prikazani standardni elektrodni potencijali (Eo, V) za polu-reakcije redukcije
formiranje halogena. Za poređenje, Eo vrijednost za ki-
ugljenik je najčešći oksidant.
Standardni elektrodni potencijali za jednostavne halogene supstance
Eo, B, za reakciju |
|||||||||||||
O2 + 4e– + 4H+ 2H2 O |
|||||||||||||
Eo, V |
|||||||||||||
za elektrodu |
|||||||||||||
2G– +2e – = G2 |
|||||||||||||
Smanjena oksidativna aktivnost
Kao što se može videti iz tabele, F2 je mnogo jači oksidant,
nego O2, stoga F2 ne postoji u vodenim rastvorima oksidira vodu,
oporavlja se na F–. Sudeći po Eo vrijednosti, oksidirajuća sposobnost Cl2
Izvršilac: |
Događaj br. |
||||||||||||||||
takođe veći od O2. Zaista, tokom dugotrajnog skladištenja hlorne vode, ona se razgrađuje oslobađanjem kiseonika i stvaranjem HCl. Ali reakcija je spora (molekul Cl2 je primjetno jači od molekula F2 i
energija aktivacije za reakcije sa hlorom je veća), dispro-
porcioniranje:
Cl2 + H2 O HCl + HOCl
U vodi ne dolazi do kraja (K = 3,9 . 10–4), stoga Cl2 postoji u vodenim rastvorima. Br2 i I2 karakteriše još veća stabilnost u vodi.
Disproporcionalnost je vrlo karakterističan oksidans
reakcija redukcije za halogene. Disproporcionalnost pojačanja
izliva se u alkalnoj sredini.
Disproporcija Cl2 u lužini dovodi do stvaranja anjona
Cl– i ClO–. Konstanta disproporcionalnosti je 7,5. 1015.
Cl2 + 2NaOH = NaCl + NaClO + H2O
Kada je jod u disproporciji u lužini, nastaju I– i IO3–. Ana-
Logično, Br2 je disproporcionalan jod. Promjena proizvoda je nesrazmjerna
nacije je zbog činjenice da su anjoni GO– i GO2– u Br i I nestabilni.
Reakcija disproporcionalnosti hlora se koristi u industriji
sposobnost dobivanja jakog i brzodjelujućeg oksidatora hipoklorita,
kreč za izbjeljivanje, bertolet so.
3Cl2 + 6 KOH = 5KCl + KClO3 + 3H2 O
Izvršilac: |
Događaj br. |
||||||||||||||||
Interakcija halogena sa metalima
Halogeni snažno reagiraju s mnogim metalima, na primjer:
Mg + Cl2 = MgCl2 Ti + 2I2 TiI4
Na + halogenidi, u kojima metal ima nisko oksidaciono stanje (+1, +2),
- To su jedinjenja nalik solima sa pretežno jonskim vezama. Kako
lo, jonski halogenidi su čvrste materije sa visokom tačkom topljenja
Metalni halogenidi u kojima metal ima visok stepen oksidacije
cije su jedinjenja sa pretežno kovalentnim vezama.
Mnogi od njih su gasovi, tečnosti ili topljive čvrste materije u normalnim uslovima. Na primjer, WF6 je plin, MoF6 je tekućina,
TiCl4 je tečan.
Interakcija halogena sa nemetalima
Halogeni stupaju u direktnu interakciju sa mnogim nemetalima:
vodonik, fosfor, sumpor, itd. Na primjer:
H2 + Cl2 = 2HCl 2P + 3Br2 = 2PBr3 S + 3F2 = SF6
Veza u nemetalnim halogenidima je pretežno kovalentna.
Obično ova jedinjenja imaju niske tačke topljenja i ključanja.
Prilikom prelaska sa fluora na jod, povećava se kovalentna priroda halogenida.
Kovalentni halogenidi tipičnih nemetala su kisela jedinjenja; u interakciji s vodom, hidroliziraju se u kiseline. Na primjer:
PBr3 + 3H2 O = 3HBr + H3 PO3
PI3 + 3H2 O = 3HI + H3 PO3
PCl5 + 4H2 O = 5HCl + H3 PO4
Izvršilac: |
Događaj br. |
||||||||||||||||

Prve dvije reakcije se koriste za proizvodnju broma i jodida vodika.
noic acid.
Interhalidi. Halogeni, kombinujući se jedni s drugima, formiraju međusobne
vodi. U ovim jedinjenjima lakši i elektronegativniji halogen je u (–1) oksidacionom stanju, a teži u pozitivnom stanju.
oksidacijske kazne.
Direktnom interakcijom halogena pri zagrevanju dobijaju se: ClF, BrF, BrCl, ICl. Postoje i složeniji interhalogenidi:
ClF3, BrF3, BrF5, IF5, IF7, ICl3.
Svi interhalogenidi u normalnim uslovima su tečne supstance sa niskim tačkama ključanja. Interhalogenidi imaju visoku oksidativnu aktivnost
aktivnost. Na primjer, takve hemijski stabilne supstance kao što su SiO2, Al2O3, MgO itd. sagorevaju u parama ClF3.
2Al2 O3 + 4ClF3 = 4 AlF3 + 3O2 + 2Cl2
Fluorid ClF 3 je agresivan fluorirajući reagens koji brzo djeluje
dvorište F2. Koristi se u organskim sintezama i za dobijanje zaštitnih filmova na površini opreme od nikla za rad sa fluorom.
U vodi, interhalogenidi hidroliziraju i formiraju kiseline. Na primjer,
ClF5 + 3H2 O = HClO3 + 5HF
Halogeni u prirodi. Dobijanje jednostavnih supstanci
U industriji se halogeni dobivaju iz njihovih prirodnih spojeva. Sve
procesi za dobijanje slobodnih halogena zasnivaju se na oksidaciji halogena
Nid joni.
2G – G2 + 2e–
Značajna količina halogena nalazi se u prirodnim vodama u obliku anjona: Cl–, F–, Br–, I–. Morska voda može sadržavati do 2,5% NaCl.
Brom i jod se dobijaju iz naftnih bunara i morske vode.
Izvršilac: |
Događaj br. |
||||||||||||||||
Halogeni fluor F, hlor C1, brom Br, jod I su elementi VILA grupe. Elektronska konfiguracija valentne ljuske atoma halogena u osnovnom stanju ns 2 np 5 . Prisustvo pet elektrona na vanjskoj p orbitali, uključujući i jedan nespareni, razlog je visokog afiniteta halogena prema elektronima. Dodatak elektrona dovodi do formiranja halogenih anjona (F-, Cl-, Br-, I-) sa stabilnom ljuskom od 8 elektrona najbližeg plemenitog gasa. Halogeni su različiti nemetali.
Najelektronegativniji element, fluor, ima samo jedno oksidaciono stanje u spojevima - 1, budući da je uvijek akceptor elektrona. Ostali halogeni u jedinjenjima mogu imati oksidaciona stanja u rasponu od -1 do +7. Pozitivna oksidaciona stanja halogena su uzrokovana prijelazom njihovih valentnih elektrona u slobodne d-orbitale vanjskog nivoa (odjeljak 2.1.3) pri formiranju veza sa više elektronegativnih elemenata.
Molekuli halogena su dvoatomni: F 2, C1 2, Br 2, I 2. U standardnim uslovima, fluor i hlor su gasovi, brom je isparljiva tečnost (Tbp = 59 °C), a jod je čvrsta supstanca, ali se lako sublimira (prelazi u gasovito stanje, zaobilazeći tečno stanje).
Redox svojstva. Halogeni su jaki oksidanti, koji reagiraju sa gotovo svim metalima i mnogim nemetalima:
Posebno visoku hemijsku aktivnost pokazuje fluor, koji, kada se zagreje, reaguje čak i sa plemenitim gasovima ksenonom, kriptonom i radonom:
![]()
Hemijska aktivnost halogena opada od fluora do joda, jer s povećanjem atomskog radijusa smanjuje se sposobnost halogena da vežu elektrone:

Aktivniji halogen uvijek istiskuje manje aktivni iz svojih spojeva s metalima. Dakle, fluor istiskuje sve ostale halogene iz njihovih halogenida, a brom istiskuje samo jod iz jodida:
Različita oksidativna svojstva halogena očituju se i u njihovom djelovanju na organizam. Plinoviti hlor i fluor, zbog svojih vrlo jakih oksidacijskih svojstava, moćne su toksične tvari koje uzrokuju teška oštećenja pluća i sluzokože očiju, nosa i larinksa. Jod je blaži oksidant koji ispoljava antiseptička svojstva, pa se široko koristi u medicini.
Razlike u redoks svojstvima halogena također se pojavljuju kada su u interakciji s vodom. Fluor oksidira vodu, a redukcijski agens je atom kisika u molekuli vode:
Interakcija drugih halogena sa vodom je praćena redoks dismutacijom njihovih atoma. Dakle, kada hlor reaguje sa vodom, jedan od atoma molekule hlora, dobijajući elektron od drugog atoma, se redukuje, a drugi atom hlora, koji odustaje od jednog elektrona, oksidira. Ovo stvara hlorna voda, koji sadrže klorovodik (hlorovodoničnu kiselinu) i hipohlorovu (hipohlornu) kiselinu:
Reakcija je reverzibilna, a njena ravnoteža je snažno pomaknuta ulijevo. Hipohlorna kiselina je nestabilna i lako se razgrađuje, posebno na svetlosti, sa stvaranjem jakog oksidacionog sredstva - atomskog kiseonika:
Dakle, klorna voda sadrži u različitim koncentracijama tri oksidirajuća agensa s različitim oksidacijskim sposobnostima: molekularni hlor, hipohlornu kiselinu i atomski kiseonik, čiji se zbir često naziva "aktivni hlor".
Nastali atomski kisik izbjeljuje boje i ubija mikrobe, što objašnjava izbjeljivanje i baktericidni učinak vode s klorom.
Hipohlorna kiselina je jači oksidant od gasovitog hlora. Reaguje sa organskim jedinjenjima RH i kao oksidaciono sredstvo i kao reagens za hlorisanje:
Stoga, kada se voda za piće koja sadrži organske tvari kao nečistoće klorira, one se mogu pretvoriti u toksičnija organohlorna jedinjenja RC1. Ovo svakako treba uzeti u obzir pri razvoju metoda prečišćavanja vode i njihovoj primjeni.
Kada se alkalije dodaju klornoj vodi, ravnoteža se pomiče udesno zbog neutralizacije hipohlorne i hlorovodonične kiseline:
Dobijeni rastvor mešavine soli, tzv Javel voda, koristi se kao sredstvo za izbjeljivanje i dezinfekciju. Ova svojstva su posljedica činjenice da se kalijev hipohlorit pod uticajem CO2 + H 2 0 i kao rezultat hidrolize pretvara u nestabilnu hipohlornu kiselinu, formirajući atomski kiseonik. Kao rezultat toga, Javel voda uništava boje i ubija mikrobe.
Kada gasoviti hlor deluje na vlažno gašeno vapno Ca(OH) 2, dobija se mešavina soli CaCl 2 i Ca(0C1) 2 tzv. izbjeljivač:
Klorid vapna može se smatrati miješanom kalcijevom soli hlorovodonične i hipohlorne kiseline CaCl(OCl). U vlažnom zraku, izbjeljivač, u interakciji s vodom i ugljičnim dioksidom, postupno oslobađa hipoklornu kiselinu, koja osigurava njegova svojstva izbjeljivanja, dezinfekcije i otplinjavanja:
Kada je izbjeljivač izložen klorovodičnoj kiselini, oslobađa se slobodni klor:
Kada se zagrije, hipoklorovita kiselina se razgrađuje kao rezultat redoks nesrazmjernosti da nastane hlorovodonična i perhlorična kiselina:
![]()
Kada se hlor propušta kroz vrući rastvor alkalija, kao što je KOH, nastaju kalijum hlorid i kalijum hlorat KClO 3 (Bertholletova so):
Oksidirajuća sposobnost anjona hlornih kiselina koje sadrže kiseonik u vodenim rastvorima u seriji SlO - - SlO4(-) opada uprkos povećanju stepena oksidacije hlora u njima:
![]()
Ovo se objašnjava povećanjem stabilnosti anjona u ovoj seriji zbog povećane delokalizacije njihovog negativnog naboja. Istovremeno, LiC10 4 i KClO 4 perhlorati u suhom stanju na visokim temperaturama su jaki oksidanti i koriste se za mineralizaciju različitih biomaterijala pri određivanju anorganskih komponenti koje sadrže.
Halogeni anjoni (osim F-) su sposobni da doniraju elektrone, tako da su redukcioni agensi. Kako se njihov radijus povećava, smanjuje se sposobnost halogenih aniona od kloridnog aniona do jodidnog aniona:

Dakle, jodovodonična kiselina se oksidira atmosferskim kisikom već na normalnoj temperaturi:
![]()
Hlorovodonična kiselina se ne oksidira kiseonikom, pa je hloridni anjon stabilan u tjelesnim uvjetima, što je sa stanovišta fiziologije i medicine veoma važno.
Kiselinsko-bazna svojstva. Halogenidi vodonika HF, HC1, HBr, HI, zbog polariteta svojih molekula, vrlo su rastvorljivi u vodi. U tom slučaju dolazi do hidratacije molekula, što dovodi do njihove disocijacije sa stvaranjem hidratiziranih protona i halogenih aniona. Jačina kiselina u seriji HF, HC1, HBr, HI raste zbog povećanja radijusa i polarizabilnosti anjona od F- do I-.
Hlorovodonična kiselina, kao komponenta želudačnog soka, igra važnu ulogu u procesu probave. Uglavnom zbog hlorovodonične kiseline čiji je maseni udio u želučanom soku 0,3%, pH joj se održava u rasponu od 1 do 3. Hlorovodonična kiselina pospješuje prelazak enzima pepsina u njegov aktivni oblik, koji osigurava probavu proteina zbog hidrolitičkog cijepanja peptidnih veza sa stvaranjem različitih aminokiselina:
Određivanje sadržaja hlorovodonične kiseline i drugih kiselina u želučanom soku razmatrano je u odjeljku. 8.3.3.
U nizu kiselina klora koje sadrže kisik, kako se njegovo oksidacijsko stanje povećava, jačina kiselina se povećava.

To je zbog povećanja polariteta O-H veze zbog pomaka njene elektronske gustoće prema atomu hlora, kao i zbog povećanja stabilnosti anjona.
Kompleksna svojstva. Halogeni anioni imaju tendenciju da formiraju komplekse kao ligande. Stabilnost halogenih kompleksa obično opada u redu F- > Cl- > Br- > > I-. To je proces nastajanja kompleksa koji objašnjava toksični učinak fluoridnih aniona, koji formiranjem kompleksa fluorida sa metalnim kationima uključenim u aktivne centre enzima potiskuju njihovu aktivnost.
Molekul joda pokazuje zanimljiva svojstva formiranja kompleksa. Dakle, rastvorljivost molekularnog joda u vodi naglo raste u prisustvu kalijum jodida, što je povezano sa stvaranjem kompleksnog anjona
Niska stabilnost ovog kompleksnog jona osigurava prisustvo molekularnog joda u rastvoru. Stoga se u medicini kao baktericidno sredstvo koristi vodena otopina joda s dodatkom KI. Osim toga, molekularni jod formira inkluzijske komplekse sa škrobom (odjeljak 22.3) i polivinil alkoholom (plavi jod). U ovim kompleksima, molekule joda ili njihovi pridruženi anioni jodida ispunjavaju kanale formirane spiralnom strukturom odgovarajućih polihidroksi polimera. Inkluzioni kompleksi nisu vrlo stabilni i sposobni su za postepeno oslobađanje molekularnog joda. Stoga je lijek kao što je plavi jod djelotvorno, ali blago, dugodjelujuće baktericidno sredstvo.
Biološka uloga i upotreba halogena i njihovih spojeva u medicini. Halogeni u obliku raznih jedinjenja su dio živih tkiva. U organizmu svi halogeni imaju oksidaciono stanje 1. Istovremeno, hlor i brom postoje u obliku hidratisanih Cl- i Br- aniona, a fluor i jod su deo biosupstrata nerastvorljivih u vodi:
Jedinjenja fluora su komponente koštanog tkiva, noktiju i zuba. Biološki efekat fluora prvenstveno je povezan sa problemom zubnih bolesti. Fluoridni anion, zamjenjujući hidroksidni ion u hidroksiapatitu, formira sloj zaštitne cakline od čvrstog fluorapatita:
Fluorizacija vode za piće do koncentracije fluoridnih jona od 1 mg/l i dodavanje natrijum fluorida u pastu za zube značajno smanjuju karijes u populaciji. Istovremeno, kada je koncentracija anjona fluorida u vodi za piće iznad 1,2 mg/l, povećava se krhkost kostiju i zubne cakline i javlja se opšta iscrpljenost organizma tzv. fluoroza.
Hloridni anjoni obezbeđuju protok jona kroz ćelijske membrane, učestvuju u održavanju osmotske homeostaze i stvaraju povoljno okruženje za delovanje i aktivaciju protolitičkih enzima želudačnog soka.
Bromidni anjoni u ljudskom tijelu lokalizirani su uglavnom u hipofizi i drugim endokrinim žlijezdama. Utvrđeno je prisustvo dinamičke veze između sadržaja bromidnih i hloridnih anjona u organizmu. Dakle, povećani sadržaj bromidnih aniona u krvi potiče brzo oslobađanje kloridnih aniona u bubrezima. Bromidi su uglavnom lokalizirani u međućelijskoj tekućini. Oni pojačavaju inhibitorne procese u neuronima moždane kore, pa se kalijum, natrij i bromokafor bromidi koriste u farmakologiji.
Jod i njegova jedinjenja utiču na sintezu proteina, masti i hormona. Više od polovine količine joda nalazi se u štitnoj žlijezdi u vezanom stanju u obliku tiroidnih hormona. Kod nedovoljnog unosa joda u organizam nastaje endemska struma. U cilju prevencije ove bolesti kuhinjskoj soli se dodaje NaI ili KI (1-2 g na 1 kg NaCl). Dakle, svi halogeni su neophodni za normalno funkcionisanje živih organizama.
Poglavlje 13
DEFINICIJA
Halogeni– Elementi VIIA grupe – fluor (F), hlor (Cl), brom (Br) i jod (I).
Elektronska konfiguracija vanjskog energetskog nivoa halogena ns 2 np 5. Budući da halogenima nedostaje samo jedan elektron prije nego što završe energetski nivo, u ORR-u najčešće ispoljavaju svojstva oksidacijskih sredstava. Oksidacijska stanja halogena: od “-1” do “+7”. Jedini element halogenske grupe, fluor, pokazuje samo jedno oksidaciono stanje "-1" i najelektronegativniji je element.
Molekuli halogena su dvoatomni: F 2, Cl 2, Br 2, I 2. Sa povećanjem naboja jezgra atoma nekog hemijskog elementa, tj. pri prelasku s fluora na jod smanjuje se oksidacijska sposobnost halogena, što potvrđuje i sposobnost da niže halogene istiskuju višim iz halogenovodičnih kiselina i njihovih soli:
Br 2 + 2HI = I 2 + 2HBr
Cl 2 + 2KBr = Br 2 + 2KCl
Fizička svojstva halogena
Na br. fluor je svijetložuti plin oštrog mirisa. Otrovno. Hlor je gas svetlo zelene boje, baš kao i fluor, ima oštar miris. Jako otrovno. Pri povišenom pritisku i sobnoj temperaturi lako prelazi u tečno stanje. Brom je teška tečnost crveno-braon boje sa karakterističnim neprijatnim oštrim mirisom. Tečni brom, kao i njegove pare, veoma su otrovni. Brom je slabo rastvorljiv u vodi i dobro u nepolarnim rastvaračima. Jod je tamno siva čvrsta supstanca sa metalnim sjajem. Jodna para je ljubičasta. Jod se lako sublimira, tj. prelazi u gasovito stanje iz čvrstog, zaobilazeći tečno stanje.
Proizvodnja halogena
Halogeni se mogu dobiti elektrolizom otopina ili talina halogenida:
MgCl 2 = Mg + Cl 2 (rastop)
Najčešće se halogeni dobivaju reakcijom oksidacije halogenovodičnih kiselina:
MnO 2 + 4HCl = MnCl 2 + Cl 2 +2H 2 O
K 2 Cr 2 O 7 + 14HCl = 3Cl 2 + 2KCl +2CrCl 3 +7H 2 O
2KMnO 4 +16HCl = 2MnCl 2 +5Cl 2 +8H 2 O +2KCl
Hemijska svojstva halogena
Najveću hemijsku aktivnost ima fluor. Većina hemijskih elemenata, čak i na sobnoj temperaturi, stupa u interakciju sa fluorom, oslobađajući veliku količinu toplote. Čak i voda gori u fluoru:
2H 2 O + 2F 2 = 4HF + O 2
Slobodni hlor je manje reaktivan od fluora. Ne reaguje direktno sa kiseonikom, azotom i plemenitim gasovima. U interakciji je sa svim drugim supstancama poput fluora:
2Fe + Cl 2 = 2FeCl 3
2P + 5Cl 2 = 2PCl 5
Kada hlor stupi u interakciju s vodom na hladnoći, dolazi do reverzibilne reakcije:
Cl 2 + H 2 O↔HCl +HClO
Smjesa produkta reakcije naziva se hlorna voda.
Kada hlor interaguje sa alkalijama na hladnoći, nastaju mešavine hlorida i hipohlorita:
Cl 2 + Ca(OH) 2 = Ca(Cl)OCl + H 2 O
Kada se hlor otopi u vrućoj otopini lužine, dolazi do sljedeće reakcije:
3Cl 2 + 6KOH=5KCl +KClO 3 +3H 2 O
Brom se, kao i hlor, otapa u vodi i, delimično reagujući s njom, formira takozvanu „bromnu vodu“, dok je jod praktički nerastvorljiv u vodi.
Jod se značajno razlikuje po hemijskoj aktivnosti od ostalih halogena. Ne reaguje sa većinom nemetala, a sa metalima reaguje sporo samo kada se zagreje. Interakcija joda s vodikom događa se samo uz jako zagrijavanje; reakcija je endotermna i vrlo reverzibilna:
H 2 + I 2 = 2HI - 53 kJ.
Primjeri rješavanja problema
PRIMJER 1
| Vježbajte | Izračunajte zapreminu hlora (br.) koji je reagovao sa kalijum jodidom ako je nastao jod mase 508 g |
| Rješenje | Napišimo jednačinu reakcije: Cl 2 + 2KI = I 2 + 2KCl Nađimo količinu nastalog joda: v(I 2)=m(I 2)/M(I 2) v(I 2)=508/254=2 mol Prema jednadžbi reakcije, količina supstance hlora. Iz udžbenika hemije mnogi ljudi znaju da halogeni uključuju hemijske elemente periodnog sistema Mendeljejeva iz grupe 17 u tabeli. Prevedeno sa grčkog kao rođenje, porijeklo. Gotovo svi su vrlo aktivni, zbog čega burno reagiraju s jednostavnim tvarima, s izuzetkom nekoliko nemetala. Šta su halogeni i koja su njihova svojstva? U kontaktu sa Lista halogenaHalogeni su dobri oksidanti, iz tog razloga se u prirodi mogu naći samo u nekim jedinjenjima. Što je veći atomski broj, to je manja hemijska aktivnost elemenata ove grupe. Halogena grupa uključuje sljedeće elemente:
Potonji je razvijen na Institutu za nuklearna istraživanja, koji se nalazi u gradu Dubna. Fluor je otrovan gas blijedožute boje. Hlor je takođe otrovan. Ovo je plin koji ima prilično oštar i neugodan miris svijetlozelene boje. Brom ima crvenkasto-smeđu boju i toksična je tečnost koja čak može uticati na čulo mirisa. Veoma je isparljiv, pa se čuva u ampulama. Jod je kristalna, lako sublimirana, tamnoljubičasta supstanca. Astatin je radioaktivan, kristalna boja: crna sa plavom, poluživot je 8,1 sat.
Fluor je u interakciji sa inertnim gasovima i ozračen je (Xe + F 2 = XeF 2 + 152 kJ). Kada se zagrije, fluor djeluje na druge halogene, oksidirajući ih. Formula važi: Hal 2 + F 2 = 2HalF, gde je Hal = Cl, Br, I, At, u slučaju kada su HalF oksidaciona stanja hlora, broma, joda i astatina jednaka +1. Fluor također vrlo energično stupa u interakciju sa složenim supstancama. Posljedica je oksidacija vode. U tom slučaju dolazi do eksplozivne reakcije koja se ukratko zapisuje formulom: 3F 2 + ZH 2 O = OF 2 + 4HF + H 2 O 2. HlorAktivnost slobodnog hlora je nešto manja od fluora, ali ima i dobru sposobnost reakcije. To se može dogoditi u interakciji s mnogim jednostavnim supstancama, s rijetkim izuzecima u obliku kisika, dušika i inertnih plinova. On može burno reagirati sa složenim supstancama, stvarajući supstitucijske reakcije, svojstvo dodavanja ugljovodonika takođe je svojstveno hloru. Kada se zagrije, brom ili jod se istiskuju iz jedinjenja sa vodonikom ili metalima.
Cl2+ hν → 2Cl, Cl + H2 → HCl + H, H + Cl2 → HCl + Cl, Cl + H2 → HCl + H, itd. Fotoni, kada su pobuđeni, uzrokuju razgradnju molekula Cl 2 na atome i dolazi do lančane reakcije koja uzrokuje pojavu novih čestica koje pokreću početak sljedeće faze. U istoriji hemije ovaj fenomen je proučavan. Ruski hemičar i dobitnik Nobelove nagrade N. N. Semenov. 1956. je proučavao fotohemijsku lančanu reakciju i time dao veliki doprinos nauci. Klor reaguje sa mnogim složenim supstancama, to su reakcije supstitucije i adicije. Dobro se otapa u vodi. Cl 2 + H 2 O = HCl + HClO - 25 kJ. Sa alkalijama, kada se zagreje, hlor može neproporcionalno.
Brom, jod i astatHemijska aktivnost broma je nešto manja od one gore spomenutog fluora ili hlora, ali je i prilično visoka. Brom se često koristi u tečnom obliku. On se, kao i hlor, veoma dobro rastvara u vodi. S njim dolazi do djelomične reakcije, omogućavajući dobivanje "bromne vode". Hemijska aktivnost joda značajno se razlikuje od ostalih predstavnika ove serije. Gotovo da ne stupa u interakciju s nemetalima, već sa Kod metala reakcija se odvija vrlo sporo i samo kada se zagrije. U tom slučaju dolazi do velike apsorpcije topline (endotermna reakcija), koja je vrlo reverzibilna. Osim toga Jod se ni na koji način ne može rastvoriti u vodi, to se ne može postići ni grijanjem, zbog čega “jodna voda” ne postoji u prirodi. Jod se može rastvoriti samo u rastvoru jodida. U tom slučaju nastaju kompleksni anioni. U medicini se ovo jedinjenje naziva Lugolova otopina. Astat reaguje sa metalima i vodonikom. U nizu halogena, hemijska aktivnost opada u pravcu od fluora do astatina. Svaki halogen u seriji F - At je sposoban da istisne sljedeće elemente iz spojeva s metalima ili vodonikom. Astatin je najpasivniji od ovih elemenata. Ali karakterizira ga interakcija s metalima. AplikacijaHemija je čvrsto ukorijenjena u naše živote, prodire u sva područja. Čovjek je naučio da koristi halogene, kao i njihove spojeve, za svoju korist. Biološki značaj halogena je neosporan. Njihova područja primjene su različita:
Klor je našao najrašireniju upotrebu u našim životima. Opseg njegove primjene je prilično raznolik. Primjeri korištenja:
Treba imati na umu da su halogeni vrlo otrovne tvari. Ovo svojstvo je posebno izraženo kod fluora. Halogeni mogu izazvati gušenje, iritaciju disajnih puteva i oštetiti biološko tkivo. Pare hlora mogu biti izuzetno opasne, kao i aerosol fluora, koji ima slab miris i može se osjetiti u visokim koncentracijama. Osoba može doživjeti efekat gušenja. Prilikom rada s takvim priključcima potrebno je poduzeti mjere opreza. Metode za proizvodnju halogena su složene i raznolike. U industriji se tome pristupa uz određene zahtjeve, koji se striktno poštuju. Više o temi |
 Visoka oksidaciona aktivnost halogena opada sa fluora na jod. Najaktivniji od njegove braće je fluor, koji ima sposobnost da reaguje sa bilo kojim metalom, formirajući soli, neki od njih se spontano zapale, oslobađajući ogromnu količinu toplote. Bez zagrijavanja, ovaj element reagira sa gotovo svim nemetalima, reakcije su praćene oslobađanjem određene količine topline (egzotermne).
Visoka oksidaciona aktivnost halogena opada sa fluora na jod. Najaktivniji od njegove braće je fluor, koji ima sposobnost da reaguje sa bilo kojim metalom, formirajući soli, neki od njih se spontano zapale, oslobađajući ogromnu količinu toplote. Bez zagrijavanja, ovaj element reagira sa gotovo svim nemetalima, reakcije su praćene oslobađanjem određene količine topline (egzotermne). Ovaj element ima poseban odnos sa vodonikom. Na sobnoj temperaturi i bez izlaganja svjetlosti, hlor ne reaguje ni na koji način na ovaj gas, ali kada se zagreje ili usmeri na svetlost, doći će do eksplozivne lančane reakcije. Formula je data u nastavku:
Ovaj element ima poseban odnos sa vodonikom. Na sobnoj temperaturi i bez izlaganja svjetlosti, hlor ne reaguje ni na koji način na ovaj gas, ali kada se zagreje ili usmeri na svetlost, doći će do eksplozivne lančane reakcije. Formula je data u nastavku: Od prirodnog jedinjenja kriolita, čija je hemijska formula sledeća: Na3AlF6, dobija se aluminijum. Jedinjenja fluora se široko koriste u proizvodnji paste za zube. Poznato je da fluor pomaže u prevenciji karijesa. Koristi se alkoholna tinktura joda za dezinfekciju i dezinfekciju rana.
Od prirodnog jedinjenja kriolita, čija je hemijska formula sledeća: Na3AlF6, dobija se aluminijum. Jedinjenja fluora se široko koriste u proizvodnji paste za zube. Poznato je da fluor pomaže u prevenciji karijesa. Koristi se alkoholna tinktura joda za dezinfekciju i dezinfekciju rana.