نظام عازلة الأمونيا. حلول عازلة. تصنيف المحاليل العازلة. آلية عملهم. آلية عمل المخازن المؤقتة
تعريف.
في الممارسة المعملية ، غالبًا ما يكون من الضروري العمل مع الحلول التي لها قيمة pH معينة. تسمى هذه الحلول حلول المخزن المؤقت.
حلول عازلة- الحلول التي لا يتغير الرقم الهيدروجيني لها عمليا عند إضافتها إليها كميات كبيرةالأحماض والقواعد أو عند تخفيفها.
يمكن أن تكون الحلول العازلة من أربعة أنواع:
1. حامض ضعيف وملحه.على سبيل المثال ، محلول منظم أسيتات CH 3 COOH + CH 3 COONa (الرقم الهيدروجيني = 4.7).
2... قاعدة ضعيفة وملحها.على سبيل المثال ، محلول الأمونيا العازلة NH 4 OH + NH 4 Cl (الرقم الهيدروجيني = 9.2).
3. محلول من أملاح حمضية.على سبيل المثال ، محلول الفوسفات العازلة NaH 2 PO 4 + Na 2 HPO 4 (الرقم الهيدروجيني = 8). في هذه الحالة ، يلعب الملح دور حمض ضعيف.
مخازن الأحماض الأمينية والبروتينات.
آلية العمل.
يعتمد عمل المحاليل العازلة على حقيقة أن الأيونات أو الجزيئات العازلة تربط أيونات H + أو OH - الأحماض أو القلويات التي يتم إدخالها فيها ، مع تكوين إلكتروليتات ضعيفة. على سبيل المثال ، إذا تمت إضافة حمض الهيدروكلوريك إلى محلول الأسيتات المؤقت CH 3 COOH + CH 3 COON ، فسيحدث التفاعل:
CH 3 COONa + HCl = CH 3 COOH + NaCl
CH 3 COO - + H + = CH 3 COOH
CH 3 COO - أيونات ، تتفاعل مع H + كاتيونات حمض الهيدروكلوريك ، تشكل جزيئات حمض الأسيتيك ، H + لا تتراكم في المحلول ، وبالتالي لا يتغير تركيزها عمليًا ، وبالتالي لا تتغير قيمة الرقم الهيدروجيني للمحلول.
عند إضافة القلويات (على سبيل المثال ، هيدروكسيد الصوديوم) إلى محلول الأسيتات ، يحدث التفاعل:
CH 3 COOH + NaOH = CH 3 COONa + H 2 O
CH 3 COOH + OH - = CH 3 COO - + H 2 O
تتحد H + كاتيونات حمض الأسيتيك مع OH - أيونات قلوية لتكوين الماء. ينخفض تركيز الحمض. بدلاً من الكاتيونات H + المستهلكة ، نتيجة لتفكك حمض الأسيتيك CH 3 COOH ، تظهر الكاتيونات H + مرة أخرى ويتم استعادة تركيزها السابق ولا تتغير قيمة الأس الهيدروجيني للمحلول.
القدرة العازلة.
يحافظ أي محلول منظم عمليًا على درجة حموضة ثابتة فقط حتى تتم إضافة كمية معينة من الحمض أو القلوي ، أي أنه يحتوي على درجة معينة خزان عازل.
القدرة العازلة -هذه هي الكمية المحددة (مول) لحمض قوي أو قلوي يمكن إضافته إلى لتر واحد من المحلول المنظم بحيث لا يتغير الرقم الهيدروجيني الخاص به بأكثر من واحد.
طبخ.
تكون خصائص التخزين المؤقت ضعيفة جدًا إذا كان تركيز أحد المكونات يختلف 10 مرات أو أكثر عن تركيز المكون الآخر. لذلك ، غالبًا ما يتم تحضير المحاليل العازلة عن طريق خلط المحاليل ذات التركيز المتساوي لكلا المكونين أو عن طريق إضافة كمية مناسبة من الكاشف إلى محلول مكون واحد ، مما يؤدي إلى تكوين تركيز متساوٍ للشكل المترافق.
لتحضير خليط محلول الأمونيا ، اخلط 100 مل من محلول NH 4 Cl مع كسر كتلي 10٪ و 100 مل من محلول NH4 OH بكسر كتلة 10٪ وقم بتخفيف الخليط الناتج بالماء المقطر حتى 1 لتر.
تطبيق.
تستخدم المحاليل العازلة على نطاق واسع في التحليل الكيميائي ، التحليل البيوكيميائيلإنشاء والحفاظ على قيمة pH للوسط أثناء التفاعلات.
على سبيل المثال ، يتم فصل أيونات Ba 2+ عن أيونات Ca 2+ عن طريق الترسيب باستخدام Cr 2 O 7 2- أيونات ثنائي كرومات في وجود محلول عازل خلات ؛ عند تحديد العديد من الكاتيونات المعدنية باستخدام Trilon B عن طريق القياس المعقد ، يتم استخدام محلول عازلة للأمونيا.
تضمن المحاليل العازلة اتساق السوائل والأنسجة البيولوجية. أنظمة العازلة الرئيسية في الجسم هي الهيدروكربونات والهيموجلوبين والفوسفات والبروتين. علاوة على ذلك ، فإن عمل جميع أنظمة العازلة مترابط. ترتبط أيونات الهيدروجين المستلمة من الخارج أو المتكونة في عملية التمثيل الغذائي بأحد مكونات أنظمة العازلة. ومع ذلك ، في بعض الأمراض ، قد يحدث تغيير في قيمة الرقم الهيدروجيني في الدم. يسمى التحول من قيمة الرقم الهيدروجيني في الدم إلى المنطقة الحمضية من قيمة الرقم الهيدروجيني الطبيعي 7.4 الحماض، إلى المنطقة القلوية - قلاء.يحدث الحماض في أشكال حادة من داء السكري ، والعمل البدني المطول والعمليات الالتهابية. قد يحدث القلاء إذا كان القصور الكلوي أو الكبدي شديدًا ، أو إذا كان التنفس ضعيفًا.
السوائل والأنسجة والأعضاء البيولوجية.
يتم التعبير عن ذلك بقيم ثابتة إلى حد ما للأس الهيدروجيني للوسائط البيولوجية (الدم ، واللعاب ، وعصير المعدة ، وما إلى ذلك) وقدرة الجسم على استعادة قيم الأس الهيدروجيني الطبيعية عند تعرضها للحصص الأولية. دعم النظام التوازن البروتوليتي ،لا يشمل فقط الآليات الفسيولوجية (التعويض الرئوي والكلوي) ، ولكن أيضًا فيزيائيًا كيميائيًا: التخزين المؤقت والتبادل الأيوني والانتشار.
يعد ضمان ثبات درجة الحموضة في الدم والأعضاء والأنسجة الأخرى أحد أهم شروط الوجود الطبيعي للكائن الحي. يتم تحقيق هذا الحكم من خلال وجود العديد من الأنظمة التنظيمية في الجسم ، وأهمها الأنظمة العازلة. يلعب الأخير دورًا رئيسيًا في الحفاظ على KOR في الجسم.
بالإضافة إلى ذلك ، فإن المواد المتعلقة بهذا الموضوع ضرورية لدراسة الموضوعات اللاحقة للموضوع (قياس الجهد ، وخصائص حلول اللولب ، وما إلى ذلك) والتخصصات مثل الكيمياء الحيوية ، وعلم الأحياء الدقيقة ، وعلم الأنسجة ، والنظافة ، وعلم وظائف الأعضاء ، في الأنشطة العملية لـ طبيب في تقييم نوع وخطورة انتهاكات اتفاقية حقوق الطفل.
حلول عازلةوتسمى المحاليل التي تحافظ على قيم الأس الهيدروجيني غير المتغيرة عند تخفيفها أو إضافتها بكمية صغيرة من حمض أو قاعدة قوية.المحاليل العازلة البروتوليتية عبارة عن مخاليط من الإلكتروليتات التي تحتوي على أيونات تحمل الاسم نفسه.
هناك نوعان رئيسيان من المحاليل العازلة التحلل:
أي حمضي يتكون من حمض ضعيف وفائض من قاعدة مقترنة به (الملح يتكون من قاعدة قوية وأنيون هذا الحمض). على سبيل المثال: CH 3 COOH و CH 3 COONa - عازلة أسيتات
CH 3 COOH + H 2 O ↔ H 3 O + + CH 3 COO - فائض من المترافق
حمض الأساس
CH 3 COONa → Na + + CH 3 COO -
الأساسية ، أي يتكون من قاعدة ضعيفة وفائض من الحمض المترافق (أي ملح يتكون من حمض قوي وكاتيون من هذه القاعدة). على سبيل المثال: NH 4 OH و NH 4 Cl - محلول الأمونيا.
NH 3 + H 2 O ↔ OH - + NH 4 + فائض من المترافق
قاعدة حمضية
NH 4 Cl → Cl - + NH 4 +
يتم حساب معادلة نظام المخزن المؤقت باستخدام صيغة Henderson-Hasselbach:
الرقم الهيدروجيني = pK + السجل ، الرقم الهيدروجيني = pK + السجل ،
حيث pK = -lg K D.
C - التركيز المولي أو ما يعادله من المنحل بالكهرباء (C = V N)
آلية عمل المخازن المؤقتة
دعنا نعتبرها في مثال المخزن المؤقت للأسيتات: CH 3 COOH + CH 3 COONa
يرجع التركيز العالي لأيونات الأسيتات إلى التفكك الكامل لإلكتروليت قوي - أسيتات الصوديوم ، وحمض الخليك في وجود الأنيون الذي يحمل نفس الاسم موجود في محلول في شكل غير مؤين تقريبًا.
1. عند إضافة كمية صغيرة من حمض الهيدروكلوريك ، ترتبط أيونات H + بالقاعدة المترافقة CH 3 COO - الموجودة في المحلول ، في إلكتروليت ضعيف CH 3 COOH.
CH 3 COO‾ + H + CH 3 COOH (1)
توضح المعادلة (1) أنه يتم استبدال حمض الهيدروكلوريك القوي بكمية مكافئة من الحمض الضعيف CH 3 COOH. تزداد كمية CH 3 COOH ووفقًا لقانون التخفيف لـ V. Ostwald ، تقل درجة التفكك. نتيجة لذلك ، يزداد تركيز أيونات H + في المخزن المؤقت ، ولكن بشكل ضئيل للغاية. يبقى الرقم الهيدروجيني ثابتًا.
عند إضافة حمض إلى المخزن المؤقت ، يتم تحديد الرقم الهيدروجيني بواسطة الصيغة:
الرقم الهيدروجيني = pK + lg
2. عند إضافة كمية صغيرة من القلويات إلى المخزن المؤقت ، فإنها تتفاعل مع CH 3 COOH. سوف تتفاعل جزيئات حمض الخليك مع أيونات الهيدروكسيد لتكوين H 2 O و CH 3 COO:
CH 3 COOH + OH ‾ ↔ CH 3 COO‾ + H 2 O (2)
نتيجة لذلك ، يتم استبدال القلوي بكمية مكافئة من الملح الأساسي الضعيف CH 3 COONa. تنخفض كمية CH 3 COOH ووفقًا لقانون التخفيف لـ V. Ostwald ، تزداد درجة التفكك بسبب الحموضة المحتملة لبقية جزيئات CH 3 COOH غير المنفصلة. وبالتالي ، فإن تركيز أيونات H + عمليًا لا يتغير. يبقى الرقم الهيدروجيني ثابتًا.
عند إضافة القلويات ، يتم تحديد الأس الهيدروجيني بواسطة الصيغة:
الرقم الهيدروجيني = pK + lg
3. عندما يتم تخفيف المخزن المؤقت ، لا يتغير الأس الهيدروجيني أيضًا ، لأن ثابت التفكك ونسبة المكونات تبقى دون تغيير.
وبالتالي ، يعتمد الرقم الهيدروجيني للعازل على: ثوابت التفكك ونسب تركيز المكون. كلما زادت هذه القيم ، زاد الرقم الهيدروجيني للمخزن المؤقت. سيكون الرقم الهيدروجيني للعازل أعلى عندما تكون نسبة المكونات مساوية لواحد.
لتوصيف المخزن المؤقت كمياً ، يتم تقديم المفهوم خزان عازل.
الحجم: بكسل
بدء العرض من الصفحة:
كشف الدرجات
2 الأسئلة الرئيسية: 1. النظم العازلة ، والتكوين وآلية عملها 2. خلات ، الفوسفات ، الأمونيا ، الهيدروكربونات ، مخازن الهيموغلوبين 3. حساب درجة الحموضة للمحاليل العازلة. 4. السعة العازلة والعوامل المؤثرة عليها 5. قيمة النظم العازلة للكيمياء والبيولوجيا والطب والصيدلة
3 في عملية التمثيل الغذائي في أجسامنا ، يتم إطلاق الكثير من أحماض الهيدروكلوريك والبيروفيك واللاكتيك. ولكن في الكائن الحي يتم الحفاظ عليها بدقة. يتم الحفاظ على ثبات الأس الهيدروجيني للوسائط البيولوجية ليس فقط بمساعدة الآليات الفسيولوجية (التعويض الرئوي والكلوي) ، ولكن أيضًا بمساعدة عمل التخزين المؤقت الفيزيائي الكيميائي والتبادل الأيوني والانتشار. يتم ضمان الحفاظ على التوازن الحمضي القاعدي عند مستوى معين على المستوى الجزيئي من خلال عمل الأنظمة العازلة.
4 الحلول التي تحافظ على قيمة pH ثابتة عند إضافة كميات صغيرة من الأحماض والقلويات القوية ، وكذلك عند تخفيفها ، تسمى أنظمة العازلة الأولية. تسمى قدرة بعض المحاليل على الحفاظ على تركيز أيونات الهيدروجين دون تغيير حركة التخزين المؤقت ، وهي الآلية الرئيسية لاستتباب الحالة الأولية. المحاليل العازلة هي مخاليط من قاعدة ضعيفة أو حمض ضعيف وأملاحها. في المحاليل العازلة ، وفقًا لنظرية برونستيد لوري ، فإن المكونات "النشطة" الرئيسية هي البروتونات الحاملة.
5 يمكن تحضير المحاليل العازلة بطريقتين: 1. المعادلة الجزئية لإلكتروليت ضعيف مع إلكتروليت قوي: CH 3 COOH (فائض) + هيدروكسيد الصوديوم. هيدروكسيد الصوديوم (فائض) + حمض الهيدروكلوريك 2. عن طريق خلط محاليل الإلكتروليت الضعيفة مع أملاحها (أو أملاحان): CH 3 COOH و CH 3 COONa ؛ NH 3 و NH 4 Cl ؛ NaH 2 PO 4 و Na 2 HPO 4
6 السبب في ظهور جودة جديدة للعمل العازل في المحاليل هو مزيج من عدة موازنات بروتوليتي B (قاعدة) + H + HB + (حمض كوبريك) HA (حمض) H + + A - (قاعدة مترافقة) حمض مترافق - أزواج القاعدة HB + / Vi HA / A - تسمى أنظمة عازلة ، وهي عبارة عن توازن مشترك لعمليات التأين والتحلل المائي.
7 وهكذا ، تتكون أنظمة المخزن المؤقت الأولية من: مكونين. 1. ضعف المرافقة. القاعدة الحمضية II. ضعف القاعدة المترافق. حمض أحد المكونات يربط H + لحمض قوي ، OH الآخر - من قلوي قوي.
8 تصنيف النظم العازلة I. نظم عازلة الحمض. هم خليط من حمض ضعيف HA (مانح بروتون) وأملاحه A - (مستقبل البروتون). q الأسيتات: CH 3 COOH + CH 3 COONa CH 3 3 COOH COO q الهيدروكربونات: حمض ضعيف قاعدة مقترنة H 2 CO HCO 3 3
9 II. أنظمة عازلة أساسية. هم خليط من قاعدة ضعيفة (متقبل البروتون) وملحها (بروتون مانح). نظام عازلة الأمونيا: خليط من قاعدة ضعيفة NH 3 H 2 O (متقبل البروتون) وملح الإلكتروليت القوي NH + 4 (مانح بروتون). منطقة عازلة 8.2-10.2 NH 4 NH OH + 4 حمض متقارن ذو قاعدة ضعيفة
10 ثالثا. أنظمة المحلول الملحي. KH 2 PO 4 + K 2 HPO 4 داخل الخلايا NaH 2 PO 4 + Na 2 HPO 4 خارج الخلية نظام Hydrophosphate العازلة (منطقة عمل المخزن المؤقت pH 6.2 8.2). إنه خليط من حمض ضعيف Н 2 РО - 4 (مانح بروتون) و eesolinro 2-4 (بروتون متقبل) Н 2РО НРО حمض ضعيف قاعدة مقترنة
11 رابعا. أنظمة تخزين الأحماض الأمينية والبروتينات. يبدأ تأثير التخزين المؤقت لأنظمة التخزين المؤقت هذه في الظهور عند إضافة كمية معينة من الحمض أو القلويات إليها. يتكون خليط من شكلين من البروتين: أ) ضعيف "حمض البروتين" + ملح من هذا الحمض الضعيف ب) "قاعدة بروتينية" ضعيفة + ملح من هذه القاعدة الضعيفة
12 حساب أنظمة عازلة الأس الهيدروجيني (معادلة Henderson-Hasselbach) باستخدام مثال محلول محلول الأسيتات ، ضع في اعتبارك حساب أنظمة العازلة. CH COOH CH COONa أسيتات الصوديوم عمليًا 3 تتحلل تمامًا إلى أيونات: CH 3 COONa CH 3 COO - + H + 3 يتفكك حمض الأسيتيك فقط إلى حد صغير: CH 3 COOH CH 3 COO - + H + تطبيق قانون التأثير الجماعي على معادلة تفكك حمض الخليك:
13 في وجود أسيتات الصوديوم ، يتحول توازن تفكك حمض الأسيتيك بشدة إلى اليسار وفقًا لمبدأ Le Chatelier. تقريبًا كل الحمض الموجود في مثل هذا المحلول غير مفكك ، ولا يتفكك سوى كمية صغيرة منه ، مكونًا أيونات H + وتوفير محلول حمضي. لذلك ، فإن تركيز التوازن للحمض غير المنفصل في هذا المحلول يساوي عمليا تركيزه الكلي ، أي C (CH 3 COOH) يساوي. ج (حامض). تركيز أيونات الأسيتات في الخليط العازل يساوي عمليا التركيز الأولي للملح: C (CH 3 COO -) C (ملح).
14 في معادلة ثابت تفكك حمض الأسيتيك ، نعوض عن التركيز الكلي للحمض والملح ، نحصل على K d = C C k you. lgcd = pk acid ، ثم + = K d C C k أنت الملح
15 ph = pk to you lg С С to you salts or ph = pk to you + log С С acid salts هذه المعادلة تسمى معادلة Henderson-Hesselbach. هذه هي المعادلة الأساسية المستخدمة لوصف التوازن الحمضي القاعدي في النظم البيولوجية.
16 بعد استنتاج مماثل للأنظمة العازلة الرئيسية: poh ph = = 14 pk basic pk + basic log С log С (salts) (bases) С С (salts) (bases) طبيعة المنحل بالكهرباء ضعيف (pk (حمض) ، pk (القاعدة) ، على نسبة تركيزات الملح والحمض (القاعدة) ودرجة الحرارة.
17 وتجدر الإشارة إلى أن الأنظمة العازلة تحافظ بشكل فعال على الرقم الهيدروجيني في النطاق: pk (الأحماض) ± 1 للأنظمة الحمضية ؛ 14 (باك (قواعد) ± 1) للأنظمة الأساسية. آلية عمل الأنظمة العازلة. 1. التخفيف. عند تخفيفه بالماء ، ينخفض تركيز الحمض والملح بالماء ونفس العدد من المرات ، لا تتغير النسبة lg C (ملح) / C (حمض) ، لذلك لا يتغير الرقم الهيدروجيني للمحلول المنظم عمليًا. بالإضافة إلى ذلك ، فإن pk من الحمض أو pk القاعدة مستقلة عن التخفيف. 2- إضافة الأحماض والقواعد. عندما يتم إضافة كمية صغيرة من أيون حامض قوي + (تتشكل أثناء التفكك) إلى المخزن المؤقت للأسيتات
18 مرتبطة بالأيونات المشبعة ، الموجودة بشكل زائد ، مع تكوين جزيئات CH 3 COOH المنفصلة بشكل ضعيف. درجة تفكك CH 3 COOH صغيرة وتركيز [H +] عمليا لا يتغير ، سوف ينخفض الرقم الهيدروجيني للمحلول المنظم ، ولكن بشكل ضئيل. CH 3 COOH CH 3 COONa + HCl CH 3 COOH + NaCl x x x المخزن المؤقت phfl ph = pk to you + log C С salts to you x + x
19 عند إضافة كمية صغيرة من هيدروكسيد الصوديوم ، يتم تحييد أيونات OH بواسطة المكون الحمضي للمحلول المنظم ، مكونًا جزيئات الماء. CH 3 COOH + NaOH CH 3 COONa + H 2 O xxx CH 3 COONa. نتيجة لذلك ، يتم استبدال القاعدة القوية المضافة بكمية مكافئة من قاعدة ضعيفة مقترنة CH 3 COO - مما يؤثر على تفاعل الوسط مع a مدى أقل. يزيد الرقم الهيدروجيني لمحلول العازلة ، ولكن ليس بشكل كبير.
20 الرقم الهيدروجيني pH = pk لك + سجل C С ملح لك + x x مثال: قارن التغير في الرقم الهيدروجيني عند تمرير 0.01 مول من كلوريد الهيدروجين خلال 1 لتر: محلول عازل خلات يحتوي على 0.1 مول / لتر ملح وحمض ؛ v الماء المقطر القيمة الأولية للرقم الهيدروجيني للمحلول المنظم تساوي pH = rxn 3 COOH = 4.75 ، منذ ذلك الحين C لك = ملح C بعد إضافة HCl: pH = 4.75 + log 0.1 0.01 0.1 + 0.01 pH = 4.66 ؛ ΔрН = 4 ، = 0.09 وحدة أس هيدروجيني
21 v ph = 7 للماء المقطر. بعد المرور 0.01 مول من حمض الهيدروكلوريك ph = -lg 0.01 = 2 ؛ ΔрН = 7 2 = 5 وحدات أس هيدروجيني إن قدرة المحلول المنظم على الحفاظ على الرقم الهيدروجيني كحمض قوي أو قلوي قوي تضاف عند مستوى ثابت تقريبًا بعيدًا عن أن تكون غير محدودة ومحدودة بقيمة ما يسمى بقدرة التخزين المؤقت.
22 سعة المخزن سعة المخزن المؤقت (B) هي عدد مولات الحمض القوي أو المكافئ القلوي الذي يجب إضافته إلى 1 لتر من محلول المخزن المؤقت من أجل إزاحة الرقم الهيدروجيني بمقدار واحد. يتم تحديد سعة المخزن المؤقت للنظام فيما يتعلق بالحمض المضاف (في الحمض) أو القاعدة (القلوية) (في القاعدة) ويتم حسابها بواسطة الصيغ: في الحمض. = C H (HA) ph - ph 0 V (HA) ، V (b.p.) H بشكل رئيسي. =، ph - ph V (B) V (b.p.) حيث V (HA)، V (B) - كميات من الحمض المضاف أو القلوي ، l ؛ C n = (HA) ، C n (B) التركيزات المولية لما يعادل الحمض والقلوي ، على التوالي ؛ V (b.r.) - حجم محلول المخزن المؤقت الأولي ، ل ؛ ph about، ph - قيم الأس الهيدروجيني للمحلول المنظم قبل وبعد إضافة الحمض أو القلوي ؛ ph-ph o - معامل الاختلاف. ج (ب) 0
23 يتم تحديد سعة التخزين المؤقت فيما يتعلق بالحمض (في الحمض) من خلال تركيز (عدد المكافئات) لخصائص الصنوبر المكون ؛ يتم تحديد سعة المخزن المؤقت فيما يتعلق باللمس (بشكل أساسي) من خلال تركيز (عدد المكافئات) للمكون والخصائص الحمضية في محلول المخزن المؤقت.
24 تعتمد سعة المخزن المؤقت على نسبة المكونات وتركيزها أ) نسبة المكونات حمض الملح 90 مليمول 10 مليمول = = = مليمول حمض الهيدروكلوريك + 10 مليمول حمض الهيدروكلوريك = = لوغاريتم 4 = 0.60 لوغار 0.67 = -0.17 = 0.67 سعة المخزن هو الحد الأقصى عندما تكون نسبة المكونات مساوية لواحد ، بينما B main = B acid ، arn = pk
ب) تركيز المكونات. كلما زاد التركيز ، زادت سعة المخزن المؤقت. حمض الملح 20 ملي مول 50 = 1 = 1 20 ملي مول مليمول حمض الهيدروكلوريك + 10 ملي مول حمض الهيدروكلوريك = 0.33 = 0 ، لوغاريتم 0.33 = 0.48 لوغاريتم 0.67 = -0.17
26 يقتصر استخدام أي نظام عازل على منطقة معينة من الأس الهيدروجيني: للأنظمة الحمضية = pk acid ± 1 ؛ بالنسبة للأنظمة الأساسية ، الرقم الهيدروجيني = 14 - (pk base ± 1). الخلاصة: تعتمد سعة المخزن المؤقت بشكل أساسي على نسبة تركيزات المكونات وتركيزاتها المطلقة ، وبالتالي على التخفيف. أنظمة عازلة لثبات درجة الحموضة في الدم الوسائط السائلةالجسم مدعوم بأنظمة عازلة: هيدروكربونات ، هيموجلوبين ، فوسفات ، بروتين. إن عمل جميع الأنظمة العازلة في الجسم مترابط ، مما يوفر السوائل البيولوجية بقيمة ثابتة من الأس الهيدروجيني. في البشر والحيوانات ، توجد أنظمة عازلة في الدم (البلازما وكريات الدم الحمراء) ، في الخلايا والمساحات بين الخلايا للأنسجة الأخرى.
27 يتم تمثيل أنظمة الدم العازلة بواسطة أنظمة عازلة للبلازما وأنظمة عازلة من كريات الدم الحمراء. أنظمة عازلة لبلازما الدم هيدروكربونات 35٪ بروتين. 7٪ فوسفات 2٪ pH = 7.4 44٪ دور الأخير غير مهم. أنها تمثل 44 ٪ من قدرة الدم العازلة. أنظمة عازلة من كريات الدم الحمراء pH = 7.25 خضاب الدم 35٪ هيدروكربونات 18٪ 56٪ نظام الفوسفات العضوي 3٪ نصيبهم يمثل 56٪ من قدرة الدم العازلة.
28 HYDROCARBONATE BUFFER SYSTEM يمثل نظام عازلة البيكربونات 53٪ من إجمالي سعة تخزين الدم (35٪ في البلازما ، 18٪ في كريات الدم الحمراء). يكاد يكون من المستحيل قياس تركيز حمض الكربونيك في الدم بشكل مباشر. لذلك ، بدلاً من إدخال تركيز ثاني أكسيد الكربون في معادلة Henderson-Hasselbach ، تأخذ هذه المعادلة الشكل التالي: pH = 6.1 + log حيث pk = log (n 2 CO 3) = 6.1
29 يُقاس الضغط الجزئي لثاني أكسيد الكربون CO 2 عمليًا في الدم ، ويُحسب تركيز ثاني أكسيد الكربون المذاب في البلازما بضربه في ثابت قابلية ذوبان ثاني أكسيد الكربون 2. إذا تم التعبير عنه بالكيلوباسكال (kPa) ، فإن ثابت التيار هو 0.23 ، إذا بوحدة مم. RT. فن. 0.03. لذلك ، إذا تم التعبير عن Р СО 2 بالكيلوباسكال ، فإن المعادلة تأخذ الشكل التالي: рн = 6.1 + لوغاريتم الضغط الجزئي لـ CО 2 في بلازما الدم عادة حوالي 5.3 كيلو باسكال (40 ملم زئبق) ، وهو ما يتوافق مع تركيز ثاني أكسيد الكربون ~ 1.2 ملي مول / لتر.
30 يكون الضغط الجزئي لثاني أكسيد الكربون في بلازما الدم عادة ~ 5.3 كيلو باسكال (40 ملم زئبق) ، وهو ما يتوافق مع تركيز ثاني أكسيد الكربون بمقدار 1.2 ملي مول / لتر. تركيز أيونات البيكربونات في السائل خارج الخلية عند Р СО 2 = 5.3 كيلو باسكال يساوي 24 مليمول / لتر. النسبة في السائل خارج الخلية [HCO - 3] / [CO 2] (كلا القيمتين في مليمول / لتر) هي 20: 1. وفقًا لمعادلة Henderson-Hasselbach ، فإن هذه النسبة تقابل الرقم الهيدروجيني لبلازما الدم التي تساوي 7.4: pH = 6.1 + log24 / 1.2 = 6.1 + log20 = 6.1 + 1.3 = 7.4 وبالتالي ، فإن التفاعل النشط لبلازما الشرايين الدم في الأشخاص الأصحاء يتوافق مع الرقم الهيدروجيني = 7.40.
31 نظرًا لوجود بيكربونات في الدم أكثر من ذلك ، فإن نظام عازلة الدم أعلى بكثير للأحماض منه للقواعد. إنها رائعة الأهمية البيولوجيةحيث في عملية التمثيل الغذائي ، يتم تكوين المزيد من الأحماض من القواعد. يحدد التركيز القلوية الاحتياطية في الدم. يتم تحديد الاحتياطي القلوي للدم بحجم ثاني أكسيد الكربون الذي يمتص بمقدار 100 سم 3 من الدم عند ملامسته لخليط غاز يحتوي على 5.5٪ من ثاني أكسيد الكربون عند ضغط 40 مم زئبق ، وهو ما يتوافق مع ضغط ثاني أكسيد الكربون في الرئتين. في الدم ، يكون الاحتياطي القلوي 50-65٪ (حجمي) من ثاني أكسيد الكربون.
32 الانخفاض في النسبة:< 20 является причиной ацидоза. Различают газовый инегазовый ацидоз. Ацидоз газовый возникает при высокой концентрации СО 2 во вдыхаемом воздухе, заболевании органов дыхания (пневмония), угнетение дыхательного центра (анестетики, седативные препараты). Негазовый ацидоз возникает при накоплении нелетучих продуктов обмена, при ожогах и воспалительных процессах. Повышение соотношения [НСО 3- ]/ [СО 2 ]>20 يؤدي الى القلاء.
33 القلاء الغازي الالتهاب الرئوي والربو نتيجة فرط التنفس ، بما في ذلك أثناء التهوية المكثفة للرئتين (انخفاض تركيز ثاني أكسيد الكربون). قلاء غير غازي فقدان كميات كبيرة من حمض الهيدروكلوريك أثناء القيء إفراز كميات كبيرة من حمض الهيدروكلوريك أثناء تناول مدرات البول. تناول كميات كبيرة من NaHCO 3 تناول طويل الأمد للمياه المعدنية مع صودا كبيرة. القلويات
34 المظاهر السريرية الرئيسية في الحماض والقلاء الحماض: تثبيط الجهاز العصبي المركزي ، مع درجة حموضة أقل من 7 ، والتثبيط يصل إلى درجة فقدان الاتجاه ؛ يقع الشخص في غيبوبة. زيادة التنفس من أجل إزالة ثاني أكسيد الكربون ، كتفاعل تكيفي القلاء: فرط الاستثارة الجهاز العصبي، الذي يصاحبه تقلصات توتونية (متشنجة) ؛ قد تحدث الوفاة من تقلص توتر عضلات الجهاز التنفسي
35 تصحيح حالة القاعدة الحمضية للجسم. كمساعدات طارئة للحماض ، يتم استخدام التسريب الوريدي لمحاليل بيكربونات الصوديوم ، ومع ذلك ، عندما يتم إعطاؤها ، نتيجة لتحييد لك ، يتم إطلاق ثاني أكسيد الكربون ، مما يقلل من فعالية العامل. هذا العيب يخلو من التريسامين ، الذي يربط البروتونات الزائدة: H 2 N-C (CH 2 OH) 3 + H + H 3 N + -C (CH 2 OH) 3. كما يستخدم لاكتات الصوديوم كوسيلة لتصحيح الحماض. للقضاء على ظاهرة القلاء ، يتم استخدام محلول حمض الأسكوربيك كإجراء مؤقت.
36 من الممكن أيضًا حدوث تغيير في درجة الحموضة في بيئات أخرى من الجسم ، على سبيل المثال ، في أجزاء مختلفة من الجهاز الهضمي ، وخاصة في المعدة. مع انخفاض حموضة عصير المعدة ، يتم وصف حمض الهيدروكلوريك المخفف ، مع زيادة مستحضرات مضادات الحموضة المختلفة: كربونات المغنيسيوم الأساسية Mg (OH) 2 4 MgCO 3 H 2 O ، أكسيد المغنيسيوم ، كربونات الكالسيوم والكالوماجين (حبيبات تحتوي على كربونات المغنيسيوم الأساسية وبيكربونات الصوديوم ) ... يعتمد العمل الدوائي لجميع العوامل المدرجة على تحييد p
37 نظام عازلة الهيموغلوبين يوجد نظام عازلة الهيموغلوبين فقط في كريات الدم الحمراء. ترتبط آلية عملها بإضافة الأكسجين وإطلاقه. في هذا الصدد ، أدى الهيموغلوبين (Hb) إلى أكسدة HHBO 2 وخفض أشكال HHB. ННв + О 2 2 Н + + HbO - 2 حمض ННв Н + + в قاعدة حمض مترافق آلية العمل بناءً على التفاعلات: قاعدة مترافقة
38 HbO - 2+ H + HHbO 2 HHb + O 2 قاعدة HHBO 2 حمض HHb + OH HbO H 2 O + OH HB + H 2 O acid Hb + H + HHb قلوي قوي يؤدي إلى رد فعل وقائي لنظام المخزن المؤقت للحفاظ عليه قيمة الأس الهيدروجيني الثابتة للوسط ، والتي يتم تفسيرها من خلال ارتباط H + و OH المضافين وتشكيل إلكتروليتات منخفضة الفصل.
39 يعمل نظام عازلة الهيموجلوبين في الجسم بفعالية فقط بالاشتراك مع نظام الهيدروكربونات. 1. بلازما الدم في بلازما الدم ، بسبب نظام عازلة الهيدروكربونات ، يحدث عدد من التفاعلات ، ونتيجة لذلك يتكون ثاني أكسيد الكربون. H 2 CO 3 + OH - H 2 O + HCO 3 - HCO 3 + H + H 2 CO 3 CO 2 H 2 O من بلازما الدم ، ينتشر ثاني أكسيد الكربون في كريات الدم الحمراء ، حيث يحفز إنزيم الأنهيدراز الكربوني تفاعله مع الماء ، مكونًا حمض الكربونيك. 2. كريات الدم الحمراء H 2 O + CO 2 H 2 CO 3
40 في كريات الدم الحمراء ، يزداد تركيز أيونات البيكربونات وفقًا للمخطط: HB - + H 2 CO 3 HHb + HCO - 3 تنتشر أيونات البيكربونات الناتجة في السائل خارج الخلية. يعود الدم الوريدي إلى الرئتين ، ويتفاعل الهيموغلوبين مع الأكسجين ويتشكل أوكسي هيموغلوبين. 3. يتفاعل أوكسي هيموغلوبين الرئتين مع أيونات الهيدروكربونات ННв + 2 2 ؛ ННвО 2 + НСО 3- вО 2- + 2 СО 3 2 СО 3 2 О + СО 2 من الرئتين تتم إزالة СО 2 في الغلاف الجوي بسبب التهوية الرئوية. هذه ، من حيث المبدأ ، آلية الحفاظ على التوازن الحمضي القاعدي.
41 أنظمة عازلة البروتين أنظمة عازلة البروتين هي حالة ampholytic ، لأن تتكون من أحماض أمينية α تحتوي على مجموعات ذات خصائص حمضية (COOH و NH + 3) وخصائص أساسية (COO و NH 2). يمكن تمثيل آلية عمل نظام المخزن المؤقت على النحو التالي: نظام المخزن المؤقت الحمضي أ) H 3 N + R COOH + OH H 3 N + R COO + H 2 O حمض البروتين ب) H 3 N + R COO + H + H 3 N + R COOH ملح البروتين الحمضي (قاعدة مترافقة)
42 نظام عازلة أساسي أ) H 2 NR COO + H + H 3 N + R COO بروتين قاعدة ب) H 3 N + R COO + OH H 2 NR COO + H 2 O ملح بروتين القاعدة (حمض متقارن) حيث R هو بقايا جزيئات السنجاب. إن دور بروتينات بلازما الدم في توازن أيونات الهيدروجين صغير جدًا. نظام عازلة الفوسفات يوجد نظام عازلة الفوسفات في كل من الدم والسائل الخلوي للأنسجة الأخرى ، وخاصة الكلى.
43 في الخلايا يتم تمثيله بواسطة KH 2 PO 4 و 2 HPO 4 ، في بلازما الدم والفضاء بين الخلايا - NaH 2 PO 4 و Na 2 HPO 4. الدور الرئيسي في آلية عمل هذا النظام يلعبه الأيون H 2 PO - 4: H 2 PO - 4 H + H 2 PO 2-4 الدقة الحمضية. القاعدة: تؤدي الزيادة في تركيز H + إلى حدوث تحول في رد الفعل إلى اليسار ، أي لتكوين الحمض: HPO 2-4 H + H 2 PO - 4 res. عازلة الفوسفات في الدم مرتبطة ارتباطًا وثيقًا بالبيكربونات. Н 2 СО 3 + НРО 2-4 Na НСО 3 + 2 РО - 4 في الدم في البول
44 نظام عازلة الأمونيوم يتكون في الكلى من الجلوتامين تحت تأثير الجلوتاميناز في تفاعل نزع الأمين التأكسدي. NH 3 H + NH + 4 poh = pk + lg NH 4 OH + R COOH R COONH 4
45 استخدام BS في مناطق أخرى حلول عازلةتمنع التربة الزيادة المفرطة في الحموضة أو القلوية ، وبالتالي تخلق وتحافظ على ظروف الحياة النباتية. لإنشاء وسيط بقيمة أس هيدروجيني معينة في البحث العلمي في العديد من عمليات الإنتاج التكنولوجي. للحفاظ على ثبات قيم الإمكانات الكهروكيميائية للأنظمة ، يتم استخدام BS ، التي تكمن أفعالها في التوازن.
الأسئلة الرئيسية: 1. الأنظمة العازلة ، تكوينها وآلية عملها 2. خلات ، فوسفات ، أمونيا ، هيدروكربونات ، مخازن هيموجلوبين 3. حساب درجة حموضة المحاليل العازلة. 4. القدرة والعوامل العازلة
أنظمة التخزين المؤقت. 1. تعريف وتصنيف وتكوين نظام العازلة. 2. آلية عمل التخزين المؤقت. 3. اشتقاق صيغة أنظمة عازلة الأس الهيدروجيني. 4. خصائص الأنظمة العازلة: التأثير على نسبة الأس الهيدروجيني
الجامعة الروسية الوطنية للبحوث الطبية دورة محاضرة في الكيمياء العامة والحيوية لطلاب كليات الطب وطب الأطفال وكليات طب الأسنان وموسكو وطب الفم الموضوع 6
محاضرات 910. أنظمة عازلة. 1 نظم العازلة مجموعة من عدة مواد في محلول يعطيها خصائص التخزين المؤقت، بمعنى آخر. القدرة على تحمل التغيير في التفاعل النشط للوسيط (ph) عند التخفيف ،
مؤسسة التعليم الفيدرالية للميزانية الحكومية تعليم عالىسميت جامعة ولاية فورونيج الزراعية بعد الإمبراطور بيتر الأول قسم الكيمياء تقرير موجز عن المواد غير العضوية
موضوع الدرس: BUFFER SOLUTIONS. الغرض من الدرس. لإتقان الأفكار حول تكوين وتصنيف وآلية عمل الأنظمة العازلة. تعلم كيفية تطبيق المواد النظرية لحساب الأس الهيدروجيني والعازل
المؤسسة التعليمية التابعة للدولة للتعليم المهني العالي "جامعة ولاية إيركوتسك الطبية" التابعة لوزارة الصحة الاتحاد الروسيقسم
وزارة التعليم والعلوم في الاتحاد الروسي جامعة ولاية نوفوسيبيرسك التعليمية المتخصصة ومركز علمي التوازن الكيميائي في الحلول نوفوسيبيرسك 01 أسيد-بيسك
4. مفهوم المحاليل العازلة تعريف الأنظمة العازلة وتصنيفها العديد من التفاعلات في المحلول تسير في الاتجاه الصحيح فقط عند تركيز معين من أيونات H +. تغييرها إلى ذلك
مثال .. قم ببناء مخطط توزيع لمحلول حمض الفوسفوريك في نطاق pH ، 0.0. احسب الكسور المولية للجسيمات عند الرقم الهيدروجيني = ، 5 ، 9 ،. التوازنات في محلول حامض الفوسفوريك:
الميزانية الفيدرالية للمؤسسة التعليمية للتعليم العالي في ولاية فورونيج الجامعة الزراعية التي سميت بعد EMPEROR PETER I قسم الكيمياء تقرير موجز بيولوجي
HYDROLYSIS المفاهيم العامة التحلل المائي هو تفاعل تبادلي لتفاعل المواد مع الماء ، مما يؤدي إلى تحللها. غير عضوي و المواد العضويةفصول مختلفة.
2 3 مقدمة مستوى عالالمعرفة والحراك الأكاديمي والاجتماعي ، والكفاءة المهنية للمتخصصين ، والاستعداد للتعليم الذاتي وتحسين الذات من متطلبات اليوم. ونتيجة لهذا
وزارة الصحة في أوكرانيا ، جامعة خاركيف الطبية الوطنية ، النظم العازلة ، المبادئ التوجيهية لدورها البيولوجي في عمل مستقلطلاب السنة الأولى في التخصص
فرد واجب، فرض 5. مؤشر الهيدروجين للبيئة. التحلل المائي للجزء النظري من الأملاح الشوارد عبارة عن مواد موصلة للتيار الكهربائي. عملية تحلل مادة ما إلى أيونات تحت تأثير مذيب
مؤسسة التعليم العالي للميزانية الحكومية للتعليم المهني العالي جامعة موسكو الطبية لطب الأسنان التابعة لوزارة الصحة والتنمية الاجتماعية
ندوة 1. التوازن في نظام متجانس ، التوازن الحمضي القاعدي ، الاستخدام في القياس بالمعايرة (مؤلف دكتوراه Monogarova OV). الكيمياء التحليلية علم تحديد التركيب الكيميائي للمواد
الدرس 5 مؤشر الهيدروجين للبيئة. هيدروجين الأملاح موضوع الدروس 1. مراقبة تمهيدية حول موضوع "مؤشر الهيدروجين للبيئة. التحلل المائي للأملاح ". 2. ندوة حول "التفاعلات الأيضية للكهارل. هيدروجين
أنظمة عازلة للدم (من المخزن الإنجليزي ، برتقالي لتليين التأثير) أنظمة وآليات فسيولوجية توفر قاعدة حمضية. 43765414836 أنظمة عازلة ، محاليل عازلة ، مخاليط عازلة ، أنظمة ،
الدرس الخامس مؤشر الهيدروجين للبيئة. التحلل المائي للجزء النظري من الأملاح الشوارد عبارة عن مواد موصلة للتيار الكهربائي. تسمى عملية تحلل المادة إلى أيونات تحت تأثير المذيب بالكهرباء
طالب كيمياء عامة: المجموعة: تاريخ التسليم: الغرض من العمل: العمل المخبري 8 حلول إلكتروليت الخبرة 1. اعتماد الموصلية الكهربائية للحلول على درجة تفكك الإلكتروليتات المفاهيم الأساسية:
وزارة الصحة العامة في أوكرانيا
3 محاليل الإلكتروليت المحاليل السائلة مقسمة إلى محاليل إلكتروليت قادرة على توصيل التيار الكهربائي ، ومحاليل غير إلكتروليتية غير موصلة للكهرباء. المذاب في غير المنحل بالكهرباء
المحاضرة 6 التوازن الحمضي القاعدي 1 خطة المحاضرة 1. الخصائص العامة للتوازن الكيميائي. 2. التفكك الالكتروليتي. الأحماض والقواعد حسب أرهينيوس. 3. حموضة المحاليل. فتاه. الثوابت
التحلل المائي. ناتج القابلية للذوبان - الموضوع 11 - شروط التفاعل بين الإلكتروليتات - التفاعلات في محاليل الإلكتروليت هي تفاعلات بين الأيونات شرط أساسيمسار ردود الفعل في الحلول
المحاضرة 5: التوازن البروتيني في المحاليل الملحية (التحلل المائي). حلول عازلة. توازن محلول الرواسب. حاصل الإذابة. التوازن البروتيني في محلول الملح تفاعل الهيدروليسس
ما هو حمض و BASE؟ أرصدة الأحماض الأساسية الحياة ليست صراعًا ضد الخطيئة ، ليس ضد قوة المال ، ولكن ضد أيونات الهيدروجين أرهينيوس ، 1894 برونستيد-لوري ، 1923 لويس ، 1923
1. اساس نظرىالطريقة المحاضرة 2 الطريقة الحمضية القاعدية تعتمد الطريقة على تفاعل التعادل: H + + OH - H 2 O يتم استخدام الطريقة للتحديد الكمي للأحماض والقلويات ، وكذلك
مهام الامتحان في تخصص "الكيمياء العامة وغير العضوية" طرق التعبير عن تركيز الحلول. معايرة حمض القاعدة. 1. في الممارسة الطبية ، غالبًا ما يستخدم محلول كلوريد الصوديوم بنسبة 0.9٪
الجامعة الاقتصادية الروسية سميت باسم G.V. PLEKHANOV الكيمياء غير العضوية الموضوع: التفكك الالكتروليتي
1. أستاذ مشارك في قسم الكيمياء العامة وغير العضوية بجامعة NUST "MISiS" ، مرشح العلوم الكيميائية Marina Norairovna Ter-Hakobyan 2. موطن الأحماض والقواعد - الماء هو الأهم مادة كيميائيةتشغيل
18. التفاعلات الأيونية في محاليل التفكك الالكتروليتي. التفكك الالكتروليتي هو تفكك الجزيئات في المحلول لتكوين أيونات موجبة وسالبة الشحنة. يعتمد اكتمال الاضمحلال
1. ما هي شحنة نواة ذرة الكربون؟ 1) 0 2) +6 3) +12 4) -1 2. ما هو القاسم المشترك بين الذرات 12 6C و 11 6 C؟ 1) الكتلة العدد 2) عدد البروتونات 3) عدد النيوترونات 4) الخواص المشعة
مهام I (التأهيل) مرحلة المراسلات للأولمبياد "المواهب الشابة في كاميا. CHEMISTRY "2008/2009 سنة دراسية يجب أن تجيب على المهام في ملف الإجابات! في المهام من 1 إلى 19 ، يجب تحديد واحد أو أكثر
الأسس النظرية لدورة "الكيمياء الحيوية الإنشائية" المحاضرة سفيتلانا بوبكوفا ، دكتوراه في العلوم الكيميائية. الموضوع: بنية الماء. الخصائص الفيزيائيةماء. تفكك الماء. المنتج الأيوني للماء.
الحلول (3) التوازن في المحاليل المنحل بالكهرباء. محاضرة عن الأس الهيدروجيني والعلاقات العامة لدورة "الكيمياء العامة وغير العضوية" للصف الحادي عشر من SUNC لتوازن القاعدة الحمضية في المحاليل وفقًا لأرينيوس: يُطلق على الإلكتروليت اسم حمض ،
الكيمياء غير العضوية الغرض من العمل: الطالب: المجموعة: تاريخ العمل: العمل المخبري حلول الإلكتروليت الخبرة 1. التوصيل الكهربائي لمحاليل الإلكتروليت القوية والضعيفة أساسي
القسم الثاني. مشكلة الكيمياء التحليلية 1 (بواسطة PV Chulkin) 1. لتبسيط الحل ، نعبر عن تكوين الأموفوس من خلال معلمة واحدة: a (nh) 2 HPO (1 a) (nh) H 2 PO. الكتلة المولية M = 132a 115 (1 a)
حل الخيار 2 1. التكوين الإلكتروني لأنيون O 2 (1s 2 2s 2 2p 6) يحتوي على الكاتيونات Na، Mg 2. 2. الكتلة المولية لمادة بسيطة مادة بسيطة السيليكون Si. M = ρ V م = 2.33 12.1 = 28 جم / مول. 3.
التحلل المائي للأملاح تم تنفيذ العمل بواسطة مدرس من أعلى فئة VB Timofeeva. ما هو التحلل المائي التحلل المائي هو عملية التفاعل الأيضي للمواد المعقدة مع الماء التحلل المائي.تفاعل الملح مع الماء نتيجة لذلك
خصائص الحلول الحلول عبارة عن أنظمة متجانسة (متجانسة) تتكون من مكونين أو أكثر (مكونات) ، يمكن أن تختلف مقاديرها في حدود واسعة. الحل يتكون من مذاب
Achinovich Olga Vladimirovna عقيدة الحلول الحلول عبارة عن مذيب هو مادة ذائبة - مثال: الماء مذيب إذا قمت بإذابة مادة صلبة (جلوكوز) أو غاز (CO 2). - ماذا إذا
الوكالة الفيدرالية للتعليم ، ياروسلاف ، جامعة ولاية وايز نوفغورود ، قسم الكيمياء والبيئة ، تعليمات منهجية للعمل المخبري ، فيليكي نوفغورود 2006
Negrebetsky 2008 2010 محاضرة 5 العمليات في الحلول. التوازن البروتيني مفاهيم مهمة العمليات في الحلول 5.1 Negrebetsky 2008 2010 1. التوازن في المحاليل المائية. ترطيب الأيونات. قطبية
خطة المحاضرة 5:. التوازن التحليلي في المحاليل الملحية (التحلل المائي) .. كاشف المجموعة للمجموعة التحليلية الثالثة وآلية عملها .. كاشف المجموعة للمجموعة التحليلية الثانية.
قضايا الائتمان التفاضلي في الكيمياء الطبية لطلاب كليات الطب وطب الأسنان 1. التوازن الحمضي القاعدي والتعقيد في الحلول البيولوجية. 1. بيوجينيك
حل الخيار 1 1. التكوين الإلكتروني لكاتيون Al 3+ (1s 2 2s 2 2p 6) يمتلكه الأنيونات F ، O 2. 2. الكتلة المولية لمادة بسيطة مادة بسيطة الذهب Au. 3. ClCH 2 CH 2 CH 2 CH 2 CH 2 CH 3 ؛
1 النظرية. المعادلات الجزيئية الأيونية لتفاعلات التبادل الأيوني تسمى تفاعلات التبادل الأيوني التفاعلات بين محاليل الإلكتروليت ، ونتيجة لذلك يتبادلون أيوناتهم. ردود الفعل الأيونية
وزارة الصحة في جمهورية مولدوفا جامعة الدولةالطب والصيدلة Nicolae Testemitanu كلية الصيدلة قسم كيمياء عامة G. V. BUDU، S. V. MELNIK ANALYTICAL
الوكالة الفيدرالية للتعليم المؤسسة التعليمية الحكومية للتعليم المهني العالي "جامعة تومسك البوليتكنيكال" المعتمدة عميد HTF V.M._Pogrebenkov 2007
الأحكام الرئيسية لنظرية التفكك الإلكتروليتي فاراداي ميخائيل 22. IX.1791 25.VIII. 1867 عالم فيزيائي وكيميائي إنجليزي. في النصف الأول من القرن التاسع عشر. قدم مفهوم الإلكتروليتات وغير المنحلات بالكهرباء. مواد
1. يتم عرض الخصائص الرئيسية بواسطة الأكسيد الخارجي للعنصر: 1) الكبريت 2) النيتروجين 3) الباريوم 4) الكربون 2. أي من الصيغ يتوافق مع التعبير عن درجة تفكك الإلكتروليتات: 1) α = n \ n 2) V م = V \ n 3) n =
1 الوحدة 1 الأساس النظري العام للكيمياء التحليلية. موضوع التحليل النوعي: التوازن الحمضي الأساسي ودوره في الكيمياء التحليلية (في التحليلات). محاضرة النظم العازلة 5 الهدف: الشكل
1. أي مما يلي هو الأكثر شيوعًا غير المعدني؟ 1) الأكسجين 2) الكبريت 3) السيلينيوم 4) التيلوريوم 2. أي من العناصر المدرجة يحتوي على أكبر قدر من القدرة الكهربية؟ 1) الصوديوم
وزارة التربية والتعليم في الاتحاد الروسي مهام اختبار مجمع جامعة شرق سيبيريا الحكومية التكنولوجية في الكيمياء العامة وغير العضوية التطوير المنهجيللدفاع عن النفس
1 المحاضرة 14 التفاعلات الأيونية يتم تقليل التفاعلات الكيميائية في محاليل الإلكتروليت إلى تبادل الأيونات. تتميز ردود الفعل هذه بمعدلات عالية جدًا. في سياق تفاعلات التبادل الأيوني ، حالات الأكسدة
1 خطة المحاضرة: 1. الأحكام الأساسية لنظرية المحاليل الإلكتروليتية. مجموع التركيز (التحليلي) ونشاط الأيونات في المحلول وعلاقتها .. معدل التفاعل الكيميائي والتوازن الكيميائي.
المعهد الحكومي للتعليم المهني العالي "الجامعة البيلاروسية الروسية" قسم "تقنيات المعادن" الكيمياء القواعد الارشاديةللتدريب العملي للطلاب
المحاضرة 3 خطة المحاضرة: 1. سلوك الأحماض أحادية القاعدة القوية والضعيفة في المحاليل المائية. 2. سلوك القواعد الأحادية الحمضية القوية والضعيفة في المحاليل المائية. 3. سلوك polybasic القوي والضعيف
المحاضرة 14 التفاعلات الأيضية في محاليل الإلكتروليت. حاصل الإذابة. تفكك الماء. التحلل المائي للأملاح المفاهيم الأساسية: تفاعلات التبادل الأيوني ، المعادلات الجزيئية الأيونية ، منتج الذوبان
حلول الأولمبياد "مستقبل كوزباس" في الكيمياء 1. قم بإجراء التحولات: Mg MgO MgSO 4 Mg (OH) 2 Mg (OH) Cl MgCl 2 Li Li 2 O LiOH LiH 2 PO 4 Li 2 HPO 4 Li 3 PO 4 لا لا 2 أو 3 لا (أوه) 2 لا 3 لا (أوه) 3
1 المحاضرة 5 اضطراب فسيولوجيا المرض السريري لمحتويات الحالة الأساسية للأحماض 1. مقدمة 2. معلومات عامة حول ACV 3. أهمية مادة الحمض بالنسبة للجسم 4. آثار تحول PH + في TU و
كيمياء. الكيمياء العامة وغير العضوية. التحلل المائي للأملاح هيدرات الأملاح عند دراسة تأثير مؤشر عالمي على محاليل بعض الأملاح ، يمكن للمرء أن يلاحظ ما يلي: كما نرى ، الوسيط الأول
مؤشرات الرقم الهيدروجيني الرقم الهيدروجيني جوهر التحليل المائي أنواع الأملاح خوارزمية لرسم معادلات للتحلل المائي للأملاح التحلل المائي لأنواع مختلفة من الأملاح طرق قمع وتعزيز التحلل المائي محلول الاختبار B4 الهيدروجين
1. أعط أمثلة على استخدام تفاعلات التعقيد في طريقة التحليل الحمضي القاعدي. اكتب معادلات التفاعل. يتم استخدام تفاعلات التعقيد لطريقة التحليل القاعدي الحمضي
مرحلة بدوام كامل. الصف 11. حلول. المهمة 1. مزيج من ثلاثة الغازات أ ، ب ، جكثافة هيدروجين تبلغ 14. تم تمرير جزء 168 جم من هذا الخليط عبر فائض من محلول البروم في مذيب خامل
منحنى المعايرة هو رسم بياني لاعتماد معلمة النظام المرتبطة بتركيز المادة المُعايرة أو المُعاير أو منتج التفاعل ، على درجة عملية المعايرة (على سبيل المثال ، على الكمية
مجموعة من المشاكل في الكيمياء للصف التاسع في الطب بقلم أ. مركز موسكو التعليمي 109 2012 جزء كبير من مادة مذابة. 1. يحتوي 250 جم من المحلول على 50 جم من كلوريد الصوديوم. حدد
صنفتكوينه وطبيعة مكوناته.
يرجى الإشارةمدى قيم الأس الهيدروجيني التي يكون لهذا النظام سعة عازلة ضمنها.
اكتبمعادلات التفاعل التي تعكس آلية عملها (الشكل الأيوني).
يشرحلماذا نظام عازلة الأمونيا ليس جزءًا من الدم
1- تكوين وطبيعة المكونات:
أ) NH 4 OH (NH 3 x H 2 O) - هيدروكسيد الأمونيوم ، إلكتروليت ضعيف
ب) NH 4 C1 - ملح ، كلوريد الأمونيوم ، إلكتروليت قوي.
هيدروكسيد الأمونيوم هو إلكتروليت ضعيف ؛ في المحلول يتفكك جزئيًا إلى أيونات:
NH 4 OH<=>NH 4 + OH-
عند إضافة كلوريد الأمونيوم إلى محلول هيدروكسيد الأمونيوم ، يتفكك الملح كإلكتروليت قوي بشكل شبه كامل إلى أيونات:
NH 4 C1> NH 4 + + C1-
ويثبط تفكك القاعدة ، حيث يتحول توازنها نحو رد الفعل العكسي.
- يتم حساب نطاق قيم الأس الهيدروجيني التي يكون للنظام قيد الدراسة سعة عازلة ضمنها بواسطة الصيغة:
حيث KB هو ثابت التفكك NH 4 OH = 1.8 * 10 -5 ، C 0 هو التركيز الأساسي ، Cc هو تركيز الملح.
الرقم الهيدروجيني = 14-4.74 + السجل (C 0 / Cc) = 9.26 + السجل (C 0 / Cc). اعتمادًا على نسبة C 0 / Cc ، فإن نطاق الأس الهيدروجيني هو 8.26-10.26.
- تعتمد قدرة المخزن المؤقت للأمونيا على الحفاظ على درجة حموضة ثابتة تقريبًا في المحلول على حقيقة أن المكونات المتضمنة فيها تربط أيونات H + و OH- التي يتم إدخالها في المحلول أو تتشكل نتيجة التفاعل الجاري في هذا المحلول . عند إضافة حمض قوي إلى خليط محلول الأمونيا ، فإن أيونات H + سوف ترتبط بالجزيئات أو هيدروكسيد الأمونيوم ، ولن تزيد تركيز أيونات H + وتقلل من الرقم الهيدروجيني للمحلول:
NH 4 OH + H + = NH 4 + + H 2 O
عند إضافة القلويات ، فإن أيونات OH سوف تربط أيونات NH4 + ، وبالتالي تشكل مركبًا منفصلًا قليلاً ، ولا تزيد الرقم الهيدروجيني للمحلول:
NH 4 + + OH - = NH 4 OH
- لا يتم تضمين نظام عازلة الأمونيا في تكوين الدم TOP RT ، نظرًا لأن نطاق قيم الأس الهيدروجيني الذي سيكون له سعة عازلة في المنطقة القلوية (الرقم الهيدروجيني أكبر من 8). درجة الحموضة في بلازما الدم الطبيعي 7.40 ± 0.05 ، أي أقل من منطقة التخزين.
1. 3)اكتبمخطط تفاعل تفاعل الإيثيل مع ميثيل أمين.
يصفآلية رد الفعل هذا.
يبرردور المحفز الحمضي.
يشرحإمكانية تفاعل التحلل المائي للأمين الناتج في بيئة حمضية وقلوية.

2. آلية هذا التفاعل هي الإضافة المحبة للنواة يليها إزالة جزيء الماء

3. دور المحفز الحمضي - البروتونات في المرحلة أ)
4. في وجود الأحماض المخففة ، تتحلل الإيمينات بالماء لتشكيل مركبات الكربونيل والأمينات ، وهذا التفاعل هو عكس تفاعل تخليق الإيمينات:

في وجود القلويات ، لا يحدث التحلل المائي
التذكرة 4.
النظام الديناميكي الحراري (TM) -هذا هو أي كائن حقيقي معزول عن البيئة من أجل دراسة عمليات تبادل الطاقة والطاقة بين الأجزاء المكونة لها ، وكذلك بينها و بيئةباستخدام الطرق الديناميكية الحرارية
تصنيف الأنظمة الديناميكية الحرارية
3. افتحتبادل كل من المادة والطاقة مع نظام التشغيل (كائن حي ، وعاء مفتوح بالماء المغلي)
4. مغلق- يتبادل مع نظام التشغيل الطاقة فقط على شكل حرارة أو عمل (غاز في اسطوانة مغلقة)
5. معزول- لا تتبادل أي شيء أو طاقة. لا يوجد أشخاص معزولون تمامًا في الطبيعة.
من خلال وجود واجهة داخل المركبة
1. متجانس- لا يوجد واجهة ، جميع المكونات في طور الماء ، وجميع المواد الفيزيائية والكيميائية في أي جزء من الحجم متشابهة (خليط من الغازات)
2. غير متجانسة- يحتوي على الواجهة ، تختلف الأجزاء المنفصلة للنظام (المراحل) باختلاف sv-you (الدم)
خيارات- الكميات التي تحدد حالة المركبة
القياس المباشر ممكن
المعلمات الرئيسية هي المعلمات التي يمكن قياسها باستخدام الأجهزة المناسبة (m ، V ، C ، الكثافة ، الحجم)
وظائف الدولة - الطاقة الداخلية E (U) ؛ المحتوى الحراري (H) ؛ إنتروبيا (S) ؛ طاقة جيبس (G) ؛ الطاقة الحرة أو طاقة هيلمهولتز
يمكنك تحديد التغيير في قيم وظيفة الحالة
∆X (X 2 -X 1) ، حيث X-U ، H ، S ، G ، H
الحالة الديناميكية الحرارية- مجموعة القيم المادية لعدد معين. القيم التي تميز جميع الأنظمة الفيزيائية و hm sv-va
أنواع الحالات:
عدم التوازن - تتغير المعلمات تلقائيًا (كوب من الماء الساخن)
لا تتغير معلمات التوازن بدون تأثيرات خارجية
ثابت = ثبات المعلمات بسبب العوامل الخارجية (المتأصلة في الكائنات الحية)
معالجة- انتقال النظام من حالة إلى أخرى مصحوبة بتغييرات في البارامترات الديناميكية الحرارية.
تصنيف-
من خلال ثبات المعلمات:
أ) isochoric (v = const)
ب) متساوي الضغط (ضغط - ثابته)
ج) متساوي الحرارة (درجة الحرارة = ثوابت)
بعلامة التأثير الحراري:طارد للحرارة و ماص للحرارة
عن طريق نفقات الطاقة: عفوية ، غير عفوية
حسب طبيعة الدورة:- قابل للعكس - يتدفق في اتجاهين أمامي وخلفي خلال نفس المراحل ، دون تغييرات في البيئة. بيئة.
لا رجوع فيه - لا يمكن لجميع العمليات المضي قدمًا في الاتجاهين الأمامي والخلفي خلال نفس المراحل.
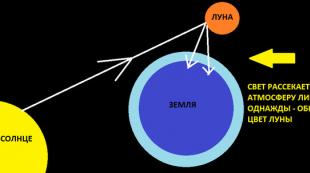
آلية التخزين المؤقت (على سبيل المثال ، محلول الأمونيا)
دعونا نفكر في آلية عمل نظام المخزن المؤقت باستخدام مثال نظام المخزن المؤقت للأمونيا: NH 4 OH (NH 3 x H 2 O) + NH 4 C1.
هيدروكسيد الأمونيوم هو إلكتروليت ضعيف ؛ في المحلول يتفكك جزئيًا إلى أيونات:
NH 4 OH<=>NH 4 + OH -
عند إضافة كلوريد الأمونيوم إلى محلول هيدروكسيد الأمونيوم ، يتفكك الملح ، باعتباره إلكتروليتًا قويًا ، تمامًا تقريبًا إلى أيونات NH 4 C1> NH 4 + C1 - ويثبط تفكك القاعدة ، حيث يتحول توازنها نحو رد الفعل العكسي. لذلك ، C (NH 4 OH)؟ C (القاعدة) ؛ و C (NH 4 +)؟ ج (ملح).
إذا كان في محلول منظم C (NH 4 OH) = C (NH 4 C1) ، فإن الرقم الهيدروجيني = 14 - pKosn. = 14 + سجل 1.8.10-5 = 9.25.
تعتمد قدرة المخاليط العازلة على الحفاظ على درجة حموضة ثابتة تقريبًا لمحلول ما على حقيقة أن المكونات المتضمنة فيها تربط أيونات H + و OH- التي يتم إدخالها في المحلول أو تتشكل نتيجة تفاعل التفاعل في هذا المحلول. عندما يضاف حمض قوي إلى خليط محلول الأمونيا ، فإن أيونات H + سوف ترتبط مع الأمونيا أو جزيئات هيدروكسيد الأمونيوم ، ولن تزيد تركيز أيونات H + وتقلل من الرقم الهيدروجيني للمحلول.
عند إضافة القلويات ، فإن أيونات OH سوف تربط أيونات NH4 + ، مما يؤدي إلى تكوين مركب سيئ التفكك ، ولا يؤدي إلى زيادة الرقم الهيدروجيني للمحلول.
يتم إنهاء إجراء التخزين المؤقت بمجرد استهلاك أحد الأجزاء المكونة لمحلول المخزن المؤقت (القاعدة المترافقة أو الحمض المترافق) تمامًا.
لتحديد قدرة المحلول المنظم على مقاومة تأثير الأحماض والقواعد القوية ، يتم استخدام كمية تسمى سعة المخزن المؤقت. مع زيادة تركيز المخزن المؤقت ، تزداد قدرته على مقاومة التغيرات في الأس الهيدروجيني بسبب إضافة الأحماض أو القلويات.
تسمى خاصية الحلول التي تحافظ على قيمة الأس الهيدروجيني ضمن حدود معينة عند إضافة كميات صغيرة من الأحماض أو القلويات بالتخزين المؤقت. تسمى حلول التخزين المؤقت المخازن المؤقتة.
بالنسبة لحالة المعايرة: حمض الأكساليك وهيدروكسيد البوتاسيوم ، ارسم منحنى المعايرة ، وضّح حالة المعايرة ، قفزة المعايرة ، نقطة التكافؤ ، المؤشرات المستخدمة
قفزة المعايرة: الرقم الهيدروجيني = 4-10. الحد الأقصى للخطأ في٪ أقل من 0.4.
المؤشرات - ثيمول فثالين ، فينول فثالين.
المخفض ، ما العناصر النظام الدورييمكن أن تكون عناصر الاختزال ولماذا؟
العامل المختزل هو مادة تتبرع بالإلكترونات أثناء التفاعل ، أي يتأكسد.
يمكن أن تكون عوامل الاختزال عبارة عن ذرات متعادلة وأيونات سالبة الشحنة من غير المعادن وأيونات معدنية موجبة الشحنة في أدنى حالة أكسدة وأيونات معقدة وجزيئات تحتوي على ذرات في حالة أكسدة وسيطة.
ذرات محايدة. عوامل الاختزال النموذجية هي الذرات التي تحتوي على 1 إلى 3 إلكترونات عند مستوى الطاقة الخارجي. تشمل هذه المجموعة من عوامل الاختزال المعادن ، أي عناصر s- و d - و f. تظهر أيضًا غير المعادن مثل الهيدروجين والكربون خصائص مختزلة. في التفاعلات الكيميائية ، يتبرعون بالإلكترونات.
الذرات ذات قدرة التأين المنخفضة هي عوامل اختزال قوية. وتشمل ذرات عناصر أول مجموعتين فرعيتين رئيسيتين من الجدول الدوري لعناصر D.I. منديليف (معادن الأرض القلوية والقلوية) ، وكذلك Al ، Fe ، إلخ.
في المجموعات الفرعية الرئيسية للجدول الدوري ، تزداد قابلية اختزال الذرات المحايدة بزيادة نصف قطر الذرات. لذلك ، على سبيل المثال ، في سلسلة Li - Fr ، يكون عامل الاختزال الأضعف هو Li ، والأقوى هو Fr ، وهو عمومًا أقوى عامل اختزال لجميع عناصر الجدول الدوري.
الأيونات سالبة الشحنة من اللافلزات. تتشكل الأيونات السالبة الشحنة عن طريق ربط إلكترون واحد أو أكثر بذرة غير فلزية محايدة:
لذلك ، على سبيل المثال ، يمكن للذرات المحايدة من الكبريت واليود التي تحتوي على 6 و 7 إلكترونات في المستويات الخارجية أن تربط 2 و 1 إلكترونًا على التوالي وتتحول إلى أيونات سالبة الشحنة.
تعتبر الأيونات السالبة عوامل اختزال قوية ، حيث إنها في ظل الظروف المناسبة يمكنها التبرع ليس فقط بالإلكترونات الزائدة المحتجزة بشكل ضعيف ، ولكن أيضًا بالإلكترونات من مستواها الخارجي. علاوة على ذلك ، كلما كان اللا فلز أكثر نشاطًا كعامل مؤكسد ، تضعف قدرته على الاختزال في حالة الأيون السالب. على العكس من ذلك ، كلما كان العنصر غير المعدني أقل نشاطًا كعامل مؤكسد ، كان أكثر نشاطًا في حالة الأيون السالب كعامل مختزل.
تزداد القدرة الاختزالية للأيونات السالبة الشحنة بنفس الشحنة مع زيادة نصف قطر الذرة. لذلك ، على سبيل المثال ، في مجموعة الهالوجينات ، يتمتع أيون اليود بقدرة اختزال أكبر من أيونات البروم والكلور ، ولا يُظهر الفلور أي خصائص اختزال.
أيونات معدنية موجبة الشحنة في أدنى حالة أكسدة. تتشكل أيونات المعادن في أدنى حالة أكسدة من ذرات متعادلة نتيجة لعودة جزء فقط من الإلكترونات من الغلاف الخارجي. لذلك ، على سبيل المثال ، يمكن لذرات القصدير والكروم والحديد والنحاس والسيريوم ، عند تفاعلها مع مواد أخرى ، أن تتخلى أولاً عن أقل عدد من الإلكترونات.
يمكن لأيونات المعادن في أدنى حالة أكسدة أن تظهر خصائص مختزلة إذا كانت حالات الأكسدة الأعلى ممكنة.
في معادلة ORP ، رتب المعاملات باستخدام طريقة التوازن الإلكتروني. أشر إلى العامل المؤكسد وعامل الاختزال.
K 2 Cr 2 O 7 + 6FeSO 4 + 7H 2 SO 4 = K 2 SO 4 + Cr 2 (SO 4) 3 + 3Fe 2 (SO 4) 3 + 7H 2 O
1 Cr 2 +6 + 3e x 2 Cr 2 + 3 عامل مؤكسد
6 Fe +2 - 1e Fe +3 عامل اختزال
2KMnO 4 + 5H 2 S + 3H 2 SO 4 = K 2 SO 4 + 2MnSO4 + 5S + 8H 2 O
2 Mn +7 + 5е Mn +2 عامل مؤكسد
5 S -2 - 2e S 0 عامل اختزال