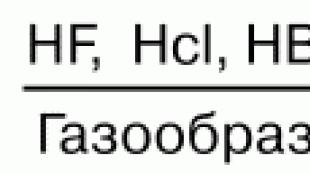Galogenlar birikmalarining fizik va kimyoviy xossalari. Galogenlar va ularning birikmalari. Galogen birikmalar va ularning inson organizmidagi roli
Galogenlar– VII guruh elementlari – ftor, xlor, brom, yod, astatin (astatin radioaktivligi tufayli kam o‘rganilgan). Galogenlar alohida metall bo'lmaganlardir. Faqat yod kamdan-kam hollarda metallarga o'xshash xususiyatlarni namoyon qiladi.
Qo'zg'atmagan holatda galogen atomlari umumiy elektron konfiguratsiyaga ega: ns2np5. Bu shuni anglatadiki, galogenlar ftordan tashqari 7 ta valent elektronga ega.
Galogenlarning fizik xususiyatlari: F2 – rangsiz, suyultirilishi qiyin gaz; Cl2 - sariq-yashil, o'tkir bo'g'uvchi hid bilan oson suyultiriladigan gaz; Br2 - qizil-jigarrang suyuqlik; I2 binafsha rangli kristall moddadir.

Vodorod galogenidlarining suvdagi eritmalari kislotalar hosil qiladi. HF - vodorod ftorid (ftorid); HCl - xlorid (tuz); NBr - vodorod bromidi; HI - vodorod yodidi. Kislotalarning kuchi yuqoridan pastgacha kamayadi. Hidroflorik kislota galogenli kislotalar qatorida eng zaif, gidroiyod kislota esa eng kuchli hisoblanadi. Bu Hg ning bog'lanish energiyasi yuqoridan kamayishi bilan izohlanadi. NG molekulasining kuchi xuddi shu yo'nalishda kamayadi, bu yadrolararo masofaning oshishi bilan bog'liq. Suvda ozgina eriydigan tuzlarning eruvchanligi ham kamayadi:
Chapdan o'ngga qarab galogenidlarning eruvchanligi pasayadi. AgF suvda yaxshi eriydi. Erkin holatdagi barcha galogenlar oksidlovchi moddalardir. Ularning oksidlovchi moddalar sifatida kuchi ftordan yodgacha kamayadi. Kristalli, suyuq va gazsimon holatda barcha galogenlar alohida molekulalar shaklida mavjud. Atom radiuslari bir xil yo'nalishda ortadi, bu erish va qaynash nuqtalarining oshishiga olib keladi. Ftor atomlarga yodga qaraganda yaxshiroq ajraladi. Elektrod potentsiallari halogen kichik guruhini pastga siljitishda kamayadi. Ftor eng yuqori elektrod potentsialiga ega. Ftor eng kuchli oksidlovchi moddadir. Har qanday yuqori bo'sh halogen eritmada manfiy bir zaryadlangan ion holatida bo'lgan pastki qismini siqib chiqaradi.
20. Xlor. Vodorod xlorid va xlorid kislotasi
Xlor (Cl) - 3-davrda turadi, davriy tizimning asosiy kichik guruhining VII guruhida, seriya raqami 17, atom massasi 35,453; halogenlarni nazarda tutadi.
Jismoniy xususiyatlar: o'tkir hidli sariq-yashil gaz. Zichlik 3,214 g/l; erish nuqtasi -101 ° C; qaynash nuqtasi -33,97 °C, oddiy haroratda 0,6 MPa bosim ostida osongina suyultiriladi. Suvda erigan sarg'ish xlorli suv hosil qiladi. Organik erituvchilarda, ayniqsa geksanda (C6H14) va uglerod tetrakloridida yaxshi eriydi.
Xlorning kimyoviy xossalari: elektron konfiguratsiya: 1s22s22p63s22p5. Tashqi sathda 7 ta elektron mavjud. Darajani to'ldirish uchun sizga -1 oksidlanish holatini ko'rsatadigan xlor qabul qiladigan 1 ta elektron kerak bo'ladi. Xlorning + 7 gacha bo'lgan ijobiy oksidlanish darajalari ham mavjud. Quyidagi xlor oksidlari ma'lum: Cl2O, ClO2, Cl2O6 va Cl2O7. Ularning barchasi beqaror. Xlor kuchli oksidlovchi moddadir. To'g'ridan-to'g'ri metallar va metall bo'lmaganlar bilan reaksiyaga kirishadi:
Vodorod bilan reaksiyaga kirishadi. Oddiy sharoitlarda reaktsiya sekin, kuchli isitish yoki yorug'lik bilan - zanjir mexanizmiga ko'ra portlash bilan davom etadi:
![]()
Xlor gidroksidi eritmalar bilan o'zaro ta'sir qiladi, tuzlar - gipoxloritlar va xloridlar hosil qiladi:
Xlor gidroksidi eritmasiga o'tkazilganda, xlorid va gipoxlorit eritmalari aralashmasi hosil bo'ladi:
Xlor qaytaruvchi vositadir: Cl2 + 3F2 = 2ClF3.
Suv bilan o'zaro ta'siri:
Xlor uglerod, azot va kislorod bilan bevosita reaksiyaga kirishmaydi.
Kvitansiya: 2NaCl + F2 = 2NaF + Cl2.
Elektroliz: 2NaCl + 2H2O = Cl2 + H2 + 2NaOH.
Tabiatda topish: quyidagi minerallar tarkibiga kiradi: galit (tosh tuzi), silvit, bishofit; dengiz suvida natriy, kaliy, magniy va boshqa elementlarning xloridlari mavjud.
Vodorod xlorid HCl. Jismoniy xususiyatlar: rangsiz gaz, havodan og'irroq, xlorid kislota hosil qilish uchun suvda yaxshi eriydi.
Kvitansiya: laboratoriyada:
Sanoatda: vodorod xlor oqimida yondiriladi. Keyinchalik, vodorod xlorid xlorid kislota hosil qilish uchun suvda eritiladi (yuqoriga qarang).
Kimyoviy xossalari: xlorid kislota kuchli, bir asosli, vodorodgacha kuchlanish qatoridagi metallar bilan o'zaro ta'sir qiladi: Zn + 2HCl = ZnCl2 + H2.
Qaytaruvchi vosita sifatida ko'plab metallarning oksidlari va gidroksidlari bilan reaksiyaga kirishadi.
Elementlar kimyosi
VIIA kichik guruhining nometallari
VIIA kichik guruhining elementlari yuqori bo'lgan odatiy bo'lmagan metalldir
elektronegativlik, ular guruh nomiga ega - "galogenlar".
Ma'ruzada yoritiladigan asosiy masalalar
VIIA kichik guruhidagi metall bo'lmaganlarning umumiy xususiyatlari. Elektron tuzilishi, atomlarning eng muhim xususiyatlari. Eng xarakterli ste-
oksidlanish jazolari. Galogenlar kimyosining xususiyatlari.
Oddiy moddalar.
Tabiiy birikmalar.
Galogen birikmalar
Gidrogal kislotalar va ularning tuzlari. Tuz va gidroflorik kislota
uyalar, kvitansiya va ariza.
Halid komplekslari.
Galogenlarning ikkilik kislorodli birikmalari. Beqarorlik taxminan.
Oddiy moddalarning oksidlanish-qaytarilish xossalari va ko-
birliklar. Nomutanosiblik reaksiyalari. Latimer diagrammalar.
Ijrochi: |
Tadbir raqami. |
||||||||||||||||

VIIA kichik guruhi elementlari kimyosi
umumiy xususiyatlar
Marganets |
||||||||
Technetium |
||||||||
VIIA-guruhni p-elementlar hosil qiladi: ftor F, xlor
Cl, brom Br, yod I va astatin At.
Valentlik elektronlarining umumiy formulasi ns 2 np 5.
VIIA guruhining barcha elementlari odatiy metall bo'lmaganlardir.
Tarqatishdan ko'rinib turibdiki |
|||||||
valent elektronlar |
|||||||
atomlarning orbitallariga ko'ra |
faqat bitta elektron etishmayapti |
||||||
barqaror sakkiz elektronli qobiq hosil qilish
qutilar, shuning uchun ular bor tomon kuchli moyillik mavjud
elektron qo'shilishi.
Barcha elementlar osonlikcha oddiy bir zaryadni hosil qiladi
ny anionlar G –.
Oddiy anionlar shaklida VIIA guruh elementlari tabiiy suvda va tabiiy tuzlarning kristallarida, masalan, galit NaCl, silvit KCl, ftoritda uchraydi.
CaF2.
Elementlarning umumiy guruhi nomi VIIA-
"galogenlar" guruhi, ya'ni "tuzlarni tug'diruvchi", ularning metallar bilan birikmalarining ko'pchiligi oldindan
tipik tuz (CaF2, NaCl, MgBr2, KI), qaysi
to'g'ridan-to'g'ri o'zaro ta'sir orqali olinishi mumkin
metallning halogen bilan o'zaro ta'siri. Erkin halogenlar tabiiy tuzlardan olinadi, shuning uchun "galogenlar" nomi "tuzlardan tug'ilgan" deb ham tarjima qilinadi.
Ijrochi: |
Tadbir raqami. |
||||||||||||||||

Minimal oksidlanish darajasi (-1) eng barqaror hisoblanadi
barcha halogenlar uchun.
VIIA guruh elementlari atomlarining ba'zi xarakteristikalari keltirilgan
VIIA guruh elementlari atomlarining eng muhim xarakteristikalari
qarindosh- |
Qarindoshlik |
||||||
elektr |
|||||||
salbiy |
ionlanish, |
||||||
ness (ko'ra |
|||||||
Ovoz berish) |
|||||||
sonining ortishi |
|||||||
elektron qatlamlar; |
|||||||
hajmining oshishi |
|||||||
elektr quvvatini kamaytirish |
|||||||
uch tomonlama salbiy |
Galogenlar yuqori elektron yaqinligiga ega (maksimal
Cl) va juda yuqori ionlanish energiyasi (F da maksimal) va maksimal
har bir davrda mumkin bo'lgan elektronegativlik. Ftor eng ko'p
barcha kimyoviy elementlarning elektronegativi.
Galogen atomlarida bitta juftlashtirilmagan elektronning mavjudligi aniqlanadi
oddiy moddalardagi atomlarning diatomik molekulalarga birlashishini ifodalaydi G2.
Oddiy moddalar uchun galogenlar eng xarakterli oksidlovchi moddalardir
xususiyatlar, F2 da eng kuchli va I2 ga o'tishda zaiflashadi.
Galogenlar barcha metall bo'lmagan elementlarning eng katta reaktivligi bilan tavsiflanadi. Ftor, hatto halogenlar orasida ham ajralib turadi
juda yuqori faollikka ega.
Ikkinchi davr elementi ftor ikkinchisidan kuchli farq qiladi
kichik guruhning boshqa elementlari. Bu barcha metall bo'lmaganlar uchun umumiy namunadir.
Ijrochi: |
Tadbir raqami. |
||||||||||||||||
Ftor, eng elektronegativ element sifatida, jinsiy aloqani ko'rsatmaydi
doimiy oksidlanish darajasi. Har qanday aloqada, shu jumladan ki-
kislorod, ftor oksidlanish holatida (-1).
Boshqa barcha halogenlar ijobiy oksidlanish darajasini ko'rsatadi
leniya maksimal +7 gacha.
Galogenlarning eng xarakterli oksidlanish darajalari:
F: -1, 0;
Cl, Br, I: -1, 0, +1, +3, +5, +7.
Cl oksidlanish darajasida bo'lgan ma'lum oksidlarga ega: +4 va +6.
Ijobiy holatda eng muhim halogen birikmalar,
Oksidlanishning jazosi kislorodli kislotalar va ularning tuzlaridir.
Musbat oksidlanish darajasidagi barcha halogen birikmalar
kuchli oksidlovchi moddalardir.
dahshatli oksidlanish darajasi. Nomutanosiblik ishqoriy muhit tomonidan ta'minlanadi.
Oddiy moddalar va kislorod birikmalarini amaliy qo'llash
Galogenlarning kamayishi asosan ularning oksidlovchi ta'siriga bog'liq.
Eng oddiy moddalar, Cl2, eng keng amaliy qo'llanilishini topadi.
va F2. Xlor va ftorning eng katta miqdori sanoatda iste'mol qilinadi
organik sintez: plastmassalar, sovutgichlar, erituvchilar ishlab chiqarishda,
pestitsidlar, dorilar. Metalllarni olish va ularni tozalash uchun katta miqdorda xlor va yod ishlatiladi. Xlor ham ishlatiladi
tsellyulozani oqartirish uchun, ichimlik suvini zararsizlantirish uchun va ishlab chiqarishda
oqartiruvchi suv va xlorid kislotasi. Oksokislotalarning tuzlari portlovchi moddalar ishlab chiqarishda ishlatiladi.
Ijrochi: |
Tadbir raqami. |
||||||||||||||||

Kislotalar - xlorid va erigan kislotalar amaliyotda keng qo'llaniladi.
Ftor va xlor yigirmata eng keng tarqalgan elementlardan biridir
u erda tabiatda brom va yod sezilarli darajada kamroq. Barcha galogenlar tabiatda oksidlanish holatida uchraydi(-1). Faqat yod KIO3 tuzi shaklida bo'ladi,
Chili selitrasida (KNO3) nopoklik sifatida kiritilgan.
Astatin - sun'iy ravishda ishlab chiqarilgan radioaktiv element (u tabiatda mavjud emas). Otning beqarorligi yunon tilidan kelgan nomda aks etadi. "astatos" - "beqaror". Astatin saraton o'smalarining radiatsiya terapiyasi uchun qulay emitent hisoblanadi.
Oddiy moddalar
Galogenlarning oddiy moddalarini ikki atomli molekulalar G2 hosil qiladi.
Oddiy moddalarda, elektronlar sonining ko'payishi bilan F2 dan I2 ga o'tish paytida
taxt qatlamlari va atomlarning qutblanishining ortishi, o'sish bor
molekulalararo o'zaro ta'sir agregatlarning o'zgarishiga olib keladi.
standart sharoitlarda turish.
Ftor (normal sharoitda) sariq gaz bo'lib, -181o C da aylanadi
suyuqlik holati.
Xlor sariq-yashil gaz bo'lib, -34o C da suyuqlikka aylanadi.
Cl nomi u bilan bog'liq bo'lib, u yunoncha "xloros" - "sariq-" dan keladi.
yashil". F2 ga nisbatan Cl2 ning qaynash nuqtasining keskin oshishi,
molekulalararo o'zaro ta'sir kuchayganligini ko'rsatadi.
Brom toʻq qizil, juda uchuvchan suyuqlik boʻlib, 58,8o S da qaynaydi.
elementning nomi gazning o'tkir yoqimsiz hidi bilan bog'liq va undan olingan
"bromos" - "xushbo'y".
Yod - quyuq binafsha rangli kristallar, zaif "metall"
qizdirilganda osongina sublimatsiyalanadigan, binafsha rangli bug'larni hosil qiluvchi bo'laklar;
tez sovutish bilan |
114o C gacha bo'lgan bug'lar |
suyuqlik hosil bo'ladi. Harorat |
|||||||||||||||||
Ijrochi: |
Tadbir raqami. |
||||||||||||||||||
Yodning qaynash nuqtasi 183 ° S. Uning nomi yod bug'ining rangidan kelib chiqadi -
"yodos" - "binafsha".
Barcha oddiy moddalar o'tkir hidga ega va zaharli hisoblanadi.
Ularning bug'larini inhalatsiyalash shilliq pardalar va nafas olish organlarining tirnash xususiyati keltirib chiqaradi va yuqori konsentratsiyalarda - bo'g'ilish. Birinchi jahon urushi paytida xlor zaharli vosita sifatida ishlatilgan.
Ftor gazi va suyuq brom terining kuyishiga olib keladi. Ha bilan ishlash
logens, ehtiyot choralarini ko'rish kerak.
Galogenlarning oddiy moddalari qutbsiz molekulalar tomonidan hosil qilinganligi sababli
soviydi, ular qutbsiz organik erituvchilarda yaxshi eriydi:
spirt, benzol, uglerod tetraxlorid va boshqalar.Xlor, brom va yod suvda kam eriydi, ularning suvdagi eritmalari xlor, brom va yodli suvlar deyiladi. Br2 boshqalarga qaraganda yaxshiroq eriydi, to'yingandagi brom konsentratsiyasi.
Eritma 0,2 mol/l ga, xlor esa 0,1 mol/l ga etadi.
Ftorid suvni parchalaydi:
2F2 + 2H2 O = O2 + 4HF
Galogenlar yuqori oksidlanish faolligi va o'tish xususiyatini namoyon qiladi
galoid anionlariga aylanadi.
G2 + 2e– 2G–
Ftor ayniqsa yuqori oksidlovchi faollikka ega. Ftor asil metallarni oksidlaydi (Au, Pt).
Pt + 3F2 = PtF6
U hatto ba'zi inert gazlar (kripton,
ksenon va radon), masalan,
Xe + 2F2 = XeF4
Ko'pgina juda barqaror birikmalar F2 atmosferasida yonadi, masalan.
suv, kvarts (SiO2).
SiO2 + 2F2 = SiF4 + O2
Ijrochi: |
Tadbir raqami. |
||||||||||||||||

Ftor bilan reaktsiyalarda, hatto azot va oltingugurt kabi kuchli oksidlovchi moddalar ham
nik kislota, qaytaruvchi sifatida harakat qiladi, ftor esa kirishni oksidlaydi
tarkibida O(–2) mavjud.
2HNO3 + 4F2 = 2NF3 + 2HF + 3O2 H2 SO4 + 4F2 = SF6 + 2HF + 2O2
F2 ning yuqori reaktivligi konsentratsiyani tanlashda qiyinchiliklar tug'diradi.
u bilan ishlash uchun konstruktiv materiallar. Odatda bu maqsadlar uchun biz foydalanamiz
Nikel va mis mavjud bo'lib, ular oksidlanganda ularning yuzasida ftoridlarning zich himoya plyonkalarini hosil qiladi. F nomi uning tajovuzkor harakati bilan bog'liq.
Men ovqatlanaman, bu yunon tilidan keladi. "Ftorlar" - "buzg'unchi".
F2, Cl2, Br2, I2 qatorlarida oksidlanish qobiliyati kuchayishi tufayli zaiflashadi.
atomlar hajmini oshirish va elektronegativlikni kamaytirish.
Suvli eritmalarda moddalarning oksidlovchi va qaytaruvchi xossalari
Moddalar odatda elektrod potentsiallari yordamida tavsiflanadi. Jadvalda qisqartirish yarim reaktsiyalari uchun standart elektrod potentsiallari (Eo, V) ko'rsatilgan
galogenlarning hosil bo'lishi. Taqqoslash uchun, ki- uchun Eo qiymati
uglerod eng keng tarqalgan oksidlovchi moddadir.
Oddiy halogen moddalar uchun standart elektrod potentsiallari
Eo, B, reaksiya uchun |
|||||||||||||
O2 + 4e– + 4H+ 2H2 O |
|||||||||||||
Eo, V |
|||||||||||||
elektrod uchun |
|||||||||||||
2G– +2e – = G2 |
|||||||||||||
Oksidlanish faolligining pasayishi
Jadvaldan ko'rinib turibdiki, F2 - ancha kuchli oksidlovchi,
O2 dan ko'ra, shuning uchun F2 suvli eritmalarda mavjud emas , suvni oksidlaydi,
F-gacha tiklanish. Eo qiymatiga ko'ra, Cl2 ning oksidlanish qobiliyati
Ijrochi: |
Tadbir raqami. |
||||||||||||||||
O2 dan ham yuqori. Haqiqatan ham, xlorli suvni uzoq muddatli saqlash vaqtida u kislorodning chiqishi va HCl hosil bo'lishi bilan parchalanadi. Ammo reaktsiya sekin (Cl2 molekulasi F2 molekulasiga qaraganda sezilarli darajada kuchliroq va
xlor bilan reaksiyalar uchun aktivlanish energiyasi yuqori), dispro-
qismlarga ajratish:
Cl2 + H2 O HCl + HOCl
Suvda u oxirigacha etib bormaydi (K = 3,9 . 10-4), shuning uchun Cl2 suvli eritmalarda mavjud. Br2 va I2 suvda yanada katta barqarorlik bilan tavsiflanadi.
Nomutanosiblik juda xarakterli oksidlovchi hisoblanadi
halogenlar uchun qaytarilish reaktsiyasi. Kuchaytirishning nomutanosibligi
ishqoriy muhitda quyiladi.
Ishqorda Cl2 ning nomutanosibligi anionlarning hosil bo'lishiga olib keladi
Cl- va ClO-. Disproporsiya konstantasi 7,5 ga teng. 1015.
Cl2 + 2NaOH = NaCl + NaClO + H2O
Yod ishqorda nomutanosiblashganda I- va IO3- hosil bo'ladi. Ana-
Mantiqan, Br2 yodni nomutanosiblashtiradi. Mahsulot o'zgarishi nomutanosibdir
millat Br va I dagi GO– va GO2– anionlari beqaror ekanligi bilan bog‘liq.
Xlorning nomutanosiblik reaktsiyasi sanoatda qo'llaniladi
kuchli va tez ta'sir qiluvchi gipoxlorit oksidlovchini olish qobiliyati,
oqartiruvchi ohak, bertolet tuzi.
3Cl2 + 6 KOH = 5KCl + KClO3 + 3H2 O
Ijrochi: |
Tadbir raqami. |
||||||||||||||||
Galogenlarning metallar bilan o'zaro ta'siri
Galogenlar ko'plab metallar bilan kuchli reaksiyaga kirishadi, masalan:
Mg + Cl2 = MgCl2 Ti + 2I2 TiI4
Na + galogenidlar, ularda metall past oksidlanish darajasiga ega (+1, +2),
- Bular tuzga o'xshash birikmalar bo'lib, ular asosan ionli aloqalarga ega. Qanday
lo, ionli galogenidlar erish nuqtasi yuqori bo'lgan qattiq moddalardir
Metallning oksidlanish darajasi yuqori bo'lgan metall halidlari
ionlar asosan kovalent bog'lanishga ega bo'lgan birikmalardir.
Ularning ko'pchiligi normal sharoitda gazlar, suyuqliklar yoki eruvchan qattiq moddalardir. Masalan, WF6 gaz, MoF6 suyuqlik,
TiCl4 suyuqlikdir.
Galogenlarning metall bo'lmaganlar bilan o'zaro ta'siri
Galogenlar ko'plab metall bo'lmaganlar bilan bevosita o'zaro ta'sir qiladi:
vodorod, fosfor, oltingugurt va boshqalar. Masalan:
H2 + Cl2 = 2HCl 2P + 3Br2 = 2PBr3 S + 3F2 = SF6
Metall bo'lmagan galogenidlardagi bog'lanish asosan kovalentdir.
Odatda bu birikmalar past erish va qaynash nuqtalariga ega.
Ftordan yodga o'tganda galogenidlarning kovalent tabiati kuchayadi.
Odatda nometallarning kovalent galogenidlari kislotali birikmalardir; suv bilan o'zaro ta'sirlashganda ular gidrolizlanib, kislotalar hosil qiladi. Masalan:
PBr3 + 3H2 O = 3HBr + H3 PO3
PI3 + 3H2 O = 3HI + H3 PO3
PCl5 + 4H2 O = 5HCl + H3 PO4
Ijrochi: |
Tadbir raqami. |
||||||||||||||||

Dastlabki ikkita reaksiya brom va vodorod yodidi ishlab chiqarish uchun ishlatiladi.
noik kislota.
Intergalidlar. Galogenlar bir-biri bilan qo'shilib, o'zaro ta'sir qiladi.
olib boradi. Bu birikmalarda engilroq va ko'proq elektron manfiy galogen (-1) oksidlanish darajasida, og'irroq esa musbat holatda bo'ladi.
oksidlanish jazolari.
Galogenlarning qizdirilganda to'g'ridan-to'g'ri o'zaro ta'siri tufayli quyidagilar olinadi: ClF, BrF, BrCl, ICl. Bundan tashqari, murakkabroq intergalidlar mavjud:
ClF3, BrF3, BrF5, IF5, IF7, ICl3.
Oddiy sharoitlarda barcha intergalidlar qaynash nuqtasi past bo'lgan suyuq moddalardir. Intergalidlar yuqori oksidlanish faolligiga ega
faoliyat. Masalan, SiO2, Al2 O3, MgO va boshqalar kabi kimyoviy barqaror moddalar ClF3 bug'larida yonadi.
2Al2 O3 + 4ClF3 = 4 AlF3 + 3O2 + 2Cl2
Ftorid ClF 3 tez ta'sir qiluvchi agressiv ftorli reagentdir
hovli F2. U organik sintezlarda va ftor bilan ishlash uchun nikel uskunalari yuzasida himoya plyonkalarni olish uchun ishlatiladi.
Suvda intergalidlar gidrolizlanib, kislotalar hosil qiladi. Masalan,
ClF5 + 3H2 O = HClO3 + 5HF
Tabiatdagi halogenlar. Oddiy moddalarni olish
Sanoatda galogenlar ularning tabiiy birikmalaridan olinadi. Hammasi
erkin galogenlarni olish jarayonlari galogenning oksidlanishiga asoslangan
Nid ionlari.
2G – G2 + 2e–
Galogenlarning katta miqdori tabiiy suvlarda anionlar shaklida uchraydi: Cl-, F-, Br-, I-. Dengiz suvida 2,5% gacha NaCl bo'lishi mumkin.
Brom va yod neft quduqlari va dengiz suvlaridan olinadi.
Ijrochi: |
Tadbir raqami. |
||||||||||||||||
Galogenlar ftor F, xlor C1, brom Br, yod I VILA guruhining elementlari. Asosiy holatda galogen atomlarining valentlik qobig'ining elektron konfiguratsiyasi ns 2 np 5. Tashqi p orbitalda beshta elektronning, shu jumladan bitta juftlashtirilmagan elektronning mavjudligi galogenlarning yuqori elektron yaqinligining sababidir. Elektronning qo'shilishi eng yaqin asil gazning barqaror 8 elektronli qobig'iga ega bo'lgan galoid anionlarining (F-, Cl-, Br-, I-) hosil bo'lishiga olib keladi. Galogenlar alohida metall bo'lmaganlardir.
Eng elektron manfiy element ftor, birikmalarda faqat bitta oksidlanish darajasiga ega - 1, chunki u har doim elektron qabul qiluvchi hisoblanadi. Murakkablardagi boshqa galogenlar oksidlanish darajasi -1 dan +7 gacha bo'lishi mumkin. Galogenlarning musbat oksidlanish darajalari koʻproq elektron manfiy elementlar bilan bogʻlanishlar hosil qilganda ularning valentlik elektronlarining tashqi darajadagi erkin d-orbitallarga oʻtishi (2.1.3-boʻlim) natijasida yuzaga keladi.
Galogen molekulalari ikki atomli: F 2, C1 2, Br 2, I 2. Standart sharoitda ftor va xlor gazlar, brom uchuvchi suyuqlik (Tbp = 59 °C), yod esa qattiq, lekin u osonlik bilan sublimatsiyalanadi (suyuqlik holatini chetlab o'tib, gaz holatiga aylanadi).
Redoks xossalari. Galogenlar kuchli oksidlovchi moddalar bo'lib, deyarli barcha metallar va ko'plab metall bo'lmaganlar bilan reaksiyaga kirishadi:
Ftor ayniqsa yuqori kimyoviy faollikni namoyish etadi, u qizdirilganda hatto ksenon, kripton va radon gazlari bilan ham reaksiyaga kirishadi:
![]()
Galogenlarning kimyoviy faolligi ftordan yodgacha kamayadi, chunki atom radiusi ortishi bilan halogenlarning elektron biriktirish qobiliyati pasayadi:

Faolroq galogen har doim kamroq faolni metallar bilan birikmalaridan siqib chiqaradi. Shunday qilib, ftor boshqa barcha galogenlarni galogenidlaridan, brom esa yodidlardan faqat yodni siqib chiqaradi:
Galogenlarning turli oksidlanish xususiyatlari ularning organizmga ta'sirida ham namoyon bo'ladi. Gazsimon xlor va ftor juda kuchli oksidlovchi xossalariga ko'ra o'pka va ko'z, burun va halqum shilliq qavatlariga jiddiy zarar etkazadigan kuchli zaharli moddalardir. Yod antiseptik xususiyatga ega bo'lgan engil oksidlovchi vositadir, shuning uchun u tibbiyotda keng qo'llaniladi.
Galogenlarning oksidlanish-qaytarilish xossalaridagi farqlar ular suv bilan o'zaro ta'sirlashganda ham paydo bo'ladi. Ftor suvni oksidlaydi, qaytaruvchi modda suv molekulasining kislorod atomi hisoblanadi:
Boshqa galogenlarning suv bilan o'zaro ta'siri ularning atomlarining oksidlanish-qaytarilish dismutatsiyasi bilan birga keladi. Shunday qilib, xlor suv bilan reaksiyaga kirishganda, xlor molekulasining boshqa atomdan elektron oladigan atomlaridan biri kamayadi va elektrondan voz kechgan boshqa xlor atomi oksidlanadi. Bu yaratadi xlorli suv, vodorod xlorid (xlorid kislotasi) va gipoxlorid (gipoxlorid) kislotani o'z ichiga olgan:
Reaksiya teskari bo'lib, uning muvozanati kuchli chapga siljigan. Hipoklorik kislota beqaror va oson parchalanadi, ayniqsa yorug'likda, juda kuchli oksidlovchi vosita - atomik kislorod hosil bo'lishi bilan:
Shunday qilib, xlorli suv turli konsentratsiyalarda turli oksidlanish qobiliyatiga ega bo'lgan uchta oksidlovchi moddalarni o'z ichiga oladi: molekulyar xlor, gipoxlorid kislota va atomik kislorod, ularning yig'indisi ko'pincha deyiladi. "faol xlor".
Olingan atom kislorodi bo'yoqlarni oqartiradi va mikroblarni o'ldiradi, bu xlorli suvning oqartiruvchi va bakteritsid ta'sirini tushuntiradi.
Hipoklorik kislota xlor gaziga qaraganda kuchliroq oksidlovchi moddadir. U RH organik birikmalari bilan oksidlovchi va xlorlovchi reagent sifatida reaksiyaga kirishadi:
Shuning uchun, tarkibida organik moddalar bo'lgan ichimlik suvi xlorlangan aralashmalar sifatida, ular RC1 ning zaharliroq xlorli birikmalariga aylanishi mumkin. Suvni tozalash usullarini ishlab chiqishda va ularni qo'llashda buni albatta hisobga olish kerak.
Xlorli suvga ishqor qo'shilganda, gipoxlorid va xlorid kislotalarning neytrallanishi tufayli muvozanat o'ngga siljiydi:
Tuzlar aralashmasining hosil bo'lgan eritmasi deyiladi Javhar suvi, oqartiruvchi va dezinfektsiyalovchi sifatida ishlatiladi. Bu xususiyatlar kaliy gipoxloritning CO2 + H 2 0 ta'sirida va gidroliz natijasida beqaror gipoxlorid kislotaga aylanib, atom kislorodini hosil qilishiga bog'liq. Natijada, Javel suvi bo'yoqlarni yo'q qiladi va mikroblarni o'ldiradi.
Gazsimon xlor ho'l o'chirilgan ohak Ca(OH) 2 ga ta'sir qilganda CaCl 2 va Ca (0C1) 2 tuzlari aralashmasi olinadi. oqartiruvchi:
Ohak xloridini CaCl(OCl) xlorid va gipoxlorik kislotalarning aralash kaltsiy tuzi deb hisoblash mumkin. Nam havoda oqartiruvchi suv va karbonat angidrid bilan o'zaro ta'sirlanib, asta-sekin gipoxlorid kislotani chiqaradi, bu uning sayqallash, dezinfektsiyalash va gazsizlantirish xususiyatlarini ta'minlaydi:
Oqartirish xlorid kislotasiga ta'sir qilganda, erkin xlor ajralib chiqadi:
Qizdirilganda gipoxlorid kislota oksidlanish-qaytarilish nomutanosibligi natijasida xlorid va perklorik kislotalarni hosil qilish uchun parchalanadi:
![]()
Xlor KOH kabi issiq ishqor eritmasidan o'tkazilganda kaliy xlorid va kaliy xlorat KClO 3 (Bertollet tuzi) hosil bo'ladi:
SlO - - SlO4(-) qatoridagi suvli eritmalardagi kislorodli xlor kislotalari anionlarining oksidlanish qobiliyati ulardagi xlorning oksidlanish darajasi oshishiga qaramay pasayadi:
![]()
Bu ularning manfiy zaryadining delokalizatsiyasining kuchayishi tufayli ushbu seriyadagi anionlarning barqarorligi oshishi bilan izohlanadi. Shu bilan birga, yuqori haroratlarda quruq holatda bo'lgan LiC10 4 va KClO 4 perxloratlar kuchli oksidlovchi moddalar bo'lib, ular tarkibidagi noorganik komponentlarni aniqlashda turli biomateriallarni mineralizatsiya qilish uchun ishlatiladi.
Galogen anionlari (F-dan tashqari) elektronlarni berishga qodir, shuning uchun ular qaytaruvchi moddalardir. Ularning radiusi oshgani sayin, galoid anionlarining qaytarilish qobiliyati xlorid anionidan yodid anioniga o'tadi:

Shunday qilib, gidroiyod kislota normal haroratda atmosfera kislorodi bilan oksidlanadi:
![]()
Xlorid kislota kislorod bilan oksidlanmaydi, shuning uchun xlorid anioni tana sharoitida barqaror, bu fiziologiya va tibbiyot nuqtai nazaridan juda muhimdir.
Kislota-asos xususiyatlari. Vodorod galogenidlari HF, HC1, HBr, HI molekulalarining qutbliligi tufayli suvda yaxshi eriydi. Bu holda molekulalarning hidratsiyasi sodir bo'lib, ularning gidratlangan protonlar va galoid anionlari hosil bo'lishi bilan dissotsiatsiyasiga olib keladi. HF, HC1, HBr, HI qatoridagi kislotalarning kuchi F-dan I-gacha bo'lgan anionlarning radiusi va qutblanishining ortishi hisobiga ortadi.
Xlorid kislotasi me'da shirasining tarkibiy qismi sifatida ovqat hazm qilish jarayonida muhim rol o'ynaydi. Asosan me'da shirasida massa ulushi 0,3% bo'lgan xlorid kislotasi tufayli uning pH 1 dan 3 gacha bo'lgan oraliqda saqlanadi. Xlorid kislota pepsin fermentini faol shaklga o'tishiga yordam beradi, bu esa oqsillarning hazm bo'lishini ta'minlaydi. turli aminokislotalarning hosil bo'lishi bilan peptid bog'larining gidrolitik parchalanishi tufayli:
Oshqozon shirasining xlorid kislotasi va boshqa kislotalarning tarkibini aniqlash bo'limida muhokama qilindi. 8.3.3.
Xlorning kislorodli kislotalar qatorida uning oksidlanish darajasi oshgani sayin kislotalarning kuchi ortadi.

Bu uning elektron zichligining xlor atomi tomon siljishi, shuningdek, anionlarning barqarorligi oshishi tufayli O-H bog'ining qutbliligining oshishi bilan bog'liq.
Komplekslash xususiyatlari. Galogen anionlar ligandlar sifatida komplekslar hosil qiladi. Galogenid komplekslarining barqarorligi odatda F- > Cl- > Br- > > I- tartibida kamayadi. Aynan kompleks hosil bo'lish jarayoni ftorid anionlarining toksik ta'sirini tushuntiradi, bu fermentlarning faol markazlariga kiritilgan metall kationlari bilan ftorid komplekslarini hosil qilib, ularning faolligini bostiradi.
Yod molekulasi qiziqarli kompleks hosil qiluvchi xususiyatlarni namoyish etadi. Shunday qilib, molekulyar yodning suvda eruvchanligi kaliy yodid ishtirokida keskin ortadi, bu murakkab anion hosil bo'lishi bilan bog'liq.
Ushbu kompleks ionning past barqarorligi eritmada molekulyar yod mavjudligini ta'minlaydi. Shuning uchun tibbiyotda KI qo'shilgan yodning suvli eritmasi bakteritsid sifatida ishlatiladi. Bundan tashqari, molekulyar yod kraxmal (22.3-bo'lim) va polivinil spirti bilan inklyuziya komplekslarini hosil qiladi. (ko'k yod). Ushbu komplekslarda yod molekulalari yoki ularning yodid anionlari bilan assotsiatsiyasi mos keladigan poligidroksi polimerlarning spiral tuzilishidan hosil bo'lgan kanallarni to'ldiradi. Inklyuziya komplekslari juda barqaror emas va asta-sekin molekulyar yodni chiqarishga qodir. Shuning uchun ko'k yod kabi preparat samarali, ammo yumshoq, uzoq muddatli bakteritsid agenti hisoblanadi.
Galogenlar va ularning birikmalarining biologik roli va tibbiyotda qo‘llanilishi. Turli birikmalar ko'rinishidagi galogenlar tirik to'qimalarning bir qismidir. Organizmda barcha galogenlarning oksidlanish darajasi 1 ga teng. Shu bilan birga, xlor va brom gidratlangan Cl- va Br-anionlar shaklida, ftor va yod esa suvda erimaydigan biosubstratlarning bir qismidir:
Ftorli birikmalar suyak to'qimasi, tirnoq va tishlarning tarkibiy qismidir. Ftoridning biologik ta'siri birinchi navbatda tish kasalliklari muammosi bilan bog'liq. Ftorid anioni gidroksiapatitdagi gidroksid ionini almashtirib, qattiq florapatitdan himoya emal qatlamini hosil qiladi:
Ichimlik suvini 1 mg/l ftorid ioni konsentratsiyasiga ftorlash va tish pastasiga natriy ftorid qo'shilishi aholida tish kariesini sezilarli darajada kamaytiradi. Shu bilan birga, ichimlik suvida ftorid anionining kontsentratsiyasi 1,2 mg / l dan yuqori bo'lsa, suyaklar va tish emalining mo'rtligi oshadi va tananing umumiy charchashi paydo bo'ladi. floroz.
Xlorid anionlari hujayra membranalari orqali ionli oqimlarni ta'minlaydi, osmotik gomeostazni saqlashda ishtirok etadi va me'da shirasining protolitik fermentlarining ta'siri va faollashishi uchun qulay muhit yaratadi.
Inson tanasidagi bromid anionlari asosan gipofiz va boshqa endokrin bezlarda lokalizatsiya qilinadi. Organizmdagi bromid va xlorid anionlarining tarkibi o'rtasida dinamik bog'liqlik mavjudligi aniqlangan. Shunday qilib, qonda bromid anionlarining ko'payishi buyraklar tomonidan xlorid anionlarining tez chiqarilishiga yordam beradi. Bromidlar asosan hujayralararo suyuqlikda joylashgan. Ular miya yarim korteksining neyronlarida inhibitiv jarayonlarni kuchaytiradi va shuning uchun kaliy, natriy va bromokafora bromidlari farmakologiyada qo'llaniladi.
Yod va uning birikmalari oqsillar, yog'lar va gormonlar sinteziga ta'sir qiladi. Yod miqdorining yarmidan ko'pi qalqonsimon bezda qalqonsimon gormonlar shaklida bog'langan holatda bo'ladi. Tanadagi yodning etarli darajada iste'mol qilinmasligi bilan endemik guatr rivojlanadi. Ushbu kasallikning oldini olish uchun osh tuziga NaI yoki KI qo'shiladi (1 kg NaCl uchun 1-2 g). Shunday qilib, barcha halogenlar tirik organizmlarning normal ishlashi uchun zarurdir.
13-bob
TA’RIF
Galogenlar– VIIA guruhi elementlari – ftor (F), xlor (Cl), brom (Br) va yod (I).
Galogenlarning tashqi energiya darajasining elektron konfiguratsiyasi ns 2 np 5. Galogenlar energiya darajasini to'ldirishdan oldin faqat bitta elektronga ega bo'lmaganligi sababli, ORRda ular ko'pincha oksidlovchi moddalarning xususiyatlarini namoyish etadilar. Galogenlarning oksidlanish darajasi: “-1” dan “+7” gacha. Galogen guruhining yagona elementi ftor faqat bitta oksidlanish holatini "-1" ko'rsatadi va eng elektronegativ element hisoblanadi.
Galogen molekulalari ikki atomli: F 2, Cl 2, Br 2, I 2. Kimyoviy element atomi yadrosining zaryadining ortishi bilan, ya'ni. ftordan yodga o'tganda galogenlarning oksidlanish qobiliyati pasayadi, bu quyi halogenlarni gidrogal kislotalar va ularning tuzlaridan yuqoriroqlari bilan siqib chiqarish qobiliyati bilan tasdiqlanadi:
Br 2 + 2HI = I 2 + 2HBr
Cl 2 + 2KBr = Br 2 + 2KCl
Galogenlarning fizik xossalari
No. ftor o'tkir hidli och sariq gazdir. Zaharli. Xlor och yashil gaz, xuddi ftor kabi, o'tkir hidga ega. Yuqori zaharli. Yuqori bosim va xona haroratida u osongina suyuq holatga aylanadi. Brom - xarakterli yoqimsiz o'tkir hidli qizil-jigarrang og'ir suyuqlik. Suyuq brom, shuningdek, uning bug'lari juda zaharli hisoblanadi. Brom suvda yomon, qutbsiz erituvchilarda yaxshi eriydi. Yod to'q kulrang qattiq modda bo'lib, metall yaltiraydi. Yod bug'i binafsha rangga ega. Yod osongina sublimatsiya qiladi, ya'ni. suyuq holatni chetlab o'tib, qattiq holatdan gazsimon holatga aylanadi.
Galogenlarni ishlab chiqarish
Galogenlarni eritmalar yoki galogenid eritmalarini elektroliz qilish orqali olish mumkin:
MgCl 2 = Mg + Cl 2 (eritma)
Ko'pincha halogenlar gidrogal kislotalarning oksidlanish reaktsiyasi natijasida olinadi:
MnO 2 + 4HCl = MnCl 2 + Cl 2 +2H 2 O
K 2 Cr 2 O 7 + 14HCl = 3Cl 2 + 2KCl +2CrCl 3 +7H 2 O
2KMnO 4 +16HCl = 2MnCl 2 +5Cl 2 +8H 2 O +2KCl
Galogenlarning kimyoviy xossalari
Ftor eng katta kimyoviy faollikka ega. Ko'pgina kimyoviy elementlar, hatto xona haroratida ham, ftor bilan o'zaro ta'sir qiladi va katta miqdorda issiqlik chiqaradi. Hatto suv ftorda yonadi:
2H 2 O + 2F 2 = 4HF + O 2
Erkin xlor ftorga qaraganda kamroq reaktivdir. Kislorod, azot va asil gazlar bilan bevosita reaksiyaga kirishmaydi. Ftor kabi boshqa barcha moddalar bilan o'zaro ta'sir qiladi:
2Fe + Cl 2 = 2FeCl 3
2P + 5Cl 2 = 2PCl 5
Sovuqda xlor suv bilan o'zaro ta'sir qilganda, teskari reaktsiya paydo bo'ladi:
Cl 2 + H 2 O↔HCl +HClO
Reaksiya mahsulotlari aralashmasi xlorli suv deb ataladi.
Sovuqda xlor ishqorlar bilan o'zaro ta'sirlashganda xloridlar va gipoxloritlar aralashmalari hosil bo'ladi:
Cl 2 + Ca(OH) 2 = Ca(Cl)OCl + H 2 O
Xlorni issiq gidroksidi eritmasida eritganda quyidagi reaksiya sodir bo'ladi:
3Cl 2 + 6KOH=5KCl +KClO 3 +3H 2 O
Brom, xlor kabi, suvda eriydi va u bilan qisman reaksiyaga kirishib, "bromli suv" deb ataladigan suvni hosil qiladi, yod esa suvda deyarli erimaydi.
Yod kimyoviy faolligi bilan boshqa galogenlardan sezilarli farq qiladi. Koʻpchilik nometallar bilan reaksiyaga kirishmaydi, faqat qizdirilganda metallar bilan sekin reaksiyaga kirishadi. Yodning vodorod bilan o'zaro ta'siri faqat kuchli qizdirilganda sodir bo'ladi, reaktsiya endotermik va juda qaytaruvchan:
H 2 + I 2 = 2HI - 53 kJ.
Muammoni hal qilishga misollar
MISOL 1
| Mashq qilish | Og'irligi 508 g bo'lgan yod hosil bo'lsa, kaliy yodid bilan reaksiyaga kirishgan xlor hajmini (no) hisoblang. |
| Yechim | Reaksiya tenglamasini yozamiz: Cl 2 + 2KI = I 2 + 2KCl Hosil bo'lgan yod miqdorini topamiz: v(I 2)=m(I 2)/M(I 2) v(I 2)=508/254=2 mol Reaksiya tenglamasiga ko'ra, xlor moddasining miqdori. Kimyo darsligidan ko'pchilik biladiki, galogenlar jadvaldagi 17-guruhdan Mendeleyev davriy tizimining kimyoviy elementlarini o'z ichiga oladi. Yunon tilidan tug'ilish, kelib chiqish deb tarjima qilingan. Ularning deyarli barchasi juda faol, shuning uchun ular oddiy moddalar bilan kuchli reaksiyaga kirishadilar, bir nechta metall bo'lmaganlar bundan mustasno. Galogenlar nima va ularning xususiyatlari qanday? Bilan aloqada Galogenlar ro'yxatiGalogenlar yaxshi oksidlovchi moddalardir, shuning uchun tabiatda ularni faqat ba'zi birikmalarda topish mumkin. Atom raqami qanchalik baland bo'lsa, ushbu guruh elementlarining kimyoviy faolligi shunchalik past bo'ladi. Galogenlar guruhiga quyidagi elementlar kiradi:
Ikkinchisi Dubna shahrida joylashgan Yadro tadqiqotlari institutida ishlab chiqilgan. Ftor - och sariq rangga ega zaharli gaz. Xlor ham zaharli hisoblanadi. Bu och yashil rangdagi juda o'tkir va yoqimsiz hidga ega gaz. Brom qizil-jigarrang rangga ega va zaharli suyuqlik bo'lib, hatto hid hissiga ham ta'sir qilishi mumkin. U juda uchuvchan, shuning uchun u ampulalarda saqlanadi. Yod kristall, oson sublimatsiya qilinadigan, to'q binafsha rangli moddadir. Astatin radioaktiv, kristall rangi: ko'k bilan qora, yarim yemirilish davri 8,1 soat.
Ftor inert gazlar bilan o'zaro ta'sir qiladi va nurlanadi (Xe + F 2 = XeF 2 + 152 kJ). Ftor qizdirilganda boshqa halogenlarga ta'sir qiladi, ularni oksidlaydi. Formula o'rinli: Hal 2 + F 2 = 2HalF, bu erda Xlor, brom, yod va astatinning yarim oksidlanish darajalari + 1 ga teng bo'lgan holda Hal = Cl, Br, I, At. Ftor ham murakkab moddalar bilan juda kuchli ta'sir o'tkazadi. Natijada suvning oksidlanishi. Bunday holda, portlovchi reaktsiya sodir bo'ladi, u qisqacha formula bilan yoziladi: 3F 2 + ZH 2 O = OF 2 + 4HF + H 2 O 2. XlorErkin xlorning faolligi ftordan bir oz kamroq, lekin u ham yaxshi reaksiyaga kirishish qobiliyatiga ega. Bu kislorod, azot va inert gazlar ko'rinishidagi noyob istisnolardan tashqari, ko'plab oddiy moddalar bilan o'zaro ta'sirlashganda sodir bo'lishi mumkin. U murakkab moddalar bilan shiddatli reaksiyaga kirishishi mumkin, almashtirish reaktsiyalarini yaratish, uglevodorodlarni qo'shish xususiyati ham xlorga xosdir. Qizdirilganda brom yoki yod vodorod yoki metallar bilan birikmalardan ajraladi.
Cl2+ h n → 2Cl, Cl + H2 → HCl + H, H + Cl2 → HCl + Cl, Cl + H2 → HCl + H va boshqalar. Fotonlar qo'zg'alganda, Cl 2 molekulalarining atomlarga parchalanishiga olib keladi va keyingi bosqichning boshlanishini boshlaydigan yangi zarrachalarning paydo bo'lishiga olib keladigan zanjir reaktsiyasi sodir bo'ladi. Kimyo tarixida bu hodisa o'rganilgan. Rus kimyogari, Nobel mukofoti laureati N.N. Semenov. 1956 yilda fotokimyoviy zanjir reaktsiyasini o'rgandi va shu bilan fanga katta hissa qo'shdi. Xlor ko'plab murakkab moddalar bilan reaksiyaga kirishadi, bular almashtirish va qo'shilish reaktsiyalari. U suvda yaxshi eriydi. Cl 2 + H 2 O = HCl + HClO - 25 kJ. Ishqorlar bilan, qizdirilganda, xlor mumkin nomutanosib.
Brom, yod va astatinBromning kimyoviy faolligi yuqorida qayd etilgan ftor yoki xlornikidan bir oz kamroq, lekin u ham ancha yuqori. Brom ko'pincha suyuq holatda ishlatiladi. U, xlor kabi, suvda juda yaxshi eriydi. U bilan qisman reaktsiya paydo bo'lib, "bromli suv" olish imkonini beradi. Yodning kimyoviy faolligi ushbu seriyaning boshqa vakillaridan sezilarli darajada farq qiladi. U deyarli metall bo'lmaganlar bilan emas, balki o'zaro ta'sir qiladi Metallar bilan reaksiya juda sekin va faqat qizdirilganda sodir bo'ladi. Bunday holda, issiqlikning katta yutilishi (endotermik reaktsiya) sodir bo'ladi, bu juda qaytariladi. Buning ustiga Yodni hech qanday tarzda suvda eritib bo'lmaydi, bunga hatto isitish bilan ham erishib bo'lmaydi, shuning uchun "yodli suv" tabiatda mavjud emas. Yod faqat yodid eritmasida eritilishi mumkin. Bunda kompleks anionlar hosil bo'ladi. Tibbiyotda bu birikma Lugol eritmasi deb ataladi. Astatin metallar va vodorod bilan reaksiyaga kirishadi. Galogenlar qatorida kimyoviy faollik ftordan astatingacha bo'lgan yo'nalishda kamayadi. F - At seriyasidagi har bir halogen keyingi elementlarni metallar yoki vodorod bilan birikmalardan siqib chiqarishga qodir. Astatin bu elementlarning eng passividir. Ammo u metallar bilan o'zaro ta'sir qilish bilan tavsiflanadi. IlovaKimyo hayotimizga mustahkam o‘rnashib olgan, barcha sohalarga kirib bormoqda. Inson o'z manfaati uchun galogenlarni, shuningdek, uning birikmalaridan foydalanishni o'rgandi. Galogenlarning biologik ahamiyati shubhasizdir. Ularni qo'llash sohalari har xil:
Xlor bizning hayotimizda eng keng tarqalgan foydalanishni topdi. Uni qo'llash doirasi juda xilma-xildir. Foydalanishga misollar:
Shuni esda tutish kerakki, galogenlar juda zaharli moddalardir. Bu xususiyat ayniqsa ftorda yaqqol namoyon bo'ladi. Galogenlar asfiksiyaga, nafas olish yo'llarining tirnash xususiyati keltirib chiqarishi va biologik to'qimalarga zarar etkazishi mumkin. Xlor bug'lari o'ta xavfli bo'lishi mumkin, shuningdek, zaif hidga ega va yuqori konsentratsiyalarda sezilishi mumkin bo'lgan ftorli aerozol. Biror kishi bo'g'ilish ta'sirini boshdan kechirishi mumkin. Bunday ulanishlar bilan ishlashda ehtiyot choralarini ko'rish kerak. Galogenlarni olish usullari murakkab va xilma-xildir. Sanoatda bunga qat'iy rioya qilinadigan muayyan talablar bilan yondashiladi. Mavzu bo'yicha ko'proq |
 Galogenlarning yuqori oksidlanish faolligi ftordan yodgacha kamayadi. Uning birodarlarining eng faoli ftor bo'lib, u har qanday metallar bilan reaksiyaga kirishish, tuzlar hosil qilish qobiliyatiga ega, ularning ba'zilari o'z-o'zidan yonib, juda katta miqdorda issiqlik chiqaradi. Issiqliksiz bu element deyarli barcha metall bo'lmaganlar bilan reaksiyaga kirishadi, reaktsiyalar ma'lum miqdorda issiqlik (ekzotermik) chiqishi bilan birga keladi.
Galogenlarning yuqori oksidlanish faolligi ftordan yodgacha kamayadi. Uning birodarlarining eng faoli ftor bo'lib, u har qanday metallar bilan reaksiyaga kirishish, tuzlar hosil qilish qobiliyatiga ega, ularning ba'zilari o'z-o'zidan yonib, juda katta miqdorda issiqlik chiqaradi. Issiqliksiz bu element deyarli barcha metall bo'lmaganlar bilan reaksiyaga kirishadi, reaktsiyalar ma'lum miqdorda issiqlik (ekzotermik) chiqishi bilan birga keladi. Bu element vodorod bilan o'ziga xos munosabatga ega. Xona haroratida va yorug'likka ta'sir qilmasdan, xlor bu gazga hech qanday ta'sir ko'rsatmaydi, lekin u qizdirilsa yoki yorug'likka yo'naltirilsa, portlovchi zanjirli reaktsiya paydo bo'ladi. Formula quyida keltirilgan:
Bu element vodorod bilan o'ziga xos munosabatga ega. Xona haroratida va yorug'likka ta'sir qilmasdan, xlor bu gazga hech qanday ta'sir ko'rsatmaydi, lekin u qizdirilsa yoki yorug'likka yo'naltirilsa, portlovchi zanjirli reaktsiya paydo bo'ladi. Formula quyida keltirilgan: Tabiiy birikma kriolitdan kimyoviy formulasi quyidagicha: Na3AlF6 olinadi. alyuminiy. Ftorli birikmalar ishlab chiqarishda keng qo'llaniladi tish pastalari. Ftorid kariesning oldini olishga yordam berishi ma'lum. Yodning spirtli damlamasi ishlatiladi yaralarni dezinfektsiyalash va dezinfektsiyalash uchun.
Tabiiy birikma kriolitdan kimyoviy formulasi quyidagicha: Na3AlF6 olinadi. alyuminiy. Ftorli birikmalar ishlab chiqarishda keng qo'llaniladi tish pastalari. Ftorid kariesning oldini olishga yordam berishi ma'lum. Yodning spirtli damlamasi ishlatiladi yaralarni dezinfektsiyalash va dezinfektsiyalash uchun.