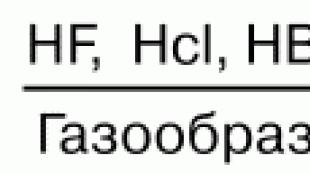Halogener fysikaliska och kemiska egenskaper hos föreningar applikationer. Halogener och deras föreningar. Halogenföreningar och deras roll i människokroppen
Halogener– Grupp VII element – fluor, klor, brom, jod, astatin (astatin har studerats lite på grund av dess radioaktivitet). Halogener är distinkta icke-metaller. Endast jod i sällsynta fall uppvisar vissa egenskaper som liknar metaller.
I det oexciterade tillståndet har halogenatomerna en gemensam elektronisk konfiguration: ns2np5. Det betyder att halogener har 7 valenselektroner, förutom fluor.
Fysikaliska egenskaper hos halogener: F2 – färglös, svår flytande gas; Cl2 är en gulgrön, lätt flytande gas med en stickande kvävande lukt; Br2 – rödbrun vätska; I2 är ett violett kristallint ämne.

Vattenhaltiga lösningar av vätehalogenider bildar syror. HF – vätefluorid (fluorid); HCl – saltsyra (salt); НBr—vätebromid; HI – vätejodid. Syrors styrka minskar från topp till botten. Fluorvätesyra är den svagaste i serien av halogenerade syror, och jodvätesyra är den starkaste. Detta förklaras av det faktum att bindningsenergin för Hg minskar från ovan. Styrkan hos NG-molekylen minskar i samma riktning, vilket är förknippat med en ökning av det internukleära avståndet. Lösligheten av svagt lösliga salter i vatten minskar också:
Från vänster till höger minskar lösligheten av halogenider. AgF är mycket lösligt i vatten. Alla halogener i fritt tillstånd är oxidationsmedel. Deras styrka som oxidationsmedel minskar från fluor till jod. I kristallina, flytande och gasformiga tillstånd finns alla halogener i form av individuella molekyler. Atomradien ökar i samma riktning, vilket leder till en ökning av smält- och kokpunkter. Fluor dissocierar till atomer bättre än jod. Elektrodpotentialerna minskar när man rör sig nedåt i halogenundergruppen. Fluor har den högsta elektrodpotentialen. Fluor är det starkaste oxidationsmedlet. Varje högre fri halogen kommer att ersätta den lägre, som är i tillståndet av en negativ enkelladdad jon i lösning.
20. Klor. Klorväte och saltsyra
Klor (Cl) – står i 3:e perioden, i grupp VII av huvudundergruppen av det periodiska systemet, serienummer 17, atommassa 35.453; avser halogener.
Fysikaliska egenskaper: gulgrön gas med en stickande lukt. Densitet 3,214 g/l; smältpunkt -101 °C; kokpunkt -33,97 °C, Vid normal temperatur blir det lätt flytande under ett tryck på 0,6 MPa. Upplöses i vatten, det bildar gulaktigt klorvatten. Det är mycket lösligt i organiska lösningsmedel, särskilt hexan (C6H14) och koltetraklorid.
Kemiska egenskaper hos klor: elektronisk konfiguration: 1s22s22p63s22p5. Det finns 7 elektroner i den yttre nivån. För att slutföra nivån behöver du 1 elektron, som klor accepterar, som uppvisar ett oxidationstillstånd på -1. Det finns även positiva oxidationstillstånd för klor upp till +7. Följande kloroxider är kända: Cl2O, ClO2, Cl2O6 och Cl2O7. De är alla instabila. Klor är ett starkt oxidationsmedel. Det reagerar direkt med metaller och icke-metaller:
Reagerar med väte. Under normala förhållanden fortsätter reaktionen långsamt, med stark uppvärmning eller belysning - med en explosion, enligt en kedjemekanism:
![]()
Klor interagerar med alkalilösningar och bildar salter - hypokloriter och klorider:
När klor leds in i en alkalilösning bildas en blandning av klorid- och hypokloritlösningar:
Klor är ett reduktionsmedel: Cl2 + 3F2 = 2ClF3.
Interaktion med vatten:
Klor reagerar inte direkt med kol, kväve och syre.
Mottagande: 2NaCl + F2 = 2NaF + Cl2.
Elektrolys: 2NaCl + 2H2O = Cl2 + H2 + 2NaOH.
Att hitta i naturen: ingår i följande mineraler: halit (stensalt), sylvit, bischofit; havsvatten innehåller klorider av natrium, kalium, magnesium och andra element.
Klorväte HCl. Fysikaliska egenskaper: färglös gas, tyngre än luft, mycket löslig i vatten för att bilda saltsyra.
Mottagande: i laboratoriet:
Inom industrin: väte förbränns i en ström av klor. Därefter löses klorväte i vatten för att bilda saltsyra (se ovan).
Kemiska egenskaper: saltsyra är stark, enbasisk, interagerar med metaller i spänningsserien upp till väte: Zn + 2HCl = ZnCl2 + H2.
Som reduktionsmedel reagerar det med oxider och hydroxider av många metaller.
Elementens kemi
Ickemetaller av VIIA-undergrupp
Element i VIIA-undergruppen är typiska icke-metaller med hög
elektronegativitet, de har ett gruppnamn - "halogener".
Huvudfrågor som behandlas i föreläsningen
Allmänna egenskaper hos icke-metaller i VIIA-undergruppen. Elektronisk struktur, de viktigaste egenskaperna hos atomer. Den mest karakteristiska ste-
oxidationsstraff. Funktioner i halogenernas kemi.
Enkla ämnen.
Naturliga föreningar.
Halogenföreningar
Halogenvätesyror och deras salter. Salt och fluorvätesyra
slots, kvitto och ansökan.
Halidkomplex.
Binära syreföreningar av halogener. Instabilitet ca.
Redoxegenskaper hos enkla ämnen och sam-
enheter. Disproportionella reaktioner. Latimerdiagram.
Testamentsexekutor: |
Event nr. |
||||||||||||||||

Kemi av element i VIIA-undergruppen
generella egenskaper
Mangan |
||||||||
Teknetium |
||||||||
VIIA-gruppen bildas av p-element: fluor F, klor
Cl, brom Br, jod I och astatin At.
Den allmänna formeln för valenselektroner är ns 2 np 5.
Alla element i grupp VIIA är typiska icke-metaller.
Som framgår av fördelningen |
|||||||
valenselektroner |
|||||||
enligt atomernas orbitaler |
bara en elektron saknas |
||||||
för att bilda ett stabilt skal med åtta elektroner
lådor, det är därför de har det finns en stark tendens till
addition av en elektron.
Alla element bildar lätt enkel enkelladdning
ny anjoner G – .
I form av enkla anjoner finns element av grupp VIIA i naturligt vatten och i kristaller av naturliga salter, till exempel halit NaCl, sylvite KCl, fluorit
CaF2.
Allmänt gruppnamn för element VIIA-
grupp "halogener", dvs. "föder salter", beror på det faktum att de flesta av deras föreningar med metaller är för-
är ett typiskt salt (CaF2, NaCl, MgBr2, KI), som
som kan erhållas genom direkt interaktion
interaktion mellan metall och halogen. Fria halogener erhålls från naturliga salter, så namnet "halogener" översätts också som "födda från salter."
Testamentsexekutor: |
Event nr. |
||||||||||||||||

Minsta oxidationstillstånd (–1) är det mest stabila
för alla halogener.
Vissa egenskaper hos atomerna i grupp VIIA-element ges i
De viktigaste egenskaperna hos atomer av element i grupp VIIA
Relativ- |
Affinitet |
||||||
elektrisk |
|||||||
negativ |
jonisering, |
||||||
ness (enligt |
|||||||
Omröstning) |
|||||||
ökning i antal |
|||||||
elektroniska lager; |
|||||||
ökning i storlek |
|||||||
minskning av el |
|||||||
trippel negativitet |
Halogener har en hög elektronaffinitet (max vid
Cl) och mycket hög joniseringsenergi (maximalt vid F) och maximum
möjlig elektronegativitet i varje period. Fluor är mest
elektronegativ för alla kemiska grundämnen.
Närvaron av en oparad elektron i halogenatomer avgör
representerar föreningen av atomer i enkla ämnen till diatomiska molekyler Г2.
För enkla ämnen, halogener, är de mest karakteristiska oxidationsmedlen
egenskaper, som är starkast i F2 och försvagas vid övergång till I2.
Halogener kännetecknas av den största reaktiviteten av alla icke-metalliska grundämnen. Fluor, även bland halogener, sticker ut
har extremt hög aktivitet.
Elementet i den andra perioden, fluor, skiljer sig starkast från den andra
andra delar av undergruppen. Detta är ett allmänt mönster för alla icke-metaller.
Testamentsexekutor: |
Event nr. |
||||||||||||||||
Fluor, som det mest elektronegativa elementet, visar inte sex
inhemska oxidationstillstånd. I alla sammanhang, inklusive med ki-
syre, fluor är i oxidationstillståndet (-1).
Alla andra halogener uppvisar positiva oxidationsgrader
leniya upp till maximalt +7.
De mest karakteristiska oxidationstillstånden för halogener:
F: -1, 0;
Cl, Br, I: -1, 0, +1, +3, +5, +7.
Cl har kända oxider där den finns i oxidationstillstånd: +4 och +6.
De viktigaste halogenföreningarna, i positiva tillstånd,
Sanktioner för oxidation är syrehaltiga syror och deras salter.
Alla halogenföreningar i positiva oxidationstillstånd är
är starka oxidationsmedel.
fruktansvärd grad av oxidation. Disproportionering främjas av en alkalisk miljö.
Praktisk tillämpning av enkla ämnen och syreföreningar
Minskningen av halogener beror främst på deras oxiderande effekt.
De enklaste ämnena, Cl2, har den bredaste praktiska tillämpningen.
och F2. Den största mängden klor och fluor konsumeras i industrin
organisk syntes: vid tillverkning av plast, köldmedier, lösningsmedel,
bekämpningsmedel, droger. Betydande mängder klor och jod används för att få fram metaller och för att förädla dem. Klor används också
för blekning av cellulosa, för desinficering av dricksvatten och i produktion
vatten av blekmedel och saltsyra. Salter av oxosyror används vid tillverkning av sprängämnen.
Testamentsexekutor: |
Event nr. |
||||||||||||||||

Syror - salt och smälta syror - används ofta i praktiken.
Fluor och klor är bland de tjugo vanligaste grundämnena
där finns det betydligt mindre brom och jod i naturen. Alla halogener förekommer i naturen i sitt oxidationstillstånd(-1). Endast jod förekommer i form av saltet KIO3,
som ingår som en förorening i chilensk salpeter (KNO3).
Astatin är ett artificiellt producerat radioaktivt grundämne (det finns inte i naturen). Instabiliteten hos At återspeglas i namnet, som kommer från grekiskan. "astatos" - "instabil". Astatin är en bekväm sändare för strålbehandling av cancertumörer.
Enkla ämnen
Enkla ämnen av halogener bildas av diatomiska molekyler G2.
I enkla ämnen, under övergången från F2 till I2 med en ökning av antalet elektroner
tronlager och en ökning av atomernas polariserbarhet sker en ökning
intermolekylär interaktion, vilket leder till en förändring i aggregerad sam-
står under standardförhållanden.
Fluor (under normala förhållanden) är en gul gas, vid –181o C övergår den till
flytande tillstånd.
Klor är en gulgrön gas som omvandlas till vätska vid –34o C. Med färgen ha-
Namnet Cl är associerat med det, det kommer från grekiskan "kloros" - "gul-
grön". En kraftig ökning av kokpunkten för Cl2 jämfört med F2,
indikerar ökad intermolekylär interaktion.
Brom är en mörkröd, mycket flyktig vätska, kokar vid 58,8oC.
namnet på elementet är förknippat med den skarpa obehagliga lukten av gas och härrör från
"bromos" - "illaluktande".
Jod – mörklila kristaller, med en svag "metallic"
klumpar, som vid upphettning lätt sublimeras och bildar violetta ångor;
med snabb kylning |
ångor upp till 114oC |
vätska bildas. Temperatur |
|||||||||||||||||
Testamentsexekutor: |
Event nr. |
||||||||||||||||||
Kokpunkten för jod är 183 ° C. Dess namn kommer från färgen på jodånga -
"jodos" - "lila".
Alla enkla ämnen har en stickande lukt och är giftiga.
Inandning av deras ångor orsakar irritation av slemhinnor och andningsorgan, och vid höga koncentrationer - kvävning. Under första världskriget användes klor som ett giftigt ämne.
Fluorgas och flytande brom orsakar brännskador på huden. Jobbar med ha-
logens bör försiktighetsåtgärder vidtas.
Eftersom enkla ämnen av halogener bildas av opolära molekyler
kyler, de löser sig väl i opolära organiska lösningsmedel:
alkohol, bensen, koltetraklorid etc. Klor, brom och jod är svårlösliga i vatten, deras vattenlösningar kallas klor, brom och jodvatten. Br2 löser sig bättre än andra, bromkoncentration i sat.
Lösningen når 0,2 mol/l och klor – 0,1 mol/l.
Fluor sönderdelar vatten:
2F2 + 2H2O = O2 + 4HF
Halogener uppvisar hög oxidativ aktivitet och övergång
till halogenidanjoner.
Г2 + 2e– 2Г–
Fluor har särskilt hög oxidativ aktivitet. Fluor oxiderar ädelmetaller (Au, Pt).
Pt + 3F2 = PtF6
Det interagerar till och med med vissa inerta gaser (krypton,
xenon och radon), till exempel,
Xe + 2F2 = XeF4
Många mycket stabila föreningar brinner i en F2-atmosfär, t.ex.
vatten, kvarts (SiO2).
Si02 + 2F2 = SiF4 + O2
Testamentsexekutor: |
Event nr. |
||||||||||||||||

I reaktioner med fluor, även sådana starka oxidationsmedel som kväve och svavel
ninsyra, fungerar som reduktionsmedel, medan fluor oxiderar tillförseln
som innehåller O(–2) i sin sammansättning.
2HNO3 + 4F2 = 2NF3 + 2HF + 3O2 H2SO4 + 4F2 = SF6 + 2HF + 2O2
Den höga reaktiviteten hos F2 skapar svårigheter med valet av kon-
strukturella material för att arbeta med det. Vanligtvis för dessa ändamål använder vi
Det finns nickel och koppar, som, när de oxideras, bildar täta skyddande filmer av fluorider på sin yta. Namnet F beror på dess aggressiva handling.
Jag äter, det kommer från grekiskan. "fluoros" - "destruktiv".
I serierna F2, Cl2, Br2, I2 försvagas oxidationsförmågan på grund av en ökning
öka storleken på atomer och minska elektronegativiteten.
I vattenlösningar, materiens oxidativa och reduktiva egenskaper
Ämnen karakteriseras vanligtvis med hjälp av elektrodpotentialer. Tabellen visar standardelektrodpotentialer (Eo, V) för reduktionshalvreaktioner
bildning av halogener. Som jämförelse, Eo-värdet för ki-
kol är det vanligaste oxidationsmedlet.
Standardelektrodpotentialer för enkla halogenämnen
Eo, B, för reaktion |
|||||||||||||
O2 + 4e– + 4H+ 2H2O |
|||||||||||||
Eo, V |
|||||||||||||
för elektrod |
|||||||||||||
2Г– +2е – = Г2 |
|||||||||||||
Minskad oxidativ aktivitet
Som framgår av tabellen, F2 är ett mycket starkare oxidationsmedel,
än O2, därför finns inte F2 i vattenlösningar det oxiderar vatten,
återhämtar sig till F–. Att döma av E®-värdet, oxidationsförmågan hos Cl2
Testamentsexekutor: |
Event nr. |
||||||||||||||||
också högre än för O2. Under långtidslagring av klorvatten sönderfaller det faktiskt med frigöring av syre och bildning av HCl. Men reaktionen är långsam (Cl2-molekylen är märkbart starkare än F2-molekylen och
aktiveringsenergin för reaktioner med klor är högre), dispro-
portionering:
Cl2 + H2O HCl + HOCl
I vatten når det inte slutet (K = 3,9 . 10–4), därför finns Cl2 i vattenlösningar. Br2 och I2 kännetecknas av ännu större stabilitet i vatten.
Disproportionering är ett mycket karakteristiskt oxidativ
reduktionsreaktion för halogener. Disproportionering av förstärkningen
hälls i en alkalisk miljö.
Disproportionering av Cl2 i alkali leder till bildandet av anjoner
Cl– och ClO–. Disproportionationskonstanten är 7,5. 1015.
Cl2 + 2NaOH = NaCl + NaClO + H2O
När jod disproportioneras i alkali bildas I– och IO3–. Ana-
Logiskt sett oproportionerar Br2 jod. Produktbyten är oproportionerlig
nation beror på att anjonerna GO– och GO2– i Br och I är instabila.
Kanvänds inom industri
förmåga att erhålla ett starkt och snabbverkande hypokloritoxidationsmedel,
blekning kalk, bertholet salt.
3Cl2 + 6 KOH = 5KCl + KClO3 + 3H2O
Testamentsexekutor: |
Event nr. |
||||||||||||||||
Interaktion mellan halogener och metaller
Halogener reagerar kraftigt med många metaller, till exempel:
Mg + Cl2 = MgCl2 Ti + 2I2 TiI4
Na + halogenider, i vilka metallen har ett lågt oxidationstillstånd (+1, +2),
– Det är saltliknande föreningar med övervägande jonbindningar. Hur
se, joniska halogenider är fasta ämnen med hög smältpunkt
Metallhalider där metallen har en hög grad av oxidation
tioner är föreningar med övervägande kovalenta bindningar.
Många av dem är gaser, vätskor eller smältbara fasta ämnen under normala förhållanden. Till exempel är WF6 en gas, MoF6 är en vätska,
TiCl4 är flytande.
Interaktion mellan halogener och icke-metaller
Halogener interagerar direkt med många icke-metaller:
väte, fosfor, svavel, etc. Till exempel:
H2 + Cl2 = 2HCl 2P + 3Br2 = 2PBr3 S + 3F2 = SF6
Bindningen i icke-metallhalider är övervägande kovalent.
Typiskt har dessa föreningar låga smält- och kokpunkter.
Vid övergång från fluor till jod ökar halogenidernas kovalenta natur.
De kovalenta halogeniderna av typiska icke-metaller är sura föreningar; när de interagerar med vatten, hydrolyserar de för att bilda syror. Till exempel:
PBr3 + 3H2O = 3HBr + H3P03
PI3 + 3H2O = 3HI + H3P03
PCl5 + 4H2O = 5HCl + H3P04
Testamentsexekutor: |
Event nr. |
||||||||||||||||

De två första reaktionerna används för att producera brom och vätejodid.
noinsyra.
Interhalider. Halogener, som kombinerar med varandra, bildar interg-
leder. I dessa föreningar är den lättare och mer elektronegativa halogenen i (–1) oxidationstillstånd, och den tyngre är i positivt tillstånd.
oxidationsstraff.
På grund av den direkta interaktionen av halogener vid upphettning erhålls följande: ClF, BrF, BrCl, ICl. Det finns också mer komplexa interhalider:
ClF3, BrF3, BrF5, IF5, IF7, ICl3.
Alla interhalider är under normala förhållanden flytande ämnen med låga kokpunkter. Interhalider har en hög oxidativ aktivitet
aktivitet. Till exempel brinner sådana kemiskt stabila ämnen som SiO2, Al2O3, MgO, etc. i ClF3-ångor.
2Al2O3 + 4ClF3 = 4 AlF3 + 3O2 + 2Cl2
Fluor ClF 3 är ett aggressivt fluorerande reagens som verkar snabbt
gård F2. Det används i organiska synteser och för att erhålla skyddande filmer på ytan av nickelutrustning för att arbeta med fluor.
I vatten hydrolyserar interhalider för att bilda syror. Till exempel,
ClF5 + 3H2O = HCI03 + 5HF
Halogener i naturen. Att få enkla ämnen
Inom industrin erhålls halogener från deras naturliga föreningar. Allt
processer för att erhålla fria halogener är baserade på oxidation av halogen
Nidjoner.
2Г – Г2 + 2e–
En betydande mängd halogener finns i naturliga vatten i form av anjoner: Cl–, F–, Br–, I–. Havsvatten kan innehålla upp till 2,5 % NaCl.
Brom och jod erhålls från oljekällans vatten och havsvatten.
Testamentsexekutor: |
Event nr. |
||||||||||||||||
Halogenerna fluor F, klor C1, brom Br, jod I är element i VILA-gruppen. Elektronisk konfiguration av valensskalet av halogenatomer i grundtillståndet ns 2 np 5 . Närvaron av fem elektroner i den yttre p-orbitalen, inklusive en oparad, är orsaken till halogenernas höga elektronaffinitet. Tillsatsen av en elektron leder till bildandet av halidanjoner (F-, Cl-, Br-, I-) med ett stabilt 8-elektronskal av närmaste ädelgas. Halogener är distinkta icke-metaller.
Det mest elektronegativa elementet, fluor, har bara ett oxidationstillstånd i föreningar - 1, eftersom det alltid är en elektronacceptor. Andra halogener i föreningar kan ha oxidationstillstånd som sträcker sig från -1 till +7. De positiva oxidationstillstånden för halogener orsakas av övergången av deras valenselektroner till fria d-orbitaler på den yttre nivån (avsnitt 2.1.3) när de bildar bindningar med mer elektronegativa element.
Halogenmolekylerna är diatomiska: F 2, C1 2, Br 2, I 2. Under standardförhållanden är fluor och klor gaser, brom är en flyktig vätska (Tbp = 59 °C), och jod är ett fast ämne, men det sublimeras lätt (omvandlas till ett gasformigt tillstånd och går förbi det flytande tillståndet).
Redoxegenskaper. Halogener är starka oxidationsmedel som reagerar med nästan alla metaller och många icke-metaller:
Fluor uppvisar särskilt hög kemisk aktivitet, som vid upphettning reagerar även med ädelgaserna xenon, krypton och radon:
![]()
Den kemiska aktiviteten hos halogener minskar från fluor till jod, eftersom med ökande atomradie minskar halogenernas förmåga att fästa elektroner:

Den mer aktiva halogenen tränger alltid undan den mindre aktiva från dess föreningar med metaller. Således ersätter fluor alla andra halogener från deras halogenider, och brom ersätter endast jod från jodider:
De olika oxidativa egenskaperna hos halogener manifesteras också i deras effekt på kroppen. Gasformigt klor och fluor är på grund av sina mycket starka oxiderande egenskaper kraftfulla giftiga ämnen som orsakar allvarliga skador på lungor och slemhinnor i ögon, näsa och struphuvud. Jod är ett mildare oxidationsmedel som uppvisar antiseptiska egenskaper, så det används ofta inom medicin.
Skillnader i redoxegenskaperna hos halogener uppträder också när de interagerar med vatten. Fluor oxiderar vatten, där reduktionsmedlet är syreatomen i vattenmolekylen:
Interaktionen mellan andra halogener och vatten åtföljs av redox-dismutation av deras atomer. Sålunda, när klor reagerar med vatten, reduceras en av atomerna i klormolekylen, som får en elektron från en annan atom, och den andra kloratomen, som ger upp en elektron, oxideras. Detta skapar klorvatten, som innehåller klorväte (saltsyra) och underklorsyrlighet (underklorsyrlighet):
Reaktionen är reversibel och dess jämvikt förskjuts kraftigt åt vänster. Hypoklorsyra är instabil och sönderdelas lätt, särskilt i ljus, med bildning av ett mycket starkt oxidationsmedel - atomärt syre:
Klorvatten innehåller alltså i olika koncentrationer tre oxidationsmedel med olika oxiderande förmåga: molekylärt klor, hypoklorsyra och atomärt syre, vars summa ofta kallas "aktivt klor".
Det resulterande atomära syret bleker färgämnen och dödar mikrober, vilket förklarar den blekande och bakteriedödande effekten av klorvatten.
Hypoklorsyra är ett starkare oxidationsmedel än klorgas. Det reagerar med organiska föreningar RH både som oxidationsmedel och som kloreringsreagens:
Därför, när dricksvatten som innehåller organiska ämnen som föroreningar kloreras, kan de förvandlas till mer giftiga klororganiska föreningar RC1. Detta bör definitivt beaktas vid utveckling av vattenreningsmetoder och deras tillämpning.
När alkali tillsätts klorvatten skiftar jämvikten åt höger på grund av neutraliseringen av underklor- och saltsyror:
Den resulterande lösningen av en blandning av salter, kallas Spjutvatten, används som blekning och desinfektionsmedel. Dessa egenskaper beror på det faktum att kaliumhypoklorit under påverkan av CO2 + H 2 0 och som ett resultat av hydrolys omvandlas till instabil hypoklorsyra, vilket bildar atomärt syre. Som ett resultat förstör Javel-vatten färgämnen och dödar mikrober.
När gasformigt klor verkar på våtsläckt kalk Ca(OH) 2 erhålls en blandning av salter CaCl 2 och Ca(0C1) 2, kallad bleka:
Kalkklorid kan betraktas som ett blandat kalciumsalt av saltsyra och underklorsyra CaCl(OCl). I fuktig luft frigör blekmedel, som interagerar med vatten och koldioxid, gradvis hypoklorsyra, vilket ger dess blekande, desinficerande och avgasande egenskaper:
När blekmedel utsätts för saltsyra frigörs fritt klor:
Vid upphettning sönderfaller hypoklorsyra som ett resultat av redoxdisproportionering för att bilda salt- och perklorsyra:
![]()
När klor leds genom en het alkalilösning, såsom KOH, bildas kaliumklorid och kaliumklorat KClO 3 (Bertholletsalt):
Oxidationsförmågan hos anjoner av syrehaltiga klorsyror i vattenlösningar i serien СlO - - СlO4(-) minskar trots ökningen av oxidationsgraden av klor i dem:
![]()
Detta förklaras av en ökning av stabiliteten hos anjoner i denna serie på grund av ökad delokalisering av deras negativa laddning. Samtidigt är LiC10 4 och KClO 4 perklorater i torrt tillstånd vid höga temperaturer starka oxidationsmedel och används för mineralisering av olika biomaterial vid bestämning av vilka oorganiska komponenter de innehåller.
Halogenanjoner (förutom F-) kan donera elektroner, så de är reduktionsmedel. När deras radie ökar, ökar den reducerande förmågan hos halidanjoner från kloridanjonen till jodidanjonen:

Således oxideras jodvätesyra av atmosfäriskt syre redan vid normal temperatur:
![]()
Saltsyra oxideras inte av syre, och därför är kloridanjonen stabil under kroppsförhållanden, vilket är mycket viktigt ur fysiologi och medicin.
Syra-bas egenskaper. Vätehalogenider HF, HC1, HBr, HI, på grund av deras molekylers polaritet, är mycket lösliga i vatten. I detta fall sker hydratisering av molekylerna, vilket leder till att de dissocieras med bildandet av hydratiserade protoner och halidanjoner. Styrkan hos syror i serierna HF, HC1, HBr, HI ökar på grund av en ökning av anjonernas radie och polariserbarhet från F- till I-.
Saltsyra, som en komponent i magsaft, spelar en viktig roll i matsmältningsprocessen. Främst på grund av saltsyra, vars massandel i magsaft är 0,3 %, hålls dess pH i intervallet från 1 till 3. Saltsyra främjar övergången av pepsinenzymet till dess aktiva form, vilket säkerställer nedbrytningen av proteiner på grund av den hydrolytiska klyvningen av peptidbindningar med bildning av olika aminosyror:
Bestämningen av innehållet av saltsyra och andra syror i magsaft diskuterades i avsnitt. 8.3.3.
I serien av syrehaltiga syror av klor, när dess oxidationstillstånd ökar, ökar syrornas styrka.

Detta beror på en ökning av polariteten hos O-H-bindningen på grund av en förskjutning i dess elektrontäthet mot kloratomen, samt på en ökning av anjonernas stabilitet.
Komplexerande egenskaper. Halogenanjoner tenderar att bilda komplex som ligander. Stabiliteten för halogenidkomplex minskar vanligtvis i ordningen F- > Cl- > Br- > > I-. Det är processen för komplexbildning som förklarar den toxiska effekten av fluoridanjoner, som genom att bilda fluorkomplex med metallkatjoner som ingår i enzymernas aktiva centra undertrycker deras aktivitet.
Jodmolekylen uppvisar intressanta komplexbildande egenskaper. Således ökar lösligheten av molekylärt jod i vatten kraftigt i närvaro av kaliumjodid, som är associerad med bildandet av en komplex anjon
Den låga stabiliteten hos denna komplexa jon säkerställer närvaron av molekylärt jod i lösning. Därför används inom medicin en vattenlösning av jod med tillsats av KI som ett bakteriedödande medel. Dessutom bildar molekylärt jod inklusionskomplex med stärkelse (avsnitt 22.3) och polyvinylalkohol (blått jod). I dessa komplex fyller jodmolekyler eller deras associerade med jodidanjoner kanalerna som bildas av den spiralformade strukturen hos motsvarande polyhydroxipolymerer. Inklusionskomplex är inte särskilt stabila och har förmåga att gradvis frisätta molekylärt jod. Därför är ett läkemedel som blått jod ett effektivt, men milt, långtidsverkande bakteriedödande medel.
Biologisk roll och användning av halogener och deras föreningar i medicin. Halogener i form av olika föreningar är en del av levande vävnader. I kroppen har alla halogener ett oxidationstillstånd på 1. Samtidigt finns klor och brom i form av hydratiserade Cl- och Branjoner, och fluor och jod ingår i vattenolösliga biosubstrat:
Fluorföreningar är komponenter i benvävnad, naglar och tänder. Den biologiska effekten av fluor är främst förknippad med problemet med tandsjukdomar. Fluoridanjonen, som ersätter hydroxidjonen i hydroxiapatit, bildar ett lager av skyddande emalj från fast fluorapatit:
Fluorering av dricksvatten till en fluoridjonkoncentration på 1 mg/l och tillsats av natriumfluorid till tandkräm minskar karies avsevärt i befolkningen. Samtidigt, när koncentrationen av fluoranjon i dricksvatten är över 1,2 mg/l, ökar benets och tandemaljens skörhet och allmän utmattning av kroppen uppträder, kallad fluoros.
Kloridanjoner tillhandahåller jonflöden genom cellmembran, deltar i att upprätthålla osmotisk homeostas och skapar en gynnsam miljö för verkan och aktivering av protolytiska enzymer i magsaft.
Bromidanjoner i människokroppen är lokaliserade främst i hypofysen och andra endokrina körtlar. Förekomsten av ett dynamiskt samband mellan innehållet av bromid och kloridanjoner i kroppen har fastställts. Således främjar det ökade innehållet av bromidanjoner i blodet den snabba frisättningen av kloridanjoner av njurarna. Bromider är lokaliserade främst i den intercellulära vätskan. De förbättrar hämmande processer i hjärnbarkens neuroner, och därför används kalium-, natrium- och bromokamferbromider i farmakologi.
Jod och dess föreningar påverkar syntesen av proteiner, fetter och hormoner. Mer än hälften av mängden jod finns i sköldkörteln i ett bundet tillstånd i form av sköldkörtelhormoner. Med otillräckligt intag av jod i kroppen utvecklas endemisk struma. För att förhindra denna sjukdom tillsätts NaI eller KI till bordssalt (1-2 g per 1 kg NaCl). Således är alla halogener nödvändiga för att levande organismer ska fungera normalt.
Kapitel 13
DEFINITION
Halogener– Grupp VIIA grundämnen – fluor (F), klor (Cl), brom (Br) och jod (I).
Elektronisk konfiguration av den yttre energinivån för halogener ns 2 np 5. Eftersom halogener endast saknar en elektron innan de fullbordar energinivån, uppvisar de i ORR oftast egenskaperna hos oxidationsmedel. Oxidationstillstånd för halogener: från "-1" till "+7". Det enda elementet i halogengruppen, fluor, uppvisar endast ett oxidationstillstånd "-1" och är det mest elektronegativa elementet.
Halogenmolekyler är diatomiska: F 2, Cl 2, Br 2, I 2. Med ökande laddning av kärnan i en atom av ett kemiskt element, dvs. när man går från fluor till jod minskar halogenernas oxidationsförmåga, vilket bekräftas av förmågan att ersätta lägre halogener med högre från halogenvätesyror och deras salter:
Br2 + 2HI = I2 + 2HBr
Cl2 + 2KBr = Br2 + 2KCl
Fysikaliska egenskaper hos halogener
Vid nr. fluor är en ljusgul gas med en stickande lukt. Giftig. Klor är en ljusgrön gas, precis som fluor har den en stickande lukt. Mycket giftig. Vid förhöjt tryck och rumstemperatur förvandlas det lätt till flytande tillstånd. Brom är en tung vätska av rödbrun färg med en karakteristisk obehaglig stickande lukt. Flytande brom, såväl som dess ångor, är mycket giftiga. Brom är dåligt lösligt i vatten och väl i opolära lösningsmedel. Jod är ett mörkgrått fast ämne med en metallisk glans. Jodånga är lila. Jod sublimerar lätt, d.v.s. omvandlas till ett gasformigt tillstånd från ett fast ämne, samtidigt som det går förbi det flytande tillståndet.
Produktion av halogener
Halogener kan erhållas genom elektrolys av lösningar eller smältor av halogenider:
MgCl2 = Mg + Cl2 (smälta)
Oftast erhålls halogener genom oxidationsreaktionen av halogenvätesyror:
MnO2 + 4HCl = MnCl2 + Cl2 +2H2O
K2Cr2O7 + 14HCl = 3Cl2 + 2KCl +2CrCl3 +7H2O
2KMnO4 +16HCl = 2MnCl2 +5Cl2 +8H2O +2KCl
Kemiska egenskaper hos halogener
Fluor har den största kemiska aktiviteten. De flesta kemiska grundämnen, även vid rumstemperatur, interagerar med fluor och avger en stor mängd värme. Även vatten brinner i fluor:
2H2O + 2F2 = 4HF + O2
Fritt klor är mindre reaktivt än fluor. Det reagerar inte direkt med syre, kväve och ädelgaser. Det interagerar med alla andra ämnen som fluor:
2Fe + Cl2 = 2FeCl3
2P + 5Cl2 = 2PCl 5
När klor interagerar med vatten i kylan uppstår en reversibel reaktion:
Cl2 + H2O↔HCl +HClO
Blandningen av reaktionsprodukter kallas klorvatten.
När klor interagerar med alkalier i kylan bildas blandningar av klorider och hypokloriter:
Cl2 + Ca(OH)2 = Ca(Cl)OCl + H2O
När klor löses i en varm alkalilösning sker följande reaktion:
3Cl2 + 6KOH=5KCl +KClO3 +3H2O
Brom, liksom klor, löses i vatten och, delvis reagerande med det, bildar det så kallade "bromvattnet", medan jod är praktiskt taget olösligt i vatten.
Jod skiljer sig väsentligt i kemisk aktivitet från andra halogener. Det reagerar inte med de flesta icke-metaller, och reagerar långsamt med metaller endast när det värms upp. Interaktionen mellan jod och väte sker endast vid stark uppvärmning; reaktionen är endoterm och mycket reversibel:
H2 + I2 = 2HI - 53 kJ.
Exempel på problemlösning
EXEMPEL 1
| Träning | Beräkna volymen klor (antal) som reagerade med kaliumjodid om jod som vägde 508 g bildades |
| Lösning | Låt oss skriva reaktionsekvationen: Cl2 + 2KI = I2 + 2KCl Låt oss ta reda på mängden jod som bildas: v(I2)=m(I2)/M(I2) v(I2)=508/254=2 mol Enligt reaktionsekvationen, mängden klorämne. Från en lärobok i kemi vet många att halogener inkluderar kemiska element i Mendeleevs periodiska system från grupp 17 i tabellen. Översatt från grekiska som födelse, ursprung. Nästan alla av dem är mycket aktiva, på grund av vilka de reagerar våldsamt med enkla ämnen, med undantag för ett fåtal icke-metaller. Vad är halogener och vilka egenskaper har de? I kontakt med Lista över halogenerHalogener är bra oxidationsmedel, av denna anledning kan de i naturen bara hittas i vissa föreningar. Ju högre atomnummer, desto mindre kemisk aktivitet har elementen i denna grupp. Halogengruppen innehåller följande element:
Den senare utvecklades vid Institute of Nuclear Research, som ligger i staden Dubna. Fluor är en giftig gas med en blekgul färg. Klor är också giftigt. Detta är en gas som har en ganska skarp och obehaglig lukt av ljusgrön färg. Brom har en rödbrun färg och är en giftig vätska som till och med kan påverka luktsinnet. Det är mycket flyktigt, så det förvaras i ampuller. Jod är en kristallin, lätt sublimerad, mörklila substans. Astatin är radioaktivt, kristallfärg: svart med blått, halveringstid är 8,1 timmar.
Fluor interagerar med inerta gaser och bestrålas (Xe + F 2 = XeF 2 + 152 kJ). Vid uppvärmning påverkar fluor andra halogener och oxiderar dem. Formeln gäller: Hal 2 + F 2 = 2HalF, där Hal = Cl, Br, I, At, i fallet då HalF oxidationstillstånd för klor, brom, jod och astatin är lika med + 1. Fluor interagerar också ganska kraftigt med komplexa ämnen. Konsekvensen är vattenoxidation. I detta fall uppstår en explosiv reaktion, som kortfattat skrivs av formeln: 3F 2 + ZH 2 O = OF 2 + 4HF + H 2 O 2. KlorAktiviteten hos fritt klor är något mindre än fluor, men det har också en god reaktionsförmåga. Detta kan inträffa vid interaktion med många enkla ämnen, med sällsynta undantag i form av syre, kväve och inerta gaser. han kan reagera våldsamt med komplexa ämnen, vilket skapar substitutionsreaktioner, är egenskapen att tillsätta kolväten också inneboende i klor. Vid upphettning ersätts brom eller jod från föreningar med väte eller metaller.
Cl2+ hν → 2Cl, Cl + H2 → HCl + H, H + Cl2 → HCl + Cl, Cl + H2 → HCl + H, etc. Fotoner, när de exciteras, orsakar nedbrytning av Cl 2-molekyler till atomer, och en kedjereaktion inträffar, vilket orsakar uppkomsten av nya partiklar som initierar början av nästa steg. I kemins historia har detta fenomen studerats. Rysk kemist och Nobelpristagare N.N. Semenov. 1956 studerade han den fotokemiska kedjereaktionen och gjorde därigenom ett stort bidrag till vetenskapen. Klor reagerar med många komplexa ämnen, dessa är substitutions- och additionsreaktioner. Det löser sig bra i vatten. Cl2 + H2O = HCl + HClO - 25 kJ. Med alkalier, vid upphettning, kan klor oproportionerlig.
Brom, jod och astatinDen kemiska aktiviteten hos brom är något mindre än den för ovan nämnda fluor eller klor, men den är också ganska hög. Brom används ofta i flytande form. Det, som klor, löser sig mycket bra i vatten. En partiell reaktion sker med det, vilket gör att man kan få "bromvatten". Den kemiska aktiviteten av jod skiljer sig märkbart från andra representanter för denna serie. Det interagerar nästan inte med icke-metaller, utan med Med metaller sker reaktionen mycket långsamt och endast vid upphettning. I detta fall sker en stor absorption av värme (endoterm reaktion), som är mycket reversibel. Förutom Jod kan inte lösas i vatten på något sätt, detta kan inte uppnås ens med uppvärmning, varför "jodvatten" inte finns i naturen. Jod kan endast lösas i jodidlösning. I detta fall bildas komplexa anjoner. Inom medicinen kallas denna förening Lugols lösning. Astatin reagerar med metaller och väte. I serien av halogener minskar den kemiska aktiviteten i riktning från fluor till astatin. Varje halogen i F - At-serien är kapabel att ersätta efterföljande grundämnen från föreningar med metaller eller väte. Astatin är det mest passiva av dessa element. Men det kännetecknas av interaktion med metaller. AnsökanKemi är fast förankrad i våra liv och tränger in i alla områden. Människan har lärt sig att använda halogener, såväl som dess föreningar, för sin egen fördel. Den biologiska betydelsen av halogener är obestridlig. Deras användningsområden är olika:
Klor har funnit den mest utbredda användningen i våra liv. Omfattningen av dess tillämpning är ganska varierande. Exempel på användning:
Man måste komma ihåg att halogener är mycket giftiga ämnen. Denna egenskap är särskilt uttalad i fluor. Halogener kan orsaka kvävning, irritation i luftvägarna och skada biologisk vävnad. Klorångor kan vara extremt farliga, liksom fluoraerosol, som har en svag lukt och kan kännas i höga koncentrationer. En person kan uppleva en kvävningseffekt. Vid arbete med sådana anslutningar måste försiktighetsåtgärder vidtas. Metoderna för att framställa halogener är komplexa och varierande. Inom industrin närmar man sig detta med vissa krav, som strikt följs. Mer om ämnet |
 Den höga oxidationsaktiviteten av halogener minskar från fluor till jod. Den mest aktiva av sina bröder är fluor, som har förmågan att reagera med alla metaller och bilda salter, några av dem antänds spontant och släpper ut en enorm mängd värme. Utan uppvärmning reagerar detta element med nästan alla icke-metaller, reaktioner åtföljs av frigöring av en viss mängd värme (exoterm).
Den höga oxidationsaktiviteten av halogener minskar från fluor till jod. Den mest aktiva av sina bröder är fluor, som har förmågan att reagera med alla metaller och bilda salter, några av dem antänds spontant och släpper ut en enorm mängd värme. Utan uppvärmning reagerar detta element med nästan alla icke-metaller, reaktioner åtföljs av frigöring av en viss mängd värme (exoterm). Detta element har ett säreget förhållande till väte. Vid rumstemperatur och utan exponering för ljus reagerar klor inte på något sätt på denna gas, men när det väl värms upp eller riktas mot ljus kommer en explosiv kedjereaktion att inträffa. Formeln ges nedan:
Detta element har ett säreget förhållande till väte. Vid rumstemperatur och utan exponering för ljus reagerar klor inte på något sätt på denna gas, men när det väl värms upp eller riktas mot ljus kommer en explosiv kedjereaktion att inträffa. Formeln ges nedan: Från den naturliga föreningen kryolit, vars kemiska formel är följande: Na3AlF6, erhålls aluminium. Fluorföreningar används ofta i produktionen tandkrämer. Fluor är känt för att hjälpa till att förebygga karies. Alkoholtinktur av jod används för desinfektion och desinfektion av sår.
Från den naturliga föreningen kryolit, vars kemiska formel är följande: Na3AlF6, erhålls aluminium. Fluorföreningar används ofta i produktionen tandkrämer. Fluor är känt för att hjälpa till att förebygga karies. Alkoholtinktur av jod används för desinfektion och desinfektion av sår.