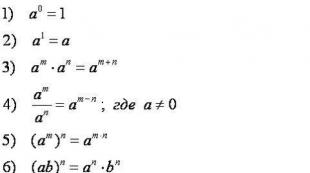Përgatitjet e kimisë për përdorimin e opsioneve demo. Struktura Kim Eger
Rezultati i EGE Nga kimia, nuk ka më të ulët se numri minimal i pikëve të pikave jep të drejtën për të hyrë në universitete në specialitet, ku ka një subjekt të kimisë në listën e testeve të hyrjes.
Universitetet nuk kanë të drejtë të instalojnë pragun minimal të kimisë nën 36 pikë. Universitetet prestigjioze, si rregull, vendosin pragun e tyre minimal shumë më të lartë. Sepse për studim, duhet të ketë njohuri shumë të mira të studentëve të vitit të parë.
Në faqen zyrtare të Fii, çdo vit mund të publikohen opsionet e Kimisë: demonstrim, periudha e hershme. Këto janë këto opsione që japin një ide të strukturës së provimit të ardhshëm dhe nivelin e kompleksitetit të detyrave dhe janë burime të informacionit të besueshëm gjatë përgatitjes për përdorim.
Opsionet frontale të kimisë 2017
| Vit | Shkarko opsionin e fillimit |
| 2017 | variant po Himii. |
| 2016 | shkarko |
Versioni demo i provimit në kimi 2017 nga FIPI
| Opsionet + Përgjigjet | Shkarko Opsionin Demo |
| Specifikim | demo Variant Himiya EGE |
| Kodifikator | kodifikator. |
NË ambiente Në kimi të vitit 2017 ka ndryshime në krahasim me Kim të kaluar 2016, prandaj është e dëshirueshme të përgatitet sipas versionit aktual dhe për zhvillimin e ndryshëm të të diplomuarve për të përdorur opsionet e viteve të fundit.
Materiale dhe pajisje shtesë
Materialet e mëposhtme janë bashkangjitur në çdo version të ekzaminimit të punës së provimit në kimi:
- Sistemi periodik elemente kimike Di. Mendeleev;
- Tabela e solubilitetit të kripërave, acideve dhe bazave në ujë;
- Rreshti elektrokimik i tensioneve metalike.
Gjatë ekzekutimit të punës së provimit, lejohet të përdorë një kalkulator të paprogramuar. Lista e pajisjeve dhe materialeve shtesë, përdorimi i të cilave lejohet për përdorim, miratohet me urdhër të Ministrisë së Arsimit dhe Shkencës të Rusisë.
Për ata që duan të vazhdojnë arsimin e tyre në shkollën e mesme, zgjedhja e artikujve duhet të varet nga lista e testeve të hyrjes nga specialiteti i përzgjedhur
(drejtimi i përgatitjes).
Lista e testeve të hyrjes në universitete për të gjitha specialitetet (drejtimet e përgatitjes) përcaktohet me urdhër të Ministrisë së Arsimit dhe Shkencës të Rusisë. Çdo universitet zgjedh nga kjo listë e atyre ose sendeve të tjera që tregojnë në rregullat e tyre të pritjes. Ju duhet të njiheni me këtë informacion në faqet e universiteteve të përzgjedhura, para se të aplikoni për pjesëmarrje në provim me listën e artikujve të përzgjedhur.
11/14/2016 Njoftime të botuara në faqen e internetit të Fii mundësitë e demonstrimit, kodifikuesit dhe specifikimet e materialeve të matjes së kontrollit të unifikuar provim shtetëror dhe provimin kryesor shtetëror të vitit 2017, duke përfshirë edhe kimi.
Deverovyy Ege në kimi 2017 me përgjigje
| Opsionet + Përgjigjet | Shkarko versionin demo |
| Specifikim | demo Variant Himiya EGE |
| Kodifikator | kodifikator. |
Kimi Demo Check 2016-2015
| Kimi | Shkarko Demo + Përgjigjet |
| 2016 | eGE 2016. |
| 2015 | eGE 2015. |
Në Kim në kimik në vitin 2017, ndryshime të rëndësishme, pra, demolizmi i viteve të fundit është dhënë për t'u njohur me veten.
Kimi - Ndryshime të rëndësishme: Struktura e punës së provimit është optimizuar:
1. Struktura e Pjesës 1 të Kim është ndryshuar rrënjësisht: detyrat përjashtohen me një zgjedhje të një përgjigjeje; Detyrat janë grupuar nga blloqe të veçanta tematike, secila prej të cilave ka detyra të niveleve themelore dhe të larta të kompleksitetit.
2. Reduktuar numrin e përgjithshëm të detyrave nga 40 (në 2016) në 34.
3. Ndryshoi shkallën e vlerësimit (nga 1 në 2 pikë) që kryen detyrat e nivelit bazë të kompleksitetit që kontrollojnë mësimin e njohurive për lidhjen gjenetike të substancave inorganike dhe organike (9 dhe 17).
4. Rezultati primar maksimal për kryerjen e punës në tërësi do të jetë 60 pikë (në vend të 64 pikave në vitin 2016).
Kohëzgjatja e provimit në kimi
Kohëzgjatja totale e punës së provimit është 3.5 orë (210 minuta).
Një kohë e përafërt e caktuar për ekzekutimin e detyrave individuale është:
1) për secilën detyrë të nivelit bazë të kompleksitetit të Pjesës 1 - 2-3 minuta;
2) për çdo detyrë të kompleksitetit të ngritur të Pjesës 1 - 5-7 minuta;
3) për çdo detyrë nivel i lartë Kompleksiteti i Pjesës 2 është 10-15 minuta.
Për të kryer detyrat 1-3, përdorni serinë e mëposhtme të elementeve kimike. Përgjigja në detyrat 1-3 është sekuenca e numrave nën të cilët tregohen elementët kimikë në këtë seri.
1) na 2) k 3) SI 4) mg 5) c
Numri i detyrës 1
Përcaktoni atomet e cilat prej të cilave të specifikuara në rreshtin e elementeve janë katër elektron në nivelin e jashtëm të energjisë.
Përgjigje: 3; pesë
Numri i elektroneve në nivelin e jashtëm të energjisë (shtresa elektronike) e elementeve të nëngrupeve kryesore është e barabartë me numrin e numrit.
Kështu, silic dhe karboni janë të përshtatshme nga përgjigjet e përfaqësuara, sepse Ata janë në nëngrupin kryesor të grupit të katërt të tabelës D.I. Mendeleeva (GRUPI IVA), I.E. Përgjigjet e drejta 3 dhe 5.
Detyra numër 2.
Nga ato të specifikuara në një numër të elementeve kimike, zgjidhni tre artikuj që Sistemi periodik Elementet kimike D.I. Mendeleev janë në një periudhë. Vendosni artikujt e zgjedhur në mënyrë që të rritet vetitë e tyre metalike.
Shkruani në fushën e përgjigjes së artikujve të përzgjedhur në sekuencën e dëshiruar.
Përgjigje: 3; katër; një
Nga elementët e dorëzuar në një periudhë ka tre - kjo është na natriumi, silikoni si dhe Magnezi.
Kur ngas brenda një periudhe të tabelës periodike d.i. Mendeleev (linjat horizontale) në të djathtë në të majtë lehtëson kthimin e elektroneve të vendosura në shtresën e jashtme, i.e. Pronat metalike të elementeve janë rritur. Kështu, vetitë metalike të natriumit, silikonit dhe magnezit janë intensifikuar në Row SI Numri i detyrës 3. Nga ato të treguara në një numër të artikujve, zgjidhni dy elemente që tregojnë shkallën më të ulët të oksidimit të barabartë me -4. Rekord në fushën e përgjigjes së artikujve të përzgjedhur. Përgjigje: 3; pesë Sipas rregullave të oktet, atomet e elementeve kimike kanë tendencë të kenë në nivelin e tyre të jashtëm të elektroneve 8 elektronesh, si gazra fisnike. Kjo mund të arrihet ose duke u kthyer elektronet e nivelit të fundit, atëherë ai i mëparshëm, i cili përmban 8 elektron, ose, përkundrazi, shtimi i elektroneve shtesë në tetë bëhet i jashtëm. Natriumi dhe kaliumi i përkasin metaleve alkaline dhe janë të vendosura në nëngrupin kryesor të grupit të parë (IA). Kjo do të thotë se në shtresën e jashtme të jashtme të atomeve të tyre është një elektron. Në këtë drejtim, humbja e një elektronike të vetme është energjikisht më e dobishme sesa pranimi i shtatë. Me magnez, situata është e ngjashme, vetëm ajo është në nëngrupin kryesor të grupit të dytë, domethënë në nivelin e elektroneve të jashtme ai ka dy elektron. Duhet të theksohet se natriumi, kaliumi dhe magnezit lidhen me metalet, dhe për metalet, në parim, një shkallë negative e oksidimit është e pamundur. Shkalla minimale e oksidimit të çdo metali është zero dhe është vërejtur në substanca të thjeshta. Elementet kimike Carbon C dhe Silicon SI janë jo-metale dhe janë të vendosura në nëngrupin kryesor të grupit të katërt (IVA). Kjo do të thotë se ka 4 elektron në shtresën e tyre të jashtme elektronike. Për këtë arsye, këto elemente janë të mundshme si kthimet e këtyre elektroneve dhe shtimi i katër më shumë në shumën totale prej 8m. Më shumë se 4 elektronet e silikonit dhe atomet e karbonit nuk mund të bashkëngjiten, kështu që niveli minimal i oksidimit për ta është -4. Detyra numër 4. Nga lista e propozuar, zgjidhni dy komponime në të cilat është i pranishëm lidhja kimike jonike. Përgjigje: 1; 3. Është e mundur të përcaktohet prania e një lloji jonik të komunikimit në përbërje në shumicën dërrmuese të rasteve, është e mundur që përbërja e njësive të saj strukturore në të njëjtën kohë të përfshihen atomet e metaleve tipike dhe atomet jo-metalike. Mbi këtë bazë, ne vendosim që komunikimi jonik është i disponueshëm në një përbërës në numrin 1 - CA (CLO 2) 2, sepse Në formulën e saj, ju mund të shihni atomet e një metalike tipike të kalciumit dhe jo-metalulov atomet - oksigjen dhe klor. Megjithatë, më shumë komponime që përmbajnë në të njëjtën kohë atomet e metaleve dhe nonmetalla, në artikullin e listës së specifikuar. Përveç funksionit të mësipërm, prania e obligacioneve të joneve në kompleks mund të thuhet nëse përbërja e njësisë së saj strukturore përmban cation amoni (NH 4 +) ose analoge organike - alkilammonium cations rnh 3 +, dialkylamonia r 2 nh 2 + , Provalkilammonium R3 NH + dhe TETRAKLAMMONIUM R 4 N +, ku r është një radikal hidrokarbon. Për shembull, lloji i komunikimit të joneve zhvillohet në përbërje (CH3) 4 NCL në mes të CATIM (CH3) 4 + dhe klorur-jon CL. Ndër përbërësit e treguar në detyrë ka klorur amoni, në të një lidhje jonike është zbatuar në mes të CATIM të Amonit të NH 4 + dhe klorur CL. Numri 5. Vendosni korrespondencën midis formulës së substancës dhe klasës / grupit në të cilin kjo substancë i takon: secilës pozitë të treguar nga letra, zgjidhni pozicionin e duhur nga kolona e dytë, e treguar nga numri. Regjistro numrin e lidhjeve të përzgjedhura në fushën e përgjigjes. Përgjigje: A-4; B-1; Në 3 Shpjegim: Salinat e dërrasuara quhen kripëra që rezultojnë nga zëvendësimi i paplotë i atomeve të hidrogjenit në lëvizje në një kation metalik, kation amoni ose alklllamonium. Në acidet inorganike që kalojnë brenda kuadrit të programit të shkollës, të gjitha atomet e hidrogjenit janë të luajtshme, domethënë, ata mund të zëvendësojnë me metal. Shembuj të kripërave acidike inorganike në mesin e listës së paraqitur është bikarbonati i amonit NH 4 HCO 3 - produkti i zëvendësimit të një prej dy atomeve të hidrogjenit në acidin e qymyrit për kation amoni. Në thelb, kripë acid është disi mesatar midis kripës normale (të mesme) dhe acidit. Në rastin e NH 4 HCO 3, mesatarja midis kripës normale (NH 4) 2 CO 3 dhe acidit karbonik H 2 CO 3. Në substancat organike, vetëm atomet e hidrogjenit të përfshira në grupet e karboksil (-SOOH) ose grupet hidroksil të fenolit (AR-OH) janë të aftë të zëvendësojnë substancat organike. Kjo është, për shembull, acetat natriumi CH3 Coona, pavarësisht nga fakti se në molekulën e saj, jo të gjitha atomet e hidrogjenit janë të zevendesuar në kationet metalike, është një mesatare, jo një kripë acidike (!). Atomet e hidrogjenit në substancat organike të bashkangjitura direkt në atomin e karbonit nuk janë pothuajse kurrë në gjendje të zëvendësojnë atomet metalikë, me përjashtim të atomeve të hidrogjenit me një S≡C të trefishtë të komunikimit. Prerja e oksideve - oksidet jo metalike që nuk formohen me oksidet kryesore ose bazat e kripës, domethënë, ose duke mos reaguar me ta në të gjitha (më shpesh) ose në reagim me ta një produkt tjetër (jo kripë). Shpesh thuhet se oksidet joformuese janë oksidet jo-metalike që nuk reagojnë me bazat dhe oksidet kryesore. Megjithatë, nuk funksionon gjithmonë për identifikimin e oksideve joformuese. Për shembull, bashkë, duke qenë një oksid joformues, reagon me oksidin kryesor të hekurit (ii), por me formimin e jo-kripës dhe metalit të lirë: Co + Feo \u003d CO 2 + FE Oksidet e pazgjidhura nga shkalla e shkollës përfshijnë oksidet jo metalike në shkallën e oksidimit +1 dhe +2. Në total, ato gjenden në provimin 4 - kjo është CO, jo, n 2 o dhe sio (sio e fundit personalisht unë kurrë nuk kam takuar në detyra). Detyra numër 6. Nga lista e propozuar e substancave, zgjidhni dy substanca, me secilën prej të cilave hekuri reagon pa ngrohje. Përgjigje: 2; katër Kloride zink i përket kripërave, dhe hekuri në metale. Metal reagon me kripë vetëm nëse është më aktive në krahasim me përbërjen e kripës. Aktiviteti relativ i metaleve përcaktohet për një numër të aktivitetit metalik (ndryshe, një rresht i tensioneve të metaleve). Hekuri në një rresht të aktivitetit metalik është e drejta e zinkut, kjo do të thotë se është më pak aktive dhe nuk mund të zhvendos zinkun nga kripa. Kjo është, reagimi i hekurit me numrin e substancave 1 nuk shkon. Covo 4 Sulfate (ii) Cuso 4 do të reagojë me hekur, pasi hekuri është e majta e bakrit në një rresht të aktivitetit, domethënë është një metal më aktiv. Azoti i koncentruar, si dhe acide sulfurike të koncentruara nuk janë në gjendje të reagojnë me hekur, alumin dhe krom në pamje të një fenomeni të tillë si passivimi: në sipërfaqen e këtyre metaleve nën veprimin e këtyre acideve është formuar pa kripë ngrohje, e cila vepron si një guaskë mbrojtëse. Megjithatë, kur të nxehtë, ky shell mbrojtës shpërndahet dhe reagimi bëhet i mundshëm. Ato. Meqenëse tregohet se ngrohja nuk është, reagimi i hekurit me cok. HNO 3 nuk vazhdon. Acidi Salonik në pavarësi nga përqendrimi i referohet acideve jo oksiduese. Me acide jo oksiduese me lirim hidrogjeni, metale reagojnë në një rresht të aktivitetit të së majtës së hidrogjenit. Këto metale janë vetëm të vërteta. Përfundim: Reagimi i hekurit me rrjedhat e acidit hidroklorik. Në rastin e oksidit metalik dhe metalik, reagimi, si në rastin e një kripë, është e mundur nëse metali i lirë është më aktiv në përbërjen e oksidit. Fe, sipas një numri të aktivitetit metalik, më pak aktiv se al. Kjo do të thotë se FE me Al 2 o 3 nuk reagon. Numri i detyrës 7. Nga lista e propozuar, zgjidhni dy oksid, të cilat reagojnë me një zgjidhje të acidit klorhidrik, por mos reagoni
me zgjidhje hidroksid natriumi. Shkruani në fushën e përgjigjes së substancave të përzgjedhura. Përgjigje: 3; katër Co - një oksid i pafavorshëm, me një zgjidhje ujore të alkali nuk reagon. (Duhet të mbahet mend se, megjithatë, në kushte të ashpra - presion dhe temperaturë të lartë - të gjitha të njëjtat reagojnë me një alkali të ngurtë, formon formon - kripërat e acidit formik.) Pra, 3 - oksid squfur (VI) është një oksid acidik në të cilin korrespondon acidi sulfurik. Oksidet acid me acide dhe oksidet e tjera acidike nuk reagojnë. Kjo është, kështu që 3 nuk reagon me acid klorhidrik dhe reagon me bazën - hidroksid natriumi. Jo të përshtatshme. Cuo - oksid bakri (ii) - lidhen me oksidet me kryesisht pronat kryesore. Reagon me HCL dhe nuk reagon me zgjidhje hidroksid natriumi. I përshtatshëm MGO - oksid magnezi - i referohen oksideve tipike kryesore. Reagon me HCL dhe nuk reagon me zgjidhje hidroksid natriumi. I përshtatshëm Zno - oksid me vetitë e theksuara amfourologjike - reagon lehtësisht si me baza dhe acide të forta (si dhe oksidet acidike dhe kryesore). Jo të përshtatshme. Detyra numër 8. Përgjigje: 4; 2. Me reagimin midis dy kripërave të acideve inorganike, gazi është formuar vetëm kur përzierjen e zgjidhjeve të nxehta të kripërave të nitratit dhe amonit për shkak të formimit të nitratit të amonit të paqëndrueshëm termikisht të paqëndrueshëm. Për shembull, NH 4 CL + kno 2 \u003d t o \u003d\u003e n 2 + 2h 2 o + kcl Megjithatë, nuk ka nitrat në listë dhe kripërat e amonit. Pra, një nga tre kripërat (Cu (nr. 3) 2, k 2 kështu 3 dhe na 2 sio 3) reagon ose me acid (HCL) ose me alkali (Naoh). Ndër kripërat e acideve inorganike, vetëm kripërat e amonit dallohen nga gazi kur bashkëveprojnë me alkalis: NH 4 + + OH \u003d NH 3 + H 2 O Kripërat e amonit, siç e kemi thënë tashmë, jo në listë. Vetëm një variant i ndërveprimit të kripës me mbetje acidesh. Kripërat në mesin e këtyre substancave përfshijnë CU (nr. 3) 2, K 2 SO 3 dhe NA 2 Sio 3. Reagimi i nitratit të bakrit me acid klorhidrik nuk vazhdon, sepse As gaz ose sediment, as një agjent i ulët subvencionues (ujë ose acid i dobët) nuk është formuar. Solikat natriumi reagon me acid klorhidrik, megjithatë, për shkak të lirimit të sedimentit të acidit silicic të bardhë, dhe jo gaz: Na 2 sio 3 + 2hcl \u003d 2nacl + h 2 sio 3 ↓ Varianti i fundit mbetet - ndërveprimi i sulfit të kaliumit dhe acidit hidroklorik. Në të vërtetë, si rezultat i reagimit të shkëmbimit të joneve midis sulfit dhe pothuajse çdo acid i paqëndrueshëm, është formuar acid i paqëndrueshëm sulfurik, i cili menjëherë shpërbëhet në një oksid të ngjyrosur me gaz (iv) dhe ujë. Numri i detyrës 9. Regjistrojnë në numrin e tabelës së substancave të përzgjedhura nën letrat e duhura. Përgjigje: 2; pesë CO 2 i referohet oksideve acid dhe për ta kthyer atë në një kripë, është e nevojshme të ndikojë ose oksidin kryesor ose në bazën. Ato. Për të marrë nga CO2 karbonat e kaliumit, është e nevojshme të ndikojë ose oksid kaliumi ose hidroksid kaliumi. Kështu, substanca X është oksid kaliumi: K 2 O + CO 2 \u003d K 2 CO 3 Kaliumi Bicarbonate KHCO 3, si dhe karbonat e kaliumit, është një kripë e acidit të thatë, me ndryshimin e vetëm që hidrokarbonati është një produkt i zëvendësimit të paplotë të atomeve të hidrogjenit në acid të thatë. Për të marrë nga kripë normale (e mesme) me një kripë të thartë, ju duhet të veproni në të me të njëjtën acid që është formuar nga ky kripë, ose për të vepruar si një oksid acid që korrespondon me një acid të caktuar, në prani e ujit. Kështu, reagenti y është dioksidi i karbonit. Kur kalon përmes një zgjidhjeje të karbonatit të kaliumit ujor, ky i fundit shkon në bikarbonat kalium: K 2 CO 3 + H 2 O + CO 2 \u003d 2Khco 3 Detyra numër 10. Instaloni korrespondencën midis ekuacionit të reagimit dhe pasurisë së elementit të azotit, të cilin ekziston në këtë reagim: për çdo pozicion të treguar nga letra, zgjidhni pozicionin përkatës të treguar nga numri. Regjistrojnë në numrin e tabelës së substancave të përzgjedhura nën letrat e duhura. Përgjigje: A-4; B-2; Në 2; Zoti. A) NH 4 HCO 3 - Kripë, e cila përfshin një CATIM të Amonit NH 4 +. Në katin e amonit, azoti gjithmonë ka një shkallë oksidimi të barabartë me -3. Si rezultat i reagimit, ajo kthehet në Amoniak NH3. Hidrogjeni është pothuajse gjithmonë (përveç komponimeve të tij me metale) ka një shkallë të oksidimit të barabartë me +1. Prandaj, kështu që molekula e amoniakut është një elektronik, azoti duhet të ketë një shkallë të oksidimit të barabartë me -3. Kështu, ndryshimet në shkallën e oksidimit të azotit nuk ndodhin, dmth. Nuk tregon pronat redox. B) Siç është treguar më sipër, azoti në Amoniak NH3 ka një shkallë oksidimi -3. Si rezultat i reagimit me CUO, amoniaku kthehet në një substancë të thjeshtë n 2. Në çdo substancë të thjeshtë, shkalla e oksidimit të elementit në të cilin është formuar është zero. Kështu, atomi i azotit humbet ngarkesën e saj negative, pasi që elektronet korrespondojnë me akuzën negative, që do të thotë humbjen e tyre të atomit të azotit si rezultat i reagimit. Një element që humb pjesën e elektroneve të saj si rezultat i reagimit quhet një agjent reduktues. C) Si rezultat i reagimit NH 3 me shkallën e oksidimit të azotit, të barabartë me -3, kthehet në oksid azotit nr. Oksigjeni pothuajse gjithmonë ka një shkallë të oksidimit të barabartë me -2. Prandaj, në mënyrë që molekula e oksidit të azotit të jetë në mënyrë elektronike, atomi i azotit duhet të ketë një shkallë të oksidimit +2. Kjo do të thotë që një atom i azotit si rezultat i reagimit ka ndryshuar shkallën e oksidimit nga -3 deri në +2. Kjo tregon humbjen e atomit të azotit të 5 elektroneve. Kjo është, azot, siç ndodh B, është një agjent reduktues. D) n 2 është një substancë e thjeshtë. Në të gjitha substancat e thjeshta, një element që formon ata ka një shkallë të oksidimit, të barabartë me 0. Si rezultat i reagimit të azotit, nitride litiumi litium është konvertuar. Shkalla e vetme e oksidimit metalik alkali, përveç zero (shkalla e oksidimit prej 0 është nga çdo element), i barabartë me +1. Në mënyrë të tillë që njësia strukturore Li3n ishte elektronike, azoti duhet të ketë një shkallë të oksidimit të barabartë me -3. Rezulton se si rezultat i reagimit, azoti fitoi një pagesë negative, që do të thotë shtimin e elektroneve. Azot në këtë reagim oksidues. Numri 11. Instaloni korrespondencën midis formulës së substancës dhe reagentëve, me secilën prej të cilave kjo substancë mund të ndërveprojë: për çdo pozicion të treguar nga letra, zgjidhni pozicionin përkatës të treguar nga numri. D) znbr 2 (r-p) 1) AGNO 3, NA 3 PO 4, CL 2 2) Bao, H 2 O, Koh 3) h 2, cl 2, o 2 4) hbr, lioh, ch 3 cooh 5) h 3 po 4, bacl 2, cuo Regjistrojnë në numrin e tabelës së substancave të përzgjedhura nën letrat e duhura. Përgjigje: A-3; B-2; Në 4; Zoti. A) Kur hidrogjeni i gaztë kalon përmes shkrirjes së squfurit, formohet sulfidi i hidrogjenit H 2 s: H 2 + S \u003d t o \u003d\u003e h 2 s Kur klori kalon mbi tokë, dikloridi i squfurit formohet në temperaturën e dhomës: S + cl 2 \u003d scl 2 Për surckase ege Për të ditur saktësisht se si squfuri me klorin reagon dhe, në përputhje me rrethanat, të jetë në gjendje të regjistrojë këtë ekuacion nuk është e nevojshme. Gjëja kryesore është në nivelin kryesor për të kujtuar se squfuri me klorin reagon. Klori është një oksidues i fortë, squfuri shpesh tregon një funksion të dyfishtë - si oksidativ dhe restaurues. Kjo është, nëse një agjent i fortë oksidues është në squfur, i cili është klori molekular Cl 2, do të oksidohet. Sulfur djeg me një flakë blu në oksigjen për të formuar një gaz me një erë të mprehtë - dioksid sulfur kështu 2: B) kështu që 3 - oksid squfur (VI) ka theksuar pronat acidike. Për oksidet e tilla, reagimet e ndërveprimit me ujë, si dhe me oksidet bazë dhe amfoerik dhe hidrokside janë më karakteristike. Në numrin e listës 2, ne jemi të dukshëm dhe të ujit, oksidin kryesor të BAO-s, dhe hidroksidin e Koh. Në ndërveprimin e oksidit acid me oksidin kryesor, formohet një kripë e acidit dhe metaleve të përshtatshme, e cila është pjesë e oksidit kryesor. Çfarë oksid acid korrespondon me acidin, në të cilin elementi i formimit të acidit ka të njëjtën shkallë oksidimi si në oksid. Pra, 3 oksid korrespondon me acidin sulfurik H 2 kështu 4 (dhe atje, dhe ka një shkallë të oksidimit të squfurit prej +6). Kështu, ndërveprimi i SO 3 me oksidet e metaleve do të merren me kripërat e acidit sulfurik - sulfates që përmbajnë jon sulfate so 4-: SO 3 + BAO \u003d BASO 4 Kur ndërveprojnë me ujë, oksidi acid kthehet në një acid të përshtatshëm: Pra, 3 + h 2 o \u003d h 2 kështu 4 Dhe në ndërveprimin e oksideve acid me hidroksidet me metal, formohet acid i përshtatshëm i kripës dhe ujit: Pra, 3 + 2koh \u003d k 2 kështu 4 + h 2 o C) hidroksid zink ZN (OH) 2 ka vetitë tipike amfotike, domethënë reagon ndaj oksideve acidike dhe acideve dhe oksideve bazë dhe alkaleve. Në listën 4, ne shohim si acidet - bromomrogenated HBR dhe acetik dhe alkali - lioh. Kujtojnë se alkalis quhet hidroksid uji i tretshëm në ujë: ZN (OH) 2 + 2HBR \u003d ZNBR 2 + 2H 2 O ZN (OH) 2 + 2CH 3 COOH \u003d ZN (CH3 COO) 2 + 2H 2 O Zn (oh) 2 + 2lioh \u003d li 2 D) Zink Bromide ZNBR 2 është një kripë, e tretshme në ujë. Për kripërat e tretshme, reagimet e shkëmbimit të joneve janë më të zakonshmet. Kripë mund të reagojë me një kripë tjetër, me kusht që të dy kripërat burimore të jenë të tretshme dhe të formohet një precipituar. Gjithashtu, ZNBR 2 përmban jon bromide br-. Për metalet Halides, është karakteristike që ata janë në gjendje të reagojnë me Hal 2 Halogjens, të cilat janë më të larta në tabelën Mendeleev. Në këtë mënyrë? Llojet e përshkruara të reagimeve vazhdojnë me të gjitha substancat e listës 1: ZNBR 2 + 2AGNO 3 \u003d 2AGBR + ZN (JO 3) 2 3ZNBR 2 + 2NA 3 PO 4 \u003d ZN 3 (PO 4) 2 + 6nabr Znbr 2 + cl 2 \u003d zncl 2 + br 2 Numri i detyrës 12. Vendosni korrespondencën midis emrit të substancës dhe klasës / grupit në të cilin kjo substancë i takon: secilës pozitë të treguar nga letra, zgjidhni pozicionin e duhur të treguar nga numri. Regjistrojnë në numrin e tabelës së substancave të përzgjedhura nën letrat e duhura. Përgjigje: A-4; B-2; Në 1 Shpjegim: A) metil benzinë \u200b\u200bështë toluen, ka një formulë strukturore: Siç mund të shihet, molekulat e kësaj substance përbëhen vetëm nga karboni dhe hidrogjeni, prandaj metilbenzen (toluen) i referohet hidrokarbureve B) formula strukturore e anilinës (aminobenzene) është si më poshtë: Siç mund të shihet nga formula strukturore e një molekule të anilinës përbëhet nga një radikal hidrokarbure aromatik (C 6 H 5 -) dhe një grup amino (-NH 2), pra, Anilina i referohet amines aromatike, i.e. Përgjigja e duhur është 2. C) 3-metilbutanal. Fundi i al "sugjeron që substanca i referohet Aldehidit. Formula strukturore e kësaj substance: Numri 13. Nga lista e propozuar, zgjidhni dy substanca që janë izomerë strukturorë të Bouthen-1. Shkruani në fushën e përgjigjes së substancave të përzgjedhura. Përgjigje: 2; pesë Shpjegim: Izomerët e quajnë substancat që kanë të njëjtin formulë molekulare dhe strukturore të ndryshme, I.E. Substancat që ndryshojnë në rendin e përbërjes së atomeve, por me të njëjtën përbërje të molekulave. Detyra numër 14. Nga lista e propozuar, zgjidhni dy substanca, me ndërveprimin e të cilave me një zgjidhje të permanganatit të kaliumit do të vërehet një ndryshim në ngjyrën e zgjidhjes. Shkruani në fushën e përgjigjes së substancave të përzgjedhura. Përgjigje: 3; pesë Shpjegim: Alkans, si dhe cikloalkanes me një madhësi të ciklit me atomet e ciklit të 5-të ose më shumë janë shumë inerte dhe nuk reagojnë me zgjidhje ujore të agjentëve të fortë oksidues, të tilla si, për shembull, permanganat kalium KMNO 4 dhe kalium dichromat k 2 cr 2 o 7 . Kështu, variantet 1 dhe 4 janë zhdukur - me shtimin e ciklohexane ose propan në zgjidhjen ujore të permanganat kalium, ndryshimi i ngjyrës nuk do të ndodhë. Ndër hidrokarburet e serisë homologe të Benzenit është e pranueshme për veprimin e zgjidhjeve ujore të agjentëve oksidues, vetëm benzol, të gjitha homologët e tjerë oksidohen në varësi të mjetit ose acideve karboksilike, ose në kripërat përkatëse. Kështu zhduket opsioni 2 (benzol). Përgjigjet e drejta - 3 (toluen) dhe 5 (propylene). Të dy substancat zbardhojnë një zgjidhje vjollce të permanganat e kaliumit për shkak të rrjedhjes së reagimeve: CH 3 -CH \u003d CH 2 + 2kmno 4 + 2H 2 o → 3 -CH (OH) -CH2 OH + 2MNO 2 + 2KOH Numri i detyrës 15. Nga lista e propozuar, zgjidhni dy substanca me të cilat reagon formaldehidi. Shkruani në fushën e përgjigjes së substancave të përzgjedhura. Përgjigje: 3; katër Shpjegim: Formaldehid i referohet klasës së aldehides - komponimet organike që përmbajnë oksigjen që kanë një grup aldehyde në fund të molekulës: Reagimet tipike të Aldehidit janë oksidimi dhe reaksionet e rimëkëmbjes që rrjedhin përmes grupit funksional. Ndër listën e përgjigjeve për formaldehid janë reagimi i rimëkëmbjes, ku hidrogjeni përdoret si agjent reduktues (mace - pt, pd, ni), dhe oksidimi - në këtë rast, reagimi i pasqyrës së argjendit. Kur rivendosni hidrogjenin në një katalizator nikeli, formaldehidi kthehet në metanol: Reagimi i pasqyrës së argjendit është një reagim i rimëkëmbjes së argjendit nga zgjidhja e Amoniakut Oksid argjendi. Kur amoniaku është tretur në një zgjidhje ujore, oksidi i argjendtë konvertohet në një kompleks kompleks - diamonminebra hidroksid (i) oh. Pas shtimit të formaldehidit, një reagim redox flows në të cilën argjendi është restauruar: Detyra numër 16. Nga lista e propozuar, zgjidhni dy substanca me të cilat reagon metilamina. Shkruani në fushën e përgjigjes së substancave të përzgjedhura. Përgjigje: 2; pesë Shpjegim: Methyline është më e thjeshtë për të paraqitur komponimet organike të amines klasë. Një tipar karakteristik i amines është prania e një palë elektronike pa mesatare në atomin e azotit, si rezultat, amines shfaqin vetitë e bazës dhe në reagimet veprojnë si nuklefil. Kështu, në lidhje me këtë, methylamine si bazë dhe nukleofili reagon me klorometan dhe acid klorikorik, nga opsionet e propozuara për përgjigje. CH3 NH 2 + CH3 CL → (CH3) 2 NH 2 + CL - CH3 NH 2 + HCL → 3 NH 3 + CL - Detyra numër 17. Skema e mëposhtme e transformimit të substancave është dhënë: Të përcaktojë se cili nga këto substanca janë substanca X dhe Y. Regjistrojnë në numrin e tabelës së substancave të përzgjedhura nën letrat e duhura. Përgjigje: 4; 2. Shpjegim: Një nga reagimet e marrjes së alkoolit është reagimi i rrugicave halopgjene të hidrolizës. Kështu, është e mundur për të marrë etanol nga kloroetan duke u transmetuar në këtë të fundit me një zgjidhje alkali ujore - në këtë rast Naoh. CH3 CH2 CL + Naoh (VODN.) → CH3 CH2 OH + NACL Reagimi i ardhshëm është reagimi i oksidimit të alkoolit etilik. Oksidimi i alkooleve kryhet në katalizatorin e bakrit ose duke përdorur CUO: Numri 18. Vendosni korrespondencën midis emrit të substancës dhe produktit, i cili është formuar kryesisht nga ndërveprimi i kësaj substance me bromin: për çdo pozicion të treguar nga letra, zgjidhni pozicionin e duhur të treguar nga numri. Përgjigje: 5; 2; 3; 6. Shpjegim: Për alkans, reagimet më karakteristike janë reagimet e zëvendësimit radikal të lirë, gjatë së cilës atomi i hidrogjenit zëvendësohet me një atom halogjeni. Kështu, Ethane Bromine mund të merret nga Brometan, dhe Bromine Isobutane - 2-Bromisobutane: Meqenëse ciklet e vogla të molekulave ciklobutane janë të paqëndrueshme, kur ciklet bromination e këtyre molekulave janë shpalosur, kështu, reaksioni i lidhjes vazhdon: Në kontrast me ciklet ciklopozë dhe ciklin ciklobutan cikloheksan të madhësive të mëdha, si rezultat i së cilës atomi i hidrogjenit zëvendësohet me një atom bromi: Detyra №19. Vendosni korrespondencën midis substancave të reaktuar dhe produktit që përmban karboni, i cili formohet gjatë ndërveprimit të këtyre substancave: në çdo pozicion të treguar nga letra, zgjidhni pozicionin e duhur të treguar nga numri. Shkruani në tabelën numrat e përzgjedhur sipas letrave të përshtatshme. Përgjigje: 5; katër; 6; 2. Numri 20. Nga lista e propozuar e llojeve të reagimit, zgjidhni dy lloje të reagimeve ndaj të cilave mund të atribuohet ndërveprimi i metalit alkali me ujë. Shkruani në fushën e përgjigjes së llojeve të reaksionit të zgjedhur. Përgjigje: 3; katër Metale alkali (Li, NA, K, RB, CS, FR) janë të vendosura në nëngrupin kryesor të grupit të tabelës D.I. Mendeleev dhe po reduktojnë agjentë, duke i dhënë lehtësisht një elektron në nivel të jashtëm. Nëse ju caktoni letrën metalike alkaline m, atëherë reagimi i metalit alkali me ujë do të duket kështu: 2m + 2h 2 o → 2moh + h 2 Metalet alkali janë shumë aktive në lidhje me ujin. Reagimi vazhdon me dhunë me lirimin e një sasi të madhe të nxehtësisë, është e pakthyeshme dhe nuk kërkon përdorimin e katalizatorit (jo-stataliteti) - substancave që përshpejtojnë reagimin dhe jo pjesë të produkteve të reagimit. Duhet të theksohet se të gjitha reaksionet shumë ekzotermike nuk kërkojnë përdorimin e katalizatorit dhe vazhdojnë në mënyrë të pakthyeshme. Meqenëse metali dhe uji janë substanca në shtete të ndryshme agregate, ky reagim vazhdon në kufirin e ndarjes së fazës, prandaj është heterogjen. Lloji i këtij reagimi - zëvendësim. Reagimet midis substancave inorganike i referohen reagimeve të zëvendësimit, nëse një substancë e thjeshtë ndërvepron me kompleksin dhe si rezultat formohen substanca të tjera të thjeshta dhe komplekse. (Reagimi i neutralizimit vazhdon midis acidit dhe bazës, si rezultat i të cilave këto substanca shkëmbehen nga pjesët e tyre integrale dhe kripë dhe një substancë paksa subsorative formohen). Siç u përmend më lart, metalet alkali po reduktojnë agjentët, duke i dhënë një elektron nga shtresa e jashtme, prandaj, reagimi është redox. Numri i detyrës 27. Nga lista e propozuar e ndikimeve të jashtme, zgjidhni dy ndikime që çojnë në një rënie në shkallën e reagimit të etilenit me hidrogjen. Shkruani në fushën e përgjigjes së numrit të ndikimeve të përzgjedhura të jashtme. Përgjigje: 1; katër Faktorët e mëposhtëm ndikohen nga shkalla e reagimit kimik: ndryshimi i temperaturës dhe përqendrimi i reagentëve, si dhe përdorimi i një katalizatori. Sipas sundimit empirik të Vant-Gooff, me një rritje të temperaturës për çdo 10 gradë, norma konstante e reagimit homogjen rritet 2-4 herë. Rrjedhimisht, një rënie e temperaturës çon në një rënie në normën e reagimit. Përgjigja e parë është e përshtatshme. Siç është përmendur më lart, shkalla e reagimit gjithashtu ka një ndikim dhe ndryshimin e përqendrimit të reagentëve: nëse rritni përqendrimin e etilenit, atëherë norma e reagimit do të rritet, e cila nuk përputhet me kërkesën e detyrës. Një rënie në përqendrimin e hidrogjenit është komponenti burimor, përkundrazi, zvogëlon shkallën e reagimit. Rrjedhimisht, opsioni i dytë nuk është i përshtatshëm, por i katërti - i përshtatshëm. Katalizatori është një substancë që përshpejton shpejtësinë e reagimit kimik, por jo pjesë të produkteve. Përdorimi i katalizatorit përshpejton rrjedhën e reagimit të hidrogjenizimit të etilenit, i cili gjithashtu nuk korrespondon me gjendjen e problemit, kështu që nuk është përgjigja e duhur. Kur ndërveprimi i etilenit me hidrogjen (në katalizatorët NI, PD, PT), Ethan është formuar: CH2 \u003d CH2 (g) + H 2 (g) → CH 3 -CH 3 (g) Të gjithë komponentët e përfshirë në reagim dhe produkti janë substanca të gazta, prandaj, presioni në sistem do të ndikojë gjithashtu në normën e reagimit. Nga dy vëllime të etilenit dhe hidrogjenit, është formuar një vëllim i Ethanit, prandaj reagimi është zvogëlimi i presionit në sistem. Duke rritur presionin, ne do të përshpejtojmë reagimin. Përgjigja e pestë nuk është e përshtatshme. Detyra №22. Instaloni korrespondencën midis formulës së kripës dhe produkteve të elektrolizës të zgjidhjes ujore të kësaj kripe, të cilat u ndërmjetësuan në elektrodat inerte: në çdo pozicion, Formulë soloi Produkte të elektrolizës Shkruani në tabelën numrat e përzgjedhur sipas letrave të përshtatshme. Përgjigje: 1; katër; 3; 2. Elektroliza është një proces redox që ndodh në elektroda gjatë kalimit të rrymës elektrike të drejtpërdrejtë përmes një zgjidhjeje ose një shkrirje elektrolite. Në katodë, është mundësisht restaurimi i atyre kationeve që kanë aktivitetin më të madh oksidativ. Anonet që kanë aftësinë më të madhe restauruese janë oksiduar së pari në anodë. Electrolysis e zgjidhjes ujore 1) Procesi i elektrolizës së zgjidhjeve ujore në katodë nuk varet nga materiali katodë, por varet nga pozita e kationeve metalike në rreshtin elektrokimik të streseve. Për cations në rresht Li + - Al 3+ Procesi i rimëkëmbjes: 2H 2 O + 2E → H 2 + 2OH - (në katodë H 2 qëndron jashtë) ZN 2+ - PB 2+ Procesi i rimëkëmbjes: Mua n + + ne → mua 0 dhe 2h 2 o + 2e → h 2 + 2oh - (në katodë H 2 dhe mua do të alokulohen) CU 2+ - AU 3+ Procesi i Rimëkëmbjes Me N + + Ne → ME 0 (Mua qëndron në katodë) 2) Procesi i elektrolizës së zgjidhjeve ujore në anodë varet nga materiali i anodës dhe natyra e anionit. Nëse një anod është i pazgjidhshëm, i.e. inerte (platinum, ari, qymyr, grafit), atëherë procesi do të varet vetëm nga natyra e anioneve. Për anionet f -, kështu 4 2-, jo 3 -, po 4 3-, oh - procesi i oksidimit: 4OH - - 4E → O 2 + 2H2 O ose 2H 2 O - 4E → O 2 + 4H + (oksigjen është lëshuar në anode) të joneve halide (përveç f-) 2Hal Oxidation Procesi - - 2E → Hal 2 (falas Herogjenet janë të theksuara) Procesi i oksidimit të acidit organik: 2ROO - - 2E → R-R + 2Co 2 Ekuacioni total i elektrolizës: A) NA 3 PO 4 zgjidhje 2h 2 o → 2h 2 (në katodë) + o 2 (në anode) B) Zgjidhja e KCL 2kcl + 2h 2 o → h 2 (në katodë) + 2koh + cl 2 (në anode) C) zgjidhje CUBR2 CUBR 2 → CU (në katodë) + Br 2 (në anode) D) Zgjidhja CU (NO3) 2 2Cu (nr 3) 2 + 2h 2 o → 2cu (në katodë) + 4hno 3 + o 2 (në anode) Numri i detyrës 23. Vendosni korrespondencën midis emrit të kripës dhe raportit të kësaj kripe në hidrolizë: për çdo pozicion të treguar nga letra, zgjidhni pozicionin e duhur të treguar nga numri. Shkruani në tabelën numrat e përzgjedhur sipas letrave të përshtatshme. Përgjigje: 1; 3; 2; katër Hidroliza e kripërave - ndërveprimi i kripërave të ujit, duke çuar në shtimin e kimit të hidrogjenit H + molekulat e ujit në një anion të mbetjeve acid dhe (ose) të grupit hidroksil Oh - molekulat e ujit në kation metalik. Hidroliza i nënshtrohet kripërave të formuara nga kationet që korrespondojnë me bazat e dobëta dhe anionet që korrespondojnë me acide të dobëta. A) klorur ammoni (NH 4 CL) - kripë e formuar nga acid i fortë klorhidrik dhe amoniak (bazë e dobët), i nënshtrohet hidrolizës në kation. NH 4 CL → NH 4 + + CL - NH 4 + + 2 o → NH 3 · H 2 O + H + (formimi i amoniakut të tretur në ujë) Sycola Solution Medium (pH< 7). B) Sulfati i kaliumit (K 2 SO 4) është një kripë e formuar nga hidroksid i fortë sulfurik dhe hidroksid i kaliumit (alkali, i.e. Baza e fortë), hidroliza nuk është subjekt. K 2 kështu 4 → 2k + + kështu 4 2- C) karbonat natriumi (NA 2 CO 3) është një kripë e formuar nga acid i dobët i qymyrit dhe hidroksid natriumi (alkali, i.E. Baza e fortë) i nënshtrohet hidrolizës në anion. CO 3 2- + H2 O → HCO 3 - + OH - (formimi i një jon bicarbonate subsously subsoising) Mesatarja e zgjidhjes alkaline (pH\u003e 7). D) Sulfide alumini (al 2 s 3) - Kripë e formuar nga acidi i dobët i sulfidit të hidrogjenit dhe hidroksid alumini (baza e dobët), e ekspozuar ndaj hidroksidit të plotë për të formuar hidroksid alumini dhe hidrogjen: Al 2 s 3 + 6h 2 o → 2al (oh) 3 + 3h 2 s Mesatarja është afër neutralit (pH ~ 7). Detyra numër 24. Instaloni korrespondencën midis ekuacionit të reagimit kimik dhe drejtimit të zhvendosjes së ekuilibrit kimik duke rritur presionin në sistem: për çdo pozicion të treguar nga letra, zgjidhni pozicionin përkatës të treguar nga numri. Ekipi i reagimit A) n 2 (g) + 3h 2 (g) ↔ 2NH 3 (g) B) 2h 2 (g) + o 2 (g) ↔ 2h 2 o (g) C) h 2 (g) + cl 2 (g) ↔ 2hcl (g) D) kështu 2 (g) + cl 2 (g) ↔ so 2 cl 2 (g) Drejtimi i zhvendosjes së ekuilibrit kimik 1) ndërrime drejt reagimit të drejtpërdrejtë 2) ndërrime drejt reagimit të kundërt 3) Asnjë zhvendosje e ekuilibrit Shkruani në tabelën numrat e përzgjedhur sipas letrave të përshtatshme. Përgjigje: A-1; B-1; Në 3; Zoti. Reagimi është në ekuilibrin kimik, kur norma e reagimit të drejtpërdrejtë është e barabartë me shpejtësinë e kundërt. Zhvendosja e ekuilibrit në drejtimin e dëshiruar arrihet duke ndryshuar kushtet e reagimit. Faktorët që përcaktojnë pozicionin e ekuilibrit: - presion: Rritja e presionit ndryshon ekuilibrin drejt reagimit që çon në një rënie në vëllim (përkundrazi, reduktimi i presionit tregon bilancin drejt reagimit që çon në rritjen e vëllimit) - temperatura: Rritja e temperaturës zhvendoset ekuilibrin drejt reagimit përfundimtar (përkundrazi, ulja e temperaturës ndryshon ekuilibrin drejt reagimit ekzotermik) - përqendrimi i substancave burimore dhe produkteve të reagimit: Rritja e përqendrimit të materialeve fillestare dhe heqja e produkteve nga sfera e ndryshimit të reagimit të bilancit drejt reagimit të drejtpërdrejtë (përkundrazi, një rënie në përqendrimin e materialeve fillestare dhe një rritje në ekuilibrin e ndryshimit të produkteve të reagimit ndaj reagimit të kundërt) - katalizuesit nuk ndikojnë në zhvendosjen e ekuilibrit, por vetëm përshpejton arritjen e saj. A) Në rastin e parë, reagimi vjen me një rënie të volumit, pasi v (n 2) + 3V (H2)\u003e 2V (NH3). Duke rritur presionin në sistem, ekuilibri do të zhvendoset drejt një vëllimi më të vogël të substancave, prandaj, në drejtimin e drejtpërdrejtë (drejt reagimit të drejtpërdrejtë). B) Në rastin e dytë, reagimi gjithashtu vjen me një rënie të volumit, që nga 2V (H 2) + V (O 2)\u003e 2V (H 2 O). Duke rritur presionin në sistem, ekuilibri gjithashtu do të zhvendoset drejt reagimit të drejtpërdrejtë (ndaj produktit). C) në rastin e tretë, presioni gjatë reagimit nuk ndryshon, sepse V (h 2) + v (cl 2) \u003d 2v (HCL), kështu që asnjë zhvendosje e ekuilibrit nuk ndodh. D) Në rastin e katërt, reagimi gjithashtu vjen me një rënie të volumit, pasi v (so 2) + v (cl 2)\u003e v (kështu 2 cl 2). Duke rritur presionin në sistem, bilanci do të zhvendoset drejt formimit të produktit (reagimi i drejtpërdrejtë). Detyra №25 Vendosni korrespondencën midis formulave të substancave dhe reagentëve, me të cilat mund të dalloni midis zgjidhjeve ujore të tyre: për çdo pozicion të treguar nga letra, zgjidhni pozicionin e duhur të treguar nga numri. Formulat e substancave A) hno 3 dhe h 2 o C) nacl dhe bacl 2 D) ALCL 3 dhe MGCL 2 Shkruani në tabelën numrat e përzgjedhur sipas letrave të përshtatshme. Përgjigje: A-1; B-3; Në 3; M-2. A) Acidi nitrik dhe uji mund të dallohen nga kripë - karbonat kalciumi Caco 3. Kalciumi karbonat në ujë nuk shpërndahet, dhe kur ndërveprojnë me acid nitrik, ajo formon një kripë të tretshme - nitrat e kalciumit CA (nr 3) 2, ndërsa reagimi shoqërohet nga ndarja e dioksidit të karbonit të pangjyrë: CACO 3 + 2HNO 3 → CA (Nr 3) 2 + CO 2 + H 2 O B) Klorid i kaliumit KCL dhe Alkali Naoh mund të zgjidhen nga një zgjidhje e sulfatit të bakrit (ii). Me bashkëveprimin e sulfatit të bakrit (ii) me KCL, reagimi i shkëmbimit nuk rrjedh, ka k +, cl -, cu 2+ dhe kështu 4 jonet në zgjidhjen, të cilat nuk formojnë substanca paksa subsoing në njëri-tjetrin. Me ndërveprimin e bakrit (ii) sulfate me NaOH, flukset e reagimit të këmbimit, si rezultat i të cilit bakri (ii) hidroksid (baza bazë) bie në precipitat. C) kloridet e natriumit NACL dhe barium bacl 2 - kripëra të tretshme, të cilat gjithashtu mund të zbulohen me një zgjidhje të sulfatit të bakrit (ii). Në bashkëveprimin e bakrit (ii) sulfate me NACL, reagimi i shkëmbimit nuk vazhdon, ka na +, cl -, cu 2+ dhe kështu 4 jonet në zgjidhjen, të cilat nuk formojnë substanca shumë subsorative në njëri-tjetrin. Kur reagimi i bakrit (ii) sulfate me bacl 2 të ardhurat, flukset e reagimit të këmbimit, si rezultat i të cilit barium barium sulfate 4 bie në precipitat. D) Alclez 3 dhe alumini i magnezit Chloride MGCL 2 shpërndahen në ujë dhe sillen ndryshe kur bashkëveprojnë me hidroksid kaliumi. Kloride magnez me alkali formon një precipituar: MGCL 2 + 2koh → mg (oh) 2 ↓ + 2kcl Në bashkëveprimin e alkali me klorur alumini, një precipituar është formuar së pari, e cila pastaj shpërbëhet për të formuar një kripë komplekse - kalium tetrahydroxyaluminated: Alcl 3 + 4koh → k + 3kcl Numri i detyrës 26. Instaloni korrespondencën midis substancës dhe zonës së aplikimit: për çdo pozicion të treguar nga letra, zgjidhni pozicionin e duhur të treguar nga numri. Shkruani në tabelën numrat e përzgjedhur sipas letrave të përshtatshme. Përgjigje: A-4; B-2; Në 3; Zoti. A) Amoniaku është një produkt thelbësor i industrisë kimike, prodhimi i saj është më shumë se 130 milion ton në vit. Kryesisht amoniaku përdoret në përgatitjen e plehrave të azotit (nitrat dhe sulfat amoni, ure), droga, eksplozivë, acid nitrik, sode. Ndër opsionet e propozuara të përgjigjeve, zona e amoniakut është prodhimi i plehrave (opsioni i katërt i përgjigjes). B) metani është hidrokarburja më e thjeshtë, përfaqësuesi më i qëndrueshëm termikisht i një numri të përbërësve të kufirit. Është përdorur gjerësisht si lëndë djegëse e brendshme dhe industriale, si dhe lëndëve të para për industrinë (opsioni i përgjigjes së dytë). Metani është 90-98% është pjesë e gazit natyror. C) gome të quajtur materiale, ne marrim polimerizim të komponimeve me lidhjet e dyfishta të konjuguar. Isoprene po ndjek vetëm këtë lloj komponimi dhe përdoret për të marrë një nga llojet e gomës: D) Pesha molekulare e ulët ndryshon për të marrë plastikë, në veçanti, etileni përdoret për të marrë plastikë, të quajtur polietileni: n.Ch 2 \u003d ch 2 → (-ch 2 -ch 2 -) n Numri i detyrës 27. Llogaritni masën e nitratit të kaliumit (në gram), të cilat duhet të shpërbëhen në 150 g zgjidhje me një pjesë masive të këtij kripë 10% për të marrë një zgjidhje me një pjesë masive prej 12%. (Shënoni numrin deri në të dhjetat.) Përgjigje: 3.4 g Shpjegim: Le të shkoni të jetë një masë nitrate kaliumi, e cila është tretur në 150 g zgjidhje. Ne llogarisim masën e nitratit të kaliumit të tretur në 150 g zgjidhje: m (kno 3) \u003d 150 g · 0.1 \u003d 15 g Në mënyrë që fraksioni masiv i kripës të jetë 12%, u shtua x g e nitratit të kaliumit. Masa e zgjidhjes ishte (150 + x), ekuacioni do të shkruajë ekuacionin në formë: (Shënoni numrin deri në të dhjetat.) Përgjigje: 14.4 g Shpjegim: Si rezultat i djegies totale të sulfidit të hidrogjenit, formohet dioksidi i squfurit: 2h 2 s + 3o 2 → 2SO 2 + 2H 2 O Pasoja e ligjit Avogadro është se vëllimi i gazrave në të njëjtat kushte lidhen me njëri-tjetrin, si dhe sasitë e këtyre gazeve. Kështu, sipas ekuacionit të reagimit: ν (o 2) \u003d 3 / 2ν (h 2 s), rrjedhimisht, vëllimet e sulfidit të hidrogjenit dhe oksigjenit lidhen me njëri-tjetrin në të njëjtën mënyrë: V (o 2) \u003d 3 / 2v (h 2 s), V (o 2) \u003d 3/2 · 6.72 l \u003d 10.08 l, prandaj v (o 2) \u003d 10.08 l / 22.4 l / mol \u003d 0.45 mol Ne llogarisim masën e oksigjenit të nevojshëm për djegien e përgjithshme të sulfidit të hidrogjenit: m (o 2) \u003d 0.45 mol · 32 g / mol \u003d 14.4 g Detyra numër 30. Përdorimi i metodës së bilancit elektronik, bëni ekuacionin e reagimit: NA 2 SO 3 + ... + KOH → K 2 MNO 4 + ... + H 2 O Përcaktoni agjentin oksidues dhe reduktimin e agjentit. MN +7 + 1E → MN +6 │2 Reagimi i rimëkëmbjes S +4 - 2E → S +6 │1 Reagimi i oksidimit MN +7 (KMNO 4) - Oksidues, S +4 (NA 2 SO 3) - Restore Na 2 kështu 3 + 2kmno 4 + 2koh → 2k 2 mno 4 + na 2 kështu 4 + h 2 o Numri i detyrës 31. Hekuri u shpërbë në acid të nxehtë të koncentruar sulfurik. Kripë që rezulton u trajtua me një zgjidhje të tepërt të hidroksidit të natriumit. Precipitati që rezulton kafe u filtrua dhe kalcinuar. Substanca rezultuese u nxehtë me hekur. Shkruani ekuacionet e katër reagimeve të përshkruara. 1) hekuri, si alumini dhe krom, nuk reagojnë me acid sulfurik të koncentruar, duke mbuluar filmin oksid mbrojtës. Reagimi ndodh vetëm kur nxehet me ndarjen e gazit të squfurit: 2FE + 6H 2 SO 4 → Fe 2 (SO 4) 2 + 3SO 2 + 6H 2 O (kur të nxehtë) 2) Sulfat hekuri (iii) - kripë e tretshme në ujë, hyn në një reagim të shkëmbimit alkali, si rezultat i të cilit Hy hekuri (III) (Lidhja e III) është precipituar: FE 2 (SO 4) 3 + 3NAOH → 2FE (OH) 3 ↓ + 3NA 2 SO 4 3) Metalet e pazgjidhura Hydroxides me kalcinim decompose për oksidet e duhura dhe uji: 2fe (oh) 3 → 2 o 3 + 3h 2 o 4) Kur oksidi hekuri (iii) është i nxehtë me hekur, hekuri (ii) është formuar (hekuri në lidhjen Feo ka një shkallë të ndërmjetme të oksidimit): FE 2 O 3 + FE → 3FEO (kur nxehet) Numri 32. Shkruani ekuacionet e reagimit me të cilat mund të kryhen transformimet e mëposhtme: Kur shkruani ekuacionet e reagimit, përdorni formula strukturore për substancat organike. 1) Dehidrimi intramolekular ndodh në temperatura mbi 140 o C. Kjo ndodh si rezultat i copëzimit të atomit të hidrogjenit nga atomi i karbonit të alkoolit që ndodhet përmes një hidroksil me alkool (në pozicionin β). CH3 -CH2 -CH 2 -OH → CH2 \u003d CH-CH 3 + H 2 O (Kushtet - H 2 SO 4, 180 O C) Dehidrimi intermolekular ndodh në një temperaturë nën 140 o C nën veprimin e acidit sulfurik dhe në fund të fundit zvogëlohet në copëzimin e një molekule të ujit nga dy molekula alkoolike. 2) propilen i referohet alkenes asimetrike. Me shtimin e hidrogjenit dhe ujit halogjen, atomin e hidrogjenit bashkohet me atomin e karbonit në një komunikim të shumëfishtë të lidhur me një numër të madh të atomeve të hidrogjenit: CH2 \u003d CH-CH 3 + HCL → CH 3 -CCL-CH 3 3) Duke vepruar me një zgjidhje ujore të Naoh në një 2-kloropropane, një atom halogjeni zëvendësohet nga një grup hidroksil: CH 3 -CCL-CH 3 + NAOH (AQ.) → CH 3 -CHOH-CH 3 + NACL 4) Është e mundur për të marrë propilen jo vetëm nga propanol-1, por edhe nga reagimi propanol-2 i dehidrimit intramolekular në temperatura mbi 140 o c: CH 3 -CH (OH) -CH 3 → CH2 \u003d CH-CH 3 + H 2 O (Kushtet H 2 SO 4, 180 O C) 5) Në një medium alkaline, duke vepruar në një të holluar me zgjidhje ujore të permanganatit të kaliumit, alkens hydroxylation ndodh me formimin e diols: 3CH 2 \u003d CH-CH 3 + 2kmno 4 + 4h 2 o → 3hoch 2 -CH (OH) -CH 3 + 2MNO 2 + 2KOH Numri i detyrës 33. Përcaktoni fraksionet masive (në%) të hekurit (ii) sulfide dhe sulfide alumini në përzierje, nëse përpunimi i 25 G i kësaj përzierje është siguruar me ujë, i cili reagoi plotësisht me 960 g një zgjidhje prej 5% të sulfatit të bakrit ( Ii). Në përgjigje, shkruani ekuacionet e reagimit që janë të specifikuara në gjendjen e detyrës dhe të sjellin të gjitha llogaritjet e nevojshme (specifikoni njësitë e matjes së dëshiruar sasi fizike). Përgjigje: ω (al 2 s 3) \u003d 40%; Ω (Cuso 4) \u003d 60% Kur përpunoni përzierjen e hekurit (ii) sulfid sulfat dhe alumini, sulfati është thjesht i tretur, dhe sulfidi është hidrolizuar për të formuar hidroksid alumini (iii) dhe sulfid hidrogjeni: Al 2 s 3 + 6h 2 o → 2al (oh) 3 ↓ + 3h 2 s (i) Kur sulfidi i hidrogjenit kalon përmes një zgjidhjeje të bakrit (ii) zgjidhje sulfate, sulfuri bakri (ii) bie: Cuso 4 + H 2 S → Cus ↓ + H 2 SO 4 (II) Ne llogarisim masën dhe sasinë e substancës së sulfatit të tretur të bakrit (ii): m (cuso 4) \u003d m (p-ra) · ω (cuso 4) \u003d 960 g · 0.05 \u003d 48 g; ν (cuso 4) \u003d m (cuso 4) / m (cuso 4) \u003d 48 g / 160 g \u003d 0.3 mol Sipas ekuacionit të reagimit (ii) ν (cuso 4) \u003d ν (h 2 s) \u003d 0.3 mol, dhe sipas ekuacionit të reagimit (iii) ν (al 2 s 3) \u003d 1 / 3ν (h 2 s) \u003d 0, 1 mol Llogaritni masën e sulfidit të aluminit dhe sulfatit të bakrit (ii): m (al 2 s 3) \u003d 0.1 mol · 150 g / mol \u003d 15 g; M (cuso4) \u003d 25 g - 15 g \u003d 10 g ω (al 2 s 3) \u003d 15 g / 25g · 100% \u003d 60%; Ω (Cuso 4) \u003d 10 g / 25g · 100% \u003d 40% Numri 34. Kur djegia e një mostre të disa kompleks organik Pesha 14.8 g janë marrë 35.2 g dioksid karboni dhe 18.0 g ujë. Dihet se densiteti relativ i avullit të kësaj substance përgjatë hidrogjenit është i barabartë me 37. Gjatë studimit prona kimike Kjo substancë është vërtetuar se me ndërveprimin e kësaj substance me bakri (ii) oksid, ka formuar ketoni. Bazuar në këto kushte të detyrës: 1) Llogaritjet e nevojshme për të krijuar një formulë molekulare organike (specifikoni njësitë e matjes së sasive të dëshiruara fizike); 2) Shkruani formulën molekulare të lëndës organike origjinale; 3) të bëjë formulën strukturore të kësaj substance, e cila në mënyrë unike pasqyron rendin e komunikimit të atomeve në molekulën e saj; 4) Shkruani ekuacionin e reagimit për këtë substancë me oksid bakri (ii) duke përdorur formulën strukturore të substancës. Detyrat tipike të testimit për kimikë përmbajnë 10 opsione për grupet e detyrave të hartuara duke marrë parasysh të gjitha tiparet dhe kërkesat e provimit të unifikuar shtetëror në vitin 2017. Qëllimi i manualit është që t'u ofrojë lexuesve informacion rreth strukturës dhe përmbajtjes së Kim 2017 në kimi, shkalla e vështirësisë së detyrave. Shembuj. Nga lista e propozuar e substancave, zgjidhni dy substanca me secilën prej të cilave reagon bakri. Përmbajtje Specifikim 1. Emërimi i Kim Ege Provimi i unifikuar i shtetit (në tekstin e mëtejmë EGE) është një vlerësim objektiv i cilësisë së trajnimit të personave që kanë zotëruar programet arsimore të arsimit të mesëm të përgjithshëm, duke përdorur detyrat e formularit të standardizuar (materialet e matjes së kontrollit). EGE është mbajtur në përputhje me ligjin federal të 29 dhjetorit 2012 Nr. 273-FZ "për Arsimin në Federatën Ruse". Materialet e matjes së kontrollit ju lejojnë të vendosni nivelin e zhvillimit nga të diplomuarit e komponentit federal standarde shtetërore Mesatare (të plotë) të arsimit të përgjithshëm në kimi, nivelet bazë dhe të profilit. Rezultatet e provimit të unifikuar të shtetit për kimi organizata arsimore Arsimimi i mesëm profesional dhe organizatat arsimore të arsimit të lartë profesional si rezultat i testeve të hyrjes në kimikë. 2. Dokumentet që përcaktojnë përmbajtjen e Kim Ege 3. Qasjet në përzgjedhjen e përmbajtjes, zhvillimin e strukturës së Kim Ege Baza e qasjeve në zhvillimin e Kim EGE 2017 në kimi arriti në ato qëndrime të përgjithshme metodologjike që janë identifikuar gjatë formimit të modeleve të ekzaminimit të viteve të mëparshme. Thelbi i këtyre parametrave është si më poshtë. 4. Struktura e CIM EGE Çdo version i punës së ekzaminimit është ndërtuar sipas planit të unifikuar: puna përbëhet nga dy pjesë, duke përfshirë 40 detyra. Pjesa 1 përmban 35 detyra me një përgjigje të shkurtër, duke përfshirë 26 detyra të nivelit bazë të kompleksitetit (numrat rendor të këtyre detyrave: 1, 2, 3, 4, ... 26) dhe 9 detyra të nivelit të lartë të kompleksitetit ( Numrat e sekuencës së këtyre detyrave: 27, 28, 29, ... 35). Pjesa 2 përmban 5 detyra të një niveli të lartë të kompleksitetit, me një përgjigje të detajuar (numrat rendor të këtyre detyrave: 36, 37, 38, 39, 40).Formula e substancave
Reagent
Në koleksion ka përgjigje për të gjitha opsionet e testimit dhe zgjidhjet e të gjitha detyrave të një prej opsioneve janë dhënë. Përveç kësaj, mostrat e formularëve të përdorur në përdorim janë dhënë për të regjistruar përgjigjet dhe zgjidhjet.
Autori i detyrave është një shkencëtar kryesor, një mësues dhe një metodolog i cili merr pjesëmarrjen e drejtpërdrejtë në zhvillimin e materialeve të matjes së kontrollit të EGE.
Doracaku është i dedikuar për mësuesit që të përgatisin studentët për provimin e kimisë, si dhe nxënësit e shkollave të mesme dhe të diplomuarit - për vetë-përgatitjen dhe vetëkontrollin.
Në klorur amonium ka lidhje kimike:
1) jonik
2) polare kovalente
3) Të lidhni jo-polare
4) hidrogjen
5) metal
1) klorur zink (R-P)
2) sulfat natriumi (rr)
3) Acid nitrik holluar
4) acid i koncentruar sulfurik
5) oksid alumini
Parathënie
Udhëzime për kryerjen e punës
OPSIONI 1
Pjesa 1
Pjesa 2
Opsioni 2.
Pjesa 1
Pjesa 2
Opsioni 3.
Pjesa 1
Pjesa 2
Opsioni 4.
Pjesa 1
Pjesa 2
Opsioni 5.
Pjesa 1
Pjesa 2
Opsioni 6.
Pjesa 1
Pjesa 2
Opsioni 7.
Pjesa 1
Pjesa 2
Opsioni 8.
Pjesa 1
Pjesa 2
Opsioni 9.
Pjesa 1
Pjesa 2
Opsioni 10.
Pjesa 1
Pjesa 2
Përgjigjet dhe zgjidhjet
Përgjigjet për detyrat e Pjesës 1
Zgjidhje dhe përgjigje për detyrat e Pjesës 2
Zgjidhja e detyrave të opsionit 10
Pjesa 1
Pjesa 2.
Shkarko falas libër elektronik Në një format të përshtatshëm, shikoni dhe lexoni:
Shkarkoni Librin EEE 2017, Kimi, Testet tipike, Medvedev Yu.n. - fileskachat.com, shkarko shpejtë dhe pa pagesë.
materialet e matjes së kontrollit
për mbajtjen e një provimi të vetëm shtetëror në vitin 2017
në kimi