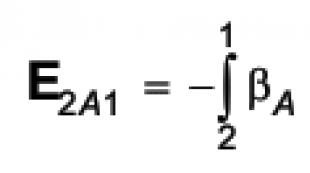Kno3 rozklad pri reakčnej teplote. Alternatíva k topeniu. II. Motivačný moment
Výhody
Tento typ paliva mám obzvlášť rád, pretože je netoxický. Pozostáva z potravinárskeho výrobku a hnojiva. Nemusím si tak robiť veľké starosti s manipuláciou alebo stratou kúskov na dvore. KNO3 sa používa ako konzervant mäsa pri výrobe klobás a v medicíne. V mladosti som dostal KNO3 z lekárne, kde na fľaštičkách bolo napísané, čo mám užívať? lyžička rozpustená vo vode ako diuretikum. Našiel som ho aj v mäsiarstve, kde ho používali pri výrobe klobásy. A všimol som si, že moja zubná pasta obsahuje KNO3 ako desenzibilizátor. Nie je teda potrebné sa obávať miernej expozície a dokonca ani požitie malého množstva KNO3 nespôsobí okamžité poškodenie väčšiny ľudí. Pri pohľade na vrece Petrovho špeciálneho tekutého hnojiva som si všimol, že na prvom mieste je dusičnan draselný. Rastliny to milujú.
Upozornenia na KNO3:
- Existujú dôkazy, že používanie dusičnanov/dusitanov v potravinách môže spôsobiť rakovinu, a hoci konzumácia KNO3 je možná, neodporúča sa.
- Po požití sa dusičnan draselný metabolizuje na dusitan draselný, ktorý je toxický a nebezpečný najmä pre deti! Držte to mimo ich dosahu!
- U niektorých ľudí sa po expozícii KNO3 vyvinie dermatitída. Ak ste na to náchylní, použite rukavice.
- Vdýchnutie veľkého množstva prachu KNO3 môže spôsobiť poškodenie pľúc. Ak ste vystavení prachu KNO3, noste vhodný respirátor.
Ďalšie dobré veci o Rcandy:
- Stabilný, nezrúti sa za predpokladu, že je izolovaný od vzdušnej vlhkosti
- Reformovateľný, možno ho zahriať a vytvarovať do takmer akéhokoľvek tvaru, alebo stlačiť do tvaru tlakom ruky
- Vynikajúca pevnosť v tlaku, dobrá pevnosť v ťahu.
- Produkuje husté oblaky bieleho dymu, možno použiť ako stopovač.
- Rýchlosť horenia je možné regulovať teplotou varenia, ako aj pridaním prísad.
- Relatívne necitlivé na vznietenie nárazom alebo trením, možno vŕtať, rezať, biť kladivom bez zapálenia.*
Nedostatky
- Nepáči sa mi, že palivo je hygroskopické, absorbuje vlhkosť zo vzduchu. Musí byť utesnený pred vzduchom, inak sa v krátkom čase stane zbytočným, najmä na Floride, kde sa 90% vlhkosť považuje za nízku. Toto je tiež bezpečnostný faktor, pretože stratené malé kúsky paliva nebudú dlho horľavé. Čoskoro sa stanú tekutými, absorbujú sa do zeme a rastliny to zožerú.
- Toto palivo je trochu krehké, preto musí byť v motore umiestnené tak, aby sa počas spracovania alebo spaľovania nerozbilo alebo nerozbilo. Vyskytujú sa obavy, keď sa zabalené dáma môže zlomiť, ak sa roztiahne, a keď sa dáma môže navzájom naraziť. Existovala určitá obava, že šmykové sily spôsobené extrémnym zrýchlením zničia bloky a kusy upchajú trysku. Konzervatívna konštrukcia motora môže kompenzovať tieto obmedzenia, ale môže obmedziť výber geometrie kontroléra.
- Toto palivo má ISP (špecifický impulz) nižší ako niektoré iné palivá, najmä kompozitné.
- Pri spaľovaní v motore vytvára veľmi málo viditeľný plameň. Ide skôr o estetickú záležitosť – mnohí ľudia radi vidia lesklé biele alebo farebné plamene, podobné kondenzácii. Ešte som nenašiel aditívum, ktoré vytvára viditeľné plamene alebo iskry. Dennis Welch uvádza, že titán vytvára krásny chvost, ale to si musím overiť sám.
- Výroba tohto paliva vyžaduje použitie pece, ktorá sa zvyčajne nachádza v kuchyni. Pozor! To predstavuje nebezpečenstvo pre váš byt.
 |
Upozorňujeme, že neodporúčam vyrábať toto palivo vo vašej domácej kuchyni. Dúfam, že jedného dňa dobre zdokumentovaný bezpečnostný program umožní bezpečne variť mierne množstvá v kuchyni. Náhodné riziko nemusí byť v kuchyni väčšie ako v dielni, no následky budú pravdepodobne katastrofálnejšie. Tým sa mnohým vyrieši dilema, keďže väčšina rúr sa nachádza v kuchyni a nedá sa ľahko premiestniť. Hľadám spôsoby riešenia tohto problému a prijímam akékoľvek návrhy. Momentálne skúmam možné využitie vstavaného sušiaceho stojana do dielne, termostaticky ovládané plynové grily pre použitie mimo domácnosti. Žiadne z týchto riešení ešte nebolo testované. Uprednostňujem pripojenie mobilného plynového sporáka k prenosnej propánovej nádrži, ako je tá na mojej zadnej palube. |
Pár dobrých správ: Nedávno som urobil polovičnú dávku RCandy v mojej hriankovej rúre s použitím pyrexovej zapekacej misky vhodnej veľkosti. Takže ak nie ste pripravení na rúru vo vašej dielni, toto môže byť dobré miesto, kde začať.
Recept
Fotografie v tomto dokumente sú miniatúry, kliknutím na ne zobrazíte väčšie fotografie.
Ak sa chcete vrátiť na túto stránku, kliknite na tlačidlo Späť.
Ingrediencie:
Vybavenie zahŕňa:
- 2 pyrexové 9-palcové pekáče
- 2 kamenné dlaždice alebo sklenené dosky, používané ako kryty
- Malý kastról - preferujem nerezovú alebo smaltovanú oceľ, ale nevidím dôvod, prečo by sa nedali použiť aj ostatné.
- Pákové alebo iné váhy s presnosťou na gram a schopné vážiť do 100 g a viac.
- stolový nôž a lyžica (voliteľné)
- Odmerka alebo pohár
- Rúra predhriata na 300 stupňov Fahrenheita (150 stupňov Celzia)
- Rukoväť kanvice alebo iné
- Nádoby z 35 mm filmu alebo iné malé nádoby, ktoré budú vzduchotesné a pri zapálení sa neroztrieštia. Nikdy som nezažil spontánne horenie tohto paliva, ale kto vie:
Potrebný je aj hasiaci prístroj. Je dobré, ak ho nepotrebujete, ale je lepšie ho mať pre každý prípad.
KNO3
Používam hlavne dusičnan draselný zakúpený od dodávateľov ohňostrojov ako Firefox a Skylighter. Obaja sú dobrí. Predávajú KNO3 za 2,50 až 4,00 doláre za libru v závislosti od značky a mletia. Kvalitnejšie prášky sú drahšie. Na tento proces postačí najhrubšia značka, pretože rozpustenie ledku ho rozdrví na veľmi malú veľkosť častíc.
Med funguje dobre ako náhrada kukuričného sirupu, ale robí konečné palivo hygroskopickejším, takže ho neodporúčam. Nedávno som použil sirup Honey Girl, čo je ochutený kukuričný sirup, a to tiež fungovalo dobre. Javorový sirup nefungoval - palivo dobre horí, ale netvorí sa.




Nádoba sa umiestni na oheň. Toto je stredne nebezpečný bod. Fotografia jasne ukazuje, že pod panvicou je ohrievací plameň. Označte dve rôzne dlaždice. Obidve fungujú. Niekedy používam zapustené dlaždice, ktoré fungujú skvele. Som si istý, že by sa to dalo urobiť nad ohňom. Nezáleží na tom, ako nádobu zahrievate, pokiaľ sa KNO3 a cukor rozpustia. Je dôležité, aby ste sledovali a nenechali zmes prevrieť alebo vyschnúť!
Nakoniec sa všetko rozpustí, zmes sa vyjasní. Päť minút sa môže zdať dlhých, ale musíte sa pozerať bez zastavenia!
Do každej formy ide zhruba polovica. Vraj do každej nádoby musím dať presne polovicu, ale drobné rozdiely nie sú veľký problém. A rád to robím rýchlo, aby kôrka, ktorá sa rýchlo vytvorí, nezostala v nádobe, ktorú používam, a tým nevyváži zmes.


 | Formuje sa za 10 minút. Začnú sa vytvárať bubliny. |
 | Formuje sa za 25 minút. Dobre tvarované bubliny. V strede každej formičky zostáva ešte trochu tekutiny. |
 | Formuje sa za 35 minút. Neexistuje žiadna tekutina, ale vločky a bubliny sú modro-biele. |
 | Formuje sa po 40 minútach a neskôr. Farba zmesi sa postupne mení z modrobielej na slonovinovú. Na fotografii to nie je zobrazené. Opäť si všimnite, že zlatá farba vzdialenej formy je ilúzia; obe zmesi sú rovnakej farby, viac podobné farbe blízkej formy. |
Všimnite si, že zmes NEMIEŠAJTE, kým sa varenie nedokončí. Rozbitie bublín spomalí odparovanie vody, čím sa proces spomalí. Preto túto zmes pred vykonaním testu krehkosti nemiešajte.



V 45. minúte sa formy vyberú z pece a odoberie sa malá vzorka.
Vyvaľká sa do gule veľkosti hrášku, vyrovná sa na studenom suchom povrchu a nechá sa asi 20 sekúnd vychladnúť. Forma sa vráti do pece, kým sa vzorka ochladí.




Ochladená vzorka sa ohne na dve časti. Ak sa vzorka ohne bez zlomenia, zmes je stále mokrá a bude sa musieť variť dlhšie. Vzorky odoberajte každé tri minúty alebo dovtedy, kým sa ohnutá vzorka nerozbije.
(Nedávno som zistil, že dobrá štruktúra sa dá dosiahnuť malým množstvom zvyškovej vlhkosti v zmesi. Ak sa ochladená vzorka ťažko ohne, môže to byť dobré. Môže to znížiť krehkosť výsledného paliva, ale toto ešte nebolo stanovené.)



V tomto prípade som panvičky vybral z rúry včas. Ochladená vzorka je čisto rozbitá a vykazuje jednotnú štruktúru. V skutočnosti to bolo trochu zrnité, takmer suché. Ešte päť minút a zmes by sa musela zachrániť.*
*Aby ste ušetrili, pridajte 1 čajovú lyžičku vody do každej panvice, zakryte ju nádobou a vráťte do rúry na 15 minút. Pokračujte v príprave a opakovaní testov, kým sa nedosiahne požadovaná štruktúra.
Akonáhle zmes prejde testom ohybu, je pripravená a mala by byť okamžite spracovaná. Čas na škrabanie. Toto je nebezpečný bod, pri ktorom musíte nosiť všetky ochranné prostriedky. Nikdy som nemal oheň, ale stavím sa, že keby sa vločky vznietili, rozleteli by sa na všetky strany a spôsobili by veľké škody.



Vločky v každej forme sa zoškrabú a spoja v jednej nádobe.



Používam tuhú polievkovú lyžicu na stláčanie, miešanie a plastifikáciu vločiek, kým sa nezačnú stláčať. Spočiatku sa môžu brániť držať sa spolu. Buďte vytrvalí. Ak ste zmes príliš nevysušili, nakoniec sa to stane.
Ďalší nový trik: Vsypte vločky a rozbúchajte ich drevenou alebo plastovou paličkou. To spôsobí, že sa zhutnia s menšou námahou, než je jednoduché miešanie a stláčanie.

Po minúte alebo dvoch ochladzovania je palivo stále horúce, ale môže byť potrebné ho mierne spracovať. Podávam ho z jednej ruky do druhej, aby som si udržal dobrý vzťah s mojimi nervovými bunkami.

Tu odlomím malú vzorku a zrolujem do tyčinky. Všimnite si, že doska je pokrytá látkou. Hladký povrch vytvára pre toto palivo vynikajúci ryhovaný povrch.

Môžete z neho vyvaľkať pekné tyčinky ako hlina. Vytvrdne presne tak, ako ste ho zrolovali, pričom si zachová svoj zamýšľaný tvar.




Pevnejším rozdrvením paliva ho môžem prikryť dlaždicami. To mi umožňuje udržať ho dlhšie teplý a mäkký. Teplota pece sa zníži na 200 F (93 C). Palivo pri tejto teplote môže zostať mäkké po dlhú dobu bez toho, aby sa rozložilo.
Alternatíva k ručnému drveniu paliva: Použite kuchynský robot! Môže byť umiestnený vonku alebo na veľmi bezpečnom mieste. Kombajn zapojím do odpojenej predlžovacej šnúry a následne zapojím predlžovačku do elektrickej siete v bezpečnej vzdialenosti. Nikdy som nemal náhodný požiar, ale vždy je šanca.










Asi po 1 minúte sa palivo zmení na guľu. Ak som spokojný, vypnem auto a vyberiem palivo. Zvyčajne ho vyvaľkám na menšie guľôčky, ktoré vychladnú a vložia do tesne uzavretej nádoby.
Kusy si vždy odložím na výrobu prútov na testovanie rýchlosti horenia.





Kus paliva sa ručne zroluje do tyče s priemerom 1/4 palca. Odreže sa kus dlhý 1 palec a jeden koniec sa zapáli. Tento tvar sa nazýva palivová tyč. Na zapálenie nemusíte použiť propánový horák, je to len dobrý zdroj stabilného plameňa a necháva jednu ruku voľnú na držanie drôtu a druhú na držanie stopiek.
Stopky spustím, keď sa rozsvieti palivo a zastavím, keď dohorí. Pretože palivo horí z jedného konca na druhý, táto hodnota bude mierou spaľovania paliva vo vzduchu. Táto vzorka zhorela palec za 11 sekúnd, čo je priemer pre ľahký výbuch paliva. Niektoré vzorky zhoria palec za 8 alebo 9 sekúnd. Pod tlakom bude horieť rýchlejšie ako raketový motor.

Prút vychladol, tak ho rozlámem na kúsky a vložím do krabičiek od filmu. Vo vzduchotesnej nádobe možno palivo skladovať roky. Používam tieto ?-palcové palice na víry a mikrorakety.
Každú nádobu zreteľne označte a umiestnite na bezpečné miesto.
Snáď najpozoruhodnejšou vlastnosťou tohto paliva je, že sa dá znovu ohrievať a tvarovať do akéhokoľvek tvaru. Vložte ho do rúry s teplotou 200 F (93 C), kým sa nezahreje, nadobudne konzistenciu tmelu a dá sa ručne tvarovať ako hlina do akéhokoľvek tvaru. Ľahký tlak ruky mu môže dať tvar matrice (formy).

Napríklad vyrobím palivovú bombu do motora. Je to jednoducho valcový blok s priemerom 5/8" s 1/8" priechodným otvorom a váži 10 gramov. Používa sa v spojení s čiernym komerčným práškom zrnitosti FFFG. 
Odrežte kúsok s hmotnosťou asi 10 gramov alebo trochu viac. 
Zrolujte do valca s priemerom veľkosti skrine motora. V tomto prípade mala trubica priemer 5/8 palca.

Umiestnite dávku čierneho prášku na dosku a potom po nej prevalcujte palivo, aby sa zrnká prilepili. Ak sa neprilepia, vložte palivo na niekoľko minút do rúry na 200 F (93 C), kým opäť nezmäkne.

Vytvorte priechodný otvor cez stred palivovej náplne. Urobte to dostatočne veľké pre váš zapaľovač. Tu používam bambusové špízy, tie isté, aké sa používajú na ražniči alebo tempure. Tieto palice používam na veľa vecí:

Teraz sa pokúšam vložiť blok do rúrky s priemerom 5/8 palca. Tento kus je príliš veľký.

Tak valím znova. Palivo trochu stvrdlo, a preto sa dá presnejšie valcovať.

Nie je tu zobrazené, ale vážil som tento tablet a vážil viac ako 12 gramov. Tým sa obal takmer určite roztrhne, preto som kúsok odrezal ostrým nožom. Potom bola hmotnosť 10,2 gramov. Dosť blízko.


Teraz je všetko v poriadku, stačí ho umiestniť do 5/8 palcovej trubice.


Keďže túto kontrolu ihneď nepoužijem, umiestnim ju do škatuľky od filmu. Spolu so zvyškom tohto sťahovania. Jednoducho urobte hrudky a hrudky paliva, vložte ich teplé do nádob a pevne uzavrite. Položte nádoby na boky, kým nevychladnú. Ak tak neurobíte, palivo stečie ku dnu a stuhne a vy strávite veľa času jeho odstraňovaním.
Jimmy zívanie
5/26/01
rev 6/5/03
Preložil Incubus
POZNÁMKY PREKLADATEĽA
1. TÁTO TECHNOLÓGIA JE PREKLADANÁ A ZVEREJŇOVANÁ S LAKÚCNYM POVOLENÍM AUTORA.
2. PRI CELOM ALEBO ČIASTOČNOM VYTLAČENÍ JE POVINNÝ ODKAZ NA PÔVODNÝ ZDROJ (WWW.JAMESYAWN.COM).
3. PREKLAD JE HLAVNE CITLIVÝ, NIE DOSLOVNÝ. ZVLÁŠTNA POZORNOSŤ SA VENOVALA TECHNOLÓGII A BEZPEČNOSTI.
Sopečný termit (spaľovanie zmesi oxidu železa Fe 3 O 4 a hliníka)
(№ 4 2009)
V roku 1898 vynašiel nemecký metalurgický inžinier Hans Goldschmidt metódu tavenia kovov z ich oxidov pomocou hliníka ako redukčného činidla. Na tento účel sa použila zmes práškov hliníka a oxidu kovu, ktorú vedec nazval termit (z gréckeho „therme“ - teplo, teplo).
V prípade termitu z Fe 3 O 4 a hliníka sa vyvinie teplota okolo 2400 °C a samotná táto reakcia začína, keď teplota dosiahne 1000 °C. Spôsob výroby kovov pomocou termitu sa nazýval aluminotermia a zmes oxidu kovu a práškového hliníka sa nazývala Goldschmidtov termit. Aluminotermia je špeciálny prípad metalotermie, ktorý bol objavený v roku 1856. N.N. Beketov.
Dnes je známych veľa rôznych termitových kompozícií. Ako redukčné činidlo môže pôsobiť nielen hliník, ale aj horčík, vápnik, ferosilicium, bór, boridy, kremík, titán, atď. agentov. Termity sa používajú nielen na získavanie kovov, ale aj na zváranie a tiež ako vojenské zápalné zmesi.
Teraz uskutočníme spaľovaciu reakciu termitu Fe 3 O 4 + Al, ktorá navonok pripomína erupciu lávy zo sopečného krátera. Na experiment sa najskôr pripraví úplne suchý riečny piesok sušením pri 200 °C v peci alebo jednoducho v peci. Zároveň vysušte malý keramický hrniec. Široká kovová nádoba (umývadlo, panvica a pod.) je naplnená suchým pieskom, nad ňou je hlinený kvetináč upevnený v prstenci statívu a jeho spodný otvor je prekrytý hárkom filtračného papiera. Sušené prášky oxidu železa Fe304 a hliníka sa zmiešajú v hmotnostnom pomere 3:1. Vezmite najviac 200 g tejto zmesi - termit (asi 50 g Al a približne 150 g Fe 3 O 4) a nalejte do hrnca do 3/4 objemu. Na prípravu termitovej zmesi Namiesto hliníkového prášku by ste nemali používať hliníkový prášok.. Hliníkový prášok obsahuje oxidovaný hliník, ktorý značne narúša začiatok reakcie. Ale hlavným problémom je, že hliníkový prášok obsahuje veľa vzduchu, čo vedie k silnému striekaniu veľmi horúcej zmesi.
V termitovej zmesi naliatej do hrnca urobte v strede priehlbinu a umiestnite do nej poistku - kúsok horčíkovej pásky brúsenej jemnozrnným brúsnym papierom. Pomocou dlhej triesky zapália magnéziový pásik a rýchlo sa vzdiali na vzdialenosť 2-3 m. Po vyhorení zápalnice začne prudká reakcia. Nad hrncom sa objaví plameň a dym, vyletujú z neho horúce častice zmesi a spodným otvorom vyteká prúd roztaveného železa, ktorý vzniká reakciou:
8Al + 3Fe304 = 6Fe + 4Al203
Hliník je reaktívnejší kov ako železo, takže odoberá kyslík z oxidu železa a mení sa na oxid hlinitý. Po ochladení roztaveného železa sa výsledná guľôčka vyberie z piesku a očistí sa od trosky - oxidu hlinitého.
Teraz je zrejmé, prečo musí byť piesok úplne suchý. Z vlhkého piesku sa vyparí voda a začnú striekať kvapky roztaveného železa. V tomto prípade sa zážitok stane mimoriadne nebezpečným.
Ak experiment vykonávate vonku, potom bude železná plechovka, ktorá je zakopaná v piesku, fungovať aj ako jednorazová reakčná nádoba.
Fe304 možno získať pôsobením nadbytku roztoku amoniaku na roztok, ktorý obsahuje rovnaké množstvá solí Fe(II) a Fe(III). Vytvorí sa zrazenina, ktorá sa odfiltruje, premyje vodou, vysuší a kalcinuje pri teplote približne 200 °C.
__________________________________________________
Dusičnan draselný je anorganická binárna zlúčenina reprezentovaná vzorcom KN03, tiež známa ako dusičnan draselný, dusičnan draselný, dusičnan draselný. Zlúčenina KNO 3 je bezfarebný kryštalický prášok, neprchavý, bez zápachu a má hygroskopické vlastnosti. Látka je vysoko rozpustná vo vode. Nie je toxický pre zvieratá. V prírode sa látka KNO 3 nachádza vo forme minerálu nitrokalitu, ktorého najväčšie ložiská sa nachádzajú vo Východnej Indii a Čile. V malých množstvách sa nachádza v rastlinách a živočíšnych organizmoch.
Chemické vlastnosti a spôsoby získavania dusičnanu draselného
Dusičnan draselný KNO 3 sa rozkladá pri teplote 400 °C za vzniku dusitanu draselného KNO 2 a kyslíka O 2 . Táto látka pôsobí ako silné oxidačné činidlo a reaguje s horľavými materiálmi a redukčnými činidlami. Látka KNO 3 je v čase uvoľnenia redukovaná vodíkom.
V laboratórnych podmienkach sa KNO 3 získava reakciou potaše Ca(NO 3) 2 a dusičnanu vápenatého K 2 CO 3, čo je najstarší spôsob výroby tejto látky. V súčasnosti sa namiesto potaše používa síran draselný K 2 SO 4 . Tou istou reakciou sa získa roztok dusičnanu draselného. Z moderných metód výroby dusičnanu draselného KNO 3 je dostupnejšia a lacnejšia reakcia chloridu draselného KCl a dusičnanu sodného NaNO 3.
Oblasti použitia dusičnanu draselného
Dusičnan draselný KNO 3, ako aj roztok dusičnanu draselného sa používa ako hnojivo (jedno z dusíkatých hnojív bohatých na draslík, ktorý je nevyhnutnou zložkou pre rast rastlín). Látka sa používa aj v elektrickom vákuovom priemysle, metalurgii, tavení optického skla a pri výrobe strelného prachu.
Nutričné vlastnosti dusičnanu draselného
Dusičnan draselný je široko používaný v potravinárskom priemysle ako potravinárska prídavná látka E252, klasifikovaná ako konzervačná látka.
Konzervačné látky sú chemické látky, potravinárske prídavné látky E200 - E299, ktoré potláčajú rast mikroorganizmov vo výrobku, zabraňujú vzniku nepríjemného zápachu a chuti výrobku, vzniku plesňových procesov a tvorbe toxínov mikrobiálneho pôvodu. .
Dusičnan draselný sa používa pri výrobe:
- syry (tvrdé, polotvrdé, mäkké);
- analógy syrov na báze mlieka;
- klobásy a mäsové výrobky (solené, varené, údené), mäsové konzervy;
- rybie výrobky (sleď, solené a marinované šproty);
- výrobky z husacej pečene.
 Potravinová prísada je tiež fixátor farieb. Látka sa pridáva do potravinárskych výrobkov na uchovanie atraktívneho vzhľadu výrobku na dlhšiu dobu. Má slabý antibakteriálny účinok.
Potravinová prísada je tiež fixátor farieb. Látka sa pridáva do potravinárskych výrobkov na uchovanie atraktívneho vzhľadu výrobku na dlhšiu dobu. Má slabý antibakteriálny účinok.
Účinky dusičnanu draselného na telo
Dusičnan draselný vytvára karcinogénny účinok - vývoj malígnych nádorov pod vplyvom vonkajších faktorov. V odporúčaných dávkach však E252 nemá žiadne škodlivé účinky na dospelý ľudský organizmus. Negatívny vplyv dusičnanov sa vysvetľuje ich premenou v ľudskom tele na dusitany (v potravinách dochádza k nekontrolovanej premene dusičnanu draselného na dusitany) a karcinogénne nitrozamíny. Množstvo dusičnanov vstupujúcich do organizmu s prídavnými látkami v potravinách, najmä s E252, je zanedbateľné v porovnaní s obsahom týchto látok v pitnej vode, ako aj v zelenine (v dôsledku nadmerného hnojenia).
Dlhodobá expozícia E252 v malých dávkach na tele môže viesť k rozvoju nasledujúcich príznakov a ochorení:
- Silná bolesť brucha
- Slabosť
- Závraty
- Mentálne poruchy
- Porucha priestorovej orientácie
- Arytmia
- Zápal obličiek
- Anémia
právne informácie
Dusičnan draselný ako potravinárska prídavná látka je schválený na použitie pri výrobe potravín v Ruskej federácii a na Ukrajine, ako aj v krajinách Európskej únie.
Späť dopredu
Pozor! Ukážky snímok slúžia len na informačné účely a nemusia predstavovať všetky funkcie prezentácie. Ak vás táto práca zaujala, stiahnite si plnú verziu.
Úspech v učení závisí od túžby dieťaťa učiť sa. Pre zvýšenie motivácie k štúdiu chémie využívam rôzne vyučovacie technológie, ktoré umožňujú študentom zapojiť sa do aktívneho kognitívneho procesu.
Ciele lekcie:
- Upevniť a rozšíriť vedomosti žiakov o chemických reakciách, ich znakoch a podmienkach vzniku;
- Zaviesť rozkladné reakcie a začať rozvíjať schopnosť zostavovať rovnice chemických reakcií;
- Pokračovať v precvičovaní schopnosti študentov nastavovať koeficienty;
- Pokračovať v rozvíjaní schopnosti študentov riešiť problémy pomocou rovníc chemických reakcií;
- Pokračujte v rozvíjaní zručností pozorovania a porovnávania;
- Formovať chemickú kultúru, schopnosť počúvať ostatných pri práci v triede, v skupine.
Vybavenie:
- Na demonštračné pokusy: kliešte na téglik, trieska, liehová lampa, kryštalický KNO 3, drevené uhlie, HNO 3 (konc.), H 2 O 2, MnO 2., laboratórny stojan s nohou;
- Počítač, projektor, prezentácia „Reakcie rozkladu“.
Počas vyučovania
I. Organizačný moment.
II. Motivačný moment.
Najzaujímavejšie na svete okolo nás je, že je veľmi zložitý a navyše sa neustále mení. Každú sekundu v nej prebieha nespočetné množstvo chemických reakcií, v dôsledku ktorých sa niektoré látky menia na iné. Muž sa nadýchol – a v tele sa začali oxidačné reakcie organických látok. Vydýchol - a oxid uhličitý vstúpil do vzduchu, ktorý potom absorbovali rastliny a zmenili sa na sacharidy. Niektoré reakcie môžeme pozorovať priamo, napríklad hrdzavenie železných predmetov, zrážanie krvi a horenie automobilového paliva. Drvivá väčšina chemických procesov však zostáva neviditeľná, no určujú vlastnosti okolitého sveta. Na riadenie premien látok je potrebné dôkladne pochopiť povahu takýchto reakcií. Našou úlohou po štúdiu vlastností látok je naučiť sa využívať získané poznatky v prospech ľudstva.
III. Aktualizácia vedomostí.
- Čo vieme o chemických reakciách? (Snímka 2)
- Aké podmienky sú potrebné na to, aby došlo k chemickej reakcii? (Snímka 3)
- Aké sú príznaky chemickej reakcie? (Snímka 4)
- Uveďte príklady chemických reakcií.
Záver: Existuje veľa chemických reakcií. Neustále unikajú. Čo je potrebné urobiť, aby ste sa pri tejto rozmanitosti chemických reakcií nezmiatli?
Naučte sa klasifikovať chemické reakcie.
Zavedenie pojmu rozkladná reakcia.
1. Pozrite si multimediálnu „Elektrolýzu vody“(digitálna databáza videí o chémii). Dodatok 2
Potom si počas rozhovoru urobte poznámku:
voda → vodík + kyslík
2H20 2H2 + 02
2. Demonštračné pokusy.
a) Rozklad dusičnanu draselného. KNO 3 sa vloží do skúmavky, skúmavka sa upevní v stojane a zohreje - ľadok sa rýchlo roztopí a zmení sa na hustú kvapalinu. Vhoďte horúce uhlie do taveniny; uhlie v skúmavke sa ešte viac rozžhaví a začne skákať, interagujúc s kyslíkom.
2KNO 3 2KNO 2 + O 2 (Snímka 5)
b) Rozklad hydroxidu meďnatého. Skúmavku zahrejte s čerstvo získanou zrazeninou Cu(OH) 2 – tá sčernie vplyvom vzniknutého oxidu meďnatého.
Cu(OH)2CuO + H20 (Snímka 6)
c) Rozklad peroxidu vodíka pomocou katalyzátora (MnO 2, surová mrkva, zemiaky).
H202 2H20 + 02 (Snímka 7)
d) Rozklad oxidu ortutnatého (II). Skúsenosti J. Priestleyho
2HgO 2Hg + O2 (Snímka 8)
Diskutované problémy:
- Čo majú všetky tieto reakcie spoločné? (Snímka 9)
- Aký je ich rozdiel?
- Ako môžeme jedným slovom nazvať procesy, ktoré prebiehajú? (Snímka 9)
- Aké podmienky sú potrebné na to, aby tieto reakcie nastali? (Snímka 9)
1. Prebieha proces rozkladu látok (rozkladná reakcia). Pri všetkých reakciách jedna látka reaguje a vznikajú dve alebo viac nových látok: jednoduché aj zložité. Pokúste sa sformulovať definíciu rozkladnej reakcie.
2. Takmer všetky rozkladné reakcie sú spravidla endotermickými reakciami, pretože Aby reakcia prebehla, sú potrebné určité podmienky: zahrievanie, elektrický prúd a prítomnosť ďalších látok, ktoré reakciu urýchľujú – katalyzátorov. (Snímka 10)
Katalyzátory v autách. (Snímka 11)
- Denne cestujú milióny áut a každé z nich je zdrojom znečistenia ovzdušia. Cítiť to najmä vo veľkých mestách, kde výfukové plyny z áut môžu narobiť veľké problémy.
- Moderné autá majú katalyzátor resp automobilový katalyzátor . Úlohou automobilového katalyzátora je znižovať množstvo škodlivých látok vo výfukových plynoch. Medzi nimi:
- Oxid uhoľnatý (CO) je jedovatý plyn bez farby a zápachu.
- uhľovodíky, tiež známe ako prchavé organické zlúčeniny, sú jednou z hlavných zložiek smog , vznikajú v dôsledku neúplného spaľovania paliva
- súčasťou sú aj oxidy dusíka (NO a NO2). smog , a kyslý dážď , vplyv sliznica osoba.
Katalyzátory sú v prírode všadeprítomné. Stačí povedať, že všetky premeny látok v živých organizmoch prebiehajú za účasti prírodných katalyzátorov - enzýmy a preto nevyžadujú vysoké teploty. To je veľmi dôležité – inak by sa mohli variť živé tkanivá, ktoré vykonávajú chemické reakcie.Bez špeciálnych „biologických“ katalyzátorov – enzýmov – sa nedosiahne ani lahodný chlieb, ani chutný syr, ani kyslá kapusta. Rozrezané jablko na vzduchu stmavne, pretože enzým polyfenoloxidáza urýchľuje oxidáciu polyfenolov, organických látok, ktoré sa nachádzajú v bunkách ovocia. Keď sa rana naleje peroxidom vodíka, peroxid vodíka sa „varí“ - rýchlo sa rozkladá na vodu a kyslík pod vplyvom enzýmu katalázy nachádzajúceho sa v krvi. Telo potrebuje katalázu na zničenie peroxidu vodíka, ktorý vzniká pri bunkovom dýchaní.
Tráviace šťavy obsahujú desiatky enzýmov: lipázy, ktoré rozkladajú tuky na glycerol a organické kyseliny; proteázy, ktoré degradujú proteíny atď.
Katalyzátory sa používajú aj v chemickom priemysle pri syntéze rôznych látok, vrátane takých dôležitých chemických produktov, ako je amoniak NH 3 a kyselina sírová H 2 SO 4 .
Katalyzátory patria medzi najpotrebnejšie látky, aj keď niekedy o tom veľa nepremýšľame.
Chemické reakcie, v dôsledku ktorých sa teplo absorbuje, sa nazývajú endotermický.(Snímka 12)
Látky, ktoré menia rýchlosť chemickej reakcie, ale v dôsledku reakcie sa nespotrebujú, sa nazývajú katalyzátory.(Snímka 12)
IV. Konsolidácia.
Dokončite úlohy.
(Snímka 13)
- Usporiadajte koeficienty prevedením diagramov na reakčné rovnice. Určite rozkladnú reakciu vašej opcie. Uveďte vysvetlenie.
| možnosť 1 CuO + H2 -> Cu + H20 CO + O 2 → CO 2 AI + CI 2 → AICI 3 CaC03 → CaO + CO2 |
Možnosť 2 HCI + AI → AICI 3 + H 2 Na20 + H20 -> NaOH KCIO 3 → KCI + O 2 Na + H2 -> NaH |
- Úloha. Určte látkové množstvo a hmotnosť jedného z reakčných produktov, ak sa v dôsledku reakcie rozložia 2 móly látky.
V. Domáca úloha§ 27, býv. 1, 2 str. 155 (Snímka 14).
VI. Použité knihy:
- Gabrielyan O.S."Chémia". 8. ročník. Učebnica.
- O.S. Gabrielyan, N.P. Voskoboyniková, A. V. Yashuková"Chémia", 8. ročník. Príručka pre učiteľa. M.: Drop, 2002.
- O.S. Gabrielyan, T.V. Smirnova. Učíme sa chémiu v 8. ročníku.
- L.Yu. Alikberová„Zábavná chémia: Kniha pre študentov, učiteľov a rodičov“, M.: AST - PRESS, 1999.
- Encyklopédia pre deti. Zväzok 17. Chémia. M.: Avanta +, 2000.
- Internetové materiály.