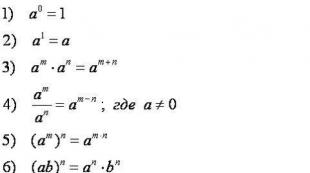ქიმიის მზადება გამოყენების პარამეტრების გამოყენებისათვის. სტრუქტურა Kim Eger
Ege- ის შედეგი ქიმიის საშუალებით, არ არის დაბალი, ვიდრე მინიმალური კომპლექტი რაოდენობა, იძლევა სპეციალობით უნივერსიტეტებში შესვლის უფლებას, სადაც შესასვლელი ტესტების სიაში ქიმიის საგანი არსებობს.
უნივერსიტეტებს არ აქვთ უფლება, დააყენოთ მინიმალური ქიმიის ბარიერი 36 ქულით. პრესტიჟული უნივერსიტეტები, როგორც წესი, მათი მინიმალური ბარიერი ბევრად უფრო მაღალია. იმის გამო, რომ სწავლა, პირველი წლის მოსწავლეების ძალიან კარგი ცოდნა უნდა იყოს.
FII- ის ოფიციალურ ვებ-გვერდზე ყოველწლიურად გამოქვეყნებულია ქიმიის EEM- ის პარამეტრები: დემონსტრაცია, ადრეული პერიოდი. ეს ვარიანტია, რომ მომავალი გამოცდის სტრუქტურის იდეა და ამოცანების სირთულის დონე და საიმედო ინფორმაციის წყაროები გამოყენებისას.
ქიმიის შუბლის პარამეტრები 2017
| წელი | ჩამოტვირთეთ დაწყებული ვარიანტი |
| 2017 | ვარიანტის PO HIMII. |
| 2016 | ძლეებ |
გამოცდის დემო ვერსია 2017 წლიდან FIPI- დან
| პარამეტრები + პასუხები | ჩამოტვირთეთ დემო ვარიანტი |
| სპეციფიკაცია | demo ვარიანტი Himiya Ege |
| Codifier | კოდფიკატორი. |
-ში სავალდებოება 2017 წლის ქიმიაში 2016 წლის კიმთან შედარებით ცვლილებებია, ამიტომ სასურველია მოამზადოს მიმდინარე ვერსიის მიხედვით და კურსდამთავრებულთა მრავალფეროვნების მრავალფეროვნების მრავალფეროვნების გამოყენებისათვის.
დამატებითი მასალები და აღჭურვილობა
ქიმიის გამოცდის თითოეული ვერსიის თითოეულ მასალასთან დაკავშირებული მასალები:
- პერიოდული სისტემა ქიმიური ელემენტები Di. მენდელეევი;
- მარილების, მჟავებისა და ბაზების ხსნარის ცხრილი;
- ლითონის ძაბვის ელექტროქიმიური რიგი.
შემოწმების სამუშაოების შესრულებისას, მას უფლება აქვს გამოიყენოს არაპროგრამული კალკულატორი. დამატებითი მოწყობილობების და მასალების სია, რომლის გამოყენებაც სარგებლობს, დამტკიცებულია რუსეთის განათლებისა და მეცნიერების სამინისტროს ბრძანებით.
მათთვის, ვისაც სურს გააგრძელოს განათლება უმაღლეს სკოლაში, არჩევანის არჩევანი უნდა იყოს დამოკიდებული შესასვლელი გამოცდების სიაში შერჩეული სპეციალობით
(პრეპარატის მიმართულება).
უნივერსიტეტებში შესასვლელი ტესტების ჩამონათვალი ყველა სპეციალობით (მომზადების მიმართულებები) განისაზღვრება რუსეთის განათლებისა და მეცნიერების სამინისტროს ბრძანებით. თითოეული უნივერსიტეტი ირჩევს ამ ჩამონათვალს ან სხვა ნივთებს, რომლებიც მიუთითებენ მათ მიღებაზე. თქვენ უნდა გაეცნოთ ამ ინფორმაციას შერჩეული უნივერსიტეტების საიტებზე, შერჩეული ნივთების სიაში მონაწილეობის მისაღებად.
11/14/2016 გამოქვეყნებულია FII- ის ვებ-გვერდზე გამოქვეყნებული განცხადებები დემონსტრაციის პარამეტრებიერთიანობის კონტროლის საზომი მასალების კოდისტები და სპეციფიკაციები სახელმწიფო გამოცდა და 2017 წლის მთავარი გამოცდა, მათ შორის ქიმიაში.
Deverovyy Ege ქიმიაში 2017 პასუხებით
| პარამეტრები + პასუხები | ჩამოტვირთვა Demo ვერსია |
| სპეციფიკაცია | demo ვარიანტი Himiya Ege |
| Codifier | კოდფიკატორი. |
ქიმიის დემო შემოწმება 2016-2015
| Ქიმია | ჩამოტვირთვა Demo + პასუხები |
| 2016 | ege 2016. |
| 2015 | ege 2015. |
კიმში ქიმიაში 2017 წელს, მნიშვნელოვანი ცვლილებები, ამიტომ, გასული წლების დემოლიზმი გადაეცემა საკუთარ თავს.
ქიმია - მნიშვნელოვანი ცვლილებები: გამოცდების სტრუქტურა ოპტიმიზირებულია:
1. კიმ-ის ნაწილი 1-ის სტრუქტურა ფუნდამენტურად შეიცვალა: ამოცანები გამორიცხულია ერთი რეაქციის არჩევანით; ამოცანები დაჯგუფებულია ცალკეული თემატური ბლოკებით, რომელთაგან თითოეული აქვს სირთულის ორივე ძირითადი და ამაღლებული დონის ამოცანებს.
2. შემცირდა 40 (2016 წელს) 34-მდე ამოცანების საერთო რაოდენობა.
3. შეიცვალა შეფასების მასშტაბი (1-დან 2 ქულა), რომელიც ასრულებს სირთულის ძირითად დონის ამოცანებს, რომლებიც შეამოწმებენ ცოდნის სწავლებას არაორგანული და ორგანული ნივთიერებების გენეტიკური კავშირის შესახებ (9 და 17).
4. მთლიანი მუშაობის მაქსიმალური ძირითადი ქულა იქნება 60 ქულა (2016 წელს 64 ქულის ნაცვლად).
გამოცდის ხანგრძლივობა ქიმიაში
საგამოცდო სამუშაოს საერთო ხანგრძლივობაა 3.5 საათი (210 წუთი).
ინდივიდუალური ამოცანების აღსრულების სავარაუდო დროა:
1) ნაწილი 1-დან 2-3 წუთის სირთულის ძირითადი დონის თითოეული ამოცანა;
2) ნაწილი 1 - 5-7 წუთის განმავლობაში;
3) თითოეული ამოცანა მაღალი დონე ნაწილი 2-ის სირთულეა 10-15 წუთი.
ამოცანების შესრულება 1-3, გამოიყენეთ ქიმიური ელემენტების შემდეგი სერია. პასუხი ამოცანებში 1-3 არის რიცხვების თანმიმდევრობა, რომლის მიხედვითაც ქიმიური ელემენტები მითითებულია ამ სერიაში.
1) na 2) k 3) si 4) mg 5) გ
სამუშაო ნომერი 1
განსაზღვრავს ელემენტების რიგებში მითითებულ ატომებს გარე ენერგეტიკულ დონეზე ოთხი ელექტრონია.
პასუხი: 3; ხუთი
ძირითადი ქვეჯგუფების ელემენტების გარე ენერგეტიკული დონის (ელექტრონულ ფენის) ელექტრონების რაოდენობა ნომრის ნომერზეა.
ამდენად, სილიკონი და ნახშირბადის შესაფერისია წარმოდგენილი პასუხებისგან, რადგან ისინი მაგიდის მეოთხე ჯგუფის ძირითად ქვეჯგუფში არიან მენდელეევი (IVA ჯგუფი), ანუ. სწორი პასუხები 3 და 5.
სამუშაო ნომერი 2.
რიგი ქიმიური ელემენტების მითითებით, აირჩიეთ სამი ელემენტი პერიოდული სისტემა ქიმიური ელემენტები D.I. მენდელეევი ერთ პერიოდში არიან. მოათავსეთ შერჩეული ნივთები მათი ლითონის თვისებების გაზრდის მიზნით.
ჩაწერეთ სასურველი თანმიმდევრობით შერჩეული ნივთების რეაგირების სფეროში.
პასუხი: 3; ოთხი; ერთი
ერთ პერიოდში წარმოდგენილი ელემენტებისგან არის სამი - ეს არის ნატრიუმის NA, სილიციუმის SI და მაგნიუმის მგ.
პერიოდული ცხრილის ერთ პერიოდში დ. MENDELEEV (ჰორიზონტალური ხაზები) მარცხნივ მარჯვნივ ხელს უწყობს გარე ფენაზე მდებარე ელექტრონების დაბრუნებას, I.E. ელემენტების ლითონის თვისებები გაუმჯობესებულია. ამდენად, ნატრიუმის, სილიკონისა და მაგნიუმის ლითონის თვისებები გაძლიერდება SI Row- ში სამუშაო ნომერი 3. რიგი ელემენტების მითითებით, აირჩიეთ ორი ელემენტი, რომელიც აჩვენებს ქვედა ხარისხის ჟანგვის ტოლი -4. ჩანაწერი შერჩეული ნივთების საპასუხო სფეროში. პასუხი: 3; ხუთი ოქტის წესით, ქიმიური ელემენტების ატომები, როგორც ჩანს, მათი გარე ელექტრონულ დონეზე 8 ელექტრონებს, ისევე როგორც კეთილშობილური აირების მსგავსად. ეს შეიძლება მიღწეული იყოს ამ უკანასკნელის ელექტრონების დაბრუნებით, მაშინ წინა, რომელიც შეიცავს 8 ელექტრონს, ან, პირიქით, დამატებით ელექტრონების დამატებით რვა რვა ხდება. ნატრიუმი და კალიუმი ეკუთვნის ტუტე ლითონებს და მდებარეობს პირველი ჯგუფის (IA) ძირითად ქვეჯგუფში. ეს იმას ნიშნავს, რომ მათი ატომების გარე ელექტრონულ ფენაზე არის ერთი ელექტრონი. ამ თვალსაზრისით, ერთი ელექტრონის დაკარგვა ენერგიულად უფრო მომგებიანია, ვიდრე კიდევ ერთი შვიდი მიერთება. მაგნიუმთან ერთად, სიტუაცია მსგავსია, მხოლოდ მეორე ჯგუფის მთავარ ქვეჯგუფშია, რომელიც, გარე ელექტრონულ დონეზე მას აქვს ორი ელექტრონი. აღსანიშნავია, რომ ნატრიუმის, კალიუმის და მაგნიუმის უკავშირდება ლითონებს და ლითონებს, პრინციპში, ჟანგვის უარყოფითი ხარისხი შეუძლებელია. ნებისმიერი ლითონის ჟანგვის მინიმალური ხარისხი ნულოვანია და მარტივი ნივთიერებებით არის დაცული. ქიმიური ელემენტები ნახშირბადის C და სილიკონის SI არ არის ლითონები და მდებარეობს მეოთხე ჯგუფის ძირითად ქვეჯგუფში (IVA). ეს იმას ნიშნავს, რომ არსებობს 4 ელექტრონიკა მათი გარე ელექტრონული ფენა. ამ მიზეზით, ეს ელემენტები შესაძლებელია, როგორც ამ ელექტრონების დაბრუნების და კიდევ ოთხი დამატებით 8 მ. არ შეიძლება იყოს სილიკონისა და ნახშირბადის ატომების 4 ელექტრონულ ელექტრონებს, ამიტომ მათთვის მინიმალური ჟანგვის ხარისხი -4. სამუშაო ნომერი 4. შემოთავაზებული სიიდან, აირჩიეთ ორი ნაერთების, რომელშიც იონური ქიმიური ობლიგაცია იმყოფება. პასუხი: 1; 3. შესაძლებელია განისაზღვროს იონური ტიპის კომუნიკაციის თანდასწრებით საქმეების უმრავლესობაში, ამავე დროს მისი სტრუქტურული ერთეულების შემადგენლობისთვის შესაძლებელია ტიპიური ლითონის ატომები და არალეტალური ატომები. ამ საფუძველზე, ჩვენ ვამტკიცებთ, რომ Ionic კომუნიკაცია ხელმისაწვდომია ნომერზე 1-CA (CLO 2) 2, რადგან მისი ფორმულაში შეგიძლიათ იხილოთ ტიპიური კალციუმის ლითონის და არალეგულოვის ატომების ატომები - ჟანგბადი და ქლორი. თუმცა, მეტი ნაერთების შემცველი ამავე დროს ატომები ლითონის და nonmetalla, მითითებულ სიაში. ზემოაღნიშნული ფუნქციის გარდა, იონის ობლიგაციების არსებობა შეიძლება ითქვას, თუ მისი სტრუქტურული ერთეულის შემადგენლობა შეიცავს ამონიუმის ცემას (NH 4 +) ან მის ორგანულ ანალოგებს - ალკილამონიუმის ციმციებს RNH 3 +, Dialkylamonia r 2 NH 2 + , Trialkilammonium R 3 NH + და Tetraalklammonium R 4 N +, სადაც არის რამდენიმე ნახშირწყალბადული რადიკალური. მაგალითად, საკომუნიკაციო ტიპის კომუნიკაცია ხდება CIFED (CH 3) 4 NCL- ს შორის (CH 3) 4 + და CL ქლორიდი-იონი. ამოცანში მითითებულ ნაერთებს შორის არის ამონიუმის ქლორიდი, მასში იონური კავშირი ხორციელდება NH 4 + და CL ქლორიდი-იონის ამონიუმის ცემას შორის. სამუშაო ნომერი 5. ნივთიერების ფორმულისა და კლასის / ჯგუფის ფორმას შორის კორესპონდენცია, რომელსაც ეს ნივთიერება ეკუთვნის: წერილში მითითებულ თითოეულ პოზიციას, აირჩიეთ ნომრის მითითებით მეორე სვეტის შესაბამისი პოზიცია. რეაგირების სფეროში შერჩეული კავშირების რაოდენობა. პასუხი: A-4; B-1; 3 წელს განმარტება: შებერნახში მარილებს უწოდებენ მარილებს, რომლებიც იწვევენ ლითონის Cation, ამონიუმის Cation ან Alkyllammonium- ის წყალბადის ატომების არასრული ჩანაცვლებისგან. არაორგანულ მჟავებში, რომლებიც სკოლის პროგრამის ფარგლებში გაივლიან, ყველა წყალბადის ატომი მოძრაობს, ანუ მათ შეუძლიათ ლითონის შეცვლა. წარმოდგენილ სიაში მჟავე არაორგანული მარილების მაგალითებია ამონიუმის ბიკარბონატი NH 4 HCO 3 - ნახშირის მჟავების ერთ-ერთი ორი წყალბადის ატომის ჩანაცვლების პროდუქტი. არსებითად, მჟავა მარილი გარკვეულწილად ნიშნავს ნორმალურ (საშუალო) მარილისა და მჟავას შორის. NH 4 HCO 3- ის შემთხვევაში, საშუალოდ ნორმალურ მარილით (NH 4) შორის 2 CO 3 და CARBONIC ACID H 2 CO 3. ორგანულ ნივთიერებებში, მხოლოდ ჰიდროგენური ატომები შედის კარბოქსილის ჯგუფებში (-OSOH) ან Phenol- ის ჰიდროქსილის ჯგუფებში (AR-OH), რომელსაც შეუძლია შეცვალოს ორგანული ნივთიერებები. ეს არის, მაგალითად, ნატრიუმის აცეტატი CH 3 Coona, მიუხედავად იმისა, რომ მისი მოლეკულაში, ყველა წყალბადის ატომები არ არის შერწყმული ლითონის cations, არის საშუალო, არ მჟავე მარილი (!). წყალბადის ატომები უშუალოდ ნახშირბადის ატომსთან დაკავშირებულ ორგანულ ნივთიერებებში თითქმის ვერასდროს ვერ შეძლებენ ლითონის ატომების შემცვლელს, გარდა წყალბადის ატომების გარდა, კომუნიკაციის სამმაგი სთ. ჭრის ოქსიდები - არასამთავრობო ლითონის ოქსიდები, რომლებიც არ ქმნიან მარილის ძირითად ოქსიდებს ან ბაზებს, ანუ, არც მათთან არ არის რეაგირება (ყველაზე ხშირად) ან მათთან ერთად სხვადასხვა პროდუქტი (არა მარილი). ხშირად ამბობენ, რომ არასამთავრობო ფორმირების ოქსიდები არიან არაალოლური ოქსიდები, რომლებიც არ რეაგირებენ ბაზებთან და მთავარ ოქსიდებთან. მიუხედავად ამისა, ეს ყოველთვის არ მუშაობს არა-ფორმირების ოქსიდების იდენტიფიცირებისთვის. მაგალითად, CO, როგორც არასამთავრობო ფორმირების ოქსიდი, რეაგირებს რკინის ძირითადი ოქსიდის (II), მაგრამ ფორმირება არასამთავრობო მარილი და თავისუფალი ლითონის: CO + FEO \u003d CO 2 + FE არაკომუნიკაციური ოქსიდები სკოლის მაჩვენებელს მოიცავს არალეგალური ოქსიდების ხარისხზე +1 და +2 ხარისხში. საერთო ჯამში, ისინი გვხვდება გამოცდაზე 4 - ეს არის CO, NO, N 2 O და SIO (უკანასკნელი SIO პირადად მე არასდროს არ შეხვდა ამოცანებს). სამუშაო ნომერი 6. ნივთიერებების შემოთავაზებული ჩამონათვალიდან აირჩიეთ ორი ნივთიერება, რომელთაგან თითოეული რკინის რეაგირებს გათბობის გარეშე. პასუხი: 2; ოთხი თუთიის ქლორიდი მარილებს ეკუთვნის და რკინას ლითონებს ეკუთვნის. ლითონის რეაგირებს მარილი მხოლოდ იმ შემთხვევაში, თუ ეს უფრო აქტიურია მარილის შემადგენლობასთან შედარებით. ლითონების შედარებით აქტივობა განისაზღვრება რიგი ლითონის აქტივობისთვის (განსხვავებულად, ლითონების ძაბვის რიგით). რკინის ლითონის აქტივობა არის თუთიის უფლება, ეს იმას ნიშნავს, რომ ნაკლებად აქტიურად და არ შეიძლება მარილისგან თუთიისგან. ანუ რკინის რეაქცია ნივთიერების ნომრით 1 არ მიდის. Covo 4 სულფატი (II) Cuso 4 რეაგირებას რკინის, რადგან რკინის არის მარცხენა სპილენძის რიგის საქმიანობა, ანუ, უფრო აქტიური ლითონის. კონცენტრირებული აზოტის, ასევე კონცენტრირებული გოგირდის მჟავებს არ შეუძლია რკინის, ალუმინის და ქრომის რეაგირება ასეთი ფენომენის თვალსაზრისით: ამ მჟავების მოქმედების ქვეშ მყოფი ამ ლითონების ზედაპირზე ჩამოყალიბებული მარილის გარეშე, რომელიც მოქმედებს როგორც დამცავი ჭურვი. თუმცა, როდესაც მწვავე, ეს დამცავი ჭურვი გაჟღენთილია და რეაქცია ხდება შესაძლებელი. ისინი. მას შემდეგ, რაც აღინიშნება, რომ გათბობა არ არის, რკინის რეაქცია კონცერტით. HNO 3 არ გაგრძელდება. სალონის მჟავა დამოუკიდებლობისგან კონცენტრაციისგან ეხება არა-ოქსიდანტური მჟავებისგან. წყალბადის გათავისუფლების არა-ოქსიდანტური მჟავებით, ლითონები რეაგირებენ წყალბადის მარცხნივ აქტივობაში. ეს ლითონები მართალია. დასკვნა: რკინის რეაქცია ჰიდროქლორინის მჟავასთან ერთად. ლითონის და ლითონის ოქსიდის შემთხვევაში, რეაქცია, როგორც მარილის შემთხვევაში, შესაძლებელია, თუ უფასო ლითონის უფრო აქტიურია ოქსიდის შემადგენლობაში. ფე, რიგი ლითონის აქტივობის მიხედვით, ვიდრე ალ. ეს იმას ნიშნავს, რომ FE 2 O 3 არ რეაგირებს. სამუშაო ნომერი 7. შემოთავაზებული სიიდან, აირჩიეთ ორი ოქსიდი, რომელიც რეაგირებს ჰიდროქლორინის მჟავასთან, მაგრამ არ რეაგირება
ნატრიუმის ჰიდროქსიდის გადაწყვეტასთან ერთად. ჩაწერეთ შერჩეული ნივთიერებების საპასუხო სფეროში. პასუხი: 3; ოთხი Co - არახელსაყრელი ოქსიდი, ალკალის წყალხსნარით არ რეაგირებს. (უნდა აღინიშნოს, რომ, მიუხედავად იმისა, რომ მკაცრი პირობები - მაღალი წნევა და ტემპერატურა - ეს ყველაფერი იგივე რეაგირებს მყარი ტუტე, ფორმირების ფორმირებით - ფორმალური მჟავის მარილები). ასე რომ 3 - გოგირდის ოქსიდის (VI) არის მჟავე ოქსიდის, რომელსაც გოგირდის მჟავა შეესაბამება. მჟავებისა და სხვა მჟავე ოქსიდების მჟავა ოქსიდები არ რეაგირებენ. ანუ, ასე რომ 3 არ რეაგირებს ჰიდროქლორინის მჟავასთან და რეაგირებს ბაზაზე - ნატრიუმის ჰიდროქსიდი. Არაშესაფერისი. Cuo - სპილენძის ოქსიდი (II) - უკავშირდება ოქსიდების ძირითადად ძირითად თვისებებთან. რეაგირებს HCl- თან და არ რეაგირებს ნატრიუმის ჰიდროქსიდის გადაწყვეტასთან. სათანადო MgO - მაგნიუმის ოქსიდი - იხილეთ ტიპიური ძირითადი ოქსიდები. რეაგირებს HCl- თან და არ რეაგირებს ნატრიუმის ჰიდროქსიდის გადაწყვეტასთან. სათანადო Zno - ოქსიდი გამოხატული amphoteric თვისებები - ადვილად რეაგირებს როგორც ძლიერი ბაზები და მჟავები (ასევე მჟავე და მთავარი oxides). Არაშესაფერისი. სამუშაო ნომერი 8. პასუხი: 4; 2. არაორგანული მჟავების ორ მარილს შორის რეაქციით, გაზის ჩამოყალიბება მხოლოდ ნიტრიტისა და ამონიუმის მარილების ცხელი გადაწყვეტილებების შერწყმისას თერმულად არასტაბილური ამონიუმის ნიტრიტის ფორმირების გამო. Მაგალითად, Nh 4 cl + kno 2 \u003d t o \u003d\u003e n 2 + 2h 2 o + kcl თუმცა, არ არსებობს ნიტრიტი სიაში და ამონიუმის მარილები. ასე რომ, სამი მარილები (CU (NO 3) 2, K 2 ასე 3 და NA 2 SIO 3) რეაგირებს მჟავა (HCL) ან ალკალით (NAOH). არაორგანული მჟავების მარილების შორის, მხოლოდ ამონიუმის მარილები გამოირჩევიან ალკალისთან ურთიერთქმედებისას: NH 4 + + OH \u003d NH 3 + H 2 O ამონიუმის მარილები, როგორც უკვე ვთქვით, არ არის სიაში. მხოლოდ მარილის ურთიერთქმედების ერთადერთი ვარიანტი რჩება. ამ ნივთიერებებში მარილები მოიცავს CU (No 3) 2, K 2 ასე 3 და NA 2 SIO 3. სპილენძის ნიტრატის რეაქცია ჰიდროქლორინის მჟავასთან არ იწყება, რადგან არც გაზი ან ნალექი, არც დაბალი სუბსიდირება აგენტი (წყალი ან სუსტი მჟავა) არ არის ჩამოყალიბებული. სოლიკატ ნატრიუმის რეაგირებს ჰიდროქლორინის მჟავასთან ერთად, თუმცა თეთრი მწვავე სილიციური მჟავის ნალექების გათავისუფლების გამო, და არა გაზი: Na 2 sio 3 + 2hcl \u003d 2nacl + h 2 sio 3 ↓ ბოლო ვარიანტი რჩება - კალიუმის სულფიტი და ჰიდროქლორინის მჟავის ურთიერთქმედება. სინამდვილეში, იონის გაცვლის რეაქციის შედეგად, სულფეტი და თითქმის ნებისმიერი მჟავა, არასტაბილური გოგირდის მჟავა ჩამოყალიბდა, რაც მყისიერად დაიშლება უფერო გაზის ოქსიდის (IV) და წყალში. სამუშაო ნომერი 9. ჩანაწერი ცხრილის ნომერზე შერჩეული ნივთიერებების შესაბამისი ასოებით. პასუხი: 2; ხუთი CO 2 ეხება მჟავა ოქსიდს და მარილის ჩართვას, აუცილებელია ძირითადი ოქსიდის ან ბაზის გავლენას. ისინი. CO 2 კალიუმის კარბონატის მიღება, აუცილებელია კალიუმის ოქსიდის ან კალიუმის ჰიდროქსიდის გავლენა. ამდენად, ნივთიერება x არის კალიუმის ოქსიდი: K 2 O + CO 2 \u003d K 2 CO 3 კალიუმის ბიკარბონატი ხმო 3, ისევე როგორც კალიუმის კარბონატი, არის ქოქოსის მჟავის მარილი, ერთადერთი განსხვავება, რომ ნახშირწყალბადები არის ქვანახშირის მჟავების წყალბადის ატომების არასრული ჩანაცვლება. ნორმალური (საშუალო) მარილის მისაღებად მჟავე მარილით, თქვენ უნდა იმოქმედოთ იმავე მჟავასთან, რომელიც იქმნება ამ მარილით, ან იმოქმედოს მჟავე ოქსიდით, რომელიც შეესაბამება მოცემულ მჟავას, თანდასწრებით წყალი. ამდენად, Y რეაქცია არის ნახშირორჟანგი. როდესაც იგი გადის წყალსადენის კარბონატული ხსნარის მეშვეობით, ეს უკანასკნელი კალიუმის ბიკარბონატისკენ მიდის: K 2 Co 3 + H 2 O + CO 2 \u003d 2KHCO 3 სამუშაო ნომერი 10. დააინსტალირეთ რეაქციის განტოლება და აზოტის ელემენტის ქონების კორესპონდენცია, რომელიც ამ რეაქციაში არსებობს: წერილში მითითებულ თითოეულ პოზიციაზე, აირჩიეთ ნომერზე მითითებული შესაბამისი პოზიცია. ჩანაწერი ცხრილის ნომერზე შერჩეული ნივთიერებების შესაბამისი ასოებით. პასუხი: A-4; B-2; 2-ზე; Ბატონი. ა) NH 4 HCO 3 მარილი, რომელიც მოიცავს ამონიუმის ცემას NH 4 +. ამონიუმის Cation- ში, აზოტის ყოველთვის აქვს ოქსიდაციის ხარისხი -3-ის ტოლი. რეაქციის შედეგად, ამიაკში NH 3-ში ჩნდება. წყალბადის თითქმის ყოველთვის (გარდა მისი ნაერთების ლითონებით) აქვს +1- ის ტოლია ჟანგვის ხარისხი. აქედან გამომდინარე, ისე, რომ ამიაკის მოლეკულა არის ელექტრონული ელექტრონული, აზოტის უნდა ჰქონდეს ჟანგვის ხარისხი -3. ამდენად, აზოტის ჟანგვის ხარისხში ცვლილებები არ მოხდება, ანუ. ეს არ აჩვენებს Redox- ის თვისებებს. ბ) როგორც ზემოთ უკვე ნაჩვენები, აზოტის NH 3- ში აზოტის NH 3- ს აქვს ოქსიდიზაციის ხარისხი -3. Cuo- სთან რეაქციის შედეგად ამიაკი უბრალო ნივთიერებაშია. ნებისმიერი მარტივი ნივთიერება, ელემენტის ჟანგვის ხარისხი, რომელიც ჩამოყალიბებულია ნულოვანი. ამრიგად, აზოტის ატომი კარგავს უარყოფით ბრალდებას და მას შემდეგ, რაც ელექტრონები შეესაბამება უარყოფით ბრალდებას, რაც ნიშნავს რეაქციის შედეგად აზოტის ატომს. რეაქციის შედეგად მისი ელექტრონების ნაწილს დაკარგავს ელემენტს, რომელსაც აგენტი შეამცირებს. გ) NH 3 რეაქციის შედეგად აზოტის ჟანგვის ხარისხით, -3-ის ტოლია, აზოტის ოქსიდის არა. ჟანგბადს თითქმის ყოველთვის აქვს ოქსიდაციის ხარისხი -2 -2. აქედან გამომდინარე, აზოტის ოქსიდის მოლეკულა ელექტრონულად, აზოტის ატომს უნდა ჰქონდეს ოქსიდაციის ხარისხი. ეს იმას ნიშნავს, რომ რეაქციის შედეგად აზოტის ატომი შეიცვალა -3-დან +2-მდე. ეს მიუთითებს 5 ელექტრონების აზოტის ატომის დაკარგვას. ეს არის აზოტის, როგორც ეს მოხდება B, არის შემცირების აგენტი. დ) N 2 არის მარტივი ნივთიერება. ყველა უბრალო ნივთიერებაში, ელემენტს, რომელიც ქმნის მათ, აქვს ოქსიდაციის ხარისხი, 0. აზოტის რეაქციის შედეგად, LI3N ლითიუმის ნიტრიდი მოაქცია. ერთადერთი ხარისხი ტუტე ლითონის ჟანგვის, გარდა ნულოვანი (0-ის ოქსიდაციის ხარისხი ნებისმიერი ელემენტიდან), +1. ისე, რომ სტრუქტურული ერთეულის LI3N იყო ელექტრონული, აზოტის უნდა ჰქონდეს ჟანგვის ხარისხი ტოლი -3. გამოდის, რომ რეაქციის შედეგად აზოტის შედეგად უარყოფითი ბრალდება შეიძინა, რაც ნიშნავს ელექტრონების დამატებას. აზოტის ამ oxidizer რეაქციაში. სამუშაო ნომერი 11. ნივთიერებისა და რეაგენტების ფორმულას შორის კორესპონდენცია დააინსტალირეთ, რომელთაგან თითოეული ამ ნივთიერებას შეუძლია ურთიერთქმედება: წერილში მითითებულ თითოეულ პოზიციაზე აირჩიეთ ნომერზე მითითებული შესაბამისი პოზიცია. დ) Znbr 2 (R-P) 1) AGNO 3, NA 3 PO 4, CL 2 2) Bao, H 2 o, koh 3) H 2, CL 2, O 2 4) HBR, LIOH, CH 3 COOH 5) H 3 PO 4, BACL 2, Cuo ჩანაწერი ცხრილის ნომერზე შერჩეული ნივთიერებების შესაბამისი ასოებით. პასუხი: A-3; B-2; 4-ზე; Ბატონი. ა) როდესაც გაზიანი წყალბადის გავლით გოგირდის დნობის მეშვეობით, წყალბადის სულფიდის H 2 S იქმნება: H 2 + s \u003d t o \u003d\u003e H 2 s როდესაც ქლორი გადადის ზემოთ ადგილზე, გოგირდის დელლორიდი ოთახის ტემპერატურაზე იქმნება: S + CL 2 \u003d SCL 2 -თვის surchase Ege ზუსტად ვიცი, როგორ გოგირდის ქლორის რეაქცია და, შესაბამისად, შეძლებს ამ განტოლების ჩაწერა არ არის აუცილებელი. მთავარია, მთავარ დონეზე უნდა გვახსოვდეს, რომ გოგირდის ქლორის რეაგირებს. ქლორის არის ძლიერი oxidizer, გოგირდის ხშირად გვიჩვენებს ორმაგი ფუნქცია - ორივე ოქსიდაციური და აღდგენითი. ანუ, თუ ძლიერი ჟანგვის აგენტი გოგირდოვანია, რომელიც მოლეკულური ქლორინის CL 2 არის, ეს იქნება oxidize. გოგირდის დამწვრობა ჟანგბადში ლურჯი ფლეიმის მქონე გაზი, რომელიც გაზის შექმნას მკვეთრი სუნი - გოგირდის დიოქსიდი 2: ბ) 3 - გოგირდის ოქსიდის (VI) გამოაცხადა მჟავე თვისებები. ასეთი ოქსიდებისათვის, წყლის ურთიერთქმედების რეაქციები, ისევე როგორც ძირითადი და ამფოთერული ოქსიდები და ჰიდროქსიდები ყველაზე დამახასიათებელია. სიის ნომერი 2, ჩვენ მხოლოდ ხილული და წყალი, მთავარი Bao ოქსიდი, და Koh ჰიდროქსიდი. მჟავა ოქსიდის ურთიერთქმედებისას მთავარ ოქსიდთან ერთად ჩამოყალიბებულია შესაბამისი მჟავა და ლითონის მარილი, რომელიც მთავარი ოქსიდის ნაწილია. რა მჟავა ოქსიდს შეესაბამება მჟავას, რომელშიც მჟავა-ფორმირების ელემენტს აქვს ოქსიდის ჟანგვის იგივე ხარისხი. ასე რომ 3 ოქსიდი შეესაბამება გოგირდის მჟავა H 2 ასე რომ 4 (და იქ, და არსებობს გოგირდის ოქსიდაციის ხარისხი +6). ამრიგად, მე -3 ნაწილის ურთიერთქმედება ლითონების ოქსიდებისგან მიიღება გოგირდის მჟავების მარილები - სულფატს, რომელიც შეიცავს სულფატის იონის შემცველობას, ასე რომ 4 2- ასე რომ 3 + bao \u003d baso 4 წყლით ინტერაქციისას მჟავე ოქსიდის მჟავა ხდება: ასე რომ 3 + h 2 o \u003d h 2 ასე რომ 4 და მჟავე ოქსიდების ურთიერთქმედება მეტალის ჰიდროქსიდთან, მარილის შესაბამისი მჟავა და წყალი იქმნება: ასე რომ 3 + 2koh \u003d k 2 ასე რომ 4 + h 2 o გ) თუთიის ჰიდროქსიდი ZN (OH) 2 აქვს ტიპიური amphoteric თვისებები, რომ არის, რეაგირებს ორივე მჟავე ოქსიდები და მჟავები და ძირითადი ოქსიდები და alkalis. სიაში 4, ჩვენ ვხედავთ როგორც მჟავები - Bromomrogenated HBR და epetic და alkali - lioh. შეგახსენებთ, რომ ალკალის წყალს ჰიდროქსიდების წყალში უწოდებენ: Zn (oh) 2 + 2hbr \u003d znbr 2 + 2h 2 o o ZN (OH) 2 + 2CH 3 COOH \u003d ZN (CH 3 COO) 2 + 2H 2 O ZN (OH) 2 + 2LIOH \u003d LI 2 დ) თუთიის ბრომიდი Znbr 2 არის მარილი, ხსნადი წყალში. ხსნადი მარილებისთვის, იონური გაცვლითი რეაქციები ყველაზე გავრცელებულია. მარილი შეიძლება რეაგირება სხვა მარილი, იმ პირობით, რომ ორივე წყარო მარილები ხსნადი და ნალექის ჩამოყალიბდა. ასევე, Znbr 2 შეიცავს Bromide Ion Br-. ლითონების Halides, ეს არის დამახასიათებელი, რომ მათ შეუძლიათ რეაგირება Hal 2 Halogens, რომლებიც უფრო მაღალია Mendleeev მაგიდა. Ამგვარად? რეაქციების აღწერილი ტიპები გაგრძელდება სიის ყველა ნივთიერებით 1: Znbr 2 + 2agno 3 \u003d 2agbr + zn (№ 3) 2 3znbr 2 + 2na 3 po 4 \u003d zn 3 (PO 4) 2 + 6nabr Znbr 2 + cl 2 \u003d zncl 2 + br 2 სამუშაო ნომერი 12. შინაარსისა და კლასის / ჯგუფის დასახელების კორესპონდენცია, რომელსაც ეს ნივთიერება ეკუთვნის: წერილში მითითებულ თითოეულ პოზიციას შორის, აირჩიეთ ნომრის მითითებით შესაბამისი პოზიცია. ჩანაწერი ცხრილის ნომერზე შერჩეული ნივთიერებების შესაბამისი ასოებით. პასუხი: A-4; B-2; 1 წელს განმარტება: ა) მეთილის ბენზენი არის ტოლუენი, აქვს სტრუქტურული ფორმულა: როგორც ჩანს, ამ ნივთიერების მოლეკულები შედგება მხოლოდ ნახშირბადის და წყალბადის, ამიტომ მეთილბენზენი (ტოლუენი) ეხება ნახშირწყალბადებს ბ) Aniline (Aminobenzene) სტრუქტურული ფორმულა ასეთია: როგორც ჩანს, ანილინის მოლეკულის სტრუქტურული ფორმულააგან შედგება არომატული ნახშირწყალბადების რადიკალური (C 6 H 5 -) და ამინოს ჯგუფი (-NH 2), ამდენად, ანილინი ეხება არომატული amines, I.E. სწორი პასუხი არის 2. გ) 3-მეთილბუტანი. AL- ის დასასრული ვარაუდობს, რომ ნივთიერება ალდეჰიდამს ეხება. ამ ნივთიერების სტრუქტურული ფორმულა: სამუშაო ნომერი 13. შემოთავაზებული სიიდან, აირჩიეთ ორი ნივთიერება, რომელიც არის Bouthen-1- ის სტრუქტურული იზომერები. ჩაწერეთ შერჩეული ნივთიერებების საპასუხო სფეროში. პასუხი: 2; ხუთი განმარტება: იზომერები ზარის ნივთიერებებს, რომლებიც იმავე მოლეკულური ფორმულისა და სხვადასხვა სტრუქტურული, ანუ. ნივთიერებები, რომლებიც განსხვავდებიან ატომების ნაერთებისგან, მაგრამ მოლეკულების იგივე შემადგენლობით. სამუშაო ნომერი 14. შემოთავაზებული სიიდან, აირჩიეთ ორი ნივთიერება, რომელთა ურთიერთქმედებაც კალიუმის პერმანგანატის გადაწყვეტასთან ერთად შეინიშნება ცვლილებების შეტანისას. ჩაწერეთ შერჩეული ნივთიერებების საპასუხო სფეროში. პასუხი: 3; ხუთი განმარტება: ალკანი, ისევე როგორც ციკლის ზომით ციკლის ზომა მე -5 ან მეტი ნახშირბადის ატომებით არის ძალიან ინერტული და არ რეაგირებს თუნდაც ძლიერი ჟანგვის აგენტებს, როგორიცაა, მაგალითად, კალიუმის პერმანგანატი KMNO 4 და კალიუმის Dichromat K 2 CR 2 O 7 . ამრიგად, ვარიანტები 1 და 4 გაუჩინარდება - CycloHexane ან Propane- ის დამატებით კალიუმის პერმანგანატის წყალხსნარში, ფერის ცვლილება არ მოხდება. ბენზინის ჰომოგარარბონებს შორის ბენზინის ჰომეროგარბონებს შორის ნორმალურია ოქსიდერის აგენტების წყალხსნარში, მხოლოდ ბენზენზე, ყველა სხვა ჰომოლოგები, რომლებიც დამოკიდებულია საშუალო ან კარბოქსილის მჟავებზე, ან შესაბამისი მარილების მიხედვით. რითაც ქრება ვარიანტი 2 (ბენზენი). სწორი პასუხები - 3 (ტოლუენი) და 5 (პროპილენი). ორივე ნივთიერებები კალიუმის პერმანგანატის იისფერი ხსნარის გამო, რეაქციების გამო: Ch 3-ch 2 + 2kmno 4 + 2h 2 o → ch 3-sch (oh) -ch 2 oh + 2mno 2 + 2koh სამუშაო ნომერი 15. შემოთავაზებული სიიდან, აირჩიეთ ორი ნივთიერება, რომელთანაც ფორმალდეჰიდე რეაგირებს. ჩაწერეთ შერჩეული ნივთიერებების საპასუხო სფეროში. პასუხი: 3; ოთხი განმარტება: ფორმალდეჰიდე ეხება ალდეჰიდების კლასს - ჟანგბადის შემცველი ორგანული ნაერთების მოლეკულის ბოლოს ალდეჰიდის ჯგუფს: ტიპიური Aldehyde რეაქციები არის ოქსიდაცია და აღდგენის რეაქციები, რომელიც მიედინება ფუნქციურ ჯგუფს. ფორმალდეჰიდის რეაგირების ჩამონათვალში არის აღდგენის რეაქცია, სადაც წყალბადის გამოყენება გამოიყენება როგორც შემცირების აგენტი (კატა, PT, PD, NI) და ოქსიდაცია - ამ შემთხვევაში ვერცხლის სარკის რეაქცია. ნიკელის კატალიზატორზე წყალბადის აღდგენისას ფორმალდეჰიდი მეტანოლს გადააქვს: ვერცხლის სარკის რეაქცია ვერცხლის აღდგენის რეაქციაა ამიაკის გადაწყვეტა ვერცხლის ოქსიდი. როდესაც ამიაკი დაიშალა წყალხსნარში, ვერცხლისფერი ოქსიდის კონვერტირებულია კომპლექსური კომპლექსის კომპლექსური ნაერთის - დიმალუმინამ ჰიდროქსიდი (I). ფორმალდეჰიდის დასრულების შემდეგ, რომელიც ვერცხლის რეაქციაში აღდგენილია: სამუშაო ნომერი 16. შემოთავაზებული სიიდან, აირჩიეთ ორი ნივთიერება, რომელთანაც მეთილამინი რეაგირებს. ჩაწერეთ შერჩეული ნივთიერებების საპასუხო სფეროში. პასუხი: 2; ხუთი განმარტება: MethyLine არის მარტივი, წარმოადგინოს ორგანული ნაერთების კლასის amines. Amines- ის დამახასიათებელი ფუნქცია არის აზოტის ატომის საშუალო ელექტრონული წყვილის ყოფნა, რის შედეგადაც amines გამოფენებში წარმოდგენილია ბაზის თვისებები და რეაქციები, როგორც ბირთვები. ამდენად, ამით, მეთილამინი, როგორც ბაზა და ბირთოფილი რეაგირებს ქლორომეთანთან და ჰიდროქლორინის მჟავასთან, შემოთავაზებული ვარიანტებიდან პასუხების შესახებ. Ch 3 NH 2 + CH 3 CL → (CH 3) 2 NH 2 + Cl - Ch 3 NH 2 + HCL → Ch 3 NH 3 + CL - სამუშაო ნომერი 17. ნივთიერებების ტრანსფორმაციის შემდეგი სქემა მოცემულია: განსაზღვრავს რომელი ნივთიერებების რომელი ნივთიერებები X და Y. ჩანაწერი ცხრილის ნომერზე შერჩეული ნივთიერებების შესაბამისი ასოებით. პასუხი: 4; 2. განმარტება: ალკოჰოლური სასმელების მოპოვების ერთ-ერთი რეაქცია არის ჰიდროლიზის ჰალოგენის ხეივნის რეაქცია. ამდენად, შესაძლებელია ქლოროტოანისგან ეთანოლის მოპოვება, ამ უკანასკნელთან ერთად, წყალხსნარში ალკალის გადაწყვეტა - ამ შემთხვევაში NAOH. Ch 3 ch 2 cl + naoh (Vodn) → ch 3 ch 2 oh + nacl მომდევნო რეაქცია არის ეთილის ალკოჰოლური ჟანგვის რეაქცია. ალკოჰოლური სასმელების ოქსიდაცია ხორციელდება სპილენძის კატალიზატორზე ან Cuo- ის გამოყენებით: სამუშაო ნომერი 18. დაადგინეთ კორესპონდენცია ნივთიერებისა და პროდუქტის სახელით, რომელიც ძირითადად ამ ნივთიერების ურთიერთქმედებით ბრომს შორისაა: წერილში მითითებულ თითოეულ პოზიციაზე აირჩიეთ ნომერზე მითითებული შესაბამისი პოზიცია. პასუხი: 5; 2; 3; 6. განმარტება: ალკანელებისთვის, ყველაზე დამახასიათებელი რეაქციები თავისუფალი რადიკალური ჩანაცვლების რეაქციებს წარმოადგენს, რომლის დროსაც წყალბადის ატომს შეიცვალა ჰალოგენის ატომი. ამდენად, ბრომი ეთანი შეიძლება მოიპოვოს Brometan, და Bromine Isobutane - 2-Bromisobutane: მას შემდეგ, რაც Cyclopropane და CycloButane მოლეკულების მცირე ციკლები არასტაბილურია, როდესაც ამ მოლეკულების ციკლები გამჟღავნებულნი არიან, ამდენად, კავშირის რეაქცია აგრძელებს: Cyclopropane ციკლისგან განსხვავებით და CycloButan Cyclohexane ციკლი დიდი ზომის, რის შედეგადაც წყალბადის ატომი შეიცვალა ბრომი ატომის მიერ: ამოცანა №19. რეაქტიულ ნივთიერებებსა და ნახშირბადის შემცველი პროდუქტის კორესპონდენცია, რომელიც ჩამოყალიბებულია ამ ნივთიერებების ურთიერთქმედებისას: წერილში მითითებულ თითოეულ პოზიციაზე, აირჩიეთ ნომრის მითითებით შესაბამისი პოზიცია. ჩაწერეთ მაგიდაზე შერჩეული ნომრები შესაბამისი ასოებით. პასუხი: 5; ოთხი; 6; 2. სამუშაო ნომერი 20. რეაქციის ტიპების შემოთავაზებულ ჩამონათვალში, აირჩიეთ ორი ტიპის რეაქცია, რომელსაც ალკალის ლითონის ურთიერთქმედება შეიძლება მიეკუთვნოს. შერჩეული რეაქციის ტიპების რეაგირების სფეროში ჩაწერეთ. პასუხი: 3; ოთხი ტუტე ლითონები (LI, NA, K, RB, CS, FR) განლაგებულია მაგიდის დ.ის ჯგუფის ძირითად ქვეჯგუფში I. MENDELEEV და შემცირების აგენტები, ადვილად აძლევს ელექტრონულ გარე დონეზე. თუ თქვენ დანიშნულ ტუტე ლითონის წერილს მ, მაშინ ალკალის ლითონის რეაქცია წყლით გამოიყურება: 2m + 2h 2 o → 2moh + h 2 ალკალის ლითონები ძალიან აქტიურია წყლის მიმართ. რეაქცია ძალადობას იწვევს დიდი რაოდენობით სითბოს გათავისუფლებას, შეუქცევადია და არ საჭიროებს კატალიზატორის (არაკადალიტი) ნივთიერებების გამოყენებას რეაქციის დაჩქარებასა და რეაქციის პროდუქციის ნაწილს. უნდა აღინიშნოს, რომ ყველა უაღრესად ეგზოთერმული რეაქცია არ საჭიროებს კატალიზატორის გამოყენებას და შეუქცევადად გააგრძელებს. მას შემდეგ, რაც ლითონი და წყალი სხვადასხვა საერთო ქვეყნებში ნივთიერებებია, ეს რეაქცია მიმდინარეობს ფაზის საზღვრების საზღვარზე, ამიტომ ჰეტეროგენურია. ამ რეაქციის ტიპი - ჩანაცვლება. არაორგანულ ნივთიერებებს შორის რეაქციები ეხება ჩანაცვლების რეაქციებს, თუ მარტივი ნივთიერება რთულია კომპლექსით და შედეგად წარმოიქმნება სხვა მარტივი და კომპლექსური ნივთიერებები. (ნეიტრალიზაციის რეაქცია მიმდინარეობს მჟავასა და ბაზას შორის, რის შედეგადაც ეს ნივთიერებები გაცვალეს მათი განუყოფელი ნაწილებისა და მარილისა და ოდნავ საარსებო ნივთიერებებით). როგორც ზემოთ აღვნიშნეთ, ალკალის ლითონები შემცირებას აგენტები, გარე ფენის ელექტრონულად, ამიტომ რეაქცია არის Redox. სამუშაო ნომერი 27. გარე გავლენის შემოთავაზებული ჩამონათვალიდან, აირჩიეთ ორი გავლენა, რამაც გამოიწვია ეთილენის რეაქციის შემცირების შემცირება წყალბადისთ. დაწერეთ შერჩეული გარე გავლენის რაოდენობის საპასუხო სფეროში. პასუხი: 1; ოთხი ქიმიური რეაქციის მაჩვენებლით გავლენას ახდენს შემდეგი ფაქტორები: რეაგენტების ტემპერატურისა და კონცენტრაციის ცვლილება, ასევე კატალიზატორის გამოყენება. Vant-gooff- ის ემპირიული მმართველობის თანახმად, ყოველ 10 გრადუსზე ტემპერატურის ზრდით, ერთგვაროვანი რეაქციის განაკვეთი 2-4-ჯერ იზრდება. შესაბამისად, ტემპერატურის შემცირება იწვევს რეაქციის შემცირებას. პირველი პასუხი შესაფერისია. როგორც ზემოთ აღვნიშნეთ, რეაქციის მაჩვენებელს ასევე აქვს რეაგენტების კონცენტრაციის გავლენა და შეცვლა: თუ ეთილენის კონცენტრაციის გაზრდა, მაშინ რეაქციის მაჩვენებელი ასევე გაიზრდება, რაც არ შეესაბამება ამოცანას. წყალბადის კონცენტრაციის შემცირება არის წყარო კომპონენტი, პირიქით, ამცირებს რეაქციის მაჩვენებელს. შესაბამისად, მეორე ვარიანტი არ არის შესაფერისი, მაგრამ მეოთხე - შესაფერისი. კატალიზატორი არის ნივთიერება დაჩქარება ქიმიური რეაქციის სიჩქარე, მაგრამ არა ნაწილის ნაწილი. კატალიზატორის გამოყენება აჩქარებს ეთილენის წყალბადის რეაქციის ნაკადს, რომელიც ასევე არ შეესაბამება პრობლემის მდგომარეობას, ამიტომ ეს არ არის სწორი პასუხი. როდესაც ეთილენის ურთიერთქმედება წყალბადის (კატალიზატორების NI, PD, PT), ეთანი ჩამოყალიბდა: CH 2 \u003d CH 2 (გ) + H 2 (გ) → ch 3-ს 3 (გ) რეაქციაში ჩართული ყველა კომპონენტია და პროდუქტი აირისებრი ნივთიერებებია, ამიტომ სისტემაში ზეწოლა გავლენას მოახდენს რეაქციის მაჩვენებელს. ეთილენისა და წყალბადის ორი ტომი, ეთანის ერთი მოცულობა იქმნება, ამიტომ რეაქცია არის სისტემაში ზეწოლის შემცირება. ზეწოლის გაღრმავებით, რეაქციას დაჩქარდება. მეხუთე პასუხი არ არის შესაფერისი. ამოცანა №22. დააინსტალირეთ მარილის ფორმულას შორის არსებული კორესპონდენცია და ამ მარილის წყალხსნარების ელექტროლიზის პროდუქტებს შორის, რომლებიც ინერტული ელექტროდების შუამავლობით იყვნენ: თითოეული პოზიცია, სოლოის ფორმულა ელექტროლიზის პროდუქტები ჩაწერეთ მაგიდაზე შერჩეული ნომრები შესაბამისი ასოებით. პასუხი: 1; ოთხი; 3; 2. Electrolysis არის Redox პროცესი, რომელიც მოხდეს ელექტროდების დროს გადაცემის პირდაპირი ელექტროენერგიის მეშვეობით გამოსავალი ან ელექტროლიტური დნება. კათოდაზე სასურველია იმ საკომისიოს აღდგენა, რომლებსაც აქვთ ყველაზე დიდი ოქსიდაციური აქტივობა. ანონებს, რომლებსაც აქვთ ყველაზე დიდი რესტავრაციული უნარი, პირველად ოკეანეში. წყლის ხსნარის ელექტროლიზი 1) კათოდზე წყალხსნარების ელექტროლიზის პროცესი არ არის დამოკიდებული კათოდური მასალის შესახებ, მაგრამ დამოკიდებულია ლითონის ცემის პოზიციაზე ხაზს უსვამს ელექტროქიმიურ რიგს. ზედიზედ LI + - AL 3+ აღდგენის პროცესი: 2h 2 o + 2e → H 2 + 2oh - (Cathode H 2 გამოირჩევა) ZN 2+ - PB 2+ აღდგენის პროცესი: მე N + + NE → ME 0 და 2H 2 O + 2E → H 2 + 2OH - (Cathode H 2- ზე და მე გამოტოვებთ) CU 2+ - AU 3+ აღდგენის პროცესი ME N + + NE → მე 0 (მე გამოირჩევა კათოდაზე) 2) ანდოდის წყალხსნარების ელექტროლიზის პროცესი დამოკიდებულია ანდოდის მასალებზე და ანონის ბუნება. თუ ანოდი არის insoluble, ანუ. ინერტული (პლატინის, ოქრო, ქვანახშირი, გრაფიტი), მაშინ პროცესი დამოკიდებულია მხოლოდ ანონების ბუნებაზე. Anions F -, ასე რომ 4 2-, No 3 -, PO 4 3-, OH - ოქსიდაციის პროცესი: 4OH - 4E → O 2 + 2H 2 O ან 2H 2 O - 4E → O 2 + 4H + (ჟანგბადი გაათავისუფლეს ანდოდაზე) Halide Ions (გარდა F-) 2HAL oxxidation პროცესი - 2E → Hal 2 (უფასო ჰალოგენები ხაზს უსვამენ) ორგანული მჟავა ჟანგვის პროცესს: 2RCOO - - 2E → R-R + 2CO 2 სულ ელექტროლიზის განტოლება: ა) NA 3 PO 4 გამოსავალი 2H 2 O → 2H 2 (კათოდაზე) + O 2 (ანდოსზე) ბ) KCL Solution 2kcl + 2h 2 o → H 2 (კათოდაზე) + 2koh + cl 2 (ანდოსზე) გ) CUBR2 Solution CUBR 2 → CU (კათოდაზე) + Br 2 (ანდოდში) დ) CU Solution (NO3) 2 2CU (№ 3) 2 + 2H 2 O → 2CU (კათოდაზე) + 4HNO 3 + O 2 (ანდოში) სამუშაო ნომერი 23. დაადგინეთ მარილის სახელი და ამ მარილის თანაფარდობა ჰიდროლიზში: წერილში მითითებულ თითოეულ პოზიციაზე აირჩიეთ ნომრის მითითებით შესაბამისი პოზიცია. ჩაწერეთ მაგიდაზე შერჩეული ნომრები შესაბამისი ასოებით. პასუხი: 1; 3; 2; ოთხი მარილების ჰიდროლიზი - წყლის მარილების ურთიერთქმედება, რომელიც წყალბადის Cation H + წყლის მოლეკულების დამატებით მიდის ჰიდროქსილის ჯგუფის მჟავა ნარჩენების ან (ან), წყლის მოლეკულებს ლითონის ცემას. ჰიდროლიზი ექვემდებარება მარილებს, რომლებიც ქმნიან სუსტი ბაზების, და სუსტი მჟავების შესაბამისი ანიონების შესაბამისად. ა) ამონიუმის ქლორიდი (NH 4 CL) - ძლიერი ჰიდროქლორინის მჟავა და ამიაკის (სუსტი ბაზის) მიერ ჩამოყალიბებული მარილი, ექვემდებარება ჰიდროლიზს Cation- ში. NH 4 CL → NH 4 + + CL - NH 4 + + H 2 O → NH 3 · H 2 O + H + (ამონიას ფორმირება წყალში) Sycola Solution Medium (PH< 7). ბ) კალიუმის სულფატი (K 2 ასე 4) არის ძლიერი გოგირდის მჟავა და კალიუმის ჰიდროქსიდი (ალკალი, ან ძლიერი ბაზა), ჰიდროლიზი არ ექვემდებარება. K 2 ასე 4 → 2k + + ასე რომ 4 2- გ) ნატრიუმის კარბონატი (NA 2 CO 3) არის სუსტი ნახშირის მჟავა და ნატრიუმის ჰიდროქსიდის (ალკალი, I.E. ძლიერი ბაზა) მიერ ჩამოყალიბებული მარილი ანონიდან ჰიდროლიზზე. CO 3 2- + H 2 o → HCO 3 - + OH - (Bicarbonate ION- ის სუსტად-სუბსიდიის ფორმირება) ტუტე Solution Medium (PH\u003e 7). დ) ალუმინის სულფიდის (ალ 2 S 3) - მარილი ჩამოყალიბებულია სუსტი წყალბადის სულფიდის მჟავა და ალუმინის ჰიდროქსიდი (სუსტი ბაზა), რომელიც ჰიდროლიზს დაუცველებს ალუმინის და წყალბადის სულფიდის ჰიდროქსიდის შექმნას: Al 2 s 3 + 6h 2 o → 2al (oh) 3 + 3h 2 s საშუალო ნეიტრალურია (pH ~ 7). სამუშაო ნომერი 24. ქიმიური რეაქციის განტოლებისა და ქიმიური წონასწორობის გადაადგილების მიმართულებას შორის კორესპონდენციის დაყენება სისტემაში ზეწოლის გაზრდის გზით: წერილში მითითებულ თითოეულ პოზიციაზე აირჩიეთ ნომერზე მითითებული შესაბამისი პოზიცია. რეაქციის განტოლება ა) N 2 (გ) + 3H 2 (გ) ↔ 2nh 3 (გ) ბ) 2h 2 (გ) + o 2 (გ) ↔ 2h 2 o (გ) გ) H 2 (G) + CL 2 (G) ↔ 2HCL (G) დ) ასე რომ 2 (გ) + CL 2 (G) ↔ So 2 CL 2 (G) ქიმიური წონასწორობის მიმართულებით გადაადგილება 1) პირდაპირ რეაქციაზე გადადის 2) გადადის საპირისპირო რეაქციაზე 3) არ არის წონასწორობის გადაადგილება ჩაწერეთ მაგიდაზე შერჩეული ნომრები შესაბამისი ასოებით. პასუხი: A-1; B-1; 3; Ბატონი. რეაქცია ქიმიური წონასწორობისაა, როდესაც პირდაპირი რეაქციის მაჩვენებელი საპირისპირო სიჩქარის ტოლია. სასურველ მიმართულებით წონასწორობის გადაადგილება მიღწეულია რეაქციის პირობების შეცვლით. წონასწორობის პოზიციის განსაზღვრის ფაქტორები: - შევიწროება: გაზრდილი წნევა მოცულობის წონასწორობისკენ მიმავალ გზაზე გადადის მოცულობის შემცირებაზე (პირიქით, წნევის შემცირება აჩვენებს ბალანსს რეაქციისკენ მიმავალი ტომის ზრდისთვის) - ტემპერატურა: ტემპერატურის გაზრდა ენდოთერმული რეაქციის მიმართ ბალანსს (პირიქით, ტემპერატურის შემცირება ეგზოთერმული რეაქციისადმი წონასწორობას ახდენს) - წყარო ნივთიერებების და რეაქციის პროდუქტების კონცენტრაცია: რეაქციის სფეროს საწყისი მასალების კონცენტრაციის გაზრდა და რეაქციის სფეროს პროდუქციის მოხსნა პირდაპირი რეაქციისადმი (პირიქით, საწყის მასალების კონცენტრაციის შემცირება და რეაქციის პროდუქტების ზრდა საპირისპირო რეაქციის მიმართ) - კატალიზატორები არ იმოქმედებს წონასწორობის გადაადგილებასთან, მაგრამ მხოლოდ მისი მიღწევის აჩქარებს. ა) პირველ შემთხვევაში, რეაქცია გააჩნია მოცულობის შემცირებას, რადგან V (N 2) + 3V (H 2)\u003e 2V (NH 3). სისტემაში ზეწოლის გაზრდის გზით, წონასწორობა ნივთიერებების მცირე მოცულობით გადადის, ამიტომ პირდაპირი მიმართულებით (პირდაპირი რეაქციის მიმართ). ბ) მეორე შემთხვევაში, რეაქცია ასევე გააჩნია მოცულობის შემცირებას, რადგან 2V (H 2) + V (O 2)\u003e 2V (H 2 o). სისტემაში ზეწოლის გაზრდის გზით, წონასწორობა ასევე გადაეცემა პირდაპირ რეაქციას (პროდუქტის მიმართ). გ) მესამე შემთხვევაში, რეაქციის დროს ზეწოლა არ იცვლება, რადგან V (h 2) + v (cl 2) \u003d 2V (HCL), ასე რომ, წონასწორობის გადაადგილება ხდება. დ) მეოთხე შემთხვევაში, რეაქცია ასევე გააჩნია მოცულობის შემცირებას, რადგან V (ასე 2) + V (CL 2)\u003e V (ასე 2 CL 2). სისტემაში ზეწოლის გაზრდის გზით, ბალანსი გადანაწილდება პროდუქტის ფორმირებაზე (პირდაპირი რეაქცია). სამუშაო №25 კომპლექტი ნივთიერებების ფორმებსა და რეაქციას შორის კორესპონდენცია, რომელთანაც შეგიძლიათ გამოაცხადოთ მათი წყალხსნარში: წერილში მითითებულ თითოეულ პოზიციაზე, აირჩიეთ ნომრის მითითებით შესაბამისი პოზიცია. ნივთიერებების ფორმულები ა) HNO 3 და H 2 o გ) NACL და BACL 2 დ) ალკლა 3 და MGCL 2 ჩაწერეთ მაგიდაზე შერჩეული ნომრები შესაბამისი ასოებით. პასუხი: A-1; B-3; 3; M-2. ა) აზოტის მჟავა და წყალი შეიძლება გამოირჩეოდეს მარილი - კალციუმის კარბონატი CACO 3. კალციუმის კარბონატი წყალში არ დაიშლება და ნიტრიკ მჟავასთან ურთიერთქმედებისას, იგი ხსნადი მარილი - კალციუმის ნიტრატი CA (არა 3) 2, ხოლო რეაქცია თან ახლავს უფერო ნახშირბადის დიოქსიდის გამოყოფას: CACO 3 + 2HNO 3 → CA (№ 3) 2 + CO 2 + H 2 O ბ) კალიუმის ქლორიდის KCL და ალკალი NAOH შეიძლება აირჩეს სპილენძის სულფატის (II) გადაწყვეტის გზით. CCL- ის სპილენძის სულფატის (II) ურთიერთქმედებით, გაცვლითი რეაქცია არ არის ნაკადის, არსებობს K +, CL - CU 2+ და ასე რომ 4 იონების გადაწყვეტაში, რომელიც არ ქმნის ერთმანეთს მცირე რაოდენობის ნივთიერებებს. სპილენძის (II) სულფატის ურთიერთქმედებით NAOH- სთან ერთად, გაცვლითი რეაქცია მიედინება, რომლის შედეგადაც სპილენძი (II) ჰიდროქსიდი (ბაზის ბაზა) ნალექებისკენ მიდის. გ) ნატრიუმის ქლორიდები NACL და Barium Bacl 2 - ხსნადი მარილები, რომელიც ასევე შეიძლება გამჟღავნდეს სპილენძის სულფატის (II) გადაწყვეტას. სპილენძის ურთიერთქმედებისას NACL- თან, გაცვლითი რეაქცია არ გაგრძელდება, არსებობს na +, cl - cu 2+ და ასე 4 იონების გადაწყვეტაში, რომელიც არ ქმნის მკაცრ საარსებო ნივთიერებებს ერთმანეთს. როდესაც სპილენძის (ii) სულფატის რეაქცია BACL 2- ით, გაცვლითი რეაქციის ნაკადს, რომლის შედეგადაც ბარიუმის ბარიუმის სულფატი 4 დაეცემა ნალექებისკენ. დ) ალკლ 3 და მაგნიუმის ალუმინის ქლორიდები MGCL 2 წყალში დაითხოვოს და სხვაგვარად იქცევიან კალიუმის ჰიდროქსიდთან ურთიერთქმედებისას. მაგნიუმის ქლორიდი ალკალით ქმნის ნალექებს: MGCL 2 + 2koh → მგ (OH) 2 ↓ + 2kcl ალუმინის ქლორიდისთან ერთად ალკალის ურთიერთქმედებისას, ნალექის პირველი ჩამოყალიბებულია, რომელიც შემდეგ დაიშლება კომპლექსური მარილის შექმნისთვის - კალიუმის ტეტრაჰიდროქსიალიუმი: Alcl 3 + 4koh → K + 3kcl სამუშაო ნომერი 26. დააინსტალირეთ კორესპონდენცია ნივთიერებასა და განცხადებას შორის: წერილით მითითებული თითოეული პოზიციისთვის, აირჩიეთ ნომრის მითითებით შესაბამისი პოზიცია. ჩაწერეთ მაგიდაზე შერჩეული ნომრები შესაბამისი ასოებით. პასუხი: A-4; B-2; 3; Ბატონი. ა) ამიაკი ქიმიური მრეწველობის არსებითი პროდუქტია, მისი წარმოება წელიწადში 130 მილიონ ტონაზე მეტია. ძირითადად ამიაკი გამოიყენება აზოტის სასუქების მომზადებაში (ნიტრატი და ამონიუმის სულფატი, შარდოვანა), ნარკოტიკები, ასაფეთქებელი ნივთიერებები, აზოტის მჟავა, სოდა. შემოთავაზებულ პასუხებს შორის, ამიაკის ფართობი არის სასუქების წარმოება (მეოთხე პასუხი ვარიანტი). ბ) მეთანი არის უმარტივესი ნახშირწყალბადები, ყველაზე მეტად მდგრადი წარმომადგენელი რიგი ლიმიტის ნაერთების. იგი ფართოდ გამოიყენება როგორც შიდა და სამრეწველო საწვავი, ასევე ნედლეულის ინდუსტრიაში (მეორე პასუხი ვარიანტი). მეთანი არის 90-98% ბუნებრივი აირის ნაწილია. გ) რეზინის მოუწოდა მასალები, ჩვენ ვიღებთ კომპონენტების პოლიმერიზაციას კონიუგატოთ ორმაგი ობლიგაციებით. Isoprene არის მხოლოდ ამ ტიპის ნაერთების შემდეგ და გამოიყენება რეზინის ერთ-ერთი ტიპის მისაღებად: დ) დაბალი მოლეკულური წონა ალკენები გამოიყენება პლასტმასის მისაღებად, კერძოდ, ეთილენი გამოიყენება პლასტმასის მისაღებად, რომელსაც პოლიეთილენი მოუწოდა: ნ.Ch 2 \u003d ch 2 → (-ch 2 -ch 2 -) n სამუშაო ნომერი 27. გამოთვალეთ კალიუმის ნიტრატის მასა (გრამი), რომელიც 150 გ-ში უნდა დაიშალოს ამ მარილის მასიურ ფრაქციაში 10% -ით 12% -ის მასიური ფრაქციის მისაღებად. (ჩაწერეთ ნომერი მეათეზე.) პასუხი: 3.4 გ განმარტება: მოდით X წავიდეთ კალიუმის ნიტრატის მასა, რომელიც 150 გ-ში გადაწყდება. ჩვენ გამოვთვალოთ კალიუმის ნიტრატის მასა 150 გ-ში გამოსავალი: m (kno 3) \u003d 150 გ · 0.1 \u003d 15 გ მარილის მასის ფრაქციისთვის 12% -ით, კალიუმის ნიტრატის X გ. გამოსავლის მასა იყო (150 + x), განტოლება განტოლება განტოლება ფორმით: (ჩაწერეთ ნომერი მეათეზე.) პასუხი: 14.4 გ განმარტება: წყალბადის სულფიდის მთლიანი წვის შედეგად, გოგირდის დიოქსიდი იქმნება: 2h 2 s + 3o 2 → 2se 2 + 2h 2 o o Avogadro კანონი არის ის, რომ გაზების მოცულობა იმავე პირობებში ეხება ერთმანეთს, ისევე როგორც ამ გაზების რაოდენობას. ამდენად, რეაქციის განტოლების მიხედვით: ν (o 2) \u003d 3/2 í (h 2 s), შესაბამისად, წყალბადის სულფიდისა და ჟანგბადის მოცულობები ერთმანეთთან ერთმანეთთან ერთმანეთთან: V (o 2) \u003d 3/2V (H 2 S), V (o 2) \u003d 3/2 · 6.72 ლ \u003d 10.08 ლ, აქედან გამომდინარე v (o 2) \u003d 10.08 ლ / 22.4 ლ / Mol \u003d 0.45 MOL ჩვენ გამოვთვალოთ წყალბადის სულფიდის მთლიანი წვისთვის საჭირო ჟანგბადის მასა: m (o 2) \u003d 0.45 mol · 32 გ / mol \u003d 14.4 გ სამუშაო ნომერი 30. ელექტრონული ბალანსის გამოყენებით, რეაქციის განტოლება: Na 2 ასე რომ 3 + ... + KOH → K 2 MNO 4 + ... + H 2 O განსაზღვრავს ჟანგვის აგენტი და შემცირების აგენტი. MN +7 + 1E → MN +6 │2 აღდგენის რეაქცია S +4 - 2E → S +6 │1 ოქსიდაციის რეაქცია Mn +7 (kmno 4) - oxidizer, s +4 (na 2 ასე 3) - აღდგენა Na 2 ასე რომ 3 + 2kmno 4 + 2koh → 2k 2 mno 4 + na 2 ასე რომ 4 + H 2 o სამუშაო ნომერი 31. რკინის დაიშალა ცხელი კონცენტრირებული გოგირდის მჟავა. შედეგად მარილი მკურნალობდა ნატრიუმის ჰიდროქსიდის ჭარბი გადაწყვეტა. შედეგად ყავისფერი ნალექების გაფილტრული და გაანგარიშებული. შედეგად ნივთიერება გაცხელდა რკინას. დაწერეთ ოთხი აღწერილი რეაქციის განტოლებები. 1) რკინის, ისევე როგორც ალუმინის და Chrome, არ რეაგირებს კონცენტრირებული გოგირდის მჟავას, რომელიც დაფარავს დამცავი ოქსიდის ფილმს. რეაქცია ხდება მხოლოდ მაშინ, როდესაც გოგირდის გაზის გამოყოფა: 2fe + 6h 2 ასე რომ 4 → FE 2 (ასე რომ 4) 2 + 3so 2 + 6h 2 o (როდესაც მწვავე) 2) რკინის სულფატი (III) - ხსნადი მარილი წყალში, შევიდა ალკალის გაცვლითი რეაქციაში, რომლის შედეგადაც რკინის (iii) ჰიდროქსიდი (III კავშირი) არის ნაგულისხმევი: FE 2 (ასე რომ 4) 3 + 3Naoh → 2fe (OH) 3 ↓ + 3NA 2 SO 4 3) Insoluble ლითონები Hydroxides ერთად კალკულაცია decompose შესაბამისი ოქსიდები და წყალი: 2fe (OH) 3 → FE 2 O 3 + 3H 2 O 4) როდესაც რკინის (iii) ოქსიდი თბება რკინის რკინის, რკინის (II) იქმნება (რკინის FEO კავშირი აქვს შუალედური ხარისხი ჟანგვის): FE 2 O 3 + FE → 3feo (როდესაც მწვავე) სამუშაო ნომერი 32. დაწერეთ რეაქციის განტოლებები, რომელთანაც შეიძლება განხორციელდეს შემდეგი ტრანსფორმაციები: რეაქციის განტოლების წერისას, ორგანული ნივთიერებების სტრუქტურული ფორმულების გამოყენებისას. 1) Intramolecular დეჰიდრატაცია ხდება 140 o C- ზე ზემოთ ტემპერატურაზე. ეს ხდება ალკოჰოლური ნახშირბადის ატომის წყალბადის ატომისგან, რომელიც მდებარეობს ალკოჰოლური ჰიდროქსილის მეშვეობით (β- პოზიციაში). Ch 3 -ch 2 -ch 2 -oh → ch 2 \u003d ch-ch 3 + h 2 o (პირობები - h 2 ასე რომ 4, 180 o გ) Intermolecular დეჰიდრატაცია ხდება ტემპერატურაზე ქვემოთ 140 o C Sulfuric მჟავის მოქმედებით და საბოლოო ჯამში, ორი ალკოჰოლური მოლეკულებისგან ერთი წყლის მოლეკულის გამოყოფა. 2) Propylene ეხება ასიმეტრიული alkenes. ჰალოგენური წყალბადის და წყლის დამატებით, წყალბადის ატომი კარბონის ატომს უერთდება მრავალჯერადი კომუნიკაციას, რომელიც დაკავშირებულია წყალბადის ატომების დიდი რაოდენობით: Ch 2 \u003d ch-ch 3 + hcl → ch 3 -chcl-ch 3 3) 2-ქლოროპროპანზე NAOH- ის წყალხსნარში მოქმედი ჰალოგენ ატომის შეცვლილია ჰიდროქსილის ჯგუფი: CH 3 -Chcl-ch 3 + Naoh (AQ.) → Ch 3 -choh-ch 3 + NACL 4) შესაძლებელია პროპლოენის მიღება არა მხოლოდ Propanol-1- ისგან, არამედ 140-ზე მეტ ტემპერატურაზე ინტრამოლეკულური დეჰიდრატაციის პროპანოლური -2 რეაქციისგან: CH 3-ს (OH) -CH 3 → Ch 2 \u003d CH-CH 3 + H 2 o (პირობები H 2 ასე რომ 4, 180 o გ) 5) ტუტე მედიაში, კალიუმის პერმანგანატის წყალხსნარით, ალკენს ჰიდროქსილიზაციით ხდება დიოლოების ფორმირებით: 3ch 2 \u003d ch-ch 3 + 2kmno 4 + 4h 2 o → 3hoch 2-sch (oh) -ch 3 + 2mno 2 + 2koh სამუშაო ნომერი 33. რკინის (II) სულფატისა და ალუმინის სულფიდის მასობრივი ფრაქციების განსაზღვრა ნარევიდან, თუ ამ ნარევის 25 გ-ის დამუშავება წყლით იყო უზრუნველყოფილი, რომელიც მთლიანად რეაგირებდა სპილენძის სულფატის 5% -ით 5% -ით. II). საპასუხოდ, ჩაწერეთ რეაქციის განტოლებები, რომლებიც მითითებულია ამოცანა მდგომარეობაში, და ყველა საჭირო გათვლებით (მიუთითეთ სასურველი სულისკვეთების ერთეული ფიზიკური რაოდენობა). პასუხი: ω (al 2 s 3) \u003d 40%; Ω (Cuso 4) \u003d 60% რკინის (II) სულფატისა და ალუმინის სულფიდის ნარევი, სულფატი უბრალოდ დაიშალა და სულფიდს ჰიდროლიზირებულია ალუმინის ჰიდროქსიდი (III) და წყალბადის სულფიდის შექმნა: Al 2 s 3 + 6h 2 o → 2al (oh) 3 ↓ + 3h 2 s (i) როდესაც წყალბადის სულფედი გადადის სპილენძის (II) სულფატის ხსნარის მეშვეობით, სპილენძის სულფიდი (II) Falls: Cuso 4 + H 2 S → CUS ↓ + H 2 SO 4 (II) ჩვენ გამოვთვალოთ მასობრივი და სპილენძის სულიფტის ნივთიერების რაოდენობა (II): m (cuso 4) \u003d m (p-ra) · ω (Cuso 4) \u003d 960 გ · 0.05 \u003d 48 გ; ν (cuso 4) \u003d m (cuso 4) / m (cuso 4) \u003d 48 გ / 160 გ \u003d 0.3 MOL რეაქციის განტოლების მიხედვით (ii) ν (cuso 4) \u003d ν (h 2 s) \u003d 0.3 mol, და რეაქციის განტოლების მიხედვით (iii) ν (al 2 s 3) \u003d 1/3 í (h 2 s) \u003d 0, 1 MOL გამოთვალეთ ალუმინის სულფიდისა და სპილენძის სულფატის მასა (II): m (al 2 s 3) \u003d 0.1 mol · 150 გ / mol \u003d 15 გ; M (cuso4) \u003d 25 გ - 15 გ \u003d 10 გ ω (al 2 s 3) \u003d 15 გ / 25G · 100% \u003d 60%; Ω (Cuso 4) \u003d 10 გ / 25G · 100% \u003d 40% სამუშაო ნომერი 34. როდესაც იწვის ნიმუშის ზოგიერთი Ორგანული ნაერთი წონა 14.8 გ-მ 35.2 გ ნახშირბადის დიოქსიდი და 18.0 გ წყალი მოიპოვა. ცნობილია, რომ ამ ნივთიერების ორთქლის შედარებითი სიმჭიდროვე წყალბადის გასწვრივ 37-ის ტოლია ქიმიური თვისებები ეს ნივთიერება დადგინდა, რომ ამ ნივთიერების ურთიერთქმედება სპილენძის (II) ოქსიდი, კეტონი ჩამოყალიბდა. დაყრდნობით: 1) გათვლილია მოლეკულური ფორმულის დამყარების მიზნით ორგანული (მიუთითეთ სასურველი ფიზიკური რაოდენობის გაზომვის ერთეული); 2) დაწერეთ ორიგინალური ორგანული ნივთიერებების მოლეკულური ფორმულა; 3) ამ ნივთიერების სტრუქტურული ფორმულა, რომელიც ცალსახად ასახავს თავის მოლეკულაში ატომების კომუნიკაციის შეკვეთას; 4) ამ ნივთიერების რეაქციის განტოლება სპილენძის ოქსიდი (II) ნივთიერების სტრუქტურული ფორმულის გამოყენებით. ქიმიის ტიპიური ტესტის ამოცანები შეიცავს 2017 წლის ერთიან სახელმწიფო გამოცდის ყველა მახასიათებელსა და მოთხოვნებს გათვალისწინებულ ამოცანებს. სახელმძღვანელოს მიზანია უზრუნველყოს მკითხველის ინფორმაცია Kim 2017- ის სტრუქტურისა და შინაარსის შესახებ ქიმიაში, ამოცანების სირთულის ხარისხი. მაგალითები. ნივთიერებების შემოთავაზებული ჩამონათვალიდან, აირჩიეთ ორი ნივთიერებები, რომელთაგან თითოეული სპილენძი რეაგირებს. კმაყოფილი სპეციფიკაცია 1. კიმ Ege- ის დანიშვნა ერთიანი სახელმწიფო გამოცდა (შემდგომში, როგორც Ege) წარმოადგენს იმ პირთა მომზადების ხარისხის ობიექტურ შეფასებას, რომლებმაც საშუალო ზოგადი განათლების საგანმანათლებლო პროგრამების შემუშავება, სტანდარტიზებული ფორმის ამოცანების გამოყენებით (კონტროლის საზომი მასალები). EGE ტარდება 2012 წლის 29 დეკემბრის, 2012 წლის 29 დეკემბრის ფედერალური კანონმდებლობის შესაბამისად რუსეთის ფედერაციაში განათლების შესახებ ". კონტროლის საზომი მასალები საშუალებას გაძლევთ შექმნას განვითარების დონის ფედერალური კომპონენტის კურსდამთავრებულები სახელმწიფო სტანდარტი საშუალო (სრული) ზოგადი განათლება ქიმიაში, ძირითადი და პროფილის დონეზე. ქიმიის ერთიანი სახელმწიფო გამოცდის შედეგები აღიარებულია საგანმანათლებლო ორგანიზაციები მაღალი პროფესიული განათლების საშუალო პროფესიული განათლებისა და განათლების ორგანიზაციები, როგორც ქიმიის შესვლის ტესტების შედეგები. 2. კიმ Ege- ის შინაარსის განსაზღვრის დოკუმენტები 3. შინაარსის შერჩევისას კიმ Ege- ის სტრუქტურის განვითარება KIM Ege 2017- ის განვითარების საფუძველზე ქიმიაში შეადგინა ამ ზოგადი მეთოდური დამოკიდებულება, რომლებიც წინა წლების გამოცდების მოდელების ფორმირებისას გამოვლინდა. ამ პარამეტრების არსი ასეთია. 4. CIM Ege სტრუქტურა გამოკვლევის სამუშაოების თითოეული ვერსია აგებულია ერთიანი გეგმის მიხედვით: მუშაობა შედგება ორი ნაწილისაგან, მათ შორის 40 ამოცანად. ნაწილი 1 შეიცავს 35 ამოცანას მოკლე რეაგირებით, მათ შორის სირთულის ძირითადი დონის 26 ამოცანას (ამ ამოცანების რიგითი ნომრები: 1, 2, 3, 4, ... 26) და სირთულის ამაღლების დონის 9 ამოცანები ( ამ ამოცანების თანმიმდევრობა: 27, 28, 29, ... 35). ნაწილი 2 შეიცავს მაღალი ხარისხის სირთულის 5 ამოცანას, დეტალური რეაგირებით (ამ ამოცანების რიგით რიცხვები: 36, 37, 38, 39, 40).ნივთიერებების ფორმულა
რეაგენტები
კოლექციაში პასუხობს ყველა გამოცდის ვარიანტს და გადაწყვეტილებებს ერთ-ერთი ვარიანტის ყველა ამოცანას მოცემულია. გარდა ამისა, გამოყენებისათვის გამოყენებული ფორმების ნიმუშები მოცემულია რეაგირებისა და გადაწყვეტილებების აღსაწერად.
ამოცანების ავტორი არის წამყვანი მეცნიერი, მასწავლებელი და მეთოდოლოგი, რომელიც პირდაპირ მონაწილეობას იღებს EGE- ის კონტროლის საზომი მასალების განვითარებაში.
სახელმძღვანელო განკუთვნილია მასწავლებლებისთვის, რათა მოამზადოს ქიმიის გამოცდისთვის სტუდენტების მომზადება, ასევე უმაღლესი სკოლის მოსწავლეები და კურსდამთავრებულები - თვით მომზადება და თავშეკავება.
ამონიუმის ქლორიდში ქიმიური კავშირებია:
1) ionic
2) კოვალენტური პოლარული
3) არა პოლარული
4) წყალბადის
5) ლითონი
1) თუთია ქლორიდი (R-P)
2) ნატრიუმის სულფატი (RR)
3) განზავებული აზოტის მჟავა
4) კონცენტრირებული გოგირდის მჟავა
5) ალუმინის ოქსიდი
Წინასიტყვაობა
სამუშაოს შესრულების ინსტრუქცია
ვარიანტი 1
Ნაწილი 1
Მე -2 ნაწილი
ვარიანტი 2.
Ნაწილი 1
Მე -2 ნაწილი
ვარიანტი 3.
Ნაწილი 1
Მე -2 ნაწილი
ვარიანტი 4.
Ნაწილი 1
Მე -2 ნაწილი
ვარიანტი 5.
Ნაწილი 1
Მე -2 ნაწილი
ვარიანტი 6.
Ნაწილი 1
Მე -2 ნაწილი
ვარიანტი 7.
Ნაწილი 1
Მე -2 ნაწილი
ვარიანტი 8.
Ნაწილი 1
Მე -2 ნაწილი
ვარიანტი 9.
Ნაწილი 1
Მე -2 ნაწილი
ვარიანტი 10.
Ნაწილი 1
Მე -2 ნაწილი
პასუხები და გადაწყვეტილებები
პასუხები ნაწილი 1
გადაწყვეტილებები და პასუხები ნაწილი 2
ვარიანტის ამოცანების გადაწყვეტა 10
Ნაწილი 1
Მე -2 ნაწილი.
Უფასო გადმოწერა ელექტრონული წიგნი მოსახერხებელ ფორმატში, უყურეთ და წაიკითხეთ:
ჩამოტვირთეთ წიგნი EEE 2017, ქიმია, ტიპიური ტესტები, მედვედევი yu.n. - Fileskachat.com, სწრაფი და უფასო ჩამოტვირთვა.
კონტროლის საზომი მასალები
2017 წელს ერთი სახელმწიფო გამოცდის ჩატარების მიზნით
ქიმიაში