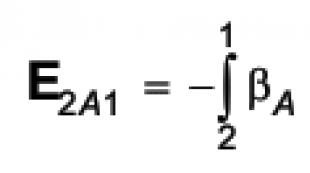Kno3 დაშლა რეაქციის ტემპერატურაზე. დნობის ალტერნატივა. II. სამოტივაციო მომენტი
უპირატესობები
განსაკუთრებით მომწონს ამ ტიპის საწვავი, რადგან ის არატოქსიკურია. იგი შედგება საკვები პროდუქტისა და სასუქისგან. ამ გზით მე არ მიწევს ზედმეტად ფიქრი მის მოპყრობაზე ან ეზოში მისი ნაწილების დაკარგვაზე. KNO3 გამოიყენება როგორც ხორცის კონსერვანტი ძეხვის წარმოებაში და მედიცინაში. ახალგაზრდობაში მივიღე KNO3 აფთიაქიდან, სადაც ბოთლებზე იყო მითითებული რა უნდა წავიღო? ჩაის კოვზი წყალში გახსნილი, როგორც შარდმდენი. ასევე ვიპოვე ჯალათში, სადაც ძეხვის წარმოებაში იყენებდნენ. და შევამჩნიე, რომ ჩემი კბილის პასტა შეიცავს KNO3, როგორც დესენსიბილიზატორი. ამრიგად, არ არის საჭირო ფიქრი ზომიერი ექსპოზიციის შესახებ და KNO3-ის მცირე რაოდენობით მიღებაც კი არ გამოიწვევს მყისიერ ზიანს ადამიანთა უმეტესობას. პეტრეს სპეციალური თხევადი სასუქის ჩანთას რომ შევხედე, შევამჩნიე, რომ სიაში პირველი იყო კალიუმის ნიტრატი. მცენარეებს უყვართ.
გაფრთხილება KNO3-ზე:
- არსებობს მტკიცებულება, რომ საკვებში ნიტრატების/ნიტრიტების გამოყენებამ შეიძლება გამოიწვიოს კიბო, და მიუხედავად იმისა, რომ KNO3-ის მოხმარება შესაძლებელია, არ არის რეკომენდებული.
- მიღების შემდეგ, კალიუმის ნიტრატი მეტაბოლიზდება კალიუმის ნიტრიტად, რაც ტოქსიკურია და განსაკუთრებით საშიშია ბავშვებისთვის! შეინახეთ ისინი მიუწვდომელ ადგილზე!
- ზოგიერთ ადამიანს უვითარდება დერმატიტი KNO3-ის ზემოქმედების შემდეგ. თუ თქვენ ხართ მგრძნობიარე ამის მიმართ, გამოიყენეთ ხელთათმანები.
- დიდი რაოდენობით KNO3 მტვრის ინჰალაციამ შეიძლება გამოიწვიოს ფილტვების დაზიანება. თუ თქვენ მოხვდებით KNO3 მტვერთან, ატარეთ შესაბამისი რესპირატორი.
სხვა კარგი რამ Rcandy-ის შესახებ:
- სტაბილურია, არ იშლება, იმ პირობით, რომ იზოლირებულია ჰაერის ტენიანობისგან
- რეფორმირებადი, შეიძლება გაცხელდეს და ჩამოყალიბდეს თითქმის ნებისმიერ ფორმაში, ან დაჭერით ფორმაში ხელის წნევით
- შესანიშნავი კომპრესიული ძალა, კარგი დაჭიმვის ძალა.
- წარმოქმნის თეთრი კვამლის მკვრივ ღრუბლებს, შეიძლება გამოყენებულ იქნას როგორც ტრასერი.
- წვის სიჩქარის კონტროლი შესაძლებელია როგორც მომზადების ტემპერატურით, ასევე დანამატების შეყვანით.
- შედარებით არამგრძნობიარეა აალების მიმართ დარტყმის ან ხახუნის გამო, შეიძლება გაბურღული, გაჭრა, ჩაქუჩით დარტყმა აალების გარეშე.*
ხარვეზები
- მე არ მომწონს ის, რომ საწვავი არის ჰიგიროსკოპიული, შთანთქავს ტენიანობას ჰაერიდან. ის ჰაერიდან უნდა იყოს დალუქული, წინააღმდეგ შემთხვევაში ის მოკლე დროში გამოუსადეგარი გახდება, განსაკუთრებით ფლორიდაში, სადაც 90% ტენიანობა ითვლება დაბალ. ასევე, ეს არის უსაფრთხოების ფაქტორი, რადგან დაკარგული საწვავის მცირე ნაჭრები დიდხანს არ იქნება აალებადი. მალე ისინი გახდებიან თხევადი, შეიწოვება მიწაში და მცენარეები შეჭამენ მას.
- ეს საწვავი გარკვეულწილად მყიფეა, ამიტომ ის უნდა იყოს განლაგებული ძრავში ისე, რომ არ გატყდეს ან დაქუცმაცდეს დამუშავების ან წვის დროს. შეშფოთება წარმოიქმნება, როდესაც შეფუთული ქვები შეიძლება გატყდეს, თუ ისინი გაფართოვდებიან და როდესაც ქვები შეიძლება მოხვდნენ ერთმანეთს. არსებობდა გარკვეული შეშფოთება, რომ ექსტრემალური აჩქარებით გამოწვეული ათვლის ძალები გაანადგურებდა ბლოკებს და ნაჭრები ჩაკეტავდა საქშენს. ძრავის კონსერვატიულ დიზაინს შეუძლია ამ შეზღუდვების კომპენსირება, მაგრამ შეიძლება შეზღუდოს გამშვები გეომეტრიის არჩევანი.
- ამ საწვავს აქვს ISP (სპეციფიკური იმპულსი) უფრო დაბალი ვიდრე ზოგიერთი სხვა საწვავი, განსაკუთრებით კომპოზიტები.
- ის წარმოქმნის ძალიან მცირე ხილულ ცეცხლს ძრავში დაწვისას. ეს უფრო ესთეტიკური საკითხია - ბევრს მოსწონს მბზინავი თეთრი ან ფერადი ცეცხლის დანახვა, კონტრალის მსგავსი. მე ჯერ კიდევ ვერ ვიპოვე დანამატი, რომელიც წარმოქმნის ხილულ ცეცხლს ან ნაპერწკალს. დენის უელჩი იტყობინება, რომ ტიტანი ქმნის ლამაზ კუდს, მაგრამ მე თვითონ უნდა შევამოწმო ეს.
- ამ საწვავის დამზადებისთვის საჭიროა ღუმელის გამოყენება, რომელიც ჩვეულებრივ მდებარეობს სამზარეულოში. ყურადღება! ეს საფრთხეს უქმნის თქვენს ბინას.
 |
გთხოვთ გაითვალისწინოთ, რომ მე არ გირჩევთ ამ საწვავის დამზადებას თქვენი სახლის სამზარეულოში. ვიმედოვნებ, რომ ერთ დღეს კარგად დოკუმენტირებული უსაფრთხოების პროგრამა შესაძლებელს გახდის სამზარეულოში ზომიერი რაოდენობით უსაფრთხოდ მომზადებას. შემთხვევითი რისკი შეიძლება არ იყოს უფრო დიდი სამზარეულოში, ვიდრე სახელოსნოში, მაგრამ შედეგები უფრო კატასტროფული იქნება. ეს ბევრს მოაგვარებს დილემას, რადგან ღუმელების უმეტესობა განლაგებულია სამზარეულოში და მათი ადვილად გადატანა შეუძლებელია. ვეძებ გზებს ამ პრობლემის გადასაჭრელად და ვიღებ ნებისმიერ წინადადებას. ამჟამად ვიკვლევ ჩაშენებული საშრობი თაროს შესაძლო გამოყენებას სახელოსნოსთვის, თერმოსტატით კონტროლირებადი გაზის გრილები სახლის გარეთ გამოსაყენებლად. ამ ხსნარებიდან არცერთი ჯერ არ არის გამოცდილი. ჩემი უპირატესობაა მობილური გაზქურის მიმაგრება პორტატული პროპანის ავზზე, როგორც ჩემს უკანა გემბანზე. |
რამდენიმე კარგი ამბავი: ცოტა ხნის წინ მოვამზადე RCandy-ის ნახევარი პარტია ჩემს სადღეგრძელოში შესაფერისი ზომის პირექსის საცხობი თასის გამოყენებით. ასე რომ, თუ არ ხართ მზად თქვენს სახელოსნოში ღუმელისთვის, ეს შეიძლება კარგი ადგილი იყოს დასაწყებად.
რეცეპტი
ამ დოკუმენტის ფოტოები არის ესკიზები, დააწკაპუნეთ მათზე უფრო დიდი ფოტოების სანახავად.
ამ გვერდზე დასაბრუნებლად დააჭირეთ ღილაკს უკან.
ინგრედიენტები:
აღჭურვილობა მოიცავს:
- 2 პირექსის 9 დიუმიანი საცხობი ტაფა
- 2 ქვის ფილა ან შუშის ფირფიტა, გამოიყენება გადასაფარებლად
- პატარა ქვაბი - მირჩევნია უჟანგავი ან მინანქარი ფოლადი, მაგრამ ვერ ვხედავ მიზეზს, რომ სხვების გამოყენება არ შეიძლება.
- ბერკეტი ან სხვა სასწორი გრამამდე ზუსტი და შეუძლია 100 გ-მდე და მეტი წონა.
- სუფრის დანა და კოვზი (სურვილისამებრ)
- საზომი კოვზი ან ჭიქა
- ღუმელი წინასწარ გახურებულ 300 გრადუს ფარენჰეიტზე (150 გრადუს ცელსიუსზე)
- ქვაბის სახელური ან სხვა
- 35 მმ ფირის კონტეინერები ან სხვა პატარა კონტეინერები, რომლებიც იქნება ჰერმეტულად და არ იშლება აალებისას. მე არასოდეს განმიცდია ამ საწვავის სპონტანური წვა, მაგრამ ვინ იცის:
ასევე აუცილებელია ცეცხლმაქრი. კარგია თუ არ გჭირდება, მაგრამ ჯობია ყოველი შემთხვევისთვის გქონდეს.
KNO3
მე ძირითადად ვიყენებ კალიუმის ნიტრატს, რომელიც შეძენილია ფეიერვერკის მომწოდებლებისგან, როგორიცაა Firefox და Skylighter. ორივე კარგია. ისინი ყიდიან KNO3-ს 2,50-დან 4,00 დოლარამდე თითო ფუნტი, ბრენდისა და დაფქვის მიხედვით. უმაღლესი ხარისხის ფხვნილები უფრო ძვირია. ყველაზე უხეში ბრენდი გამოდგება ამ პროცესისთვის, რადგან მარილის დაშლა მას ძალიან მცირე ნაწილაკებამდე აქცევს.
თაფლი კარგად მუშაობს, როგორც სიმინდის სიროფის შემცვლელი, მაგრამ საბოლოო საწვავს უფრო ჰიგიროსკოპულს ხდის, ამიტომ არ გირჩევთ. მე ცოტა ხნის წინ გამოვიყენე Honey Girl სიროფი, რომელიც არის არომატიზებული სიმინდის სიროფი, და ეს ასევე კარგად მუშაობდა. ნეკერჩხლის სიროფი არ მუშაობდა - საწვავს კარგად წვავს, მაგრამ არ წარმოიქმნება.




კონტეინერი მოთავსებულია ცეცხლზე. ეს არის ზომიერად საშიში წერტილი. ფოტოზე ნათლად ჩანს, რომ ტაფის ქვეშ არის გამათბობელი ალი. გთხოვთ, მონიშნოთ ორი განსხვავებული ფილა. ორივე მუშაობს. ზოგჯერ ვიყენებ ჩაღრმავებულ ფილებს, რომლებიც მშვენივრად მუშაობს. დარწმუნებული ვარ, რომ ეს შეიძლება გაკეთდეს ცეცხლზე. არ აქვს მნიშვნელობა როგორ გაცხელებთ ჭურჭელს, სანამ KNO3 და შაქარი იხსნება. მნიშვნელოვანია, რომ დააკვირდეთ და არ დაუშვათ ნარევი ადუღდეს ან გამოშრეს!
ბოლოს ყველაფერი იხსნება, ნარევი გამჭვირვალე ხდება. ხუთი წუთი შეიძლება გრძელი ჩანდეს, მაგრამ თქვენ უნდა უყუროთ შეუჩერებლად!
უხეშად, ნახევარი შედის თითოეულ ფორმაში. როგორც ჩანს, თითოეულ კონტეინერში ზუსტად ნახევარი უნდა ჩავყარო, მაგრამ მცირე განსხვავებები დიდი არ არის. და მე მომწონს ამის გაკეთება სწრაფად, რათა ქერქი, რომელიც სწრაფად წარმოიქმნება, არ დარჩეს ჭურჭელში, რომელსაც მე ვიყენებ, რითაც ხდება ნარევის გაუწონასწორებლობა.


 | იქმნება 10 წუთში. ბუშტები იწყებენ ფორმირებას. |
 | იქმნება 25 წუთში. კარგად ჩამოყალიბებული ბუშტები. ყოველი ყალიბის შუაში რჩება ცოტაოდენი სითხე. |
 | იქმნება 35 წუთში. სითხე არ არის, მაგრამ ფანტელები და ბუშტები მოლურჯო-თეთრია. |
 | იქმნება 40 წუთში და შემდეგ. ნარევის ფერი თანდათან იცვლება მოლურჯო-თეთრიდან სპილოს ძვლისფერამდე. ეს არ არის ნაჩვენები ფოტოზე. კიდევ ერთხელ, გაითვალისწინეთ, რომ შორეული ფორმის ოქროსფერი ფერი არის ილუზია; ორივე ნაზავი ერთი და იგივე ფერისაა, უფრო ჰგავს ახლო ფორმის ფერს. |
გაითვალისწინეთ, რომ ნარევი არ აურიოთ მომზადების დასრულებამდე. ბუშტების გატეხვა შეანელებს წყლის აორთქლებას და პროცესი შენელდება. ასე რომ, არ აურიოთ ეს ნარევი მსხვრევადობის ტესტის გაკეთებამდე.



45-ე წუთზე ფორმებს იღებენ ღუმელიდან და იღებენ მცირე ნიმუშს.
მას ბარდის ზომის ბურთულად ახვევენ, ცივ, მშრალ ზედაპირზე აბრტყელებენ და ტოვებენ გასაცივებლად, დაახლოებით 20 წამი. ფორმას აბრუნებენ ღუმელში, სანამ ნიმუში გაცივდება.




გაცივებული ნიმუში ორად არის მოხრილი. თუ ნიმუში იღუნება გატეხვის გარეშე, ნარევი კვლავ სველია და უფრო მეტხანს დასჭირდება მოხარშვა. აიღეთ ნიმუშები ყოველ სამ წუთში ან სანამ მოხრილი ნიმუში არ გაფუჭდება.
(ახლახანს აღმოვაჩინე, რომ კარგი სტრუქტურის მიღწევა შესაძლებელია ნარევში ნარჩენი ტენიანობის მცირე რაოდენობით. თუ გაცივებული ნიმუში ძნელად იღუნება, ეს შეიძლება კარგი იყოს. ამან შეიძლება შეამციროს მიღებული საწვავის სისუსტე, მაგრამ ეს ჯერ არ არის დადგენილი.)



ამ შემთხვევაში ტაფები ღუმელიდან დროულად გამოვიღე. გაცივებული ნიმუში გატეხილია სუფთად, აჩვენებს ერთგვაროვან სტრუქტურას. სინამდვილეში ის იყო ცოტა მარცვლოვანი, თითქმის მშრალი. კიდევ ხუთი წუთი და ნარევი უნდა შენახულიყო.*
*დაზოგვის მიზნით თითოეულ ტაფას დაუმატეთ 1 ჩაის კოვზი წყალი, დააფარეთ ქილა და შედგით ღუმელში 15 წუთის განმავლობაში. განაგრძეთ ტესტების მომზადება და გამეორება სასურველი სტრუქტურის მიღწევამდე.
მას შემდეგ, რაც ნარევი გაივლის მოსახვევის ტესტს, ის მზად არის და დაუყოვნებლივ უნდა დამუშავდეს. გაფხეკის დროა. ეს არის საფრთხის წერტილი, სადაც თქვენ უნდა ატაროთ ყველა დამცავი აღჭურვილობა. ხანძარი არასდროს მქონია, მაგრამ დავდებ, თუ ფანტელები აალდება, ისინი ყველა მიმართულებით გაფრინდებიან და დიდ ზიანს მიაყენებენ.



თითოეულ ფორმაში ფანტელები იჭრება და აერთიანებს ერთ კონტეინერში.



მე ვიყენებ მაგარ სუფრის კოვზს ფანტელების დასაჭერად, მოსარევად და პლასტიზირებამდე, სანამ ისინი არ დაიწყებენ კომპაქტურობას. მათ თავიდან შეიძლება წინააღმდეგობა გაუწიონ ერთმანეთთან დაკავშირებას. იყავი დაჟინებული. თუ ნარევი ძალიან მშრალი არ გაგიკეთებიათ, ეს საბოლოოდ მოხდება.
კიდევ ერთი ახალი ხრიკი: ჩაასხით ფანტელები და დაფქვით ხის ან პლასტმასის ჩაქუჩით. ეს გამოიწვევს მათ შეკუმშვას ნაკლები ძალისხმევით, ვიდრე უბრალოდ მორევა და გაწურვა.

ერთი-ორი წუთის გაგრილების შემდეგ, საწვავი ჯერ კიდევ ცხელია, მაგრამ შეიძლება საჭირო გახდეს მსუბუქად დამუშავება. მე მას ერთი ხელიდან მეორეზე გადავცემ, რომ ნერვულ უჯრედებთან კარგი ურთიერთობა შევინარჩუნო.

აქ მე ვწყვეტ პატარა ნიმუშს და ვახვევ ჯოხად. გაითვალისწინეთ, რომ დაფა დაფარულია ქსოვილით. გლუვი დასრულება ქმნის ამ საწვავის შესანიშნავ დახრილ ზედაპირს.

შეგიძლიათ გააბრტყელოთ თიხის მსგავსად ლამაზ ჩხირებად. ის გამკვრივდება ზუსტად ისე, როგორც თქვენ გააბრტყელეთ, ინარჩუნებს დანიშნულ ფორმას.




საწვავის უფრო მჭიდროდ დაწურვით შემიძლია ფილებით დავფარო. ეს საშუალებას მაძლევს უფრო დიდხანს შევინარჩუნო თბილი და რბილი. ღუმელის ტემპერატურა მცირდება 200 F-მდე (93 C). ამ ტემპერატურაზე საწვავი შეიძლება დიდხანს დარჩეს რბილი დაშლის გარეშე.
საწვავის ხელით დაწურვის ალტერნატივა: გამოიყენეთ კვების პროცესორი! ის შეიძლება განთავსდეს გარეთ ან ძალიან უსაფრთხო ადგილას. ვაერთებ კომბაინს გამოუყენებელ გაფართოებულ კაბელში და შემდეგ ვაერთებ გაფართოების კაბელს ქსელში უსაფრთხო მანძილზე. მე არასოდეს მქონია შემთხვევითი ხანძარი, მაგრამ ყოველთვის არის შანსი.










დაახლოებით 1 წუთის შემდეგ, საწვავი ხდება ბურთი. თუ კმაყოფილი ვარ, მანქანას ვთიშავ და საწვავს ვიღებ. როგორც წესი, ვახვევ პატარა ბურთულებად, რომლებიც გაცივდება და მჭიდროდ დახურულ კონტეინერშია მოთავსებული.
მე ყოველთვის ვინახავ ნაწილებს წნელების გასაკეთებლად წვის სიჩქარის შესამოწმებლად.





საწვავის ნაწილს ხელით ახვევენ 1/4 დიუმიანი დიამეტრის ღეროში. 1 ინჩის სიგრძის ნაჭერს ჭრიან და ერთ ბოლოს ცეცხლს უკიდებენ. ამ ფორმას საწვავის ღერო ეწოდება. თქვენ არ გჭირდებათ პროპანის ჩირაღდნის გამოყენება ანთებისთვის, ის უბრალოდ სტაბილური ალის კარგი წყაროა და ერთ ხელს ტოვებს მავთულის დასაჭერად, მეორეს კი წამზომის დასაჭერად.
წამზომს ვიწყებ, როცა საწვავი აანთებს და ვაჩერებ როცა დაიწვება. ვინაიდან საწვავი იწვის ერთი ბოლოდან მეორემდე, ეს მნიშვნელობა იქნება ჰაერში საწვავის წვის სიჩქარე. ეს ნიმუში დაწვა ინჩი 11 წამში, რაც საშუალოა საწვავის მსუბუქი ადიდებისთვის. ზოგიერთი ნიმუში იწვის ინჩის 8 ან 9 წამში. ის უფრო სწრაფად დაიწვება წნევის ქვეშ, როგორც სარაკეტო ძრავა.

კვერთხი გაცივდა, ამიტომ ვტეხავ ნაჭრებად და ვათავსებ ფირის ყუთებში. ჰერმეტულ კონტეინერში საწვავის შენახვა შესაძლებელია წლების განმავლობაში. მე ვიყენებ ამ ?-ინჩის ჯოხებს მორევებისა და მიკრორაკეტებისთვის.
მკაფიოდ მონიშნეთ თითოეული კონტეინერი და მოათავსეთ უსაფრთხო ადგილას.
ამ საწვავის, ალბათ, ყველაზე ღირსშესანიშნავი თვისება ის არის, რომ მისი ხელახლა გაცხელება და ნებისმიერი ფორმის ფორმირება შესაძლებელია. შედგით 200 F (93 C) გახურებულ ღუმელში, სანამ არ გაცხელდება, ის არ მიიღებს ნაყენის კონსისტენციას და შეიძლება ხელით თიხის მსგავსი ფორმა მიიღოს. ხელის მსუბუქმა წნევამ შეიძლება მას მატრიცის (ყალიბის) ფორმა მისცეს.

მაგალითად, მე გავაკეთებ საწვავის ბომბს ძრავისთვის. ეს არის უბრალოდ ცილინდრული ბლოკი 5/8" დიამეტრით 1/8" ნახვრეტით და იწონის 10 გრამს. იგი გამოიყენება FFFG მარცვლის ზომის შავ კომერციულ ფხვნილთან ერთად. 
დავჭრათ ნაჭერი, რომლის წონაა დაახლოებით 10 გრამი ან ცოტა მეტი. 
გადაახვიეთ ცილინდრში ძრავის კორპუსის ზომის დიამეტრით. ამ შემთხვევაში, მილის დიამეტრი 5/8 ინჩი იყო.

მოათავსეთ შავი ფხვნილის დოზა მოძრავ დაფაზე, შემდეგ გადაახვიეთ მასზე საწვავი, რათა მარცვლები დარჩეს. თუ ისინი არ წებოვანა, შედგით საწვავი ღუმელში 200 F (93 C) ტემპერატურაზე რამდენიმე წუთის განმავლობაში, სანამ ისევ არ დარბილდება.

გააკეთეთ ხვრელი საწვავის დამუხტვის შუაში. გააკეთეთ ის საკმარისად დიდი თქვენი აალებადი. აქ ბამბუკის შამფურებს ვიყენებ, იგივე შიშ ქაბაბს ან ტემპურას. ამ ჩხირებს ბევრ რამეში ვიყენებ:

ახლა ვცდილობ ბლოკის ჩასმა 5/8 დიუმიანი დიამეტრის მილში. ეს ნაჭერი ძალიან დიდია.

ასე რომ, მე კვლავ ვტრიალებ. საწვავი ოდნავ გამაგრდა და, შესაბამისად, შეიძლება უფრო ზუსტად დაიბრუნოს.

აქ არ არის ნაჩვენები, მაგრამ მე ავწონე ეს ტაბლეტი და იწონიდა 12 გრამს. ეს თითქმის აუცილებლად გაანადგურებს გარსაცმს, ამიტომ ცალი ბასრი დანით დავჭრა. ამის შემდეგ წონა იყო 10,2 გრამი. Საკმაოდ ახლოს.


ახლა ყველაფერი კარგადაა, უბრალოდ მოათავსეთ იგი 5/8 დიუმიან მილში.


იმის გამო, რომ მე არ გამოვიყენებ ამ ქამას დაუყოვნებლივ, ვათავსებ მას ფირის ყუთში. ამ ჩამოტვირთვის დანარჩენთან ერთად. უბრალოდ გააკეთეთ სიმსივნეები და საწვავი, მოათავსეთ ისინი თბილ კონტეინერებში და მჭიდროდ დახურეთ. მოათავსეთ კონტეინერები გვერდებზე, სანამ არ გაგრილდება. თუ ეს არ გაკეთდა, საწვავი ჩაედინება ფსკერამდე და გამაგრდება და მის ამოღებას დიდ დროს დახარჯავთ.
ჯიმი იონი
5/26/01
rev 6/5/03
თარგმნა ინკუბუსმა
მთარგმნელის შენიშვნები
1. ეს ტექნოლოგია ითარგმნება და გამოქვეყნებულია ავტორის კეთილი ნებართვით.
2. მისი მთლიანად ან ნაწილობრივ ხელახლა დაბეჭდვისას, ორიგინალური წყაროს ბმული (WWW.JAMESYAWN.COM) სავალდებულოა.
3. თარგმანი ძირითადად მგრძნობიარეა და არა პირდაპირი. განსაკუთრებული ყურადღება დაეთმო ტექნოლოგიასა და უსაფრთხოებას.
ვულკანური თერმიტი (რკინის ოქსიდის Fe 3 O 4 და ალუმინის ნარევის წვა)
(№ 4 2009)
1898 წელს გერმანელმა მეტალურგიელმა ინჟინერმა ჰანს გოლდშმიდტმა გამოიგონა ლითონების დნობის მეთოდი მათი ოქსიდებიდან ალუმინის, როგორც შემცირების აგენტის გამოყენებით. ამ მიზნით გამოიყენებოდა ალუმინის და ლითონის ოქსიდის ფხვნილების ნარევი, რომელსაც მეცნიერმა თერმიტი უწოდა (ბერძნულიდან "თერმე" - სითბო, სითბო).
Fe 3 O 4-ისა და ალუმინის თერმიტის შემთხვევაში ვითარდება დაახლოებით 2400°C ტემპერატურა და თავად ეს რეაქცია იწყება, როცა ტემპერატურა 1000°C-ს მიაღწევს. თერმიტის გამოყენებით ლითონების წარმოების მეთოდს ეწოდა ალუმინოთერმია, ხოლო ლითონის ოქსიდისა და ალუმინის ფხვნილების ნარევს გოლდშმიდტის თერმიტი. ალუმინოთერმია არის მეტალოთერმიის განსაკუთრებული შემთხვევა, რომელიც აღმოაჩინეს 1856 წელს. ნ.ნ. ბეკეტოვი.
დღეს ცნობილია მრავალი განსხვავებული თერმიტის შემადგენლობა. არა მარტო ალუმინს, არამედ მაგნიუმს, კალციუმს, ფეროსილიციუმს, ბორი, ბორიდებს, სილიციუმს, ტიტანს და ა.შ. შეუძლია შემამცირებელ აგენტად იმოქმედოს. დაჟანგვის სახით ასევე გამოიყენება დაბალაქტიური ლითონების ფტორიდები ან ქლორიდები და ტეფლონიც კი (ფტორპლასტიკური-4). აგენტები. თერმიტები გამოიყენება არა მხოლოდ ლითონების მოსაპოვებლად, არამედ შედუღებისთვის და ასევე, როგორც სამხედრო ცეცხლგამჩენი ნარევები.
ახლა ჩვენ განვახორციელებთ თერმიტის Fe 3 O 4 + Al-ის წვის რეაქციას, რომელიც გარეგნულად წააგავს ვულკანური კრატერიდან ლავის ამოფრქვევას. ექსპერიმენტისთვის, მდინარის სრულიად მშრალი ქვიშა ჯერ მზადდება ღუმელში ან უბრალოდ ღუმელში 200°C-ზე გაშრობით. ამავდროულად გააშრეთ პატარა კერამიკული ქვაბი. ლითონის ფართო კონტეინერი (აუზი, ტაფა და ა.შ.) ივსება მშრალი ქვიშით, ზემოდან კი თიხის ყვავილების ქოთანი დამაგრებულია სამფეხის რგოლში და მისი ქვედა ხვრელი დაფარულია ფილტრის ფურცლით. რკინის ოქსიდის Fe 3 O 4 და ალუმინის გამხმარი ფხვნილები შერეულია წონით 3:1 თანაფარდობით. აიღეთ არაუმეტეს 200 გ ამ ნარევიდან - ტერმიტი (დაახლოებით 50 გ Al და დაახლოებით 150 გ Fe 3 O 4) და ჩაასხით ქვაბში მოცულობის 3/4-მდე. თერმიტის ნარევის მოსამზადებლად არ უნდა გამოიყენოთ ალუმინის ფხვნილი ალუმინის ფხვნილის ნაცვლად.. ალუმინის ფხვნილი შეიცავს დაჟანგულ ალუმინს, რომელიც მნიშვნელოვნად აფერხებს რეაქციის დაწყებას. მაგრამ მთავარი უბედურება ის არის, რომ ალუმინის ფხვნილი შეიცავს უამრავ ჰაერს და ეს იწვევს ძალიან ცხელი ნარევის ძლიერ გაფრქვევას.
ქვაბში ჩასხმულ თერმიტის ნარევში გააკეთეთ ჩაღრმავება ცენტრში და მოათავსეთ მასში დაუკრავენ - მაგნიუმის ლენტის ნაჭერი, წვრილმარცვლოვანი ქვიშა. გრძელი ნატეხის გამოყენებით ანთებენ მაგნიუმის ზოლს და სწრაფად შორდებიან 2-3 მ მანძილზე, მას შემდეგ რაც დაუკრავენ დაიწვება, იწყება ძალადობრივი რეაქცია. ქოთნის ზემოთ ჩნდება ცეცხლი და კვამლი, მისგან გამოფრინავს ნარევის ცხელი ნაწილაკები, ხოლო რეაქციის შედეგად წარმოქმნილი გამდნარი რკინის ნაკადი ქვედა ხვრელიდან გამოდის:
8Al + 3Fe 3 O 4 = 6Fe + 4Al 2 O 3
ალუმინი რკინაზე უფრო რეაქტიული ლითონია, ამიტომ ის ჟანგბადს ართმევს რკინის ოქსიდს და გადაიქცევა ალუმინის ოქსიდად. როცა გამდნარი რკინა გაცივდება, მიღებულ მძივს აშორებენ ქვიშას და ასუფთავებენ წიდას - ალუმინის ოქსიდს.
ახლა აშკარა ხდება, რატომ უნდა იყოს ქვიშა მთლიანად მშრალი. წყალი აორთქლდება სველი ქვიშიდან და დნობის რკინის წვეთები დაიწყებს ღვარცოფს. ამ შემთხვევაში გამოცდილება უკიდურესად საშიში გახდება.
თუ ექსპერიმენტს გარეთ ჩაატარებთ, მაშინ რკინის თუნუქის ქილა, რომელიც ჩაფლულია ქვიშაში, ასევე იმუშავებს როგორც ერთჯერადი რეაქციის ჭურჭელი.
Fe 3 O 4 შეიძლება მივიღოთ ამიაკის ხსნარის ჭარბი მოქმედებით ხსნარზე, რომელიც შეიცავს თანაბარი რაოდენობით Fe(II) და Fe(III) მარილებს. წარმოიქმნება ნალექი, მას ფილტრავენ, რეცხავენ წყლით, აშრობენ და კალცინებენ დაახლოებით 200°C-ზე.
__________________________________________________
კალიუმის ნიტრატი არის არაორგანული ორობითი ნაერთი, რომელიც წარმოდგენილია ფორმულით KNO 3, ასევე ცნობილია როგორც კალიუმის ნიტრატი, კალიუმის ნიტრატი, კალიუმის ნიტრატი. KNO 3 ნაერთი არის უფერო კრისტალური ფხვნილი, არამდგრადი, უსუნო და აქვს ჰიგიროსკოპიული თვისებები. ნივთიერება წყალში ძალიან ხსნადია. არ არის ტოქსიკური ცხოველებისთვის. ბუნებაში ნივთიერება KNO 3 გვხვდება მინერალური ნიტროკალიტის სახით, რომლის ყველაზე დიდი საბადოები გვხვდება აღმოსავლეთ ინდოეთში და ჩილეში. ის მცირე რაოდენობით გვხვდება მცენარეებსა და ცხოველურ ორგანიზმებში.
კალიუმის ნიტრატის მიღების ქიმიური თვისებები და მეთოდები
კალიუმის ნიტრატი KNO 3 იშლება 400°C ტემპერატურაზე და წარმოიქმნება კალიუმის ნიტრიტი KNO 2 და ჟანგბადი O 2 . ეს ნივთიერება მოქმედებს როგორც ძლიერი ოქსიდიზატორი და რეაგირებს აალებადი მასალებთან და შემამცირებელ აგენტებთან. ნივთიერება KNO 3 მცირდება წყალბადით გათავისუფლების დროს.
ლაბორატორიულ პირობებში KNO 3 მიიღება კალიუმის Ca(NO 3) 2 და კალციუმის ნიტრატის K 2 CO 3 რეაქციით, რაც ამ ნივთიერების წარმოების უძველესი მეთოდია. ამჟამად კალიუმის სულფატი K 2 SO 4 გამოიყენება კალიუმის ნაცვლად. ამავე რეაქციით მიიღება კალიუმის ნიტრატის ხსნარი. კალიუმის ნიტრატის KNO 3 წარმოების თანამედროვე მეთოდებს შორის, კალიუმის ქლორიდის KCl და ნატრიუმის ნიტრატის NaNO 3 რეაქცია უფრო ხელმისაწვდომი და იაფია.
კალიუმის ნიტრატის გამოყენების სფეროები
კალიუმის ნიტრატი KNO 3, ისევე როგორც კალიუმის ნიტრატის ხსნარი, გამოიყენება სასუქად (კალიუმით მდიდარი ერთ-ერთი აზოტიანი სასუქი, რომელიც მცენარის ზრდისთვის აუცილებელი კომპონენტია). ნივთიერება ასევე გამოიყენება ელექტრო ვაკუუმის ინდუსტრიაში, მეტალურგიაში, ოპტიკური მინის დნობისა და დენთის წარმოებაში.
კალიუმის ნიტრატის კვებითი თვისებები
კალიუმის ნიტრატი ფართოდ გამოიყენება კვების მრეწველობაში, როგორც საკვები დანამატი E252, კლასიფიცირებული, როგორც კონსერვანტი.
კონსერვანტები არის ქიმიური ნივთიერებები, საკვები დანამატები E200 - E299, რომლებიც თრგუნავენ პროდუქტში მიკროორგანიზმების ზრდას, ასევე ხელს უშლიან პროდუქტის უსიამოვნო სუნისა და გემოს გაჩენას, ობის პროცესების განვითარებას და მიკრობული წარმოშობის ტოქსინების წარმოქმნას. .
კალიუმის ნიტრატი გამოიყენება წარმოებაში:
- ყველი (მყარი, ნახევრად მყარი, რბილი);
- რძეზე დაფუძნებული ყველის ანალოგები;
- ძეხვეული და ხორცპროდუქტები (დამარილებული, მოხარშული, შებოლილი), დაკონსერვებული ხორცი;
- თევზის პროდუქტები (ქაშაყი, დამარილებული და მარინირებული შპრატი);
- ბატის ღვიძლის პროდუქტები.
 საკვები დანამატი ასევე არის ფერის ფიქსატორი. ნივთიერება ემატება საკვებ პროდუქტებს, რათა პროდუქტის მიმზიდველი გარეგნობა შეინარჩუნოს უფრო ხანგრძლივი დროის განმავლობაში. აქვს სუსტი ანტიბაქტერიული ეფექტი.
საკვები დანამატი ასევე არის ფერის ფიქსატორი. ნივთიერება ემატება საკვებ პროდუქტებს, რათა პროდუქტის მიმზიდველი გარეგნობა შეინარჩუნოს უფრო ხანგრძლივი დროის განმავლობაში. აქვს სუსტი ანტიბაქტერიული ეფექტი.
კალიუმის ნიტრატის გავლენა სხეულზე
კალიუმის ნიტრატი წარმოქმნის კანცეროგენულ ეფექტს - ავთვისებიანი სიმსივნეების განვითარებას გარე ფაქტორების გავლენის ქვეშ. თუმცა, რეკომენდებული დოზებით, E252 არ ახდენს მავნე ზემოქმედებას ზრდასრული ადამიანის ორგანიზმზე. ნიტრატების უარყოფითი გავლენა აიხსნება ადამიანის ორგანიზმში მათი გარდაქმნით ნიტრიტებად (კალიუმის ნიტრატის უკონტროლო გადაქცევა ნიტრიტებად ხდება საკვებ პროდუქტებში) და კანცეროგენულ ნიტროზამინებად. საკვები დანამატებით ორგანიზმში შემავალი ნიტრატების რაოდენობა, კერძოდ, E252-ით, უმნიშვნელოა ამ ნივთიერებების შემცველობასთან შედარებით სასმელ წყალში, ასევე ბოსტნეულში (გადაჭარბებული განაყოფიერების შედეგად).
E252-ის ხანგრძლივმა ზემოქმედებამ სხეულზე მცირე დოზებით შეიძლება გამოიწვიოს შემდეგი სიმპტომებისა და დაავადებების განვითარება:
- მუცლის ძლიერი ტკივილი
- სისუსტე
- თავბრუსხვევა
- ფსიქიკური დარღვევები
- სივრცეში ორიენტაციის დარღვევა
- არითმია
- თირკმლის ანთება
- ანემია
ლეგალური ინფორმაცია
კალიუმის ნიტრატი, როგორც საკვები დანამატი, დამტკიცებულია საკვების წარმოებაში გამოსაყენებლად რუსეთის ფედერაციასა და უკრაინაში, ასევე ევროკავშირის ქვეყნებში.
უკან წინ
ყურადღება! სლაიდების გადახედვა მხოლოდ საინფორმაციო მიზნებისთვისაა და შესაძლოა არ წარმოადგენდეს პრეზენტაციის ყველა მახასიათებელს. თუ გაინტერესებთ ეს ნამუშევარი, გთხოვთ გადმოწეროთ სრული ვერსია.
სწავლაში წარმატება დამოკიდებულია ბავშვის სწავლის სურვილზე. ქიმიის შესწავლის მოტივაციის ამაღლების მიზნით ვიყენებ სწავლების სხვადასხვა ტექნოლოგიებს, რომლებიც საშუალებას აძლევს მოსწავლეებს ჩაერთონ აქტიურ შემეცნებით პროცესში.
გაკვეთილის მიზნები:
- ქიმიური რეაქციების, მათი ნიშნებისა და წარმოშობის პირობების შესახებ მოსწავლეთა ცოდნის კონსოლიდაცია და გაფართოება;
- დაშლის რეაქციების დანერგვა და ქიმიური რეაქციების განტოლებების შედგენის უნარის გამომუშავება;
- განაგრძეთ სტუდენტების კოეფიციენტების დადგენის უნარის პრაქტიკა;
- განაგრძეთ მოსწავლეთა უნარის გამომუშავება ამოცანების გადაჭრის ქიმიური რეაქციების განტოლებების გამოყენებით;
- განაგრძეთ დაკვირვებისა და შედარების უნარების განვითარება;
- ქიმიური კულტურის ჩამოყალიბება, სხვების მოსმენის უნარი კლასში, ჯგუფში მუშაობისას.
აღჭურვილობა:
- საჩვენებელი ექსპერიმენტებისთვის: მაშები, ნატეხი, ალკოჰოლური ნათურა, კრისტალური KNO 3, ნახშირი, HNO 3 (კონს.), H 2 O 2, MnO 2., ლაბორატორიული სადგამი ფეხით;
- კომპიუტერი, პროექტორი, პრეზენტაცია „დაშლის რეაქციები“.
გაკვეთილების დროს
I. საორგანიზაციო მომენტი.
II. სამოტივაციო მომენტი.
ყველაზე საინტერესო ჩვენს ირგვლივ სამყაროში არის ის, რომ ის ძალიან რთული და, უფრო მეტიც, მუდმივად იცვლება. ყოველ წამს მასში უთვალავი ქიმიური რეაქცია ხდება, რის შედეგადაც ზოგიერთი ნივთიერება სხვაში გარდაიქმნება. კაცმა ამოისუნთქა - და ორგანიზმში ორგანული ნივთიერებების ჟანგვის რეაქციები დაიწყო. მან ამოისუნთქა - და ნახშირორჟანგი შევიდა ჰაერში, რომელიც შემდეგ შეიწოვება მცენარეებით და გადაიქცა ნახშირწყლებად. ჩვენ შეგვიძლია პირდაპირ დავაკვირდეთ ზოგიერთ რეაქციას, მაგალითად, რკინის საგნების დაჟანგვას, სისხლის შედედებას და მანქანის საწვავის წვას. თუმცა, ქიმიური პროცესების აბსოლუტური უმრავლესობა რჩება უხილავი, მაგრამ ისინი განსაზღვრავენ მიმდებარე სამყაროს თვისებებს. ნივთიერებების ტრანსფორმაციების გასაკონტროლებლად, საჭიროა საფუძვლიანად გავიგოთ ასეთი რეაქციების ბუნება. ჩვენი ამოცანა, ნივთიერების თვისებების შესწავლით, არის ვისწავლოთ მიღებული ცოდნის გამოყენება კაცობრიობის სასარგებლოდ.
III. ცოდნის განახლება.
- რა ვიცით ქიმიური რეაქციების შესახებ? (სლაიდი 2)
- რა პირობებია საჭირო ქიმიური რეაქციის დასაწყებად? (სლაიდი 3)
- რა ნიშნები ახასიათებს ქიმიურ რეაქციას? (სლაიდი 4)
- მიეცით ქიმიური რეაქციების მაგალითები.
დასკვნა:არსებობს მრავალი ქიმიური რეაქცია. ისინი მუდმივად ჟონავს. რა უნდა გაკეთდეს იმისათვის, რომ თავიდან ავიცილოთ დაბნეულობა ამ მრავალფეროვან ქიმიურ რეაქციაში?
ისწავლეთ ქიმიური რეაქციების კლასიფიკაცია.
დაშლის რეაქციის ცნების შესავალი.
1. იხილეთ მულტიმედია „წყლის ელექტროლიზი“(ქიმიის შესახებ ვიდეოების ციფრული მონაცემთა ბაზა). დანართი 2
შემდეგ, საუბრის დროს, გააკეთეთ შენიშვნა:
წყალი → წყალბადი + ჟანგბადი
2H 2 O 2H 2 + O 2
2. საჩვენებელი ექსპერიმენტები.
ა) კალიუმის ნიტრატის დაშლა. KNO 3 მოთავსებულია სინჯარაში, სინჯარას ამაგრებენ სადგომში და თბება - მარილი სწრაფად დნება და იქცევა სქელ სითხეში. ჩაყარეთ ცხელი ნახშირი დნობაში; ქვანახშირი საცდელ მილში კიდევ უფრო ცხელდება და იწყებს ხტუნვას, ურთიერთქმედებს ჟანგბადთან.
2KNO 3 2KNO 2 + O 2 (სლაიდი 5)
ბ) სპილენძის(II) ჰიდროქსიდის დაშლა. საცდელი მილი გააცხელეთ Cu(OH) 2-ის ახლად მიღებული ნალექით - წარმოქმნილი სპილენძის(II) ოქსიდის გამო გაშავდება.
Cu(OH) 2 CuO + H 2 O (სლაიდი 6)
გ) წყალბადის ზეჟანგის დაშლა კატალიზატორის გამოყენებით (MnO 2, უმი სტაფილო, კარტოფილი).
H 2 O 2 2H 2 O + O 2 (სლაიდი 7)
დ) ვერცხლისწყლის (II) ოქსიდის დაშლა. ჯ.პრისტლის გამოცდილება
2HgO 2Hg + O2 (სლაიდი 8)
განხილული საკითხები:
- რა საერთო აქვს ყველა ამ რეაქციას? (სლაიდი 9)
- რა განსხვავებაა მათ შორის?
- როგორ შეიძლება, ერთი სიტყვით ვუწოდოთ მიმდინარე პროცესები? (სლაიდი 9)
- რა პირობებია საჭირო ამ რეაქციების განვითარებისთვის? (სლაიდი 9)
1. მიმდინარეობს ნივთიერებების დაშლის პროცესი (დაშლის რეაქცია). ყველა რეაქციაში ერთი ნივთიერება რეაგირებს და წარმოიქმნება ორი ან მეტი ახალი ნივთიერება: მარტივიც და რთულიც. შეეცადეთ ჩამოაყალიბოთ დაშლის რეაქციის განმარტება.
2. როგორც წესი, თითქმის ყველა დაშლის რეაქცია არის ენდოთერმული რეაქცია, რადგან რეაქციის დასაწყებად საჭიროა გარკვეული პირობები: გათბობა, ელექტრული დენი და სხვა ნივთიერებების - კატალიზატორების არსებობა, რომლებიც აჩქარებენ რეაქციას. (სლაიდი 10)
კატალიზატორები მანქანებში. (სლაიდი 11)
- მილიონობით მანქანა ყოველდღიურად სარგებლობს გზებით და თითოეული მათგანი ჰაერის დაბინძურების წყაროა. ეს განსაკუთრებით იგრძნობა დიდ ქალაქებში, სადაც მანქანების გამონაბოლქვმა შეიძლება დიდი პრობლემები შექმნას.
- თანამედროვე მანქანებს აქვთ კატალიზატორი ან მანქანის კატალიზატორი . საავტომობილო კატალიზატორის ამოცანაა გამონაბოლქვი აირებში მავნე ნივთიერებების რაოდენობის შემცირება. Მათ შორის:
- ნახშირბადის მონოქსიდი (CO) არის შხამიანი, უფერო და უსუნო აირი.
- ნახშირწყალბადები, ასევე ცნობილი როგორც აქროლადი ორგანული ნაერთები, ერთ-ერთი მთავარი კომპონენტია სმოგი , წარმოიქმნება საწვავის არასრული წვის გამო
- აზოტის ოქსიდები (NO და NO2) ასევე კომპონენტია სმოგი , და მჟავე წვიმა , გავლენა ლორწოვანი გარსი პირი.
კატალიზატორები ბუნებით ყველგან არიან. საკმარისია ითქვას, რომ ცოცხალ ორგანიზმებში ნივთიერებების ყველა ტრანსფორმაცია ხდება ბუნებრივი კატალიზატორების მონაწილეობით - ფერმენტები და ამიტომ არ საჭიროებს მაღალ ტემპერატურას. ეს ძალიან მნიშვნელოვანია - წინააღმდეგ შემთხვევაში შეიძლებოდა ქიმიურ რეაქციებს მოქმედი ცოცხალი ქსოვილების მოხარშვა, სპეციალური „ბიოლოგიური“ კატალიზატორების - ფერმენტების გარეშე - არც გემრიელი პური მიიღება, არც მადისაღმძვრელი ყველი და არც მჟავე კომბოსტო. დაჭრილი ვაშლი ჰაერში ბნელდება, რადგან ფერმენტი პოლიფენოლ ოქსიდაზა აჩქარებს ნაყოფის უჯრედებში ნაპოვნი ორგანული ნივთიერებების, პოლიფენოლების დაჟანგვას. როდესაც ჭრილობას წყალბადის ზეჟანგით ასხამენ, წყალბადის ზეჟანგი "ადუღდება" - ის სწრაფად იშლება წყალში და ჟანგბადში სისხლში ნაპოვნი კატალაზას ფერმენტის გავლენის ქვეშ. ორგანიზმს კატალაზა სჭირდება წყალბადის ზეჟანგის გასანადგურებლად, რომელიც წარმოიქმნება უჯრედული სუნთქვის დროს.
საჭმლის მომნელებელი წვენები შეიცავს ათობით ფერმენტს: ლიპაზებს, რომლებიც ცხიმებს გლიცეროლად და ორგანულ მჟავებად ანაწილებენ; პროტეაზები, რომლებიც ანადგურებენ ცილებს და ა.შ.
კატალიზატორები ასევე გამოიყენება ქიმიურ ინდუსტრიაში სხვადასხვა ნივთიერებების სინთეზში, მათ შორის ისეთი მნიშვნელოვანი ქიმიური პროდუქტების ჩათვლით, როგორიცაა ამიაკი NH 3 და გოგირდის მჟავა H 2 SO 4.
კატალიზატორები ყველაზე საჭირო ნივთიერებებს შორისაა, თუმცა ხანდახან ამაზე ბევრს არ ვფიქრობთ.
ქიმიურ რეაქციებს, რომლის შედეგადაც სითბო შეიწოვება, ეწოდება ენდოთერმული.(სლაიდი 12)
ნივთიერებები, რომლებიც ცვლის ქიმიური რეაქციის სიჩქარეს, მაგრამ არ მოიხმარენ რეაქციის შედეგად, ეწოდება კატალიზატორები.(სლაიდი 12)
IV. კონსოლიდაცია.
დაასრულეთ დავალებები.
(სლაიდი 13)
- დაალაგეთ კოეფიციენტები დიაგრამების რეაქციის განტოლებად გადაქცევით. განსაზღვრეთ თქვენი ვარიანტის დაშლის რეაქცია. მიეცით განმარტება.
| ვარიანტი 1 CuO + H 2 → Cu + H 2 O CO + O 2 → CO 2 AI + CI 2 → AICI 3 CaCO 3 → CaO + CO 2 |
ვარიანტი 2 HCI + AI → AICI 3 + H 2 Na 2 O + H 2 O → NaOH KCIO 3 → KCI + O 2 Na + H 2 → NaH |
- დავალება.განსაზღვრეთ ნივთიერების რაოდენობა და ერთ-ერთი რეაქციის პროდუქტის მასა, თუ რეაქციის შედეგად დაიშალა ნივთიერების 2 მოლი.
V. საშინაო დავალება§ 27, ყოფილი. 1, 2 გვ. 155 (სლაიდი 14).
VI. გამოყენებული წიგნები:
- გაბრიელიან ო.ს.„ქიმია“.მე-8 კლასი. სახელმძღვანელო.
- ო.ს. გაბრიელიანი, ნ.პ. ვოსკობოინიკოვა, A.V. Yashukova„ქიმია“, მე-8 კლასი. მასწავლებლის სახელმძღვანელო. M.: Bustard, 2002 წ.
- O.S. გაბრიელიანი, T.V. სმირნოვა.მე-8 კლასში ვსწავლობთ ქიმიას.
- ლ.იუ. ალიკბეროვა”გასართობი ქიმია: წიგნი სტუდენტებისთვის, მასწავლებლებისთვის და მშობლებისთვის”, M.: AST - PRESS, 1999 წ.
- ენციკლოპედია ბავშვებისთვის. ტომი 17. ქიმია. მ.: ავანტა +, 2000 წ.
- ინტერნეტ მასალები.