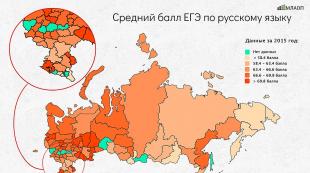
Kako se održava titracija. Odjeljak III. Kalkulacije u Tiptimetrijskoj analizi. Priprema standardnih rješenja
Instalacija naslova - jedna od najvažnijih operacija laboratorijske tehnologije. Iz ispravnosti pripreme pod nazivom rešenje je zavisivanje rezultata analize. Ne treba zaboraviti da, na primjer, u tvornici na osnovu analize podataka, kontrole tokom tehnološkog procesa i pogrešne analize može biti jedna ili neke druge komplikacije. Budući da je svaka analiza gotovo uvijek u pratnji titracije, svaki laboratorijski radnik mora naučiti tehniku \u200b\u200bprovođenja ove operacije.
Potrebno je zapamtiti nekoliko pravila vezanih za pod nazivne rješenja.
1. Nazovljena rješenja moraju biti svježa. Dugoročno skladište ne bi trebalo biti dozvoljeno. Za svako rješenje postoji rok za skladištenje.
2. Titrirana rješenja kada stojite promijenite svoj titar, pa bi ih ponekad trebali provjeriti. Ako naprave posebno odgovorna analiza, potreban je test rješenja.
3. Naslovna rješenja na kojima se svjetlosni djeluje - (AGNO3 rješenja itd.), Trebaju se pohraniti u žutim bocama ili u takvoj tome što bi zaštitilo rješenje iz djelovanja svjetlosti.
4. Prilikom pripreme minobacača manganskog kalijuma, Titer treba instalirati ne prije 3-4 dana nakon kuhanja. Isto se odnosi i na sva ostala rješenja koja su sposobna mijenjati s vremenom ili kada se kontakt sa zrakom, staklom itd.
5. Titalni alkalisovi rješenja su bolja za skladištenje u bocama prekrivenim unutar parafina, kao i zaštititi ih od djelovanja diznog ugljičnog dioksida (Chlobe cijev sa natronskim vapnom ili asca-rit),
6. Sve boce sa pod nazivim rješenjima moraju imati jasan natpis koji ukazuje na supstancu, normalnost, ispravke, vrijeme izrade rješenja i datuma provjere testa.
7. U titriranju kiselih ili alkalnih rješenja korisno je primijeniti takozvanu rješenje svjedoka.
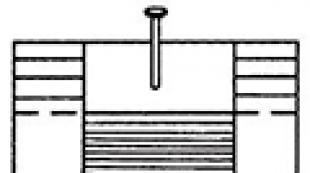
Tokom titracije, tikvica mora biti ostavljena, i desna ruka Upravljajte gardom zarge, dajete li tečnost u jednolično. Kad je titracija vrlo velika važnost Ima brzinu toga. Stoga, kada je ponovljena titracija istog rješenja, potrebno je da brzina dodavanja rješenja iz Burete je moguća ista, I.E., određena količina tekućine u isto vrijeme. Položaj ruku kada je titracija prikazana na slici. 352.
Vrlo je prikladno za miješanje rješenja na titla "za promjenu magnetske miješalice. U ovom slučaju titriranje se može izvesti i u konvencionalnoj koničnoj tikvici i u posebnom, prilagođenom za titraciju tekućine za cijelu temperaturu.
Sa analitičkim radom, mnogo se pažnje treba posvetiti izračunima. Neće se činiti teškim ako iz samog početka rada naučimo koncepte koji su podloge svih proračuna, I.E., koncepti naslova, normalnosti i ekipera gram i odnos između njih.
Na primjer, ako se uzima neki uzorak željene tvari, Titer t iz pripremljenog rješenja bit će jednak hitchu alipodijeljeno na svezak (v) rješenja:
Sl. 352. Položaj ruku prilikom titracije.
sVEDOK JOVANOVIĆ - ODGOVOR: \u003d T * 1000 g
Normalnost se može izračunati ako je uzorak poznat ali i gram ekvivalentno rastvorljivim supstancama
Ako se rješenje pripremi u drugom zapreminu, manjim ili većim od 1000 ml, raspoloženje se izračunava za 1 l, a zatim će formula za obračun izračunati formula za izračunavanje normalnosti 
Ova formula omogućava vam izračunavanje normalnosti rješenja iz pričvršćivanja bez obzira na jačinu zvuka. Između titra, gram-ekvivalenta i normalnosti, postoji jednostavna ovisnost:

Ponekad u proračunima, izmjene i dopune koeficijenta normalnosti ili normalnosti K. Ovaj amandman je omjer titra praktičnog t do titra teorijskih (MA):

Ovaj amandman pokazuje bilo koju količinu mililitara tog uobičajenog rješenja odgovara 1 ml ovog rješenja. Pomnoživši rezultate titracije (ML), rezultirajući obim dat je određenoj koncentraciji, na primjer 0,1 n. Solvent.
Međutim, ekspedicija korištenja izmjene i dopune normalnosti je vrlo sumnjiva, jer se svi proračuni mogu uspješno izvršiti bez ovog amandmana, samo komplicirajući obračun.
Kada radimo sa normalnim rješenjima, problem se uvijek svodi na određivanje normalnosti nepoznatog rješenja, a zatim odrediti broj nepoznate tvari sadržane u rješenju. Tako će biti glavna procijenjena analitička formula sa svim volumetrijskim definicijama

i.E., proizvod normalnosti poznatog rješenja o količini poznatog rješenja kada je kraj reakcije uvijek jednak proizvodu normalnosti nepoznatog rješenja za obim potonjeg. Ovaj proizvod prikazuje broj ekvivalenta reagovanih tvari. Odavde možete odrediti normalnost nepoznatog rješenja A2, što će biti jednako

(2)
Kada je vrijednost N2 poznata, koristite opću formulu za određivanje normalnosti na priključkom (a);

(3)
Budući da je analitički zadatak utvrditi vrijednost A, iz ove formule su pronađene;

(4)
Ili, zamjenjujući vrijednost N2 od formule (2), dobivamo:

Gore navedene formule omogućuju svim proračunima bez korekcija u normalu, jer se pretpostavlja da se može izraziti bilo kojim cijelim ili frakcijskim brojem. Glavna stvar u bilo kojem izračunu za pronalaženje broja ekvivalenata, s množenjem koje će iznos željene tvari uvijek dobiti vrijednosti ekvivalenta.
Primjer. Pretpostavimo da je postojao uzorak od 0,5000 g rude koji sadrži željezo. Nakon što je rastvoren i razblažen s rezultirajućem otopinom na 100 ml u mjernom tikvicu za titraciju pomoću Permangapato-Mettery metode svaki put kada uzimaju 10 ml analiziranog rješenja.
Rješenje KMNO4-0.0495 N. Titracija je otišla: 11.2; 11.1; 11.0; 11.1 ml KMNO4 rešenja. Uzimamo prosječno 11,1 ml. Normalnost otopine 11.1 0,0495 \u003d 10 * N2, odakle

Iznos Fe u 100 ml rješenja (gram ekvivalentna Fe u ovom slučaju iznosi 55,85):
Da bi izrazili sadržaj željeza u rudu u procentima, desna strana jednakosti množi se JoO i dijeljenje rude u uzorak, odnosno

Tehnika timetrijske analize
Mjerna posuđa.Mjerni cilindri Prijavite se za približno, s tačnošću 1-2 ml, mjerne tekućine.
Volumetrijske tikvice Koristi se za pripremu rješenja sa precizno poznatom koncentracijom. Obično je suspenzija tvari kvantitativno prebačena u dimenzionalnu tikvicu, otopljenu i razblaženu vodom do definiranog volumena (na primjer, 100 ml), ograničen kružnom etiketom (linija) na vratu (do sada) donji rub meniskusa tečnosti neće dodirnuti osobine).
Pipetteskoristi se za odabir i prijenos preciznog volumena otopine s jedne plovile u drugu. Prije upotrebe, pipeta se ispira, oprana destilovana voda i nužno isperite istim rješenjem koje će se mjeriti. U suprotnom, preostala voda u pipetu razriješit će rješenje analize i koncentracija će se promijeniti. Pravila rada sa pipetama: Donji kraj pipete je uronjen u otopinu i usisati rješenje gumenom kruškom kroz gornju rupu. Kada se nivo tekućine raste iznad linije, brzo zatvorite gornju rupu indeksičnim prstom desne ruke I uklonite pipetu iz otopine. Zatim, višak otopine pažljivo objavljuje donja ivica meniskusa ne podudara se s linijomprikazano na pipetu. U tom trenutku kada meniscus dodirne liniju, prst je čvrsto pritisnut u gornju rupu pipete i zaustaviti curenje tečnosti. Punjeni pipette prebačen je na tikvicu za titraciju. Da biste to učinili, tikvica se čuva u nagnutom položaju, pipeta pričvršćuje donji kraj na zid tikvice, držeći pipetu okomito. Lagano oslobađajući kažiprst, daju rješenje za odvod, čekajući oko 15 sekundi i uklonite zadnji kap dodirom vrha pipete na zid tikvice. Ne puhajte i ne uspanite zadnje kapi pipete tečnostiOd kalibracije pipete, naljepnica se primjenjuje sa činjenicom da je uz besplatan istek u tekućini, ona ostaje malo na zidovima.
Burettes Predstavljaju se od samokilindričnih diplomiranih posuda s dizalicom ili gumenim zatvaračem. Velika djela primjenjuju se putem svakog mililitara, a mali - nakon 0,1 ml. Burete se koriste za mjerenje volumena rješenja koja se konzumira za titraciju. Prije rada, BURNETE se ispraće, a zatim ispere rješenje koje će biti Tite. Zatim postavljanjem stezaljke na gumeni dio suvene, ispunjen s otopinom za titraciju iznad''0 '' '' '' '' '' I, napunite izvučenu cijev, nakon zraka, ne ostaje zrak. Nakon toga, donji meniskus postavljen je na''0 '' '' '' '' '' '' '' '' '' izdanje viška rješenja iz Burete. Brojanja na Buretu izrađene su do 0,05 ml. Odbrojavanje je ometano činjenicom da tečnost u Bursuru ima konkavni meniskus. Iz tog razloga oko prilikom brojanja treba čuvati precizno na nivou tekućine. Inače, broj će biti pogrešno napravljen. Svaka titracija započinje sa '0' '' '' '' '' '' '', kao što je bolje nadoknaditi greške u kalibraciji Burette. Izvlačimo rješenje iz BURNETE-u ne baš brzo (ne brže od 3-4 kapi u sekundi), u protivnom se neće iscrpiti sa zidova na vrijeme i pokaže se da je netačno.
Priprema standardnih rješenja:
1. Napravite jednadžbu reakcije između standardne tvari i tvari, čija bi se koncentracija trebala instalirati. Reakcijskom jednadžbom izračunajte molarne mase ekvivalentne (e) standardne tvari. Zatim izračunajte masu standardne supstance potrebne za pripremu zadanog volumena rješenja određene koncentracije pomoću formule:
gdje je c molarna koncentracija ekvivalenta (normalnost) rješenja; V je potrebno rješenje u ml.
2. Na tehnokemijskim vagama vaga prazna zavarivanja.
3. Vaganje kante sa priključkom na tehnokemijske vage.
4. Kante za vaganje sa pričvršćivanjem na analitičkim vagama.
5. Kvantitativno bez gubitaka za prenos pričvršćivanja od šarke do mjernu tikvicu kroz sušni lijevak (Nakon prebacivanja tvari na lijevak iz tikvice ne izvadite!). Vagati prazne zarelike na analitičkim vagama.
6. Pripremite rješenje.
Objavljeno na Ref.RF
Da biste to učinili, prvo isprati ostatke tvari iz lijevka u tikvici, kako bi predigla lijevak da bi bio jaz između nje i zidova tikvice. Dodajte u tikvicu destilovane vode na 1/3 - 1/2 glasnoće i sadržaj tikvice s rotacijskim pokretima temeljito miješajte da biste u potpunosti otapali uzorak. Donesite jačinu otopine na kalibracijsku oznaku (uz donji meniskus), zatvorite tikvicu sa utikačem i, držeći se, temeljito pomiješajte s kažiprstom, okrećući tikvicu sa vratom u barem 8 puta.
Uzorkovanje i titracija:
1. Pripremite se za posao u borbi protiv tereta. Da biste to učinili, isperite biru s malom količinom rješenja titrant koji se koristi za sipanje rješenja. Nakon toga, napunite birotu rješenjem s otopinom titrana gotovo do vrha; Zatim zamjenjujući čašu ispod nje i otvori stezaljku, napunite burete '' '' '' '' '' Burette (izvučene cijev zavod) tako da u njemu nema mjehurića zraka u njemu. Postavite nivo titrana na''0 '' '' '' '' 'i na donjim izbornicima rješenja.
2. Na tikvicu naslovu odaberite zasebni dio rješenja na titla (alikQot), prethodno isperite pipete odabranim rješenjem za uklanjanje ostataka vode iz nje. Dodaj u tikvicu potrebnu za reagense titracije, indikator.
3. Titriranje. Da biste to učinili, tikvica s titratum otopinom postavlja se na stativu ispod tereta na takav način da su borbe '' '' '' '' '' '' '' '' '' '' '' '' '' '' '' 'surete su u tikvici. Lijeva ruka drži stezaljku, desna ruka je tikvica za svoj vrh, tako da ne zatvori otopinu u tikvici. Čvrsta stezaljka i kružni pokreti stalno miješajući Sadržaj tikvice je TEDING. Istovremeno, titrant se oslobađa iz Burete brže od 3-4 kapi u sekundi, u suprotnom neće iscrpiti od zidova na vrijeme i pokaže se da je netačno. Po postizanju tačke ekvivalencije (izvana, manifestuje se u promjeni boje rješenja) Zaustavljanje titracije. Uklonite očitavanja titracije na zavodu s preciznošću od 0,05 ml i zapišite titrant u laboratorijskim dnevniku. Titracija se vrši najmanje tri puta. Istovremeno, rezultati titracije trebaju biti konvergiranje, ᴛ.ᴇ. Odstupanje ne smije prelaziti 0,1ml. Prilikom dobijanja tri konvergirajuća rezultata, oni pronalaze prosječnu vrijednost i izračunava se koncentracija analiziranog rješenja. U slučaju, kao rezultat tri titracije, konvergirajuće rezultate se ne dobivaju, četvrti, 5. titracija prije primanja tri rezultata konvergiranja.
Proračuni rezultata titracije:
Izračun prosječne količine titlata Izvršite formulu:
Izračun molor koncentracije ekvivalenta (normalnost) titlata za otapalo standardne supstance.Prema zakonu ekvivalenta:
gde se iz St.-Ra - normalnost standardnog rešenja; Sa t - normalom titranta; V st.r-ra - volumen standardnog rješenja jednak zapreminu pipete; V T - jačina zvuka TTRATA jednaka je prosječnoj vrijednosti odbrojavanja na teretu (V CF).
Od formule (31) izrazit ćemo molarni koncentraciju titrana ekvivalenta:
Izračun mase utvrđene supstance u određivanju rješenjaizvršite formulu:
gdje je c normalnost titrana; E - molarna masa ekvivalenta utvrđene supstance; V CP - prosječni volumen tri konvergirajuće rezultate titracije.
Titrimetrijska tehnika analize - koncept i vrste. Klasifikacija i karakteristike kategorije "Tehnika titrimetrijske analize" 2017, 2018.
tutrimetrijska analiza
TUTRIMETRIC (VOLUSE) ANALIZA Kombinuje grupu kvantitativne metode hemijske analize na osnovu procesa titracije. Sastoji se od mjerenja jačine rešenja reagensa koji se konzumira na ekvivalentnoj interakciji s utvrđenom supstancom. Koncentracijom i volumenom rješenja reagensa izračunava se sadržaj utvrđene tvari. Metoda titrimetrijske analize primjenjiva je za utvrđivanje prosječnih i velikih tvari (preko 1%).
Reakcije korištene u Tiptimettriji trebaju ispunjavati sljedeće osnovne zahtjeve:
- Reakcija treba kvantificirati, tj. Konstantna ravnoteža reakcije treba biti dovoljno velika;
- reakcija mora brzo proći;
- reakcija ne bi trebala biti komplicirana protokom neželjenih reakcija;
- Mora postojati način da se utvrdi kraj reakcije.
Ako reakcija ne zadovoljava barem jedan od ovih zahtjeva, ne može se koristiti u tutrimeričkoj analizi.
Ovisno o vrsti reakcije, što u osnovi definiranja, udvajaju se sljedeće metode titrimetrijske analize: kiselinsko-osnovni, redox, talogitirati i složeni.
Prema metodi prikaza krajnje tačke razlikovanja vizualni, potenciometrijski, fotometrijski, provodnici, amperometrijsko tiranjeitd.
Ovisno o načinu provođenja titracije direktno, obrnuto, indirektno (po zamjenicama).
Titracija se može izvesti iz odvojene udubine i pipeting. U prvom slučaju je titran cjelokupni iznos utvrđene supstance. U slučaju pipetivanja, proučeno rješenje (ili uzorak tvari) kvantitativno se prenosi na mjernu tikvicu, dovedi do etikete na etiketu i temeljito se miješaju. Zatim je iz mjerne tikvice odabrano nekoliko uzoraka rješenja (alikvoti) za paralelne titracije.
Glavni uvjeti koji se koriste u titrimetrijskoj analizi
Titracija- Proces postepeno kontroliranog ljepljivosti rješenja s precizno poznatom koncentracijom na određeni obim drugog rješenja.
Titrans (titrirano, radno rešenje) - rješenje koje se pridržava ima potpuno poznatu koncentraciju.
Titrirano rješenje - Rješenje na koje titrant žuri.
Tuthrimetric sistem - mješavina tvari formiranih interakcijom titrana i supstanci titla.
Tačka ekvivalencije (t. er)- Trenutak titracije, kada je broj ekvivalenta titrana jednak broju ekvivalenta utvrđene tvari.
Indikator- Supstanca ili aparat koji se koriste za uspostavljanje konačne točke titracije, koje se obično razlikuje od točke ekvivalencije.
Stepen petlje ( f.) - omjer broja ekvivalenta titracije koji je došao na titraciju u bilo koje vrijeme titracije, na početni iznos ekvivalenta utvrđene supstance:
Div_adblock129 "\u003e
Burette je ocijenjena u CM3 s odjelima kroz jednu ili dvije desetine cm3. Prema sistemu, preporučuje se izraziti sveske u DM3 i CM3, ali su dozvoljene stare jedinice: litre i mililitnici. 1 litra zauzima 1 dm3, 1 mililitar - 1 cm3. Konvencionalne zareze imaju kapacitet od 10, 25 i 50 cm3 (ml), a tri digitalna znaka su desetine, jedinice i desetine mililita. Stotine Millitritra utvrđuju se otprilike.
Mjerne tikvice obično imaju kapacitet od 25, 50, 100, 200, 250, 500 i 1000 cm3 (ml). Pipete se obično izrađuju zapremine 5, 10, 15, 20, 25, 50 cm3 (ml).
Koristeći mjernu jela treba imati pamćenje da njegov kapacitet često ne odgovara tačno određenoj. Učionica klase 1 sa kapacitetom veće od 10 ml pogodna je za rad sa tačnošću od 0,1%, za 2 klase jela dopuštena odstupanja dvostruko više.
Ispunjavanje rešenja zavod
Pur Burette ispunjen je 1/3 titrana, uvjereni su u ispravnost zatvarača i odsustvo zračnog mjehurića u njemu. Za to vrh suvode podiže i malo otvori stezaljku. Ako je tečnost glatka mlaza, bez mjehurića zraka, bireta je ispravno popunjena. Naginjanje i okretanjem suvere, mokri zid rješenjem, nakon čega se gotovo cijelo rješenje isušeno kroz nos. Prije početka titracije, BURETTE je instalirana strogo vertikalno i ispuni titran na nulu. Istovremeno, nivo meniskusa tečnog konkavnog dijela trebao bi se podudarati s nultim podjelom na skali (nula podjela treba biti na nivou oka) za bezboljnu rješenja. Za oslikana rješenja nula je instalirana na gornjem rubu meniskusa.
Mjerenje sa pipeta rješenjima
Čista pipeta s gumenom kruške ispunjen je titriranim rješenjem prije početka proširenja. Zatvaranjem gornjeg kraja indeksom prstom, pipeta se pretvori nekoliko puta, pokušavajući navlažiti cijelu unutrašnju površinu malo iznad oznake. Rješenje za bacanje.
Sada napunite pipetu gumenom kruškom malo iznad oznake. Uklonite krušku, rupa je blago prekrivena prstom, "držeći" rezervoar pipete na nivou oka, pažljivo iscrpi višak otopine tako da je meniskus tečnosti konkavni sa konkavnim dijelom sa etiketom. Nakon toga rupa pipete stezaljke i prenosi je u drugu plovilu. Vrh pipete otvara se i daje tečnosti mirno sipaju. Nakon tekućine iz pipete stabljike, zadnje kapi su isušene, dodirujući zid plovila u koji se tečnost izliva. Tada se izvlači pipeta, ne obraća pažnju na tečnost koja ostaje u njemu. Da puše tečnost iz pipete je nemoguće.
Pravila za tiranje
Mjesto na kojem se vrši titracija treba dobro pripremiti i osvijetljena. Na bazi stativa sa zavojem, treba staviti bijeli papirni list. Burette je ojačana paralelno sa štapom stativa.
Titrirajte s malim porcijama - kapi. Otvorite stezaljku zavod s lijevom rukom, a titracijska titrana drži pravo, stalno miješajući svoj sadržaj s rotacijskim pokretima. Nakon napuštanja rastvora, odbrojavanje podjela na teretu proizvodi se za 20-30 sekundi kako bi se tekućina omogućila da iscrpljuje tečnost koja preostaje na zidovima utora.
Odbrojavanje se uklanja duž dna (bezbojna rješenja) ili na vrhu (oslikana rješenja) ivica meniskusa. Menisk mora biti na nivou očiju. Da biste dobili pouzdane rezultate, titriranje najmanje tri puta se ponavlja. Svaka ponovna titracija započinje od nula odbrojavanja Burete.
Tivanje grešaka
Kada su moguća potrebna titracija, slučajne i sistematske greške. Nasumične greške povezane su s mjerenjem jačine zvuka i mase pričvršćivanja, sistematična (indikator) pojavljuju se kada je tačka tačke titracije točke ekvivalencije nedosljedna.
Pogreške mjerenjarješenja Zbog netačnosti mjerenja rješenja tvari i titrana. Oni su presavijeni iz glasnoće jednog pada (V ~ 0.05 ml), koji se obično prepisuje rješenjem, a greška u kalibraciji brojila (koneri, pipeti, mjerne tikvice), u kojima se ± (0,01 - 0,02) ML odstupanja su dozvoljeni. Pogreška relativne titracije ovisi o volumenu potrošenog titrana ili titriranog rješenja i jednak je:
gdje je v zbroj količine pada (~ 0,05 ml) i odstupanja u količini
burettes (~ 0.02 ml) i pipete (~ 0.02 ml);
V je jačina titriranog rješenja ili titrana, ml.
Tutrimetric, ili svezak, analiza- Metoda kvantitativne analize na osnovu mjerenja volumena (ili mase) reagensa T, potrošeno na reakciju s utvrđenom supstancom X. Drugim riječima, titrana analiza je analiza zasnovana na titraciji.
Cilj laboratorijskih razreda na metoda tutrimetrijske analize je izrada praktičnih veština na tehnici tintimetrijske analize i savladavanju metoda statističke obrade analize na primer posebnih kvantitativnih definicija, kao i konsolidaciju teorijskog znanja rešavanjem Tipični zadaci naseljavanja za svaku temu.
Poznavanje teorije i prakse metoda tirimetrijske analize potrebna je za naknadnu studiju instrumentalnih metoda analize, drugih hemijskih i posebnih farmaceutskih disciplina (farmaceutska, toksikološka hemija, farmakognozijska tehnologija). Studirane metode tutrimetrijske analize su farmakopeja i široko se koriste u praktičnoj aktivnosti odredbe za kontrolu kvalitete lijekova.
Legenda
A, X, T - bilo koja supstanca, utvrđena supstanca i titrant;
m (a), m (x), t (t)- masa bilo koje tvari određene tvari i titom, odnosno, G;
M (a), m (x), M (t)- molarna masa bilo koje tvari, utvrđene supstance i titlata, respektivno, g / mol;
n (a), n (x), n (t) - količina bilo koje tvari određene tvari i titom, odnosno krtica;
Količina supstance je ekvivalentna bilo kojoj supstanci, utvrđenoj supstanci i titoru, odnosno krtica;
 - volumen rješenja bilo koje supstance, određena tvari i titom, respektivno, l;
- volumen rješenja bilo koje supstance, određena tvari i titom, respektivno, l;
 - volumen djelićeg znanstvene supstance jednak kapacitetu pipete, l;
- volumen djelićeg znanstvene supstance jednak kapacitetu pipete, l;
 - volumen analiziranog rješenja utvrđene supstance, jednak kapacitetu tikvice, l.
- volumen analiziranog rješenja utvrđene supstance, jednak kapacitetu tikvice, l.
1. Osnovni pojmovi titrimetrijske
analiza
1.1. Titracija- Proces određivanja tvari X postepeni dodatak malih količina tvari t, u kojoj izaziva otkrivanje točke (trenutak) kada je sva supstanca x reagovala. Tihting vam omogućuje da pronađete količinu tvari x prema poznatoj količini tvari koji se naviknu u ovo poantu (trenutak) uzimajući u obzir činjenicu da je odnos u kojem se X i T reagira iz stoichimetry ili nekako različito.
1.2. Tartran- Rješenje koje sadrži aktivni reagens T, sa kojim se provodi titracija. Tipično se titracija vrši dodavanjem titrana iz kalibrirane mreže u titracijsku tikvicu s analiziranim rješenjem. U ovoj tikvici ispred titracije alikhit udioanalizirano rješenje.
1.3. ALIQUIT SHARE (ALIQUT)- Tačno poznat dio analiziranog rješenja za analizu. Često je odabran kalibriranom pipetom, a jačina zvuka obično se označava simbolom. V ss.
1.4. Tačka ekvivalencije (TE)- takav poenta (trenutak) titracije, u kojem je količina dodanog titrana t ekvivalentna količini titrirane supstance H. sinonimi TE: sTOICIOMETRIJSKA TOČKA, TEORETSKA PRIVREDNA PJEČETA.
1.5. Završna točka titracije (KTT) - Point (trenutak) titracije, u kojem je neko rješenje rješenja (na primjer, njegova boja) pokazuje uočljivu (oštre) promjenu. CTT odgovara manje-više TE, ali se najčešće ne odgovara.
1.6. Indikator- Supstanca koja prikazuje vidljivu promjenu u PE ili u blizini. U savršenom slučaju, indikator je prisutan u dovoljnoj niskoj koncentraciji interval njegove tranzicijene
bitan broj TTRANS T. Oštra vidljive promjene u indikatoru (na primjer, njegova boja) odgovara kT.
1.7. Interval tranzicije indikatora- Regija koncentracije vodikovih jona, metala ili drugih jona, u okviru kojeg je u mogućnosti otkriti promjenu nijanse, intenziteta boje, fluorescencije ili druge imovine vizuelnog pokazatelja uzrokovanog promjenom u odnosu na omjera dva odgovarajuća oblika pokazatelja. Ovo se područje obično izražava u obliku negativnog logaritama koncentracija, na primjer:  Za redox indikator, interval tranzicije je odgovarajuća regija Redox potencijala.
Za redox indikator, interval tranzicije je odgovarajuća regija Redox potencijala.
1.8. Stepen penzionisanjarator zapremine V. (T)dodan titrant u količinu V (TE) titrana koji odgovara TE. Drugim riječima, stepen rafiniranog rješenja je omjer količine penzione supstance do početne količine u analiziranom rješenju:

1.9. Nivo tiranja- Naručite  koncentracija vrste titrantnog rješenja, na primjer, 10 -1, 10 -2, 10 -3, itd.
koncentracija vrste titrantnog rješenja, na primjer, 10 -1, 10 -2, 10 -3, itd.
1.10. Krivulja tiranja -grafička slika ovisnosti koncentracije koncentracije sa (x) određenom supstancom x ili nekim pridruženim svojstvima sistema (otopina) iz jačine zvuka V (T)dodani titrant T. Vrijednost C (x) tijekom titracije varira za nekoliko reda veličine, tako da je krivulja titracije često izgrađena u koordinatama:  Na osi apscissa, zapremina dodane trante V deponovan je (T)ili diplomu petlje /. Ako prema ordinatoru osi, postavite ravnotežnu koncentraciju sa (x) ili intenzitetom proporcionalnih svojstava, a zatim dobijete krivulja linearne titracije.Ako se Ordinat os odgodi
Na osi apscissa, zapremina dodane trante V deponovan je (T)ili diplomu petlje /. Ako prema ordinatoru osi, postavite ravnotežnu koncentraciju sa (x) ili intenzitetom proporcionalnih svojstava, a zatim dobijete krivulja linearne titracije.Ako se Ordinat os odgodi  ili svojstva intenziteta logaritam proporcionalna (x), a zatim get logaritamska (ili monologmična) krivulja titracije.Za jasniju identifikaciju karakteristika procesa titracije i u primijenjenim svrhama, ponekad se izgradi krivulje diferencijalne titracije,stavljanje osi apscisa zapremina dodanog TTRAT-a V (T),i duž ordinate osi - prvi derivat logaritama koncentracije (ili intenziteta proporcionalnih svojstava) u smislu količine titrana dodata:
ili svojstva intenziteta logaritam proporcionalna (x), a zatim get logaritamska (ili monologmična) krivulja titracije.Za jasniju identifikaciju karakteristika procesa titracije i u primijenjenim svrhama, ponekad se izgradi krivulje diferencijalne titracije,stavljanje osi apscisa zapremina dodanog TTRAT-a V (T),i duž ordinate osi - prvi derivat logaritama koncentracije (ili intenziteta proporcionalnih svojstava) u smislu količine titrana dodata:  Na primjer, takve krivulje titracije obično se koriste u fizikalnoj metoda analize, na primjer, s potenciometrijskom titracijom.
Na primjer, takve krivulje titracije obično se koriste u fizikalnoj metoda analize, na primjer, s potenciometrijskom titracijom.
1.11. Standardno rješenje- Rješenje koje ima poznatu koncentraciju aktivne tvari.
1.12. Standardizacija- Proces pronalaženja koncentracije aktivnog reagensa u rješenju (najčešće titriranjem sa standardnim rješenjem odgovarajuće supstance).
1.13. Titing skok- Oštri interval promjene promjene nekih fizičkih ili fizičkih hemijskih svojstava rješenja u blizini točke ekvivalencije obično se primjećuju kada se doda 99,9-100,1% titrana u odnosu na njen stoichiometrijski iznos.
1.14. Neirne titracija- titracija rješenja identično analiziranom rješenju u količini, kiselosti, broju pokazatelja itd., ali ne sadrže određenu supstancu.
2. Osnovne operacije tutrimeričke analize
2.1. Čišćenje, pranje, skladištenje mjernih jela.
2.2. Provjerite kapacitet mjernih jela.
2.3. Uzimanjem problema sa precizno poznatom masom na razlici u rezultatima dva vaganja (obično na analitičkim vagama).
2.4. Kvantitativni prijenos uzorkovanja tvari u mjernu tikvicu i raspuštanje tvari.
2.5. Ispunjavanje mjernih jela (tikvice, burette, pipette) rješenje.
2.6. Pražnjenje pipeta, nosača.
2.7. Odabir djelića aliquanstva analiziranog rješenja.
2.8. Titracija i proračuni zasnovani na rezultatima titracije.
3. Kalibracija mjernih jela
U trimetričnoj analizi, tačno volumen otopine mjere se mjernim jelima, koje koriste mjerne tikvice kapaciteta 1000, 500, 250, 100, 50 i 25 ml, pipetama i ocjenjivanim pipetama kapaciteta 10, 5, 3, 2 i 1 ml. Kapacitet tikvica i pipeta na 20 ° C urezan je na vratu tikvice ili na bočnoj površini pipete (nazivna zapremina). Uz masovnu proizvodnju mjernih jela, važeći (istinita) kapacitet mjernih tikvica, nosača, pipeta može se razlikovati od nominalnih vrijednosti navedenih na posuđem. Da bi se postigla potrebna tačnost rezultirajućih rezultata titrimetrijske analize
Kalibracija dimenzionalnih jela temelji se na određivanju tačne mase ranjive ili sipane destilirane vode, što se određuje rezultatima od vaganja jela prije i nakon izlijevanja infuzije ili izlijevanja vode. Zapremina vode u kalibriranim jelima (njegov kapacitet) i masa vode povezana su s odnosom:

gde  - Gustina vode u iskustvu, g / ml.
- Gustina vode u iskustvu, g / ml.
Gustina vode ovisi o temperaturi, tako da kada izračunate podatke treba koristiti. 2-1.
Tabela 2-1.Vrijednosti gustine vode na odgovarajućoj temperaturi

Mjerne tikvice kalibriraju se za infuziju i terete i pipete - za izlijevanje, jer male količine tekućine tijekom izlijevanja uvijek ostaju na zidovima posuđa.
3.1. Provjerite kapacitet mjernih tikvica
Tik je pažljivo natopljen, osušen i vagati na analitičkim vagama s točnošću od ± 0,002, a zatim ga napuniti vodom (ovdje i dalje - destilirano) duž donjeg menizije, ukidaju kap vode u vrh vrata i ponovo izvagala. Svako vaganje prazne tikvice i tikvice vodom vrši se najmanje dva puta, dok odstupanje između dva vaga ne smije biti prelazi ± 0,005 g. Razlika između mase skljive sa vodom i masom prazne tikvice jednaka je masi vode koja sadrži tikvicu na određenoj temperaturi. Pravi kapacitet tikvice izračunava se podjelom prosječne vrijednosti mase vode na njenoj gustoći po temperaturi iskustva (vidi tablicu 2-1).
Na primjer, kada kalibrira mjerna tikvica sa nominalnom zapreminom od 100 ml, prosječna vrijednost vodene mase na 18 ° C iznosi 99.0350. Tada je istinski kapacitet mjerne tikvice jednak:
3.2. Provjerite budžetu kapaciteta
BURETTE je stakleni cilindar, unutrašnji promjer može biti nešto promijenjen duž duljine BURNETE. Jednake podjele na baruru u raznim dijelovima odgovaraju nejednakim količinama rješenja. Zato se, kada kalibrira uvode, pravi sveski se izračunavaju za svaki odabrani dio BURNETE.
Čisto i osušena jevod ispunjen je vodom do nula tragova duž donjeg meniskusa i uklanjaju kapicu vode s unutarnje površine vrha nosača sa filternim papirom. Tada su zamke zamijenjene pod barurom, unaprijed ponderirani poklopcem na analitičkim vagama. Određena količina vode polako se isprazni u zamke (na primjer, 5 ml). Nakon toga kante su zatvorene poklopcem i izvagle su ponovo. Razlika u masi fuquisa s vodom i praznim uvalama jednaka je masi vode koja se nalazi u baruru između podjela 0 i 5 ml na temperaturi iskustva. Zatim je, jer je, Burette ponovo napunjena vodom do nula tragova duž donjeg meniskusa, polako sipala 10 ml vode u prazan binx i slična metoda određuje masu vode koja se nalazi u baruru između podjela 0 i 10 ml. Kada kalibrira, na primjer, 25 ml takva operacija provodi se 5 puta i masa vode koja odgovara nominalnim količinama navedenim na baruru 5, 10, 15, 20 i 25 ml. Svako vaganje praznog fuquisa i fuquisa s vodom ponavlja se najmanje dva puta, dok odstupanje između dva vaga ne bi trebalo prelazi ± 0,005.
Onda tablica. 2-1 Odredite gustoću vode na temperaturi iskustva i izračunajte istinski kapacitet zavoda za svaku vrijednost nominalnog volumena navedenog na njemu.
Na osnovu dobivenih podataka, iznos amandmana izračunava se između izračunate vrijednosti istinskog kapaciteta i odgovarajuću vrijednost zapremine nominalne mreže:

a zatim nacrtajte krivulju kapacita zavod u koordinate  (Sl. 2-1).
(Sl. 2-1).
Na primjer, ako s kalibracijom birote sa kapacitetom od 25 ml na temperaturi od 20 ° C, dobiveni su sljedeći eksperimentalni podaci koji su zajedno sa rezultatima odgovarajućih proračuna prikazani u tablici. 2-2.
Na osnovu rezultata tabelarnih podataka, nacrtajte krivulju zatvaranja za datu mrežu, koristeći se pomoću kojih možete pročistiti rezultate reference na baruru.
Tabela 2-2.Rezultati kalibracije Buretti Kapacitet 25 ml


Sl. 2-1.Krivulja Izmjene i dopune korupcije
Na primjer, neka 7,50 ml titrana provede na titriranju djelića alikvotske delojne supstance. U skladu s rasporedom (vidi Sl. 2-1), veličina amandmana koja odgovara ovom nominalnom zapreminu je 0,025 ml, istinski volumen potrošenog titla je: 7,50 - 0,025 \u003d 7.475 ml.
3.3. Provjera kapaciteta pipete
Čista i suspendovana na analitičkim vaga Pipette napunjena je vodom do nula oznake na donjem meniskusu, a zatim polako
utikač duž zida u unaprijed odmjerenim binkama. Bure su zatvoreni poklopcem i vagaju vodom. Svako vaganje praznog fuquisa i kašike za vodu ponavlja se najmanje dva puta, dok odstupanje između dva vaga ne bi trebalo prelaziti ± 0,005. Razlika u masovnoj rubi s vodom i praznim Buquisom jednaka je masi voda koja se nalazi pipetom. Pravi kapacitet pipete izračunava se dijeljenjem prosječne mase vode na gustoću vode na temperaturi iskustva (vidi tablicu 2-1).
4. Tipični proračuni u Tiptimetrijskoj analizi
4.1. Metode za izražavanje koncentracija koje se koriste za proračune u Tiptimetrijskoj analizi
4.1.1. Molarna koncentracija tvari sa (a), MOL / L - količina supstanci A u krticu, sadržana u 1 litri rješenja:
 (2.1)
(2.1)
gde  - količina tvari A u MOL-u rastvorenu u V (a) l
- količina tvari A u MOL-u rastvorenu u V (a) l
Čvrsta.
4.1.2. Molarna koncentracija ekvivalentne supstance  , MOL / L je količina tvari ekvivalentnog A u MOL-u sadržanom u 1 litri rješenja (bivše ime je "normalno" rješenje):
, MOL / L je količina tvari ekvivalentnog A u MOL-u sadržanom u 1 litri rješenja (bivše ime je "normalno" rješenje):
 (2.2)
(2.2)
gde  - iznos supstancije je ekvivalentan i u krtici,
- iznos supstancije je ekvivalentan i u krtici,
rastvoren u V (a) l rješenja;  - molarna masa ekvivalenta
- molarna masa ekvivalenta
a, g / mol; - faktor ekvivalencije tvari.
4.1.3. Titre tvari T. (A), g / ml - masa rastvorene supstance A u gramima sadržanim u 1 ml rješenja:
4.1.4. Tuthrimetric Factor Recalkulacija  I, g / ml - masa utvrđene supstance u gramima koja interaktira sa 1 ml titranta:
I, g / ml - masa utvrđene supstance u gramima koja interaktira sa 1 ml titranta:
(2.4)
4.1.5. Korekcijski faktor F.- Vrijednost koja označava koliko puta se praktične koncentracije titranta razlikuju od odgovarajućih teorijskih vrijednosti navedenih u tehnici:
 (2.5)
(2.5)
4.2. Izračun molarne mase ekvivalenta tvari u reakcijama koji se koriste u titrimetrijskoj analizi
Ekvivalent se naziva stvarnom ili konvencionalnom česticom, što može priložiti ili dati jedan hidrogen H + (ili biti drugačiji ekvivalent u kiselinskim reakcijama) ili pričvrstiti ili davati jedan elektron u reakcijama koji se mogu priložiti u reakcijom u oksidansu.
Faktor ekvivalencije  - broj koji pokazuje koji
- broj koji pokazuje koji
ekvivalentnost udjela iz prave čestice tvari A. Faktor ekvivalencije izračunava se na osnovu stoichiometrije ove reakcije: 
gde Z.- Broj protona ili priloženih jednim reagiranjem (molekula ili jona) u reakciji kiseline ili broj elektrona razlikovanih ili primljenim po jednoj reagiranoj čestici (molekula ili jona) u oksidaciji oksidacije ili oporavka.
Molarna masa ekvivalente tvari je masa jednog mola ekvivalentna supstanci jednaka proizvodu faktora ekvivalencije na molarnoj masi materije, g / mol. Može se izračunati formulom:
 (2.6)
(2.6)
4.3. Priprema rješenja razrjeđivanje koncentriranijeg rješenja poznatom koncentracijom
Prilikom provođenja trimetrijske analize u nekim slučajevima potrebno je pripremiti rješenje tvari i količine  sa približno poznatom koncentracijom razrjeđivanjem koncentriranijeg rješenja.
sa približno poznatom koncentracijom razrjeđivanjem koncentriranijeg rješenja.
Kada se otopina razblaže vodom, količina tvari A ili količina ekvivalentne tvari se ne mijenja, stoga, u skladu s izrazima (2.1) i (2.2), možete napisati:
(2.7)  (2.8)
(2.8)
ako su indeksi 1 i 2 rješenja prije i nakon razrjeđivanja, respektivno.
Odbačenih omjera, izračunava se količina koncentriranijeg rješenja  što se mora mjeriti za pripremu zadanog rješenja.
što se mora mjeriti za pripremu zadanog rješenja.
4.4. Priprema unaprijed određenog obima rješenja na spoj sa precizno poznatom masom
4.4.1. Izračun masovnih uzoraka
Teorijska masa standardne tvari A, koja je neophodna za pripremu određenog obima rješenja poznatom koncentracijom, izračunava se iz izraza (2.1) i (2.2). Jednak je:
(2.9)
ako se koristi molarna koncentracija tvari u otopinu, a:
(2.10)
ako se koristi molarna koncentracija ekvivalenta tvari u otopini.
4.4.2. Izračun tačne koncentracije pripremljenog rešenja
Koncentracija otopine supstance pripremljena prema točnoj težini mase m (a) izračunava se iz odnosa (2.1-2.3), gdje t (a)- Praktična masa supstance A, koja je uzeta razlika u dva vaganja na analitičkim vagama.
4.5. Izračun koncentracije titrana tokom svoje standardizacije
Poznata količina standardnih rješenja  sa koncentracijom
sa koncentracijom  titrirati s otopinom titrana zapremine V (T)(ili obrnuto). U ovom slučaju, za reakciju koja teče u rješenju u procesu titracije
titrirati s otopinom titrana zapremine V (T)(ili obrnuto). U ovom slučaju, za reakciju koja teče u rješenju u procesu titracije  Zakon ekvivalenta ima obrazac:
Zakon ekvivalenta ima obrazac:
i 
Odavde se dobija izraz za izračun molske koncentracije titrana ekvivalent prema rezultatima titracije:
 (2.12)
(2.12)
4.6. Izračun mase utvrđene supstance u analiziranom rješenju4.6.1. Direktna titracija
Utvrđena supstanca u analiziranom rješenju titrira direktno titrant.
4.6.1.1. Izračun pomoću molerne koncentracije titrant ekvivalenta
Udio s pogledom rješenja utvrđene supstance  titrirati
titrirati
rješenje zapitaj sa zapreminom V (t). U ovom slučaju, za reakciju koja teče u rješenju tokom procesa titracije:

zakon ekvivalenta ima obrazac:  i
i
(2.13)
Stoga je molarska koncentracija ekvivalenta utvrđene tvari izračunate prema rezultatima titracije jednaka:
 (2.14)
(2.14)
Rezultirajući izraz je zamijenjen u jednadžbu (2.2) i dobiva se formulom za izračunavanje mase materijala tvari u tikvici  Prema rezultatima direktnog titracije:
Prema rezultatima direktnog titracije:
 (2.15)
(2.15)
Ako se, u titraciji, dio titrana troši na reakciju s pokazateljem, provodi se "prazno iskustvo", a zapremina Tttranat V "(T) je određen,
potrošio na titraciju pokazatelja. Prilikom izračunavanja, ovaj se jačini oduzme od glasnoće titrana, koji je išao na titraciju otopine utvrđene supstance. Ovaj amandman se vrši u provođenju "praznog iskustva" na sve izračunate formule koje se koriste u Tiptimetrijskoj analizi. Na primjer, formula (2.15) za izračunavanje mase utvrđene supstance, uzimajući u obzir "iskustvo u praznom hodu", bit će posmatrano:
(2.16)
4.6.1.2. Proračun pomoću titrimetrijskog faktora za rekalkulaciju
Imamo analizirano rješenje  Na titraciji alik-
Na titraciji alik-
ratni otapalo  rješenje tvari se konzumira zapremine tranšta v (T)sa teorijskim tiptimetrijskim faktorom rekalkulacije
rješenje tvari se konzumira zapremine tranšta v (T)sa teorijskim tiptimetrijskim faktorom rekalkulacije  i koeficijent korekcije F.Tada je masa utvrđene tvari u djeliću alikvot jednaka:
i koeficijent korekcije F.Tada je masa utvrđene tvari u djeliću alikvot jednaka:
(2.17)
i u čitavoj analiziranoj jačini 
(2.18)
4.6.2. Zamjenik titracije
 dodaje se očigledan višak reagensa A i supstituent supstituent objavljuje se u ekvivalentnoj supstanci:
dodaje se očigledan višak reagensa A i supstituent supstituent objavljuje se u ekvivalentnoj supstanci:

Supstituent je titriran odgovarajućim titlatom:

Zakon ekvivalenta za supstituciju titracija:

korištenje odnosa (2.8) može se napisati u obrascu:

Odavde se dobija formulom za izračunavanje koncentracije molara ekvivalenta utvrđene tvari u otopinu prema rezultatima supstitucije titracije:

što ima isti izgled kao i sa direktnom titracijom (2.14). Zbog toga su svi proračuni mase supstance utvrđeni u analiziranom problemu pod izdržanim titracijom izvršeni prema formulama (2,15-18) za direktno titraciju. 4.6.3. Inverzna titracija
U djelić alikvotske odlučne supstance  dodati poznatvišak prvog Tontratte
dodati poznatvišak prvog Tontratte  :
:

Tada se višak nereagovanog prvog titrana trlja drugim tonarkom, to se troši zapremina.  :
:

Zakon ekvivalenta u ovom slučaju može se pisati kao:

Odavde izračunava se molarna koncentracija ekvivalenta tvari X u otopini:
 (2.19)
(2.19)
Rezultirajući izraz u jednadžbi (2.2) je zamijenjen i formula se može izračunati mase utvrđene tvari u analizirano rješenje jednako zapremine tikvice, prema rezultatima obrnutog titracije:

5. Implementacija i pružanje praktičnog rada na Tiptimetrijskoj analizi
5.1. Opće odredbe
Prilikom proučavanja odjeljka "Titrimetrijska analiza" predviđa rad na sljedećim temama.
Tema I.Metode kisele bazne titracije.
Tema II.Metode titracije oksidacije i oporavka.
Tema III.Metode padavina titracije.
Tema IV.Metode složenometrijske titracije.
Lekcija 1.Priprema rastvora klorovodične kiseline i njegove standardizacije.
Lekcija 2.Određivanje alkalne mase u rješenju. Određivanje karbonatalnih masa u rješenju. Određivanje alkalne mase i karbonata u rješenju sa zajedničkim prisustvom.
Lekcija 3.Određivanje mase amonijaka u rješenjima amonijumskih soli.
a) Test kontrola 1.
b) određivanje mase amonijaka u rješenjima amonijum soli. Lekcija 4.Permanganatometrična titracija.
a) Pismeno testiranje 1.
b) određivanje mase vodikovog peroksida u otopini.
c) određivanje mase željeza (II) u otopinu soli. Određivanje masovne frakcije željeza (II) u uzorku soli.
Lekcija 5.Jodometrijsko titracija.
a) određivanje mase vodikovog peroksida u otopini.
b) Određivanje mase bakra (ii) u rješenju. Lekcija 6.Jodimetrična titracija.
Lekcija 7.Bromatometrijska titracija. Određivanje mase arsena (Iii)u rješenju.
Lekcija 8.Bromometrijska titracija. Određivanje masovnog djela natrijumsijuma salikila u pripremi.
Lekcija 9.Nitritometrijska titracija.
a) Test kontrola 2.
b) utvrđivanje masovnog udjela romana u pripremi. Lekcija 10.Argentometrijska titracija heksacianoferratom
tric titracija.
a) Pismeno testiranje 2.
b) određivanje mase kalijuma bromida i kalijuma jodida u rješenju metodama argenometrijskog titracije.
c) Određivanje mase cinka u rješenju heksacianoferratometrijskog titracije.
Lekcija 11.Sveobuhvatno određivanje cinka i vodećeg masa u rješenju.
a) Test kontrola 3.
b) određivanje mase cinka i vode u rješenju.
Lekcija 12.Kompletno određivanje željeza (III) i kalcijum u rješenju.
a) Pismeno testiranje 3.
b) određivanje mase željeza (iii) i kalcijuma u rješenju.
Ovisno o specifičnoj situaciji, neki su radovi dopušteni za vrijeme ne-jednog, ali dvije klase. Također je moguće premještanje vremena ispitivanja kontrola i pisanih testova.
Na kraju svake teme, primjeri ispitivanja predmeta daju se za posredni nadzor znanja učenika, sadržaj konačnog pisanog ispitivanog rada, primjer ulaznice za pisanje testnog rada.
Na kraju svakog zanimanja, student izdaje protokol koji uključuje datum i ime obavljenog rada, suštinu metodologije, postupak obavljanja radova dobivenih eksperimentalnim podacima, proračunima, tablicama, zaključacima. Sva izračunavanja rezultata analize (koncentracija rješenja, masu utvrđene supstance) studenti se izvode s tačnošću četvrte značajne znamenke, osim u slučajevima posebno navedenim u tekstu.
Privremena kontrola praktičnih vještina i teorijsko znanje vrši se korištenjem testne kontrole i pisanih testova.
5.2. Materijal koji pruža tutrimetrijsku analizu
Glassware:burettes kapaciteta 5 ml, dimenzionalnih pipeta kapaciteta 2 i 5 ml, mjerne tikvice kapaciteta 25, 50, 100 i 250 ml, konusne tikvice kapaciteta 10-25 ml, staklena goriva, stakleni lijekovi s promjerom 20-30 mm, tikvice iz običnog ili tamnog stakla kapaciteta 100, 200 i 500 ml, mjerenje cilindara kapaciteta 10, 100 ml.
Reagensi:rad primjenjuje kvalifikacijske reagense "H.C." i "Ch.d.a.", indikatorski papir.
Uređaji:vage analitički s više težina, tehničke vage s višestrukim ormarićem, laboratorijskim termometrom sa skalom od 20-100 ° C, stativ sa stopama za osiguranje masena i prstenova za azbestne mreže, vodene kupelji, vodene kupeljice.
Pomoćni materijali i pribor:deterdženti (soda, deterdžentski puderi, hromirana mešavina), pečenje posuđa, gumene kruške, azbestne mreže, ljepilo, stakleno olovke, filter papir.
Bibliografija
1. Položaj za studente u odjeljku "Titrimetrijska analiza".
2.Kharitonov yu.yu.Analitička hemija (analitika): u 2 T.- ED. 5. - m.: Hiljačka škola, 2010. (u daljnjem tekstu: "Tutorial").
3.Lurie yu.yu.Priručnik o analitičkoj hemiji. - M.: HEMIJA, 1989. (u daljnjem tekstu "Imenik").
4.Dzhabarov D.N.Zbirka vježbi i zadataka na analitičkoj hemiji. - M.: Ruski doktor, 2007.
Odjeljak III
Proračuni u Tiptimetrijskoj analizi
1. Izračun molarne mase ekvivalentne supstance
Ekvivalentan oni se odnose na stvarnu ili uvjetnu česticu tvari, što je u ovoj aciplicilnoj osnovnoj reakciji ekvivalentno jednom hidrogen jonu ili u ovoj reakciji oksidacijskog oporavka - jedan elektron.
Faktor ekvivalencije fECW. (A) \u003d 1 / z - broj koji ukazuje na kakvu vrstu ekvivalencije iz prave čestice supstanceAli, Izračunava se na temelju stoichiometrije ove reakcije.
Ekvivalent molarne mase Supstance A, M (1 / ZA) - masa one molitvene ekvivalentne supstanceAli
M (1 / za) \u003d 1 / zm (a).
U kisele-osnovne reakcije U jednom HCL molekuli, jedan hidrogeni atom uključen je u reakciju, tako da je ekvivalent HCL jednak HCL molekuli i fex.(HCl) \u003d 1; U jednoj molekuli NaOH-a uključen je jedan ion u reakciju, prema tome, Naoh je ekvivalent molekuli Naoh i fex.(Naoh) \u003d 1.
U H3PO4 + 2 Anaoh reakciji → Na2nro4 + 2N2O
jedna molekula H3RO4 reagira sa dva molekula, ili sa dva ekvivalenta, NaOH, dakle, fex.(H3RO4) \u003d ½ i m (½n3ro4) \u003d ½m (H3RO4) \u003d 49,00 g / mol.
U reakciji NH4CL + NAOH → NH3 + NACL + H2O
jedan molekul amonijum-hlorida reagira s jednom molekulom, ili jednom ekvivalentnom, Naon, pa tako fECW. (NN4SL) \u003d 1, a molarna masa NH4Cl ekvivalenta jednaka je molarnoj masi od 53,49 g / mol.
U redox reakcija:
K2CR2O7 + 3K2SO3 + 4H2SO4 → 4K2SO4 + CR2 (SO4) 3 + 4H2O
u skladu s jednadžbom polu-resursa za oporavak:
CR2O72- + 14h + 6 j → 2cr3 + + 7H2O
jedan CR2O72 ion prima 6 elektrona, pa fex.(K2sr2o7) \u003d fex.(CR2O72-) \u003d 1/6 i m (1/62CR2O7) \u003d 1/6 m (K2CR2O7) \u003d 49,03 g / mol.
U skladu s jednadžbom oksidacijskog polu-formacije:
SO32- + H2O - 2 → SO42- + 2H +
jedan ion So32- daje dva elektrona, tako fex.(Na2SO3) \u003d Fex.(SO32-) \u003d ½ i m (½na2so3) \u003d ½m (NA2SO3) \u003d 63,02 g / mol.
2. Karakteristike rješenja koja se koriste u proračunima u titrimimetry
Molarna koncentracija tvariAli u rješenjuSa) mOL / DM3 (MOL / L) prikazuje broj molova supstanceAli, rješenje sadržano u 1 dm3 (l):
https://pandia.ru/text/80/149/images/image002_91.gif "width \u003d" 235 "visina \u003d" 43 src \u003d "\u003e (3.2)
gde je n (1 / z a) iznos supstance ekvivalentnog A, MOL-a, rastvorenog u V DM3 (L) rješenja;
M (1 / z a) - molarna masa ekvivalencije tvari A, G / MOL;
1 / Z - Faktor ekvivalencije.
Titar tvariT (a), g / cm3 (g / ml) - masovna koncentracija, pokazuje koliko grama rastvorene supstanceAli Sadržano u 1 cm3 (ml) rješenja:
https://pandia.ru/text/80/149/images/image004_74.gif "width \u003d" 253 "visina \u003d" 41 src \u003d "\u003e, (3.4)
gdje je t (t) titar titranta, g / cm3 (g / ml);
M (1 / z x) - molarna masa ekvivalenta utvrđene tvari, g / mol;
M (1 / z t) - molarna masa ekvivalenta titranta, g / mol;
C (1 / z t) je molarna koncentracija ekvivalenta titranta, MOL / DM3 (MOL / L).
Korekcijski faktorF - vrijednost koja označava koliko puta je praktična molarna koncentracija ekvivalenta titrantaSa (1 / zt) pr. njegov titerT (t) . ili tutrimetrijski faktor za rekalkulacijut (t / x) pr. razlikuju se od odgovarajućih "teorijskih" vrijednostiC (1 / ZT) Teorem., T (t) Theore. it (t / x) teorema., naveden u metodologiji.
Div_adblock324 "\u003e
ako se koristi molarna koncentracija tvari;
ako se koristi molarna koncentracija ekvivalenta tvari;
m (a) \u003d t (a) · V (a) · 103,
ako se koristi titar tvari, i
![]()
ako se koristi tritimetrijski faktor rekalkulacije (titer za otkrivenu supstancu).
3.2. Izračun koncentracije pripremljenog rješenja
Vrijednosti koncentracija rješenja pripremljenih iz hidrauličkih rješenja izračunavaju se formulama (3.1 - 3.3).
3.3. Priprema rješenja razrjeđivanjem više koncentriranih rješenja
Prilikom razrjeđivanja otopine vodom (ili drugom otapalom) količini supstanci a i količinu ekvivalentne supstance i ne mijenjajte se, dakle
n1 (a) \u003d n2 (a) i
n1 (1 / za) \u003d N2 (1 / ZA),
stoga možete napisati:
C1 (a) · V1 (a) \u003d C2 (a) · V2 (a)
C1 (1 / za) · V1 (a) \u003d C2 (1 / ZA) · V2 (A),
tamo gdje su indeksi 1 i 2 rješenja prije i nakon razrjeđivanja, respektivno.
4. Standardizacija Tontratte
4.1. Izračun molarni koncentracija ekvivalenta titranta
4.1.1. Metoda pojedinih apartmana
Standard standardne mase supstance M (A) rastvoren je u vodi, a rezultirajuće otopine titrira rješenje titrana zapremine V (T). U ovom slučaju, zakon ekvivalenta ima obrazac:
n (1 / z a) \u003d n (1 / z t)
https://pandia.ru/text/80/149/images/image010_50.gif "width \u003d" 154 "visina \u003d" 39 src \u003d "\u003e.
4.1.2. Metoda pipenetizacije (alikvot)
Poznati volumen standardnog rješenja V (a) sa koncentracijom sa (1 / z a) titrira se rješenjem količine V (t). U ovom slučaju, zakon ekvivalenta ima obrazac:
https://pandia.ru/text/80/149/images/image012_43.gif "width \u003d" 145 "visina \u003d" 39 src \u003d "\u003e
4.2. Izračun titrimetrijskih faktorskih rekalkulacija, titra i korekcije korekcije titranta
Tion exirt of tttrant t (t) (g / ml) izračunava formulom
https://pandia.ru/text/80/149/images/image014_22.gif "width \u003d" 154 "visina \u003d" 64 src \u003d "\u003e
gdje je m (x) masa određene tvari x u hitcu.
Stoga je masa utvrđene tvari x u sakrij jednaka:
m (x) \u003d c (1 / zt) ∙ V (t) ∙ m (1 / zx).
Prilikom obavljanja masovnih analiza, prikladno je izračunati masu utvrđene tvari koristeći tUTRIMETRIČKI FAKTOR REKALKULACIJE (TITER ZA ODREĐENU TREBA)t (t / x).
Ako se titriranje analiziranog uzorka konzumira zapremine titrana V (t), L sa titrom otkrivene supstance T (t / x), masa tvari jednaka je:
m (x) \u003d t (t / x) ∙ V (t) ∙ 103.
Kada titracija alicvoal osoblje Rješenje određene tvari za količinu V (x) Zakon ekvivalenta ima obrazac:
https://pandia.ru/text/80/149/images/image016_19.gif "width \u003d" 165 "visina \u003d" 39 src \u003d "\u003e
i masa utvrđene tvari u VK tikvici:
https://pandia.ru/text/80/149/images/image018_17.gif "width \u003d" 184 "visina \u003d" 41 src \u003d "\u003e.
5.1.2. Zamjenik titracije
Očigledan višak reagensa A dodaje se određenoj supstanci x i supstituent supstituent oslobađa se u iznosu ekvivalentnom tvari:
X + A → B + ...
Zamjenik titriranog TTRANS T:
B + T → C + ...
Zakon ekvivalenta za supstituciju titracija ima obrazac:
https://pandia.ru/text/80/149/images/image027_11.gif "width \u003d" 120 "visina \u003d" 91 "\u003e
gdje je w (x) masovna djela X u uzorku,
w% (x) je masovna djela supstance x u uzorku,%,
m (x) je masa x tvari u uzorku.