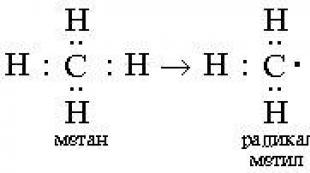Kimyo bo'yicha taqdimot. Karboksilik kislotalar - taqdimot. Mavzu bo'yicha taqdimot "Karboksilik kislotalar" Monobasik karboksilik kislotalar taqdimoti
1. Karbon kislotalarning funksional guruhi va umumiy formulasini toping.
2. Ta'rifni shakllantirish.
3. Karboksilik kislotalarning tasnifini o'rganing.
4. Nomenklaturani o‘zlashtirish malakalari.
5. Eng muhim karboksilik kislotalarning fizik va kimyoviy xossalarini ko'rib chiqing.
6. Ayrim karboksilik kislotalarning qo’llanish sohalarini aniqlang.
Yuklab oling:
Ko‘rib chiqish:
Taqdimotni oldindan ko‘rishdan foydalanish uchun Google hisobini yarating va unga kiring: https://accounts.google.com
Slayd sarlavhalari:
Vazifalar 1. Karbon kislotalarning funksional guruhi va umumiy formulasini toping. 2. Ta'rifni shakllantirish. 3. Karboksilik kislotalarning tasnifini o'rganing. 4. Nomenklaturani o‘zlashtirish malakalari. 5. Eng muhim karboksilik kislotalarning fizik va kimyoviy xossalarini ko'rib chiqing. 6. Ayrim karboksilik kislotalarning qo’llanish sohalarini aniqlang.
Barcha karboksilik kislotalar funksional guruhga ega - C OH O Karbonil guruhi Gidroksil guruhi Karboksil guruhi Umumiy formulasi R C OH O C n H 2n +1 C Yoki to'yingan bir asosli kislotalar O OH uchunmi? Karboksilik kislotalar nima deyiladi? Karboksilik kislotalar - molekulalarida uglevodorod radikali bilan bog'langan COOH karboksil guruhi bo'lgan organik birikmalar. ? Karboksilik kislotalar ilgari o'rganilgan aldegidlar sinfiga genetik jihatdan qanday bog'liq? R C O H + [O] R C O OH [O]= KM nO 4, K 2 Cr 2 O 7+ H 2 SO 4 kons.
Karboksilik kislotalarning tasnifi Karboksil guruhlar soniga qarab Bir asosli Ikki asosli (sirka) (oksalat) CH 3 C C - CO OH Ko'p asosli (limon) O OH O HO N 2 C - C O OH HC - C O OH H 2 C - C O OH. Radikalning tabiatiga qarab Toʻyingan (propionik) O CH 3- CH 2- C OH Toʻyinmagan (akril) O CH 2 =CH-C OH Aromatik (benzoy) CO OH C atomlarining tarkibiga koʻra: C 1 -C 9 - past, 10 yoki undan ko'p - yuqori
Taklif etilayotgan kislotalarni tasniflang 1) C H 3 - CH 2 - CH 2 - CH 2 - COOH 2) HOOC - CH 2 - CH 2 - COOH 3) COOH 4) CH 3 - (C H 2) 7 - CH = CH - ( CH 2) 7 - COOH 5) HOOC - CH 2 - CH - CH 2 - COOH COOH CH 3 1. Bir asosli, cheklovchi, pastki 2. Ikki asosli, cheklovchi, pastki 3. Bir asosli, cheklovchi, pastki 4. Birobasik, to'yinmagan, eng yuqori 5. .Polybasic, yakuniy, eng past
KARBOKSIL KISLOTALARNING NOMENKLATURASI ALKAN + OH + OHIK KISLOTA METANI OHIK KISLOTA (FOM kislotasi)
CH3 – COOH 1 2 ETAN KISlotasi (sirka kislotasi) CH3 – CH2 – CH2 - COOH 1 2 3 4 BUTAN KISLOTA (BUTRIAL KISLOTA)
CH3 – CH2 – CH2 – CH2 – COOH PENTAN KISlotasi (VALERYAN KISLOTA) 1 2 3 4 5 HOOC – COOH ETAN KISITASI (OKSAL KISLOTASI) 1 2
Karboksilik kislotalarning gomologik qatori Kimyoviy formulasi Kislotaning sistematik nomi Kislotaning ahamiyatsiz nomi Kislotali qoldiqning nomi HCOO H CH3COO da shaklli shakli N CH3CH2COO da sirka atsetat N CH3CH2CH2COO da propion propion N CH3CH2CH2COO da butirik va CH3CH2COO N CCH2 da butirik (CH3CH2COO N da Formik) N2)4–SOO N CH3-(CH2)8 da Kapronovaya kapron – CH3-(CH2)14 da COO N kaprik kapron – CH3-(CH2)14 da COO N Palmitik palmitat CH3-(CH2)16- COO N Stearik stearat Metan Etan Propan Butan Pentan Geksan Dekan Hexadecane Oktadekan
Karboksilik kislotalarni nomlash algoritmi: 1. Biz uglerod atomlarining asosiy zanjirini topamiz va uni karboksil guruhidan boshlab raqamlaymiz. 2. O‘rinbosarlarning o‘rnini va ularning nom(lar)ini ko‘rsatamiz. 3. Zanjirdagi uglerod atomlari sonini ko'rsatuvchi ildizdan keyin “-ic” kislota qo'shimchasi keladi. 4. Agar bir nechta karboksil guruhlar bo'lsa, u holda “- ova” dan oldin raqam qo'yiladi (-di, - uch...) Misol: 3-metilbutan + -ova = 3-metilbutan kislotasi
MADDALARNING XALQARO NOMENKLATURA (2 – METIL PROPAN KISlotasi) CH3 – CH – COOH 2. CH3 – CH2 – CH – CH – COOH 3. CH3 – CH = CH – CH – HO – COOH 42 BO‘YICHA NOMLARINI BERING. – CH – COOH (2, 3 – DIMEtil pentan kislotasi) (2 – metil pentan kislotasi) (2 – ETIL butan kislotasi) CH3 CH3 CH3 CH3 C 2 H 5
: 1 . Karboksil guruhini o'z ichiga olgan kompozitsiyadagi uglerod skeletini yozadigan so'zning ildizini tanlang. 2. Karboksil guruhidan boshlab uglerod atomlarini raqamlaymiz. 3. O‘rinbosarlarni raqamlash bo‘yicha ko‘rsatamiz. 4. Yo'qolgan vodorod atomlarini qo'shish kerak (uglerod tetravalent). 5. Formulaning to'g'ri yozilganligini tekshiring. 2-metilbutan kislotasi. Misol: Karbon kislotalarning formulalarini yozish algoritmi
Jismoniy xususiyatlari C 1 – C 3 Xarakterli o'tkir hidli suyuqliklar, suvda yaxshi eriydi C 4 – C 9 Noxush hidli yopishqoq yog'li suyuqliklar, suvda yomon eriydi C 10 va undan ko'p Hidsiz qattiq moddalar, suvda erimaydi.
Fizik holati suyuqlik Rangsiz shaffof suyuqlik Hidi o'tkir sirka Suvda eruvchanligi yaxshi Qaynash harorati 118 º C Erish nuqtasi 17 º C Sirka kislotasining fizik xossalari:
Pastki karboksilik kislotalar suyuqlikdir; yuqori - qattiq moddalar.Kislotaning nisbiy molekulyar og'irligi qanchalik katta bo'lsa, uning hidi kamroq bo'ladi. Kislotaning nisbiy molekulyar og'irligi oshishi bilan eruvchanligi pasayadi.Karbon kislotalarning fizik xossalarining molekula tuzilishiga bog'liqligi: Aldegidlarning gomologik qatori ikkita gazsimon moddadan (xona haroratida) boshlanadi va yo'q. karboksilik kislotalar orasidagi gazlar. Bu nima bilan bog'liq?
Karboksilik kislotalarning kimyoviy xossalari I. Noorganik kislotalar bilan umumiy Eruvchan karboksilik kislotalar suvli eritmalarda dissotsilanadi: CH 3 – COOH CH 3 – COO + H + Muhit kislotalimi? Kislotali muhitda indikatorlarning rangi qanday o'zgaradi? Litmus (binafsha) - qizil rangga aylanadi Metil apelsin - pushti rangga aylanadi Fenoftalein - rangi o'zgarmaydi 2. Elektrokimyoviy kuchlanish qatoridagi metallar bilan vodorodgacha o'zaro ta'siri: 2CH 3 - COOH + M g Sirka kislotasi (CH 3 -COO) 2 M g Magniy asetat + H 2 2CH 3 - COOH + Zn Sirka kislotasi (CH 3 –COO) 2 Zn Rux asetat + H 2 Metall karboksilik kislota eritmasi bilan reaksiyaga kirishganda, vodorod va tuz hosil bo'ladi.
3. Asosiy oksidlar bilan oʻzaro taʼsiri: 2 CH 3 – COOH + C u O Sirka kislotasi t (CH 3 – COO) 2 C u Mis asetat + H 2 O 4. Metall gidroksidlar bilan oʻzaro taʼsiri (neytrallanish reaksiyasi) CH 3 – COOH + H O. – Na Sirka kislotasi CH 3 COO Na Natriy asetat + H 2 O 5. Kuchsiz va uchuvchi kislotalarning tuzlari bilan oʻzaro taʼsiri (masalan, karbonat, kremniy, vodorod sulfid, stearik, palmitik...) 2CH 3 – COOH Sirka kislotasi + Na 2 CO 3 natriy karbonat 2CH 3 COO Na Natriy asetat + H 2 CO 3 CO 2 H 2 O 2 CH3 – COOH + Cu(OH) 2 Sirka kislotasi (CH3COO) 2 Cu Mis asetat + H2O
Chumoli kislotaning o'ziga xos xossalari “Kumush oyna” reaksiyasi H- CO OH + Ag 2 O t 2Ag + H 2 CO 3 CO 2 H 2 O Chumoli kislota Kumush oksidi kumush
Karboksilik kislotalarning tabiatida paydo bo'lishi va ishlatilishi Chumoli kislotasi (Metanik kislota) - Kimyoviy formula CH2O2, yoki HCOOH. - Chumoli kislotasi qizil chumolilarning kislotali sekretsiyalarida 1670 yilda ingliz tabiatshunosi Jon Rey tomonidan topilgan. Chumoli kislota eng nozik qichitqi o'ti tuklarida, ari zahari, qarag'ay ignalarida ham mavjud bo'lib, turli xil mevalar, to'qimalar, organlar, hayvonlar va odamlarning sirlarida oz miqdorda bo'ladi.
Savol: Nega chumoli chaqishi yoki qichitqi chaqishi joyini suv bilan namlay olmaysiz? Bu faqat og'riqning kuchayishiga olib keladi. Nima uchun jarohatlangan joy ammiak bilan namlangan bo'lsa, og'riq susayadi? Bu holatda yana nimadan foydalanish mumkin? Chumoli kislota suvda eritilganda elektrolitik dissotsilanish jarayoni sodir bo'ladi: HCOOH HCOO + H Natijada muhitning kislotaliligi oshadi va terining korroziyasi jarayoni kuchayadi. Og'riqni yo'qotish uchun siz kislotani zararsizlantirishingiz kerak, buning uchun gidroksidi reaktsiyaga ega bo'lgan eritmalardan, masalan, ammiak eritmasidan foydalanishingiz kerak. HCOOH + N H4OH HCOO NH4 + H2O yoki HCOOH + NaHCO3 HCOO Na + CO2 + H2O
Sirka kislotasi (etanik kislota) Bu inson tomonidan olingan va ishlatiladigan birinchi kislota. 4 ming yildan ko'proq vaqt oldin Qadimgi Misrda "tug'ilgan". 17-18-asrlar oxirida Rossiyada u "nordon namlik" deb nomlangan. Biz uni birinchi marta sharob pishirish paytida oldik. Lotincha nomi Acetum acidum, shuning uchun tuzlarning nomi - asetatlar. Muzlik sirka kislotasi 16,8 ºC dan past haroratlarda qattiqlashadi va muzga o'xshaydi - Sirka mohiyati - 70% kislota eritmasi. - Stol sirkasi - 6% yoki 9% kislota eritmasi. Sirka kislotasi - hayvonlarning sekretsiyasi (siydik, safro, najas), o'simliklarda (xususan, yashil barglar), nordon sut va pishloqda mavjud; - vino va pivoning fermentatsiyasi, chirishi, nordonlanishi va ko'plab organik moddalarning oksidlanishi paytida hosil bo'ladi;
Sirka kislotasini qo'llash - Sirka kislotasining suvli eritmalari oziq-ovqat sanoatida (oziq-ovqat qo'shimchasi E-260) va maishiy pazandachilikda, shuningdek konservalashda keng qo'llaniladi; ishlab chiqarishda: dorilar, masalan, aspirin; sun'iy tolalar, masalan, ipak asetat; indigo bo'yoqlari, yonmaydigan plyonka, organik shisha; lak erituvchilar; kimyoviy o'simliklarni himoya qilish vositalari, o'simliklar o'sishi stimulyatorlari; Natriy asetat CH3COO N a qon quyish uchun mo'ljallangan konservant sifatida ishlatiladi; Kaliy asetat CH3COOK - diuretik sifatida; Qo'rg'oshin asetat (CH3COO) 2 Pb - siydikda shakarni aniqlash uchun; Temir (III) (CH3COO)3Fe, alyuminiy (CH3COO) 3Al va xrom (III) (CH3COO) 3Cr atsetatlari to'qimachilik sanoatida mordan bo'yash uchun ishlatiladi; Mis (II) asetat (CH3COO) 2 C u Parij yashil deb ataladigan o'simlik zararkunandalariga qarshi kurashish uchun tayyorgarlikning bir qismidir;
Sirka kislotasidan foydalanish Kosmetologiyada spirtli sirkadan foydalanish ma'lum. Ya'ni, perm va doimiy bo'yashdan keyin sochlarga yumshoqlik va yorqinlik berish. Buning uchun spirtli sirka (1 litr suv uchun 3-4 osh qoshiq sirka) qo'shilgan holda sochlaringizni iliq suv bilan yuvish tavsiya etiladi. Xalq tabobatida sirka nonspesifik antipiretik sifatida ishlatiladi. losonlar yordamida bosh og'rig'i uchun. kompresslar yordamida hasharotlar chaqishi uchun. parfyumeriya mahsulotlarini ishlab chiqarishda ajralmas Buni bilasizmi - Agar zanglagan gaykani ochish kerak bo'lsa, kechqurun unga sirka kislotasi namlangan latta qo'yish tavsiya etiladi? Ertalab bu yong'oqni ochish ancha oson bo'ladi. - Kun davomida organizmda 400 g sirka kislota hosil bo'ladi? Bu 8 litr oddiy sirka qilish uchun etarli bo'ladi
Barcha kislotalardan, Bu, albatta, prima. Hamma joyda ko'rinadigan va ko'rinmas holda mavjud. U hayvonlar va o'simliklarda mavjud, Texnologiya va tibbiyot abadiy u bilan. Uning avlodlari asetatlar - juda zarur "yigitlar". Taniqli aspirin, yaxshi janob kabi, bemorning isitmasini pasaytiradi va sog'lig'ini tiklaydi. Bu mis asetat. U o'simliklarning do'sti va ukasi, Dushmanlarini o'ldiradi. Kislota hali ham ma'lum darajada qo'llaniladi - u bizni asetat ipakdan tikadi. Va kimki köfte sevsa, sirkani uzoq vaqtdan beri biladi. Kino haqida ham savol bor: hamma bilishi kerakki, asetat plyonkasisiz biz kino ko'ra olmaymiz. Albatta, boshqa maqsadlarda foydalanish mumkin. Va siz ularni shubhasiz bilasiz. Lekin aytiladigan asosiy narsa, do'stlar, "Sanoat noni": sirka kislotasi. CH 3 COOH CH3COOH Mis asetatning suvli eritmasi
Limon kislotasi COOH HOOC – CH 2 – C – CH 2 – COOH OH oksalat kislotasi HOOC –– COOH Chumoli kislota H –– COOH Asetilsalitsil kislotasi COOH OCOCH 3 tartarik kislota HOOC – CH - CH –– COOH OH OH Sut kislotasi CH 3 - CH –– COOH OH Molik kislota HOOC – CH - CH 2 –– COOH OH Suksin kislotasi HOOC – CH 2 - CH 2 –– COOH Benzoy kislotasi COOH Askorbin kislota H O OH H =O HOH 2 C-NONS O Sirka kislota H 3 C – – COOH Karboksilik kislotalar kislotalikni oshirish tartibida
Xulosa 1. Karboksilik kislotalar - molekulalarida uglevodorod radikali bilan bog'langan karboksil guruhi - COOH bo'lgan organik birikmalar. 2.Karboksilik kislotalar quyidagilarga bo'linadi: asosliligiga ko'ra (mono-, ikki va ko'p asosli) uglevodorod radikaliga (to'yingan, to'yinmagan va aromatik) C atomlarining tarkibiga ko'ra (pastki va yuqori) 3. Karbon kislotaning nomi quyidagilardan iborat: alkan + tuxum kislotasining nomi. 4. Karboksilik kislotaning molekulyar massasi ortishi bilan kislotaning eruvchanligi va kuchi kamayadi. 5. Noorganik kislotalar kabi eriydigan karboksilik kislotalar suvli eritmada dissotsiatsiyalanib, vodorod ionlarini hosil qiladi va indikator rangini o'zgartiradi. Ular metallar (H gacha), asosiy va amfoter oksidlar va gidroksidlar, kuchsiz kislotalarning tuzlari bilan reaksiyaga kirishib, tuzlar hosil qiladi. 6 Tabiatda keng tarqalgan va odamlar uchun katta amaliy ahamiyatga ega.
Uy vazifasi § 14, mashqlar No 6 mashq No 9 Qirolicha Kleopatra sud shifokorining maslahati bilan zargarlarga ma'lum bo'lgan eng katta marvaridni sirkada eritib, keyin olingan eritmani bir muncha vaqt oldi. Kleopatra qanday munosabatda bo'ldi? U qanday aloqani o'rnatdi? 3. Yuqori karboksilik kislotalar haqida hisobot tayyorlang
E'tiboringiz uchun rahmat
Karboksilik kislotalar
Slaydlar: 41 ta soʻz: 1295 ta tovush: 24 ta effekt: 62 taKarboksilik kislotalar. Barcha karboksilik kislotalar funktsional guruhga ega. Karboksilik kislotalar nima deyiladi? O'z-o'zini nazorat qilish vazifasi. Karboksilik kislotalarning nomenklaturasi. Tabiatdagi karboksilik kislotalar. Karboksilik kislotalarning umumiy formulasi. Karboksil guruhining tuzilishi. Karboksilik kislotalarning fizik xossalari. To'yingan karboksilik kislotalarning fizik xossalari. Karboksilik kislotalarning kimyoviy xossalari. Galogenlar bilan reaksiya. Karboksilik kislotalarni tayyorlash. Karboksilik kislota molekulalari dimerlarni hosil qiladi. Karboksilik kislotalarni aniqlashni takrorlang. Efirlarning nomenklaturasi. Tabiatdagi esterlar. Mis asetat. - Kislotalar 1.ppt
Karboksilik kislotalarning o'zaro ta'siri
Slaydlar: 14 ta so‘z: 359 ta tovush: 0 ta effekt: 0Karboksilik kislotalar. To'yingan monobazik karboksilik kislotalarning tarkibi O R - C OH umumiy formulasiga mos keladi. Tasniflash. Kislotalarga misollar. Izomerizm. Tuzilishi. Fizikaviy va kimyoviy xossalari. Pastki karboksilik kislotalar o'tkir hidli suyuqliklar, suvda yaxshi eriydi. CH3COOH + SOCl2 CH3COCl + HCl + SO2. Qabul qilish usullari. 4. Efirlarning gidrolizi: 5. Kislota angidridlarining gidrolizi: Tayyorlashning o'ziga xos usullari. Alohida kislotalar uchun maxsus tayyorlash usullari mavjud: Karboksilik kislotalardan foydalanish. Yelim. Gerbitsidlar. Konservant, ziravorlar. Parfyumeriya, kosmetika. - Karboksilik kislotalar.ppt
Karboksilik kislotalarning xossalari
Slaydlar: 21 ta so‘z: 424 ta tovush: 0 ta effekt: 96 taKarboksilik kislotalar. Organik kimyo 11-sinf. -COOH karboksil guruhi. Metandioik kislota (dikarboksilik kislota). 2-gidroksipropanik kislota (2-gidroksi-1,2,3-propanetrikkarboksilik kislota). Jismoniy xususiyatlar. Molekulaning qutblanishi. Vodorod aloqalarini hosil qilish imkoniyati. Yuqori qaynash nuqtalari. Sirka kislotasining dimeri. Suvda eruvchanligi. Karboksil guruhining tuzilishi. Radikallar. Nukleofillar. Elektrofillar. Kimyoviy xossalari. Ular kislotalarning umumiy xossalarini namoyon qiladi. Karboksilik kislota. Magniy karboksilat. Etan kislotasi. Magniy etanat. Kaltsiy etat. Natriy metan. - Karboksilik kislotalar 1.ppt
Tabiatdagi karboksilik kislotalar
Slaydlar: 20 ta so‘z: 379 ta tovush: 0 ta effekt: 0Karboksilik kislotalar. Ba'zi umumiy kislotalarning formulalari va nomlari. Kislota qoldiqlarining formulalari va nomlari. Pastki karboksilik kislotalar. - o'tkir hidli rangsiz suyuqliklar. Molyar massa ortishi bilan qaynash nuqtasi ortadi. ...Tabiatdagi karboksilik kislotalar: C2H5COOH – daraxt smolasi. C3H7COOH - sariyog '. C4H9COOH - valeriana o'tining ildizlari. C6H5COOH - chinnigullar yog'i. Eng oddiy karboksilik kislotalar. E'tibor bering... HCOOH kislotasi aldegidlar kabi "kumush oyna" reaktsiyasiga kiradi: Va suvni olib tashlaydigan moddalar ta'sirida parchalanadi: Karboksilik kislotalarni olish. - Karboksilik kislotalar 2.ppt
Karboksilik kislota
Slaydlar: 9 ta so‘z: 193 ta tovush: 0 ta effekt: 0 taTaqdimot. Karboksilik kislotalar. Darsning maqsadi. Xalqaro va ahamiyatsiz nomenklaturalar asoslarini, karboksilik kislotalardan foydalanishni ko'rib chiqing. Karboksil guruhining tuzilishini tahlil qiling va karboksilik kislotalarning kimyoviy harakatini taxmin qiling. Karboksilik kislotalarning tasnifi. Karboksil guruhlar soniga ko'ra. Cheksiz. Aromatik. Monobasik. Ikki asosli. Ko'p asosli. Cheklash. Uglevodorod radikalining turiga ko'ra. Cheklovchi qatordagi bir asosli kislotalarning umumiy formulasi. CnH2n+1COOH bu yerda n nolga teng bo'lishi mumkin. Eng oddiy karboksilik kislotalar. Ayrim karboksilik kislotalarning formulalari va nomlari. - Karboksilik kislotalar 3.ppt
Karbon kislotalar
Slaydlar: 14 ta so‘z: 889 ta tovush: 0 ta effekt: 0Karboksilik kislotalar. Tuzilishi. Molekulasida bitta karboksil guruhi bo'lgan organik kislotalar bir asosli. Ikki karboksil guruhini o'z ichiga olgan karboksilik kislotalar ikki asosli deb ataladi. Oksalat kislotasi. To'yingan (yoki to'yingan) karboksilik kislotalar uglevodorod radikalida a-bog'larni o'z ichiga olmaydi. Masalan, benzoy kislotasi: Nomenklatura va izomeriya. Uglerod atomlarini raqamlash karboksil guruhidan boshlanadi. Metan (chumoli) kislotasi. Etandionik (oksalat) kislota. To'yingan bir asosli karboksilik kislotalarning fizik xususiyatlari. Kimyoviy xossalari. - Karboksilik kislotalar 4.ppt
To'yinmagan karboksilik kislotalar
Slaydlar: 11 ta soʻz: 305 ta tovush: 0 ta effekt: 37 taTo'yinmagan karboksilik kislotalar. Jismoniy xususiyatlar. Izomerizm. Qabul qilish usullari. Kimyoviy xossalari. Biologik tuzilish. Ilova. Akril kislota. Metakril kislota. CH2=CH-coon. CH2=c-coon. CH3. Oleyk kislotasi. CH3 – (CH2)7-CH=CH-(CH2)7 -koon. Linoleik kislota. CH3-(CH2)4-CH=CH-CH2-CH=CH-(CH2)7-koon. Linolenik kislota. CH3-SN2-CH=CH-CH2-CH=CH-CH2-CH=CH-(CH2)7-coon. To'yinmagan karboksilik kislotalarning izomeriyasi. Uglerod zanjiri. Ikki tomonlama bog'lanish pozitsiyalari. Geometrik (sis-trans izomerizm). Oleyk kislotaning geometrik izomerlari. Azot oksidlari. Elaid kislotasi. - Karboksilik kislotalar 5.ppt
Sirka va stearik kislotalar
Slaydlar: 14 ta so‘z: 236 ta tovush: 0 ta effekt: 09-sinf 6-dars.Karbon kislotalar. Dars rejasi. Karboksilik kislotalar haqida tushuncha. Sirka kislotasi. Stearin kislotasi. Savollar va mashqlar. 1. Karbon kislotalar haqida tushuncha. Karboksil guruhining tuzilish formulasi: O C O H. -Kun. Karboksilik kislota. Karboksilat anioni. Karboksilik kislotalar orasida bir tonna mashhur "shaxslar" mavjud. Kislotalarda karboksil guruhlari bor, lekin bu yerdagi barcha kislotalar kuchli emas. 2. Sirka kislotasi. Sirka kislotasi CH3COOH organik kislotalarning eng qadimgisidir. Sof sirka kislotasi o'tkir hidli rangli suyuqlikdir. Sirka kislotasi kimyo sanoatida ko'p miqdorda qo'llaniladi. - Karboksilik kislotalar 6.ppt
Karboksilik kislotalar kimyosi
Slaydlar: 14 ta so‘z: 341 ta tovush: 0 ta effekt: 0Karboksilik kislotalar. Leksiya. 1. Kislotalarni aniqlash. 2. Gomologik qatorlar. Eng oddiy vakillari to'yingan monobazik karboksilik kislotalardir. Yagona funktsional karboksil guruhini tashkil etuvchi karbonil va gidroksil guruhlari. Karboksilik kislotalarning xossalari mavjudligiga bog'liq. Almashtirish 2-uglerod atomida sodir bo'ladi va katalizatorda sodir bo'ladi. Bu reaksiya aminokislotalarni ishlab chiqarish uchun oraliq reaksiya hisoblanadi. Karboksilik kislotalar guruhi. Aldegid guruhi. Oleyk kislotasi. 9,10 - dibromostear kislotasi. Oleyk kislota yuqori to'yinmagan karboksilik kislotalarga tegishli. - Karboksilik kislotalar chemistry.ppt
Karboksilik kislotalarning sinflari
Slaydlar: 33 ta soʻz: 809 ta tovush: 0 ta effekt: 13 taKislorod o'z ichiga olgan organik birikmalar. Karboksilik kislotalar. Karboksilik kislotalarni tayyorlash. Umumiy formula. Ta'rif. Karboksilik kislotalarning tasnifi. Karbon kislotalarning uglevodorod radikalining tabiatiga ko'ra tasnifi. Karboksilik kislotalarning funktsional guruhlar soni bo'yicha tasnifi. Bir asosli karboksilik kislotalarning vakillari. Kislotalarning gomologik qatori. Karboksilik kislotalarning nomenklaturasi. Karboksilik kislotalarning izomeriyasi. Karboksilik kislotalarning fizik xossalari. Karboksilik kislotalarni qo'llash. Organik birikmalar ishlab chiqarish. Metilbutan kislotasi. Funktsional guruh. - Karboksilik kislotalar sinflari.ppt
Karboksilik kislotalarga misollar
Slaydlar: 15 ta soʻz: 563 ta tovush: 0 ta effekt: 10 taKarboksilik kislotalar. Strukturani o'rganish. Bu organik moddalar. Valerik kislota. Ko'rsatkich. Formik kislota. Karboksilik kislotalarning tasnifi. Oksalat kislotasi. Limon kislotasi. Sirka kislotasi. Karboksilik kislotalarning kimyoviy xossalari. Ular efirlarni hosil qiladi. Stearin kislotasi. Kislotalar. - Karboksilik kislotalarga misollar.ppt
Karboksilik kislotalarning xossalari
Slaydlar: 24 ta so'z: 328 ta tovush: 0 ta effekt: 0Kimyo fanidan dars ishlanmasi. Funktsional guruh tushunchasi. Balki qila olaman deb o'ylagandir. Organik moddalarning yangi sinfini tavsiflang. Kislota. Kislota xossalari. Karboksil guruhi. Monobasik karboksilik kislotalar. Organik moddalar. Xarakterlash rejasi. Karboksilik kislotalar. Tasniflash. Strukturaviy izomeriya. Jismoniy xususiyatlar. Dimer tuzilishi. Elektron siljishi. Kimyoviy xossalari. Suvli eritmada dissotsilanish. Xususiyatlari. - karboksilik kislotalarning xossalari.ppt
Karboksilik kislotalar va ularning xossalari
Slaydlar: 28 ta soʻz: 1463 ta tovush: 0 ta effekt: 65 taKarboksilik kislotalar. Kislotalarning kashfiyoti. Organik kislotalar bilan bog'liq qiziqarli tarixiy faktlar. Formik kislotani o'z ichiga olgan qichitqi o'ti. Tabiatdagi karboksilik kislotalar. Formik kislota birinchi marta 17-asrda ajratilgan. Sirka kislotasi tabiatda keng tarqalgan. Organik moddalar. R-COOH. Karboksilik kislotalarning nomenklaturasi. Tasniflash. Dikarboksilik kislotalar. Karboksilik kislotalarni nomlash algoritmi. Karboksilik kislotalarning formulalarini yozish algoritmi. Moddani nomlang. Etanik yoki sirka kislotasi. Xlorasetik kislota yoki xloretanoik kislota. Qaysi kislota kuchliroq? - Karbon kislotalar va ularning xossalari.pptx
Karboksilik kislotalarning kimyoviy xossalari
Slaydlar: 17 ta so‘z: 666 ta tovush: 0 ta effekt: 25 taKarboksilik kislotalarning kimyoviy xossalari. Bilim sari yo'l. Kimyoviy xossalari. Funktsional guruh. Karboksilik kislotalarning formulalari. Karboksilik kislotalarning nomi. Karboksilik kislotalarning ahamiyatsiz nomlari. Karboksil guruhining tuzilishi. Formik kislota. Salitsil kislotasi. Oksalat kislotasi. Noorganik kislotalarning kimyoviy xossalari. Karboksilik kislotalarning umumiy xossalari. Karboksilik kislotalar. Vazifa. - karboksilik kislotalarning kimyoviy xossalari.ppt
Karboksilik kislota hosilalari
Slaydlar: 19 So‘z: 412 Ovoz: 0 Effekt: 127Karboksilik kislotalarning funksional hosilalari. Karboksil. Keton. Karboksilik kislotalarni almashtirish mahsulotlari. Esterlar. Esterifikatsiya. Metan (chumoli) kislotasi. Amidlar. Metanamid. Efir va amidlarning kimyoviy xossalari. Kislota gidrolizi. Qaytariladigan jarayon. Katalizator. Amidlarning gidrolizi. Nukleofilni tark etish. Efirlarning gidrolizi. Mineral kislotalarning efirlari. Sulfat kislotaning efirlari. Fosfor kislotasining efirlari. - karboksilik kislotalarning hosilalari.ppt
To'yingan karboksilik kislotalar
Slaydlar: 41 ta soʻz: 1517 ta tovush: 24 ta effekt: 62 taBir asosli karboksilik kislotalarning tuzilishi. Karboksilik kislotalar. Barcha karboksilik kislotalar funktsional guruhga ega. O'z-o'zini nazorat qilish vazifasi. Arzimas nomlar. Gomologik seriyalar. Jismoniy xususiyatlar. Karboksilik kislotalarning kimyoviy xossalari. Asosiy oksidlar bilan reaksiyaga kirishing. Ushbu kislotalarning qaysi biri kuchliroq? Karboksilik kislotalarni tayyorlash. Etan. Ta'rif. Organik moddalar. Karboksilik kislota formulasini tanlang. Karboksilik kislotalarni aniqlashni takrorlang. Nazariya. Efirlarning nomenklaturasi. Izobutil asetat. Karboksilik kislotalarni nomlang. Dimetilgeksanoik kislota. Mis asetat. - to'yingan karboksilik kislotalar.ppt
To'yingan bir asosli karboksilik kislotalar
Slaydlar: 13 ta soʻz: 764 ta tovush: 1 ta effekt: 20 taTo'yingan karboksilik kislotalarning tuzilishi va nomenklaturasi. To'yingan bir asosli karboksilik kislotalar. Karboksilik kislotalar. Izomeriya turlari. Uglerod atomi. Karboksilik kislotalarni nomlang. Arzimas nomlar. Monobasik karboksilik kislotalar. Jismoniy xususiyatlar. Kashfiyot tarixi. Formik kislota. Gazsimon moddalar. Organik moddalar. - bir asosli karboksilik kislotalarni cheklash.ppt
Yog 'kislotasi
Slaydlar: 44 ta soʻz: 2065 ta tovush: 0 ta effekt: 0.Ko'p to'yinmagan yog'li kislotalar signalizatsiya molekulalari sifatida. 1. Lipidomika va lipidologiya. Klassik paradigma: Postgenomik davr paradigmasi: Lipidomikaga qiziqish quyidagilar bilan bog'liq: 1. Hujayralarni o'rganishga umumiy yondashuvlarning o'zgarishi. Lipidologiya. To'qimalar va hujayralar. Lipid ekstraktlari. Lipid profili. Fermentlar, oqsillar. Tizim boshqaruvi. Lipidomika. Lipidomiklarning boshqa "-omikalar" orasida o'rni. Tizimning qurilishi. Bashorat. Diagnostika. Davolash. 2. Signal molekulalari sifatida araxidon kislotasi va boshqa polien yog 'kislotalari. n-6 Linoleik (18:2n-6) g-Linolenik (18:3n-6) Dihomo-g - linolenik (18:3n-6) Araxidonik (20:4n-6) Dokosatetraenoik (22:4n-6) Dokosapentaenoik (22:5n-6). - Yog 'kislotalari.ppt
Omega kislotasi
Slaydlar: 12 ta so‘z: 617 ta tovush: 0 ta effekt: 0OMEGA 3 va OMEGA 6 ko'p to'yinmagan yog'li kislotalar (PUFA). Shilliq pardalar va terining epiteliysining tuzilishi va funktsiyasi buziladi. Teri shikastlanishi ham xarakterlidir: dermatologik kasalliklar yuzaga keladi va teri osti oqadilar bilan infektsiyaga moyillik mavjud. OMEGA 3 guruhiga kiruvchi eikosapentaenoik va dokozaxeksaenoik yog 'kislotalari o'smalarning o'sishini sekinlashtiradi. PUFAlarni etarli darajada iste'mol qilmasa, hayvonlarning o'sishi sekinlashadi, unumdorligi pasayadi va fiziologik holat yomonlashadi. So'nggi paytlarda OMEGA 3 va OMEGA 6 yog 'kislotalarining immunitet tizimining modulyatorlari sifatida ta'sirini ko'rsatadigan tadqiqotlar o'tkazildi. -


Vazifalar 1. Karbon kislotalarning funksional guruhi va umumiy formulasini toping. 2. Ta'rifni shakllantirish. 3. Karboksilik kislotalarning tasnifini o'rganing. 4. Nomenklaturani o‘zlashtirish malakalari. 5. Eng muhim karboksilik kislotalarning fizik va kimyoviy xossalarini ko'rib chiqing. 6. Ayrim karboksilik kislotalarning qo’llanish sohalarini aniqlang.

Barcha karboksilik kislotalar funksional guruhga ega Karbonil guruhi O - C gidroksil guruhi OH Karboksil guruhi Umumiy formula R C O OH Yoki to‘yingan bir asosli kislotalar uchun O OH Cn H2n+1C? Karboksilik kislotalar nima deyiladi? Karboksilik kislotalar - molekulalarida uglevodorod radikali bilan bog'langan COOH karboksil guruhi bo'lgan organik birikmalar. ? Karboksilik kislotalar ilgari o'rganilgan aldegidlar sinfiga genetik jihatdan qanday bog'liq? R C O H + [O] R C O OH [O]= KMnO4, K2Cr2O7+ H2SO4 kons. Karboksilik kislotalar - molekulalarida uglevodorod radikali bilan bog'langan COOH karboksil guruhi bo'lgan organik birikmalar. R C

Karboksilik kislotalarning tasnifi Karboksil guruhlari soniga qarab bir asosli ikki asosli (sirkali) (oksalat) O OH CH3C C - CO OH O H O radikalining tabiatiga qarab To'yingan (propion) O CH3- CH2-C OH To'yinmagan (akril) O CH2= CH-C OH Ko‘p asosli (limon) O H2C – C OH HC - C O OH O H2C - C OH Aromatik (benzoy) C O OH C atomlarining tarkibiga ko‘ra: C1C9 past, C10 va undan yuqori.

Taklif etilayotgan kislotalarni tasniflang 1) CH3 – CH2 – CH2 – CH2 COOH 1. Bir asosli, to‘yingan, pastki 2) HOOC CH2 CH2 COOH 2. Ikki asosli, to‘yingan, quyi 3) COOH CH3 3. Bir asosli, to‘yingan, quyi 4) CH3 – ( CH2 )7 –CH = CH (CH2)7 COOH 4. Bir asosli, to‘yinmagan, undan yuqori 5) HOOC –CH2 CH – CH2 COOH COOH 5. Ko‘p asosli, to‘yingan, quyi

KARBOKSIL KISLOTALARNING NOMENKLATURASI KARBOKSIL KISLOTALARNING NOMENKLATURASİ ALKAN KISLOTA + OB + ANIK KISLOTA ALKAN METANIK KISLOTA META KISLOTA (FOM KISLOTA)

2 1 CH3 – COOH COOH CH3 – ETANETAN KISLOTA (sirka kislotasi)) 33 44 11 COOH CH3 – CH2 – CH2 COOH CH3 – CH2 – CH2 22 BUTAN KISLOTA BUTAN KISLOTA (BİTRİKBUTAT)

44 22 55 11 COOH CH3 – CH2 – CH2 – CH2 – COOH CH3 – CH2 – CH2 – CH2 – 33 pentan kislotasi pentan kislotasi (VALERian kislotasi) (VALERian kislotasi) 22 NOOS – NOOS 11 COOHNEDIACIDODIACIDO ) (oksalik kislota)

Karboksilik kislotalarning gomologik qatori Karboksilik kislotalarning gomologik qatori Kimyoviy formulasi Kislotaning sistematik nomi Kislotaning ahamiyatsiz nomi Kislotali qoldiqning nomi Format Asetat Propionat Butirat kapronat kaprikat HCOOH CH3COOH CH3CH2COOH CH3CH2CH2COOH CH3CH2COOH CH3CH2CH2COOH CH3CH2CH2COOH CH3CH2CH2COOH CH3COOH2 e Pentan tuxum geksan formik asatik propion moyi neylon valerian valerinat CH3(CH2)8 – COOH Dekan kaprik CH3(CH2)14 – COOH CH3(CH2)16 COOH geksadekan oktadekan palmitik palmitat stearik stearat

Karboksilik kislotalarni nomlash algoritmi: 1. Uglerod atomlarining bosh zanjirini toping va karboksil guruhidan boshlab raqamlang. 2. O‘rinbosarlarning o‘rnini va ularning nom(lar)ini ko‘rsatamiz. 3. Zanjirdagi uglerod atomlari sonini ko'rsatuvchi ildizdan keyin “oik” kislota qo'shimchasi keladi. 4. Agar bir nechta karboksil guruhlar mavjud bo'lsa, u holda "ova" dan oldin raqam qo'yiladi (di, uch...) Misol: 4 CH3 3 CH 2 CH2 1 COOH CH3 3 metilbutan + ova = 3metilbutan kislotasi

MADDALARGA NOM BERING MARDALARGA XALQARO NOMENKLATURA (2 – METILPROPAN (2 – METIL PROPANOIK KISLOTA) KISLOTA) CH3 – CH – COOH 1.1. CH3 – CH – COOH CH3CH3 2. CH3 – CH2 – CH – CH – COOH 2. CH3 – CH2 – CH – CH – COOH CH3CH3 CH3CH3 (2, 3 – DIMETHYL PENTA PENTA (2, 3 – DIMETHYL NNOVAICID) CH3 – CH = CH – CH – COOH 3. CH3 – CH = CH – CH – COOH CH3CH3 4. HOOC – CH2 – CH – COOH 4. HOOC – CH2 – CH – COOH CC22NNH55 (2 – METİLPENT (2 – METİL) ) KISLOTA) PENTENEN – 3– 3 – OVA – OVA (2 – ETILBUTAN (2 – ETILBUTANDIIOIK KISLOTA))

Karboksilik kislotalarning formulalarini yozish algoritmi: 1. Karboksil guruhini o'z ichiga olgan kompozitsiyadagi uglerod skeleti yoziladigan so'zning ildizini tanlang. 2. Karboksil guruhidan boshlab uglerod atomlarini raqamlaymiz. 3. O‘rinbosarlarni raqamlash bo‘yicha ko‘rsatamiz. 4. Yo'qolgan vodorod atomlarini qo'shish kerak (uglerod tetravalent). 5. Formulaning to'g'ri yozilganligini tekshiring. Misol: 4 3 2 1 C C C COOH 2metilbutanoik kislota. 4 3 2 1 C C C COOH 4 3 2 1 CH3 CH2 CH COOH CH3 CH3

Jismoniy xususiyatlari CC11 – – CC33 Xususiyatga ega suyuqliklar Xarakterli o'tkir hidli, o'tkir hidli suyuqliklar, suvda yaxshi eriydi CC44 – C – C99 Yopishqoq yog'li Yopishqoq yog'li suyuqliklar, o'ziga xos hidli, yoqimsiz hidli. , suvda yomon eriydi CC1010 va undan ko'p qattiq moddalar, qattiq moddalar, hidsiz, hidsiz, erimaydi suvda suvda erimaydi

Sirka kislotaning fizik xossalari: Fizik holati suyuqligi Rangi rangsiz shaffof suyuqlik Hidi oʻtkir sirka kislotasi Suvda eruvchanligi yaxshi Qaynash harorati 118 º S Erish nuqtasi 17 º C

Karbon kislotalarning fizik xossalarining molekula tuzilishiga bog'liqligi: Quyi karboksilik kislotalar suyuqlikdir; yuqori - qattiq moddalar.Kislotaning nisbiy molekulyar og'irligi qanchalik katta bo'lsa, uning hidi kamroq bo'ladi. Kislotaning nisbiy molekulyar massasi ortishi bilan eruvchanligi pasayadi.Aldegidlarning gomologik qatori ikkita gazsimon moddadan (xona haroratida) boshlanadi va karboksilik kislotalar orasida gazlar yo`q. Bu nima bilan bog'liq?

Karbon kislotalarning kimyoviy xossalari Karboksilik kislotalarning kimyoviy xossalari I. Noorganik kislotalar bilan tez-tez dissotsilanadi: 1. CH3 – COOH CH3 – COO + H suvli eritmalarida eriydigan karboksilik kislotalar + Muhit kislotalimi? Kislotali muhitda indikatorlarning rangi qanday o'zgaradi? 2. Vodorodgacha elektrokimyoviy kuchlanish qatoridagi metallar bilan o'zaro ta'siri: Litmus (binafsha) - qizil rangga aylanadi Metil apelsin - pushti rangga aylanadi Fenoftalein - rangi o'zgarmaydi 2CH3 - COOH + Mg Sirka kislotasi 2CH3 COOH + Zn Sirka kislotasi (CH3 -COO) 2Mg Magniy asetat ( CH3 – COO)2Zn Rux asetat + H2 + H2 Metall karboksilik kislota eritmasi bilan reaksiyaga kirishganda, vodorod va tuz I hosil bo'ladi. Noorganik kislotalar bilan keng tarqalgan

3. Asosiy oksidlar bilan oʻzaro taʼsiri: 2 CH3 – COOH + CuO Sirka kislotasi (CH3 – COO) 2Su Mis asetat t + H2O 4. Metall gidroksidlar bilan oʻzaro taʼsiri (neytrallanish reaksiyasi) CH3 – COOH + H2O –Na Sirka kislotasi 2CH3 – COOH + Cu (OH)2 Sirka kislotasi CH3COONa Natriy asetat + H2O (CH3COO)2Cu Mis asetat + H2O 5. Kuchsizroq va koʻproq uchuvchi kislotalarning tuzlari bilan oʻzaro taʼsiri (masalan, karbonat, kremniy, vodorod sulfid, stearik, palmitik...) 2CH3– COOH Sirka kislotasi + Na2CO3 natriy karbonat 2CH3COONa Natriy asetat + H2CO3 CO2 H2O

Chumoli kislotaning o'ziga xos xossalari “Kumush oyna” reaksiyasi O + Ag2O t 2Ag + H2CO3 H C OH Chumoli kislota Kumush oksidi kumush CO2 H2O

Karboksilik kislotalarning tabiatida paydo bo'lishi va ishlatilishi Chumoli kislotasi (Metanik kislota) - Kimyoviy formula CH2O2, yoki HCOOH. Chumoli kislotasi qizil chumolilarning kislotali sekretsiyalarida 1670 yilda ingliz tabiatshunosi Jon Rey tomonidan topilgan. Chumoli kislota eng nozik qichitqi o'ti tuklarida, ari zahari, qarag'ay ignalarida ham mavjud bo'lib, turli xil mevalar, to'qimalar, organlar, hayvonlar va odamlarning sirlarida oz miqdorda bo'ladi.


Savol: Nega chumoli chaqishi yoki qichitqi chaqishi joyini suv bilan namlay olmaysiz? Bu faqat og'riqning kuchayishiga olib keladi. Nima uchun jarohatlangan joy ammiak bilan namlangan bo'lsa, og'riq susayadi? Bu holatda yana nimadan foydalanish mumkin? Chumoli kislota suvda eritilganda elektrolitik dissotsilanish jarayoni sodir bo'ladi: HCOOH HCOO + H Natijada muhitning kislotaliligi oshadi va terining korroziyasi jarayoni kuchayadi. Og'riqni yo'qotish uchun siz kislotani neytrallashingiz kerak, buning uchun ammiak eritmasi kabi gidroksidi reaktsiyaga ega bo'lgan eritmalardan foydalanishingiz kerak. HCOOH + NH4OH HCOONH4 + H2O yoki HCOOH + NaHCO3 HCOONa + CO2 + H2O

Sirka kislotasi (etanik kislota) Bu inson tomonidan olingan va ishlatiladigan birinchi kislota. 4 ming yildan ko'proq vaqt oldin Qadimgi Misrda "tug'ilgan". 17-18-asrlar oxirida Rossiyada u "nordon namlik" deb nomlangan. Biz uni birinchi marta sharob pishirish paytida oldik. Lotincha nomi Acetum acidum, shuning uchun tuzlarning nomi - asetatlar. Muzlik sirka kislotasi 16,8 ºS dan past haroratlarda qattiqlashadi va muzga o'xshaydi.Sirka mohiyati 70% kislota eritmasidir. Stol sirkasi 6% yoki 9% kislota eritmasi. Sirka kislotasi hayvonlarning sekretsiyasi (siydik, safro, najas), o'simliklar (ayniqsa, yashil barglar), nordon sut va pishloqda mavjud; sharob va pivoning fermentatsiyasi, chirishi, nordonlanishi va ko'plab organik moddalarning oksidlanishi paytida hosil bo'ladi;

Sirka kislotasini qo'llash Sirka kislotasini qo'llash Sirka kislotasining suvli eritmalari oziq-ovqat sanoatida (oziq-ovqat qo'shimchasi E 260) va maishiy pishirishda, shuningdek, konserva tayyorlashda keng qo'llaniladi; ishlab chiqarishda: dorilar, HP, aspirin; sun'iy tolalar, masalan, ipak asetati; indigo bo'yoqlari, yonmaydigan plyonka, organik shisha; lak erituvchilar; kimyoviy o'simliklarni himoya qilish vositalari, o'simliklar o'sishi stimulyatorlari; Natriy asetat CH3COONa quyish uchun mo'ljallangan qon uchun konservant sifatida ishlatiladi; Kaliy asetat CH3COOK - diuretik sifatida; Siydikdagi shakarni aniqlash uchun qo'rg'oshin asetat (CH3COO)2 Pb; Temir (III) (CH3COO)3Fe, alyuminiy (CH3COO)3Al va xrom (III) (CH3COO)3Cr atsetatlari toʻqimachilik sanoatida mordan boʻyash uchun ishlatiladi; Mis (II) asetat (CH3COO) 2Cu o'simlik zararkunandalariga qarshi kurashish uchun preparat tarkibiga kiradi, ya'ni Parij yashil deb ataladi; Sirka kislotasining suvli eritmalari oziq-ovqat sanoatida (oziq-ovqat qo'shimchasi E 260) va maishiy pazandachilikda, shuningdek konservalashda keng qo'llaniladi; ishlab chiqarishda: dorilar, HP, aspirin; sun'iy tolalar, masalan, asetat ipak; indigo bo'yoqlari, yonmaydigan plyonka, pleksiglas; lak erituvchilar; o'simliklarni kimyoviy himoya qilish vositalari, o'simliklarning o'sishini stimulyatorlari; natriy asetat CH3COONa quyish uchun mo'ljallangan qon uchun konservant sifatida ishlatiladi; kaliy asetat CH3COOK sifatida siydikda qand miqdorini aniqlash uchun qo'rg'oshin atsetat (CH3COO)2 Pb, temir (III) (CH3COO)3Fe, alyuminiy (CH3COO)3Al va xrom (III) (CH3COO)3Cr atsetatlari to'qimachilik sanoatida mordan bo'yash uchun ishlatiladi; Mis asetat (II) ( CH3COO) 2Cu o'simlik zararkunandalariga qarshi kurashish uchun preparatning bir qismi bo'lib, Parij yashil deb ataladi;

Sirka kislotasidan foydalanish Kosmetologiyada spirtli sirkadan foydalanish ma'lum. Ya'ni, perm va doimiy bo'yashdan keyin sochlarga yumshoqlik va yorqinlik berish. Buning uchun spirtli sirka (1 litr suv uchun 34 osh qoshiq sirka) qo'shilgan holda sochingizni iliq suv bilan yuvish tavsiya etiladi. Xalq tabobatida sirka nonspesifik antipiretik sifatida ishlatiladi. losonlar yordamida bosh og'rig'i uchun. kompresslar yordamida hasharotlar chaqishi uchun. Agar zanglagan gaykani ochish kerak bo'lsa, kechqurun unga sirka kislotasi namlangan latta qo'yish tavsiya etilishini bilasizmi? Ertalab bu yong'oqni ochish ancha oson bo'ladi. Kun davomida organizmda 400 g sirka kislota hosil bo'ladi? Bu parfyumeriya mahsulotlarini ishlab chiqarishda ajralmas bo'lgan 8 litr oddiy sirka qilish uchun etarli bo'ladi.

N N S C 3 O O Barcha kislotalardan, Bu, albatta, prima. Hamma joyda ko'rinadigan va ko'rinmas holda mavjud. U hayvonlar va o'simliklarda mavjud, Texnologiya va tibbiyot abadiy u bilan. Uning avlodlari asetatlardir.Juda kerakli "yigitlar". Taniqli aspirin, yaxshi janob kabi, bemorning isitmasini pasaytiradi va sog'lig'ini tiklaydi. Bu mis asetat. U o'simliklarning do'sti va ukasi, Dushmanlarini o'ldiradi. Kislota hali ham ma'lum darajada qo'llaniladi - u bizni asetat ipakdan tikadi. Va kimki köfte sevsa, sirkani uzoq vaqtdan beri biladi. Kino haqida ham savol bor: hamma bilishi kerakki, asetat plyonkasisiz biz kino ko'ra olmaymiz. Albatta, boshqa maqsadlarda foydalanish mumkin. Va siz ularni shubhasiz bilasiz. Lekin aytiladigan asosiy narsa, do'stlar, "Sanoat noni": sirka kislotasi. Mis asetatning CH3COOH suvli eritmasi
Xulosa 1.Karboksilik kislotalar - molekulalarida uglevodorod radikali bilan bog'langan karboksil guruhi - COOH bo'lgan organik birikmalar. 2.Karbon kislotalar quyidagilarga bo‘linadi: asosliligi (bir, ikki va ko‘p asosli) bo‘yicha uglevodorod radikali (to‘yingan, to‘yinmagan va aromatik) tarkibidagi C atomlari (pastki va yuqori) bo‘yicha 3. Karbon kislotaning nomi nomidan tuzilgan. alkan + tuxum kislotasi. 4. Karboksilik kislotaning molekulyar massasi ortishi bilan kislotaning eruvchanligi va kuchi kamayadi. 5. Noorganik kislotalar kabi eriydigan karboksilik kislotalar suvli eritmada dissotsiatsiyalanib, vodorod ionlarini hosil qiladi va indikator rangini o'zgartiradi. Ular metallar (H gacha), asosiy va amfoter oksidlar va gidroksidlar, kuchsiz kislotalarning tuzlari bilan reaksiyaga kirishib, tuzlar hosil qiladi. 6 Tabiatda keng tarqalgan va odamlar uchun katta amaliy ahamiyatga ega.

Uyga vazifa 1. 2. §14, mashqlar No 6 mashq No 9 Qirolicha Kleopatra sud shifokorining maslahati bilan zargarlarga ma'lum bo'lgan eng katta marvaridni sirkada eritib yubordi va keyin olingan eritmani bir muddat oldi. Kleopatra qanday munosabatda bo'ldi? U qanday aloqani o'rnatdi? 3. Yuqori karboksilik kislotalar haqida hisobot tayyorlang

"Matematika - bu tabiat kitobi yozilgan til"
GALILEO GALILIE - ITALYA MATEMATIGI, FİZİK, ASTRONOMI


Bilimlarni yangilash
Aldegidlar - molekulalarida uglevodorod radikali bilan bog'langan funktsional atomlar guruhi - COH bo'lgan organik moddalar.
Karbonil - - C = O;
Aldegid - - C = O
1. Aldegidlarga qanday birikmalar kiradi?
2. Qaysi funksional guruh karbonil, qaysi biri aldegid deb ataladi? Ularning orasidagi farq nima?
3. Aldegidlar uchun qanday reaksiyalar eng xosdir?
4. Kislorodli birikmalarga tegishli organik birikmalarning asosiy sinflarini sanab bering.
Qo'shilish va oksidlanish reaktsiyalari.
Spirtli ichimliklar, aldegidlar, ketonlar, karboksilik kislotalar, uglevodlar.


Dars maqsadlari
Tarbiyaviy:
Talabalarni karboksilik kislotalar tushunchasi va ularning tasnifi bilan tanishtirish; chumoli va sirka kislotalari misolida karboksilik kislotalarning xossalari (yonish, esterlanish); xossalari asosida karboksilik kislotalarni qo'llash.
Tarbiyaviy:
Kimyoga ijobiy munosabatni shakllantirish.
Rivojlanish: ahamiyatsiz va xalqaro nomenklaturadan foydalangan holda o'rganilayotgan moddalarni nomlash qobiliyatini rivojlantirish; karboksilik kislotalar kiradigan reaksiya turlarini aniqlash; karboksilik kislotalarning tuzilishi va xossalarini tavsiflash; karboksilik kislotalarning reaksiyaga kirishish qobiliyatining ularning molekulalari tuzilishiga bog‘liqligini tushuntirish; sirka kislota tuzlarini olish uchun kimyoviy tajriba o'tkazish; olingan bilim va ko'nikmalarni amaliy faoliyatda qo'llash (laboratoriyada va uyda moddalar bilan xavfsiz ishlash); berilgan konsentratsiyali eritmalarni tayyorlash qobiliyati.

Karboksilik kislotalar (tuzilmasi)
Karboksil
guruh
uglevod onil guruhi
gidro oksil guruh




Tasniflash
Radikalning tabiatiga ko'ra
Karboksil guruhlar soniga ko'ra - bir-, ikki-, uch-asosiy
Quyidagi kislotalar qaysi sinfga kiradi?
CH 3 – C = O
O = C – C = O
LEKIN U
CH 2 = CH – C = O
- C = O

sistematik va ahamiyatsiz nomenklatura
N-COOH - metan ov aya (chumoli)
CH 3 -COOH - etan ov aya (sirka)
NOOS-COON - etan dio vaya (oksal)
NOOS-SN 2 -CH 2 -COOH-butan diov va men
(qahrabo)
BILAN 6 N 5 COOH - benzoy
BILAN 17 N 35 COOH - stearik
BILAN 17 N 33 COOH - oleyk

tadqiqot
- Moddalarni nomlang:
CH 2 - CH - CH - COUN
CH 3 CH 3 CH 3
CH 3
CH 3 - C - CH 2 - COUN
CH 3
- 2 metilbutan kislotasi
- 2,2 dimetilpropan kislotasi
- 3,3 dikloreksanoik kislota

Jismoniy xususiyatlar
- BILAN 1 - BILAN 3 xarakterli o'tkir hidli suyuqliklar
- BILAN 4 - BILAN 9 yoqimsiz hidli viskoz yog'li suyuqliklar
- c C 10 erimaydigan qattiq moddalar
- Karboksilik kislotalar molekulalararo vodorod aloqalari mavjudligi sababli yuqori qaynash nuqtalariga ega va asosan dimerlar shaklida mavjud.
- Nisbiy molekulyar og'irlikning oshishi bilan to'yingan monobazik kislotalarning qaynash harorati ortadi

N–S
Formik kislota
- Chumolilarning zaharli bezlarida, qichitqi o'tlarida va archa ignalarida mavjud.
- Barcha karboksilik kislotalardan 10 baravar kuchli.
- Uni 1831 yilda T. Pelouz gidrosiyan kislotasidan olgan.
Ishlatilgan:
- terini bo'yash va ko'nlash uchun mordan sifatida
- tibbiyotda
- sabzavotlarni konservalashda
- neylon, neylon, polivinil uchun hal qiluvchi sifatida

Chumoli kislotaning xossalari va ishlatilishi
- O'tkir hidli rangsiz suyuqlik, suvda yaxshi eriydi .
- U kislotalar va aldegidlarga xos xususiyatlarni namoyon qilishi mumkin.

CH 3 - BILAN
Sirka kislotasi
Ba'zi o'simliklarda, terda, siydikda, safroda uchraydi. Inson tanasi kuniga 0,5 kg bu kislota chiqaradi.
- Qadim zamonlardan beri ma'lum.
- 1700 g sof shaklda ajratilgan
- 1845 yilda G. Kolbe uni sintetik usulda oldi.
- U sintetik tarzda ham hosil bo'lishi mumkin (bakteriyalar ta'sirida vino nordon).

Kimyoviy xossalari
Faol metallar bilan o'zaro ta'siri.
2CH 3 COOH + Mg = (CH 3 COO) 2 Mg+H 2
Ishqorlar bilan o'zaro ta'siri.
CH 3 COOH + NaOH = CH 3 COONa + H 2 O
Asosiy oksidlar bilan o'zaro ta'siri.
2CH 3 COOH + CaO = (CH 3 COO) 2 Ca+H 2 O
Tuzlar bilan o'zaro ta'siri.
2CH 3 COOH+Na 2 CO 3 = 2CH 3 COONa + H 2 O+CO 2
Spirtli ichimliklar bilan o'zaro ta'siri
CH 3 COOH + HOC 2 H 5 = CH 3 -CO-O-C 2 H 5 +H 2 O
etil asetat
efir
Tabiatda esterlar gullar, mevalar va rezavorlar tarkibida mavjud. Ular mevali suvlar va parfyumeriya ishlab chiqarishda ishlatiladi.

Sirka kislotaning xossalari va ishlatilishi
Rangsiz suyuqlik, xarakterli hid, suvda eriydi, ko'plab organik moddalar uchun yaxshi hal qiluvchi, teri bilan aloqa qilsa xavfli.

Karboksilik kislotalarni tayyorlash
- Birlamchi spirtlar va aldegidlarning oksidlanishi (katalizatordagi kislorod va KMnO 4 ; K 2 Cr 2 O 7 ):
R-CH 2 OH → RCOH → RCOOH
- Metanning katalitik oksidlanishi:
2CH 4 + 3O 2 → 2H–COOH + 2H 2 O
- butanning katalitik oksidlanishi:
2CH 3 – CH 2 – CH 2 – CH 3 +5O 2 → 4CH 3 COOH + 2H 2 O
- Aromatik kislotalar benzol gomologlarini oksidlash orqali sintezlanadi: oksidlovchi sifatida KMnO eritmalaridan foydalanish mumkin. 4 yoki K 2 Cr 2 O 7 kislotali muhitda:
C 6 H 5 CH 3 BILAN 6 N 5 COOH+H 2 O
(5C 6 H 5 CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH+3K 2 SO 4 + 6MnSO 4 +14 soat 2 O)

ilova
- Formik kislota– tibbiyotda, asalarichilikda, organik sintezda, erituvchilar va konservantlar ishlab chiqarishda; kuchli kamaytiruvchi vosita sifatida.
- Sirka kislotasi– oziq-ovqat va kimyo sanoatida (tsellyuloza asetat ishlab chiqarish, undan atsetat tolasi, organik shisha, plyonka ishlab chiqariladi; bo'yoqlar, dori-darmonlar va efirlarni sintez qilish uchun).
- Butirik kislota– aromatizatorlar, plastifikatorlar va flotatsion reagentlar ishlab chiqarish uchun.
- Oksalat kislotasi– metallurgiya sanoatida (toshdan tozalash).
- Stearik C17H35COOH va palmitik kislota C 15 H 31 COOH - metallga ishlov berishda sirt faol moddalar, moylash materiallari sifatida.

Nazorat savollari
- Qichitqi o'tlar va meduzalarning qichitqi hujayralarining qichitqi ta'siri qanday moddadir:
a) chumoli kislotasi, b) chumoli aldegidi
2. Qichitqi o'ti ajralishidan kelib chiqqan kuyishda og'riqni qanday engillashtiradi:
a) suv bilan yuving, b) kuchsiz ishqor eritmasi bilan yuving;
v) sirka kislotaning kuchsiz eritmasi bilan yuviladi.
3. Chumoli kislotaning tuzilish formulasini shunday yozish mumkin: HO-SON. Binobarin, bu kislota ikki tomonlama funktsiyali modda bo'ladi. Uni qanday chaqirish mumkin:
a) spirt, b) aldegid spirti, v) kislota
4. Gomologik qatordagi karboksilik kislotalarning fizik xossalarining o‘zgarishi misolida miqdoriy munosabatlarning sifat munosabatlariga o‘tishini ko‘rib chiqish mumkinmi?

5. Taklif etilgan formulalardan karboksilik kislotalarning formulalarini yozing va ularni nomlang:
CH 3 , CH 3 COOH, C 2 N 5 Oh, SN 3 UYQU, S 2 N 4 , BILAN 15 N 31 COOH, C 6 N 6 , BILAN 5 N 11 COOH, C 3 N 7 UNS
6. Sirka kislota qanday moddalar bilan o'zaro ta'sir qiladi:
a) rux, natriy oksidi, magniy gidroksid, natriy karbonat, spirt (etil)
b) rux, natriy oksidi, magniy gidroksid, natriy karbonat, metan
Reaksiya tenglamalarini yozing.

O'ZBARLIK BILIMLARINI TEKSHIRISH
1) a; 2) b; 3) b;
4) fizikaviy va kimyoviy xossalarga ko'ra mumkin;
5) CH 3 COOH, C 15 N 31 COOH, C 5 N 11 COOH, C 3 N 7 COOH; 6) a.
2CH 3 COOH + Zn = (CH 3 SOO) 2 Zn + H 2
2CH 3 COOH + MgO = (CH 3 SOO) 2 Mg + H 2 HAQIDA
2CH 3 COOH + Mg(OH) 2 = (CH 3 SOO) 2 Mg + 2H 2 HAQIDA
2CH 3 COOH + Na 2 CO 3 = 2CH 3 COONa + H 2 CO 3
CH 3 COOH + C 2 N 5 U = CH 3 COO C 2 N 5 + N 2 HAQIDA


E'tiboringiz uchun rahmat
Uyga vazifa: 153 - 157-betlar
Kimyo, texnik kasblar uchun darslik, M, "Akademiya", 2011 yil.
Karboksilik kislotalarning alohida turlari (tartarik, sut, olma, limon va boshqalar) uchun taqdimotlar tayyorlang.
Ish kitobi 21-bet.
“Sirka kislotasini o‘rgatish va u bilan tajribalar o‘tkazish” amaliy ishiga tayyorlanish.