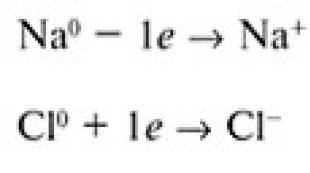Mekanizmi i formimit të lidhjeve jonike të oksigjenit. Kapitulli III. lidhja kimike dhe struktura molekulare. Përkufizimi i lidhjes jonike
Një lidhje jonike shfaqet kur elektronegativiteti ndryshon ndjeshëm nga njëri-tjetri (në shkallën Pauling Δχ> 1.7), dhe kjo ndodh gjatë bashkëveprimit të joneve të formuara nga elementë të karakterizuar nga veti kimike dukshëm të ndryshme.
Një lidhje jonike është një tërheqje elektrostatike midis joneve të ngarkuar në mënyrë të kundërt që formohen si rezultat i zhvendosjes së plotë të një çifti elektronik të përbashkët nga një atom i një elementi në një atom të një elementi tjetër.
Në varësi të vetive individuale të atomeve të disa elementeve, tendenca mbizotëruese është të humbasin elektronet dhe të shndërrohen në jone të ngarkuar pozitivisht (katione), ndërsa atomet e elementeve të tjerë, përkundrazi, priren të fitojnë elektrone, duke u shndërruar kështu në të ngarkuar negativisht. jonet (anionet), siç ndodh me atomet e natriumit të zakonshëm dhe klorit tipik jometal.
Modeli i kushtëzuar i formimit të joneve Na + dhe Cl - me transferim të plotë të një elektroni të valencës nga një atom natriumi në një atom klori
Aftësia e elementeve për të formuar jone të thjeshtë (d.m.th., që vijnë nga një atom i vetëm) përcaktohet nga konfigurimi elektronik i atomeve të tyre të izoluar, si dhe nga vlerat e elektronegativitetit, energjive jonizuese dhe afiniteteve të elektroneve (minimumi i kërkuar për të hiqni një elektron nga joni negativ përkatës në një distancë të pafundme). Është e qartë se kationet formohen më lehtë nga atomet e elementeve me energji të ulët jonizimi - metalet alkaline dhe alkaline tokësore (Na, K, Cs, Rb, Ca, Ba, Sr, etj.). Formimi i kationeve të thjeshta të elementeve të tjerë është më pak i mundshëm, pasi kjo shoqërohet me shpenzimin e energjisë së madhe për jonizimin e atomit.
Anionet e thjeshta formohen më lehtë nga p-elementet e grupit të shtatë (Cl, Br, I) për shkak të afinitetit të tyre të lartë elektronik. Shtimi i një elektroni në atomet O, S, N shoqërohet me çlirimin e energjisë. Dhe shtimi i elektroneve të tjera për të formuar anione të thjeshta të shumëfishta të ngarkuara është energjikisht i pafavorshëm.
Prandaj, përbërjet që përbëhen nga jone të thjeshtë janë të pakta në numër. Ato formohen më lehtë nga bashkëveprimi i metaleve alkaline dhe tokës alkaline me halogjenet.
Karakteristikat e lidhjes jonike
1. Jo-drejtimi. Ngarkesat elektrike të joneve përcaktojnë tërheqjen dhe zmbrapsjen e tyre dhe në përgjithësi përcaktojnë përbërjen stoikiometrike të përbërjes. Jonet mund të mendohen si topa të ngarkuar, fushat e forcës së të cilëve janë të shpërndara në mënyrë uniforme në të gjitha drejtimet në hapësirë. Prandaj, për shembull, në përbërjen NaCl, jonet e natriumit Na+ mund të bashkëveprojnë me jonet e klorurit Cl- në çdo drejtim, duke tërhequr një numër të caktuar të tyre.
Jo-drejtimi është një veti e lidhjes jonike për shkak të aftësisë së secilit jon për të tërhequr jonet e shenjës së kundërt drejt vetes në çdo drejtim.
Pra, jodrejtimi shpjegohet me faktin se fusha elektrike e jonit ka simetri sferike dhe zvogëlohet me distancën në të gjitha drejtimet, kështu që bashkëveprimi ndërmjet joneve ndodh pavarësisht nga drejtimi.
2. Pangopja.Është e qartë se bashkëveprimi i dy joneve me shenjë të kundërt nuk mund të çojë në kompensimin e plotë të ndërsjellë të fushave të tyre të forcës. Prandaj, një jon me një ngarkesë të caktuar ruan aftësinë për të tërhequr jone të tjerë të shenjës së kundërt në të gjitha drejtimet. Numri i joneve të tilla "të tërhequr" është i kufizuar vetëm nga madhësitë e tyre gjeometrike dhe forcat reciproke të zmbrapsjes.
Pangopja është një veti e lidhjes jonike, e cila manifestohet në aftësinë e një joni që ka një ngarkesë të caktuar për të bashkuar çdo numër jonesh të shenjës së kundërt.
3. Polarizimi i joneve. Në një lidhje jonike, çdo jon, duke qenë një bartës i një ngarkese elektrike, është një burim i një fushe elektrike të forcës, prandaj, në një distancë të ngushtë midis joneve, ato ndikojnë reciprokisht njëri-tjetrin.
Polarizimi i një joni është deformimi i shtresës së tij elektronike nën ndikimin e fushës së forcës elektrike të një joni tjetër.
4. Polarizueshmëria dhe aftësia polarizuese e joneve. Gjatë polarizimit, elektronet në shtresën e jashtme i nënshtrohen zhvendosjes më të fortë. Por nën veprimin e së njëjtës fushë elektrike, jonet e ndryshme deformohen në shkallë të ndryshme. Sa më të dobëta elektronet e jashtme të lidhen me bërthamën, aq më lehtë ndodh polarizimi.
Polarizimi është zhvendosja relative e bërthamës dhe shtresës elektronike në një jon kur ekspozohet ndaj fushës elektrike të një joni tjetër. Aftësia polarizuese e joneve është aftësia e tyre për të ushtruar një efekt deformues në jonet e tjera.
Fuqia polarizuese varet nga ngarkesa dhe madhësia e jonit. Sa më e madhe të jetë ngarkesa e një joni, aq më e fortë është fusha e tij, domethënë jonet e shumëfishta të ngarkuara kanë aftësinë më të madhe polarizuese.
Vetitë e përbërjeve jonike
Në kushte normale, komponimet jonike ekzistojnë si lëndë të ngurta kristalore që kanë pika të larta shkrirjeje dhe vlimi dhe për këtë arsye konsiderohen të paqëndrueshme. Për shembull, pikat e shkrirjes dhe të vlimit të NaCl janë përkatësisht 801 0 C dhe 1413 0 C, CaF 2 - 1418 0 C dhe 2533 0 C. Në gjendje të ngurtë, përbërjet jonike nuk përçojnë rrymë elektrike. Ato janë shumë të tretshme në dhe pak ose aspak të tretshëm në tretës jopolarë (vajguri, benzinë). Në tretësit polare, komponimet jonike shpërndahen (ndahen) në jone. Kjo shpjegohet me faktin se jonet kanë energji më të larta tretësish, të cilat janë në gjendje të kompensojnë energjinë e shpërbërjes në jone në fazën e gazit.
Gjatësia e lidhjes - distancë ndërbërthamore. Sa më e shkurtër kjo distancë, aq më e fortë është lidhja kimike. Gjatësia e një lidhjeje varet nga rrezet e atomeve që e formojnë atë: sa më të vogla të jenë atomet, aq më e shkurtër është lidhja midis tyre. Për shembull, gjatësia e lidhjes H-O është më e shkurtër se gjatësia e lidhjes H-N (për shkak të më pak shkëmbimit të atomit të oksigjenit).

Një lidhje jonike është një rast ekstrem i një lidhjeje kovalente polare.
Lidhje metalike.
Parakusht për formimin e këtij lloji të lidhjes është:
1) prania e një numri relativisht të vogël elektronesh në nivelet e jashtme të atomeve;
2) prania e bosh (orbitaleve të lira) në nivelet e jashtme të atomeve metalike
3) energji relativisht e ulët e jonizimit.
Le të shqyrtojmë formimin e një lidhjeje metalike duke përdorur si shembull natriumin. Elektroni i valencës së natriumit, i cili ndodhet në nënnivelin 3s, mund të lëvizë relativisht lehtë nëpër orbitalet boshe të shtresës së jashtme: përgjatë 3p dhe 3d. Kur atomet afrohen më shumë si rezultat i formimit të një rrjete kristalore, orbitalet e valencës së atomeve fqinje mbivendosen, për shkak të së cilës elektronet lëvizin lirshëm nga një orbital në tjetrin, duke krijuar një lidhje midis TË GJITHA atomeve të kristalit metalik.
Në nyjet e rrjetës kristalore ka jone dhe atome të metalit të ngarkuar pozitivisht, dhe midis tyre ka elektrone që mund të lëvizin lirshëm në të gjithë rrjetën kristalore. Këto elektrone bëhen të zakonshme për të gjithë atomet dhe jonet e metalit dhe quhen "gaz elektron". Lidhja midis të gjithë joneve të metalit të ngarkuar pozitivisht dhe elektroneve të lira në rrjetën kristalore metalike quhet lidhje metalike.
Prania e një lidhjeje metalike përcakton vetitë fizike të metaleve dhe lidhjeve: ngurtësinë, përçueshmërinë elektrike, përçueshmërinë termike, lakueshmërinë, duktilitetin, shkëlqimin metalik. Elektronet e lira mund të bartin nxehtësi dhe energji elektrike, kështu që ato janë arsyeja e vetive fizike kryesore që dallojnë metalet nga jometalet - përçueshmëri e lartë elektrike dhe termike.
Lidhja hidrogjenore.
Lidhja hidrogjenore ndodh midis molekulave që përmbajnë hidrogjen dhe atomeve me EO të lartë (oksigjen, fluor, azot). Lidhjet kovalente H-O, H-F, H-N janë shumë polare, për shkak të të cilave një ngarkesë pozitive e tepërt grumbullohet në atomin e hidrogjenit, dhe një ngarkesë negative e tepërt në polet e kundërta. Midis poleve të ngarkuara në mënyrë të kundërt, lindin forcat e tërheqjes elektrostatike - lidhjet e hidrogjenit.
Lidhjet e hidrogjenit mund të jenë ose ndërmolekulare ose intramolekulare. Energjia e një lidhjeje hidrogjeni është afërsisht dhjetë herë më e vogël se energjia e një lidhjeje kovalente konvencionale, por megjithatë, lidhjet e hidrogjenit luajnë një rol të rëndësishëm në shumë procese fiziko-kimike dhe biologjike. Në veçanti, molekulat e ADN-së janë spirale të dyfishta në të cilat dy zinxhirë nukleotidesh janë të lidhura me lidhje hidrogjeni. Lidhjet ndërmolekulare të hidrogjenit ndërmjet molekulave të ujit dhe fluorit të hidrogjenit mund të përshkruhen (me pika) si më poshtë:

Substancat me lidhje hidrogjeni kanë rrjeta kristalore molekulare. Prania e një lidhje hidrogjeni çon në formimin e lidhjeve molekulare dhe, si pasojë, në një rritje të pikave të shkrirjes dhe vlimit.
Përveç llojeve kryesore të listuara të lidhjeve kimike, ekzistojnë edhe forca universale të ndërveprimit midis çdo molekule që nuk çon në thyerjen ose formimin e lidhjeve të reja kimike. Këto ndërveprime quhen forcat van der Waals. Ato përcaktojnë tërheqjen e molekulave të një substance të caktuar (ose substancave të ndryshme) me njëra-tjetrën në gjendje të lëngshme dhe të ngurta grumbullimi.
Llojet e ndryshme të lidhjeve kimike përcaktojnë ekzistencën e llojeve të ndryshme të rrjetave kristalore (tabela).
Substancat që përbëhen nga molekula kanë struktura molekulare. Këto substanca përfshijnë të gjitha gazet, lëngjet, si dhe lëndët e ngurta me një rrjetë kristalore molekulare, siç është jodi. Lëndët e ngurta me një rrjetë atomike, jonike ose metalike kanë strukturë jo molekulare, ato nuk kanë molekula.
Tabela
| Veçori e rrjetës kristalore | Lloji grilë | |||
| molekulare | Jonike | bërthamore | Metal | |
| Grimcat në nyjet e rrjetës | Molekulat | Kationet dhe anionet | Atomet | Kationet dhe atomet e metaleve |
| Natyra e lidhjes midis grimcave | Forcat e ndërveprimit ndërmolekular (përfshirë lidhjet hidrogjenore) | Lidhjet jonike | Lidhje kovalente | Lidhje metalike |
| Forca e lidhjes | I dobët | E qëndrueshme | Shumë e qëndrueshme | Forca të ndryshme |
| Vetitë dalluese fizike të substancave | Me shkrirje të ulët ose sublimuese, fortësi të ulët, shumë të tretshme në ujë | Rezistent, i fortë, i brishtë, shumë i tretshëm në ujë. Zgjidhjet dhe shkrirjet përçojnë rrymë elektrike | Shumë refraktar, shumë i fortë, praktikisht i pazgjidhshëm në ujë | Përçueshmëri e lartë elektrike dhe termike, shkëlqim metalik, duktilitet. |
| Shembuj të substancave | Substanca të thjeshta - jometale (në gjendje të ngurtë): Cl 2, F 2, Br 2, O 2, O 3, P 4, squfur, jod (përveç silikonit, diamantit, grafitit); substanca komplekse që përbëhen nga atome jometale (përveç kripërave të amonit): ujë, akull të thatë, acide, halogjene jometale: PCl 3, SiF 4, CBr 4, SF 6, substanca organike: hidrokarbure, alkoole, fenole, aldehide etj. . | Kripërat: klorur natriumi, nitrat bariumi etj.; alkalet: hidroksidi i kaliumit, hidroksidi i kalciumit, kripërat e amonit: NH 4 Cl, NH 4 NO 3 etj., oksidet e metaleve, nitridet, hidridet etj. (përbërjet e metaleve me jometalet) | Diamant, grafit, silic, bor, germanium, oksid silikoni (IV) - silicë, SiC (karborund), fosfor i zi (P). | Bakri, kaliumi, zinku, hekuri dhe metale të tjera |
| Krahasimi i substancave sipas pikave të shkrirjes dhe vlimit. | ||||
| Për shkak të forcave të dobëta të ndërveprimit ndërmolekular, substanca të tilla kanë pikat më të ulëta të shkrirjes dhe vlimit. Për më tepër, sa më e madhe të jetë pesha molekulare e substancës, aq më e lartë është t 0 pl. ajo ka. Përjashtim bëjnë substancat molekulat e të cilave mund të formojnë lidhje hidrogjeni. Për shembull, HF ka një t0 pl më të lartë se HCl. | Substancat kanë t 0 pl. të lartë, por më të ulët se substancat me një rrjetë atomike. Sa më të larta të jenë ngarkesat e joneve që ndodhen në vendet e rrjetës dhe sa më e shkurtër të jetë distanca midis tyre, aq më e lartë është pika e shkrirjes së substancës. Për shembull, t 0 pl. CaF 2 është më i lartë se t 0 pl. KF. | Ata kanë t 0 pl më të lartë. Sa më e fortë të jetë lidhja midis atomeve në rrjetë, aq më e lartë është t 0 pl. ka substancë. Për shembull, Si ka një t0 pl më të ulët se C. | Metalet kanë t0 pl. të ndryshme: nga -37 0 C për merkurin deri në 3360 0 C për tungsten. |
E para prej tyre është formimi i lidhjeve jonike. (E dyta është arsimi, i cili do të diskutohet më poshtë). Kur formohet një lidhje jonike, një atom metalik humbet elektrone, dhe një atom jometal fiton elektrone. Për shembull, merrni parasysh strukturën elektronike të atomeve të natriumit dhe klorit:
Na 1s 2 2s 2 2 fq 6 3 s 1 - një elektron në nivelin e jashtëm
Cl 1s 2 2s 2 2 fq 6 3 s 2 3 f 5 - shtatë elektrone në nivelin e jashtëm
Nëse një atom natriumi i dhuron elektronin e tij të vetëm 3s një atomi klori, rregulli i oktetit do të jetë i kënaqur për të dy atomet. Atomi i klorit do të ketë tetë elektrone në shtresën e tretë të jashtme, dhe atomi i natriumit do të ketë gjithashtu tetë elektrone në shtresën e dytë, e cila tani është bërë shtresa e jashtme:
Na+1s2 2s 2 2 fq 6
Cl - 1s 2 2s 2 2 fq 6 3 s 2 3 fq 6 - tetë elektrone në nivelin e jashtëm
Në këtë rast, bërthama e atomit të natriumit përmban ende 11 protone, por numri i përgjithshëm i elektroneve është ulur në 10. Kjo do të thotë se numri i grimcave të ngarkuara pozitivisht është një më shumë se numri i atyre të ngarkuara negativisht, pra ngarkesa totale i “atomit” të natriumit është +1.
"Atomi" i klorit tani përmban 17 protone dhe 18 elektrone dhe ka një ngarkesë prej -1.
Atomet e ngarkuara të formuara nga humbja ose fitimi i një ose më shumë elektroneve quhen jonet. Jonet e ngarkuara pozitivisht quhen kationet, dhe quhen ato me ngarkesë negative anionet.
Kationet dhe anionet, që kanë ngarkesa të kundërta, tërhiqen nga njëri-tjetri nga forcat elektrostatike. Kjo tërheqje e joneve me ngarkesë të kundërt quhet lidhje jonike.
. Ndodh në komponimet e formuara nga një metal dhe një ose më shumë jometale.
Përbërjet e mëposhtme e plotësojnë këtë kriter dhe kanë natyrë jonike: MgCl 2, Fel 2, CuF, Na 2 0, Na 2 S0 4, Zn(C 2 H 3 0 2) 2.
Ekziston një mënyrë tjetër për të përshkruar komponimet jonike:
Në këto formula, pikat tregojnë vetëm elektronet e vendosura në shtresën e jashtme ( elektronet e valencës ). Formula të tilla quhen formula të Lewis për nder të kimistit amerikan G. N. Lewis, një nga themeluesit (së bashku me L. Pauling) të teorisë së lidhjes kimike.
Transferimi i elektroneve nga një atom metali në një atom jometal dhe formimi i joneve është i mundur për faktin se jometalet kanë elektronegativitet të lartë, dhe metalet kanë elektronegativitet të ulët.
Për shkak të tërheqjes së fortë të joneve me njëri-tjetrin, përbërjet jonike janë kryesisht të ngurta dhe kanë një pikë shkrirjeje mjaft të lartë.
Një lidhje jonike formohet nga transferimi i elektroneve nga një atom metali në një atom jometal. Jonet që rezultojnë tërhiqen nga njëri-tjetri nga forcat elektrostatike.
Lidhja jonike
(u përdorën materiale nga faqja http://www.hemi.nsu.ru/ucheb138.htm)
Lidhja jonike ndodh përmes tërheqjes elektrostatike midis joneve të ngarkuar në mënyrë të kundërt. Këto jone formohen si rezultat i transferimit të elektroneve nga një atom në tjetrin. Një lidhje jonike formohet midis atomeve që kanë dallime të mëdha në elektronegativitet (zakonisht më i madh se 1.7 në shkallën Pauling), për shembull, midis atomeve të metaleve alkali dhe halogjenit.
Le të shqyrtojmë shfaqjen e një lidhjeje jonike duke përdorur shembullin e formimit të NaCl.
Nga formulat elektronike të atomeve
Na 1s 2 2s 2 2p 6 3s 1 dhe
Cl 1s 2 2s 2 2p 6 3s 2 3p 5
Mund të shihet se për të përfunduar nivelin e jashtëm, është më e lehtë për një atom natriumi të heqë dorë nga një elektron sesa të fitojë shtatë, dhe për një atom klori është më e lehtë të fitojë një elektron sesa të fitojë shtatë. Në reaksionet kimike, atomi i natriumit heq një elektron, dhe atomi i klorit e merr atë. Si rezultat, predha elektronike të atomeve të natriumit dhe klorit shndërrohen në predha elektronike të qëndrueshme të gazeve fisnike (konfigurimi elektronik i kationit të natriumit
Na + 1s 2 2s 2 2p 6,
dhe konfigurimi elektronik i anionit të klorit është
Cl – - 1s 2 2s 2 2p 6 3s 2 3p 6).
Ndërveprimi elektrostatik i joneve çon në formimin e një molekule NaCl.
Natyra e lidhjes kimike shpesh reflektohet në gjendjen e grumbullimit dhe vetitë fizike të substancës. Komponimet jonike si kloruri i natriumit NaCl janë të forta dhe refraktare sepse ekzistojnë forca të fuqishme të tërheqjes elektrostatike midis ngarkesave të joneve të tyre "+" dhe "-".
Joni i klorit i ngarkuar negativisht tërheq jo vetëm jonin "e tij" Na+, por edhe jonet e tjera të natriumit rreth tij. Kjo çon në faktin se pranë ndonjërit prej joneve nuk ka një jon me shenjën e kundërt, por disa.
Struktura e një kristali të klorurit të natriumit NaCl.
Në fakt, ka 6 jone natriumi rreth secilit jon klori dhe 6 jone klori rreth secilit jon natriumi. Ky paketim i renditur i joneve quhet kristal jonik. Nëse një atom i vetëm klori është i izoluar në një kristal, atëherë midis atomeve të natriumit që e rrethojnë nuk është më e mundur të gjendet ai me të cilin reagoi klori.
Të tërhequr nga njëri-tjetri nga forcat elektrostatike, jonet janë jashtëzakonisht ngurrues për të ndryshuar vendndodhjen e tyre nën ndikimin e forcës së jashtme ose një rritje të temperaturës. Por nëse kloruri i natriumit shkrihet dhe vazhdon të nxehet në vakum, ai avullon, duke formuar molekula diatomike NaCl. Kjo sugjeron që forcat e lidhjes kovalente nuk fiken kurrë plotësisht.
Karakteristikat themelore të lidhjeve jonike dhe vetitë e përbërjeve jonike
1. Një lidhje jonike është një lidhje e fortë kimike. Energjia e kësaj lidhjeje është e rendit 300 – 700 kJ/mol.
2. Ndryshe nga një lidhje kovalente, një lidhje jonike është jo-drejtuese, sepse një jon mund të tërheqë jone të shenjës së kundërt drejt vetes në çdo drejtim.
3. Ndryshe nga një lidhje kovalente, një lidhje jonike është e pangopur, pasi bashkëveprimi i joneve të shenjës së kundërt nuk çon në kompensimin e plotë të ndërsjellë të fushave të tyre të forcës.
4. Gjatë formimit të molekulave me një lidhje jonike, transferimi i plotë i elektroneve nuk ndodh, prandaj, lidhjet jonike qind për qind nuk ekzistojnë në natyrë. Në molekulën NaCl, lidhja kimike është vetëm 80% jonike.
5. Komponimet me lidhje jonike janë lëndë të ngurta kristalore që kanë pika të larta shkrirjeje dhe vlimi.
6. Shumica e përbërjeve jonike janë të tretshme në ujë. Tretësirat dhe shkrirjet e përbërjeve jonike përçojnë rrymë elektrike.
Lidhje metalike
Kristalet metalike janë të strukturuara ndryshe. Nëse shqyrtoni një copë metali natriumi, do të zbuloni se pamja e saj është shumë e ndryshme nga kripa e tryezës. Natriumi është një metal i butë, i prerë lehtësisht me thikë, i rrafshuar me çekiç, mund të shkrihet lehtësisht në një filxhan në një llambë alkooli (pika e shkrirjes 97,8 o C). Në një kristal natriumi, çdo atom është i rrethuar nga tetë atome të tjera të ngjashme.

Struktura kristalore e Na metalike.
Figura tregon se atomi Na në qendër të kubit ka 8 fqinjët më të afërt. Por e njëjta gjë mund të thuhet për çdo atom tjetër në një kristal, pasi ata janë të gjithë të njëjtë. Kristali përbëhet nga fragmente të përsëritura "pafundësisht" të paraqitura në këtë figurë.
Atomet e metaleve në nivelin e jashtëm të energjisë përmbajnë një numër të vogël elektronesh valente. Meqenëse energjia e jonizimit të atomeve metalike është e ulët, elektronet e valencës mbahen dobët në këto atome. Si rezultat, jonet e ngarkuar pozitivisht dhe elektronet e lira shfaqen në rrjetën kristalore të metaleve. Në këtë rast, kationet metalike janë të vendosura në nyjet e rrjetës kristalore, dhe elektronet lëvizin lirshëm në fushën e qendrave pozitive, duke formuar të ashtuquajturin "gaz elektronik".
Prania e një elektroni të ngarkuar negativisht midis dy kationeve bën që secili kation të ndërveprojë me këtë elektron.
Kështu, Lidhja metalike është lidhja midis joneve pozitive në kristalet metalike që ndodh përmes tërheqjes së elektroneve që lëvizin lirshëm në të gjithë kristalin.
Meqenëse elektronet e valencës në një metal shpërndahen në mënyrë të barabartë në të gjithë kristalin, një lidhje metalike, si një lidhje jonike, është një lidhje jo-drejtuese. Ndryshe nga një lidhje kovalente, një lidhje metalike është një lidhje e pangopur. Një lidhje metalike gjithashtu ndryshon nga një lidhje kovalente në forcë. Energjia e një lidhjeje metalike është afërsisht tre deri në katër herë më e vogël se energjia e një lidhjeje kovalente.
Për shkak të lëvizshmërisë së lartë të gazit elektronik, metalet karakterizohen nga përçueshmëri e lartë elektrike dhe termike.
Kristali metalik duket mjaft i thjeshtë, por në fakt struktura e tij elektronike është më komplekse se ajo e kristaleve jonike të kripës. Nuk ka mjaft elektrone në shtresën e jashtme elektronike të elementeve metalikë për të formuar një lidhje kovalente ose jonike të plotë "oktet". Prandaj, në gjendje të gaztë, shumica e metaleve përbëhen nga molekula monoatomike (d.m.th., atome individuale që nuk lidhen me njëri-tjetrin). Një shembull tipik është avulli i merkurit. Kështu, lidhja metalike midis atomeve metalike ndodh vetëm në gjendjen e lëngshme dhe të ngurtë të grumbullimit.
Një lidhje metalike mund të përshkruhet si më poshtë: disa nga atomet e metalit në kristalin që rezulton heqin dorë nga elektronet e tyre të valencës në hapësirën midis atomeve (për natriumin kjo është...3s1), duke u kthyer në jone. Meqenëse të gjithë atomet e metaleve në një kristal janë të njëjtë, secili ka një shans të barabartë për të humbur një elektron valence.
Me fjalë të tjera, transferimi i elektroneve midis atomeve metalike neutrale dhe të jonizuara ndodh pa konsumim të energjisë. Në këtë rast, disa elektrone përfundojnë gjithmonë në hapësirën midis atomeve në formën e "gazit elektronik".
Këto elektrone të lira, së pari, mbajnë atomet metalike në një distancë të caktuar ekuilibri nga njëri-tjetri.
Së dyti, ato u japin metaleve një "shkëlqim metalik" karakteristik (elektronet e lira mund të ndërveprojnë me kuantet e dritës).
Së treti, elektronet e lira u sigurojnë metaleve përçueshmëri të mirë elektrike. Përçueshmëria e lartë termike e metaleve shpjegohet gjithashtu me praninë e elektroneve të lira në hapësirën ndëratomike - ato lehtësisht "përgjigjen" ndaj ndryshimeve të energjisë dhe kontribuojnë në transferimin e shpejtë të saj në kristal.

Një model i thjeshtuar i strukturës elektronike të një kristali metalik.
******** Duke përdorur si shembull natriumin metalik, le të shqyrtojmë natyrën e lidhjes metalike nga pikëpamja e ideve rreth orbitaleve atomike. Atomi i natriumit, si shumë metale të tjera, ka mungesë të elektroneve të valencës, por ka orbitale me valencë të lirë. I vetmi elektron 3s i natriumit është i aftë të lëvizë në ndonjë nga orbitalet fqinje të lirë dhe të afërt me energji. Ndërsa atomet në një kristal afrohen më shumë, orbitalet e jashtme të atomeve fqinje mbivendosen, duke lejuar që elektronet e lëshuara të lëvizin lirshëm nëpër kristal.
Megjithatë, "gazi elektronik" nuk është aq i çrregullt sa mund të duket. Elektronet e lira në një kristal metalik janë në orbitale të mbivendosura dhe në një farë mase janë të përbashkëta, duke formuar diçka si lidhje kovalente. Natriumi, kaliumi, rubidiumi dhe elementët e tjerë metalikë thjesht kanë pak elektrone të përbashkëta, kështu që kristalet e tyre janë të brishtë dhe të shkrirë. Me rritjen e numrit të elektroneve të valencës, forca e metaleve në përgjithësi rritet.
Kështu, lidhjet metalike priren të formohen nga elementë, atomet e të cilëve kanë pak elektrone valence në shtresën e jashtme të tyre. Këto elektrone valente, të cilat kryejnë lidhjen metalike, ndahen aq shumë sa që mund të lëvizin në të gjithë kristalin metalik dhe të sigurojnë përçueshmëri të lartë elektrike të metalit.
Një kristal NaCl nuk përçon elektricitetin sepse nuk ka elektrone të lira në hapësirën midis joneve. Të gjitha elektronet e dhuruara nga atomet e natriumit mbahen fort nga jonet e klorit. Ky është një nga ndryshimet domethënëse midis kristaleve jonike dhe atyre metalike.
Ajo që dini tani për lidhjen metalike ndihmon në shpjegimin e lakueshmërisë (duktilitetit) të lartë të shumicës së metaleve. Metali mund të rrafshohet në një fletë të hollë dhe të tërhiqet në tel. Fakti është se shtresat individuale të atomeve në një kristal metalik mund të rrëshqasin njëra-tjetrën relativisht lehtë: "gazi elektronik" i lëvizshëm zbut vazhdimisht lëvizjen e joneve individuale pozitive, duke i mbrojtur ato nga njëri-tjetri.
Sigurisht, asgjë e tillë nuk mund të bëhet me kripën e tryezës, megjithëse kripa është gjithashtu një substancë kristalore. Në kristalet jonike, elektronet e valencës janë të lidhur ngushtë me bërthamën e atomit. Zhvendosja e një shtrese jonesh në raport me një tjetër i afron jonet me të njëjtën ngarkesë dhe shkakton zmbrapsje të fortë midis tyre, duke rezultuar në shkatërrimin e kristalit (NaCl është një substancë e brishtë).

Zhvendosja e shtresave të një kristali jonik shkakton shfaqjen e forcave të mëdha refuzuese midis joneve të ngjashme dhe shkatërrimin e kristalit.
Navigimi
- Zgjidhja e problemeve të kombinuara bazuar në karakteristikat sasiore të një substance
- Zgjidhja e problemeve. Ligji i qëndrueshmërisë së përbërjes së substancave. Llogaritjet duke përdorur konceptet e "masës molare" dhe "sasia kimike" e një substance
Është jashtëzakonisht e rrallë që substancat kimike të përbëhen nga atome individuale, të palidhura të elementeve kimike. Në kushte normale, vetëm një numër i vogël i gazrave të quajtur gazra fisnikë e kanë këtë strukturë: helium, neoni, argon, kripton, ksenon dhe radoni. Më shpesh, substancat kimike nuk përbëhen nga atome të izoluar, por nga kombinime të tyre në grupe të ndryshme. Asociacione të tilla atomesh mund të numërojnë disa, qindra, mijëra ose edhe më shumë atome. Forca që i mban këto atome në grupe të tilla quhet lidhje kimike.
Me fjalë të tjera, mund të themi se një lidhje kimike është një ndërveprim që siguron lidhjen e atomeve individuale në struktura më komplekse (molekula, jone, radikale, kristale, etj.).
Arsyeja për formimin e një lidhjeje kimike është se energjia e strukturave më komplekse është më e vogël se energjia totale e atomeve individuale që e formojnë atë.
Pra, në veçanti, nëse ndërveprimi i atomeve X dhe Y prodhon një molekulë XY, kjo do të thotë që energjia e brendshme e molekulave të kësaj substance është më e ulët se energjia e brendshme e atomeve individuale nga të cilat është formuar:
E(XY)< E(X) + E(Y)
Për këtë arsye, kur formohen lidhje kimike midis atomeve individuale, lirohet energji.
Elektrone të shtresës së jashtme elektronike me energjinë më të ulët të lidhjes me bërthamën, të quajtura valencë. Për shembull, në bor këto janë elektrone të nivelit të dytë të energjisë - 2 elektrone për 2 s- orbitalet dhe 1 me 2 fq-orbitalet:
Kur formohet një lidhje kimike, çdo atom tenton të marrë konfigurimin elektronik të atomeve të gazit fisnik, d.m.th. në mënyrë që të ketë 8 elektrone në shtresën e jashtme elektronike të saj (2 për elementët e periudhës së parë). Ky fenomen quhet rregulli oktet.
Është e mundur që atomet të arrijnë konfigurimin elektronik të një gazi fisnik nëse atome të vetme fillimisht ndajnë disa nga elektronet e tyre të valencës me atome të tjera. Në këtë rast, formohen çifte të përbashkëta elektronike.
Në varësi të shkallës së ndarjes së elektroneve, mund të dallohen lidhjet kovalente, jonike dhe metalike.
Lidhja kovalente
Lidhjet kovalente më së shpeshti ndodhin midis atomeve të elementeve jometalike. Nëse atomet jometale që formojnë një lidhje kovalente i përkasin elementeve të ndryshme kimike, një lidhje e tillë quhet lidhje kovalente polare. Arsyeja për këtë emër qëndron në faktin se atomet e elementeve të ndryshëm kanë gjithashtu aftësi të ndryshme për të tërhequr një çift elektronik të përbashkët. Natyrisht, kjo çon në një zhvendosje të çiftit të përbashkët elektronik drejt një prej atomeve, si rezultat i së cilës mbi të formohet një ngarkesë e pjesshme negative. Nga ana tjetër, një ngarkesë e pjesshme pozitive formohet në atomin tjetër. Për shembull, në një molekulë të klorurit të hidrogjenit çifti elektronik zhvendoset nga atomi i hidrogjenit në atomin e klorit:
Shembuj të substancave me lidhje kovalente polare:
CCl 4, H 2 S, CO 2, NH 3, SiO 2, etj.
Një lidhje kovalente jopolare formohet midis atomeve jometale të të njëjtit element kimik. Meqenëse atomet janë identike, aftësia e tyre për të tërhequr elektrone të përbashkëta është gjithashtu e njëjtë. Në këtë drejtim, nuk vërehet zhvendosje e çiftit elektronik:
Mekanizmi i mësipërm për formimin e një lidhjeje kovalente, kur të dy atomet ofrojnë elektrone për të formuar çifte të përbashkëta elektronike, quhet shkëmbim.
Ekziston edhe një mekanizëm dhurues-pranues.
Kur një lidhje kovalente formohet nga mekanizmi dhurues-pranues, formohet një çift elektronik i përbashkët për shkak të orbitalës së mbushur të një atomi (me dy elektrone) dhe orbitalës së zbrazët të një atomi tjetër. Një atom që siguron një palë të vetme elektronesh quhet dhurues dhe një atom me një orbitale të zbrazët quhet pranues. Atomet që kanë elektrone të çiftëzuara, për shembull N, O, P, S, veprojnë si dhurues të çifteve elektronike.
Për shembull, sipas mekanizmit dhurues-pranues, lidhja e katërt kovalente N-H formohet në kationin e amonit NH 4 +:
Përveç polaritetit, lidhjet kovalente karakterizohen edhe nga energjia. Energjia e lidhjes është energjia minimale e nevojshme për të thyer një lidhje midis atomeve.
Energjia e lidhjes zvogëlohet me rritjen e rrezeve të atomeve të lidhura. Meqenëse e dimë se rrezet atomike rriten poshtë nëngrupeve, për shembull, mund të konkludojmë se forca e lidhjes halogjen-hidrogjen rritet në seri:
HI< HBr < HCl < HF
Gjithashtu, energjia e lidhjes varet nga shumëfishimi i saj - sa më i madh të jetë shumëfishimi i lidhjes, aq më e madhe është energjia e saj. Shumëfishimi i lidhjes i referohet numrit të çifteve të përbashkëta të elektroneve midis dy atomeve.
Lidhja jonike
Një lidhje jonike mund të konsiderohet si një rast ekstrem i një lidhjeje kovalente polare. Nëse në një lidhje kovalente-polare çifti i përbashkët elektronik zhvendoset pjesërisht në një nga çiftet e atomeve, atëherë në një lidhje jonike ai pothuajse plotësisht "i jepet" njërit prej atomeve. Atomi që dhuron elektron(et) fiton një ngarkesë pozitive dhe bëhet kation, dhe atomi që ka marrë elektrone prej tij merr një ngarkesë negative dhe bëhet anion.
Kështu, një lidhje jonike është një lidhje e formuar nga tërheqja elektrostatike e kationeve ndaj anioneve.
Formimi i kësaj lloj lidhjeje është tipik gjatë bashkëveprimit të atomeve të metaleve tipike dhe jometaleve tipike.
Për shembull, fluori i kaliumit. Kationi i kaliumit formohet nga heqja e një elektroni nga një atom neutral, dhe joni i fluorit formohet nga shtimi i një elektroni në atomin e fluorit:

Një forcë tërheqëse elektrostatike lind midis joneve që rezultojnë, duke rezultuar në formimin e një përbërjeje jonike.
Kur u formua një lidhje kimike, elektronet nga atomi i natriumit kaluan në atomin e klorit dhe u formuan jone të ngarkuar në të kundërt, të cilët kanë një nivel të plotë të energjisë së jashtme.
Është vërtetuar se elektronet nga atomi i metalit nuk janë shkëputur plotësisht, por zhvendosen vetëm drejt atomit të klorit, si në një lidhje kovalente.
Shumica e komponimeve binare që përmbajnë atome metalike janë jonike. Për shembull, oksidet, halogjenët, sulfidet, nitridet.
Lidhja jonike ndodh gjithashtu midis kationeve të thjeshta dhe anioneve të thjeshta (F −, Cl−, S 2-), si dhe midis kationeve të thjeshta dhe anioneve komplekse (NO 3 −, SO 4 2-, PO 4 3-, OH −). Prandaj, komponimet jonike përfshijnë kripërat dhe bazat (Na 2 SO 4, Cu(NO 3) 2, (NH 4) 2 SO 4), Ca(OH) 2, NaOH).
Lidhje metalike
Kjo lloj lidhjeje formohet në metale.
Atomet e të gjitha metaleve kanë elektrone në shtresën e jashtme elektronike të tyre që kanë një energji të ulët lidhëse me bërthamën e atomit. Për shumicën e metaleve, procesi i humbjes së elektroneve të jashtme është energjikisht i favorshëm.
Për shkak të një ndërveprimi kaq të dobët me bërthamën, këto elektrone në metale janë shumë të lëvizshme dhe procesi i mëposhtëm ndodh vazhdimisht në çdo kristal metalik:
M 0 - ne - = M n + , ku M 0 është një atom metali neutral, dhe M n + është një kation i të njëjtit metal. Figura më poshtë ofron një ilustrim të proceseve që po ndodhin.
Kjo do të thotë, elektronet "nguten" nëpër një kristal metalik, duke u shkëputur nga një atom metalik, duke formuar një kation prej tij, duke u bashkuar me një kation tjetër, duke formuar një atom neutral. Ky fenomen u quajt "erë elektronike" dhe grumbullimi i elektroneve të lira në një kristal të një atomi jometal u quajt "gaz elektron". Ky lloj ndërveprimi ndërmjet atomeve metalike quhet lidhje metalike.
Lidhja hidrogjenore
Nëse një atom hidrogjeni në një substancë është i lidhur me një element me elektronegativitet të lartë (azot, oksigjen ose fluor), kjo substancë karakterizohet nga një fenomen i quajtur lidhje hidrogjenore.
Meqenëse një atom hidrogjeni është i lidhur me një atom elektronegativ, një ngarkesë e pjesshme pozitive formohet në atomin e hidrogjenit dhe një ngarkesë e pjesshme negative formohet në atomin e elementit elektronegativ. Në këtë drejtim, tërheqja elektrostatike bëhet e mundur midis një atomi hidrogjeni të ngarkuar pjesërisht pozitivisht të një molekule dhe një atomi elektronegativ të një tjetri. Për shembull, lidhja hidrogjenore vërehet për molekulat e ujit:
Është lidhja e hidrogjenit që shpjegon pikën e shkrirjes anormalisht të lartë të ujit. Përveç ujit, lidhje të forta hidrogjeni krijohen edhe në substanca të tilla si fluori i hidrogjenit, amoniaku, acidet që përmbajnë oksigjen, fenolet, alkoolet dhe aminet.