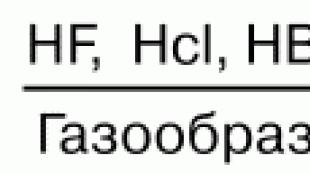Шингэн хэрхэн, хэзээ хий болж хувирдаг вэ? Хийн бодис: жишээ ба шинж чанар Хийн доторх энгийн бодисууд
Өнөөдөр 3 сая гаруй төрлийн бодис байгаа нь мэдэгдэж байна. Синтетик химич болон бусад эрдэмтэд зарим ашигтай шинж чанартай шинэ нэгдлүүдийг олж авах туршилтыг байнга хийдэг тул энэ тоо жил бүр нэмэгдэж байна.
Зарим бодисууд нь байгалийн оршин суугчид бөгөөд байгалийн жамаар үүсдэг. Нөгөө хагас нь хиймэл, синтетик юм. Гэсэн хэдий ч эхний болон хоёр дахь тохиолдолд ихээхэн хэсэг нь хийн бодисоос бүрддэг бөгөөд тэдгээрийн жишээ, шинж чанарыг бид энэ нийтлэлд авч үзэх болно.
Бодисын нэгдсэн төлөв
17-р зуунаас хойш бүх мэдэгдэж буй нэгдлүүд нь хатуу, шингэн, хийн бодис гэсэн гурван төлөвт агуулагдах чадвартай гэдгийг нийтээр хүлээн зөвшөөрсөн. Гэсэн хэдий ч сүүлийн хэдэн арван жилд одон орон, физик, хими, сансрын биологи болон бусад шинжлэх ухааны салбарт хийсэн нарийн судалгаа нь өөр хэлбэр байгааг нотолсон. Энэ бол плазм юм.
Тэр юу вэ? Энэ нь хэсэгчлэн эсвэл бүрэн юм.Тэгээд энэ төрлийн бодисуудын дийлэнх нь орчлон ертөнцөд байдаг нь харагдаж байна. Тиймээс сийвэнгийн төлөвт дараахь зүйлс олддог.
- од хоорондын бодис;
- сансрын бодис;
- агаар мандлын дээд давхарга;
- мананцар;
- олон гаригийн найрлага;
- одод.
Тиймээс өнөөдөр хатуу, шингэн, хий, плазм гэж байдаг. Дашрамд хэлэхэд хий бүрийг иончлох, өөрөөр хэлбэл ион болгон хувиргахад зохиомлоор энэ төлөвт шилжүүлж болно.
Хийн бодис: жишээ
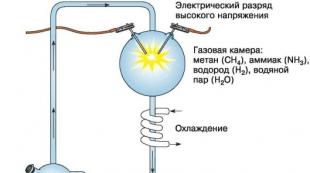
Харгалзаж буй бодисуудын олон жишээ бий. Эцсийн эцэст хийнүүд нь 17-р зуунаас хойш мэдэгдэж байсан бөгөөд байгалийн эрдэмтэн ван Хелмонт нүүрстөрөгчийн давхар ислийг олж авч, шинж чанарыг нь судалж эхэлсэн. Дашрамд хэлэхэд тэрээр энэ бүлгийн нэгдлүүдийг мөн нэрлэсэн, учир нь түүний бодлоор хий нь эмх замбараагүй, эмх замбараагүй, сүнстэй холбоотой, үл үзэгдэх боловч бодитой зүйл юм. Энэ нэр Орос улсад газар авсан.
Бүх хийн бодисыг ангилах боломжтой, дараа нь жишээ өгөхөд хялбар байх болно. Эцсийн эцэст, бүх олон янз байдлыг хамрах нь хэцүү байдаг.
Найрлагын дагуу тэдгээрийг дараахь байдлаар ялгадаг.
- энгийн,
- нарийн төвөгтэй молекулууд.
Эхний бүлэгт ямар ч хэмжээгээр ижил атомуудаас бүрдэх бодисууд орно. Жишээ нь: хүчилтөрөгч - O 2, озон - O 3, устөрөгч - H 2, хлор - CL 2, фтор - F 2, азот - N 2 болон бусад.
- устөрөгчийн сульфид - H 2 S;
- устөрөгчийн хлорид - HCL;
- метан - CH 4;
- хүхрийн давхар исэл - SO 2;
- бор хий - NO 2;
- фреон - CF 2 CL 2;
- аммиак - NH 3 болон бусад.

Бодисын шинж чанараар нь ангилах
Та мөн хийн төрлүүдийг ангилж болно янз бүрийн бодисуудорганик болон органик бус ертөнцөд харьяалагдах дагуу. Энэ нь түүнийг бүрдүүлдэг атомуудын мөн чанараар юм. Органик хий нь:
- эхний таван төлөөлөгч (метан, этан, пропан, бутан, пентан). Ерөнхий томьёо C n H 2n+2 ;
- этилен - C 2 H 4;
- ацетилен эсвэл этилен - C 2 H 2;
- метиламин - CH 3 NH 2 болон бусад.
Тухайн нэгдлүүдэд хэрэглэж болох өөр нэг ангилал бол тэдгээрийн агуулагдах хэсгүүдэд үндэслэн хуваах явдал юм. Бүх хийн бодисууд атомаас бүтдэггүй. Ион, молекул, фотон, электрон, броуны тоосонцор, сийвэн зэрэгт агуулагдах бүтцийн жишээг нэгтгэх төлөвийн нэгдлүүдийг мөн хэлнэ.
Хийн шинж чанарууд
Тухайн төлөвт байгаа бодисын шинж чанар нь хатуу эсвэл шингэн нэгдлээс ялгаатай. Гол зүйл бол хийн бодисын шинж чанар нь онцгой шинж чанартай байдаг. Тэдний тоосонцор амархан, хурдан хөдөлгөөнтэй, бодис нь бүхэлдээ изотроп шинж чанартай, өөрөөр хэлбэл шинж чанар нь найрлагад орсон бүтцийн хөдөлгөөний чиглэлээр тодорхойлогддоггүй.
Бид хамгийн чухал зүйлийг тодорхойлж чадна физик шинж чанархийн бодисууд бөгөөд энэ нь тэдгээрийг материйн оршихуйн бусад бүх хэлбэрээс ялгах болно.
- Эдгээр нь энгийн хүний арга хэрэгслээр харж, хянах, мэдрэх боломжгүй холболтууд юм. Шинж чанарыг ойлгож, тодорхой хийг тодорхойлохын тулд тэдгээр нь бүгдийг тодорхойлсон дөрвөн параметрт тулгуурладаг: даралт, температур, бодисын хэмжээ (моль), эзэлхүүн.
- Шингэнээс ялгаатай нь хий нь бүхэл бүтэн орон зайг ул мөргүй эзлэх чадвартай бөгөөд зөвхөн хөлөг онгоц эсвэл өрөөний хэмжээгээр хязгаарлагддаг.
- Бүх хий нь хоорондоо амархан холилддог бөгөөд эдгээр нэгдлүүд нь интерфейсгүй байдаг.
- Илүү хөнгөн, илүү хүнд төлөөлөгчид байдаг тул таталцал, цаг хугацааны нөлөөн дор тэдний салалтыг харах боломжтой байдаг.
- Тархалт нь эдгээр нэгдлүүдийн хамгийн чухал шинж чанаруудын нэг юм. Түүний бүтцэд бүрэн эмх замбараагүй хөдөлгөөн хийх үед бусад бодис руу нэвтэрч, дотроос нь ханах чадвар.
- Бодит хий нь цахилгаан гүйдэл дамжуулж чадахгүй, гэхдээ хэрэв бид ховордсон, ионжуулсан бодисын тухай ярих юм бол цахилгаан дамжуулах чанар огцом нэмэгддэг.
- Хийн дулаан багтаамж, дулаан дамжилтын илтгэлцүүр нь бага бөгөөд төрөл зүйлээс хамаарч өөр өөр байдаг.
- Даралт ба температур нэмэгдэхийн хэрээр зуурамтгай чанар нэмэгддэг.
- Интерфазын шилжилтийн хоёр сонголт байдаг: ууршилт - шингэн нь уур болж хувирдаг, сублимаци - шингэнийг алгасаж, хийн хэлбэрт ордог хатуу бодис.
Жинхэнэ хийн уурын өвөрмөц шинж чанар нь эхнийх нь тодорхой нөхцөлд шингэн эсвэл хатуу фаз болж хувирах чадвартай байдаг бол сүүлийнх нь тийм биш юм. Мөн энэ нэгдлүүд нь хэв гажилтыг эсэргүүцэх чадвартай, шингэн байх чадвартай гэдгийг тэмдэглэх нь зүйтэй.

Хийн бодисын ийм шинж чанар нь тэдгээрийг шинжлэх ухаан, технологи, үйлдвэрлэл, үндэсний эдийн засгийн янз бүрийн салбарт өргөнөөр ашиглах боломжийг олгодог. Нэмж дурдахад, тодорхой шинж чанарууд нь төлөөлөгч бүрийн хувьд бие даасан байдаг. Бид зөвхөн бүх бодит бүтцэд нийтлэг шинж чанаруудыг авч үзсэн.
Шахах чадвар
Өөр өөр температурт, түүнчлэн даралтын нөлөөн дор хий нь шахаж, концентрацийг нэмэгдүүлж, эзэлдэг эзэлхүүнийг бууруулдаг. Өндөр температурт тэд өргөжиж, бага температурт тэд агшдаг.
Өөрчлөлтүүд нь дарамтын дор тохиолддог. Хийн бодисын нягтрал нэмэгдэж, төлөөлөгч бүрийн хувьд өөр өөр байдаг эгзэгтэй цэгт хүрмэгц өөр нэгтгэх төлөвт шилжиж болно.

Хийн судалгааг хөгжүүлэхэд хувь нэмрээ оруулсан гол эрдэмтэд
Ийм хүмүүс олон байдаг, учир нь хийн судалгаа нь хөдөлмөр их шаарддаг, түүхэн урт үйл явц юм. Хамгийн чухал нээлтүүдийг хийж чадсан хамгийн алдартай хүмүүсийн талаар ярилцъя.
- 1811 онд нээлт хийсэн. Ямар төрлийн хий байх нь хамаагүй, гол зүйл бол ижил нөхцөлд нэг эзэлхүүн нь молекулуудын тоогоор ижил хэмжээгээр агуулагддаг. Эрдэмтний нэрээр нэрлэгдсэн тооцооны утга бий. Аливаа хийн 1 моль нь 6.03 * 10 23 молекултай тэнцүү байна.
- Ферми - хамгийн тохиромжтой квант хийн онолыг бүтээсэн.
- Гэй-Люссак, Бойл-Марриотт - тооцооллын үндсэн кинетик тэгшитгэлийг бүтээсэн эрдэмтдийн нэрс.
- Роберт Бойл.
- Жон Далтон.
- Жак Чарльз болон бусад олон эрдэмтэд.
Хийн бодисын бүтэц
Хамгийн гол онцлогавч үзэж буй бодисуудын болор торыг барихад энэ нь түүний зангилаанд бие биетэйгээ сул ковалент холбоогоор холбогдсон атомууд эсвэл молекулууд байдаг. Ван дер Ваалсын хүч нь ион, электрон болон бусад квант системүүдийн хувьд бас байдаг.
Тиймээс хийн торны бүтцийн үндсэн төрлүүд нь:
- атомын;
- молекул.
Дотор холболтууд нь амархан эвдэрдэг тул эдгээр холболтууд нь тогтмол хэлбэртэй байдаггүй, харин орон зайн эзэлхүүнийг бүхэлд нь дүүргэдэг. Энэ нь мөн цахилгаан дамжуулах чадваргүй, дулаан дамжуулалт муутай болохыг тайлбарладаг. Гэхдээ хий нь сайн дулаан тусгаарлагчтай байдаг, учир нь тархалтын ачаар тэдгээр нь хатуу бодис руу нэвтэрч, тэдгээрийн доторх чөлөөт бөөгнөрөл зайг эзэлдэг. Үүний зэрэгцээ агаарыг дамжуулдаггүй, дулааныг хадгалдаг. Энэ нь хий, хатуу бодисыг барилгын зориулалтаар хослуулан ашиглах үндэс суурь юм.

Хийн дундах энгийн бодисууд
Бүтэц, бүтцийн хувьд ямар хий энэ ангилалд хамаарах талаар бид дээр дурдсан. Эдгээр нь ижил атомуудаас бүрддэг атомууд юм. Олон жишээг өгч болно, учир нь бүх металл бус металлын нэлээд хэсэг нь тогтмол хүснэгтхэвийн нөхцөлд яг ийм нэгтгэлийн төлөвт оршдог. Жишээлбэл:
- цагаан фосфор - энэ элементийн нэг;
- азотын;
- хүчилтөрөгч;
- фтор;
- хлор;
- гелий;
- неон;
- аргон;
- криптон;
- ксенон.
Эдгээр хийн молекулууд нь нэг атомт (язгуурт хий) эсвэл полиатом (озон - O 3) байж болно. Бондын төрөл нь ковалентын туйлт бус, ихэнх тохиолдолд нэлээд сул, гэхдээ бүгдэд нь байдаггүй. Кристал тор нь молекулын төрөл бөгөөд эдгээр бодисыг нэгтгэх нэг төлөвөөс нөгөөд амархан шилжүүлэх боломжийг олгодог. Жишээлбэл, хэвийн нөхцөлд иод нь метал гялалзсан хар ягаан өнгийн талстууд юм. Гэсэн хэдий ч халах үед тэд тод ягаан хийн үүл болж хувирдаг - I 2.

Дашрамд хэлэхэд аливаа бодис, түүний дотор метал нь тодорхой нөхцөлд хийн төлөвт байж болно.
Хийн шинж чанартай цогц нэгдлүүд
Ийм хий нь мэдээжийн хэрэг дийлэнх хувийг эзэлдэг. Молекул дахь атомуудын янз бүрийн хослолууд нь ковалентын холбоо, ван дер-Ваальсийн харилцан үйлчлэлээр нэгдэж, нэгтгэх төлөвийн олон зуун янз бүрийн төлөөлөгчийг бий болгох боломжийг олгодог.
Хийн доторх нарийн төвөгтэй бодисын жишээ нь хоёр ба түүнээс дээш бүрэлдэхүүнтэй бүх нэгдлүүд байж болно өөр өөр элементүүд. Үүнд:
- пропан;
- бутан;
- ацетилен;
- аммиак;
- силан;
- фосфин;
- метан;
- нүүрстөрөгчийн дисульфид;
- хүхрийн давхар исэл;
- бор хий;
- фреон;
- этилен болон бусад.
Молекулын төрлийн болор тор. Ихэнх төлөөлөгчид усанд амархан уусч, холбогдох хүчил үүсгэдэг. Эдгээр нэгдлүүдийн ихэнх нь үйлдвэрт явагддаг химийн синтезийн чухал хэсэг юм.
Метан ба түүний гомологууд
Заримдаа "хий" гэсэн ерөнхий ойлголт нь ихэвчлэн органик шинж чанартай хийн бүтээгдэхүүний бүхэл бүтэн холимог болох байгалийн эрдэсийг хэлдэг. Энэ нь дараахь бодисуудыг агуулдаг.
- метан;
- этан;
- пропан;
- бутан;
- этилен;
- ацетилен;
- пентан болон бусад.
Аж үйлдвэрийн хувьд тэд маш чухал ач холбогдолтой, учир нь пропан-бутан хольц нь хүмүүсийн хоол хийх гэр ахуйн хий бөгөөд үүнийг эрчим хүч, дулааны эх үүсвэр болгон ашигладаг.

Тэдгээрийн ихэнх нь спирт, альдегид, хүчил болон бусад бодисын нийлэгжилтэнд ашиглагддаг органик бодис. Жилд байгалийн хийн хэрэглээ их наяд шоо метр байдаг бөгөөд энэ нь бүрэн үндэслэлтэй юм.
Хүчилтөрөгч ба нүүрстөрөгчийн давхар исэл
Ямар хийн бодисыг нэгдүгээр ангийн сурагчдад хүртэл хамгийн өргөн тархсан, мэддэг гэж нэрлэж болох вэ? Хариулт нь ойлгомжтой - хүчилтөрөгч ба нүүрстөрөгчийн давхар исэл. Эцсийн эцэст тэд дэлхий дээрх бүх амьд биетүүдэд тохиолддог хийн солилцооны шууд оролцогчид юм.
Хүчилтөрөгчгүйгээр зөвхөн зарим төрлийн агааргүй бактери оршин тогтнох боломжтой тул хүчилтөрөгчийн ачаар амьдрал боломжтой болох нь мэдэгдэж байна. Мөн нүүрстөрөгчийн давхар исэл нь фотосинтезийн үйл явцыг явуулахын тулд түүнийг шингээдэг бүх ургамалд зайлшгүй шаардлагатай "хүнсний" бүтээгдэхүүн юм.
Химийн үүднээс авч үзвэл хүчилтөрөгч ба нүүрстөрөгчийн давхар исэл нь нэгдлүүдийн нийлэгжилтийг явуулахад чухал бодис юм. Эхнийх нь хүчтэй исэлдүүлэгч бодис, хоёр дахь нь ихэвчлэн бууруулагч бодис юм.
Галоген
Энэ бол атомууд нь хийн бодисын бөөмс бөгөөд ковалент туйлшгүй холбоогоор хоорондоо хос хосоороо холбогдсон нэгдлүүдийн бүлэг юм. Гэсэн хэдий ч бүх галоген нь хий биш юм. Бром нь энгийн нөхцөлд шингэн, иод нь амархан сублимацияд ордог хатуу бодис юм. Фтор, хлор нь амьд биетийн эрүүл мэндэд аюултай хортой бодис бөгөөд тэдгээр нь хүчтэй исэлдүүлэгч бодис бөгөөд синтез хийхэд маш өргөн хэрэглэгддэг.
Та удаан хугацаанд маш халуун шүршүүрт ордог, угаалгын өрөөний толин тусгал нь уураар бүрхэгдсэн байдаг. Та цонхон дээрх савтай усаа мартаж, дараа нь ус буцалж, тогоо шатаж байгааг олж мэдэв. Ус нь хийнээс шингэн рүү, дараа нь шингэнээс хий рүү шилжих дуртай гэж та бодож магадгүй. Гэхдээ энэ нь хэзээ тохиолддог вэ?
Агааржуулалттай орон зайд ус ямар ч температурт аажмаар ууршдаг. Гэхдээ энэ нь зөвхөн тодорхой нөхцөлд л буцалгана. Буцлах цэг нь шингэний дээрх даралтаас хамаарна. Хэвийн атмосферийн даралттай үед буцалгах цэг нь 100 градус байх болно. Өндөр байх тусам даралт буурахаас гадна буцалгах цэг буурна. Мон Бланкийн оройд 85 градус байх тул та тэнд амттай цай чанаж чадахгүй! Гэхдээ даралтат агшаагчинд шүгэл дуугарах үед усны температур аль хэдийн 130 градус, даралт нь атмосферийн даралтаас 4 дахин их байдаг. Энэ температурт хоол хүнс илүү хурдан чанаж, хавхлага хаалттай байдаг тул амт нь залуутай хамт зугтдаггүй.
Температурын өөрчлөлтөөр бодисыг нэгтгэх төлөвийн өөрчлөлт.
Аливаа шингэн нь хангалттай халсан тохиолдолд хийн төлөвт, хөргөж байвал шингэн төлөвт шилжиж болно. Тиймээс хийн зуух болон улс оронд хэрэглэдэг бутаныг битүү цилиндрт хадгалдаг. Энэ нь даралтын агшаагч шиг шингэн бөгөөд даралттай байдаг. Мөн задгай агаарт 0 градусаас доош температурт метан маш хурдан буцалж, ууршдаг. Шингэрүүлсэн метан нь танк гэж нэрлэгддэг аварга усан санд хадгалагддаг. Хэвийн атмосферийн даралттай үед метан нь 160 градусын хүйтэнд буцалдаг. Тээвэрлэлтийн явцад хий гарахаас урьдчилан сэргийлэхийн тулд савнууд нь термос шиг болгоомжтой хүрдэг.
Даралтын өөрчлөлтөөр бодисын нэгтгэх төлөвийн өөрчлөлт.
Бодисын шингэн ба хийн төлөвийн хооронд температур, даралтаас хамааралтай байдаг. Бодис шингэн төлөвт хийн төлөвөөс илүү ханасан байдаг тул хэрэв та даралтыг нэмэгдүүлбэл хий тэр даруй шингэн болж хувирна гэж бодож магадгүй юм. Гэхдээ энэ нь үнэн биш юм. Гэсэн хэдий ч, хэрэв та унадаг дугуйны насосоор агаарыг шахаж эхэлбэл энэ нь халах болно. Энэ нь поршений дээр дарснаар түүнд шилжүүлэх энергийг хуримтлуулдаг. Хийг нэгэн зэрэг хөргөхөд л шингэн болгон шахаж болно. Үүний эсрэгээр шингэн нь хий болж хувирахын тулд дулааныг хүлээн авах шаардлагатай байдаг. Тийм ч учраас спирт эсвэл эфирийг ууршуулах нь бидний биеэс дулааныг авч, арьсанд хүйтэн мэдрэмж төрүүлдэг. Салхины нөлөөгөөр далайн ус уурших нь усны гадаргууг хөргөж, хөлрөх нь биеийг хөргөнө.
3. Нүүрс устөрөгч
НҮҮСНҮҮрстөрөгч,молекулууд нь зөвхөн нүүрстөрөгч ба устөрөгчийн атомуудаас бүрддэг органик нэгдлүүд.
Хамгийн энгийн төлөөлөгч бол метан CH 4 юм. Нүүрс устөрөгч нь бусад бүх органик нэгдлүүдийн үүсгэн байгуулагчид бөгөөд нүүрсустөрөгчийн молекулд функциональ бүлгүүдийг нэвтрүүлэх замаар асар олон төрлийг олж авах боломжтой; Тиймээс органик хими нь ихэвчлэн нүүрсустөрөгч ба тэдгээрийн деривативуудын хими гэж тодорхойлогддог.
Нүүрс устөрөгч нь молекулын жингээс хамааран хий, шингэн эсвэл хатуу (гэхдээ хуванцар) бодис байж болно. Хэвийн нөхцөлд молекул дахь дөрвөн нүүрстөрөгчийн атом агуулсан нэгдлүүд - хий, жишээлбэл, метан, этан, пропан, бутан, изобутан; эдгээр нүүрсустөрөгч нь байгалийн болон холбогдох түлшний нэг хэсэг юм нефтийн хий. Шингэн нүүрсустөрөгч нь газрын тос, газрын тосны бүтээгдэхүүний нэг хэсэг юм; Тэд ихэвчлэн арван зургаан хүртэл нүүрстөрөгчийн атом агуулдаг. Зарим лав, парафин, асфальт, битум, давирхай нь бүр илүү хүнд нүүрсустөрөгч агуулдаг; Тиймээс парафин нь 16-30 нүүрстөрөгчийн атом агуулсан хатуу нүүрсустөрөгчийг агуулдаг.
Нүүрс устөрөгчийг задгай гинжин хэлхээтэй нэгдлүүд - алифатик эсвэл цикл бус, хаалттай циклийн бүтэцтэй нэгдлүүд - алициклик (аромат шинж чанаргүй) ба үнэрт (тэдгээрийн молекулууд нь бензолын цагираг эсвэл хайлсан бензолын цагиргуудаас бүрдсэн хэсгүүдийг агуулдаг) гэж хуваагддаг. ). Үнэрт нүүрсустөрөгчийг тусдаа ангид ангилдаг, учир нь HS бондын хаалттай систем байдаг тул тэдгээр нь өвөрмөц шинж чанартай байдаг.
Цикл бус нүүрсустөрөгч нь нүүрстөрөгчийн атомын салбарлагдаагүй гинжтэй (хэвийн бүтэцтэй молекулууд) ба салаалсан (изо бүтцийн молекулууд) байж болно.Нүүрстөрөгчийн атомуудын хоорондын холболтын төрлөөс хамааран алифат ба циклик нүүрсустөрөгчийг ханасан гэж хуваана. Зөвхөн энгийн холбоо (алкан, циклоалкан) агуулсан, ханаагүй, энгийн бондтой хамт олон тооны холбоо (алкен, циклоалкен, диен, алкин, циклоалкин) агуулсан.
Нүүрс устөрөгчийн ангиллыг диаграммд тусгасан болно (590-р хуудсыг үз), мөн нүүрсустөрөгчийн анги тус бүрийн төлөөлөгчдийн бүтцийн жишээг өгсөн болно.
Эдгээр бүх нэгдлүүдийн гол нийтлэг шинж чанар нь шаталтын явцад их хэмжээний дулаан ялгаруулдаг (жишээлбэл, метан шаталтын дулаан нь 890 кЖ / моль) байдаг тул нүүрсустөрөгч нь эрчим хүчний эх үүсвэрийн хувьд зайлшгүй шаардлагатай. Нүүрс устөрөгчийн хольцыг дулааны станц, бойлерийн түлш (байгалийн хий, мазут, бойлерийн түлш), автомашин, нисэх онгоц болон бусад тээврийн хэрэгслийн хөдөлгүүрт (бензин, керосин, дизель түлш) түлш болгон ашигладаг. Нүүрс устөрөгчийг бүрэн шатаахад ус, нүүрстөрөгчийн давхар исэл үүсдэг.
Урвалын хувьд нүүрсустөрөгчийн өөр өөр ангиуд нь бие биенээсээ ихээхэн ялгаатай: ханасан нэгдлүүд нь харьцангуй идэвхгүй, ханаагүй нэгдлүүд нь олон төрлийн холбоонд нэмэлт урвалд ордог, үнэрт бодисууд нь орлуулах урвалаар тодорхойлогддог (жишээлбэл, нитратжуулалт, сульфонжуулалт).
Нүүрс устөрөгчийг органик синтезийн анхдагч ба завсрын бүтээгдэхүүн болгон ашигладаг. Химийн болон нефтийн химийн үйлдвэрүүдэд зөвхөн байгалийн гаралтай нүүрсустөрөгчид төдийгүй нийлэг бодисыг ашигладаг. Сүүлийнхийг олж авах арга нь байгалийн хий (синтезийн хий үйлдвэрлэх, ашиглах - CO ба H2-ийн холимог), газрын тос (хагарал), нүүрс (устөрөгчжүүлэлт), сүүлийн үед биомасс, ялангуяа хөдөө аж ахуйн хог хаягдал, мод боловсруулахад суурилдаг. боловсруулах болон бусад үйлдвэрлэл
3.1 Ахиу нүүрсустөрөгч. Алканууд CnH3n+2
Химийн бүтцийн онцлог
Физик ба химийн үндсэн шинж чанарууд:
CH4 хий нь өнгө, үнэргүй, агаараас хөнгөн, усанд уусдаггүй
С-С4 - хий;
C5-C16 - шингэн;
C16 ба түүнээс дээш - хатуу
Гоо сайхны салбарт ашигладаг нүүрсустөрөгчийн жишээ, тэдгээрийн найрлага, шинж чанар (парафин, газрын тосны вазелин).
Гоо сайхны бүтээгдэхүүнд нүүрсустөрөгчийг гулсах нөлөө үзүүлдэг хальс үүсгэхэд ашигладаг (жишээлбэл, массажны тос), янз бүрийн бэлдмэлийн бүтэц бүрдүүлэгч бүрэлдэхүүн хэсэг болгон ашигладаг.
Хийн нүүрсустөрөгч
Метон ба этан нь байгалийн хийн бүрэлдэхүүн хэсэг юм. Пропан ба бутан (шингэрүүлсэн хэлбэрээр) нь тээвэрлэлтийн түлш юм.
Шингэн нүүрсустөрөгч
Бензин. Органик уусгагчид (архи, эфир, нүүрстөрөгчийн тетрахлорид) амархан уусдаг ердийн үнэртэй ил тод, шатамхай шингэн. Бензин, агаарын холимог нь хүчтэй тэсрэх бодис юм. Тусгай бензинийг заримдаа гипсэн үлдэгдлээс арьсыг цэвэрлэх, цэвэрлэхэд ашигладаг.
Вазелин тос. Өндөр буцалгах цэг, бага зуурамтгай чанар бүхий шингэн, наалдамхай нүүрсустөрөгч. Гоо сайхны бүтээгдэхүүнд үсний тос, арьсны тос болгон ашигладаг бөгөөд цөцгийн нэг хэсэг юм. Парафины тос. Ил тод, өнгөгүй, өнгөгүй, үнэргүй, өтгөн, тослог бодис, зуурамтгай чанар өндөр, усанд уусдаггүй, этанолд бараг уусдаггүй, эфир болон бусад органик уусгагчид уусдаг. Хатуу нүүрсустөрөгч
Парафин. Газрын тосны парафины фракцыг нэрэх замаар гаргаж авсан хатуу нүүрсустөрөгчийн холимог. Парафин нь тодорхой үнэртэй, төвийг сахисан урвал бүхий талст масс юм. Парафиныг дулааны эмчилгээнд хэрэглэдэг. Өндөр дулаан багтаамжтай хайлсан парафин нь удаан хөргөж, дулааныг аажмаар ялгаруулж, биеийн дулааныг удаан хугацаанд жигд байлгадаг. Хөргөх үед парафин нь шингэнээс хатуу төлөвт шилжиж, эзэлхүүн нь буурч, суурь эдийг шахдаг. Өнгөц судаснуудын гипереми үүсэхээс сэргийлж хайлсан парафин нь эд эсийн температурыг нэмэгдүүлж, хөлрөлтийг эрс нэмэгдүүлдэг. Парафины эмчилгээний заалт нь нүүрний арьсны seborrhea, батга, ялангуяа батга батга, нэвчсэн архаг экзем юм. Парафины маскын дараа нүүрний цэвэрлэгээ хийхийг зөвлөж байна.
Церезин. Озокеритийг боловсруулах замаар гаргаж авсан нүүрсустөрөгчийн холимог. Кокс нь өөх тостой сайн холилддог тул гоёл чимэглэлийн гоо сайхны бүтээгдэхүүнд өтгөрүүлэгч болгон ашигладаг.
Газрын тос - нүүрсустөрөгчийн холимог. Энэ нь тосонд сайн суурь болдог, найрлагад нь орсон эмийн бодисыг задалдаггүй, тос, өөх тостой ямар ч хэмжээгээр холилддог. Бүх нүүрсустөрөгчид саванждаггүй бөгөөд арьсанд шууд нэвтэрч чаддаггүй тул гоо сайхны бүтээгдэхүүнд гадаргууг хамгаалах бодис болгон ашигладаг. Бүх шингэн, хагас хатуу, хатуу нүүрсустөрөгчид өмхийрдөггүй (бичил биетний нөлөөнд автдаггүй).
Харгалзсан нүүрсустөрөгчийг ациклик гэж нэрлэдэг. Эдгээр нь нүүрсний давирхайг нэрэх явцад олж авсан циклик (молекул дахь бензолын цагирагтай) нүүрсустөрөгчөөс ялгаатай байдаг - бензол (уусгагч), нафталин нь өмнө нь эрвээхэй зэвүүн, антрацен болон бусад бодисоор ашиглагддаг.
3.2 Ханаагүй нүүрсустөрөгчид
Алкенууд (этилен нүүрсустөрөгчид) нь ханаагүй нүүрсустөрөгч бөгөөд тэдгээрийн молекулууд нь нэг давхар холбоо юм.

Химийн бүтцийн онцлог

2 H 4 этилен нь агаараас хөнгөн, усанд бага зэрэг уусдаг, сул чихэрлэг үнэртэй өнгөгүй хий юм.
Нүүрс устөрөгчийг нэрлэх зарчим:
Давхар холбоо агуулсан нүүрсустөрөгчид нь –энээр төгсдөг.
Этан С 2 Н 6 этен С 2 Н 4

3.3 Цикл ба үнэрт нүүрсустөрөгч, химийн бүтцийн зарчим, жишээ
Аренууд (үнэрт нүүрсустөрөгчид), молекулууд нь тогтвортой циклийн бүтцийг агуулдаг - бензолын цагираг, бондын онцгой шинж чанартай.
Бензолын молекулд дан (C - O ба давхар (C = C) холбоо байхгүй. Бүх холбоо нь эквивалент, тэдгээрийн урт нь тэнцүү. Энэ бол тусгай төрлийн холбоо юм - дугуй р-коньюгаци.
Гибридизаци - ;s p 2 Бондын өнцөг -120°

Зургаан эрлийз бус холбоо нь бензолын цагирагийн хавтгайд перпендикуляр байрладаг нэг электрон системийг (үнэрт цагираг) үүсгэдэг.
Химийн шинж чанар:
Бензол нь ханасан ба ханаагүй нүүрсустөрөгчийн хооронд завсрын байрлалыг эзэлдэг, учир нь орлуулах урвал (хялбар) болон нэмэлт (хэцүү) урвалд ордог.

Азулен.Энэ бол нийлэг аргаар олж авсан циклик нүүрсустөрөгч юм (chamazulene-ийн байгалийн аналогийг chamomile болон yarrow цэцэгнээс гаргаж авдаг). Азулен нь харшлын болон үрэвслийн эсрэг үйлчилгээтэй, гөлгөр булчингийн спазмыг намдааж, эд эсийн нөхөн төлжилт, эдгэрэлтийн процессыг түргэсгэдэг.Гоо сайхны бүтээгдэхүүнд төвлөрсөн хэлбэрээр (хар хөх шингэн) болон 25% -ийн уусмал хэлбэрээр хүүхдийн эмчилгээнд хэрэглэдэг. тос, шүдний оо, гоёл чимэглэлийн бүтээгдэхүүн, түүнчлэн биомеханик депиляцид зориулсан давирхайд.
4. Архи
4.1 Тодорхойлолт
Архи гэдэг нь нэг устөрөгчийн атом (H) нь гидроксил бүлгээр (OH) солигдсон органик нэгдлүүд юм.
4.2 Функциональ бүлгүүд. Спиртийг нэг ба олон атомт спирт гэж ангилах, жишээ. Согтууруулах ундааг нэрлэх зарчим
OH бүлгийн тоогоор нэг ба олон атомт спиртийг ялгадаг.
OH бүлгийн байршлаас хамааран спиртийг анхдагч, хоёрдогч, гуравдагч гэж хуваадаг. Парафин нүүрсустөрөгчөөс ялгаатай нь тэдгээр нь харьцангуй өндөр буцалгах цэгтэй байдаг. Бүх олон атомт спиртүүд чихэрлэг амттай байдаг.
Богино гинжин спиртүүд нь гидрофиль, i.e. устай хольж, гидрофиль бодисыг сайн уусгана.Урт гинжтэй нэг атомт спирт нь усанд бараг уусдаггүй, өөрөөр хэлбэл. гидрофобик.
Том молекул масстай архи (өөхний спирт) нь өрөөний температурт хатуу байдаг (жишээлбэл, миристил эсвэл цетил спирт). 24-өөс дээш нүүрстөрөгчийн атом агуулсан спиртийг лав спирт гэж нэрлэдэг.
Гидроксил бүлгийн тоо нэмэгдэхийн хэрээр архины чихэрлэг амт, усанд уусах чадвар нэмэгддэг. Тиймээс тостой төстэй глицерин (3 атомын спирт) усанд сайн уусдаг. 6 атомын хатуу спирт сорбитолыг чихрийн шижин өвчтэй хүмүүст сахар орлуулагч болгон ашигладаг.
4.3 Спиртийн үндсэн хими, физик шинж чанар, гоо сайхны салбарт хэрэглэх (метанол, этанол, изопропанол, глицерин)
Нэг атомт спирт
Метанол (метилийн спирт, модны спирт) нь ус, спирт, эфиртэй амархан холилддог тунгалаг, өнгөгүй шингэн юм. Энэхүү маш хортой бодисыг гоо сайхны бүтээгдэхүүнд ашигладаггүй.
Этанол (этилийн спирт, дарсны спирт, хүнсний спирт) нь тунгалаг, өнгөгүй, дэгдэмхий шингэн, ус болон органик уусгагчтай холилдох боломжтой, метанолоос хамаагүй бага хоруу чанартай, биологийн идэвхт бодисыг уусгагч болгон анагаах ухаан, гоо сайхны салбарт өргөн хэрэглэгддэг. (эфирийн тос, давирхай, иод гэх мэт). Этанол нь элсэн чихэр, цардуул агуулсан бодисыг исгэх замаар үүсдэг. Исгэх процесс нь мөөгөнцрийн ферментийн улмаас үүсдэг. Исгэлтийн дараа спиртийг нэрэх замаар тусгаарлана. Дараа нь хүсээгүй бодис, хольцоос цэвэршүүлэх (шулуулалт) хийдэг. Этанолыг эмийн санд голчлон 96 градусын температурт нийлүүлдэг. Этанол ба усны бусад хольц нь 90, 80, 70, 40% -ийн спирт агуулдаг. Бараг цэвэр спиртийг (маш бага хэмжээний устай) үнэмлэхүй спирт гэж нэрлэдэг.
Согтууруулах ундаа хэрэглэх зорилгоос хамааран янз бүрийн нэмэлтүүдээр (эфирийн тос, гавар) амтлана. Этанол нь арьсан доорх хялгасан судасны тэлэлтийг дэмжиж, ариутгах нөлөөтэй байдаг.
Нүүрний ариун цэврийн ус нь 0-30% спирт, үсний тос - 50%, одеколон - дор хаяж 70% агуулсан байж болно. Лаванда цэцгийн усанд 3% орчим эфирийн тос агуулагддаг. Үнэртэй ус нь 12-20% эфирийн тос, бэхлэгч, одеколон - 9% орчим эфирийн тос, бага зэрэг тогтоогч бодис агуулдаг. Изопропанол (изопропилийн спирт) нь этанолыг бүрэн, хямд орлуулагч бөгөөд хоёрдогч спиртэд хамаардаг. Цэвэршүүлсэн изопропилийн спирт ч гэсэн арилгах боломжгүй өвөрмөц үнэртэй байдаг. Изопропанолын ариутгах, тос арилгах шинж чанар нь этилийн спиртээс илүү хүчтэй байдаг. Үүнийг зөвхөн гаднаас нь, үсэнд зориулсан ариун цэврийн усны нэг хэсэг болгон, бэхэлгээ гэх мэт хэрэглэдэг. Архи нь изопропанол агуулаагүй байх ёстой бөгөөд бага хэмжээгээр нь нарс зүү (нарсны баяжмал) архины хандмал хийхийг зөвшөөрдөг.
Олон атомт спирт
Хоёр атомт спирт нь нэрнийхээ стандарт төгсгөлтэй байдаг - гликол. Гоо сайхны бэлдмэлүүдэд хоруу чанар багатай пропилен гликолыг уусгагч, чийгшүүлэгч болгон ашигладаг. Хоёр атомт спирт буюу гликолыг орлуулах нэршлийн дагуу диол гэж нэрлэдэг. Гурвалсан спирт - глицерин нь анагаах ухаан, эм зүйд өргөн хэрэглэгддэг. Глицерин нь сироптой төстэй, бараг үнэргүй, гигроскоптой, чихэрлэг амттай, OH бүлэг агуулсан бусад бүх бодист уусдаг, эфир, бензин, хлороформ, өөх тос, эфирийн тосонд уусдаггүй. 86 - 88% глицерин, усгүйжүүлсэн 98% глицерин худалдаанд нийлүүлдэг. Глицериныг шингэрүүлсэн хэлбэрээр арьсны тос, нүүрний угаалгын шингэн, шүдний оо, сахлын саван, гар гель зэрэгт оруулдаг. Тохиромжтой хэмжээгээр шингэлж, арьсыг зөөлрүүлж, уян хатан болгож, арьсны чийгийн байгалийн хүчин зүйлийг орлуулна. Арьс арчилгааны бүтээгдэхүүнд цэвэр хэлбэрээр нь хэрэглэдэггүй, учир нь хуурайшуулдаг. хүний эрүүл мэндэд органик химиЗХУ-ын Шинжлэх Ухааны Академи, зохион байгуулагчдын нэг ... хэд хэдэн чиглэлд органик хими - химиалицикл нэгдлүүд, химигетероцикл, органиккатализ, химиуураг ба амин хүчил. ...
Ионы нэгдлийн нөлөө органик хими
Хураангуй >> ХимиПроцессын стереохимийн чиглэл. IN органик химиИоны хосуудын сонирхол бий болсон ... физикийн хамгийн гайхалтай амжилтууд органик хими. Урвалын судалгаа, онд ... ионы хосын тухай ойлголт органик химимэдэгдэхүйц өөрчлөлт гарсан; байсан...
Гэсэн хэдий ч заримдаа бодисын физик холилдол ба тэдгээрийн химийн харилцан үйлчлэлийн хоорондох шугамыг зурахад хэцүү байдаг. Жишээлбэл, устөрөгчийн хлоридын хий HCl-ийг устай холих үед
H2O H ионууд үүсдэг 3 O+ ба Cl - . Тэд хөрш усны молекулуудыг өөртөө татаж, гидрат үүсгэдэг. Тиймээс эхлэлийн бүрэлдэхүүн хэсгүүд нь HCl ба H юм 2 O - холилдсоны дараа мэдэгдэхүйц өөрчлөлт гардаг. Гэсэн хэдий ч ионжуулалт ба усжилт (ерөнхий тохиолдолд уусмал) нь уусмал үүсэх явцад тохиолддог физик процесс гэж тооцогддог.Нэг төрлийн фазыг илэрхийлдэг хамгийн чухал хольцуудын нэг бол коллоид уусмалууд юм: гель, уусмал, эмульс, аэрозоль. Коллоид уусмал дахь бөөмийн хэмжээ нь жинхэнэ уусмалд 1-1000 нм байна
~ 0.1 нм (молекул хэмжээний дарааллаар).Үндсэн ойлголтууд. Бодит уусмал үүсгэхийн тулд бие биендээ ямар ч хэмжээгээр уусдаг хоёр бодисыг бүрэн уусдаг бодис гэж нэрлэдэг. Ийм бодисууд нь бүгд хий, олон шингэн (жишээлбэл, этилийн спирт).- ус, глицерин - ус, бензол - бензин), зарим хатуу бодис (жишээлбэл, мөнгө - алт). Хатуу уусмал авахын тулд эхлээд анхны бодисыг хайлуулж, дараа нь хольж, хатууруулахыг зөвшөөрөх хэрэгтэй. Тэд бүрэн уусдаг бол нэг хатуу фаз үүсдэг; уусах чадвар нь хэсэгчилсэн бол анхны бүрэлдэхүүн хэсгүүдийн аль нэгний жижиг талстууд үүссэн хатуу бодист үлддэг.Хэрэв хоёр бүрэлдэхүүн хэсэг нь зөвхөн тодорхой хувь хэмжээгээр холилдох үед нэг фаз үүсгэдэг бол бусад тохиолдолд хоёр фаз гарч ирдэг бол тэдгээрийг хэсэгчлэн уусдаг гэж нэрлэдэг. Эдгээр нь жишээлбэл, ус ба бензол: жинхэнэ уусмалыг зөвхөн их хэмжээний бензолд бага хэмжээний ус эсвэл бага хэмжээний бензолыг их хэмжээний усанд нэмэх замаар л гаргаж авдаг. Хэрэв та ус, бензолыг тэнцүү хэмжээгээр холивол хоёр фазын шингэний систем үүсдэг. Түүний доод давхарга нь бага хэмжээний бензол агуулсан ус, дээд давхарга юм
- Бензолыг бага хэмжээний усаар . Мөн ус, мөнгөн ус гэх мэт бие биедээ уусдаггүй бодисууд байдаг. Хэрэв хоёр бодис зөвхөн хэсэгчлэн уусдаг бол өгөгдсөн температур, даралтад тэнцвэрийн нөхцөлд нөгөө бодистой жинхэнэ уусмал үүсгэж чадах нэг бодисын хэмжээ хязгаартай байдаг. Ууссан бодисын хамгийн их концентрацитай уусмалыг ханасан гэж нэрлэдэг. Та ууссан бодисын концентраци нь ханасан уусмалаас ч их байдаг хэт ханасан уусмалыг бэлтгэж болно. Гэсэн хэдий ч хэт ханасан уусмал нь тогтворгүй бөгөөд нөхцөл байдал бага зэрэг өөрчлөгдөхөд, жишээлбэл, хутгах, тоосны тоосонцор орох, ууссан бодисын талстыг нэмэхэд ууссан бодисын илүүдэл тунадас үүсдэг.Аливаа шингэн нь ханасан уурын даралт нь гадаад даралтад хүрэх температурт буцалж эхэлдэг. Жишээлбэл, 101.3 кПа даралттай ус 100 хэмд буцалгана
° C учир нь энэ температурт усны уурын даралт яг 101.3 кПа байна. Хэрэв та зарим нэг дэгдэмхий бодисыг усанд уусгавал түүний уурын даралт буурна. Үүссэн уусмалын уурын даралтыг 101.3 кПа болгохын тулд уусмалыг 100-аас дээш халаах шаардлагатай.° C. Уусмалын буцалгах цэг нь цэвэр уусгагчийн буцалгах температураас үргэлж өндөр байдаг гэсэн үг. Уусмалын хөлдөх цэгийн бууралтыг ижил төстэй байдлаар тайлбарлав.Раульын хууль. 1887 онд Францын физикч Ф.Раульт янз бүрийн дэгдэмхий бус шингэн ба хатуу бодисын уусмалыг судалж, концентрацитай электролитийн бус шингэрүүлсэн уусмалаас уурын даралт буурахтай холбоотой хуулийг тогтоожээ. уусмал дээрх уусгагч нь ууссан бодисын моль фракцтай тэнцүү байна. Цэвэр уусгагчтай харьцуулахад шингэрүүлсэн уусмалын буцлах цэгийн өсөлт эсвэл хөлдөх температурын бууралт нь ууссан бодисын молийн концентрацитай (эсвэл моль фракцтай) пропорциональ бөгөөд түүний молекул жинг тодорхойлоход ашиглаж болно гэж Раультын хуульд заасан байдаг.Зан төлөв нь Раульын хуульд нийцсэн шийдлийг идеал гэж нэрлэдэг. Поляр бус хий ба шингэний уусмал (молекулууд нь цахилгаан талбайн чиглэлийг өөрчилдөггүй) хамгийн тохиромжтой шийдэл юм. Энэ тохиолдолд уусмалын дулаан нь тэг байх ба анхны бүрэлдэхүүн хэсгүүдийн шинж чанар, тэдгээрийн холилдсон харьцааг мэдэх замаар уусмалын шинж чанарыг шууд таамаглаж болно. Бодит шийдлүүдийн хувьд ийм таамаглал хийх боломжгүй юм. Бодит уусмал үүсэх үед дулааныг ихэвчлэн ялгаруулж эсвэл шингээдэг. Дулаан ялгарах процессыг экзотермик, шингээх процессыг эндотермик гэж нэрлэдэг.
Ууссан бодисын шинж чанараас бус харин түүний концентрацаас (нэгж эзэлхүүн буюу масс дахь ууссан бодисын молекулын тоо) голчлон хамаардаг уусмалын шинж чанаруудыг нэрлэдэг.
хамтарсан . Жишээлбэл, хэвийн атмосферийн даралт дахь цэвэр усны буцлах цэг нь 100 байна° C ба 1000 г усанд 1 моль ууссан (засдаггүй) бодис агуулсан уусмалын буцалгах температур аль хэдийн 100.52 байна.° C энэ бодисын шинж чанараас үл хамааран. Хэрэв бодис задарч, ион үүсгэдэг бол буцлах цэг нь ууссан бодисын нийт тоосонцрын өсөлттэй пропорциональ өсдөг бөгөөд энэ нь диссоциацийн улмаас уусмалд нэмсэн бодисын молекулуудын тооноос давсан байна. Хамтарсан бусад чухал хэмжигдэхүүнүүд нь уусмалын хөлдөх цэг, осмосын даралт ба уусгагчийн уурын хэсэгчилсэн даралт юм.Уусмалын концентраци ууссан бодис ба уусгагчийн хоорондын харьцааг илэрхийлдэг хэмжигдэхүүн юм. "Шингэрүүлсэн" ба "баяжуулсан" гэх мэт чанарын ойлголтууд нь зөвхөн уусмалд ууссан бодис бага эсвэл их хэмжээгээр агуулагдаж байгааг илтгэнэ. Уусмалын концентрацийг тооцоолохын тулд ихэвчлэн хувь (масс эсвэл эзэлхүүн) ашигладаг бөгөөд шинжлэх ухааны уран зохиолд - моль эсвэл химийн эквивалентийн тоог ашигладаг. (см . ТЭНЦҮҮ МАСС)уусгагч буюу уусмалын нэгж масс эсвэл эзэлхүүн дэх ууссан бодис. Төөрөгдөлөөс зайлсхийхийн тулд концентрацийн нэгжийг үргэлж нарийн зааж өгөх хэрэгтэй. Дараах жишээг авч үзье. 90 г ус (усны нягт нь 1 г/мл тул эзэлхүүн нь 90 мл), 10 г этилийн спирт (түүний хэмжээ 12.6 мл, спиртийн нягт нь 0.794 г / мл) -ээс бүрдэх уусмал. 100 г масстай, гэхдээ энэ уусмалын эзэлхүүн нь 101.6 мл (хэрэв ус, архи холих үед тэдгээрийн эзлэхүүнийг нэмбэл 102.6 мл-тэй тэнцүү байх болно). Уусмалын хувийн концентрацийг янз бүрийн аргаар тооцоолж болно.эсвэл

Хамгийн түгээмэл нэгж бол молярийн хэмжээ боловч үүнийг тооцоолохдоо зарим хоёрдмол утгатай зүйлийг анхаарч үзэх хэрэгтэй. Жишээлбэл, өгөгдсөн бодисын 1М уусмалыг олж авахын тулд түүний жигнэсэн тодорхой хэсгийг мольтой тэнцэх хэмжээний бага хэмжээний усанд уусгана. массыг граммаар тооцож, уусмалын эзэлхүүнийг 1 литрт хүргэнэ. Энэ уусмалыг бэлтгэхэд шаардагдах усны хэмжээ нь температур, даралтаас хамаарч бага зэрэг ялгаатай байж болно. Тиймээс өөр өөр нөхцөлд бэлтгэсэн хоёр молийн уусмал нь яг ижил концентрацитай байдаггүй. Молалийг температур, даралтаас хамаарахгүй уусгагчийн тодорхой масс (1000 гр) дээр үндэслэн тооцдог. Лабораторийн практикт тодорхой хэмжээний шингэний хэмжээг хэмжих нь (үүнд зориулж бюрет, пипетк, хэмжээст колбонд байдаг) тэдгээрийг жинлэхээс хамаагүй илүү тохиромжтой байдаг тул шинжлэх ухааны ном зохиолд концентрацийг ихэвчлэн мольоор илэрхийлдэг бөгөөд моляль нь ихэвчлэн байдаг. ихэвчлэн зөвхөн онцгой нарийвчлалтай хэмжилт хийхэд ашигладаг.
Тооцооллыг хялбарчлахын тулд хэвийн байдлыг ашигладаг. Өмнө дурьдсанчлан, бодисууд хоорондоо эквиваленттай тохирох хэмжээгээр харилцан үйлчилдэг. Ижил хэвийн байдлын янз бүрийн бодисын уусмал бэлтгэж, ижил эзэлхүүнийг авснаар тэдгээр нь ижил тооны эквивалент агуулсан гэдэгт итгэлтэй байж болно.
Уусгагч ба ууссан бодисыг ялгахад хэцүү (эсвэл шаардлагагүй) тохиолдолд концентрацийг моль фракцаар хэмждэг. Мэнгэний фракцууд нь молалит шиг температур, даралтаас хамаардаггүй.
Ууссан бодис ба уусмалын нягтыг мэдэхийн тулд нэг концентрацийг нөгөөд шилжүүлж болно: молярийг моль, моль фракц ба эсрэгээр. Өгөгдсөн ууссан болон уусгагчийн шингэрүүлсэн уусмалын хувьд эдгээр гурван хэмжигдэхүүн нь хоорондоо пропорциональ байна.
Уусах чадвар Тухайн бодис нь бусад бодисуудтай уусмал үүсгэх чадвар юм. Хий, шингэн эсвэл тоон уусах чадвар хатууөгөгдсөн температурт тэдгээрийн ханасан уусмалын концентрацаар хэмжигддэг. Энэ чухал шинж чанарбодис, түүний мөн чанарыг ойлгоход тусалдаг, түүнчлэн энэ бодис оролцож буй урвалын явцад нөлөөлдөг.Хийнүүд. Химийн харилцан үйлчлэл байхгүй тохиолдолд хийнүүд хоорондоо ямар ч харьцаатай холилддог бөгөөд энэ тохиолдолд ханасан байдлын талаар ярих нь утгагүй юм. Гэсэн хэдий ч хий нь шингэнд уусах үед даралт, температураас хамааран тодорхой хязгаарлагдмал концентраци байдаг. Зарим шингэн дэх хийн уусах чадвар нь шингэрүүлэх чадвартай холбоотой байдаг. Хамгийн амархан шингэрүүлсэн хий, тухайлбал NH 3, HCl, SO 2 , шингэрүүлэхэд хэцүү хийнүүдээс илүү уусдаг, тухайлбал О 2, H 2 ба Тэр. Хэрэв уусгагч ба хийн хооронд химийн харилцан үйлчлэл байгаа бол (жишээлбэл, ус ба NH 3 эсвэл HCl) уусах чадвар нэмэгддэг. Өгөгдсөн хийн уусах чадвар нь уусгагчийн шинж чанараас хамаарч өөр өөр байдаг боловч уусах чадварыг нэмэгдүүлэхийн тулд хийнүүдийг байрлуулах дараалал нь өөр өөр уусгагчийн хувьд ойролцоогоор ижил хэвээр байна.Татан буулгах үйл явц нь Ле Шательегийн зарчмыг (1884) дагаж мөрддөг: хэрэв тэнцвэрт систем нь ямар нэгэн нөлөөлөлд өртөх юм бол түүнд тохиолдож буй үйл явцын үр дүнд тэнцвэрт байдал ийм чиглэлд шилжиж, нөлөө нь буурах болно. Шингэн дэх хийг уусгах нь ихэвчлэн дулаан ялгарах дагалддаг. Үүний зэрэгцээ Le Chatelier-ийн зарчмын дагуу хийн уусах чадвар буурдаг. Энэ бууралт нь хийн уусах чадвар өндөр байх тусам мэдэгдэхүйц юм: ийм хийнүүд ч бас байдаг
уусмалын илүү их дулаан. Буцалсан эсвэл нэрмэл усны "зөөлөн" амт нь өндөр температурт уусах чадвар нь маш бага тул дотор нь агаар байхгүйтэй холбон тайлбарладаг.Даралт ихсэх тусам хийн уусах чадвар нэмэгддэг. Генригийн хуулийн дагуу (1803) тодорхой хэмжээний шингэнд тогтмол температурт уусч чадах хийн масс нь түүний даралттай пропорциональ байна. Энэ өмчийг хийжүүлсэн ундаа хийхэд ашигладаг. Нүүрстөрөгчийн давхар исэл 3-4 атм даралттай шингэнд уусгах; эдгээр нөхцөлд 1 атм-аас 3-4 дахин их хий (массаар) өгөгдсөн эзэлхүүнд уусдаг. Ийм шингэнтэй савыг онгойлгоход түүний доторх даралт буурч, ууссан хийн хэсэг нь бөмбөлөг хэлбэрээр ялгардаг. Шампанскийн шилийг нээх эсвэл гадаргуу дээр гарах үед ижил төстэй нөлөө ажиглагдаж байна гүний усих гүнд нүүрстөрөгчийн давхар ислээр ханасан.
Хийн хольцыг нэг шингэнд уусгах үед тэдгээрийн уусах чадвар нь хольцтой ижил даралттай бусад бүрэлдэхүүн хэсгүүд байхгүй үед ижил хэвээр байна (Далтоны хууль).
Шингэн. Хоёр шингэний харилцан уусах чадвар нь тэдгээрийн молекулуудын бүтэц хэр төстэй байгаагаас тодорхойлогддог ("ижил төстэй уусдаг"). Нүүрс устөрөгч гэх мэт туйлшгүй шингэн нь молекул хоорондын харилцан үйлчлэл багатай байдаг тул нэг шингэний молекулууд нөгөөгийн молекулуудын хооронд амархан нэвтэрдэг. шингэн сайн холино. Үүний эсрэгээр ус, нүүрсустөрөгч зэрэг туйл ба туйлшгүй шингэнүүд хоорондоо сайн холилддоггүй. Усны молекул бүр эхлээд өөртөө хүчтэй татдаг ижил төстэй бусад молекулуудын орчноос зугтаж, түүнийг сул татдаг нүүрсустөрөгчийн молекулуудын хооронд нэвтрэн орох ёстой. Үүний эсрэгээр, нүүрсустөрөгчийн молекулууд усанд уусахын тулд усны молекулуудын хооронд шахагдаж, тэдгээрийн хүчтэй харилцан таталцлыг даван туулах ёстой бөгөөд энэ нь эрчим хүч шаарддаг. Температур нэмэгдэхийн хэрээр молекулуудын кинетик энерги нэмэгдэж, молекул хоорондын харилцан үйлчлэл суларч, ус, нүүрсустөрөгчийн уусах чадвар нэмэгддэг. Температурын мэдэгдэхүйц өсөлтөөр тэдгээрийн бүрэн уусах чадварыг олж авах боломжтой. Энэ температурыг уусмалын дээд температур (UCST) гэж нэрлэдэг.Зарим тохиолдолд хэсэгчлэн холилдох хоёр шингэний харилцан уусах чадвар нь температур буурах тусам нэмэгддэг. Энэ нөлөө нь холих явцад дулаан үүсэх үед ихэвчлэн үүсдэг химийн урвал. Температурын мэдэгдэхүйц бууралт, гэхдээ хөлдөх цэгээс доошгүй тохиолдолд уусмалын хамгийн бага температурт (LCST) хүрч болно. LCTE-тэй бүх системүүд нь HCTE-тэй байдаг гэж үзэж болно (урвуу зүйл хийх шаардлагагүй). Гэсэн хэдий ч ихэнх тохиолдолд холигч шингэний аль нэг нь HTST-ээс доош температурт буцалгана. Никотин-усны систем нь 61 LCTR-тэй
° C ба VCTR нь 208 байна° C. 61-208 мужид° C, эдгээр шингэн нь хязгаарлагдмал уусах чадвартай бөгөөд энэ хязгаараас гадуур тэд бүрэн уусах чадвартай байдаг.Хатуу бодис. Бүх хатуу бодисууд шингэнд хязгаарлагдмал уусах чадвартай байдаг. Тэдний ханасан уусмалууд нь өгөгдсөн температурт байдаг тодорхой найрлага, энэ нь ууссан бодис ба уусгагчийн шинж чанараас хамаарна. Тиймээс натрийн хлоридын усанд уусах чадвар нь нафталины усанд уусахаас хэд хэдэн сая дахин их байдаг бөгөөд тэдгээрийг бензолд уусгахад эсрэг дүр зураг ажиглагдаж байна. Энэ жишээг харуулж байна ерөнхий дүрэм, үүний дагуу хатуу бодис нь ижил төстэй химийн болон физик шинж чанартай шингэнд амархан уусдаг боловч эсрэг шинж чанартай шингэнд уусдаггүй.Давс нь ихэвчлэн усанд амархан уусдаг бөгөөд архи, шингэн аммиак зэрэг бусад туйлын уусгагчид уусдаг. Гэсэн хэдий ч давсны уусах чадвар нь бас ихээхэн ялгаатай байдаг: жишээлбэл, аммонийн нитрат нь мөнгөн хлоридоос олон сая дахин усанд уусдаг.
Шингэн дэх хатуу бодисыг уусгах нь ихэвчлэн дулаан шингээх замаар явагддаг бөгөөд Ле Шательегийн зарчмын дагуу тэдгээрийн уусах чадвар нь халаах тусам нэмэгдэх ёстой. Энэ нөлөөг бодисыг дахин талстжуулах замаар цэвэршүүлэхэд ашиглаж болно. Үүнийг хийхийн тулд тэдгээрийг ханасан уусмал авах хүртэл өндөр температурт уусгаж, дараа нь уусмалыг хөргөж, ууссан бодисыг тунадасжуулсны дараа шүүнэ. Усанд уусах чадвар нь температур нэмэгдэх тусам буурдаг бодисууд (жишээлбэл, кальцийн гидроксид, сульфат, ацетат) байдаг.
Шингэн шиг хатуу бодисууд бие биендээ бүрэн уусч, нэгэн төрлийн хольц үүсгэдэг - шингэн уусмалтай төстэй жинхэнэ хатуу уусмал. Бие биедээ хэсэгчлэн уусдаг бодисууд нь температурын дагуу найрлага нь өөрчлөгддөг хоёр тэнцвэрт коньюгат хатуу уусмал үүсгэдэг.
Тархалтын коэффициент. Хоѐр холилдохгүй эсвэл хэсэгчлэн холилдох шингэний тэнцвэрийн системд бодисын уусмалыг нэмбэл системд химийн харилцан үйлчлэл байхгүй тохиолдолд бодисын нийт хэмжээнээс үл хамааран тодорхой хувь хэмжээгээр шингэний хооронд хуваарилагдана. . Энэ дүрмийг тархалтын хууль гэж нэрлэдэг ба шингэн дэх ууссан бодисын концентрацийн харьцааг тархалтын коэффициент гэж нэрлэдэг. Тархалтын коэффициент нь өгөгдсөн бодисын хоёр шингэн дэх уусах чадварын харьцаатай ойролцоогоор тэнцүү байна, өөрөөр хэлбэл. бодисыг уусах чадварын дагуу шингэн хооронд хуваарилдаг. Энэ шинж чанарыг өөр уусгагч ашиглан нэг уусгагч дахь уусмалаас өгөгдсөн бодисыг гаргаж авахад ашигладаг. Үүнийг хэрэглэх өөр нэг жишээ бол хүдрээс мөнгө гаргаж авах үйл явц бөгөөд үүнд ихэвчлэн хар тугалгатай хамт ордог. Үүний тулд хар тугалгатай холилдохгүй хайлсан хүдэрт цайр нэмнэ. Мөнгө нь хайлсан хар тугалга ба цайрын хооронд голчлон сүүлчийн дээд давхаргад тархдаг. Энэ давхаргыг цуглуулж, мөнгийг цайрын нэрэлтээр ялгадаг.Уусах чадвартай бүтээгдэхүүн (гэх мэт ). Илүүдэл (тундас) хатуу бодисын хоорондМ xБ y ба түүний ханасан уусмал нь тэгшитгэлээр дүрсэлсэн динамик тэнцвэрийг тогтооноЭнэ урвалын тэнцвэрийн тогтмол ньРеми И. Органик бус химийн хичээл , боть. 1-2. М., 1963, 1966