Суллагдсан бромыг туйлшгүй уусгагчаар эсвэл уураар нэрэх замаар ялгана. Бусад толь бичгүүдээс "бром" гэж юу болохыг хараарай. Бром бол шингэн зүйл юм
Францын химич А.Балард 1825 онд далайн байцааны үнсийг угаасны дараа гаргаж авсан усан уусмал дээр хлорын нөлөөгөөр үйлчилж, хар хүрэн, эвгүй үнэртэй шингэнийг ялгаж авсан нь бромын нээлт болсон юм. Тэрээр энэ шингэн мурид (Латин хэлнээс муриа - давсны уусмал) гэж нэрлээд Парисын Шинжлэх Ухааны Академид нээлтийнхээ тухай мессеж илгээжээ. Бром нь хүнд, тааламжгүй уурын үнэртэй (грек хэлнээс гаралтай) учир комисс шинэ элементийг бром гэж нэрлэсэн. brwmoz- өмхий).
Байгальд байх, хүлээн авах:
Дэлхийн царцдас дахь бромын агууламж (1.6*l0 -4% массаар) 10 15 -10 16 тн байна.Бром нь хлорын байнгын хамтрагч юм. Бромидын давс (NaBr, KBr, MgBr 2) нь хлоридын давсны ордод (хүснэгтийн давсанд 0.03% хүртэл, калийн давс - силвит ба карналлит - 0.3% хүртэл), далайн усанд (0.065%) байдаг. , давстай нуурын давсны уусмал (0.2% хүртэл), газрын доорхи давсны уусмал ихэвчлэн давс, газрын тосны ордуудтай холбоотой (0.1% хүртэл).
Бромын үйлдвэрлэлийн эхлэлийн материал нь бромидын ион хэлбэрээр бром агуулсан далайн ус, нуурын ус, гүний ус юм. Бромыг хлор ашиглан тусгаарлаж, уусмалаас усны уур эсвэл агаараар зайлуулна. Бромыг химийн шингээгч ашиглан үүссэн бром-агаарын хольцоос зайлуулна. Энэ зорилгоор төмрийн бромидын уусмалыг ашигладаг. Бромыг үүссэн завсрын бүтээгдэхүүнээс хлор эсвэл хүчлийн нөлөөгөөр тусгаарладаг. Дараа нь бромыг уснаас ялгаж, нэрэх замаар хлорын хольцоос цэвэрлэнэ.
Лабораториуд мөн бромидын исэлдүүлэхэд суурилсан процессуудыг ашигладаг.
6KBr + K 2 Cr 2 O 7 + 7H 2 SO 4 = 3Br 2 + Cr 2 (SO 4) 3 + 4K 2 SO 4 + 7H 2 O
Физик шинж чанарууд:
Бром бол өрөөний температурт шингэн байдаг цорын ганц металл биш юм. Энгийн бодис нь тааламжгүй үнэртэй хүнд улаан хүрэн шингэн (нягт 20°С - 3.1 г/см 3, буцлах цэг +59.82°С), бромын уур нь шар хүрэн өнгөтэй. -7.25°С-ийн температурт бром нь бүдэг металл гялбаатай улаан хүрэн зүү хэлбэртэй талст болж хатуурна. Бром нь бусад галогенээс илүү усанд уусдаг (20 хэмд 3.58 г/100 г H 2 O) - " бромын ус"Бид бромыг усан уусмалаас гаргаж авахаас хамаагүй илүү органик уусгагчид уусгадаг.
Химийн шинж чанар:
Бром бол хүчтэй исэлдүүлэгч бодис бөгөөд бараг бүх металл бус (эрхэм хий, хүчилтөрөгч, азот, нүүрстөрөгчөөс бусад) болон олон металлуудтай шууд урвалд ордог.
2P + 3Br 2 = 2PBr 3; 2Al + 3Br 2 = 2AlBr 3
Усан орчинд бром нь нитритийг нитрат, аммиакаас азот, иодыг чөлөөт иод, хүхэр, сульфитыг хүхрийн хүчил болгон исэлдүүлдэг.
2NH 3 + 6Br 2 = N 2 + 6HBr; 3Br 2 + S + 4H 2 O = 6HBr + H 2 SO 4
Бром шүлтийн уусмалтай урвалд ороход харгалзах бромид ба гипобромит (хүйтэн үед) эсвэл броматууд үүсдэг.
Br 2 + 2NaOH = NaBr + NaBrO + H 2 O (t үед Бром нь сондгой исэлдэлтийн төлөвтэй нэгдлээр тодорхойлогддог: -1, +1, +3, +5, +7.
Хамгийн чухал холболтууд:
Устөрөгчийн бромид HBr- усны ууртай харилцан үйлчлэлцсэний улмаас агаарт ялгардаг хурц үнэртэй, өнгөгүй хортой хий. Энэ нь усанд маш сайн уусдаг: 0 хэмд 612 эзлэхүүн устөрөгчийн бромид нэг эзлэхүүн усанд уусдаг. Шийдэл - хүчтэй монобазик гидробромик хүчил. Давс - бромидуудөнгөгүй талст, усанд сайн уусдаг (уусдаггүй AgBr, цайвар шар).
Бром (I) исэл Br 2 O., бор хий. CCl 4 дахь HgO дээр бромын үйлчлэлээр үүссэн. Үл хөдлөх хөрөнгө...
Гипобромын хүчил HBrO- хүчтэй исэлдүүлэгч бодис. Бромыг усанд уусгахад үүсдэг бөгөөд гэрлийн нөлөөн дор HBr ба хүчилтөрөгч болж задардаг; сул хүчиллэг шинж чанартай бөгөөд зөвхөн уусмалд байдаг. Давс - гипобромитууд, KBrO, NaBrO - талст гидрат хэлбэрээр чөлөөт төлөвт олж авсан. Тэд бүгд маш тогтворгүй, халаахад (эсвэл хүчиллэгжүүлсэн уусмал) бромид ба бромат болж задардаг.
3KBrO = 2KBr + KBrO 3
Бромтууд, HBrO 2 - бромын хүчлийн уусмалд ч үл мэдэгдэх давс нь шүлтлэг орчинд гипобромитыг бромоор исэлдүүлэх явцад үүсдэг: Ba(BrO) 2 + 2Br 2 + 4KOH = Ba(BrO 2) 2 + 4KBr + 2H 2 О
Бром хүчил, HBrO 3 - төвлөрсөн уусмал нь өнгөгүй сироп шингэн юм. Давс - броматууд. Бром хүчил ба броматууд нь хүчтэй исэлдүүлэгч бодис юм.
2S + 2NaBrO 3 = Na 2 SO 4 + Br 2 + SO 2
Бром хүчил HBrO 4 нь 6 моль/л-ээс ихгүй концентрацитай усан уусмалд байдаг. HBrO 4 нь бромын хүчилтөрөгчийн хүчлүүдийн дунд хамгийн хүчтэй исэлдүүлэгч бодис боловч түүний оролцоотой урвал маш удаан явагддаг.
Бром трифторид, BrF 3 - АД-тай улаан шингэн. 126°С нь бромын фтортой шууд урвалд орсны үр дүнд үүсдэг. Ус болон органик бодисуудтай тэсрэх урвалд ордог. Органик бус нэгдлүүдийн хувьд энэ нь хүчтэй фторжуулагч бодис шиг ажилладаг.
Хэрэглээ:
Бром ба түүний нэгдлүүдийг үндсэн органик синтезд өргөн ашигладаг. Мөнгөний бромид AgBr нь гэрэл зурагт мэдрэмтгий бодис болгон ашигладаг. Бромын нэгдлүүдийг галд тэсвэртэй бодисыг бий болгоход ашигладаг - хуванцар, мод, нэхмэлийн материалд галд тэсвэртэй нэмэлт бодисууд. Бром пентафторидыг заримдаа маш хүчтэй пуужингийн түлшний исэлдүүлэгч болгон ашигладаг. 1,2-диброметаныг хөдөлгүүрийн түлшний тогшлын эсрэг нэмэлт болгон ашигладаг. Бромидын уусмалыг газрын тосны үйлдвэрлэлд ашигладаг. Анагаах ухаанд натри, калийн бромидыг тайвшруулах эм болгон ашигладаг.
Биологийн үүрэг, хоруу чанар:
Энгийн хэлбэрээр бром нь хортой байдаг. Шингэн бром нь эдгээхэд хэцүү түлэгдэлт үүсгэдэг. 1 мг/м3 концентрацитай бромын уур нь салст бүрхэвчийг цочроох, ханиалгах, толгой эргэх, толгой өвдөхөд хүргэдэг ба өндөр концентраци (>60 мг/м3) бол амьсгал боогдох, үхэлд хүргэдэг.
Хүний биед бромидын ион хэлбэрээр бром нь иодын өрсөлдөх чадвартай дарангуйлагч тул бамбай булчирхайн үйл ажиллагааг зохицуулахад оролцдог.
Петрова М.А., Пухова М.С.
ЭМС Тюмений улсын их сургууль, 572 бүлэг.
"Дэлхий даяар" нэвтэрхий толь бичиг:
Бром
БРОМИН-a (-y); м.[Грек хэлнээс bromos - муу үнэр]
1. Химийн элемент (Br), агаарт утаа ялгаруулдаг хүнд улаан хүрэн хортой шингэн (химийн үйлдвэрлэлд давс хэлбэрээр - анагаах ухаан, гэрэл зурагт ашигладаг). Бром давс. Бромтой эм.
2. Энэ бодис эсвэл түүний нэгдлүүдийг агуулсан эмийн бүтээгдэхүүн (тайвшруулах эсвэл нойрсуулах эм болгон ашигладаг). Зааварлах, хүлээн зөвшөөрөх b. Бром (бром) нэмнэ.
◁ Бром, өө, өө. Б эм. Ус(бромын усан уусмал). Бром, өө, өө. Б эм.Бромид, өө, өө. В-давс, металл. Калийн бромидын уусмал(тайвшруулах дусал).
бромҮелэх системийн VII бүлгийн химийн элемент (лат. Bromum) нь галогенд хамаарна. Грек хэлнээс гаралтай нэр. бромос - өмхий үнэр. Агаарт утаа ялгаруулдаг, хурц эвгүй үнэртэй хүнд улаан хүрэн шингэн; нягт 3.1 г/см 3, т pl -7.25 ° C, ткип 59.2 ° C. Үүнийг аналитик химийн салбарт бромид, органик болон бусад бромын нэгдлүүдийг үйлдвэрлэхэд бромжуулах бодис болгон ашигладаг. Бром бол хортой.
БРОМИНБРОМИН (лат. Bromum), Br ("бром" гэж уншина уу), атомын дугаар 35, атомын жин 79.904 химийн элемент. Энэ нэр нь бром нь хүнд, тааламжгүй уурын үнэртэй байдаг (Грекийн bromos - өмхий үнэр).
Байгалийн бром нь хоёр нуклидын холимог юм (см.НУКЛИД)массын тоотой 79 (массын 50.56%-ийн холимогт) ба 81. Гадаад электрон давхаргын тохиргоо 4 с 2
х 5
. Нэгдлүүдийн хувьд энэ нь исэлдэлтийн төлөвийг -1, +1, +3, +5 ба +7 (валент I, III, V ба VII) харуулдаг бөгөөд исэлдэлтийн хамгийн онцлог нь -1 ба +5 юм.
Менделеевийн үелэх системийн VIIA бүлгийн дөрөвдүгээр үед галогенд багтдаг. (см.галоген).
Төвийг сахисан бромын атомын радиус нь 0.119 нм, Br -, Br 3+, Br 5+, Br 7+-ийн ионы радиус нь 0.182, 0.073, 0.045, 0.039 нм байна. Саармаг бромын атомын дараалсан иончлох энерги нь 11.84, 21.80, 35.9, 47.3 ба 59.7 эВ байна. Электрон хамаарал 3.37 эВ. Полингийн хуваарийн дагуу бромын цахилгаан сөрөг чанар 2.8 байна.
Нээлтийн түүх
Бромыг нээхэд Францын химич А.Балардын судалгаа нөлөөлсөн (см.БАЛАРД Антуан Жером), 1825 онд далайн байцааны үнсийг угаасны дараа гаргаж авсан усан уусмал дээр хлорын нөлөөгөөр хар хүрэн, муухай үнэртэй шингэн ялгаруулжээ. Тэрээр далайн уснаас гаргаж авсан энэ шингэнийг мурид (Латин муриа - давсны уусмал, давсны уусмал) гэж нэрлээд Парисын Шинжлэх Ухааны Академид нээлтийнхээ тухай мессеж илгээжээ. Энэ мессежийг шалгахын тулд байгуулагдсан комисс Балар нэрийг хүлээн аваагүй бөгөөд шинэ элементийг бром гэж нэрлэсэн. Бромыг нээсэн нь залуу, төдийлөн танигдаагүй эрдэмтнийг алдаршуулжээ. Баларын нийтлэл гарсны дараа ижил төстэй бодис агуулсан шилийг Германы химич К.Левиг, Ж.Либиг нарын судалгаа хүлээж байсан нь тогтоогджээ. (см. LIBICH Justus). Шинэ элемент нээх боломжийг алдсан Либиг: "Бромыг Балар биш, харин Бромыг нээсэн хүн" гэж хэлэв.
Байгальд байх
Бром бол дэлхийн царцдасын нэлээд ховор элемент юм. Түүний агуулгыг 0.37·10 -4% (ойролцоогоор 50-р байр) гэж тооцдог.
Химийн хувьд бром нь маш идэвхтэй тул байгальд чөлөөт хэлбэрээр байдаггүй. Энэ нь натри, кали, магнийн хлоридыг дагалддаг олон тооны өөр өөр нэгдлүүдийн (натри, кали, магнийн бромид гэх мэт) нэг хэсэг юм. Бромын өөрийн эрдэс бодисууд - бромаргирит (мөнгөний бромид AgBr) ба эмболит (холимог хлорид ба мөнгөний бромид) нь маш ховор байдаг (Байгалийн бромидуудыг үзнэ үү. (см.БАЙГАЛИЙН БРОМИД)). Бромын эх үүсвэр нь гашуун нуурын ус, газрын тос, янз бүрийн давсны ордуудыг дагалдан давсан давсны уусмал, далайн ус (65·10-4%), Сөнөсөн тэнгис нь бромоор баялаг. Одоогийн байдлаар бромыг ихэвчлэн зарим гашуун нууруудын уснаас гаргаж авдаг бөгөөд тэдгээрийн нэг нь, ялангуяа манай улсад Кулундагийн тал (Алтай) байдаг.
Физик ба химийн шинж чанар
Хэвийн нөхцөлд бром нь хүнд (нягт 3.1055 г/см3), улаан хүрэн, хурц үнэртэй өтгөн шингэн юм. Бром бол ердийн нөхцөлд шингэн байдаг энгийн бодисуудын нэг юм (бромоос гадна мөнгөн ус ч ийм бодис юм). Бром хайлах цэг нь -7.25 ° C, буцлах цэг нь + 59.2 ° C байна. Стандарт электродын потенциал Br 2 / Br - усан уусмал дахь +1.065 В.
Чөлөөт хэлбэрээр энэ нь хоёр атомт Br 2 молекул хэлбэрээр оршдог. Молекулуудын атомуудад мэдэгдэхүйц диссоциаци нь 800 ° C-ийн температурт ажиглагдаж, температурын өсөлтөд хурдан нэмэгддэг. Br 2 молекулын диаметр 0.323 нм, энэ молекул дахь цөмийн хоорондын зай 0.228 нм байна.
Бром нь бага зэрэг боловч усанд бусад галогенээс илүү уусдаг (20 ° C-ийн 100 г усанд 3.58 г) уусмалыг бромын ус гэж нэрлэдэг. Бромтой усанд гидробромик ба тогтворгүй гипобромын хүчил үүсэх урвал явагдана.
Br 2 + H 2 O = HBr + HBrO.
Бром нь ихэнх органик уусгагчидтай бүх талаараа холилдох чадвартай бөгөөд органик уусгагч молекулуудын бромжилт ихэвчлэн тохиолддог.
Химийн үйл ажиллагааны хувьд бром нь хлор ба иодын хоорондох завсрын байрлалыг эзэлдэг. Бром нь иодидуудын уусмалтай урвалд ороход чөлөөт иод ялгардаг.
Br 2 + 2KI = I 2 + 2KBr.
Эсрэгээр, хлор нь усан уусмал дахь бромидуудад үйлчлэхэд чөлөөт бром ялгардаг.
Cl 2 + 2NaBr = Br 2 + 2NaCl.
Бром хүхэртэй урвалд ороход S 2 Br 2, бром фосфортой урвалд ороход PBr 3, PBr 5 үүснэ. Бром нь мөн металл бус селентэй урвалд ордог (см.Селений)ба теллур (см.ТЕЛЛУР) .
Устөрөгчтэй бромын урвал нь халах үед үүсдэг ба устөрөгчийн бромидын HBr үүсэхэд хүргэдэг. HBr-ийн усан дахь уусмал нь гидробромик хүчил бөгөөд хүч чадлын хувьд давсны хүчил HCl-тэй төстэй. Гидробромик хүчлийн давс - бромид (NaBr, MgBr 2, AlBr 3 гэх мэт). Уусмал дахь бромидын ионуудын чанарын хариу урвал нь ус болон азотын хүчлийн уусмалд бараг уусдаггүй Ag + ионуудтай цайвар шар өнгийн AgBr тунадас үүсэх явдал юм.
Бром нь хүчилтөрөгч, азоттой шууд урвалд ордоггүй. Бром нь бусад галогентэй олон тооны өөр өөр нэгдлүүдийг үүсгэдэг. Жишээлбэл, фтортой бол бром нь тогтворгүй BrF 3 ба BrF 5, иодтой бол IBr үүсгэдэг. Олон металлуудтай харилцан үйлчлэлцэх үед бром нь бромид үүсгэдэг, жишээлбэл, AlBr 3, CuBr 2, MgBr 2 гэх мэт. Тантал, цагаан алт нь бром, бага хэмжээгээр мөнгө, титан, хар тугалгад тэсвэртэй байдаг.
Бром нь хүчтэй исэлдүүлэгч бодис бөгөөд сульфитын ионыг сульфат, нитритийн ионыг нитрат болгон исэлдүүлдэг.
Давхар холбоо агуулсан органик нэгдлүүдтэй харьцахдаа бром нэмж, холбогдох дибромо деривативыг өгдөг.
C 2 H 4 + Br 2 = C 2 H 4 Br 2.
Бром нь мөн гурвалсан холбоо агуулсан органик молекулуудтай холбогддог. Бромын усыг хийгээр дамжуулах эсвэл түүнд шингэн нэмэхэд өнгө нь өөрчлөгдөх нь хий, шингэнд ханаагүй нэгдэл байгааг илтгэнэ.
Катализаторын дэргэд халаахад бром нь бензолтой урвалд орж, бромобензол C 6 H 5 Br (орлуулах урвал) үүсгэдэг.
Бром нь шүлтийн уусмал, натри эсвэл калийн карбонатын уусмалуудтай урвалд ороход холбогдох бромид ба броматууд үүсдэг, жишээлбэл:
Br 2 + 3Na 2 CO 3 = 5NaBr + NaBrO 3 + 3CO 2.
Өргөдөл
Бромыг аналитик химийн олон тооны органик бус болон органик бодисыг бэлтгэхэд ашигладаг. Бромын нэгдлүүдийг түлшний нэмэлт, пестицид, галд тэсвэртэй бодис, гэрэл зурагт ашигладаг. Бром агуулсан эмийг өргөнөөр мэддэг. "Эмч хоолны дараа нэг халбага бром зааж өгсөн" гэсэн нийтлэг хэллэг нь цэвэр бром биш харин натрийн (эсвэл калийн) бромидын усан уусмалыг л зааж өгсөн гэсэн үг гэдгийг тэмдэглэх нь зүйтэй. Бромид эмийн тайвшруулах нөлөө нь дарангуйлах үйл явцыг сайжруулах чадварт суурилдаг (см.ТООРМОГЧ)төв мэдрэлийн системд.
Бромтой ажиллах онцлог
Бромтой ажиллахдаа хамгаалалтын хувцас, хийн маск, бээлий хэрэглэх хэрэгтэй. Бром уурын MPC 0.5 мг/м3 байна. Агаар дахь бромын агууламж ойролцоогоор 0.001% (эзэлхүүнээр) байвал салст бүрхэвчийг цочроох, толгой эргэх, өндөр концентрацитай үед амьсгалын замын спазм, амьсгал боогдох шинж тэмдэг илэрдэг. Хэрэв залгисан бол хортой тун нь 3 г, үхэлд хүргэдэг - 35 г-аас Бром уурын хордлогын үед хохирогчийг нэн даруй цэвэр агаарт гаргах ёстой; Амьсгалыг сэргээхийн тулд аммиакаар норгосон арчдасыг үе үе хохирогчийн хамар руу ойртуулж болно. Цаашдын эмчилгээг эмчийн хяналтан дор хийх ёстой. Шингэн бром нь арьсанд хүрсэн тохиолдолд түлэгдэлт үүсгэдэг.
Бромын уур, шингэн бромын аль алиных нь химийн идэвхжил, хоруу чанар өндөр тул шилэн, нягт битүүмжилсэн, зузаан ханатай саванд хадгална. Бромтой лонхыг элстэй саванд хийдэг бөгөөд энэ нь сэгсрэх үед колбыг устгахаас хамгаалдаг. Бром өндөр нягтралтай тул түүнийг агуулсан шилийг хэзээ ч хүзүүгээр нь авч болохгүй (хүзүү нь салж, улмаар хортой шингэн нь шалан дээр унах болно).
Асгарсан бромыг саармагжуулахын тулд түүний гадаргууг нэн даруй Na 2 CO 3 нойтон содын зутангаар хучих хэрэгтэй.
нэвтэрхий толь бичиг. 2009 .
Синоним:Бусад толь бичигт "бром" гэж юу болохыг хараарай.
бром- бром, а ба у... Орос хэлний зөв бичгийн толь бичиг
бром- бром/… Морфемик- зөв бичгийн дүрмийн толь бичиг
БРОМИН- БРОМИН, Бромум (Грекийн bromos үнэрээс), шингэн металлоид, галоген бүлэг, химийн найрлагатай. тэмдэглэгээ Вг; цагт. В. 79.92; дарааллаар нь элементүүдийн үелэх системд 35-р байр, VII бүлгийн 4-р байр эзэлдэг. Хар улаан хүрэн шингэн, тодорхой. жин 3,188...... Агуу анагаах ухааны нэвтэрхий толь бичиг
- (Грек bromos fetid). Маш тааламжгүй үнэртэй, улаан өнгөтэй энгийн шингэн бие; 1726 онд Балард далайн ус, давстай булгаас нээсэн. Орос хэлэнд орсон гадаад үгсийн толь бичиг. Чудинов А.Н., 1910. БРОМ... ... Орос хэлний гадаад үгсийн толь бичиг
BROM, бром, нөхөр. (Грек: bromos, муухай үнэр). Химийн элемент, хурц үнэртэй (химийн бодис) хүрэн улаан өнгөтэй идэмхий шингэн. Бромыг анагаах ухаан, гэрэл зураг, технологид ашигладаг. || Ашигласан бромидын нэгдлүүд. Анагаах ухаанд (байр.). Эмч бичсэн....... Ушаковын тайлбар толь бичиг
- (тэмдэг Br), HALOGEN бүлгийн дэгдэмхий, шингэн элемент (үелэх системийн долоо дахь бүлэг). Анх 1826 онд тусгаарлагдсан. Энэ нь өрөөний температурт шингэн хэвээр үлддэг цорын ганц металл бус элемент юм. Энэ нь уусдаг бодисоос гаргаж авсан ... Шинжлэх ухаан, техникийн нэвтэрхий толь бичиг
Бром уу? Байдал хүний биед агуулагдах элементүүдмаш бага хэмжээгээр тооцдог, учир нь эдгээр нь бидний биед 0.015 г-аас бага байдаг бодисууд юм.Эрхтэн, эд эсийн массын мянгаас нэг хувь буюу түүнээс бага (10-2-оос 10-7%) байдаг. , тиймээс тэдгээрийг бас гэж нэрлэдэг элемэнтүүдийн ул мөр. Гэсэн хэдий ч ийм бага хэмжээгээр байгаа хэдий ч эдгээр бодисуудын хангалттай хэмжээ нь бүх систем, эрхтнүүдийн бүрэн үйл ажиллагааны чухал нөхцөл юм. Эдгээр ашигт малтмалын нэг нь . Түүний тухай шинж чанар, эрүүл мэндийн ач холбогдолЭнэ нийтлэлд түүний үндсэн чиглэлийг авч үзэх болно эмчилгээний болон урьдчилан сэргийлэх зорилгоор ашиглах.
Бром: Нээлтийн түүх
Сонирхолтой бромын нээлтийн түүх, галогенүүдийн дунд үлдсэн сүүлчийн цагаан толбо. Үүний зэрэгцээ хоёр химич үүнийг өөр өөр бодисоос тусгаарласан: 1825 онд Хайдельбергийн их сургуулийн оюутан К.Левиграшаан болон франц хэл дээр хлорын нөлөөлөлд өртөх үед химич А.Балар, намгийн ургамлыг судалсан хүн, - хлорын усыг замгийн үнстэй урвалд оруулах үед. Гэсэн хэдий ч Левиг шинэ бодисыг илүү их хэмжээгээр авахыг оролдож байх хооронд Балард 1826 онд нээлтийнхээ тайланг нийтэлсэн бөгөөд үүний ачаар тэрээр дэлхий даяар алдар нэрийг олж авсан. Балар үүссэн бодисыг "давсны уусмал" гэсэн утгатай латин "мурид" гэсэн үг гэж нэрлэхийг хүссэн. Гэсэн хэдий ч давсны хүчлийг мурин хүчил, түүнээс гаргаж авсан давсыг муриат гэж нэрлэдэг байсан бөгөөд шинжлэх ухааны нийгэмлэгт нэр томъёоны төөрөгдөл гаргахгүйн тулд эртний Грек хэлнээс "өмхий үнэр" гэж орчуулагддаг бромын эрдсийг нэрлэхээр шийдсэн. .” Бром нь үнэхээр амьсгал давчдах, тааламжгүй үнэртэй байдаг. 19-р зууны туршид Оросын химийн шинжлэх ухаанд энэ микроэлементийг вром, вромид, мурид гэж нэрлэж байжээ.
БромПарафарм компанийн олон байгалийн витамин, эрдэсийн цогцолборуудын нэг хэсэг болох цэцгийн тоос, хааны вазелин, дрон үрээ гэх мэт зөгийн аж ахуйн бүтээгдэхүүнээс байгалийн оновчтой хэлбэр, тунг агуулдаг: Leveton P, Elton P, Leveton Forte ", "Apitonus P. ", "Osteomed", "Osteo-Vit", "Eromax", "Memo-Vit" болон "Cardioton". Тийм ч учраас бид байгалийн бодис болгонд маш их анхаарал хандуулж, түүний биеийн эрүүл мэндэд ач холбогдол, ашиг тусын талаар ярьдаг.
Химийн болон физикийн
бромын шинж чанар
тухай түүх бромын химийн болон физик шинж чанарМенделеевийн химийн элементүүдийн үелэх систем дэх түүний байр суурийг тайлбарлаж өгье. Дотор нь доор байрладаг бэлэг тэмдэгBr (Латин Бромумаас) 17-р бүлгийн 35-т, хаана галогенууд байдаг(фтор, хлор, бром, иод, астатин). Эдгээр нь металл бус ба идэвхтэй исэлдүүлэгч бодисууд, байгальд бие даан байдаггүй, гэхдээ зөвхөн нэгдлүүдийн нэг хэсэг нь, учир нь тэдгээр нь бараг бүх энгийн бодисуудтай нийлдэг химийн өндөр урвалд ордог. Энгийн бодисууд нь ердийн нөхцөлд шингэн хэлбэрээр байдаг хоёр элемент байдаг - мөнгөн ус, бром, зөвхөн нэг нь. шингэн бус металл - бром нь улаан хүрэн, тамхи татдаг бор өнгөтэй уур, хортой шингэн. Бром зөвхөн -7.25 ° C температурт талсжиж, + 59 ° C-т буцалгана. Энэ нь H 2 O-д уусдаг (бромын ус гэж нэрлэгддэг), гэхдээ илүү сайн - органик уусгагчид.
Цэвэр бром 2 атомт молекулаар илэрхийлэгддэг BR 2, Гэхдээ химийн өндөр идэвхжилбайгальд чөлөөт төлөвт байхыг зөвшөөрдөггүй, тиймээс энэ нь олддог бромидын найрлага(металлуудтай нэгдлүүд). Дэлхийн дотоод давхарга, чулуулгийн агууламжийн хувьд 50-д ордог тул байгалийн эх үүсвэр нь ихэвчлэн давстай нуур, далай; газрын тосны дагалдах газрын доорхи ус . Энэ нь агаарт байдаг бөгөөд далайн эрэг орчмын бүс нутагт илүү их байдаг. Гэсэн хэдий ч үйлдвэрлэлийн алдагдсан тохиолдолд бромын уур нь хүмүүст хортой, амьсгал боогдуулдаг.
Бромын шинж чанар нь түүнийг түлшний нэмэлт бодис, хөдөө аж ахуйд пестицид, шаталтыг удаашруулагч, гэрэл зурагт мөнгөн бромидын гэрэл мэдрэмтгий бодис, эм үйлдвэрлэхэд өргөнөөр ашиглах боломжийг олгодог. Энэ микроэлементтэй ажиллах нь маш болгоомжтой, аюулгүй байдлын урьдчилан сэргийлэх арга хэмжээг дагаж мөрдөхийг шаарддаг. Бээлий, комбинзон болон хийн маск нь энэ бодистой харьцах хамгийн сайн холбоотон юм.
Бромын үнэ цэнэ
биеийн хувьдхүн
Цэвэр бром- маш хортой бодис! Зөвхөн 3 грамм Элемент бром нь залгисан тохиолдолд хордлого үүсгэдэг, 35 грамм нь үхлийн аюултай. -тай холбоо барина уу шингэн бромөвдөлттэй, эдгэрдэггүй түлэгдэлтээр дүүрэн байдаг. Агаар дахь 0.001% бром нь ханиалгах, амьсгал боогдох, толгой эргэх, хамраас цус алдах шалтгаан болдог ба энэ үзүүлэлтээс хэтэрсэн тохиолдолд амьсгалын замын цочрол, үхэлд хүргэдэг. Гэсэн хэдий ч хоруу чанарыг үл харгалзан хүний биед бромын ач холбогдолхүнийг дорд үзэхэд хэцүү байдаг. Тэр нь бидний эрхтэн, эд эсэд агуулагддаг ул мөр элемент юм: тархи, цус, элэг болон бөөр, бамбай булчирхай, булчингийн эд, яс...Бидэнд бага хэмжээгээр хэрэгтэй!
Бром нь нөлөө үзүүлдэг төв мэдрэлийн систем дээр. Тархины гадаргад хуримтлагдаж, мэдрэлийн эсийн үйл ажиллагааг зохицуулж, өдөөх, дарангуйлах урвалын тэнцвэрийг хариуцдаг. Шаардлагатай бол энэ нь тайвшруулах нөлөөг хариуцдаг мембраны ферментээр дамжуулан дарангуйллыг сайжруулдаг.
Энэ микроэлемент нь дотоод шүүрлийн системд бас чухал ач холбогдолтой, Энэ нь иодын өөр нэг төрлийн үүрэг гүйцэтгэдэг тул бамбай булчирхайн иодын хэрэгцээг бууруулж, түүний өсөлтөөс сэргийлдэг - эндемик бахлуур үүсэхээс сэргийлдэг.
Бромын үүрэгходоод гэдэсний замын үйл ажиллагаандидэвхжүүлж байгаатай холбоотой хоол боловсруулах ферментэд үзүүлэх нөлөө:
- пепсин (уураг задлахад шаардлагатай);
- амилаза (нүүрс усыг задалдаг);
- липаза (хоол боловсруулах явцад өөх тосыг уусгаж, ангилдаг).
Асуулт О бромын нөлөөэрэгтэй бэлгийн үйл ажиллагааны талаардомогт бүрхэгдсэн. Тодруулбал, өмнө нь хорих ангид хоригдож байсан хоригдлууд, эмнэлгийн сэтгэцийн эмгэгийн тасагт хэвтэн эмчлүүлж буй өвчтөнүүд, армийн цэргүүд бэлгийн сулралыг сулруулах зорилгоор энэ эрдэс бодисоор хоол хүнсэндээ нэмдэг байжээ. Удаан хугацааны туршид бромыг генералтай гэж үздэг байв биед тайвшруулах нөлөө үзүүлдэг, бэлгийн хүрээг дарангуйлдаг. Гэсэн хэдий ч хожим судалгаанууд нь хэрэглэхээс огт эсрэг нөлөө үзүүлдэг болохыг нотолсон бромидын бэлдмэл, эрэгтэйчүүдийн нөхөн үржихүйн тогтолцоог тогтворжуулахад хувь нэмэр оруулах, үрийн шингэний хэмжээ ихсэхба түүний доторх эр бэлгийн эсийн тоо.
Бромыг биеэс зайлуулдагшээс, хөлрөх үед. Тиймээс түүнийг гаднаас хоол хүнсээр (шаардлагатай бол фармакологийн бэлдмэлээр) авах шаардлагатай. Гэсэн хэдий ч түүнийг арилгах нь урт процесс тул эрхтэн, эд эс дэх концентраци нэмэгдэж, эрүүл мэндэд маш аюултай.
Энэ нь хэрхэн нөлөөлдөг бромын дутагдал
хүний эрүүл мэндэд?
Бромын дутагдалхэд хэдэн ноцтой үйл ажиллагааны доголдол үүсгэж болно. Хүүхэд, өсвөр насанд түүний дутагдал нь өсөлт удааширч, насанд хүрэгчдэд энэ нь дундаж наслалт буурахад хүргэдэг. Нойрмоглох, мэдрэлийн болон гистерийн илрэлүүд, гемоглобины хэмжээ буурснаас үүдэлтэй цус багадалт, жирэмсэн эмэгтэйчүүдэд аяндаа зулбах эрсдэл нэмэгдэх, бэлгийн сулрал, хүчиллэг багассаны улмаас хоол боловсруулах эрхтний эмгэгүүд - энэ бүхэн дутагдлын үр дагавар байж болно. энэ ашигт малтмал. Энэ нөхцлийн шалтгаанууд нь бодисын солилцооны эмгэгэсвэл шээс хөөх эмийг хэтрүүлэн хэрэглэхсурталчлах гэсэн үг бромыг зайлуулахбиеэс. Оношлогоо бромын дутагдалМөн эмчилгээг мэргэжлийн эмчийн зааж өгсөн байх ёстой бөгөөд энэ тохиолдолд эмчээс зөвлөгөө авалгүйгээр өөрийгөө эмчлэхийг хатуу зөвлөдөггүй.
Бромыг хэтрүүлэн хэрэглэх
Үүнээс багагүй аюултай бромын хэтрүүлэн хэрэглэх, зөвхөн фармакологийн эм хэрэглэхтэй холбоотой үүсдэг. Түүний онцлог шинж тэмдэг нь харшлын арьсны тууралт, арьсны үрэвсэл, ходоод гэдэсний замын эмгэг, сэтгэлийн хямрал, эрч хүч алдагдах, нойргүйдэх, нойрмоглох, бронхит, ринит зэрэг бромын хорт нөлөөнд хариу үйлдэл үзүүлэх болно. Мэдрэлийн систем, мэдрэхүйн эрхтнүүд (хараа, сонсгол) өвдөж, сэтгэцийн үйл явц, танин мэдэхүйн (ойлголттой холбоотой) үйл ажиллагаа мууддаг.
Бром илүүдэл нь үхэлд хүргэж болзошгүй тул хэрэв та хэтрүүлэн хэрэглэсэн гэж сэжиглэж байгаа бол шууд хэрэглэхээ болих хэрэгтэй бром агуулсанэм ууж, тэдгээрийг цуцлах эсвэл тунг тохируулахын тулд эмчид хандана уу.
Бром эм уухВ
эмчилгээний болон урьдчилан сэргийлэх зорилгоор
Сурч байна бромид өртөххүний эрүүл мэнд, тэдгээрийг эмнэлгийн практикт нэвтрүүлэх нь бараг тэр даруй эхэлсэн бромын нээлт- 19-р зуунд, тийм бромын эм уух- эмнэлзүйн анагаах ухаанд батлагдсан эмчилгээ.
Оросын физиологич I. P. Павлов нөлөөллийн судалгаанд ихээхэн хувь нэмэр оруулсан бром агуулсан нэгдлүүдмэдрэлийн үйл ажиллагааны талаар. Түүний нохой дээр хийсэн туршилтууд үр дүнтэй болсон мэдрэлийн өвчинд зориулсан бром, мөн томилогдсон бромидын тундээд мэдрэлийн үйл ажиллагааны төрөлтэй хамааралтай байх ёстой (хүчтэй төрөлтэй бол өндөр тун шаардлагатай).
Бромидууд нь тайвшруулах үйлчилгээтэйМэдрэлийн эмгэг, нойргүйдэл, цочромтгой байдал, гистериа ба мэдрэлийн өвчин, таталт зэрэгт хэрэглэдэг., гэхдээ тэдгээрийг эпилепсийн эмчилгээнд хэрэглэхээ бараг больсон. Өнөөдөр эмч нар ерөнхийдөө болгоомжтой ханддаг бромидуудыг зааж өгсөн байдагбиеэс удаан гадагшилдаг, бромизм үүсэх аюулаас болж архагшдаг бромын хордлого. Энэ заалт хүчинтэй хэвээр байна бром агуулсанАГ-ийн хөгжлийн эхний үе шатанд ходоод, арван хоёр нугасны шархлаатай ихэвчлэн тохиолддог тархины бор гадар, эрхтэн, тогтолцооны хоорондын уялдаа холбоог зөрчсөн эм.
Нийтлэг зүйлийн дунд бром агуулсан эм, – калийн бромид, натрийн бромид, "Адонис-бром", "Бромкамфор" болон бусад, нунтаг, уусмал хэлбэрээр амаар, судсаар тарьж хэрэглэнэ. Натрийн бромид хэрэглэх боломжтойэлектрофорезын хувьд - өвдөлттэй үрэвсэлт үйл явц, герпес зостерын хувьд. Бромидын тунӨдөрт гурван удаа 0.1-1 грамм ууна.
Бромын өдөр тутмын хэрэгцээ
Ходоодны шүүсний хүчиллэгийг нэмэгдүүлэх ба бэлгийн үйл ажиллагааг идэвхжүүлэхЭрэгтэйчүүдэд мэдрэлийн эмгэгээс урьдчилан сэргийлэхийн тулд эмч нар уухыг зөвлөж байна 3-8 мг. Энэ бромын өдөр тутмын хэрэгцэээрүүл хүний хувьд. Олон тооны хүнсний нэмэлт тэжээлүүд нь бусад эрдэс бодисын хамт энэ ул мөр элементийг агуулдаг. Дунджаар 1 мг нь бидний биед хоол хүнсээр ордог.
Бромын агууламж
бүтээгдэхүүндтэжээл
Энэ нь ямар байдгийг мэдэх бүтээгдэхүүн дэх бромын агууламжхоол тэжээл, та фармакологийн эм хэрэглэхгүйгээр түүний хэрэглээг нэмэгдүүлэх боломжтой. Энэхүү ул мөр элемент нь олон ургамалд хуримтлагддаг бөгөөд энэ нь түүнийг гүнээс авч, органик хоргүй нэгдэл, давстай холбодог.
Тэд ялангуяа баялаг:
- вандуй,
- шош,
- сэвэг зарам,
- төрөл бүрийн самар болон
- үр тариа (арвай, улаан буудай гэх мэт).
Энэ нь далайн уснаас түүний найрлагад ордог
- бор замаг болон бусад замаг,
- далайн загас.
Мөн бид чулуун давснаас бром авч болно. Мөн хатуу улаан буудайгаар хийсэн сүүн бүтээгдэхүүн, гоймон, талхны бүтээгдэхүүнээс олддог.
Байгалийн бром нь массын тоо 79 (массын 50.56% -ийн хольцод) ба 81 гэсэн хоёр нуклидын холимог юм. Гадаад электрон давхаргын тохиргоо нь 4s 2 p 5. Нэгдлүүдийн хувьд исэлдэлтийн төлөв 1, +1, +3, +5 ба +7 (валент I, III, V ба VII), хамгийн онцлог исэлдэлтийн төлөв 1 ба +5 байдаг.
Менделеевийн үелэх системийн элементүүдийн VIIA бүлгийн дөрөвдүгээр үед байрлана.
Төвийг сахисан бромын атомын радиус нь 0.119 нм, Br, Br 3+, Br 5+, Br 7+-ийн ионы радиусууд нь 0.182-тай тэнцүү; 0.073; 0.045 ба 0.039 нм. Төвийг сахисан бромын атомын дараалсан иончлолын энерги нь 11.84; 21.80; 35.9; 47.3 ба 59.7 эВ. Электрон хамаарал 3.37 эВ. Полингийн хуваарийн дагуу бромын цахилгаан сөрөг чанар 2.8 байна.
Нэр:бром нь хүнд, тааламжгүй уурын үнэртэй байдагтай холбоотой (Грекийн bromos үнэрээс).
Нээлтийн түүх:Францын химич А.Балард 1825 онд далайн байцааны үнсийг угаасны дараа гаргаж авсан усан уусмал дээр хлороор үйлчилж, хар хүрэн, эвгүй үнэртэй шингэнийг ялгаж авсан нь бромын нээлтийг тэргүүлсэн юм. Тэрээр мөн далайн уснаас гаргаж авсан энэ шингэнийг мурид (Латин муриа давсны уусмал, давсны уусмал) гэж нэрлээд Парисын Шинжлэх ухааны академид нээлтийнхээ тухай мессеж илгээжээ. Энэ мессежийг шалгахын тулд байгуулагдсан комисс Балар нэрийг хүлээн аваагүй бөгөөд шинэ элементийг бром гэж нэрлэсэн. Бромыг нээсэн нь залуу, төдийлөн танигдаагүй эрдэмтнийг алдаршуулжээ. Баларын нийтлэл гарсны дараа ижил төстэй бодис агуулсан лонхнууд Германы химич К.Левиг, Ж.Либиг нарын судалгааг хүлээж байсан нь тогтоогджээ. Шинэ элемент нээх боломжийг алдсан Либиг: "Бромыг Балар биш, харин Бромыг нээсэн хүн" гэж хэлэв.
Үл хөдлөх хөрөнгө:хэвийн нөхцөлд бром нь хурц үнэртэй хүнд (нягт 3.1055 г/см3) улаан хүрэн өтгөн шингэн юм. Бром бол ердийн нөхцөлд шингэн байдаг энгийн бодисуудын нэг юм (броноос гадна өөр ийм бодис байдаг). Бром хайлах цэг нь 7.25 ° C, буцлах цэг нь + 59.2 ° C байна. Усан уусмал дахь стандарт электродын боломжит Br 2 / Br нь +1.065 В байна.
Чөлөөт хэлбэрээр энэ нь хоёр атомт Br 2 молекул хэлбэрээр оршдог. Молекулуудын атомуудад мэдэгдэхүйц диссоциаци нь 800 ° C-ийн температурт ажиглагдаж, температурын өсөлттэй хамт хурдан нэмэгддэг. Br 2 молекулын диаметр 0.323 нм, энэ молекул дахь цөмийн хоорондын зай 0.228 нм байна.
Бром нь бага зэрэг боловч усанд бусад галогенээс илүү уусдаг (200С-ийн температурт 100 г усанд 3.58 г) уусмалыг бромын ус гэж нэрлэдэг. Бромтой усанд гидробромик ба тогтворгүй гипобромын хүчил үүсэх урвал явагдана.
Br 2 + H 2 O = HBr + HBrO.
Бром нь ихэнх органик уусгагчидтай бүх талаараа холилдох чадвартай бөгөөд органик уусгагч молекулуудын бромжилт ихэвчлэн тохиолддог.
Химийн үйл ажиллагааны хувьд бром нь хлор (Cl) ба иод (I) хоёрын хооронд завсрын байрлалыг эзэлдэг. Бром нь иодидуудын уусмалтай урвалд ороход чөлөөт иод (I) ялгардаг.
Br 2 + 2KI = I 2 + 2KBr.
Бром нь хүчтэй исэлдүүлэгч бодис бөгөөд сульфитын ионыг сульфат, нитритийн ионыг нитрат болгон исэлдүүлдэг.
Давхар холбоо агуулсан органик нэгдлүүдтэй харьцахдаа бром нэмж, холбогдох дибромо деривативыг өгдөг.
C 2 H 4 + Br 2 = C 2 H 4 Br 2.
Бром нь мөн гурвалсан холбоо агуулсан органик молекулуудтай холбогддог. Бромын усыг хийгээр дамжуулах эсвэл түүнд шингэн нэмэхэд өнгө нь өөрчлөгдөх нь хий, шингэнд ханаагүй нэгдэл байгааг илтгэнэ.
Катализаторын дэргэд халаахад бром нь бензолтой урвалд орж, бромобензол C 6 H 5 Br (орлуулах урвал) үүсгэдэг.
Бром нь шүлтийн уусмал, натри (Na) эсвэл калийн (K) карбонатын уусмалуудтай урвалд ороход харгалзах бромид ба броматууд үүсдэг, жишээлбэл:
Br 2 + 3Na 2 CO 3 = 5NaBr + NaBrO 2 + 3CO 2.
Байгальд хайх:Бром бол дэлхийн царцдасын нэлээд ховор элемент юм. Түүний агуулгыг 0.37·10 4% (ойролцоогоор 50-р байр) гэж тооцдог.
Химийн хувьд бром нь маш идэвхтэй тул байгальд чөлөөт хэлбэрээр байдаггүй. Энэ нь натри, кали, магнийн хлоридыг дагалддаг олон тооны янз бүрийн нэгдлүүдийн (натри (Na), кали (K), магни (Mg) гэх мэт бромидууд) нэг хэсэг юм. Бромын дотоод эрдэс бромаргирит (мөнгөний бромид (Ag) AgBr) ба эмболит (холимог хлорид ба мөнгө (Ag) бромид) нь маш ховор байдаг. Бромын эх үүсвэр нь гашуун нуурын ус, газрын тос, янз бүрийн давсны ордуудыг дагалдан давсан давсны уусмал, далайн ус (65·10 4%), Сөнөсөн тэнгис нь бромоор баялаг. Одоогийн байдлаар бромыг ихэвчлэн зарим гашуун нууруудын уснаас гаргаж авдаг бөгөөд тэдгээрийн нэг нь, ялангуяа манай улсад Кулундагийн тал (Алтай) байдаг.
Хэрэглээ:бромыг аналитик химийн олон тооны органик бус болон органик бодисыг бэлтгэхэд ашигладаг. Бромын нэгдлүүдийг түлшний нэмэлт, пестицид, галд тэсвэртэй бодис, гэрэл зурагт ашигладаг. Бром агуулсан эмийг өргөнөөр мэддэг. "Эмч хоолны дараа нэг халбага бром зааж өгсөн" гэсэн нийтлэг хэллэг нь цэвэр бром биш харин натрийн (эсвэл калийн) бромидын усан уусмалыг л зааж өгсөн гэсэн үг гэдгийг тэмдэглэх нь зүйтэй. Бромид эмийн тайвшруулах нөлөө нь төв мэдрэлийн систем дэх дарангуйлах үйл явцыг сайжруулах чадварт суурилдаг.
Бромтой ажиллах онцлогууд:Бромтой ажиллахдаа хамгаалалтын хувцас, хийн маск, бээлий хэрэглэх хэрэгтэй. Бром уурын MPC 0.5 мг/м3 байна. Агаар дахь бромын агууламж ойролцоогоор 0.001% (эзэлхүүнээр) байвал салст бүрхэвчийг цочроох, толгой эргэх, өндөр концентрацитай үед амьсгалын замын спазм, амьсгал боогдох шинж тэмдэг илэрдэг. Хэрэв залгисан бол хортой тун нь 3 гр, 35 гр-аас үхэлд хүргэдэг.Бромын уурын хордлогын үед хохирогчийг нэн даруй цэвэр агаарт гаргаж, амьсгалыг сэргээхийн тулд аммиакаар чийгшүүлсэн арчдасыг богино хугацаанд, үе үе хэрэглэж болно. хохирогчийн хамар руу богино хугацаанд авчрах. Цаашдын эмчилгээг эмчийн хяналтан дор хийх ёстой. Шингэн бром нь арьсанд хүрсэн тохиолдолд түлэгдэлт үүсгэдэг.
ТОДОРХОЙЛОЛТ
БромҮелэх системийн үндсэн (А) дэд бүлгийн VII бүлгийн дөрөвдүгээр үед байрладаг.
Элементүүдийг хэлдэг х- гэр бүлүүд. Төмөр бус. Тэмдэглэл - Br. Серийн дугаар - 35. Харьцангуй атомын масс - 79.904 аму.
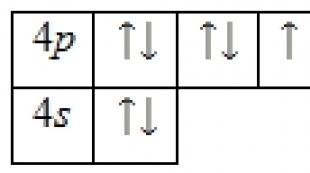
Бром атомын электрон бүтэц
Бром атом нь эерэг цэнэгтэй цөмөөс (+35) тогтдог бөгөөд дотор нь 35 протон, 45 нейтрон байдаг ба 35 электрон дөрвөн тойрог замд эргэлддэг.
Зураг 1. Бром атомын бүдүүвч бүтэц.
Орбиталуудын хоорондох электронуудын тархалт дараах байдалтай байна.
35Br) 2) 8) 18) 7 ;
1с 2 2с 2 2х 6 3с 2 3х 6 3г 10 4с 2 4х 5 .
Бром атомын гаднах энергийн түвшин нь валентийн электронууд болох 7 электрон агуулдаг. Үндсэн төлөвийн энергийн диаграмм нь дараах хэлбэртэй байна.

Бром атомын валентийн электрон бүрийг дөрвөн квант тооны багцаар тодорхойлж болно. n(үндсэн квант), л(орбиталь), м л(соронзон) ба с(эргэх):
|
Дэд түвшин |
||||
Нэг хосгүй электрон байгаа нь бромын исэлдэлтийн төлөв -1 эсвэл +1 байж болохыг харуулж байна. Дөрөвдүгээр түвшинд сул орбиталууд байдаг тул 4 г-дэд түвшний, дараа нь бромын атом нь өдөөгдсөн төлөвөөр тодорхойлогддог.

Тийм ч учраас бром бас +3 исэлдэлтийн төлөвтэй байдаг. Түүний нэгдлүүд дэх бром нь +5 ба +7 исэлдэлтийн төлөвийг харуулах чадвартай гэдгийг мэддэг.
Асуудлыг шийдвэрлэх жишээ
ЖИШЭЭ 1
| Дасгал хийх | Элемент нь 12.5% устөрөгч агуулсан устөрөгчтэй хийн нэгдэл үүсгэдэг. Энэ элементийн хамгийн өндөр исэл нь RO 2 томьёотой. Энэ элементийн атомын электрон бүрхүүл дэх электронуудын тоог заана уу. |
| Шийдэл | RO 2 найрлагын өндөр исэлүүд нь үечилсэн системийн IV бүлэгт байрлах элементүүдийг үүсгэдэг. Энэ бүлгийн элементүүд нь RH 4 найрлагатай устөрөгчтэй дэгдэмхий нэгдлүүдийг үүсгэдэг. Хүссэн элементийг X гэж тэмдэглэе. Тэгвэл устөрөгчийн нэгдлийн найрлага дахь түүний массын хувь нь: ω(X)=100 - 12.5 = 87.5%. Энэ элементийн харьцангуй атомын массыг олъё. A r (X) = ω(X)× n(H)/ω(H) = 87.5×4/12.5 = 28. Цахиур (Si) ийм атомын масстай. Асуудлын мэдэгдэлд заасан нэгдлүүдийн томъёо дараах байдалтай байна: SiO 2 ба SiH 4. Цахиурын атомын электрон бүрхүүл дэх электронуудын нийт тоо нь түүний үечилсэн хүснэгт дэх серийн дугаартай тэнцүү байна, i.e. 14. |
| Хариулт | Цахиурын атомын электрон бүрхүүлийн нийт электрон тоо 14 байна. |