Hüdrolüüs. Estrite hüdrolüüs Estris toimub reaktsioon
Estrite ja kõigi teiste happederivaatide hüdrolüüs nõuab happelist või aluselist katalüüsi. Happelise hüdrolüüsiga saadakse karboksüülhapped ja alkoholid (pöördesterdamise reaktsioon), aluselise hüdrolüüsiga tekivad karboksüülhapete ja alkoholide soolad.
Estrite happeline hüdrolüüs:
S N mehhanism, nukleofiil - H 2 O, alkoksürühm on asendatud hüdroksüülrühmaga.
Estrite leeliseline hüdrolüüs: reaktsioon kulgeb kahes etapis 2 mooli alusega, saadud hape muudetakse soolaks.
S N mehhanism, Nu = -OH
Soolaühendite teke Amiidid on neutraalsed ained, kuna ammoniaagi põhiomadusi nõrgestab selles sisalduva vesinikuaatomi asendamine happelise jäägiga. Seetõttu moodustab amiidides olev NH 2 rühm erinevalt amiinidest ooniumikatiooni vaid raskustega. Kuid tugevate hapetega annavad amiidid sooli, näiteks Cl, mida vesi kergesti lagundab. Teisest küljest on amiidides NH 2 rühma vesinik asendatav metallidega kergemini kui ammoniaagis ja amiinides. Näiteks atseetamiid lahustab kergesti elavhõbeoksiidi, moodustades ühendi (CH 3 CONH) 2 Hg.
Siiski on võimalik, et metalliderivaatide moodustumisel toimub amiidi isomerisatsioon ja saadud ühend on imiidhappe soola isomeerse (tautomeerse) struktuuriga.
st on olemas analoogia vesiniktsüaniidhappe sooladega.
2. Lämmastikhappe toime Amiidid reageerivad lämmastikhappega, nagu ka primaarsed amiinid, moodustades karboksüülhappeid ja vabastades lämmastikku:
3. Seebistamine Mineraalhapete ja leelistega keetmisel lisavad amiidid vett, moodustades karboksüülhappe ja ammoniaagi:
4. Halogeniidalküülide toime. Alküülhalogeniidide toimel amiididele või nende metalliderivaatidele saadakse N-asendatud amiide:
5. Fosforpentakloriidi toime. Fosforpentakloriidi toimel amiididele, klooramiidid
kergesti lagunev vesinikkloriidhappeks ja imiidkloriidid
Viimane koos ammoniaagiga võib anda soolasid amidiinid;
6. Muundamine amiinideks. Amiidide jõulise redutseerimisega võib saada sama arvu süsinikuaatomitega primaarseid amiine:
7. Hoffmanni reaktsioon. Hüpohaliidi ehk broomi ja leelise toimel amiididele tekivad amiinid ja karbonüülrühma süsinikuaatom eraldatakse CO 2 kujul (A. Hoffman). Reaktsiooni kulgu võib kujutada järgmiselt:
Haridusjuhendites leitakse sageli selle reaktsiooni mehhanismi teine tõlgendus:
Kuid selline reaktsiooni kulg on fragmendi moodustumise tõttu vähem usutav
kahe vaba elektronpaari kandva lämmastikuaatomiga on ebatõenäoline.
Sellele mehhanismile vastandub eelkõige asjaolu, et kui radikaal R on optiliselt aktiivne, siis ta reaktsiooni tulemusena ratseemiseeruma ei hakka. Vahepeal tooks isegi vaba radikaali R - : üürike olemasolu kaasa optilise aktiivsuse kadumise.
Keemilised omadused. Nitrorühm on üks enim tugevad elektrone väljatõmbavad rühmad ja suudab negatiivset tõhusalt ümber paigutada. tasu. Aromaatsetes ühendus induktsiooni ja eriti mesomeersete mõjude tulemusena mõjutab see elektrontiheduse jaotust: tuum omandab osalise positiivse. laeng, to-ry lokaliseeritud Ch. arr. orto- ja paraasendis; NO 2 rühma Hammetti konstandid s m 0,71, s n 0,778, s + n 0,740, s - n 1,25. Seega suurendab NO2 rühma lisamine reaktsiooni järsult. võime org. ühendus seoses nukleof.reagentidega ja raskendab p-tsiooni elektrof. reaktiivid. See määrab nitroühendite laialdase kasutamise org. süntees: NO 2 rühm viiakse org-molekuli soovitud asendisse. Komm., viige läbi dekomp. p-tion on reeglina seotud süsiniku skeleti muutusega ja muudetakse seejärel teiseks funktsiooniks või eemaldatakse. Aromaatsetes Reas kasutatakse sageli lühemat skeemi: NO 2 rühma nitreerimine-transformatsioon.
Nitrooni to-t moodustumine aromaatsete nitroühendite seerias on seotud benseenitsükli isomeriseerumisega kinoidivormiks; näiteks nitrobenseen moodustub konts. H 2 SO 4 värviline soolatoode f-ly I, o-nitrotolueen ilmutab fotokroomset tulemusena vnutrimol. prootonite ülekanne helesinise O-derivaadi moodustamiseks:
Aluste toimel primaarsetele ja sekundaarsetele nitroühenditele tekivad nitroühendite soolad; elektrofiilidega p-ioonides olevate soolade ambident-anioonid on võimelised andma nii O- kui ka C-derivaate. Niisiis, nitroühendite soolade alküülimine alküülhalogeniidide, trialküülklorosilaanide või R3O + BF-4-ga annab O-alküülimisproduktid. Viimased m.b. saadud ka diasometaani või N,O-bis-(trimetüülsilüül)atseetamiidi toimel nitroalkaanidele pKa-ga< 3 или нитроновые к-ты, напр.:
Atsükliline nitrooni to-t alküülestrid on termiliselt ebastabiilsed ja lagunevad vastavalt vnutrimolile. mehhanism:
R-ts ja ja koos r ja ry v o m s vyaz z ja C-N. Primaarsed ja sekundaarsed nitroühendid laadimisel. kaevuriga. to-tami juuresolekul. alkohol või leelise vesilahus moodustab karbonüül Comm. (vt Neph reaktsioon). R-tion läbib intervalli. nitooni moodustumine to-t:
Allikana Comm. võib kasutada silüülnitrooneetreid. Tugeva to-t toime alifaatsetele nitroühenditele võib viia sinna hüdroksaamini, näiteks:
Nitroühendite redutseerimiseks amiinideks on palju meetodeid. Laialdaselt kasutatav rauaviil, Sn ja Zn juuresolekul. to-t; katalüütikuga hüdrogeenimisel kasutatakse katalüsaatoritena Ni-Raney, Pd/C või Pd/PbCO 3 jne. Alifaatsed nitroühendid redutseeritakse kergesti amiinideks LiAlH4 ja NaBH4 juuresolekul. Pd, Na ja Al amalgaamid kuumutamisel. hüdrasiiniga Pd/C kohal; aromaatsete nitroühendite puhul kasutatakse mõnikord TlCl 3, CrCl 2 ja SnCl 2, aromaatsed. polünitroühendid redutseeritakse selektiivselt nitramiinideks Na hüdrosulfiidiga CH 3 OH-s. Valimiseks on viise. NO 2 rühma taastamine polüfunktsionaalsetes nitroühendites teisi f-isioone mõjutamata.
P(III) toimel aromaatsetele nitroühenditele toimub järjestus. NO 2 rühma deoksüdeerimine koos väga reaktiivsete nitreenide moodustumisega. R-iooni kasutatakse kondensaatori sünteesiks. heterotsüklid, näiteks:
R-ts ja NO 2 rühma säilimisega. A-H-aatomit sisaldavad alifaatsed nitroühendid alküülitakse ja atsüülitakse kergesti, moodustades reeglina O-derivaate. Kuid vastastikku mod. primaarsete nitroühendite dilitiumisoolad alküülhalogeniidide, anhüdriidide või karboksüülhapete halogeniididega põhjustavad C-alküülimise või C-atsüülimise saadusi, näiteks:
Tuntud näited vnutrimol. C-alküülimised, nt:
Primaarsed ja sekundaarsed nitroühendid reageerivad alifaatsusega. amiinid ja CH2O koos p-aminoderivaatide moodustumisega (p-tion Mannich); piirkonnas saate kasutada nitroühendite või aminoühendite eelsaadud metülooli derivaate:
Nitrometaan ja nitroetaan võivad kondenseeruda kahe metüloolamiini molekuliga ja kõrgemad nitroalkaanid ainult ühe molekuliga. Teatud reagentide vahekorras võib p-ioon viia heterotsüklilise tekkeni. ühendus, näiteks: interaktsiooniga. primaarne nitroalkaan koos kahe ekvivalendi primaarse amiini ja formaldehüüdi liiaga moodustavad Comm. f-ly V, kui reaktiive võetakse vahekorras 1:1:3-comm. vormid VI.
Aromaatsed nitroühendid sisenevad kergesti p-tooni tuuma. asendamine ja palju raskem, elektrofi piirkonnas. asendamine; sel juhul suunatakse nukleofiil orto- ja pooride positsioonidesse ning elektrofiil aga metaasendisse NO 2 rühma. Kiiruse konstant nitrobenseeni nitreerimine on 5-7 suurusjärku väiksem kui benseeni oma; see tekitab m-dinitrobenseeni.
Kui primaarsete nitroalkaanide karboksüleerimine CH 3 OMgOCOOCH 3 toimel moodustub a-nitrokarboksüülhape või nende estrid.
Mono-nitroühendite C (NO 2) 4 soolade töötlemisel Ag või leelismetallide nitrititega või nitritite toimel a-halo-nitroalkaanidega leeliselises keskkonnas (Ter Meeri piirkond), saadakse gem-dinitroühendid. a-halo-nitroalkaanide elektrolüüs aprotoonsetes p-lahustites, samuti Cl 2 nitroühendite töötlemine leeliselises keskkonnas või nitroühendite soolade elektrooksüdeerimine viivad vic-dinitroühenditeni:
Nitrorühm ei muuda olendeid. mõju vabade radikaalide alküülimisele või aromaatsele arüülimisele. ühendus; p-mine viib peamisse. orto- ja paraasendatud toodetele.
Nitroühendite taastamiseks ilma NO 2 rühma mõjutamata kasutatakse madalatel temperatuuridel NaBH 4, LiAlH 4 või diboraani lahust THF-s, näiteks:
Aromaatne di- ja trinitroühendid, eriti 1,3,5-trinitrobenseen, moodustavad stabiilseid erksavärvilisi kristalle. nad ütlesid kompleksid aromaatsusega Comm.-elektronide doonorid (amiinid, fenoolid jne). Aromaatsete ainete eraldamiseks ja puhastamiseks kasutatakse komplekse pikrilise to-one-ga. süsivesinikud. Intermod. Tugevate alustega (HO - , RO - , N - 3 , RSO - 2 , CN - , alifaatsed amiinid) di- ja trinitrobenseenid põhjustavad Meisen-heimeri komplekside moodustumist, mis eraldatakse värviliste leelismetallisooladena.
Nende reaktsioonide jaoks sobivad oksüdeerivad ained on kroom- või lämmastikhape, kroomisegu, mangaandioksiid või seleenidioksiid.
Kroomihappega oksüdeerimisel lisandub kroomhappele nukleofiilselt alkohol, samal ajal kui vesi eraldub ja moodustub kroomhappe ester (see on reaktsiooni esimene etapp, sarnaneb karboksüülhapete estrite moodustumisega, vt. Jaotis E, 7.1.5.1). Teises etapis, mis tõenäoliselt läbib tsüklilise ülemineku oleku, läheb alkoholi a-vesinik kromaadijäägiks ja metall kuuevalentsest olekust neljavalentsesse olekusse:
| n-CH3O> P-tert-C4H9> P-CH3> P-Cl> P- EI 2 | (G.6.20) |
Primaarsete alkoholide oksüdeerimisel tuleb tekkivat aldehüüdi kaitsta edasise oksüdeerumise eest karboksüülhappeks. Näiteks on võimalik reaktsioonisegust aldehüüdi pidevalt välja destilleerida: see on täiesti teostatav, kuna aldehüüdi keemistemperatuur on tavaliselt madalam kui vastava alkoholi keemistemperatuur. Sellegipoolest ületab aldehüüdide saagis dikromaadiga oksüdeerimisel harva 60%. Tähelepanuväärne on see, et kui reaktsioon on korralikult läbi viidud, ei mõjuta see peaaegu üldse mitut süsinik-süsinik sidet.
Aldehüüdid tekivad ka alkoholide kuumutamisel neutraalse dikromaadi vesilahusega, kuid ainult bensüülalkoholid annavad hea saagise.
Aldehüüdide suuremat saagist saab primaarsete alkoholide oksüdeerimisel tert-butüülkromaat (petrooleetris, benseenis või süsiniktetrakloriidis) või mangaandioksiid (atsetoonis, petrooleetris, süsiniktetrakloriidis või lahjendatud väävelhappes). Need reaktiivid võimaldavad saada hea saagisega ka küllastumata ja aromaatseid aldehüüde.
Sekundaarsete alkoholide oksüdeerimine ketoonideks on isegi lihtsam kui primaarsete alkoholide oksüdeerimine. Siin on saagised suuremad, kuna esiteks on sekundaarsete alkoholide reaktsioonivõime kõrgem kui primaarsetel ja teiseks on tekkivad ketoonid aldehüüdidega võrreldes palju vastupidavamad oksüdatsioonile. Steroidide ja terpeenide seerias on end hästi tõestanud sekundaarsete alkoholide oksüdeerimine kroomhappe ja püridiini kompleksiga, samuti kroomanhüdriidiga dimetüülformamiidis. Hea oksüdeerija on ka kroomanhüdriid atsetoonis; seda saab kasutada küllastumata sekundaarsete alkoholide oksüdeerimiseks, ilma et see mõjutaks mitmekordset süsinik-süsinik sidet.
Uus meetod, mis sobib ka takistatud alkoholide jaoks, on oksüdeerimine dimetüülsulfoksiidiga äädikhappe anhüdriidis.
Vastavalt alltoodud meetodile viiakse reaktsioon läbi kahefaasilises süsteemis. Moodustunud ketoonid ekstraheeritakse orgaanilise lahustiga ja kaitstakse seega edasise oksüdatsiooni eest.
disahhariidid- süsivesikud, mille molekulid koosnevad kahest monosahhariidi jäägist, mis on omavahel seotud kahe hüdroksüülrühma vastastikmõju tõttu.
Disahhariidimolekuli moodustumise protsessis eraldub üks veemolekul:
või sahharoosi jaoks:
Seetõttu on disahhariidide molekulaarne valem C 12 H 22 O 11.
Sahharoosi moodustumine toimub taimerakkudes ensüümide mõjul. Kuid keemikud on leidnud viisi, kuidas rakendada paljusid reaktsioone, mis on osa eluslooduses toimuvatest protsessidest. 1953. aastal viis prantsuse keemik R. Lemieux esimest korda läbi sahharoosi sünteesi, mida tema kaasaegsed nimetasid "orgaanilise keemia Everesti vallutamiseks".
Tööstuses saadakse sahharoosi suhkruroo mahlast (sisaldus 14-16%), suhkrupeedist (16-21%), aga ka mõnest teisest taimest, näiteks kanada vahtrast või pirnist.
Kõik teavad, et sahharoos on kristalne aine, millel on magus maitse ja mis lahustub vees hästi.
Suhkruroomahl sisaldab süsivesikuid sahharoosi, mida tavaliselt nimetatakse suhkruks.
Saksa keemiku ja metallurgi A. Marggrafi nimi on tihedalt seotud peedist suhkru valmistamisega. Ta oli üks esimesi teadlasi, kes kasutas oma keemiauuringutes mikroskoopi, millega avastas 1747. aastal peedimahlas suhkrukristallid.
Laktoos - kristalne piimasuhkur, saadi imetajate piimast juba 17. sajandil. Laktoos on vähem magus disahhariid kui sahharoos.
Nüüd tutvume süsivesikutega, millel on keerulisem struktuur - polüsahhariidid.
Polüsahhariidid- kõrgmolekulaarsed süsivesikud, mille molekulid koosnevad paljudest monosahhariididest.
Lihtsustatud kujul võib üldskeemi esitada järgmiselt:
Nüüd võrdleme tärklise ja tselluloosi - polüsahhariidide olulisemate esindajate - struktuuri ja omadusi.
Nende polüsahhariidide polümeeriahelate struktuuriüksus, mille valem on (C 6 H 10 O 5) n, on glükoosijäägid. Struktuuriüksuse koostise (C 6 H 10 O 5) kirja panemiseks tuleb glükoosi valemist lahutada veemolekul.
Tselluloos ja tärklis on taimset päritolu. Need moodustuvad polükondensatsiooni tulemusena glükoosi molekulidest.
Polükondensatsioonireaktsiooni võrrandi ja polüsahhariidide hüdrolüüsi pöördprotsessi saab tinglikult kirjutada järgmiselt:
Tärklise molekulidel võib olla nii lineaarne kui ka hargnenud struktuur, tselluloosi molekulidel võib olla ainult lineaarne struktuur.
Joodiga suhtlemisel annab tärklis erinevalt tselluloosist sinise värvi.
Neil polüsahhariididel on ka taimerakus erinevaid funktsioone. Tärklis toimib varutoitainena, tselluloos täidab struktuurset, ehitusfunktsiooni. Taimerakkude seinad koosnevad tselluloosist.
KANNITSEREAKTSIOON, oksüdeeriv-redutseeriv aldehüüdide disproportsioon leelise toimel primaarsete alkoholide ja karboksüülhapete moodustumisega, näiteks:
Aldehüüdi töödeldakse konts. leelise vesi- või vesi-alkoholilahus jahutamisel või vähesel kuumutamisel Katalüsaatorid - lagunevad. metallid (nt Ag, Ni, Co, Cu) ja nende oksiidid. Aldehüüdid, mis ei sisalda karbonüülrühma a-asendis aatomit H, sisenevad p-iooni. Vastasel juhul ei ole eelistatav mitte Cannizzaro reaktsioon, vaid aaldooli kondensatsioon. Aromaatse ringi elektrone eemaldavad asendajad. aldehüüdid kiirendavad protsessi, elektronidoonorid aga aeglustavad. Orto-asendis asendajatega bensaldehüüdid ei reageeri Cannizzaros; o- ja p-hüdroksübensaldehüüdid reageerivad ainult nende juuresolekul. Ag. R-siooni kahe razl.aldehüüdi kasutamisega (nn rist Cannizzaro reaktsioon) kasutab Ch. arr. et saada aromaatsest kõrge primaarsete alkoholide saagis. aldehüüdid. Sel juhul toimib formaldehüüd tavaliselt redutseeriva ainena:
ArCHO + CH 2 O: ArCH 2 OH + HCOOH
Polühüdroksümetüülitud Comm. formaldehüüd osaleb aldooli kondensatsiooni esimeses etapis ja seejärel redutseerijana Cannizzaro ristreaktsioonis:
Cannizzaro reaktsiooni kavandatud mehhanism Homogis. keskkond hõlmab hüdriidiülekande etappi
Aromaatseks aldehüüdid, ei saa välistada ühe elektroni ülekande tulemusena tekkinud radikaalanioonide Cannizzaro reaktsioonis osalemise võimalust. Sarnaselt Cannizzaro reaktsioonile viiakse R-sioon läbi intramooliga. a-ketoaldehüüdide disproportsioon. leelised (Cannizzaro ümberkorraldus):
Cannizzaro reaktsiooni kasutatakse ballil. pentaerütritooli süntees, alkoholide, karboksüülhapete jne preparatiivne tootmine.R-tion avastas S. Cannizzaro 1853. aastal.
Pürrool, furaan ja tiofeen on ühe heteroaatomiga viieliikmelised heterotsüklilised ühendid.
Aatomite nummerdamine heterotsüklis algab heteroaatomist ja kulgeb vastupäeva. Asendeid 2- ja 5- nimetatakse a-positsioonideks, 3- ja 4- b-positsioonideks.
Formaalsete tunnuste kohaselt on need ühendid aromaatsed, kuna need on konjugeeritud tsüklilised p-süsteemid, mis sisaldavad 6p elektroni - 4 dieenisüsteemi elektroni - ja heteroaatomi elektronide paari. Tsükkel on praktiliselt tasapinnaline, mis tähendab, et heteroaatomi hübridisatsiooniseisund on lähedane sp 2 -le.
Allpool on esitatud resonantsstruktuurid, mis illustreerivad heteroaatomi elektronide delokaliseerumist piki heterotsüklilist ringi, kasutades näitena furaani.
Ülaltoodud resonantsstruktuurid näitavad, et heteroaatom (antud juhul hapnikuaatom) kannab dieeni π-süsteemiga mesomeerse interaktsiooni tulemusena tsüklile üle elektrontiheduse, mille tulemusena tekib sellel teatud negatiivne laeng. süsinikuaatomid heterotsüklis ja hapnikuaatomil vastavalt positiivse laengu laeng. Hapnikuaatomil on lisaks positiivsele mesomeersele efektile loomulikult ka negatiivne induktiivne toime. Selle avaldumine vaadeldavate ühendite omadustes on aga vähem väljendunud ja seetõttu nimetatakse ühe heteroaatomiga viieliikmelisi heterotsükleid p-liiga aromaatseteks heterotsüklilisteks ühenditeks. Resonants toob kaasa heterotsükli sidemepikkuste mõningase ühtluse, mis viitab ka süsteemi teatud aromaatsusele.
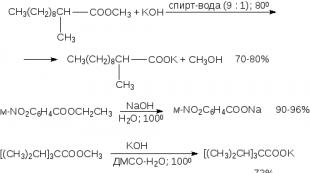
Estrite hüdrolüüsi katalüüsivad nii happed kui ka alused. Estrite happeline hüdrolüüs viiakse tavaliselt läbi kuumutamisel vesinikkloriid- või väävelhappega vesi- või vesi-alkoholikeskkonnas. Orgaanilises sünteesis kasutatakse estrite happelist hüdrolüüsi kõige sagedamini mono- ja dialküülasendatud maloonestrite puhul (17. peatükk). Maloonestri mono- ja diasendatud derivaadid läbivad kontsentreeritud vesinikkloriidhappega keetmisel hüdrolüüsi, millele järgneb dekarboksüülimine.
Alusega katalüüsitud hüdrolüüsiks kasutatakse tavaliselt NaOH või KOH vesi- või vesi-alkoholilahust. Parimad tulemused saadakse kaaliumhüdroksiidi õhukese suspensiooni kasutamisel DMSO-s, mis sisaldab väikest kogust vett.

Viimast meetodit eelistatakse takistatud hapete estrite seebistamiseks, teiseks selle meetodi modifikatsiooniks on takistatud estrite aluseline hüdrolüüs 18-kroon-6-polüestri juuresolekul:

Preparatiivsetel eesmärkidel on aluselise katalüüsiga hüdrolüüsil happelise hüdrolüüsi ees mitmeid selgeid eeliseid. Estrite aluselise hüdrolüüsi kiirus on tavaliselt tuhat korda kiirem kui happekatalüüsil. Hüdrolüüs happelises keskkonnas on pöörduv protsess, erinevalt hüdrolüüsist aluse juuresolekul, mis on pöördumatu.
18.8.2.A. Estri hüdrolüüsi mehhanismid
Estrite hüdrolüüs puhta veega on enamikul juhtudel pöörduv reaktsioon, mille tulemuseks on karboksüülhappe ja lähteestri tasakaaluline segu:

See reaktsioon happelises ja aluselises keskkonnas kiireneb oluliselt, mis on seotud happe-aluse katalüüsiga (3. peatükk).
K. Ingoldi järgi klassifitseeritakse estri hüdrolüüsi mehhanismid järgmiste kriteeriumide järgi:
(1) Katalüüsi tüüp: happeline (tähis A) või aluseline (tähis B);
(2) Lõhustamise tüüp, mis näitab, milline kahest estri -C-O sidemest reaktsiooni tulemusena lõhustub: atsüülhapnik (indeks AC) või alküülhapnik (indeks AL):

(3) Reaktsiooni molekulaarsus (1 või 2).
Nendest kolmest kriteeriumist saab teha kaheksa erinevat kombinatsiooni, mis on näidatud joonisel 18.1.

Need on kõige levinumad mehhanismid. Leeliseline seebistamine on peaaegu alati tüüpi B AC 2. Happelisel hüdrolüüsil (nagu ka esterdamisel) on enamikul juhtudel A AC 2 mehhanism.

AAC 1 mehhanismi täheldatakse tavaliselt ainult tugevalt happelistes lahustes (näiteks kontsentreeritud H 2 SO 4-s) ja see on eriti levinud steeriliselt takistatud aromaatsete hapete estrite puhul.
BAC 1 mehhanism on siiani teadmata.

BAL 2 mehhanism leiti ainult erakordselt tugevate ruumiliselt sõelutud atsüülrühmade ja -laktoonide neutraalse hüdrolüüsi korral. A AL 2 mehhanism on siiani teadmata.

Vastavalt mehhanismile reageerivad AL 1 tavaliselt tertsiaaralküülestrid neutraalses või happelises keskkonnas. Samad substraadid võivad sarnastes tingimustes reageerida vastavalt B AL 1 mehhanismile, kuid veidi aluselisemasse keskkonda üleminekul asendub B AL 1 mehhanism kohe B AC 2 mehhanismiga.
Nagu skeemilt 18.1 näha, on hapete poolt katalüüsitud reaktsioonid pöörduvad ja mikroskoopilise pöörduvuse põhimõttest (peatükk 2) järeldub, et ka happega katalüüsitud esterdamine toimub sarnaste mehhanismide kaudu. Aluskatalüüsiga aga nihkub tasakaal hüdrolüüsi (seebistamise) suunas, kuna tasakaal nihkub karboksüülhappe ionisatsiooni tõttu. Vastavalt ülaltoodud skeemile on mehhanismi A AC1 korral COOR ja COOH rühmad protoneeritud alkoksü- või hüdroksüülhapniku aatomi juures. Üldiselt on termodünaamika seisukohalt soodsam karbonüülhapniku, C=O rühma protoneerimine, kuna sel juhul saab positiivse laengu kahe hapnikuaatomi vahel ümber paigutada:

Sellele vaatamata sisaldab lahus väikestes kogustes ka tautomeerset katiooni, vajalikku vaheühendit A AC 1 mehhanismis.Mõlemad B1 mehhanismid (millest B AC 1 pole teada) ei ole tegelikult üldse katalüütilised, sest neutraalse dissotsiatsioon eeter esineb alguses.
Kaheksast Ingoldi mehhanismist on eksperimentaalselt tõestatud vaid kuus.
MÄÄRATLUS
Orgaanilised ühendid, mis on karboksüülhapete derivaadid, mis tekivad viimaste interaktsioonil alkoholidega:
Estrite struktuurivalem üldiselt:

kus R ja R' on süsivesinikradikaalid.
Estrite hüdrolüüs
Estrite üks iseloomulikumaid võimeid (lisaks esterdamisele) on nende hüdrolüüs – lõhustumine vee toimel. Teisel viisil nimetatakse estrite hüdrolüüsi seebistamiseks. Erinevalt soolade hüdrolüüsist on see antud juhul praktiliselt pöördumatu. Eristada estrite aluselist ja happelist hüdrolüüsi. Mõlemal juhul moodustuvad alkohol ja hape:
a) happeline hüdrolüüs

b) leeliseline hüdrolüüs

Näited probleemide lahendamisest
NÄIDE 1
| Harjutus | Määrake äädikhappe mass, mida on võimalik saada etüülatsetaadi seebistamisel massiga 180 g. |
| Lahendus | Kirjutame äädikhappe etüülestri hüdrolüüsi reaktsioonivõrrandi brutovalemi abil: C 4 H 8 O 2 + H 2 O ↔ CH 3 COOH + C 2 H 5 OH. Arvutage etüülatsetaadi aine kogus (moolmass - 88 g / mol), kasutades probleemi tingimustest saadud massi väärtust: υ (C 4 H 8 O 2) \u003d m (C 4 H 8 O 2) / M (C 4 H 8 O 2) \u003d 180/88 \u003d 2 mol. Vastavalt reaktsioonivõrrandile on etüülatsetaadi ja äädikhappe moolide arv: υ (C 4 H 8 O 2) \u003d υ (CH 3 COOH) \u003d 2 mol. Seejärel saate määrata äädikhappe massi (moolmass - 60 g / mol): m (CH 3 COOH) = υ (CH 3 COOH) × M (CH 3 COOH) = 2 × 60 = 120 g. |
| Vastus | Äädikhappe mass on 120 grammi. |
Estrid nimetatakse üldvalemiga karboksüülhapete funktsionaalseteks derivaatideks RC(O)VÕI" .
Karboksüülhapete (nagu ka sulfoonhapete) estreid nimetatakse sarnaselt sooladele, ainult et katiooni nimetuse asemel kasutatakse vastava alküüli või arüüli nimetust, mis asetatakse aniooni nime ette ja kirjutatakse kokku sellega. Estrirühma -COOR olemasolu võib väljendada ka kirjeldavalt, näiteks "(sellise ja sellise) happe R-ester" (see meetod on oma kohmakuse tõttu vähem eelistatud):
Madalamate alkoholide ja karboksüülhapete estrid on lenduvad vedelikud, meeldiva lõhnaga, vees halvasti lahustuvad ja enamikus orgaanilistes lahustites hästi. Estrite lõhnad meenutavad erinevate puuviljade lõhnu, mistõttu toiduainetööstuses valmistatakse neist essentse, mis matkivad puuviljalõhna. Estrite suurenenud lenduvust kasutatakse analüütilistel eesmärkidel.
Hüdrolüüs. Atsüülimisreaktsioonidest kõige olulisem on estrite hüdrolüüs alkoholi ja karboksüülhappe moodustumisega:
Reaktsioon viiakse läbi nii happelises kui leeliselises keskkonnas. happega katalüüsitud estri hüdrolüüs - esterdamise pöördreaktsioon, toimub sama mehhanismi järgi A AC 2:
Selle reaktsiooni nukleofiil on vesi. Tasakaalu nihe alkoholi ja happe moodustumise suunas tagatakse liigse vee lisamisega.
Leeliseline hüdrolüüs on pöördumatu, reaktsiooni käigus kulub eetri mooli kohta üks mool leelist, st leelis toimib selles reaktsioonis tarbitava reagendina, mitte katalüsaatorina:
Estrite hüdrolüüs in aluseline keskkond kulgeb bimolekulaarse atsüülmehhanismi B kaudu AC 2 tetraeedrilise vaheühendi (I) moodustumise kaudu. Aluselise hüdrolüüsi pöördumatuse tagab karboksüülhappe (II) ja alkoksiidiooni (III) praktiliselt pöördumatu happe-aluse interaktsioon. Saadud karboksüülhappe (IV) anioon on ise üsna tugev nukleofiil ja seetõttu ei allutata nukleofiilsele rünnakule.
Estrite ammonolüüs. Amiide saadakse estrite ammonolüüsi teel. Näiteks ammoniaagi vesilahuse toimel dietüülfumaraadile moodustub täielik fumaarhappeamiid:
Estrite ammonolüüsil madala nukleofiilsusega amiinidega muundatakse viimased kõigepealt leelis- või leelismuldmetallide amiidideks:

Karboksüülhapete amiidid: nomenklatuur; amiidrühma struktuur; happe-aluse omadused; happeline ja aluseline hüdrolüüs; poolitamine hüpobromiitide ja lämmastikhappega; dehüdratsioon nitriilideks; keemiline identifitseerimine.
Amiidid nimetatakse üldvalemiga karboksüülhapete funktsionaalseteks derivaatideks R-C(O)-NH2-n R"n, kus n = 0-2. Asendatud amiidides on atsüüljääk ühendatud asendamata aminorühmaga, N-asendatud amiidides on üks vesinikuaatomitest asendatud ühe alküül- või arüülradikaaliga, N,N-asendatud - kahega.
Ühendeid, mis sisaldavad ühte, kahte või kolme lämmastikuaatomiga seotud atsüülrühma, nimetatakse üldiselt amiididena (vastavalt primaarseteks, sekundaarseteks ja tertsiaarseteks). Asendamata rühmaga - NH2 - primaarsete amiidide nimetused on tuletatud vastavate atsüülradikaalide nimedest, asendades järelliide -õli (või -üül) -amiidiga. -karboksüülhappe sufiksiga hapetest moodustunud amiidid saavad järelliite -karboksamiid. Sulfoonhapete amiide nimetatakse ka nende vastavate hapete järgi, kasutades järelliidet -sulfoonamiid.
RCO-NH- (nagu ka RSO 2 -NH-) radikaalide nimed moodustatakse amiidide nimedest, muutes järelliide -amiid -amido-. Neid kasutatakse juhul, kui ülejäänud molekulis on vanem rühm või kui asendus toimub radikaali R-st keerulisemas struktuuris:

N-asendatud primaarsete amiidide RCO-NHR" ja RCO-NR"R" (nagu ka sarnaste sulfoonamiidide) nimetustes on radikaalide R" ja R" nimetused märgitud enne amiidi nimetust sümboliga N. -:
Seda tüüpi amiide nimetatakse sageli sekundaarseteks ja tertsiaarseteks amiididena, mida IUPAC ei soovita.
N-fenüül-asendatud amiididele on antud nende nimedes järelliide -aniliid. Asendajate asukoht aniliinijäägis on näidatud numbritega koos joontega:
Lisaks on säilinud poolsüstemaatilised nimetused, milles liide -amiid on seotud karboksüülhappe ladinakeelse nimetuse (formamiid, atseetamiid) alusega, samuti mõned triviaalne nimetused nagu "aniliidid" (atsüülitud aniliinid) või "toluidiidid" (atsüülitud toluidiinid).
Amiidid on suhteliselt kõrgete ja selgelt eristatavate sulamistemperatuuridega kristalsed ained, mis võimaldab mõnda neist kasutada derivaatidena karboksüülhapete tuvastamiseks. Harvadel juhtudel on need vedelikud, näiteks sipelghappeamiidid - formamiid ja N,N-dimetüülformamiid - tuntud dipolaarsed aprotoonsed lahustid. Madalamad amiidid lahustuvad vees hästi.
Amiidid on üks hüdrolüüsile vastupidavamaid karboksüülhapete funktsionaalsed derivaadid, tänu millele on need looduses laialt levinud. Ravimitena kasutatakse palju amiide. Ligikaudu sajandi jooksul on meditsiinipraktikas kasutatud paratsetamooli ja fenatsetiini, mis on äädikhappe asendatud amiidid.
Amiidide struktuur. Amiidrühma elektrooniline struktuur on suures osas sarnane karboksüülrühma struktuuriga. Amiidrühm on p,π-konjugeeritud süsteem, milles lämmastikuaatomi üksik elektronide paar on konjugeeritud C=O π sideme elektronidega. Amiidrühma elektrontiheduse delokaliseerimist saab kujutada kahe resonantsstruktuuriga:
Konjugatsiooni tõttu on amiidides C-N side osaliselt topeltseotud iseloomu, selle pikkus on oluliselt väiksem kui üksiksideme pikkus amiinides, samas kui C=O side on mõnevõrra pikem kui C=O side aldehüüdides ja ketoonides. Amiidrühm konjugatsiooni tõttu on lameda kujundusega . Allpool on toodud N-asendatud amiidi molekuli geomeetrilised parameetrid, mis on määratud röntgendifraktsioonianalüüsi abil:

C-N sideme osaliselt topeltseotuse oluliseks tagajärjeks on üsna kõrge energiabarjäär selle sideme ümber pöörlemisel, näiteks dimetüülformamiidi puhul on see 88 kJ/mol. Sel põhjusel võivad amiidid, millel on lämmastikuaatomil erinevad asendajad, eksisteerida π-diastereomeeridena. N-asendatud amiidid esinevad valdavalt Z-isomeeridena:

N,N-diasendatud amiidide puhul sõltub E- ja Z-isomeeride suhe lämmastikuaatomiga seotud radikaalide mahust. Amiidide stereoisomeerid on konfiguratsiooniliselt ebastabiilsed, nende olemasolu on tõestatud peamiselt füüsikalis-keemiliste meetoditega ning üksikult on neid eraldatud vaid üksikutel juhtudel. Selle põhjuseks on asjaolu, et amiidide pöörlemisbarjäär ei ole endiselt nii kõrge kui alkeenide puhul, mille puhul see on 165 kJ/mol.
Happe-aluse omadused. Amiididel on nõrgad nii happelised kui aluselised omadused . Amiidide aluselisus jääb vahemikku -0,3 kuni -3,5 Pk BH+. Amiidide aminorühma vähenenud aluselisuse põhjuseks on lämmastikuaatomi üksiku elektronpaari konjugatsioon karbonüülrühmaga. Tugevate hapetega suhtlemisel protoneeritakse amiidid hapnikuaatomi juures nii lahjendatud kui ka kontsentreeritud happelahustes. Selline suhtlus on aluseks happeline katalüüs amiidi hüdrolüüsi reaktsioonides:
Esinevad asendamata ja N-asendatud amiidid nõrgad NH-happe omadused , mis on võrreldav alkoholide happesusega ja eemaldab prootoni ainult reaktsioonides tugevate alustega.
Happe-aluse interaktsioon on amiidide moodustumise aluseks molekulidevahelised kaaslased , mille olemasolu seletab amiidide kõrgeid sulamis- ja keemistemperatuure. Võimalikud on kahte tüüpi assotsieerunud ühendid: lineaarsed polümeerid ja tsüklilised dimeerid. Ühe või teise tüübi ülekaalu määrab amiidi struktuur. Näiteks N-metüülatseetamiid, mille puhul eelistatakse Z-konfiguratsiooni, moodustab lineaarse assotsieerunud ühendi ja laktaamid, millel on jäigalt fikseeritud E-konfiguratsioon, moodustavad dimeere:

N,N-diasendatud amiidid moodustavad dimeere kahe polaarse molekuli dipool-dipool interaktsiooni tõttu:

Atsüülimisreaktsioonid. Tugeva elektrone loovutava aminorühma olemasolu tõttu konjugeeritud amiidsüsteemis on karbonüüli süsinikuaatomi elektrofiilsus ja seega ka amiidide reaktsioonivõime atsüülimisreaktsioonides väga madal. Amiidide madal atsüülimisvõime on seletatav ka asjaoluga, et amiidioon NH2 - on halb lahkuv rühm. Atsüülimisreaktsioonidest on oluline amiidide hüdrolüüs, mida saab läbi viia happelises ja aluselises keskkonnas. Amiide on palju raskem hüdrolüüsida kui teisi karboksüülhapete funktsionaalseid derivaate. Amiidide hüdrolüüs toimub estrite hüdrolüüsiga võrreldes raskemates tingimustes.
Happeline hüdrolüüs amiidid - pöördumatu reaktsioon, mis põhjustab karboksüülhappe ja ammooniumisoola moodustumist:
Enamikul juhtudel toimub amiidide happeline hüdrolüüs vastavalt mehhanismile bimolekulaarne happe atsüülimine A AC 2 , st sarnane estrite happelise hüdrolüüsi mehhanismiga. Reaktsiooni pöördumatus on tingitud asjaolust, et ammoniaak või amiin muundatakse happelises keskkonnas ammooniumiooniks, millel ei ole nukleofiilseid omadusi:

Leeliseline hüdrolüüs Sama pöördumatu reaktsioon; selle tulemusena moodustub karboksüülhappe ja ammoniaagi sool või amiin:
Amiidide aluseline hüdrolüüs, nagu estrite hüdrolüüs, toimub läbi tetraeedriline mehhanism IN AC 2 . Reaktsioon algab hüdroksiidiooni (nukleofiili) lisamisega amiidrühma elektrofiilsele süsinikuaatomile. Saadud anioon (I) protoneeritakse lämmastikuaatomi juures ja seejärel moodustub bipolaarses ioonis (II) hea lahkuv rühm, ammoniaagi või amiini molekul. Arvatakse, et aeglane staadium on tetraeedrilise vaheühendi (II) lagunemine.
Aniliidide ja muude amiidide puhul, mille lämmastikuaatomi juures on elektrone eemaldavad asendajad, võib tetraeedrilise vaheühendi (I) lagunemine toimuda dianiooni (II) moodustumisega:

Lõhustamine lämmastikhappega. Lämmastikhappe ja muude nitroseerivate ainetega koostoimel muundatakse amiidid vastavateks karboksüülhapeteks saagisega kuni 90%.
Dehüdratsioon. Fosfor(V)oksiidi ja mõnede teiste reaktiivide (POC1 3, PC1 5, SOCl 2) toimel asendamata amiidid muudetakse nitriilideks:
![]()
47. Karboksüülhapped: halogeenimine Gell-Volhard-Zelinsky järgi, kasutades sünteesiks reaktsiooni a -hüdroksü ja a -aminohapped.
Alifaatsete karboksüülhapete halogeenimine.
Alifaatsed karboksüülhapped halogeenitakse α-asendis kloori või broomiga katalüütiliste koguste juuresolekul punane fosfor või fosforhalogeniidid (Gell-Volhard-Zelinsky reaktsioon ). Näiteks kui heksaanhapet broomitakse punase fosfori või fosfor(III)kloriidi juuresolekul, moodustub 2-bromoheksaanhape suure saagisega, näiteks:
Broomimist ei toimu mitte karboksüülhape ise, vaid sellest in situ moodustunud happekloriid. Happekloriidil on tugevamad CH-happe omadused kui karboksüülhappel ja see moodustab kergemini enoolvormi.
Enool (I) lisab broomi, moodustades halogeeni derivaadi (II), mis omakorda eraldab vesinikhalogeniidi ja muutub α-halogeeniga asendatud happehalogeniidiks (III). Viimases etapis regenereeritakse asendamata karboksüülhappe halogeniid.

Teisi heterofunktsionaalseid happeid sünteesitakse saadud α-halo-asendatud hapetest, kasutades nukleofiilseid asendusreaktsioone.