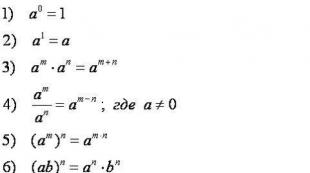Kuidas tiitrimine toimub. III jagu. Tiptimeetrilise analüüsi arvutused. Standardlahenduste ettevalmistamine
Paigaldamine pealkirja-üks tähtsamaid operatsioone laboratoorse tehnoloogia. Selle pealkirjaga lahenduse valmistamise õigsusest kadetakse analüüsi tulemusena. Pole vaja unustada, et näiteks tehases, mis põhineb andmete analüüsimisel, tehnoloogilise protsessi käigus kontrollimine ja vale analüüs võib olla ühe või teise tüsistuse asi. Kuna iga analüüs on peaaegu alati kaasas tiitrimisega, peab iga laboritöötaja õppima selle toimingu läbiviimise tehnikat.
On vaja mäletada mitmeid pealkirjaga lahendustega seotud eeskirju.
1. pealkirjaga lahendused peavad olema värsked. Pikaajaline säilitamine ei tohiks lubada. Iga lahenduse puhul on ladustamise tähtaeg.
2. Tiitratud lahendused, kui seistes oma tiitrit muuta, nii et neid tuleks mõnikord kontrollida. Kui nad teevad eriti vastutustundliku analüüsi, on lahenduse test vajalik.
3. pealkirjaga lahendused, millele valguse aktid - (AGNO3 lahused jne), tuleb hoida kollase pudelitega või sellisena, et kaitsta lahust valguse toime.
4. Mangaani kaaliumi mördite ettevalmistamisel tuleks tiiter paigaldada mitte varem kui 3-4 päeva pärast toiduvalmistamist. Sama kehtib kõigi teiste teiste lahenduste suhtes, mis on võimelised aja jooksul muutma või õhu, klaasi jne kokkupuudet.
5. Tiidud leelise lahendused on paremad säilitada parafiinis kaetud pudelites, samuti kaitsta neid õhu süsinikdioksiidi toime (CLLOBE toru Natron lubja või ASCA-RIT-ga),
6. Kõik pudelid pealkirjaga lahendustega peab olema selge pealkiri, mis näitab aine, normaalsust, parandusi, lahenduse tegemise aega ja katsekontrolli kuupäeva.
7. happeliste või leelislahuste tiitrimisel on kasulik kohaldada nn tunnistaja lahendust.
Tiitrimise ajal tuleb kolb hoida vasakule ja parem käsi Hallake büraase kraana, andes vedeliku ühtlaselt. Kui tiitrimine on väga suur tähtsus Selle kiirus on selle kiirus. Seetõttu on sama lahenduse korduva tiitrimise korral vajalik, et büreti lahuse lisamise kiirus on võimaluse korral sama, s.o teatud kogus vedela voolab samal ajal. Käe asend, kui tiitrimine on näidatud joonisel fig. 352.
Titratav lahenduse segamiseks on see väga mugav "magnetiliste segude muutmiseks. Sellisel juhul võib tiitrimist läbi viia nii tavapärases koonilises kolvis kui ka eriliseks, mis on kohandatud temperatuuriga vedelike tiitrimiseks.
Analüütilise tööga tuleks palju tähelepanu pöörata arvutustele. Nad ei tundu keeruliseks, kui algusest peale töö, et õppida kõiki arvutusi aluseks olevaid mõisteid, st pealkirja, normaalsuse ja grammi ekvivalentide mõisted ning nende vahelised suhted.
Näiteks, kui võetakse mõni soovitud aine proov, on valmis lahuse tiiter t haakeseadmega võrdne agaLahuse maht (V) jagatuna:
Joonis fig. 352. Käte asukoht tiitrimisel.
a. \u003d T * 1000 g
Normaalsust saab arvutada, kui proov on tuntud aga ja grammi ekvivalentide lahustuva aine
Kui lahus valmistatakse teises mahus, väiksem või suurem kui 1000 ml, arvutatakse meeleolu 1 l 1 l ja seejärel vormindamise valem moodustab vormi 
See valem võimaldab arvutada lahenduse normaliseerumist võtmisest hooldusest sõltumata selle mahust. Tiiteri, grammi ekvivalendi ja normaalsuse vahel on lihtne sõltuvus:

Mõnikord on arvutused, normaalsuse või normaalsuse koefitsiendi muudatused K. Käesolev muudatusettepanek on teoreetilise (MA) tiitri tiiteri tiite suhe: \\ t

See muudatus näitab mis tahes koguse milliliitrid täpselt tavaline lahus vastab 1 ml sellele lahusele. Pärast tiitrimistulemuste (ml) korrutamisel manustatakse saadud mahtu teatud kontsentratsioonile, näiteks 0,1 N. lahusti.
Kuid normaliseerumise muutmise kasutamise otstarbekus on väga kaheldav, kuna kõiki arvutusi saab edukalt teha ilma selle muudatuseta, vaid keerulise arvutamiseta.
Tavaliste lahendustega töötamisel langeb probleem alati tundmatu lahenduse normaalsuse kindlaksmääramiseks ja seejärel määrata lahuses sisalduva tundmatu aine arv. Seega on peamine hinnanguline analüütiline valem kõikide mõõtemõisted

s.o toote normaalsuse tuntud lahenduse maht teadaoleva lahenduse kui reaktsiooni lõpp on alati võrdne toote normaalsusega tundmatu lahuse mahule. See toode näitab reageeritavate ainete ekvivalentide arvu. Siit saate määrata tundmatu lahenduse normaalsuse A2, mis on võrdne

(2)
Kui N2 väärtus on tuntud, kasutage üldist valemit, et määrata haridus (a) normaalsuse määramiseks;

(3)
Kuna analüüsi ülesanne on määrata väärtus A, selle valemite leitakse;

(4)
Või asendades N2 väärtuse valemiga (2), saame:

Ülaltoodud valemid võimaldavad kõik arvutused ilma parandusteta normaalseks, kuna eeldatakse, et seda saab väljendada terviku või murdosa numbriga. Peamine asi mis tahes arvutamisel, et leida ekvivalentide arv, mille korrutamine, mille koguse soovitud aine kogus saadakse alati samaväärse väärtusega.
Näide. Oletame, et seal oli proov 0,5000 g ore, mis sisaldas rauda. Pärast selle lahustamist ja lahjendati saadud lahusega 100 ml mõõtekolbi tiitrimiseks permangaplato-metro-meetodiga iga kord, kui nad võtavad 10 ml analüüsitud lahust.
Lahendus KMNO4-0.0495 N. Tiitrimine läks: 11.2; 11.1; 11.0; 11,1 ml KMNO4 lahust. Me võtame keskmiselt 11,1 ml. Lahuse normaalsus 11.1 0,0495 \u003d 10 * N2, kust

FE summa 100 ml lahuses (Gram ekvivalent FE antud juhul on 55,85):
Et väljendada raua sisaldus maagi protsentides protsentides, korrutatakse võrdsuse parempoolse poole Joo ja ore jagama valimisse, st

Tüsetteede analüüsi tehnikat
Nõusid.Mõõteballoonid Täida ligikaudse, täpsusega 1-2 ml, mõõtevedude.
Volumerkõlvikud Kasutatakse lahenduste valmistamiseks täpselt tuntud kontsentratsiooniga. Tavaliselt on aine suspensioon kvantitatiivselt üle kantakse mõõtmelisele kolbi, lahustatakse ja lahjendatakse veega kindlaksmääratud mahuga (näiteks 100 ml), mis piiras kaela ümmarguse märgisega (joon) vedeliku meniski alumine serv ei puuduta omadusi).
Pipetidkasutatakse valikuks ja edastamiseks täpse mahu lahendus ühest laev teise. Enne kasutamist pestakse pipetit, pestakse destilleeritud veega ja tingimata loputada sama lahendusega, mida mõõdetakse. Vastasel juhul lahjendatakse pipeti vesilahus analüüsile ja kontsentratsioon muutub. Pipette tööreeglid: Pipeti alumine ots on sukeldatud lahusesse ja imege lahus kummist pirniga ülemise auku kaudu. Kui vedeliku tase tõuseb üle joone kohal, kiiresti sulgege parempoolse sõrmega ülemine auk Ja eemaldage pipeti lahusest. Seejärel vabastatakse liigne lahendus hoolikalt meniscuse alumine serv ei lange liiniga kokkunäidatud pipeti. Sel hetkel, kui Meniscus puudutab rida, sõrme tihedalt pressitud ülemise ava pipeti ja peatada leke vedeliku. Täidetud pipetti kantakse tiitrimiseks kolbi. Selleks Kolbi hoitakse kallutatud asendis, pipeti omistab selle alumine ots kolvi seinu, kellel pipeti vertikaalselt. Kergelt vabastades indeksi sõrme, nad annavad lahenduse äravoolu, oodates umbes 15 sekundit ja eemaldada viimane tilk pipeti otsa puudutusega kolbi seinale. Ärge puhuge ega raputage pipeti vedeliku viimaseid tilkaKuna pipeti kalibreerimisel kasutatakse sildi asjaolu, et vedeliku vaba aegumise korral jääb see veidi seintele.
Bürood Esindavad omavalmistatud silindriline lõpetas laevade kraanaga või kummist katiku. Suured tegusid rakendatakse iga milliliitri ja väikeste võrra - 0,1 ml. Breettes kasutatakse tiitrimiseks tarbitava lahuse mahu mõõtmiseks. Enne töö, Büreti pestakse, seejärel loputati lahendus, mis on tite. Seejärel pannes klambrit kummist osa bürett, täis selle lahusega tiitrimisel above''0 '' '' '' '' 'i, täitke koostatud toru pärast õhku, see ei jää õhk. Pärast seda on madalam meniskis seatud to '' '' '' '' '' '' '' i, büreti liigse lahuse vabanemise vabastamist. Bürendis olevad loendid valmistatakse kuni 0,05 ml. Tagaplaanil takistab asjaolu, et matmis vedelikul on nõgus mencus. Sel põhjusel esile lugedes tuleb vedeliku tasandil täpne hoida. Vastasel juhul tehakse arv valesti. Iga annuse algab "0" '' '' '' '' 'i, sest see on parem, et kompenseerida büreti kalibreerimine vigu. Toodame lahendus büreti ole väga kiiresti (mitte kiiremini kui 3-4 tilka sekundis), muidu ei voolata seinad aega ja see osutub vale.
Standardlahenduste ettevalmistamine:
1. Tee standardse aine ja aine vahelise reaktsiooni võrrandi, mille kontsentratsioon tuleb paigaldada. Reaktsioonivõrrandi abil arvutatakse samaväärse (E) standardse aine molaarmass. Järgmisena arvutage mass standardse aine, mis on vajalik konkreetse kontsentratsiooni lahuse valmistamiseks, kasutades valemit kasutades antud kontsentratsiooni lahust:
kus C on lahuse ekvivalendi (normaliseerumise) molaarne kontsentratsioon; V on vajalik lahendus milliliitris.
2. Tehnomeetiliste kaalude puhul kaaluvad tühjade hõõrvade.
3. Tehnoloogiliste kaalude haakeseadiste kaalumine.
4. Analüütiliste kaalude haakeseadise kaalumine.
5. Kvantitatiivselt ilma kahjumiteta, et üle kanda haakeseadme beksiga mõõtekolbi kuiva lehtri kaudu (Pärast aine ülekandmist lehtrile kolbist mitte!). Kaaluge analüütiliste kaalude tühjade hõõrvade tahvliga.
6. Valmistage lahus.
Postitatud ref.rf
Selleks, esimene pesta jäägid alates lehtri kolbi eelnevalt tõsta lehtri olema vahe selle ja kolvi seinu. Lisage destilleeritud vee kolbi 1/3 - 1/2 selle mahuni ja kolvi sisu pöörleva liikumisega segatakse põhjalikult proovi täielikuks lahustamiseks. Tooge kalibreerimismärgile lahuse maht (alumine menisk), sulgege kolb pistikuga ja hoidmisega, segage see sõrmega, keerake kolbi kaelaga vähemalt 8 korda.
Proovide võtmine ja tiitrimine:
1. Valmistage ette maeka tööle. Selleks loputage büretti väikese koguse tiitriv lahusega, mida kasutatakse lahuse valamiseks. Pärast seda täitke bürett lahusega, mille lahuse lahusega on peaaegu tippu; Siis asendades klaasi all tema all ja avage klamber, täitke klambri all, täitke''Nosik '' '' 'bürood (joonistatud büraami toru), nii et selles ei ole õhumullid. Seadke tiitriv taset to '' '' '' '' 'i jaoks lahenduse alumistes menüüdes.
2. pealkirjas kolbi, vali eraldi osa tiitritav lahus (alikvootne), Eelloputusega pipetti valitud eemaldatakse lahusest veejääki saada. Lisage tiitrimisreaktiivide jaoks vajalikule kolvile, indikaatorisse.
3. tiitrimine. Selleks kolb titratum lahus pannakse statiivile all burest selliselt, et the''Nosik '' '' '' s büretid olete kolbi. Vasak käsi hoiab klambrit, parem käsi on kolv selle tippu jaoks, et mitte sulgeda lahus kolbi. Klamber ja ümmargused liikumised pidevalt segades Kolvi sisu tedeeritakse. Samal ajal vabastatakse bürettist bürenti kiiremini kui 3-4 tilka sekundis, vastasel juhul ei tühjendage seinad õigeaegselt ja selgub valeks. Samaväärsuse punkti jõudmisel (väliselt avaldub see lahuse värvi muutus) tiitrimise peatus. Eemaldage bürendis tiitrimisnäitu, mille täpsus on 0,05 ml ja kirjutage tiitrimahu laborisse logi. Tiitrimine toimub vähemalt kolm korda. Samal ajal peaksid tiitrimistulemused olema lähenev, ᴛ.ᴇ. Lahknevus ei tohiks ületada 0,1 ml. Kolme lähenemise tulemuste saamisel leiavad nad keskmise väärtuse ja arvutatakse analüüsitud lahuse kontsentratsioon. Juhul kui kolme tiitri tulemusena ei saavutata lähenemist, 4., 5. tiitrimist enne vastuvõtmist kolm lähenemist tulemust.
Tiitrimise tulemuste arvutused:
Tiitrantide keskmine mahu arvutamine Viige läbi valemi:
Standardse aine lahusti lastaarvandi samaväärse (normaalse) molaarse kontsentratsiooni arvutamine.Vastavalt ekvivalentide seadusele:
kus St.-RA - standardlahuse normaalsus; T - Tiitrantide normaalsus; V ST.R-RA - standardlahuse maht, mis on võrdne pipeti mahuga; V t - Tttrata maht on võrdne boose (V CF) keskmise taustandväärtusega.
Alates valemist (31) me väljendame molaarse kontsentratsiooni tiitrivastase ekvivalendi:
Määratud aine massi arvutamine lahuse määramiselviige läbi valemi:
kus C on tiitrivastane normaalne; E - määratud aine ekvivalendi molaarmass; V CP - kolme lähenemise tiitrimise tulemuste keskmine maht.
Tiitrimeetrilise analüüsi tehnika - kontseptsioon ja tüübid. Kategooria klassifikatsioon ja omadused "Tiitrimeetrihianalüüs Tehnika" 2017, 2018.
tutrimeetriline analüüs
Tutrimeetriline analüüs Ühendab kvantitatiivsete keemiliste analüüsi meetodite rühma, mis põhineb tiitrimisprotsessil. See seisneb mõõtmise mahu mõõtmisel reaktiivi lahuse tarbitud vastava koosmõjuga määratud ainega. Reaktiivse lahuse kontsentreerimise ja mahu järgi arvutatakse kindlaksmääratud aine sisaldus. Tiitrimeetrilise analüüsi meetodit kohaldatakse keskmiste ja suurte ainete kindlaksmääramiseks (üle 1%).
Tiptimeetrias kasutatavad reaktsioonid peaksid vastama järgmistele põhinõuetele:
- reaktsioon peaks olema kvantifitseeritud, st reaktsiooni tasakaalu konstant peaks olema piisavalt suur;
- Reaktsioon peab kiiresti läbima;
- vastuseid ei tohiks kõrvaltoimete voolu keeruline;
- Reaktsiooni lõppu peab olema võimalus.
Kui reaktsioon ei vasta vähemalt ühele neist nõuetest, ei saa seda kasutada tugrimeerses analüüsis.
Sõltuvalt määratluse aluseks olevate reaktsiooni liigist eristatakse järgmised tiitrilise analüüsi meetodid: happe-aluseline, redoks, sadestamine ja keeruline.
Lõpppunkti kuvamise meetodi kohaselt eristage visual, potentsiomeetriline, fotomeetriline, dispongomeetriline, amperomeetriline tingja jne
Sõltuvalt tiitrimise meetodist juhtub otsene, vastupidine, kaudne (asetäitja).
Tiitrimist saab läbi viia eraldage õõnsad ja pipeteerimised. Esimesel juhul tiitritakse kogu määratud aine kogus. Topirakkumise korral viiakse uuritud lahendus (või aine valim) kvantitatiivselt mõõtekolbi, toob märgise etiketile ja põhjalikult segatud. Järgmisena valitakse mõõtekolbi hulgast mitu paralleelsete tiitrikute proovi (alikvoodid).
Peamised terminid, mida kasutatakse tiitrimeetrilises analüüsis
Tiitrimine- lahenduse järk-järgult kontrollitava lahuse protsessi täpselt tuntud kontsentratsiooniga teise lahuse teatud mahuga.
Titrans (tiitritud, töölahendus) - Järgistatava lahendusel on täpselt tuntud kontsentratsioon.
Tiitritud lahendus - lahendus, kuhu tiitri kõrkjad.
Tutrimeetriline süsteem - söötmete ja tiitritava aine interaktsiooniga moodustatud ainete segu.
Võrdväärsuse punkt (t. er)- tiitrimise hetk, kui tiitrivate ekvivalentide arv on võrdne määratud aine ekvivalentide arvuga.
Indikaator- aine või seade, mida kasutatakse lõpliku tiitrimispunkti loomiseks, mis erineb tavaliselt samaväärsuse punktist.
Loopimise aste ( f.) - Tiitrimise ja tiitrimise tiitrimise ajal tulnud tiitrimise ja selle tiitrimise suhe, mis on määratud aine ekvivalentide esialgne summa: \\ t
Div_adblock129 "\u003e
Bürett liigitatakse CM3-ga jagunemisega ühe või kahe kümnendiku CM3 kaudu. Vastavalt süsteemi, on soovitatav väljendada mahud DM3 ja CM3, kuid vanad üksused on lubatud: liitrit ja milliliitrid. 1 liiter hõivab 1 dm3, 1 milliliitri - 1 cm3. Tavapärased büremed on 10, 25 ja 50 cm3 (ml) ja kolm digitaalset märki on kümneid, ühikuid ja kümnendikku Millila. Millilitra sajandikku määratakse ligikaudu.
Mõõtekultuuridel on tavaliselt mahutavus 25, 50, 100, 200, 250, 500 ja 1000 cm3 (ml). Pipetid valmistatakse tavaliselt 5, 10, 15, 20, 25, 50 cm3 (ml) abil.
Kasutades mõõtenõude, tuleb meeles pidada, et selle võimsus sageli ei vasta täpselt määratud. 1. klassi klassiruum, mille võimsus on rohkem kui 10 ml, sobib töötamiseks 0,1% täpsusega, 2 klassi nõusid lubatud kõrvalekaldeid kaks korda rohkem.
Büraami lahuse täitmine
Pure bürett täidetakse 1/3 tiitrilt, nad on veendunud katiku õiglusest ja õhu mulli puudumise tõttu. Selleks on büreti tõstuk ja avage klamber veidi. Kui vedelik on sujuv jet, ilma õhumullideta, bürett täidetakse õigesti. Büraami kallutamine ja keeramine, märg seina lahusega, pärast mida peaaegu kogu lahus tühjendatakse läbi nina. Enne tiitrimist paigaldatakse bürett rangelt vertikaalselt ja täidab tiitr-nulli. Samal ajal peaks vedeliku nõgusa osa meniski tase langema kokku skaala nulliga (nullosakond peaks olema silma tasemel) värvitu lahenduste puhul. Värvitud lahenduste puhul paigaldatakse Null meniski ülemine serv.
Mõõtmine pipettide lahendustega
Puhas pipeti kummist pirniga täidetakse tiitreeritud lahusega enne paisumise algust. Lõpetades tipptasemel sõrmega, pöördub pipett mitu korda, püüdes koguda kogu sisemist pinda sildi kohal. Digger lahendus.
Nüüd täitke pipeti kummist pirniga veidi üle sildi kohal. Eemaldage pirn, auk on kergelt kaetud sõrmega, "hoides" pipeti paaki silma tasemel, tühjendage hoolikalt liigne lahus, nii et vedeliku meniskis on nõgus märgisega nõgusa osaga. Pärast seda, auk pipeti klamber ja edastada see teisele anumale. Pipeti ülemine osa avaneb ja annavad vedelike rahulikult valada. Pärast vedeliku pipett varred, viimased tilgad tühjendatakse, puudutades anuma seina, kuhu vedelik valatakse. Seejärel võetakse pipeti välja, mitte pöörata tähelepanu vedelikule, mis jääb selles. Et puhuda vedeliku pipeti on võimatu.
Tootmisreeglid
Koht, kus tiitrimine toimub, peaks olema hästi valmistatud ja valgustatud. Büretiga statiivi baasil tuleb panna valge paberileht. Büretti tugevdatakse paralleelselt statiivi vardaga.
Tiitritakse väikeste osadega - langeb. Avage vasaku käega büreti klamber ja tiitrimise kolvil on õige, segades pidevalt selle sisu pöörleva liikumisega. Pärast lahuse lahkumist toodetakse fikseerivate osakondade loendurit 20-30 sekundi jooksul, et vedelik oleks võimeline büreti seintele voolava vedeliku äravoolu.
Tagaplaanil eemaldatakse allosas (värvitu lahendusi) või meniskuse peal (värvitud lahused) serva. Menisk peab olema silmade tasemel. Usaldusväärsete tulemuste saavutamiseks korratakse vähemalt kolm korda tiitrimist. Iga uuesti tiitrimine algab büreti null-loendusest.
Vigu
Kui tiitrimine, juhuslikud ja süstemaatilised vead on võimalik. Juhuslikud vead on seotud haakekihu mahu ja massi mõõtmisega, süstemaatiline (indikaator) ilmub siis, kui samaväärsuse punkti tiitrimise punkti punkt on vastuolus.
Mõõteveadlahendused Seal on tingitud ebatäpsuse mõõtmise lahused aine ja tiitr. Need on volditud ühe tilga mahust (V ~ 0,05 ml), mida tavaliselt lahuse üle kirjutatakse ja arvestite kalibreerimise viga (breetonid, pipetid, mõõtekolbid), milles ± (0,01 - 0,02) ml kõrvalekaldeid on lubatud. Suhteline tiitrimisviga sõltub kulutatud tiitriku või tiitrinud lahuse mahust ja on võrdne:
kus V on languse mahu summa (~ 0,05 ml) ja mahu kõrvalekalded
breettes (~ 0,02 ml) ja pipetid (~ 0,02 ml);
V on tiitritud lahuse või tiitr, ml.
Tutrimeetriline või maht, analüüs- kvantitatiivse analüüsimeetod reagendi T mahu (või massi) mõõtmisel, mis veedetakse reaktsioonile määratud ainega X-ga. Teisisõnu on tiitrilise analüüsi tiitrimisel põhinev analüüs.
Tutrimeetriliste analüüside laboratoorsete klasside eesmärk on praktiliste oskuste arendamine tostuetilise analüüsi tehnikale ja analüüsimeetodite statistilise töötlemise meetodite tegemisel konkreetsete kvantitatiivsete mõistete konsolideerimisele ja teoreetiliste teadmiste konsolideerimisele Tüüpilised arvelduste ülesanded iga teema jaoks.
Tüürianalüüsi meetodite teooria ja tavade teadmised on vajalikud analüüsimeetodite, muude keemiliste ja eriliste farmatseutiliste erialade (farmatseutilise, toksikoloogilise keemia, farmakognooja, farmatseutilise tehnoloogia (farmaatsia-, toksilisuse keemia, farmakognoosi, farmaatsiatehnoloogia ja tavade tundmine. Tutrimeetrilise analüüsi uuritud meetodid on farmakopöa ja neid kasutatakse laialdaselt narkootikumide kvaliteedi kontrollimise praktilises tegevuses.
Legend
A, X, T - mis tahes aine, määratud aine ja tiitr vastavalt;
m (a), m (x), t (t)- aine ja tiitritava aine määratud aine mass vastavalt G;
M (a), m (x), M (t)- mis tahes aine, kindlaksmääratud aine ja tiitri molaarmass vastavalt G / Mol;
n (a), N (x), N (t) - aine ja tiitritava aine määratud aine kogus vastavalt moolile;
Aine kogus on samaväärne mis tahes aine, määratud aine ja tiitriga, mooli;
 - aine ja tiitritava aine ja selle tiitri määratud aine lahuse maht, l;
- aine ja tiitritava aine ja selle tiitri määratud aine lahuse maht, l;
 - määratava aine alikvoodi fraktsiooni maht, mis on võrdne pipeti võimsusega, L;
- määratava aine alikvoodi fraktsiooni maht, mis on võrdne pipeti võimsusega, L;
 - Määratud aine analüüsitud lahuse maht, mis on võrdne kolbi võimsusega, l.
- Määratud aine analüüsitud lahuse maht, mis on võrdne kolbi võimsusega, l.
1. Tiitrimeetrifikatsioonide põhikontseptsioonid
analüüs
1.1. Tiitrimine- Aine määramise protsess X väikeste ainete järkjärgulise aine järkjärguline lisamine, milles see põhjustab punkti tuvastamise (hetkel), kui kõik aine X reageeris. Tutvus võimaldab teil leida aine X-i koguse teadaoleva aine koguse kohta, mis on harjunud selle punktiga (hetk), võttes arvesse asjaolu, et suhe x ja t reageerib stöhhiomeetriast või kuidagi erinevalt.
1.2. Tartrani- aktiivne reagendi t sisaldav lahus, millega tiitrimine toimub. Tavaliselt viiakse tiitrimine läbi, lisades analüüsitud lahusega kalibreeritud büreti tiitrikolbi tiitrike kolbi. Selles kolbis tiitrimise ees alikvootide jagamineanalüüsitud lahendus.
1.3. Alikvootide jagamine (alikvoot)- analüüsimiseks võetud analüüsitud lahenduse osa täpselt teadaolev osa. Sageli valib see kalibreeritud pipeti poolt ja selle mahtu tähistab tavaliselt sümboliga. V SS.
1.4. Samaväärsuse punkt (TE)- tiitrimise selline punkt (hetk), milles lisatud tiitr t suurus on samaväärne tiitritud aine H. Sünonüümide kogusega: stöhhiomeetriline punkt, teoreetiline lõpp-punkt.
1.5. Lõplik tiitrimispunkt (KTT) - tiitrimise punkt (hetk), milles mõne lahuse lahendus (näiteks selle värv) näitab märgatavat (teravat) muutust. CTT vastab enam-vähem te, kuid kõige sagedamini ei vasta see.
1.6. Indikaator- aine, mis näitab nähtavat muutust PE-s või selle lähedal. Täiuslikul juhul on indikaator olemas piisavalt madal kontsentratsioon oma ülemineku ajavahemikmitte
oluline number Tttrans T. terava nähtav muutus indikaatoris (näiteks selle värv) vastab KTT-le.
1.7. Indikaatoride ülemineku intervall- vesiniku ioonide, metallide või teiste ioonide kontsentratsiooni piirkond, mille jooksul silma suudab tuvastada varjus, värvuse, fluorestsentsi või muu omandi muutumise tõttu, mis on tingitud muutusest Kaks vastavat vormi indikaatorit. Seda ala väljendatakse tavaliselt kontsentratsioonide negatiivse logaritmi kujul, näiteks:  Redoxi indikaatorina on ülemineku intervall redoksi potentsiaali sobiv piirkond.
Redoxi indikaatorina on ülemineku intervall redoksi potentsiaali sobiv piirkond.
1.8. Pensionile jäämise astehelitugevus V. T)lisati Tiitri V (TE) tiitrivat, mis vastab te. Teisisõnu, rafineeritud lahuse aste on suhte koguse suhe algse koguse analüüsilahuses:

1.9. Tingitase- tellimus  tiitrantide liigi kontsentratsioon, näiteks 10 -1, 10 -2, 10 -3 jne.
tiitrantide liigi kontsentratsioon, näiteks 10 -1, 10 -2, 10 -3 jne.
1.10. Cuver -kontsentratsiooni kontsentratsiooni kontsentratsiooni sõltuvuse graafiline pilt (X) määratud ainega x või mõned seotud süsteemiga seotud omadused (lahus) T)lisatud tiitriv T. väärtuse C (x) tiitrimise ajal varieerub mitmel määral suurusjärgus, mistõttu tiitrimise kõver on sageli ehitatud koordinaatidesse:  Abscissa teljel hoiule lisatud Trante V maht T)või silmus kraadi /. Kui vastavalt koordinaat teljele panna tasakaalus kontsentratsioon (x) või intensiivsusega proportsionaalsete omaduste, siis saada lineaarne tiitrimise kõver.Kui Ordinati telg lükatakse edasi
Abscissa teljel hoiule lisatud Trante V maht T)või silmus kraadi /. Kui vastavalt koordinaat teljele panna tasakaalus kontsentratsioon (x) või intensiivsusega proportsionaalsete omaduste, siis saada lineaarne tiitrimise kõver.Kui Ordinati telg lükatakse edasi  või logaritmi intensiivsuse omadused proportsionaalne (x), siis saada logaritmiline (või monologeritmic) tiitrimise kõver.Tiitrimisprotsessi omaduste selgemaks identifitseerimiseks ja rakendatud eesmärkidel ehitatakse mõnikord diferentsiaal tiitrimise kõverad,abscissa telje paigaldamine Lisatud TTRANT V maht V T),ja mööda ordinate telje - esimene derivaat logaritmi kontsentratsiooni (või proportsionaalsete omaduste intensiivsuse) maht tiitri lisatud lisatud:
või logaritmi intensiivsuse omadused proportsionaalne (x), siis saada logaritmiline (või monologeritmic) tiitrimise kõver.Tiitrimisprotsessi omaduste selgemaks identifitseerimiseks ja rakendatud eesmärkidel ehitatakse mõnikord diferentsiaal tiitrimise kõverad,abscissa telje paigaldamine Lisatud TTRANT V maht V T),ja mööda ordinate telje - esimene derivaat logaritmi kontsentratsiooni (või proportsionaalsete omaduste intensiivsuse) maht tiitri lisatud lisatud:  Sellise tiitrimise kõverad kasutatakse tavaliselt füüsikalis-keemiliste meetodite puhul, näiteks potentsiomeetrilise tiitrimisega.
Sellise tiitrimise kõverad kasutatakse tavaliselt füüsikalis-keemiliste meetodite puhul, näiteks potentsiomeetrilise tiitrimisega.
1.11. Standardlahendus- toimeaine tuntud kontsentratsiooniga lahus.
1.12. Standardimine- aktiivse reaktiivi kontsentratsiooni leidmise protsess lahusesse (kõige sagedamini tiitrides selle vastava aine standardlahusega).
1.13. Hüpata- Sharp Change intervalliga kuidagi füüsikaliste või füüsikalis-keemiliste omaduste lahuse lähedale vastavuspunkti tavaliselt täheldatakse, kui 99,9-100,1% tiitrkandja lisatakse võrreldes selle stöhhiomeetrilise koguse.
1.14. Tühjade tiitrimine- lahuse tiitrimine, mis on identne analüüsitud lahusega mahu, happesuse, indikaator jne, kuid ei sisalda määratud ainet.
2. Tutrimeerse analüüsi põhioperatsioonid
2.1. Puhastamine, pesemine, mõõtenõude hoidmine.
2.2. Kontrollige roogade mõõtmisvõimalust.
2.3. Võttes haakeseade täpselt tuntud mass erinevuse tulemuste kahe kaalumise (tavaliselt analüütiliste kaalude).
2.4. Aine proovide võtmise koguseline üleviimine mõõtekolbi ja aine lahustumist.
2.5. Mõõtehoodude täitmine (kolvid, buretid, pipeti) lahendus.
2.6. Pipetide tühjendamine, bürood.
2.7. Analüüsitud lahuse alkvarafraktsiooni valik.
2.8. Tiitrimise tulemuste põhjal tiitrimine ja arvutused.
3. mõõtenõude kalibreerimine
Phrymeetrilises analüüsis mõõdetakse lahuse täpsemahu mõõdetakse mõõtenõude abil, mis kasutavad mõõtekollektoreid, mille võimsus on 1000, 500, 250, 100, 50 ja 25 ml, pipetid ja piged pipetsiga võimsusega 10, 5, 3, 2 ja 1 ml. Kolbide ja pipettide võimsus 20 ° C juures on graveeritud kolbi kaelale või pipeti külgpinnale (nominaalne maht). Mõõtetoite masstootmise korral võib kehtib (tõsi) maht mõõtmise kolvid, breetes, pipetid võivad erineda nominaalväärtustest märgitud nõusid. Tiitrimeetrimeetrilise analüüsi tulemuste vajaliku täpsuse saavutamiseks
Mõõtmeliste roogade kalibreerimine põhineb haavatava või valatud destilleeritud vee täpne massi määramisel, mis määratakse nõudmiste kaalumise tulemustega enne ja pärast infusiooni või vee valamist. Vee maht kalibreeritud roogades (selle võimsus) ja vee mass on seotud seoses:

kus  - Vee tihedus kogemustel, g / ml.
- Vee tihedus kogemustel, g / ml.
Vee tihedus sõltub temperatuurist, nii et andmete arvutamisel tuleks kasutada andmeid. 2-1.
Tabel 2-1.Vee tiheduse väärtused sobival temperatuuril

Mõõtekolbid kalibreeritakse infusioonina ja bürood ja pipetid - valamise jaoks, kuna valamise ajal väikesed vedeliku kogused jäävad alati roogade seintele.
3.1. Kontrollige, kas mõõdulaskide maht
Kolb on hoolikalt leotatud, kuivatatud ja kaalutakse analüütiliste kaaludega, mille täpsus on täpsusega ± 0,002, seejärel täitke see veega (siin ja täiendavalt destilleeritud) mööda alumist meniskust, eemaldage vee langus kolvi kaela ülaosas ja kaalutakse uuesti. Iga kaaluga tühjade kolbi ja kolb veega viiakse läbi vähemalt kaks korda, samas kui erinevus kahe kaalumise vahel ei tohiks ületada ± 0,005 g. Erinevus kolbi massi vahel veega ja tühja kolbi massi vahel on võrdne vee massiga, mis sisaldub kolvis antud temperatuuril. Kolbi tegelik võimsus arvutatakse vee massi keskmise väärtuse jagunemisega selle tihedusega kogemuste temperatuuril (vt tabel 2-1).
Näiteks kui kalibreerides mõõtekolbi nimimahuga 100 ml, keskmine väärtus veemassi keskmine väärtus temperatuuril 18 ° C on 99,0350. Seejärel tõeline võimsus mõõtekolbi on võrdne:
3.2. Kontrollige võimsuse büretti
Bürett on klaasilinder, mis sisemine läbimõõt võib mõnevõrra muuta piki pikkuse büretti. Erinevate osade võrdsed jaotused erinevates osades vastavad lahenduse ebavõrdsetele mahule. Sellepärast, kui büreti kalibreerimisel arvutatakse tõelised mahud büreti valitud sektsiooni jaoks.
Puhas ja kuivatatud bürett täidetakse veega nullmärkidega mööda alumist meniskust ja eemaldage vee tilka büroole ülemine osa sisepinnast filtripaberiga. Siis pohvid on asendatud matmise all, eelnevalt kaalutud kaanega analüütiliste kaaludega. Teatud koguse vett kuivatatakse aeglaselt hõõrumisse (näiteks 5 ml). Pärast seda suletakse prügikastid kaanega ja kaalutakse uuesti. Erinevus massi fuquis veega ja tühjad lahed on võrdne mass veega sisalduvad matmise vahele rajoonide 0 ja 5 ml kogemuste temperatuuril. Siis bürett täis veega täis veega nullmärkidega mööda alumist meniskust, valati aeglaselt 10 ml vett tühja binxi ja sarnane meetod määrab massi massi maandumise vahele rajoonides 0 ja 10 ml. Büreti kalibreerimisel viiakse läbi 25 ml sellist operatsiooni 5 korda ja mass vett, mis vastab nominaalsele mahule määratud matmi 5, 10, 15, 20 ja 25 ml arvutatakse. Iga kaaluga tühjade fuquis ja fuquis veega korrata vähemalt kaks korda, samas kui kahe kaalumise lahknevus ei tohiks ületada ± 0,005.
Siis tabelis. 2-1 Määrake vee tihedus kogemuste temperatuuril ja arvutada büra tegeliku mahutavuse iga selle nimetamata nominaalse mahu iga väärtus.
Saadud andmete põhjal arvutatakse muudatusettepaneku summa tegeliku suutlikkuse arvutatud väärtuse ja nominaalse bureti mahu vastava väärtuse vahel:

ja seejärel joonistage büreti büreti maht koordinaatides  (Joon. 2-1).
(Joon. 2-1).
Näiteks, kui büreti kalibreerimine mahuga 25 ml temperatuuril temperatuuril 20 ° C, saadi järgmised katseandmed, mis koos vastavate arvutuste tulemustega esitatakse tabelis. 2-2.
Saadud tabelite põhjal joonistage antud büreti sulgemiskõver, mille abil saate foorumite viide tulemusi täpsustada.
Tabel 2-2.Kalibreerimistulemused Buretti Maht 25 ml


Joonis fig. 2-1.Kõvera muudatused bürette korruptsioon
Näiteks laske 7,50 ml määratud aine alikvärti tiitrimiseks kulutatud tiitel. Kooskõlas ajakavaga (vt joonis 2-1) on selle nominaalse mahuga vastava muudatuse suurus 0,025 ml, tarbitud titrantide tegelik maht on: 7,50 - 0,025 \u003d 7,475 ml.
3.3. Pipettide kontrollimine
Puhas ja peatatud analüütiliste skaalade pipett on täis veega nullmärgiga alumise meniskile ja seejärel vee aeglaselt
plug piki seina eelnevalt kaalutud binches. Bure on suletud kaanega ja kaalutakse veega. Iga kaaluga tühjade fuquise ja veekoppi korratakse vähemalt kaks korda, samas kui kahe kaalumise vaheline lahknevus ei tohi ületada ± 0,005. Buse massi erinevus veega ja tühja Buquis on võrdne massiga pipeti sisaldav vesi. Pipeti tegelik võimsus arvutatakse vee keskmise massi jagamisega vee tihedusega kogemuste temperatuuril (vt tabel 2-1).
4. Tüüpilised arvutused tüptimeetrilises analüüsis
4.1. Tiptimeetrilise analüüsi arvutamiseks kasutatavate kontsentratsioonide väljendamise meetodid
4.1.1. Aine kontsentratsioon ainega (a), mol / L - kogus aine A mooli, sisalduva 1 liitri lahuses:
 (2.1)
(2.1)
kus  - aine A aine A lahustunud V (A) l
- aine A aine A lahustunud V (A) l
tahke aine.
4.1.2. Samaväärse aine molaarne kontsentratsioon  Mol / L on ühes liitris sisalduva aine ekvivalendi aine aine kogus (endine nimi on "normaalne" lahus):
Mol / L on ühes liitris sisalduva aine ekvivalendi aine aine kogus (endine nimi on "normaalne" lahus):
 (2.2)
(2.2)
kus  - aine kogus on samaväärne ja mooli,
- aine kogus on samaväärne ja mooli,
lahustatakse lahuse V (a) l;  - samaväärse molaarmass
- samaväärse molaarmass
a, g / mol; - aine samaväärsuse tegur.
4.1.3. Ainete tiitr T. A), g / ml - lahustunud aine A mass 1 ml lahuses sisalduva grammides:
4.1.4. Tutrimeetrilise faktori ümberarvutamine  I, G / ml - Määratud aine mass grammi interakteerub 1 ml tiitrikuga:
I, G / ml - Määratud aine mass grammi interakteerub 1 ml tiitrikuga:
(2.4)
4.1.5. Parandustegur F.- väärtus, mis näitab, mitu korda tiitri praktilised kontsentratsioonid erinevad tehnika määratletud vastavatest teoreetilistest väärtustest:
 (2.5)
(2.5)
4.2. Tiitrimeetrilise analüüsi kasutatavate reaktsioonide samaväärsete ainete molaarmassi arvutamine
Samaväärset nimetatakse reaalseks või tavapäraseks osakeseks, mis võib kinnitada või anda ühele vesiniku ioon H + (või olla muidu samaväärse happeliste reaktsioonidega) või kinnitada või anda ühele elektronile oksüdeerimisreaktsioonides.
Samaväärsuse tegur  - number, mis näitab, milline
- number, mis näitab, milline
samaväärsuse osa tegelikust osakest aine A. Samaväärsuse tegur arvutatakse selle reaktsiooni stöhhiomeetria alusel: 
kus Z.- kolme reaktiivse reaktsiooni (molekuli või ioon) ühe reageeriva osakese (molekuli või ioon) arvuga või kinnitatud prootoneide arv või üks reageeriva osakese (molekuli või ioon) poolt oksüdatsiooni või taaskasutamisel saadud elektronide arv.
Aine ekvivalendi molaarmass on ühe mooli ekvivalendi mass aine võrdväärsuse faktoriga, mis on materjali, g / mol. Seda saab arvutada valemiga:
 (2.6)
(2.6)
4.3. Lahuse valmistamine, lahjendades rohkem kontsentreeritud lahust tuntud kontsentratsiooniga
Thrymeetrilise analüüsi läbiviimisel Mõnel juhul on vaja valmistada aine ja mahu lahus  ligikaudu tuntud kontsentratsiooniga, lahjendades kontsentreeritud lahust.
ligikaudu tuntud kontsentratsiooniga, lahjendades kontsentreeritud lahust.
Kui lahus lahjendatakse veega, ei muudeta aine A või samaväärse aine kogust, seega vastavalt väljenditele (2.1) ja (2.2), saate kirjutada:
(2.7)  (2.8)
(2.8)
kui indeksid 1 ja 2 on vastavalt ja pärast lahjendamist lahendusi.
Saadud suhted arvutatakse rohkem kontsentreeritud lahuse maht  mida tuleb mõõta antud lahenduse valmistamiseks.
mida tuleb mõõta antud lahenduse valmistamiseks.
4.4. Ettevalmistus eelnevalt kindlaksmääratud mahu mahuga haakeseadis täpselt tuntud mass
4.4.1. Massiproovide arvutamine
Teoreetiline mass standardse aine A, mis on vajalik valmistamiseks antud mahu lahuse tuntud kontsentratsiooniga arvutatakse väljendite (2.1) ja (2.2). See on võrdne:
(2.9)
kui aine molaarne kontsentratsioon lahus lahust kasutatakse ja:
(2.10)
kui kasutatakse aine ekvivalendi molaarne kontsentratsioon lahusesse.
4.4.2. Valmistatud lahuse täpse kontsentratsiooni arvutamine
Aine lahuse kontsentratsioon MASS M (A) täpne massi järgi valmistatakse suhted (2.1-2,3), kus t a)- Aine praktiline mass A, mis on võetud analüütiliste kaalude kaaluga kahe erinevusega.
4.5. Tiitri kontsentratsiooni arvutamine standardimise ajal
Kuulsad standardlahenduste maht  kontsentratsiooniga
kontsentratsiooniga  tiitrida koos tiitri köite V lahusega v T)(või vastupidi). Sel juhul reaktsiooni voolava lahuses tiitrimisprotsessis
tiitrida koos tiitri köite V lahusega v T)(või vastupidi). Sel juhul reaktsiooni voolava lahuses tiitrimisprotsessis  Ekvivalentide seadusel on vorm:
Ekvivalentide seadusel on vorm:
ja 
Siit saadakse ekspressioon arvutada molaarse kontsentratsiooni tiitriv ekvivalent vastavalt tiitrimistulemustele:
 (2.12)
(2.12)
4.6. Määratud aine massi arvutamine analüüsitud lahuses4.6.1. Otsetäitmine
Analüüsitud lahuses määratud aine tiitritakse otse tiitr.
4.6.1.1. Arvutus, kasutades tiitri samaväärse molaarse kontsentratsiooni
Määratud aine lahuse laiali osa  tiitrima
tiitrima
trapit lahendus mahuga V (t). Sel juhul reaktsiooni voolava lahuses tiitrimisprotsessi ajal:

ekvivalentide seadusel on vorm:  ja
ja
(2.13)
Seega on kindlaksmääratud aine ekvivalentse aine molaarne kontsentratsioon arvutatud tiitrimise tulemuste kohaselt võrdne:
 (2.14)
(2.14)
Saadud ekspressioon asendatakse võrrandiga (2.2) ja saadakse aine materjali massi arvutamise valemiga kolbis  Otsese tiitrimise tulemuste kohaselt:
Otsese tiitrimise tulemuste kohaselt:
 (2.15)
(2.15)
Kui tiitrimine, osa tiitrivastast kulub reaktsiooni indikaator, "tühikäigu kogemus" viiakse läbi ja maht TTtranat V "(T) määratakse kindlaks,
näitaja tiitrimisele. Arvutamisel lahutatakse see maht tiitrri mahust, mis läks kindlaks määratud aine lahuse tiitrimisele. See muudatusettepanek tehakse "tühikäigulisi kogemusi" kõikide arvutatud valemitele, mida kasutatakse tüptimeetrilises analüüsis. Näiteks valemi (2.15) arvutamisel massi määratud aine, võttes arvesse "tühikäigul kogemus", vaadatakse:
(2.16)
4.6.1.2. Arvutus, kasutades tiitrimeetrilise ümberkulatsiooniguriga
Meil on analüüsitud lahendus  Alik-
Alik-
sõjalahusti  ainelahust tarbitakse mahuga V T)teoreetilise tüptimeetrilise ümberarvumisfaktoriga
ainelahust tarbitakse mahuga V T)teoreetilise tüptimeetrilise ümberarvumisfaktoriga  ja paranduskoefitsient F.Seejärel mass määrava aine alikvoodi fraktsioonis on võrdne:
ja paranduskoefitsient F.Seejärel mass määrava aine alikvoodi fraktsioonis on võrdne:
(2.17)
ja kogu analüüsitud mahus 
(2.18)
4.6.2. Asetäitja
 ilmselge reaktiiv A lisatakse ja asendaja asendaja vabaneb samaväärses aines:
ilmselge reaktiiv A lisatakse ja asendaja asendaja vabaneb samaväärses aines:

Asendaja tiitritakse sobiva tiitrina:

Asendusliitmise ekvivalentide seadus:

suhe (2.8) kasutamine võib kirjutada kujul:

Siit saadud valemiga arvutamise arvutamise molaarse kontsentratsiooni samaväärse aine lahuses vastavalt tulemuste asendamise tiitrimise:

millel on sama välimus nagu otsese tiitrimisega (2.14). Seetõttu on asendaja tiitrimise all analüüsitud probleemi all oleva aine massi massi arvutused valmistatud vastavalt valemitele (2.15-2,18) otsese tiitrimise jaoks. 4.6.3. Pöörde tiitrimine
Määratud aine alikvoodi fraktsioonile  lisama teatudesimese tontratta üleliigne
lisama teatudesimese tontratta üleliigne  :
:

Seejärel hõõrutakse teine \u200b\u200btontrant'i liigne reageerimata esimene tiitritav, see kulub mahust.  :
:

Seadus ekvivalente antud juhul saab kirjutada järgmiselt:

Siit arvutatakse lahuses aine X samaväärse molaarse kontsentratsioon: \\ t
 (2.19)
(2.19)
Saadud ekspressioon võrrandis (2.2) on asendatud ja valem saadakse kindlaksmääratud aine massi arvutamiseks analüüsitud lahuses, mis on võrdne kolbi mahuga, vastavalt pöörliku tiitrimise tulemustele:

5. Rakendamine ja praktilise töö pakkumine timetimeetrilise analüüsi kohta
5.1. Üldsätted
Jaotise "tiitrilise analüüsi" uurimisel nähakse ette järgmiste teemade töö.
Teema I.Happepõhi tiitrimise meetodid.
Teema II.Oksüdatsiooni ja taaskasutamise tiitrimise meetodid.
Teema III.Sademete tiitrimise meetodid.
Teema IV.Meetodid keerukas tiitrimise.
1. tund.Vesinikkloriidhappe ja selle standardimise lahuse valmistamine.
Õppetund 2.Leelismassi määramine lahuses. Karbonaadi masside määramine lahuses. Leelismasside ja karbonaadi määramine lahuses ühise kohalolekuga.
Õppetund 3.Ammoniaagi massi määramine ammooniumsoolade lahendustes.
a) katsekontroll 1.
b) ammoniaagi massi määramine ammooniumsoolade lahendamistes. Õppetund 4.Permanganateomeetriline tiitrimine.
a) Kirjalik testimine 1.
b) vesinikperoksiidi massi määramine lahuses.
c) Irandi (II) massi määramine soolalahuses. Irandi (II) massiosa määramine soolaproovis.
5. õppetund.Jodomeetriline tiitrimine.
a) vesinikperoksiidi massi määramine lahuses.
b) vase (II) massi määramine lahuses. Õppetund 6.Jodimeetri tiitrimine.
Õppetund 7.Bromatomeetriline tiitrimine. Arseeni massi määramine Iii)lahuses.
Õppetund 8.Bromomeetriline tiitrimine. Naatriumsalitsülaadi massilise fraktsiooni määramine valmistamisel.
Õppetund 9.Nitritromeetriline tiitrimine.
a) katsekontroll 2.
b) romaanide massiosa määramine ettevalmistamisel. Õppetund 10.Haarakianoferratomi ardentiomeetriline tiitrimine
tric tiitrimine.
a) Kirjalik testimine 2.
b) massi määramine mass kaaliumbromiidi ja kaaliumi jodiidi lahuses anumemeetrilise tiitrimise meetoditega.
c) tsingi massi määramine lahuses heksakianoferratomeetrilise tiitrimise teel.
Õppetund 11.Põhjalik määramine tsink ja plii mass lahendus.
a) katsekontroll 3.
b) tsingi ja lahuse pliidi massi määramine.
Õppetund 12.Raua (III) ja kaltsiumi täielik määramine lahuses.
a) Kirjalik testimine 3.
b) raua (III) ja kaltsiumi massi määramine lahuses.
Sõltuvalt konkreetsest olukorrast on mõned teosed lubatud mitte-ühel, kuid kahel klassil. Katsekontrollide ja kirjalike testide ajastuse ajastus on võimalik nihutada.
Lõpus iga teema, näited katseelemendid on antud vahepealse jälgimise üliõpilaste teadmisi, sisu lõpliku kirjaliku testi töö, näide pileti kirjutamise testi töö.
Iga okupatsiooni lõpus küsib üliõpilane protokolli, mis sisaldab tehtud töö kuupäeva ja nimetust, metoodika sisu, eksperimentaalsete andmete, arvutuste, tabelite, järelduste tegemise tööprotseduuri. Kõik analüüsi tulemuste arvutused (lahuse kontsentratsioon, määratud aine mass) õpilast teostatakse neljanda olulise numbri täpsusega, välja arvatud tekstis eriti määratletud juhtudel.
Praktiliste oskuste ja teoreetiliste teadmiste vahekontroll viiakse läbi katsekontrolli ja kirjalike testide abil.
5.2. Tutrimeetrilise analüüsi materjal
Klaasnõud:büremed, mille võimsus on 5 ml, mõõtmete pipetit, mille võimsus on 2 ja 5 ml, mõõtekolbid, mille mahutavus on 25, 50, 100 ja 250 ml, koonilised kolvid, mille võimsus on 10-25 ml, klaaskütused, klaaskütused Läbimõõduga 20-30 mm, kolvid tavalisest või tumeda klaasist mahutavus 100, 200 ja 500 ml, mõõteballoonid mahuga 10, 100 ml.
Reaktiivid:töö rakendab kvalifikatsiooni reagente "H.C." ja "CH.D.A.", indikaatorpaber.
Seadmed:kaalud analüütilised mitme kaaluga, tehniliste skaalaga, mitme kuivatuskapi, laboratoorse termomeetriga, skaalal 20-100 ° C, statiivid jälgedes, et tagada asbestivõrkude, gaasipõletid, veevannid ja rõngad.
Abiaterjalid ja tarvikud:detergentide (sooda, pesuvahend pulbrid, kroomi segu), röstimine roogasid, kummist pirnid, asbesti võrgusilma, kirjatarvete liim, klaaspöörad, filterpaber.
Bibliograafia
1. Positsioon õpilastele jaotises "tiitrimianalüüs".
2.Kharitonov Yu.yu.Analüütiline keemia (Analytics): 2 t.- ed. 5th - m.: Kõrgkool, 2010 (edaspidi "juhendaja").
3.Lurie yu.yu.Analüütilise keemia käsiraamat. - M.: 1989. aasta keemia (edaspidi "kataloog").
4.Dzhabarov d.n.Analüütilise keemia harjutuste ja ülesannete kogumine. - M.: Vene arst, 2007.
III jagu
Tiptimeetrilise analüüsi arvutused
1. Edasaväärse aine molaarmassi arvutamine
Samaväärne nad viitavad aine tegelikule või tingimuslikule osakesele, mis selles happepõhjalistes reaktsioonis on samaväärne ühe vesiniku iooniga või oksüdatsiooni taastumise reaktsiooniga - ühe elektroniga.
Samaväärsuse tegur fecw. A) \u003d 1 / z - number, mis näitab, millist samaväärsust on pärit tõelise osakese aineAGA, See arvutatakse selle reaktsiooni stöhhiomeetria alusel.
Molari massi ekvivalent Ained A, M (1 / ZA) - mass ühe palvetamise samaväärse aineAGA
M (1 / za) \u003d 1 / zm (a).
Sisse happe-põhilised reaktsioonid Ühes HCI molekulis osaleb reaktsioonis üks vesinikuaatom, nii et HCI ekvivalent on võrdne HCI molekuliga ja fEX.(HCl) \u003d 1; Ühes NaOH-molekulis osaleb reaktsioonis üks ioon, mistõttu NaOH on NaOH molekuliga samaväärne ja fEX.(NaOH) \u003d 1.
H3PO4 + 2NAOH reaktsioonis → Na2nro4 + 2N2O
Üks H3RO4 molekul reageerib kahe molekuliga või kahe ekvivalendiga NaOH-ga, seetõttu fEX.(H3RO4) \u003d ½ ja m (½N3RO4) \u003d ½M (H3RO4) \u003d 49,00 g / mol.
Reaktsioonis NH4Cl + NaOH → NH3 + NaCl + H2O
Üks ammooniumkloriidi molekul reageerib ühe molekuliga või ühe ekvivalendiga naoniga, nii fecw. (NN4SL) \u003d 1 ja NH4CI ekvivalendi molaarmass on võrdne selle molaarmassiga 53,49 g / mol.
Sisse redoxi reaktsioon:
K2CR2O7 + 3K2SO3 + 4H2SO4 → 4K2SO4 + CR2 (SO4) 3 + 4H2O
vastavalt taastumise poolressursside võrrandile:
CR2O72- + 14H + + 6ē → 2cr3 + + 7H2O
Üks CR2O72 ioon saab 6 elektroni, nii et fEX.(K2SR2O7) \u003d \u003d fEX.(CR2O72-) \u003d 1/6 ja m (1 / 6k2cR2O7) \u003d 1/6 m (K2CR2O7) \u003d 49,03 g / mol.
Vastavalt oksüdatsiooni poole moodustamise võrrandile:
SO32- + H2O - 2ē → SO42- + 2H +
Üks ioon SO32- annab kaks elektroni, nii et fEX.(Na2SO3) \u003d FEX.(SO32-) \u003d ½ ja m (½Na2S03) \u003d ½M (Na2SO3) \u003d 63,02 g / mol.
2. Titrimimeetria arvutamisel kasutatud lahenduste omadused
Molari kontsentratsioon ainedAGA lahendusesKoos) mol / DM3 (mol / l) näitab aine mooli arvuAGA, 1 DM3 (L) sisalduv lahus:
https://pandia.ru/text/80/149/Ilages/image002_91.gif "laius \u003d" 235 "kõrgus \u003d" 43 SRC \u003d "\u003e (3.2)
kus N (1 / Z A) on lahuse V DM3 (L) lahustatud ühe ekvivalendi aine kogus;
M (1 / z a) - aine a, g / mol samaväärse molaarmass;
1 / Z - samaväärsuse tegur.
Tiiter ainedT a), G / cm3 (g / ml) - massikontsentratsioon, mis näitab, mitu grammi lahustunud ainetAGA Sisaldab 1 cm3 (ml) lahust:
https://pandia.ru/text/80/149/Ilages/image004_74.gif "laius \u003d" 253 "kõrgus \u003d" 41 SRC \u003d "\u003e, (3.4)
kus t (t) on tiitr, g / cm3 (g / ml);
M (1 / z x) - määratud aine ekvivalendi molaarmass, g / mol;
M (1 / z t) - tiitri, g / mol samaväärse molaarmass;
C (1 / z t) on tiitrivat, mol / dm3 ekvivalendi molaarne kontsentratsioon (mol / l).
ParandustegurF - väärtus, mis näitab, mitu korda tiitri samaväärse praktilise molaarse kontsentratsioonKoos (1 / zt) pr. tema tiiterT (t) . või Tutrimeetriline ümberarvutustegurt (t / x) pr. erinevad vastavatest "teoreetilistest" väärtustestC (1 / zt) teoreem., T (t) Thereore. jat (t / x) teoreem., Määratletud metoodika.
Div_adblock324 "\u003e
kui kasutatakse aine molaarset kontsentratsiooni;
kui kasutatakse aine samaväärse molaarse kontsentratsiooni;
m (a) \u003d t a) · v (a) · 103,
kui kasutatakse aine tiitrit ja
![]()
kui kasutatakse tritimeetrirakulatsiooni tegurit (tuvastatud aine tiiter).
3.2. Valmistatud lahuse kontsentratsiooni arvutamine
Hüdraulilistest lahustest valmistatud lahuste kontsentratsioonide väärtused arvutatakse valemite (3.1 - 3.3).
3.3. Lahuste valmistamine, lahjendades rohkem kontsentreeritud lahendusi
Lahust lahjendamisel veega (või muu lahustiga) koguse aine A ja samaväärse aine koguse ja ei muutu, seega
n1 (a) \u003d N2 (a) ja
n1 (1 / ZA) \u003d N2 (1 / ZA),
seetõttu saate kirjutada:
C1 (a) · V1 (a) \u003d C2 (a) · V2 (a)
C1 (1 / za) · V1 (a) \u003d C2 (1 / ZA) · V2 (a),
kui indeksid 1 ja 2 on vastavalt ja pärast lahjendamist lahendused.
4. TONTRATTA standardimine
4.1. Tiitrandi samaväärse molaarse kontsentratsiooni arvutamine
4.1.1. Üksikute sviitide meetod
Standardne aine mass M (A) lahustatakse vees ja saadud lahus tiitrida lahusega tiitri maht V (T). Sellisel juhul on ekvivalentide seaduses vorm:
n (1 / z a) \u003d N (1 / z t)
https://pandia.ru/text/80/149/images/image010_50.gif "laius \u003d" 154 "kõrgus \u003d" 39 SRC \u003d "\u003e.
4.1.2. Pipedetisatsiooni meetod (alikvoot)
Tuntud maht standardlahus V (a) kontsentratsiooniga (1 / Z a) tiitritakse lahusega V (T). Sellisel juhul on ekvivalentide seaduses vorm:
https://pandia.ru/text/80/149/Ilages/image012_43.gif "laius \u003d" 145 "kõrgus \u003d" 39 src \u003d "\u003e
4.2. Tiitrimeetrilise faktori arvutus, tiitri ja korrigeerimiskoefitsiendi arvutamine
Taltress TTTRANT T (T) (g / ml) arvutatakse valemiga
https://pandia.ru/text/80/149/Ilages/image014_22.gif "laius \u003d" 154 "kõrgus \u003d" 64 SRC \u003d "\u003e
kus m (x) on kindlaksmääratud aine X mass haakeseadis.
Seega mass määratud aine X peitmine on võrdne:
m (x) \u003d c (1 / zt) ∙ V (t) ∙ m (1 / zx).
Massianalüüside sooritamisel on mugav arvutada kindlaksmääratud aine mass tutrimeetriline ümberarvutusfaktor (tuvastatud aine tiiter)t (t / x).
Kui analüüsitud proovi tiitrimist tarbitakse tiitri V (t) mahuga, L-ga tuvastatud aine T (t / x) tiitriga, aine mass on võrdne:
m (x) \u003d t (t / x) ∙ v (t) ∙ 103.
Kui tiitrimine alicvoal töötajad Määratud aine mahtu V (x) lahuse lahendus Vormaatide seadusel on vorm:
https://pandia.ru/text/80/149/Ilages/image016_19.gif "laius \u003d" 165 "kõrgus \u003d" 39 src \u003d "\u003e
ja määratud aine mass VK kolbis:
https://pandia.ru/text/80/149/images/image018_17.gif "laius \u003d" 184 "kõrgus \u003d" 41 SRC \u003d "\u003e.
5.1.2. Asetäitja
Määratud aine X-ga lisatakse ilmne reaktiiv A ja asendaja asendaja vabaneb aine kogusele:
X + a → b + ...
Tiitrunud TTTRANS TTTRANS T:
B + T → C + ...
Asendusministeeriumi ekvivalentide seadus on vorm:
https://pandia.ru/text/80/149/images/image027_11.gif "laius \u003d" 120 "kõrgus \u003d" 91 "\u003e
kus W (x) on proovi massiline fraktsioon proovis,
w% (x) on aine X massiline fraktsioon proovis,%,
m (x) on proovi X-aine mass proovis.