Respiratorni lanac. Strukturna organizacija tkivnog lanca disanja Struktura respiratornog lanca
Redox enzimi koji kataliziraju prijenos elektrona i oksidativnu fosforilaciju lokalizirani su u lipidnom sloju unutrašnje membrane staničnih mitohondrija.
Transport elektrona do kiseonika u mitohondrijima (slika 13.3) odvija se u nekoliko faza i predstavlja lanac nosilaca elektrona, čiji se redoks potencijal povećava kako se približavaju kiseoniku (shodno tome se smanjuje potencijal redukcije). Ovi transportni sistemi se nazivaju respiratorni lanci.
Rice. 13.3.
Većina elektronskih parova ulazi u respiratorni lanac zbog djelovanja enzima (dehidrogenaza) koji koriste koenzime NAD + i NADP + kao akceptore elektrona. Cijela ova grupa enzima naziva se NAO(P)-zavisne dehidrogenaze.
Koenzimi NAD+ (nikotinamid adenin dinukleotid), FAD i FMN (flavin adenin dinukleotid i flavin mononukleotid), koenzim Q (CoQ), porodica proteina koji sadrže hem - citohromi (označeni kao citohromi b, Q, C, A, A3 ) i proteini koji sadrže ne-hem željezo srednji nosači u respiratornom lancu viših organizama. Proces počinje prijenosom protona i elektrona sa oksidiranog supstrata na koenzime NAD+ ili FAD i stvaranjem NADH i FADH2.
Naknadno kretanje elektrona od NADH i FADH 2 do kiseonika može se uporediti sa kotrljanjem niz merdevine, čije su prečke nosioci elektrona. Svakim korakom od koraka do koraka oslobađa se dio slobodne energije (vidi sliku 13.3).
U transferu elektrona sa organskih supstrata na molekularni kiseonik učestvuju tri proteinska kompleksa (I, III, IV) i dva pokretna molekula nosača: ubikinon (koenzim Q) i citokrom C.

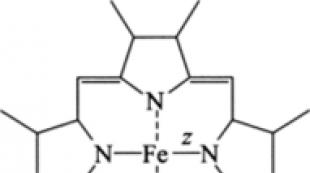
Rice. 13.4. Struktura molekula hema, z = 2* ili 3+
Sukcinat dehidrogenaza, koja zapravo pripada Krebsovom ciklusu, takođe se može smatrati kompleksom II respiratornog lanca.
Kompleksi respiratornog lanca sastoje se od mnogih polipeptida i sadrže niz različitih redoks koenzima povezanih s proteinima.
Nosači elektrona citokromi(nazvani tako zbog svoje boje) su proteini koji sadrže različite grupe kao prostetičku grupu gems. Vrsta dragulja b odgovaraju hemoglobinima. Hem je kovalentno vezan za protein (slika 13.4).
Zajednička za citohrome je sposobnost iona željeza koji se nalazi u hemu da promijeni oksidacijsko stanje prilikom prijenosa elektrona: 
Flavin-zavisne dehidrogenaze- to su proteini u kojima su sulfhidrilne grupe cisteina, koji je dio proteina, povezane s atomima željeza, što rezultira stvaranjem željezo-sumpornih kompleksa (centra). Kao iu citohromima, atomi gvožđa u takvim centrima su sposobni da doniraju i prihvate elektrone, naizmjenično prelazeći u feri- (Fe +3) i fero- (Fe +2) stanja.
Centri željezo-sumpor funkcioniraju zajedno sa enzimima koji sadrže flavin FAD ili FMN.
Phpavin adenin dinukleotid(FAD) je derivat vitamina B2 (riboflavina). Kada se reducira, FAD (oksidirani oblik) dodaje dva atoma vodika i pretvara se u FADH 2 (redukovani oblik):

Drugi nosilac elektrona koji pripada ovoj grupi, flavin mononukleotid (FMN), takođe je derivat vitamina B2 (od vitamina B2 se razlikuje samo po prisustvu fosfatne grupe).
Oba flavin koenzima mogu postojati i u obliku tzv semikinoni- slobodni radikali koji nastaju kao rezultat prijenosa samo jednog elektrona na FAD ili FMN:

Opća oznaka za različite flavoproteine koji se razlikuju u proteinskoj komponenti enzima je FP„.
Piridin zavisne dehidrogenaze dobio ovo ime jer je koenzim za njih NAD + i NADP +, čiji molekuli sadrže derivat piridin - nikotinamid:

Reakcije koje kataliziraju ovi enzimi mogu se predstaviti na sljedeći način:

Dehidrogenaze povezane sa NAD+ su uključene uglavnom u proces disanja, tj. u procesu prijenosa elektrona sa supstrata na kisik, dok su dehidrogenaze povezane s NADP+ uključene prvenstveno u prijenos elektrona sa supstrata nastalih kataboličkim reakcijama u reduktivne biosintetske reakcije.
Jedini ne-proteinski nosač elektrona je ubikinon, nazvan tako jer se ovaj kinon nalazi svuda (od sveprisutan- sveprisutan). Skraćeno je kao CoQ ili jednostavno Q. Kada se reducira, ubikinon vezuje ne samo elektrone, već i protone. Tokom prijenosa jednog elektrona pretvara se u semikinon, dvoelektronski - in hidrokinon.
Redoslijed nosača elektrona u mitohondrijskom respiratornom lancu može se predstaviti sljedećim dijagramom:

Ova shema je opisana nizom uzastopnih reakcija: 

Na taj način, kroz respiratorni lanac, elektroni sa supstrata stižu do konačnog akceptora - atmosferskog kiseonika. Voda nastala kao rezultat ovog procesa naziva se metabolička voda.
Razdvajanje vodika na protone i elektrone u mitohondrijskoj membrani je lanac transporta elektrona koji radi kao protonska pumpa, pumpajući vodikove ione iz međućelijskog prostora na vanjsku stranu membrane.
Uvod
Respiratorni lanac je sistem strukturno i funkcionalno povezanih transmembranskih proteina i nosača elektrona.
ETC pohranjuje energiju oslobođenu tijekom oksidacije NADH i FADH2 molekularnim kisikom (u slučaju aerobnog disanja) ili drugim supstancama (u slučaju anaerobnog disanja) u obliku transmembranskog potencijala zbog sekvencijalnog prijenosa elektrona duž lanac povezan sa pumpanjem protona preko membrane.
Kod prokariota, ETC je lokalizovan u CPM, kod eukariota - na unutrašnjoj membrani mitohondrija. Nosači su locirani prema njihovom redoks potencijalu; transport elektrona duž cijelog lanca odvija se spontano.
Mitohondrije se nazivaju „energetskim stanicama“ ćelije, jer se upravo u tim organelama uglavnom hvata energija dobijena oksidativnim procesima.
Respiratorni lanac
Sva korisna energija koja se oslobađa pri oksidaciji masnih kiselina i aminokiselina, te gotovo sva energija iz oksidacije ugljikohidrata, koristi se u mitohondrijima u obliku redukcijskih ekvivalenata. Mitohondrije sadrže nekoliko katalizatora koji formiraju respiratorni lanac, koji hvataju i transportuju redukcijske ekvivalente, usmjeravajući ih da reagiraju s kisikom, što dovodi do stvaranja vode. Istovremeno, funkcioniše mehanizam za hvatanje slobodne potencijalne energije sa njenom akumulacijom u obliku visokoenergetskih fosfata. Mitohondrije takođe sadrže enzimske sisteme koji obezbeđuju formiranje većine redukcionih ekvivalenata; to su enzimi -oksidacije i ciklus limunske kiseline (potonji je uobičajen metabolički put u oksidaciji svih glavnih namirnica). Ovaj odnos je prikazan na slici 1.1.
Organizacija respiratornog lanca u mitohondrijima
Glavne komponente respiratornog lanca (Slika 1.1) navedene su uzastopno po rastućem redoks potencijalu. Atomi vodika ili elektroni kreću se duž lanca od više elektronegativnih komponenti do više elektropozitivnog kiseonika, promena redoks potencijala pri prelasku iz NAD/NADH sistema u O2/H2O sistem je 1,1 V.
Glavni respiratorni lanac počinje od NAD-ovisnih dehidrogenaza, prolazi kroz flavoproteine i citohrome i završava molekularnim kisikom. Nisu svi supstrati spojeni na respiratorni lanac preko NAD-ovisnih dihidrogenaza; neki od njih, koji imaju relativno visok redoks potencijal (na primjer, fumarat/sukcinat sistem, povezani su sa flavoprotein dehidrogenazama, koje su zauzvrat povezane sa citohromima respiratornog lanca (slika 1.3).
Nedavno je ustanovljeno da u respiratornom lancu postoji još jedan transporter koji povezuje flavoproteine sa citohromom b, koji ima najmanji redoks potencijal među nitohromima. Ovaj transporter, nazvan ubikinon ili koenzim Q (slika 1.4), nalazi se u mitohondrijima u aerobnim uslovima u obliku oksidovanog kinona, au anaerobnim uslovima u redukcionom obliku kinola. Koenzim Q je komponenta mitohondrijskih lipida; među ostalim lipidima preovlađuju fosfolipidi koji su dio mitohondrijske membrane. Struktura koenzima Q slična je strukturi vitamina K i E. Plastokinon, koji se nalazi u hloroplastima, takođe ima sličnu strukturu. Sve ove supstance u svojoj strukturi imaju bočni lanac poliizoprenoida. Sadržaj koenzima Q značajno premašuje sadržaj ostalih komponenti respiratornog lanca; ovo sugerira da je koenzim Q mobilna komponenta respiratornog lanca koja prima redukcijske ekvivalente iz fiksnih flavoproteinskih kompleksa i prenosi ih u citokrome.
Rice. 1.1.
Dodatna komponenta koja se nalazi u funkcionalno aktivnim lijekovima za respiratorni lanac je gvožđe-sumporni blok FeS. Povezuje se sa flavoproteinima i citokromom b. Gvožđe i sumpor su uključeni u redoks proces, koji se odvija preko jednoelektronskog mehanizma (slika 1.5).
Moderne ideje o redoslijedu glavnih komponenti u respiratornom lancu prikazane su na Sl. 1.3. Na elektronegativnom kraju lanca, dehidrogenaze kataliziraju prijenos elektrona sa supstrata na NAD u respiratornom lancu. To se dešava na dva načina. U slučajevima kada su supstrati α-keto kiseline, piruvat i ketoglutarat, kompleksni dehidrogenazni sistemi koji sadrže lipoat i FAD učestvuju u transferu elektrona na NAD. Prenos elektrona drugim dehidrogenazama koristeći L(+)-3-hidroksiacil-CoA, D(-)-3-hidroksibutirat, prolin, glutamat, malitol i izocitrat kao supstrate se dešava direktno na NAD respiratornom lancu.
Redukovani NADH u respiratornom lancu se zauzvrat oksidira metaloflavoprotein NADH dehidrogenazom. Ovaj enzim sadrži FeS i FMN i usko je povezan sa respiratornim lancem. Koenzim Q služi kao sakupljač redukcijskih ekvivalenata, koji se putem flavoprotein dehidrogenaza dopremaju u respiratorni lanac od brojnih supstrata. Ovi supstrati uključuju sukcinat, holin i sarkozin (slika 1.3). Flavin komponenta ovih dehidrogenaza je FAD. Protok elektrona iz koenzima Q zatim prolazi kroz niz citohroma do molekularnog kiseonika (slika 1.3). Citohromi su raspoređeni po rastućem redoks potencijalu.

Rice. 1.2.

Rice. 1.3. Komponente mitohondrijalnog respiratornog lanca FeS se nalaze u lancu „na strani O2“ FP ili Cytb. Cyt - citokrom; EPFP - flavoprotein za prijenos elektrona; FeS - gvožđe-sumporni protein; FP - flavoprotein; Q - ubikinon.

Rice. 1.4.

Rice. 1.5.
Terminalni citokrom aa3 obavlja završnu fazu procesa transfera redukcionih ekvivalenata na molekularni kiseonik. Enzimski sistem sadrži bakar, bitnu komponentu pravih oksidaza. Citokrom oksidaza ima veoma visok afinitet prema kiseoniku, što omogućava respiratornom lancu da funkcioniše maksimalnom brzinom sve dok tkivo praktično ne bude iscrpljeno O2. Ova reakcija katalizirana citokrom oksidazom nije reverzibilna; određuje smjer kretanja redukcijskih ekvivalenata u respiratornom lancu, što je povezano sa stvaranjem ATP-a.
Iznesene su brojne hipoteze u vezi sa strukturnom organizacijom respiratornog lanca. Važno je da su molarni odnosi između komponenti gotovo konstantni. Funkcionalne komponente respiratornog lanca ugrađene su u unutrašnju mitohondrijalnu membranu u obliku četiri proteinsko-lipidna kompleksa respiratornog lanca.

Rice. 1.6.
Naznačeni su regioni u kojima se pretpostavlja da dolazi do spajanja sa fosforilacijom. BAL- dimerkaprol; TTFA je agens za keliranje željeza. I-NADH kompleks; ubikinon oksidoreduktaza; kompleks II - sukcinat: ubikinon oksidoreduktaza; kompleks III - ubikinol: fericitokrom c oksidoreduktaza; kompleks IV-ferocitokrom c: kiseonik oksidoreduktaza.
Na osnovu toga je zaključeno da ovi kompleksi imaju određenu prostornu orijentaciju u membrani. Citokrom je jedini rastvorljivi citokrom i, zajedno sa koenzimom Q, služi kao relativno mobilna komponenta respiratornog lanca, komunicirajući između kompleksa fiksiranih u prostoru (slika 1.6).
ETC je lokalizovan u CPM, kod eukariota - na unutrašnjoj membrani mitohondrija. Nosači su locirani prema njihovom redoks potencijalu; transport elektrona duž cijelog lanca odvija se spontano.
ATP sintaza pretvara protonski potencijal u energiju hemijske veze ATP-a. Konjugirani rad ETC i ATP sintaze naziva se oksidativna fosforilacija.
Lanac transporta elektrona mitohondrije
Utjecaj oksidativnog potencijala
| Redukciono sredstvo | Oksidator | Eo´, V |
|---|---|---|
| H2 | 2 + | - 0,42 |
| NAD H + H+ | NAD + | - 0,32 |
| NADP H + H+ | NADP+ | - 0,32 |
| Flavoprotein (smanjen) | Flavoprotein (oksidirani) | - 0,12 |
| Koenzim Q H2 | Koenzim Q | + 0,04 |
| citokrom B (Fe2+) | citokrom B (Fe3+) | + 0,07 |
| citokrom C 1 (Fe2+) | citokrom C 1 (Fe3+) | + 0,23 |
| citohromi A (Fe2+) | citohromi A(Fe3+) | + 0,29 |
| citohromi A3 (Fe2+) | citohromi A3 (Fe3+) | +0,55 |
| H2O | ½ O2 | + 0,82 |
Inhibitori respiratornog lanca
Neke supstance blokiraju prenos elektrona kroz komplekse I, II, III, IV.
- Inhibitori kompleksa I - barbiturati, rotenon, piericidin
- Inhibitor kompleksa II je malonat.
- Inhibitor kompleksa III - antimicin A, miksotiazol, stigmatelin
- Inhibitori kompleksa IV - sumporovodik, cijanid, ugljen monoksid, azot oksid, natrijum-azid
Elektronski transportni lanci bakterija
Bakterije, za razliku od mitohondrija, koriste veliki skup donora i akceptora elektrona, kao i različite puteve prijenosa elektrona između njih. Ovi putevi se mogu izvoditi istovremeno, npr. E. coli kada se uzgaja na podlozi koja sadrži glukozu kao glavni izvor organske materije, koristi dve NADH dehidrogenaze i dve kinoloksidaze, što znači prisustvo 4 puta transporta elektrona. Većina ETC enzima je inducibilna i sintetizira se samo ako je put kojim ulaze potreban.
Osim organske tvari, donori elektrona u bakterijama mogu uključivati molekularni vodonik, ugljični monoksid, amonijum, nitrit, sumpor, sulfid i dvovalentno željezo. Umjesto NADH i sukcinat dehidrogenaze mogu biti prisutne format -, laktat -, gliceraldehid-3-fosfat dehidrogenaza, hidrogenaza itd. Umjesto oksidaze, koja se koristi u aerobnim uvjetima, u nedostatku kisika, bakterije mogu koristiti reduktaze koje smanjuju različite konačni akceptori elektrona: fumarat reduktaza, nitrat i nitrit reduktaza itd.
vidi takođe
Napišite recenziju o članku "Dišni lanac transporta elektrona"
Bilješke
Izvod koji karakteriše respiratorni lanac transporta elektrona
- Časni sude, generalu. Oni stoje ovde u kolibi”, rekao je vatromet prilazeći Tušinu.- Sada, draga.
Tušin je ustao i, zakopčavši kaput i ispravivši se, otišao od vatre...
Nedaleko od artiljerijske vatre, u za njega pripremljenoj kolibi, princ Bagration sjedio je za večerom, razgovarajući s nekim od zapovjednika jedinica koji su se okupili s njim. Bio je tu starac poluzatvorenih očiju, koji je pohlepno glodao ovčju kost, i dvadesetdvogodišnji besprekorni general, pocrveneo od čaše votke i večere, i štabni oficir sa prstenom sa imenom, i Žerkov, gledajući sve nemirno, i princa Andreja, blijedog, stisnutih usana i grozničavo sjajnih očiju.
U kolibi je stajao oduzeti francuski transparent nagnut u uglu, a revizor naivnog lica je opipao tkaninu transparenta i zbunjen odmahnuo glavom, možda zato što ga je zaista zanimao izgled transparenta, a možda i jer mu je bilo teško gladnom gledati večeru za koju nije imao dovoljno pribora. U sledećoj kolibi bio je francuski pukovnik kojeg su zarobili zmajevi. Naši oficiri su se gurali oko njega i gledali u njega. Princ Bagration se zahvalio pojedinim komandantima i pitao za detalje slučaja i gubitaka. Zapovjednik puka, koji se predstavio kod Braunaua, izvijestio je kneza da se, čim je stvar počela, povukao iz šume, pokupio drvosječe i, pustivši ih da prođu pored sebe, sa dva bataljona udarili bajonetima i zbacili Francuze.
- Kako sam vidio, Vaša Ekselencijo, da je prvi bataljon uznemiren, stao sam na cestu i pomislio: „Propustiću ove i dočekati ih bojnom vatrom“; Ja sam to uradio.
Komandant puka je to toliko želeo, toliko je žalio što nije imao vremena da to uradi, da mu se činilo da se sve ovo zaista dogodilo. Možda se to zaista dogodilo? Da li se u ovoj zbrci moglo razaznati šta je bilo, a šta nije?
„I moram napomenuti, Vaša Ekselencijo“, nastavio je, prisjećajući se Dolohovljevog razgovora s Kutuzovim i njegovog posljednjeg susreta s degradiranim čovjekom, „da je redov, degradirani Dolohov, pred mojim očima zarobio francuskog oficira i posebno se istakao.“
„Evo video sam, Vaša Ekselencijo, napad Pavlograđana“, umeša se Žerkov, s nelagodom se osvrćući okolo, koji tog dana uopšte nije video husare, već je za njih čuo samo od jednog pešadijskog oficira. - Razbili su dva polja, Vaša Ekselencijo.
Na Žerkovljeve reči, neki su se nasmešili, kao i uvek očekujući od njega šalu; ali, primetivši da je to što je govorio išlo na slavu našeg oružja i današnjeg dana, poprimili su ozbiljan izraz, iako su mnogi dobro znali da je to što je Žerkov rekao laž, ni na čemu zasnovana. Princ Bagration se okrenuo starom pukovniku.
- Hvala svima gospodo, sve jedinice su junački postupile: pešadija, konjica i artiljerija. Kako su dva pištolja ostavljena u centru? – upitao je pogledom tražeći nekoga. (Princ Bagration nije pitao za oružje na lijevom krilu; već je znao da su sve puške tamo napuštene na samom početku stvari.) „Mislim da sam te pitao“, okrenuo se dežurnom oficiru na adresi. sjedište.
„Jedan je pogođen“, odgovori dežurni, „a drugi, ne razumem; I sam sam bio stalno tamo i naređivao i samo se odvezao... Bilo je vruće, stvarno”, dodao je skromno.
Neko je rekao da ovde blizu sela stoji kapetan Tušin i da su već poslali po njega.
„Da, tu ste bili“, reče princ Bagration, okrećući se princu Andreju.
„Pa, nismo se nakratko uselili“, rekao je dežurni oficir, prijatno se osmehujući Bolkonskom.
„Nisam imao zadovoljstvo da te vidim“, rekao je princ Andrej hladno i naglo.
Svi su ćutali. Tušin se pojavio na pragu, stidljivo se probijajući iza generala. Obilazeći generale u skučenoj kolibi, posramljen, kao i uvijek, na prizor svojih pretpostavljenih, Tušin nije primijetio jarbol zastave i spotakao se o njega. Nekoliko glasova se nasmijalo.
– Kako je oružje napušteno? – upita Bagration, mršteći se ne toliko na kapetana koliko na one koji se smeju, među kojima se najglasnije čuo Žerkovljev glas.
Tušin je samo sada, ugledavši silne vlasti, u svom užasu zamislio svoju krivicu i sramotu zbog činjenice da je, ostavši živ, izgubio dva pištolja. Bio je toliko uzbuđen da do tog trenutka nije imao vremena da razmišlja o tome. Smeh oficira ga je još više zbunio. Stao je ispred Bagrationa drhtave donje vilice i jedva rekao:
– Ne znam... Vaša Ekselencijo... nije bilo ljudi, Vaša Ekselencijo.
– Mogao si ga uzeti iz zaklona!
Tušin nije rekao da nema pokrića, iako je to bila apsolutna istina. Bojao se da izneveri drugog šefa i ćutke, uprtih očiju, gledao je pravo u Bagrationovo lice, kao što zbunjeni student gleda u oči ispitivača.
Tišina je bila prilično duga. Princ Bagration, očigledno ne želeći da bude strog, nije imao šta da kaže; ostali se nisu usuđivali da se umešaju u razgovor. Princ Andrej je pogledao Tušina ispod obrva, a prsti su mu se nervozno pomerali.
„Vaša ekselencijo“, prekinuo je tišinu knez Andrej svojim oštrim glasom, „udostojili ste se da me pošaljete u bateriju kapetana Tušina. Bio sam tamo i zatekao dvije trećine ubijenih ljudi i konja, dva oruđa oštećena i bez pokrića.
Princ Bagration i Tušin su sada jednako tvrdoglavo gledali u Bolkonskog, koji je govorio suzdržano i uzbuđeno.
„A ako mi, Vaša Ekselencijo, dozvolite da izrazim svoje mišljenje“, nastavio je, „onda uspeh dana najviše dugujemo akciji ove baterije i herojskoj hrabrosti kapetana Tušina i njegove čete“, rekao je princ. Andrej i, ne čekajući odgovor, odmah je ustao i otišao od stola.
Komponente respiratornog lanca su enzimski proteini sa relativno čvrsto vezanim protetičkim grupama niske molekularne težine. Takvi kompleksi kod eukariota lokalizirani su na unutrašnjoj strani mitohondrijalne membrane, a kod prokariota - u plazma membrani. Mehanizam djelovanja i lokalizacija komponenti respiratornog lanca u obje membrane su uglavnom slični.
Komponente respiratornog lanca uronjen u lipidni dvosloj. Riječ je o velikom broju enzima, koenzima i prostetičkih grupa, raznim dehidrogenazama i transportnim sistemima uključenim u prijenos elektrona i vodonika. Proteinske komponente se mogu izolovati iz membrane. Respiratorni lanci mikroorganizama sastoje se od sljedećih najvažnijih, membranski lokaliziranih nosača atoma ili elektrona vodika: flavoproteini, gvožđe-sumporni proteini, kinoni i citokromi.
Flavoproteini – koenzimi koji sadrže vitamin B2, a prostetičke grupe u njima su flavin mononukleotid (FMN) ili flavin adenin dinukleotid (FAD).
Flavoproteini vrše prijenos atoma vodika, odnosno dehidrogenaze. Dehidrogenaza koja sadrži FMN kao prostetičku grupu je NADP H2 dehidrogenaza. Ovo je početni nosač u respiratornom lancu, koji vrši prijenos vodonika iz NADP H2 do sljedećih komponenti respiratornog lanca. Dehidrogenaza sadržana kao prostetička grupa FAD-a djeluje kao sukcinat dehidrogenaza. On katalizuje oksidaciju jantarne kiseline u fumarnu kiselinu u TCA ciklusu. Atomi vodika iz FAD H2 idu direktno u kinone koji se nalaze u posljednjim fazama lanca transporta elektrona.
Gvožđe-sumporni proteini (FeS proteini) sadrže željezo-sumporne centre u kojima su atomi željeza vezani, s jedne strane, za sumpor aminokiseline cisteina, as druge, za neorganski sulfidni sumpor (slika 4).
Centri gvožđa sumpora su komponente nekih flavoproteina (na primer, sukcinat dehidrogenaze i NADP H2 dehidrogenaze), ili služe kao jedine prostetske grupe proteina. Dišni lanci sadrže veliki broj FeS centara. Centri željeznog sumpora, ovisno o svojoj strukturi, mogu izvršiti istovremeni prijenos jednog ili dva elektrona, što je povezano s promjenom valencije atoma željeza.
Rice. 4. Centri gvožđa sumpora (FeS centri) proteina
Kinoni – jedinjenja rastvorljiva u mastima. Kod gram-negativnih bakterija predstavljeni su ubikinon (koenzim Q) ili menakinon (slika 5).
 Rice. 5. Kinoni gram-negativnih bakterija: A – koenzim Q (ubikinon); B – menakinon
Rice. 5. Kinoni gram-negativnih bakterija: A – koenzim Q (ubikinon); B – menakinon
Kinoni su lipofilni i stoga su lokalizirani u lipidnoj fazi membrane. Oni nose atome vodonika. U poređenju sa drugim komponentama respiratornog lanca, kinoni se nalaze u 10-15 puta većem višku. Oni služe kao "sakupljači" vodonika koji se opskrbljuju različitim koenzimima i protetskim grupama u respiratornom lancu i prenose ga do citokroma. Tako funkcioniraju u respiratornom lancu u području između flavoproteina i citokroma.
Citohromi učestvuju u završnoj fazi u lancu transporta elektrona. Elektroni im dolaze iz kinona. Citohromi sadrže hem kao prostetičku grupu. Citokromi su obojeni; oni se međusobno razlikuju po spektru apsorpcije i redoks potencijalima. Postoje citohromi A, A 3 , b, c, o i niz drugih. Najrasprostranjeniji citokrom With. Nalazi se u gotovo svim organizmima koji imaju respiratorni lanac. Završni (terminalni) citohromi respiratornog lanca su citohromi A+ A 3 ili citokrom oksidaza. Oni prenose elektrone na molekularni kiseonik, tj. katalizuju redukciju molekularnog kiseonika u vodu. Reakcioni centar citokrom oksidaze, pored dva hema, sadrži i dva atoma bakra.
Dišni lanac ima sljedeće karakteristike:
1) Neke njegove komponente prenose samo atome vodonika, dok druge prenose samo elektrone.
2) Nosioci atoma vodika i nosači elektrona smjenjuju se uzastopno u respiratornom lancu. Flavoproteini i kinoni vrše prijenos atoma vodika, a FeS proteini i citokromi prenos elektrona.
3) Uočene su određene razlike u sastavu respiratornih lanaca mikroorganizama.
PREDAVANJE o bh
za studente _ 2 __ kurs terapeutski fakultet
Predmet Biološka oksidacija 2. Tkivno disanje. Oksidativna fosforilacija.
Vrijeme 90 min.
Vaspitno-obrazovni ciljevi:
Dajte uvod:
O strukturi respiratornog lanca (RC), inhibitori; mehanizmi rada istosmjerne struje; tačke interfejsa, ORP vrednosti DC komponenti. O P/O omjeru i njegovom značenju.
O slobodnom i nepovezanom disanju. O teorijama konjugacije OF.
O mehanizmu generiranja N +.
O strukturi i funkcijama protonske ATPaze; o mehanizmu razdvajanja.
O oksidativnoj fosforilaciji (pH i ); o mehanizmima termogeneze, ulozi smeđeg masnog tkiva.
O ulozi energetskog metabolizma; Putevi za iskorišćavanje H + i ATP. O primijenjenim aspektima bioenergije.
O načinima potrošnje O 2 u organizmu (mitohondrijski, mikrosomalni, peroksidni). O karakteristikama mikrosomalnog DC u poređenju sa mitohondrijalnim DC. O karakteristikama citokroma P 450, funkcije.
O oksidaciji peroksida. O mehanizmu nastanka reaktivnih vrsta kiseonika O 2 - , O 2 , O 2 . O ulozi peroksidnih procesa u normalnim i patološkim stanjima. O peroksidaciji lipida (LPO): (NEFA → R → dienski konjugati → hidroperoksidi → MDA). O metodama za procjenu aktivnosti LPO.
O antioksidativnoj zaštiti: enzimskoj i neenzimskoj. O karakteristikama SOD, katalaze, glutation peroksidaze, GSH reduktaze, NADPH-reproducirajućih sistema. O neenzimskom AOS-u: vitamini E, A, C, karotenoidi, histidin, kortikosteroidi, bilirubin, urea, itd.
LITERATURA
Berezov T. T., Korovkin B. F. Biološka hemija. M.: Medicina, 1990. S. 213–220; 1998. str. 305–317.
Nikolaev A. Ya. Biološka hemija. M.: Viša škola, 1989. str. 199–221.
Dodatno
Filippovič Yu. B. Osnove biohemije. M.: Viša škola, 1993. str. 403–438.
Murray R. et al. Ljudska biohemija. M.: Mir, 1993. T. 1. P. 111–139.
Leninger A. Osnove biohemije. M.: Mir, 1985. T. 2. str. 403–438, 508–550.
Alberts B. I itd., Molekularna biologija ćelije. M.: Mir, 1994.T. 1. str. 430–459.
Skulachev V.P. Energija bioloških membrana. M.: Nauka. 1989.
MATERIJALNA PODRŠKA
1. Multimedijalna prezentacija.
PRORAČUN VREMENA STUDIJA
|
Lista obrazovnih pitanja |
Iznos dodijeljenog vremena u minutama |
|
|
Struktura respiratornog lanca (RC), njegovi kompleksi, inhibitori. Mehanizam rada DC-a. Tačke sučelja, ORP vrijednosti DC komponenti. R/O odnos, njegovo značenje. |
||
|
Slobodno i nepovezano disanje. Teorije OF konjugacije (hemijske, konformacione, hemiosmotske - P. Mitchell). |
||
|
Mehanizam generisanja H +, njegove komponente, stehiometrija H + /e. |
||
|
Struktura i funkcija protonske ATPaze. Mehanizam za isključivanje. |
||
|
OF (uklanjanje pH i ). Mehanizmi termogeneze. Uloga smeđeg masnog tkiva. |
||
|
Osnovna uloga energetskog metabolizma. Putevi za iskorišćavanje H + i ATP. Primijenjeni aspekti bioenergije. |
||
|
Putevi potrošnje O2 u tijelu (mitohondrijski, mikrosomalni, peroksidni). Karakteristike mikrosomalnog DC, njegovo poređenje sa mitohondrijalnim DC. Karakteristike citokroma P 450, njihova funkcija. |
||
|
Oksidacija peroksida. Mehanizam stvaranja reaktivnih vrsta kiseonika O 2 -, O 2, O 2. Uloga peroksidnih procesa u normalnim i patološkim stanjima. Opće razumijevanje LPO (NEFA → R → dienski konjugati → hidroperoksidi → MDA). Metode za procjenu aktivnosti LPO. |
||
|
Antioksidativna zaštita: enzimska i neenzimska. Karakteristike SOD, katalaze, glutation peroksidaze, GSH reduktaze, NADPH-reproducirajućih sistema. Neenzimski AOS: vitamini E, A, C, karotenoidi, histidin, kortikosteroidi, bilirubin, urea, itd. |
Ukupno 90 min
Struktura respiratornog lanca (RC), kompleksi, inhibitori. Mehanizam rada. Tačke sučelja, ORP vrijednosti jednosmjernih komponenti. R/o koeficijent, njegovo značenje.
Respiratorni lanac.
Postepeno „kontrolisano sagorevanje“ postiže se posrednim uključivanjem respiratornih enzima sa različitim redoks potencijalima. Redox potencijal (redox potencijal) određuje smjer prijenosa protona i elektrona enzimima respiratornog lanca (Sl. 1).
Izražen je redoks potencijal vrijednost elektromotorne sile (u voltima), koji se javlja u rastvoru između oksidacionog agensa i redukcionog agensa prisutnog u koncentraciji od 1,0 mol/l na 25˚ C (pri pH = 7,0, oba su u ravnoteži sa elektrodom, koja može reverzibilno da prihvati elektrone iz redukcionog agensa ). Pri pH=7,0, redoks potencijal sistema H 2 /2H + +2ē je jednak – 0,42 v. Potpiši – znači da ovaj redoks par lako odustaje od elektrona, tj. igra ulogu redukcionog sredstva, sign + ukazuje na sposobnost redoks para da prihvati elektrone, tj. igraju ulogu oksidacionog sredstva. Na primjer, redoks potencijal NADH∙H + / NAD + para je – 0,32 v, što ukazuje na njegovu visoku sposobnost doniranja elektrona, a redoks par ½O 2 /H 2 O ima najveću pozitivnu vrijednost od +0,81 v, one. Kiseonik ima najveću sposobnost prihvatanja elektrona.
Tokom oksidacije AcCoA u TCA ciklusu, reducirani oblici NADH2 i FADH2 ulaze u DC, gdje se energija elektrona i protona pretvara u energiju visokoenergetskih veza ATP-a.
DC je skup dehidrogenaza koje transportuju elektrone i protone od supstrata do kisika.
Principi rada jednosmerne struje zasnovani su na 1. i 2. zakonu termodinamike.
Pokretačka snaga DC je razlika u ORP. Ukupna razlika čitavog DC je 1,1 V. Fosforilacijske tačke treba da imaju ORP razliku = 0,25 - 0,3 V.
1. NAD-H par ima ORP = 0,32 V.
2. Par Q-b - / - /- - 0 V.
3. O2 - ima +0,82 V.
DC je lokalizovan u unutrašnjoj membrani mitohondrija i ima 2 načina uvođenja elektrona i protona ili 2 ulaza; DC formira 4 kompleksa.
Ulaz 1: NAD-ovisni (elektroni i protoni dolaze iz svih NAD-ovisnih reakcija).
Ulaz 2: zavisi od FAD-a
PREKO ---->AF
Q --->b--->c 1 --->c--->aa 3 ---->1/2O 2
Jantarna kiselina ---->FP
Dišni lanac je oblik biološke oksidacije.
Tkivno disanje je niz redoks reakcija koje se odvijaju u unutrašnjoj mitohondrijskoj membrani uz učešće enzima respiratornog lanca. Dišni lanac ima jasnu strukturnu organizaciju; njegove komponente se formiraju respiratorni kompleksi, čiji raspored zavisi od vrednosti njihovog redoks potencijala (slika 5.1). Broj respiratornih lanaca u jednoj mitohondriji iz ćelija različitih tkiva nije isti: u jetri - 5000, u srcu - oko 20 000, stoga se miokardiociti razlikuju po intenzivnijem disanju od hepatocita.
Rice. 5.1 Redoslijed rasporeda kompleksa respiratornog lanca u unutrašnjoj mitohondrijalnoj membrani
Prije nego što se zadržimo na karakteristikama svake od komponenti respiratornog lanca, upoznajmo se sa supstratima tkivnog disanja.
Supstrati tkivnog disanja dijele se u 2 grupe:
Zavisan od NAD-a– Supstrati Krebsovog ciklusa izocitrat, α-ketoglutarat i malat. To su i piruvat, hidroksibutirat i β-hidroksi-acil~CoA, glutamat i neke druge aminokiseline. Korištenje vodika iz NAD-ovisnih supstrata NAD zavisne dehidrogenaze prenosi na prvi kompleks respiratornog lanca.
Zavisno od FAD-a – sukcinat, glicerol-3-fosfat, acil~CoA i neki drugi. Vodik iz supstrata zavisnih od FAD prenosi se u kompleks II respiratornog lanca.
Prilikom dehidrogeniranja supstrata NAD zavisne dehidrogenaze formira se redukovani oblik NAD (NADH∙H+).

Naznačen je oksidirani oblik koenzima NAD+. Ovaj koenzim je dinukleotid ( nikotinamid-Adenin-dinukleotid): jedan nukleotid sadrži vitamin PP (nikotinamid), drugi je AMP. Sposobnost koenzima da igra ulogu srednjeg nosača vodika povezana je s prisustvom vitamina PP u njegovoj strukturi. U elektronsko-protonskom obliku, proces reverzibilne hidrogenacije-dehidrogenacije može se predstaviti jednadžbom (R je ostatak koenzima):

NADH∙H+ se može formirati ne samo u mitohondrijima, već iu citosolu ćelije tokom određenih metaboličkih procesa. Međutim, citoplazmatski koenzim ne može prodrijeti u mitohondrije. Vodik redukovanog koenzima prvo se mora prenijeti na supstrate koji mogu prodiru u mitohondrije. Takvi “supstrati koji prenose H 2” su:
Oksalacetat → malat
Acetoacetat → β-hidroksibutirat
Dihidroksiaceton fosfat → glicerol-3-fosfat

NADH∙H+ se zatim oksidira kompleksom 1 respiratornog lanca. Razmotrimo rad ovog kompleksa.
I – NADH∙H + -ubikinon oksidoduktaza.
Prvi kompleks je najveći u respiratornom lancu (predstavljen sa 23-30 podjedinica). On katalizuje transfer vodonika sa NADH∙H+ na ubikinon (sl. 5.1 i 5.3). Sadrži koenzim FMN (flavin mononukleotid) i proteine željezo-sumpor koji sadrže ne-hem željezo. Funkcija ovih proteina je u razdvajanju protoka protona i elektrona: elektroni se prenose sa FMN∙H 2 na unutrašnju površinu unutrašnje mitohondrijalne membrane (okrenute prema matriksu), a protoni se prenose na vanjsku površinu unutrašnje membrane i zatim se oslobađaju u matriks mitohondrija.
Prilikom transporta protona i elektrona redoks potencijal prvog kompleksa opada za 0,38 v, što je sasvim dovoljno za sintezu ATP-a. Međutim, ATP se ne formira u samom kompleksu, a energija oslobođena kao rezultat rada kompleksa se akumulira (vidi dolje za formiranje elektrohemijskog potencijala) i djelomično se raspršuje u obliku topline.
Po svojoj strukturi, FMN je mononukleotid u kojem je dušična baza predstavljena izoaloksazinskom jezgrom riboflavina, a pentoza je ribitol (drugim riječima, FMN je fosforilirani oblik vitamina B2).

Funkcija FMN je da prihvati 2 atoma vodika iz NADH∙H+ i prenese ih na proteine željezo-sumpor. Vodik (2 elektrona i 2 protona) veže se za atome dušika izoaloksazinskog prstena, a unutarmolekulsko preuređenje dvostrukih veza se javlja kako bi se formirao intermedijer semikinon, spoj prirode slobodnih radikala (prikazano na dijagramu ukupno jednadžba reakcije, gdje je R ostatak molekule)

II kompleks tkivnog lanca disanja - sukcinat ubikinon oksidoreduktaza.
Ovaj kompleks ima nižu molekularnu težinu i također sadrži proteine željezo-sumpor. Sukcinat ubikinon oksidoreduktaza katalizira prijenos vodonika iz succinate na ubikinon. Kompleks uključuje koenzim FAD (flavin adenin dinukleotid) i enzim sukcinat dehidrogenazu, koji je također enzim Krebsovog ciklusa. Acyl~SCoA, 3-fosfo-glicerat i dihidroksiaceton fosfat Oni su i FAD-ovisni supstrati tkivnog disanja i uz pomoć ovog koenzima dolaze u kontakt sa drugim kompleksom.

Rice. 5.3 Prvi kompleks respiratornog lanca
Energija uključivanja vodikovih supstrata u kompleks II tkivnog lanca disanja se uglavnom raspršuje u obliku topline, jer se u ovom dijelu lanca redoks potencijal blago smanjuje i ta energija nije dovoljna za sintezu ATP-a.

Proces restauracije FAD-a odvija se slično onom kod FMN-a.
Koenzim Q ili ubikinon je hidrofobno jedinjenje, sastavni je deo ćelijskih membrana, nalazi se u visokim koncentracijama i pripada grupi vitamina. spada u grupu vitamina.
Ubikinon (koenzim Q). Ubikinon je mali lipofilni molekul čija je hemijska struktura benzokinon sa dugim bočnim lancem (broj izoprenoidnih jedinica kreće se od 6 kod bakterija do 10 kod sisara).
U respiratornom lancu koenzim Q je neka vrsta depoa (pula) vodonika koji prima iz različitih flavoproteina. Lipofilna priroda molekula ubikinona određuje njegovu sposobnost da se slobodno kreće u lipidnoj fazi mitohondrijske membrane, presrećući protone i elektrone ne samo iz kompleksa I i II respiratornog lanca, već i hvatajući protone iz matriksa mitohondrija. U ovom slučaju, ubikinon se reducira kako bi se formirao srednji proizvod slobodnih radikala, semikinon.
Redukovani oblik ubikinona, ubikinol, prenosi protone i elektrone u kompleks III respiratornog lanca.

Citokrom oksidaza ima visok afinitet prema kisiku i može djelovati pri niskim koncentracijama kisika.
aa 3 - sastoji se od 6 podjedinica, od kojih svaka sadrži hem i atom bakra. 2 podjedinice čine citokrom a, a preostale 4 pripadaju citokromu a 3.
Između NAD i AF, b-c, a-a3, postoji maksimalna razlika u ORP. Ove tačke su mesto sinteze ATP-a (mesto fosforilacije ADP).
III kompleks lanca tkivnog disanja – ubikinol-citokrom C oksidoreduktaza. Kompleks III uključuje citokromib I With 1 pripada grupi kompleksnih proteina hromoproteini. Protetička grupa ovih proteina je obojena (hroma boja) i po hemijskoj strukturi bliska hemu hemoglobina. Međutim, za razliku od hemoglobina i oksihemoglobina, u kojima gvožđe treba da bude samo u dvovalentnom obliku, gvožđe u citohromima tokom rada respiratornog lanca prelazi iz dvovalentnog u trovalentno stanje (i obrnuto).
Kao što naziv implicira, kompleks III prenosi elektrone sa ubikinola na citokrom C. Prvo, elektroni odlaze u oksidirani oblik citokroma b (Fe 3+), koji se redukuje (Fe 2+), zatim redukovani citokrom b prenosi elektrone na oksidirani oblik citokroma c, koji se također reducira i, zauzvrat, prenosi elektrone na citokrom C.
mitohondrijalnu membranu od kompleksa III do kompleksa IV i nazad. U ovom slučaju, 1 molekul citokroma C, naizmjenično oksidirajući i redukujući, prenosi 1 elektron.

IV kompleks respiratornog lanca – citokrom C oksidaza. Kompleks je nazvan oksidaza zbog sposobnosti direktne interakcije sa kiseonikom. Kod sisara, ovaj veliki (~200 kD) transmembranski protein sastoji se od 6-13 podjedinica, od kojih su neke kodirane mitohondrijskom DNK. Kompleks IV sadrži 2 hromoprotena - citokromA I citokromA 3 . Za razliku od drugih citohroma, citohromi A I A 3 svaki sadrži ne samo atom gvožđa, već i atom bakra. Bakar u sastavu ovih citohroma takođe prelazi između oksidovanog (Cu 2+) i redukovanog (Cu +) stanja tokom transporta elektrona.
Citokrom With-oksidaza katalizira jednoelektronsku oksidaciju 4 reducirane molekule citokroma With a istovremeno provodi potpunu (4-elektronsku) redukciju molekula kisika:
4 citokroma With(Fe 2+) + 4 H + + O 2 4 citokrom With(Fe 3+) + H 2 O
Protoni za formiranje molekula vode dolaze iz matrice. Treba napomenuti da je ova reakcija vrlo složena i da se odvija kroz međufaze stvaranja slobodnih radikala kisika.
Redox potencijal kompleksa IV je najveći (+0,57 v), njegova energija je sasvim dovoljna za sintezu 3 molekula ATP-a, ali se većina te energije koristi za “pumpanje” protona iz mitohondrijalnog matriksa u intermembranski prostor. U vezi sa aktivnim transportom protona, citokrom With-oksidaza je dobila ime "protonska pumpa".
Dakle, tkivno disanje je proces transporta elektrona i protona iz NAD- ili FAD-ovisnih supstrata do kisika, kao i protona koje opskrbljuje mitohondrijski matriks. Tokom transporta smanjuje se redoks potencijal, što je praćeno oslobađanjem energije sadržane u supstratima tkivnog disanja. Potpuna obnova molekularnog kisika u zraku u respiratornom lancu praćena je stvaranjem vode.