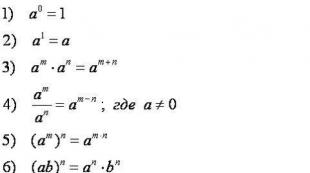الاستعدادات الكيمياء لخيارات الاستخدام التجريبي. هيكل كيم إيجر
نتيجة EGE بواسطة الكيمياء، لا تقل عن الحد الأدنى لعدد النقاط الحد الأدنى من النقاط يمنح الحق في الدخول في الجامعات في التخصص، حيث يوجد موضوع الكيمياء في قائمة اختبارات الدخول.
ليس لدى الجامعات الحق في تثبيت الحد الأدنى لعتبة الكيمياء دون 36 نقطة. الجامعات المرموقة، كقاعدة عامة، حدد الحد الأدنى لعددها أعلى بكثير. لأنه للدراسة، يجب أن تكون هناك معرفة جيدة جدا بطلاب السنة الأولى.
على الموقع الرسمي في FII، كل عام يتم نشر خيارات EEM للكيمياء: مظاهرة، الفترة المبكرة. هذه الخيارات التي تعطي فكرة عن هيكل الامتحان المستقبلي ومستوى تعقيد المهام وهي مصادر معلومات موثوقة عند التحضير للاستخدام.
خيارات أمامية للكيمياء 2017
| سنة | قم بتنزيل خيار البداية |
| 2017 | variant po himii. |
| 2016 | تحميل |
نسخة تجريبية من الامتحان في الكيمياء 2017 من FIPI
| خيارات + إجابات | تحميل عرض تجريبي |
| تخصيص | عرض تجريبي هيميا EGE |
| الترميع | kodifikator. |
في سفاحات في كيمياء عام 2017 هناك تغييرات مقارنة مع كيم الماضي 2016، لذلك من المستحسن الاستعداد وفقا للإصدار الحالي، وبالنسبة للتطوير المتنوع للخريجين لاستخدام خيارات السنوات الماضية.
مواد ومعدات إضافية
تعلق المواد التالية على كل إصدار من أعمال الفحص في الامتحان في الكيمياء:
- نظام دوري العناصر الكيميائية دي. mendeleev؛
- جدول الذوبان للأملاح والأحماض والقواعد في الماء؛
- الصف الكهروكيميائي من الفولتية المعدنية.
أثناء تنفيذ أعمال الفحص، يسمح باستخدام آلة حاسبة غير واضحة. وتم اعتماد قائمة الأجهزة والمواد الإضافية، واستخدام المسموح به للاستخدام، حسب ترتيب وزارة التعليم والعلم في روسيا.
بالنسبة لأولئك الذين يرغبون في مواصلة تعليمهم في المدرسة الثانوية، يجب أن يعتمد اختيار العناصر على قائمة اختبارات المدخل من قبل التخصص المحدد
(اتجاه الإعداد).
يتم تحديد قائمة اختبارات المدخل في الجامعات لجميع التخصصات (اتجاهات الإعداد) بترتيب وزارة التعليم والعلوم في روسيا. تختار كل جامعة من هذه القائمة من تلك أو العناصر الأخرى التي تشير إلى قواعد الاستقبال الخاصة بها. تحتاج إلى التعرف على هذه المعلومات حول مواقع الجامعات المحددة، قبل التقدم بطلب للحصول على مشاركة في الامتحان بقائمة العناصر المحددة.
11/14/2016 إعلانات نشرت على موقع Fii خيارات مظاهرة، تشفير ومواصفات مواد قياس التحكم الموحدة امتحان الدولة والامتحان الحكومي الرئيسي لعام 2017، بما في ذلك في الكيمياء.
deverovyy ege في الكيمياء 2017 مع الإجابات
| خيارات + إجابات | قم بتنزيل الإصدار التجريبي |
| تخصيص | عرض تجريبي هيميا EGE |
| الترميع | kodifikator. |
الكيمياء التجريبي تحقق 2016-2015
| كيمياء | تنزيل Demo + الردود |
| 2016 | ege 2016. |
| 2015 | eGE 2015. |
في كيم في الكيمياء في عام 2017، يتعين إعطاء تغييرات كبيرة في السنوات الماضية للتعرف على نفسها.
الكيمياء - تغييرات كبيرة: تم تحسين هيكل أعمال الفحص:
1. تغير هيكل الجزء 1 من كيم بشكل أساسي: يتم استبعاد المهام باختيار رد واحد؛ يتم تجميع المهام من خلال كتل مواضيعية منفصلة، \u200b\u200bلكل منها مهام من المستويات الأساسية والمرتفعة من التعقيد.
2. خفض إجمالي عدد المهام من 40 (في عام 2016) إلى 34.
3. غيرت مقياس التقدير (من 1 إلى 2 نقطة) أداء مهام المستوى الأساسي للتعقيد الذي تحقق من تعلم المعرفة حول الرابطة الوراثية للمواد غير العضوية والعضوية (9 و 17).
4. ستكون النقاط الأولية القصوى لأداء العمل ككل 60 نقطة (بدلا من 64 نقطة في عام 2016).
مدة الامتحان في الكيمياء
المدة الإجمالية لعمل الفحص هي 3.5 ساعات (210 دقيقة).
الوقت التقريبي المخصص لتنفيذ المهام الفردية هو:
1) لكل مهمة من المستوى الأساسي للتعقيد الجزء الأول - 2-3 دقائق؛
2) لكل مهمة التعقيد المرتفع من الجزء 1 - 5-7 دقائق؛
3) لكل مهمة مستوى عال تعقيد الجزء 2 هو 10-15 دقيقة.
لإجراء المهام 1-3، استخدم السلسلة التالية من العناصر الكيميائية. الجواب في المهام 1-3 هو تسلسل الأرقام التي يتم بموجبها المشار إليها العناصر الكيميائية في هذه السلسلة.
1) na 2) k 3) si 4) mg 5) ج
رقم المهمة 1.
حدد ذرات أي من تلك المحددة في صف العناصر هي أربعة إلكترونات على مستوى الطاقة الخارجية.
الجواب: 3؛ خمسة
عدد الإلكترونات على مستوى الطاقة الخارجية (الطبقة الإلكترونية) لعناصر المجموعات الفرعية الرئيسية يساوي رقم الرقم.
وبالتالي، فإن السيليكون والكربون مناسبون من الإجابات الممثلة، لأن هم في المجموعة الفرعية الرئيسية للمجموعة الرابعة من الجدول D.I. Mendeleeva (مجموعة IVA)، أي الإجابات الصحيحة 3 و 5.
المهمة رقم 2.
من تلك المحددة في عدد من العناصر الكيميائية، حدد ثلاثة عناصر نظام دوري العناصر الكيميائية D.I. mendeleev في فترة واحدة. ضع العناصر المحددة من أجل زيادة خصائصها المعدنية.
اكتب في حقل استجابة العناصر المحددة في التسلسل المطلوب.
الجواب: 3؛ أربعة؛ واحد
من العناصر المقدمة في فترة واحدة هناك ثلاثة - وهذا هو الصوديوم na، سيليكون سي والمغنيسيوم ملغ.
عند القيادة خلال فترة واحدة من الجدول الدوري D.I. Mendeleev (الخطوط الأفقية) على اليمين في اليسار يسهل عودة الإلكترونات الموجودة على الطبقة الخارجية، أي يتم تعزيز الخصائص المعدنية للعناصر. وبالتالي، يتم تكثيف الخصائص المعدنية للصوديوم والسيليكون والمغنيسيوم في صف SI المهمة رقم 3. من بين الأشخاص المشاركون في عدد من العناصر، حدد عناصرين تظهر درجة الأكسدة الأقل تساوي -4. سجل في مجال استجابة العناصر المحددة. الجواب: 3؛ خمسة وفقا لقاعدة الثمانية، تميل ذرات العناصر الكيميائية إلى إلكترونات مستوى الإلكترون الخارجي الخارجي، مثل الغازات النبيلة. يمكن تحقيق ذلك إما عن طريق إرجاع إلكترونات المستوى الأخير، ثم السابق، الذي يحتوي على 8 إلكترونات، أو على العكس من ذلك، فإن إضافة الإلكترونات الإضافية إلى ثمانية تصبح الخارجية. تنتمي الصوديوم والبوتاسيوم إلى المعادن القلوية وتقع في المجموعة الفرعية الرئيسية للمجموعة الأولى (IA). هذا يعني أنه على الطبقة الإلكترونية الخارجية من ذراتها هي إلكترون واحد. في هذا الصدد، فإن فقدان إلكترون واحد أكثر ربحية أكثر حيوية من انضمام سبعة آخرين. مع المغنيسيوم، فإن الوضع مشابه، فقط هو في المجموعة الفرعية الرئيسية للمجموعة الثانية، أي على مستوى الإلكترون الخارجي لديه إلكترون إلكترون. تجدر الإشارة إلى أن الصوديوم والبوتاسيوم والمغنيسيوم يرتبط بالمعادن، والمعادن، من حيث المبدأ، درجة سلبية من الأكسدة أمر مستحيل. الحد الأدنى لدرجة الأكسدة لأي معدن هو صفر ولاحظ في مواد بسيطة. العناصر الكيميائية الكربون C والسيليكون سي هي غير المعادن وتقع في المجموعة الفرعية الرئيسية للمجموعة الرابعة (IVA). هذا يعني أن هناك 4 إلكترونات على طبقة الإلكترونية الخارجية. لهذا السبب، فإن هذه العناصر ممكنة من عوائد هذه الإلكترونات وإضافة أربعة أخرى إلى إجمالي مبلغ 8M. لا يمكن إرفاق أكثر من 4 إلكترونات من ذرات السيليكون والكربون، وبالتالي فإن الحد الأدنى من درجة الأكسدة لهم هو -4. المهمة رقم 4. من القائمة المقترحة، حدد مركبين في السندات الكيميائية الأيونية موجودة. الجواب: 1؛ 3. من الممكن تحديد وجود نوع أيوني من الاتصالات في المركب في الغالبية العظمى من الحالات، من الممكن أن تكوين وحداتها الهيكلية في نفس الوقت ذرات المعدن النموذجي والذرات غير المعدنية تضمين. على هذا الأساس، نؤسس أن التواصل الأيوني متاح في مجمع في رقم 1 - كاليفورنيا (CLO 2) 2، ل في صيغتها، يمكنك أن ترى ذرات معدن الكالسيوم النموذجي وذرات غير ميتالولوف - الأكسجين والكلور. ومع ذلك، فإن المزيد من المركبات التي تحتوي في نفس الوقت على ذرات المعادن وغير المعدنية، في عنصر القائمة المحدد. بالإضافة إلى الميزة المذكورة أعلاه، يمكن قول وجود سندات أيون في المركب إذا كان تكوين الوحدة الهيكلية تحتوي على كوتا أمونيا (NH 4 +) أو النظائر العضوية الخاصة به - Cations alkymonium cations rnh 3 +، dialkylamonia r 2 nh 2 + ، Trialkilammonium R 3 NH + و TETRAKLAMMONIUM R 4 N +، حيث ص بعض الهيدروكربونات الراديكالية. على سبيل المثال، يحدث نوع الاتصال الأيوني في المركب (CH 3) 4 NCL بين الجيش (CH 3) 4 + وكلوريد كلوريد كلوريد. من بين المركبات المشار إليها في المهمة هناك كلوريد الأمونيوم، في ذلك يتم تنفيذ اتصال أيوني بين كوزي الأمونيوم من NH 4 + وكلوريد كلوريد كلوريد. المهمة رقم 5. اضبط المراسلات بين صيغة المادة والفئة / المجموعة التي تنتمي إليها هذه المادة: إلى كل موقف يشار إليه بالحرف، حدد الموضع المناسب من العمود الثاني، المشار إليه بواسطة الرقم. سجل عدد الاتصالات المحددة في حقل الاستجابة. الجواب: A-4؛ ب -1؛ في 3 تفسير: تسمى السلاسل المخبرية الأملاح الناتجة عن استبدال غير مكتمل لنقل ذرات الهيدروجين على كاتيشن معدني أو كاتيون أمونيوم أو ألغيرامونيوم. في الأحماض غير العضوية التي تمر في إطار البرنامج المدرسي، فإن جميع ذرات الهيدروجين المنقولة، وهذا هو، يمكن أن تحل محل المعدن. أمثلة على الأملاح غير العضوية الحمضية من بين القائمة المقدمة هي بيكربونات الأمونيوم NH 4 HCO 3 - نتاج استبدال واحد من ذرات الهيدروجين في حمض الفحم لكل كوزي الأمونيوم. في جوهرها، يعني الملح الحمض إلى حد ما بين الملح الطبيعي (المتوسط) والحامض. في حالة NH 4 HCO 3، المتوسط \u200b\u200bبين الملح الطبيعي (NH 4) 2 CO 3 و Carbonic Acid H 2 CO 3. في المواد العضوية، فإن ذرات الهيدروجين فقط المضمنة في مجموعات Carboxym (-SOOH) أو مجموعات هيدروكسيل من الفينول (AR-OH) قادرة على استبدال المواد العضوية. وهذا هو، على سبيل المثال، خلات الصوديوم CH 3 Coona، على الرغم من حقيقة أنه في جزيءه، لا يتم استبدال كل ذرات الهيدروجين على الكاتيونات المعدنية، وهو متوسط، وليس ملح حمض (!). لا تتمكن ذرات الهيدروجين في المواد العضوية المرفقة مباشرة على ذرة الكربون أبدا من استبدال الذرات المعدنية، باستثناء ذرات الهيدروجين مع S≡C ثلاثي من الاتصالات. أكاسيد القطع - الأكسيد غير المعدنية التي لا تشكل بأكاسيد أو قواعد الملح الرئيسية، أي إما لا تفاعل معهم على الإطلاق (في أغلب الأحيان) أو رد فعل معهم منتج مختلف (وليس الملح). غالبا ما يقال إن أكاسيد غير تشكيل أكاسيد غير ميتالول لا يتفاعل مع القواعد والأكاسيد الرئيسية. ومع ذلك، فإنه لا يعمل دائما لتحديد أكاسيد غير تشكيل. على سبيل المثال، كونها أكسيد غير تشكيل، يتفاعل مع الأكسيد الرئيسي للحديد (II)، ولكن مع تشكيل غير الملح، والمعادن المجانية: CO + FEO \u003d CO 2 + FE تتضمن أكاسيد غير تقليدية من معدل المدرسة أكاسيد غير معدن في درجة الأكسدة +1 و +2. في المجموع، يتم العثور عليها في الامتحان 4 - وهذا هو CO، NO، N، N O و Sio (آخر Sio شخصيا لم أقابل أبدا في المهام). المهمة رقم 6. من قائمة المواد المقترحة، حدد موادتين، حيث يتفاعل الحديد دون تسخين. الجواب: 2؛ أربعة كلوريد الزنك ينتمي إلى الأملاح والحديد إلى المعادن. يتفاعل المعدن مع الملح فقط إذا كان أكثر نشاطا مقارنة بتكوين الملح. يتم تحديد النشاط النسبي للمعادن لعدد من النشاط المعدني (بشكل مختلف، صف من الفولتيات المعدنية). الحديد في صف من النشاط المعدني هو حق الزنك، فهذا يعني أنه أقل نشاطا ولا يستطيع محل الزنك من الملح. وهذا هو، رد فعل الحديد مع مادة المادة 1 لا يذهب. Covo 4 Culfate (II) سوف يتفاعل Cuso 4 مع الحديد، لأن الحديد هو يسار النحاس في صف واحد من النشاط، أي معدن أكثر نشاطا. النيتروجين المركزي، وكذلك الأحماض الكبريتية المركزة غير قادرة على الرد مع الحديد والألومنيوم والكروم في ضوء هذه الظاهرة مثل التخميل: على سطح هذه المعادن تحت تأثير هذه الأحماض شكلت غير قابلة للذوبان دون تسخين الملح، والذي يتصرف كقشرة واقية. ومع ذلك، عند تسخينه، يذوب هذه القذيفة الواقية ويصبح التفاعل ممكنا. أولئك. لأنه يشار إلى أن التدفئة ليست، رد فعل الحديد مع conc. HNO 3 لا يضيء. يشير حمض السالونيك في الاستقلال عن التركيز إلى الأحماض غير المؤكسدة. مع الأحماض غير المؤكسدة مع إصدار الهيدروجين، يتفاعل المعادن في صف من نشاط يسار الهيدروجين. هذه المعادن صحيحة فقط. الخلاصة: رد فعل الحديد مع تدفقات حمض الهيدروكلوريك. في حالة أكسيد المعادن والمعادن، يكون رد الفعل، كما هو الحال في الملح، إذا كان المعدن الحر أكثر نشاطا في تكوين الأكسيد. FE، وفقا لعدد من النشاط المعدني، أقل نشاطا من آل. هذا يعني أن FE مع AL 2 O 3 لا يتفاعل. المهمة رقم 7. من القائمة المقترحة، حدد اثنين من أكسيد، والذي يتفاعل مع حل حمض الهيدروكلوريك، ولكن لا تتفاعل
مع حل هيدروكسيد الصوديوم. اكتب في مجال استجابة المواد المحددة. الجواب: 3؛ أربعة CO - أكسيد غير مؤات، مع حل مائي من القلويات لا يتفاعل. (يجب أن نتذكر ذلك، ومع ذلك، في ظروف قاسية - ارتفاع ضغط ودرجة الحرارة - كل نفس يتفاعل مع القلويات الصلبة، تشكيل فونات - أملاح حمض الفورميك.) لذلك 3 - أكسيد الكبريت (السادس) هو أكسيد الحمضي الذي يتوافق فيه حمض الكبريتيك. أكاسيد الحمض مع الأحماض والأكسيد الحمضية الأخرى لا تتفاعل. وهذا هو، لذلك 3 لا يتفاعل مع حمض الهيدروكلوريك ويتفاعل مع قاعدة هيدروكسيد الصوديوم. غير مناسب. Cuo - أكسيد النحاس (II) - تتعلق بالأكاسيد مع العقارات الرئيسية أساسا. يتفاعل مع HCL ولا تتفاعل مع محلول هيدروكسيد الصوديوم. مناسب MGO - أكسيد المغنيسيوم - الرجوع إلى أكاسيد رئيسي نموذجي. يتفاعل مع HCL ولا تتفاعل مع محلول هيدروكسيد الصوديوم. مناسب ZNO - أكسيد مع خصائص أمرائمية واضحة - يتفاعل بسهولة كلا من القواعد والأحماض القوية (وكذلك أكاسيد الحمضية والماكانية). غير مناسب. المهمة رقم 8. الجواب: 4؛ 2. مع رد الفعل بين أملاح الأحماض غير العضوية، يتم تشكيل الغاز إلا عند خلط الحلول الساخنة من أملاح النتريت والأملكة الأمونيوم بسبب تكوين نتريت الأمونيوم غير المستقر الحراري. على سبيل المثال، NH 4 CL + KNO 2 \u003d T O \u003d\u003e N 2 + 2H 2 O + KCL ومع ذلك، لا يوجد نتريت في القائمة والأملاء الأمونيوم. لذلك، أحد الأملاح الثلاثة (CU (رقم 3) 2، K 2 SO 3 و NA 2 SIO 3) يتفاعل إما مع الحمض (HCL) أو مع القلوي (NAOH). من بين أملاح الأحماض غير العضوية، تتميز أملاح الأمونيوم فقط بالغاز عند التفاعل مع القلويات: NH 4 + + OH \u003d NH 3 + H 2 O أملاح الأمونيوم، كما قلنا بالفعل، لا في القائمة. فقط مختلف عن تفاعل الملح مع بقايا الحمض. تشمل الأملاح بين هذه المواد CU (رقم 3) 2، K 2 SO 3 و NA 2 SiO 3. رد فعل نترات النحاس مع حمض الهيدروكلوريك لا يتقدم، ل لا يتم تشكيل الغاز أو الرواسب، ولا وكيل دعم منخفض (ماء أو حمض ضعيف). يتفاعل Solikat الصوديوم مع حمض الهيدروكلوريك، ومع ذلك، بسبب إطلاق رواسب الحمض السلي المكون من اللون الأبيض، وليس الغاز: NA 2 SIO 3 + 2HCL \u003d 2NACL + H 2 SIO 3 ↓ تبقى الاختلاف الأخير - تفاعل كبريتيت البوتاسيوم وحمض الهيدروكلوريك. في الواقع، نتيجة لرد فعل تبادل الأيونات بين الكبريتيت والكبريت تقريبا، يتم تشكيل حمض الكبريتيك غير المستقر، والذي يفتفي على الفور على أكسيد الغاز عديم اللون (IV) والماء. المهمة رقم 9. سجل في عدد المواتية المحددة في الجدول تحت الحروف المناسبة. الجواب: 2؛ خمسة يشير CO 2 إلى أكاسيد الأحماض وتحويله إلى ملح، من الضروري التأثير على الأكسيد الرئيسي أو القاعدة. أولئك. للحصول على من كربونات البوتاسيوم CO 2، من الضروري أن تؤثر إما على أكسيد البوتاسيوم أو هيدروكسيد البوتاسيوم. وبالتالي، فإن المادة X هي أكسيد البوتاسيوم: K 2 O + CO 2 \u003d K 2 CO 3 البوتاسيوم بيكربونات KHCO 3، وكذلك كربونات البوتاسيوم، هو ملح حمض الجوز، مع الفرق الوحيد الذي هيدروكربونات هو نتاج لاستبدال غير مكتمل من ذرات الهيدروجين في حمض الكواليك. من أجل الحصول على الملح العادي (المتوسط) مع الملح الحامض، تحتاج إما إلى التصرف به بنفس الحمض الذي يشكله هذا الملح، أو أن يكون بمثابة أكسيد الحمضي الذي يتوافق مع حمض معين، في الوجود من الماء. وهكذا، فإن y كاشف هو ثاني أكسيد الكربون. عندما يمر عبر حل كربونات البوتاسيوم المائي، فإن هذا الأخير يذهب إلى بيكربونات البوتاسيوم: K 2 CO 3 + H 2 O + CO 2 \u003d 2KHCO 3 مهمة رقم 10. قم بتثبيت المراسلات بين معادلة التفاعل وممتلكات عنصر النيتروجين، والتي موجودة في هذا التفاعل: لكل موقف المشار إليه بالحرف، حدد الموضع المقابل الذي يشار إليه الرقم. سجل في عدد المواتية المحددة في الجدول تحت الحروف المناسبة. الجواب: A-4؛ B-2؛ في 2؛ السيد. أ) NH 4 HCO 3 - الملح، والذي يتضمن كاتينا الأمونيوم NH 4 +. في كيشنيوم الأمونيوم، يحتوي النيتروجين دائما على درجة من الأكسدة تساوي -3. نتيجة لرد الفعل، يتحول إلى الأمونيا NH 3. الهيدروجين دائما تقريبا (باستثناء مركباتها مع المعادن) لديه درجة من الأكسدة يساوي +1. لذلك، بحيث يكون جزيء الأمونيا هو إلكتروني، يجب أن يكون النيتروجين درجة من الأكسدة يساوي -3. وبالتالي، لا يحدث التغييرات في درجة الأكسدة النيتروجينية، أي لا تظهر خصائص الأكسدة. ب) كما هو موضح بالفعل أعلاه، يحتوي النيتروجين في الأمونيا NH 3 على درجة من الأكسدة -3. نتيجة لرد الفعل مع CUO، تتحول الأمونيا إلى مادة بسيطة N 2. في أي مادة بسيطة، درجة الأكسدة للعنصر الذي يتم تشكيله هو الصفر. وبالتالي، فإن ذرة النيتروجين تفقد رسالتها السلبية، وبما أن الإلكترونات تتوافق مع الرسوم السلبية، مما يعني فقدان ذرة النيتروجين نتيجة لرد الفعل. عنصر يفقد الجزء من إلكتروناته نتيجة رد الفعل يسمى وكيل التقليل. ج) نتيجة لتفاعل NH 3 مع درجة أكسدة النيتروجين، يساوي -3، يتحول إلى أكسيد النيتروجين لا. دائما ما يكون الأكسجين دائما درجة من الأكسدة يساوي -2. لذلك، من أجل أن يكون جزيء أكسيد النيتروجين إلكترونيا، يجب أن يكون لدى ذرة النيتروجين درجة من الأكسدة +2. هذا يعني أن ذرة النيتروجين نتيجة لرد الفعل قد غيرت درجة الأكسدة من -3 إلى +2. يشير هذا إلى فقدان الذرة النيتروجين من 5 إلكترونات. وهذا هو، النيتروجين، كما يحدث ب، هو عامل تقليل. د) N 2 مادة بسيطة. في جميع المواد البسيطة، فإن العنصر الذي يشكلها لديه درجة من الأكسدة، يساوي 0. نتيجة لرد الفعل النيتروجين، يتم تحويل نتريد ليثيوم ليثيوم Li3n. الدرجة الوحيدة من الأكسدة المعدنية القلوية، إلى جانب الصفر (درجة أكسدة 0 هي من أي عنصر)، تساوي +1. وبهذه الطريقة أن الوحدة الهيكلية Li3n كانت إلكترونية، يجب أن يكون النيتروجين درجة من الأكسدة تساوي -3. اتضح أنه نتيجة لرد الفعل، استحوذ النيتروجين على رسوم سلبية، مما يعني إضافة الإلكترونات. النيتروجين في هذا التفاعل المؤكسد. مهمة رقم 11. قم بتثبيت المراسلات بين صيغة المادة والكواشف، حيث يمكن أن تتفاعل هذه المادة: لكل موقف يشار إليه بالحرف، حدد الموضع المقابل المشار إليه بواسطة الرقم. د) ZNBR 2 (R-P) 1) Agno 3، NA 3 PO 4، CL 2 2) باو، ح 2 O، كوه 3) H 2، CL 2، O 2 4) HBR، Lioh، Ch 3 Cooh 5) H 3 PO 4، BACL 2، كو سجل في عدد المواتية المحددة في الجدول تحت الحروف المناسبة. الجواب: A-3؛ B-2؛ في 4؛ السيد. أ) عندما يتم تمرير الهيدروجين الغازي عبر تذوب الكبريت، يتم تشكيل كبريتيد الهيدروجين H 2 S: H 2 + S \u003d T O \u003d\u003e H 2 S عندما يتم تمرير الكلور فوق الأرض، يتم تشكيل Dichloride الكبريت في درجة حرارة الغرفة: S + CL 2 \u003d SCL 2 ل surchase ege. لمعرفة بالضبط كيف يتفاعل الكبريت مع الكلور، وبناء على ذلك، تكون قادرا على تسجيل هذه المعادلة ليست ضرورية. الشيء الرئيسي هو على المستوى الرئيسي لتذكر أن الكبريت مع تفاعل الكلور. الكلور هو مؤكسد قوي، وغالبا ما يظهر الكبريت وظيفة مزدوجة - كلا من التأكسد والاستسلام. وهذا هو، إذا كان عامل مؤكسد قوي على الكبريت، وهو الكلور الجزيئي CL 2، فسوف يتأكسد. يحترق الكبريت مع لهب أزرق في الأكسجين لتشكيل الغاز مع رائحة حادة - ثاني أكسيد الكبريت حتى 2: ب) لذلك 3 - أكسيد الكبريت (السادس) قد وضح الخصائص الحمضية. بالنسبة لمثل هذه الأكاسيد، فإن ردود أفعال التفاعل مع الماء، وكذلك مع الأكاسيد الأساسية والبرفوية والهيدروكسيدات هي الأكثر تميزا. في القائمة رقم 2، نحن فقط مرئية ومياه، أكسيد الباو الرئيسي، وكوخ هيدروكسيد. في تفاعل أكسيد الحمض مع الأكسيد الرئيسي، يتم تشكيل ملح الحمض والمعادن المناسبة، وهو جزء من الأكسيد الرئيسي. ما أكسيد الحمض يتوافق مع الحمض، حيث يحتوي عنصر تشكيل الحمض على نفس درجة الأكسدة كما هو الحال في أكسيد الأكسيد. لذلك 3 أكسيد يتوافق مع حمض الكبريتيك H 2 حتى 4 (وهناك هناك، وهناك درجة أكسدة الكبريت من +6). وبالتالي، سيتم الحصول على تفاعل ذلك 3 مع أكاسيد المعادن بواسطة أملاح حمض الكبريتيك - الكبريتات التي تحتوي على كبريتات أيون حتى 4 2-: لذلك 3 + باو \u003d باسو 4 عند التفاعل مع الماء، يتحول الأكسيد الحمضي إلى حمض مناسب: لذلك 3 + H 2 O \u003d H 2 حتى 4 وفي تفاعل الأكاسيد الحمضية مع ميتال هيدروكسيدات، يتم تشكيل حمض الملح المناسب والماء: لذلك 3 + 2KOH \u003d K 2 حتى 4 + H 2 O ج) الزنك هيدروكسيد ZN (OH) 2 له خصائص أمرائمية نموذجية، وهذا هو، يتفاعل مع كل من الأكاسيد الحمضية والأحماض والأكاسيد الأساسية والقلال. في القائمة 4، نرى الأحماض - البروموم المجهر HBR واليهلي والقلويات - Lioh. أذكر أن القلويات يسمى هيدروكسيدات المياه للذوبان في الماء: ZN (OH) 2 + 2HBR \u003d ZNBR 2 + 2H 2 O ZN (OH) 2 + 2ch 3 Cooh \u003d ZN (CH 3 COO) 2 + 2H 2 O ZN (أوه) 2 + 2LOH \u003d LI 2 د) بروميد الزنك ZNBR 2 هو ملح، قابل للذوبان في الماء. للأملاح القابلة للذوبان، تفاعلات تبادل أيون هي الأكثر شيوعا. يمكن أن يتفاعل الملح مع ملح آخر، شريطة أن تكون كل من أملاح المصدر قابلة للذوبان ويتم تشكيل العجلة. أيضا، znbr 2 يحتوي على بروميد ايون br-. بالنسبة للمعادن Halides، فمن المميزة أن تكون قادرة على الرد مع هالوجينز Halogens، وهي أعلى في طاولة Mendeleev. في هذا الطريق؟ الأنواع الموصوفة من التفاعلات المضي قدما في جميع مواد القائمة 1: ZNBR 2 + 2AGNO 3 \u003d 2AGBR + ZN (رقم 3) 2 3ZNBR 2 + 2NA 3 PO 4 \u003d ZN 3 (PO 4) 2 + 6NABR ZNBR 2 + CL 2 \u003d ZNCL 2 + BR 2 المهمة رقم 12. اضبط المراسلات بين اسم المادة والفئة / المجموعة التي تنتمي إليها هذه المادة: إلى كل موقف يشار إليه الحرف، حدد الموضع المناسب المشار إليه بواسطة الرقم. سجل في عدد المواتية المحددة في الجدول تحت الحروف المناسبة. الجواب: A-4؛ B-2؛ في 1 تفسير: أ) ميثيل البنزين هو تولوين، لديه صيغة هيكلية: كما يتضح، تتكون جزيئات هذه المادة فقط من الكربون والهيدروجين، وبالتالي تشير ميثيل بينزين (التولوين) إلى الهيدروكربونات ب) الصيغة الهيكلية من أنيلين (أمينوبينزين) هي كما يلي: كما يمكن أن ينظر إليه من الصيغة الهيكلية لجزيء أنيلين يتكون من الهيدروكربون الروائي الراديكالي (C 6 H 5 -) ومجموعة أمينية (-NH 2)، وبالتالي، فإن أنيلين يشير إلى الأمينات العطرية، أي الجواب الصحيح هو 2. ج) 3-ميثيلبول. إن نهاية "" تقترح أن المادة تشير إلى الدهيدام. صيغة هيكلية لهذه المادة: مهمة رقم 13. من القائمة المقترحة، حدد موادين هي الأيزومرات الهيكلية في Bouthen-1. اكتب في مجال استجابة المواد المحددة. الجواب: 2؛ خمسة تفسير: تستدعي الأيزومرات المواد التي تحتوي على نفس الصيغة الجزيئية والهيكلية المختلفة، أي المواد التي تختلف من أجل مركب الذرات، ولكن مع نفس التركيب للجزيئات. المهمة رقم 14. من القائمة المقترحة، حدد موادتين، مع تفاعل أي حل من برمنجنات البوتاسيوم سوف يلاحظ تغييرا في لون الحل. اكتب في مجال استجابة المواد المحددة. الجواب: 3؛ خمسة تفسير: القمر، وكذلك cycloalkanes مع حجم دورة مع ذرات الكربون الخامسة أو أكثر منذر للغاية ولا تتفاعل مع حلول مائية من العوامل المؤكسدة القوية، مثل، على سبيل المثال، البوتاسيوم برمنتجانيت KMNO 4 و Dichromat Dichromat K 2 CR 2 O 7 وبعد وبالتالي، يتم اختفاء المتغيرات 1 و 4 - مع إضافة cyclohexane أو البروبان إلى محلول مائي من برمنجنات البوتاسيوم، لن يحدث تغيير اللون. من بين الهيدروكربونات من السلسلة المتماثلة من البنزين مقبولة إلى عمل حلول مائية من العوامل المؤكسدة، فقط البنزين، جميع المنتجات همنولوجيات أخرى تتأكسد اعتمادا على الأحماض المتوسطة أو إلى الكربوكسيل، أو الأملاح المقابلة. وبالتالي يختفي الخيار 2 (البنزين). الإجابات الصحيحة - 3 (Toluene) و 5 (البروبيلين). كلتا المواد تلطيخ حل البنفسجي من برمنجنات البوتاسيوم بسبب تدفق ردود الفعل: CH 3 -CH \u003d CH 2 + 2KMNO 4 + 2H 2 O → CH 3 -CH (OH) -CH 2 OH + 2MNO 2 + 2KOH المهمة رقم 15. من القائمة المقترحة، حدد موادتين يتفاعلان به الفورمالديهايد. اكتب في مجال استجابة المواد المحددة. الجواب: 3؛ أربعة تفسير: يشير الفورمالديهايد إلى فئة الألدهيديس - المركبات العضوية التي تحتوي على الأكسجين التي تحتوي على مجموعة ألديهيد في نهاية الجزيء: ردود الفعل Aldehyde النموذجية هي ردود فعل الأكسدة والانتعاش تتدفق من خلال المجموعة الوظيفية. من بين قائمة الردود على الفورمالديهايد هي رد فعل الانتعاش، حيث يتم استخدام الهيدروجين كعامل تقليل (القط. - PT، PD، NI)، والأكسدة - في هذه الحالة، رد فعل المرآة الفضية. عند استعادة الهيدروجين على محفز النيكل، يتحول الفورمالديهايد إلى الميثانول: رد فعل المرآة الفضية هو رد فعل الاسترداد الفضي من محلول الأمونيا أكسيد الفضة. عندما يتم حل الأمونيا في حل مائي، يتم تحويل أكسيد الفضة إلى مجمع مجمع - DiamonmineBra Hydroxide (I) أوه. بعد إضافة الفورمالديهايد، يتدفق تفاعل الأكسس عند استعادة الفضة: مهمة رقم 16. من القائمة المقترحة، حدد اثنين من المواد التي يتفاعل بها methylamine. اكتب في مجال استجابة المواد المحددة. الجواب: 2؛ خمسة تفسير: Methyline هو أبسط لتقديم المركبات العضوية من الأمينات الطبقة. ميزة مميزة من الأمينات هي وجود زوج إلكتروني خال من المتوسط \u200b\u200bعلى ذرة النيتروجين، ونتيجة لذلك، تظهر الأمينات خصائص القاعدة وفي التفاعلات بمثابة نواة. وبالتالي، فيما يتعلق بهذا، يتفاعل ميثيلي كقاعدة وعناية النوكلية مع حامض الكلوروميثين وحمض الهيدروكلوريك، من الخيارات المقترحة للإجابات. CH 3 NH 2 + CH 3 CL → (CH 3) 2 NH 2 + CL - CH 3 NH 2 + HCL → CH 3 NH 3 + CL - المهمة رقم 17. يتم تقديم المخطط التالي لتحويل المواد: تحديد أي من هذه المواد هي المواد x و y. سجل في عدد المواتية المحددة في الجدول تحت الحروف المناسبة. الجواب: 4؛ 2. تفسير: واحدة من ردود الفعل الحصول على الكحول هي رد فعل أزقة الهالوجين الهيدروليف. وبالتالي، من الممكن الحصول على الإيثانول من الكلوروكي من خلال بث في الأخير مع حل القلوي المائي - في هذه الحالة NAOH. CH 3 CH 2 CL + NAOH (VODN) → CH 3 CH 2 OH + NACL رد الفعل التالي هو رد فعل أكسدة الكحول الإيثيل. يتم تحويل أكسدة الكحول على محفز النحاس أو استخدام CUO: مهمة رقم 18. اضبط المراسلات بين اسم المادة والمنتج، الذي يشكل في الغالب من خلال تفاعل هذه المادة مع البروم: لكل موقف يشار إليه بالحرف، حدد الموضع المناسب الذي يشار إليه الرقم. الجواب: 5؛ 2؛ 3 6. تفسير: بالنسبة للأشوان، فإن ردود الفعل الأكثر مميزة هي ردود فعل الاستبدال الجذري المجاني، والتي يتم من خلالها استبدال ذرة الهيدروجين بذرح الهالوجين. وبالتالي، يمكن الحصول على إيثان البروم من قبل بروميتان، والبروم Isobutane - 2 بروميزوبوتان: نظرا لأن دورات صغيرة من جزيئات السيكلوبروبان والجزيئات السيكلوبوتان غير مستقرة غير مستقرة، عند الكشف عن دورات برومينات هذه الجزيئات، وبالتالي، فإن تفاعل الاتصال: على النقيض من دورات السيكلوبروباني ودورة سيكلوبوتان سيكلوهيكساني من الأحجام الكبيرة، ونتيجة لذلك يتم استبدال ذرة الهيدروجين بذرتي البروم: المهمة №19. اضبط المراسلات بين المواد التفاعلية والمنتج الذي يحتوي على الكربون، والذي يتم تشكيله أثناء تفاعل هذه المواد: لكل موقف يشار إليه بالحرف، حدد الموضع المناسب المشار إليه بواسطة الرقم. اكتب الأرقام المحددة في الجدول تحت الحروف المناسبة. الجواب: 5؛ أربعة؛ 6؛ 2. المهمة رقم 20. من قائمة أنواع رد الفعل المقترحة، حدد نوعين من ردود الفعل التي يمكن أن يعزى تفاعل المعدن القلوي بالماء. اكتب في مجال استجابة أنواع رد الفعل المحددة. الجواب: 3؛ أربعة تقع المعادن القلوية (LI، NA، K، RB، CS، FR) في المجموعات الفرعية الرئيسية الأولى من مجموعة الطاولة D.I. Mendeleev وتقليل العوامل، مما يعطي بسهولة إلكترون يقع على المستوى الخارجي. إذا قمت بتعيين الرسالة المعدنية القلوية M، فسيظهر رد فعل المعادن القلوي بالماء مثل هذا: 2M + 2H 2 O → 2MOH + H 2 المعادن القلويات نشطة للغاية فيما يتعلق بالمياه. عائدات التفاعل بعنف مع إصدار كمية كبيرة من الحرارة، لا رجعة فيه ولا تتطلب استخدام المحفز (غير النظري) - مواد تسريع رد الفعل وليس جزءا من منتجات التفاعل. تجدر الإشارة إلى أن جميع ردود الفعل المدبرة للغاية لا تتطلب استخدام المحفز والمضي قدما بشكل لا رجعة فيه. نظرا لأن المعادن والمياه هي مواد في مختلف الدول الإجمالية، فإن هذا التفاعل يتبع الحدود من قسم المرحلة، لذلك، غير متجانسة. نوع من رد الفعل هذا - استبدال. تشير ردود الفعل بين المواد غير العضوية إلى ردود الفعل الاستبدال، إذا تتفاعل مادة بسيطة مع معقدة ونتيجة لذلك يتم تشكيل المواد البسيطة والمعقدة الأخرى. (عائدات رد فعل التحييد بين الحمض والقاعدة، ونتيجة لذلك يتم تبادل هذه المواد من خلال أجزائها المتكاملة والملح ومادة تتشكيلية قليلا). كما ذكر أعلاه، يقلل المعادن القلوية من العوامل، مما يعطي إلكترونا من الطبقة الخارجية، وبالتالي فإن التفاعل هو أحمر. مهمة رقم 27. من القائمة المقترحة من التأثيرات الخارجية، حدد تأثيرين تؤدي إلى انخفاض في معدل تفاعل الإيثيلين مع الهيدروجين. اكتب في حقل استجابة عدد التأثيرات الخارجية المحددة. الجواب: 1؛ أربعة تتأثر العوامل التالية بمعدل التفاعل الكيميائي: التغيير في درجة الحرارة وتركيز الكواشف، وكذلك استخدام محفز. وفقا للحكم التجريبي للمغادرة الفتوة، بزيادة في درجة الحرارة مقابل كل 10 درجات، يزيد معدل الثابت من التفاعل المتجانس 2-4 مرات. وبالتالي، يؤدي انخفاض درجة الحرارة إلى انخفاض معدل التفاعل. الجواب الأول مناسب. كما ذكر أعلاه، فإن معدل التفاعل لديه أيضا تأثير وتغيير تركيز الكواشف: إذا كنت تزيد من تركيز الإيثيلين، فسيزداد معدل التفاعل أيضا، وهو ما لا يمتثل بمتطلبات المهمة. انخفاض في تركيز الهيدروجين هو المكون المصدر، على العكس من ذلك، يقلل من معدل التفاعل. وبالتالي، فإن الخيار الثاني غير مناسب، ولكن الرابع - مناسب. المحفز هو مادة تسريع سرعة التفاعل الكيميائي، ولكن ليس جزءا من المنتجات. إن استخدام المحفز يسرع تدفق رد فعل الهدرجين الإيثيلين، والذي لا يتوافق أيضا مع حالة المشكلة، لذلك ليس الجواب الصحيح. عندما تفاعل الإيثيلين مع الهيدروجين (على المحفزات NI، PD، PT)، يتم تشكيل إيثان: CH 2 \u003d CH 2 (G) + H 2 (G) → CH 3 -CH 3 (G) جميع المكونات المشاركة في التفاعل والمنتج هي مواد غازية، وبالتالي، فإن الضغط في النظام سيؤثر أيضا على معدل التفاعل. من بين مجلدين الإيثيلين والهيدروجين، يتم تشكيل حجم إيثان واحد، وبالتالي، فإن التفاعل هو تقليل الضغط في النظام. من خلال تعزيز الضغط، سوف نسير إلى رد الفعل. الجواب الخامس غير مناسب. المهمة №22. قم بتثبيت المراسلات بين صيغة الملح ومنتجات التحليل الكهربائي للحل المائي لهذا الملح، والذي تم توسطته على الأقطاب الكهربائية الخاملة: لكل موقف، صيغة soloi. منتجات التحليل الكهربائي اكتب الأرقام المحددة في الجدول تحت الحروف المناسبة. الجواب: 1؛ أربعة؛ 3 2. التحليل الكهربائي هو عملية الأكسدة تحدث على الأقطاب الكهربائية أثناء مرور التيار الكهربائي المباشر من خلال حل أو ذوبان بالكتروليت. في الكاثود، يفضل استعادة تلك الكاتيونات التي لديها أكبر نشاط أواسي. الأنيونات التي لديها أكبر قدر من القدرة التصالحية هي أول أكسدة على الأنود. التحليل الكهربائي للمحلول المائي 1) عملية التحليل الكهربائي للحلول المائية على الكاثود لا يعتمد على المواد الكاثودة، ولكن يعتمد على موقف الكاتيون المعدني في الصف الكهروكيميائي من الضغوط. للاتصالات في الصف LI + - - - عملية الاسترداد: 2H 2 O + 2E → H 2 + 2OH - (على الكاثود H 2 تبرز) ZN 2+ - PB 2+ عملية الاسترداد: لي N + + NE → ME 0 و 2 H 2 O + 2E → H 2 + 2OH - (على الكاثود H 2 وأنا سوف تخصيص) CU 2+ - AU 3+ عملية الاسترداد لي N + + NE → ME 0 (لي يبرز على الكاثود) 2) تعتمد عملية التحليل الكهرلي للحلول المائية على الأنود على مواد الأنود وطبيعة الأنيون. إذا كان الأنود غير قابل للذوبان، أي خامل (البلاتين، الذهب، الفحم، الجرافيت)، ثم ستعتمد العملية فقط على طبيعة الأنيونات. بالنسبة إلى الأنيونات F -، لذلك 4 2-، رقم 3 -، بو 4 3-، أوه - عملية الأكسدة: 4OH - - 4e → O 2 + 2H 2 O أو 2H 2 O - 4E → O 2 + 4H + (يتم إصدار الأكسجين على الأنود) من أيونات هاليد (باستثناء F-) عملية الأكسدة 2 هي - - 2e → Hal 2 (مجانا يتم تسليط الضوء على Halogens) عملية أكسدة الأحماض العضوية: 2RCOO - - 2E → R-R + 2CO 2 إجمالي معادلة التحليل الكهربائي: أ) حل 3 بو 4 2h 2 O → 2h 2 (على الكاثود) + O 2 (على الأنود) ب) حل KCL 2KCL + 2H 2 O → H 2 (على الكاثود) + 2KOH + CL 2 (على الأنود) ج) حل Cubr2 COBR 2 → CU (على الكاثود) + BR 2 (على الأنود) د) حل CU (NO3) 2 2CU (رقم 3) 2 + 2H 2 O → 2CU (على الكاثود) + 4hno 3 + O 2 (على الأنود) مهمة رقم 23. اضبط المراسلات بين اسم الملح ونسبة الملح إلى التحلل المائي: لكل موقف المشار إليه بالحرف، حدد الموضع المناسب المشار إليه بواسطة الرقم. اكتب الأرقام المحددة في الجدول تحت الحروف المناسبة. الجواب: 1؛ 3 2؛ أربعة التحلل المائي للأملاح - تفاعل أملاح المياه، مما يؤدي إلى إضافة جزيئات كوتشن هيدروجين H + جزيئات المياه إلى أنيون من بقايا الحمض و (أو) من مجموعة هيدروكسيل أوه - جزيئات الماء إلى الكيشن المعدني. يتعرض التحلل المائي للأملاح التي تشكلها CETSICS المقابلة للقواعد الضعيفة، والانيونات تتوافق مع الأحماض الضعيفة. أ) كلوريد الأمونيوم (NH 4 CL) - يتعرض الملح الذي شكله حمض الهيدروكلوريك القوي والأمونيا (قاعدة ضعيفة)، للتحلل المائي في الجيش. NH 4 CL → NH 4 + + CL - NH 4 + + H 2 O → NH 3 · H 2 O + H + (شكل الأمونيا المذاب في الماء) Sycola Solution متوسط \u200b\u200b(درجة الحموضة< 7). ب) كبريتات البوتاسيوم (ك 2 حتى 4) هو ملح تشكله حمض الكبريتيك القوي وهيدروكسيد البوتاسيوم (القلوي، أي قاعدة قوية)، لا يتعرض التحلل المائي. ك 2 حتى 4 → 2K + + حتى 4 2- ج) كربونات الصوديوم (NA 2 CO 3) هو الملح الذي تشكلته حمض الفحم ضعيف وهيدروكسيد الصوديوم (القلوي، أي قاعدة قوية) يتعرض للتحلل المائي على أنيون. CO 3 2- + H 2 O → HCO 3 - + OH - (تشكيل بيكربونات بيكربونات ضعيف) محلول القلوية متوسطة (PH\u003e 7). د) كبريتيد الألومنيوم (AL 2 S 3) - الملح الذي تم تشكيله بواسطة حمض كبريتيد الهيدروجين الضعيف وهيدروكسيد الألمنيوم (قاعدة ضعيفة)، يتعرض لإكمال التحلل المائي لتشكيل هيدروكسيد الألمنيوم والهيدروجين هيدروكسيد: al 2 s 3 + 6h 2 → 2al (OH) 3 + 3H 2 S المتوسط \u200b\u200bقريب من محايد (PH ~ 7). مهمة رقم 24. قم بتثبيت المراسلات بين معادلة التفاعل الكيميائي واتجاه النزوح في التوازن الكيميائي عن طريق زيادة الضغط في النظام: لكل موقف المشار إليه بالحرف، حدد الموضع المقابل المشار إليه بواسطة الرقم. معادلة رد الفعل أ) ن 2 (ز) + 3H 2 (ز) ↔ 2NH 3 (ز) ب) 2 h 2 (g) + o 2 (g) ↔ 2h 2 O (g) ج) H 2 (G) + CL 2 (G) ↔ 2HCL (G) د) حتى 2 (ز) + CL 2 (G) ↔ ذلك 2 CL 2 (G) اتجاه النزوح في التوازن الكيميائي 1) التحولات نحو رد الفعل المباشر 2) التحولات نحو رد الفعل العكسي 3) لا النزوح التوازن اكتب الأرقام المحددة في الجدول تحت الحروف المناسبة. الجواب: A-1؛ ب -1؛ في 3؛ السيد. رد الفعل في التوازن الكيميائي، عندما يكون معدل التفاعل المباشر يساوي سرعة العكس. يتم تحقيق نزوح التوازن في الاتجاه المطلوب عن طريق تغيير شروط التفاعل. العوامل التي تحدد موقف التوازن: - الضغط: زيادة الضغط تحولات التوازن نحو رد الفعل الذي يؤدي إلى انخفاض في الحجم (على العكس من ذلك، تخفيض الضغط يعرض التوازن نحو رد الفعل الذي يؤدي إلى زيادة الحجم) - درجة الحرارة: زيادة درجة الحرارة تتحول الرصيد نحو رد الفعل الحراري (على العكس من ذلك، الانخفاض في درجة الحرارة ينقل التوازن نحو رد الفعل الدليلي) - تركيز المواد المصدر ومنتجات التفاعل: زيادة تركيز مواد البدء وإزالة المنتجات من مجال رد الفعل تحول الرصيد نحو رد الفعل المباشر (على العكس من ذلك، انخفاض في تركيز المواد البدء وزيادة في منتجات التفاعل تحول التوازن نحو رد الفعل العكسي) - المحفزات لا تؤثر على نزوح التوازن، ولكن يسرع فقط إنجازه. أ) في الحالة الأولى، يأتي التفاعل مع انخفاض في الحجم، حيث v (n 2) + 3V (H 2)\u003e 2V (NH 3). من خلال تعزيز الضغط في النظام، ستتحول التوازن نحو حجم أصغر من المواد، وبالتالي، في الاتجاه المباشر (نحو رد الفعل المباشر). ب) في الحالة الثانية، يأتي رد الفعل أيضا مع انخفاض في الحجم، نظرا لأن 2 فولت (H 2) + v (O 2)\u003e 2V (H 2 O). من خلال تعزيز الضغط في النظام، سيحول التوازن أيضا نحو رد الفعل المباشر (نحو المنتج). ج) في الحالة الثالثة، لا يتغير الضغط أثناء التفاعل، لأن v (h 2) + v (cl 2) \u003d 2V (HCL)، لذلك يحدث أي نزوح توازن. د) في الحالة الرابعة، يأتي رد الفعل أيضا بانخفاض الحجم في الحجم، حيث v (حتى 2) + v (cl 2)\u003e v (لذلك 2 CL 2). من خلال زيادة الضغط في النظام، سيتحول الرصيد نحو تكوين المنتج (رد فعل مباشر). المهمة №25. اضبط المراسلات بين صيغ المواد والكاشف، حيث يمكنك التمييز بين حلولها المائية: لكل موقف المشار إليه بالحرف، حدد الموضع المناسب المشار إليه بواسطة الرقم. صيغ المواد أ) HNO 3 و H 2 O ج) nacl و bacl 2 د) Alcl 3 و MGCL 2 اكتب الأرقام المحددة في الجدول تحت الحروف المناسبة. الجواب: A-1؛ B-3؛ في 3؛ م -2. أ) الحمض النتراتي والماء يمكن تمييزها عن طريق الملح - كربونات الكالسيوم Caco 3. لا يذوب كربونات الكالسيوم في الماء، وعند التفاعل مع حمض النيتريك، فإنه يشكل ملحا قابل للذوبان - نترات الكالسيوم (رقم 3) 2، في حين أن رد الفعل مصحوبا بفصل ثاني أكسيد الكربون عديم اللون: CACO 3 + 2HNO 3 → CA (رقم 3) 2 + CO 2 + H 2 O ب) يمكن اختيار كلوريد البوتاسيوم KCL والقلويات نوح من خلال حل كبريتات النحاس (II). مع تفاعل كبريتات النحاس (II) مع KCL، لا يتدفق رد فعل التبادل، وهناك K +، CL -، CU 2+ وهكذا 4 أيونات في الحل، والتي لا تشكل موادا قليلة صغيرة في بعضها البعض. مع تفاعل النحاس (II) كبريتات مع NAOH، تدفق تفاعل التبادل، نتيجة له \u200b\u200bهيدروكسيد النحاس (2) يقع في الترسب. ج) كلوريد الصوديوم NACL و BARIUM BACL 2 - الأملاح القابلة للذوبان، والتي يمكن أيضا إفصاحها أيضا مع حل كبريتات النحاس (II). في تفاعل النحاس (II) كبريتات مع NACL، لا يتبع رد فعل التبادل، وهناك NA +، CL -، CU 2+ وهكذا 4 أيونات في الحل، والتي لا تشكل موادا ساراتية صغيرة في بعضها البعض. عندما تفاعل كبريتات النحاس (II) مع عائدات BACL 2، تدفق رد فعل التبادل، نتيجة لكبريتات بار الباريوم الباريوم 4 في الترسب. د) Alcl 3 وكلوريد الألومنيوم المغنيسيوم MGCL 2 تذوب في الماء وتتصرف بشكل مختلف عند التفاعل مع هيدروكسيد البوتاسيوم. كلوريد المغنيسيوم مع القلوي يشكل مترسيتا: MGCL 2 + 2KOH → MG (OH) 2 ↓ + 2kcl في تفاعل القلوي مع كلوريد الألومنيوم، يتم تشكيل العجلة لأول مرة، والذي يذوب بعد ذلك لتشكيل ملح معقد - رباعي البوتاسيوم TetrahyDroxient: Alcl 3 + 4koh → K + 3KCL مهمة رقم 26. قم بتثبيت المراسلات بين المادة ومنطقة التطبيق: لكل موضع يشار إليه الحرف، حدد الموضع المناسب المشار إليه بواسطة الرقم. اكتب الأرقام المحددة في الجدول تحت الحروف المناسبة. الجواب: A-4؛ B-2؛ في 3؛ السيد. أ) الأمونيا هي منتج أساسي للصناعة الكيميائية، إنتاجها أكثر من 130 مليون طن سنويا. يستخدم معظمها الأمونيا في إعداد الأسمدة النيتروجينية (نترات وكبريتات الأمونيوم، اليوريا)، المخدرات، المتفجرات، حمض النيتريك، الصودا. من بين خيارات الإجابات المقترحة، فإن منطقة الأمونيا هي إنتاج الأسمدة (خيار الإجابة الرابعة). ب) الميثان هو أبسط هيدروكربون، الممثل الأكثر استدامة حراريا لعدد من المركبات الحد. يستخدم على نطاق واسع كوقود محلي وصناعي، وكذلك المواد الخام لصناعة الخيار الثاني). الميثان 90-98٪ هو جزء من الغاز الطبيعي. ج) المطاط يسمى المواد، نحصل على البلمرة من المركبات مع الروابط المزدوجة المترافقة. Isoprene يتبع هذا النوع من المركبات ويستخدم للحصول على أحد أنواع المطاط: د) يتم استخدام ألكينز منخفض الوزن الجزيئي للحصول على البلاستيك، على وجه الخصوص، يستخدم الإيثيلين للحصول على البلاستيك، يسمى البولي ايثيلين: ن.الفصل 2 \u003d الفصل 2 → (-ch 2 -ch 2 -) ن مهمة رقم 27. احسب كتلة نترات البوتاسيوم (في غرام)، والتي ينبغي إذابا في 150 غرام من الحل مع جزء كبير من هذا الملح 10٪ للحصول على حل مع جزء كبير من 12٪. (سجل الرقم يصل إلى أعشار.) الجواب: 3.4 غرام تفسير: دع X GO كن كتلة من نترات البوتاسيوم، والتي يتم حلها في 150 غرام من الحل. نقوم بحساب كتلة نترات البوتاسيوم المذابة في 150 غرام من الحل: m (kno 3) \u003d 150 غرام · 0.1 \u003d 15 غرام من أجل أن يكون جزء كبير من الملح 12٪، تمت إضافة X G من نترات البوتاسيوم. كانت كتلة الحل (150 + X)، ستكتب المعادلة المعادلة في النموذج: (سجل الرقم يصل إلى أعشار.) الجواب: 14.4 غرام تفسير: نتيجة حرق إجمالي كبريتيد الهيدروجين، يتم تشكيل ثاني أكسيد الكبريت: 2h 2 S + 3O 2 → 2SO 2 + 2H 2 O إن نتيجة قانون Avogadro هو أن حجم الغازات في نفس الشروط تتعلق ببعضها البعض وكذلك كميات هذه الغازات. وبالتالي، وفقا لمعادلة التفاعل: ν (O 2) \u003d 3 / 2ν (H 2 S)، وبالتالي، فإن حجم كبريتيد الهيدروجين وأكسجين يرتبط مع بعضها البعض بنفس الطريقة: v (o 2) \u003d 3 / 2V (H 2 S)، V (O 2) \u003d 3/2 · 6.72 L \u003d 10.08 L، ومن ثم v (O 2) \u003d 10.08 L / 22.4 L / MOL \u003d 0.45 مول نحسب كتلة الأكسجين اللازمة للحرق الكلي لكبريتيد الهيدروجين: m (O 2) \u003d 0.45 مول · 32 جم / مول \u003d 14.4 غرام المهمة رقم 30. باستخدام طريقة التوازن الإلكتروني، اجعل معادلة التفاعل: NA 2 SO 3 + ... + KOH → K 2 MNO 4 + ... + H 2 O تحديد الوكيل المؤكسد وتقليل الوكيل. MN +7 + 1E → MN +6 │2 رد فعل الاسترداد S +4 - 2E → S +6 │1 رد فعل الأكسدة MN +7 (KMNO 4) - المؤكسد، S +4 (NA 2 SO 3) - استعادة NA 2 SO 3 + 2KMNO 4 + 2KOH → 2K 2 MNO 4 + NA 2 SO 4 + H 2 O مهمة رقم 31. تم حل الحديد في حمض الكبريتيك المركزة الساخن. تم علاج الملح الناتج عن حل فائض من هيدروكسيد الصوديوم. تم ترشيح الترسب البني الناتج والتصميل. تم تسخين المادة الناتجة بالحديد. اكتب معادلات أربعة ردود الفعل الموصوفة. 1) الحديد، مثل الألمنيوم والكروم، لا تتفاعل مع حمض الكبريتيك المركزة، تغطي فيلم أكسيد الواقي. يحدث التفاعل فقط عند تسخينه بفصل غاز الكبريت: 2FE + 6H 2 حتى 4 → FE 2 (حتى 4) 2 + 3SO 2 + 6H 2 O (عند تسخين) 2) كبريتات الحديد (III) - الملح القابل للذوبان في الماء، يدخل في تفاعل تبادل القلوي، نتيجة له \u200b\u200bحديد (III) هيدروكسيد (اتصال III) قد عجل: FE 2 (حتى 4) 3 + 3NAOH → 2FE (OH) 3 ↓ + 3NA 2 حتى 4 3) هيدروكسيدات المعادن غير القابلة للذوبان مع تحلل التحلل إلى أكاسيد ومياه مناسبة: 2fe (أوه) 3 → FE 2 O 3 + 3H 2 O 4) عند تسخين أكسيد الحديد (III) مع الحديد المعدني، يتم تشكيل الحديد (II) (الحديد في اتصال FOO لديه درجة متوسطة من الأكسدة): FE 2 O 3 + FE → 3FEO (عند تسخينها) المهمة رقم 32. اكتب معادلات التفاعل التي يمكن بها تنفيذ التحولات التالية: عند كتابة معادلات التفاعل، استخدم الصيغ الهيكلية للمواد العضوية. 1) يحدث الجفاف داخل الخلايا في درجات حرارة أعلى من 140 درجة مئوية. يحدث هذا نتيجة لانقسام ذرة الهيدروجين من ذرة الكربون الكحولية الموجودة عبر واحدة إلى الكحول هيدروكسيل (في وضع β). CH 3 -CH 2 -CH 2 -H 2 -OH → CH 2 \u003d Ch-CH 3 + H 2 O (الشروط - H 2 SO 4، 180 O C) يحدث الجفاف بين المتزوجين عند درجة حرارة أقل من 140 درجة مئوية مقابل عمل حمض الكبريتيك ويقلل في النهاية إلى انقسام جزيء مائي واحد من جزيئات الكحول. 2) البروبيلين يشير إلى ألكين غير المتماثلة. مع إضافة الهيدروجين الهلام والمياه، ينضم ذرة الهيدروجين إلى ذرة الكربون في اتصال متعدد مرتبط بعدد كبير من ذرات الهيدروجين: CH 2 \u003d Ch-CH 3 + HCL → CH 3 -Chcl-CH 3 3) يتصرف مع حل مائي من Naoh على 2-كللوبروبان، يتم استبدال ذرة الهالوجين بمجموعة هيدروكسيل: CH 3 -CHCL-CH 3 + NAOH (AQ) → CH 3 -Choh-CH 3 + NACL 4) من الممكن الحصول على البروبيلين ليس فقط من Propanol-1، ولكن أيضا من رد فعل Propanol-2 من الجفاف داخل الخلايا في درجات حرارة فوق 140 درجة مئوية: CH 3 -CH (OH) -CH 3 → CH 2 \u003d Ch-CH 3 + H 2 O (الشروط H 2 SO 4، 180 O C) 5) في وسط القلوية، يتصرف في مخففة مع حل مائي من برمنجنات البوتاسيوم، يحدث هيدروكسيلات ألكينس مع تكوين Diols: 3CH 2 \u003d Ch-CH 3 + 2KMNO 4 + 4H 2 O → 3Hoch 2 -ch (OH) -CH 3 + 2MNO 2 + 2KOH المهمة رقم 33. تحديد الكسور الجماعية (في٪) من كبريتات الحديد (2) الكبريتيد والألومنيوم كبريتيد الألومنيوم في الخليط، إذا تم تزويد معالجة 25 غرام من هذا الخليط بالماء، والذي كان رد فعل تماما مع 960 غرام من محلول 5٪ من كبريتات النحاس ( ثانيا). ردا على ذلك، اكتب معادلات التفاعل المحددة في حالة المهمة، وجلب كل الحسابات اللازمة (حدد وحدات قياس المرغوبة كميات فيزيائية). الإجابة: (al 2 s 3) \u003d 40٪؛ (cuso 4) \u003d 60٪ عند معالجة مزيج من الحديد (II) كبريتيد الكبريتيد والألومنيوم، يتم حل الكبريتات ببساطة، والكبريتيد هيدروليجيد لتشكيل هيدروكسيد الألومنيوم (3) وكبريتيد الهيدروجين: آل 2 S 3 + 6H 2 O → 2al (OH) 3 ↓ + 3h 2 S (I) عندما يتم تمرير كبريتيد الهيدروجين من خلال حل محلول كبريتات النحاس (II)، فولت كبريتيد النحاس (II): Cuso 4 + H 2 S → Cus ↓ + H 2 SO 4 (II) نحسب الكتلة وكمية جوهر كبريتات النحاس المذابة (II): m (cuso 4) \u003d m (p-ra) · (cuso 4) \u003d 960 g · 0.05 \u003d 48 جم؛ ν (cuso 4) \u003d m (cuso 4) / m (cuso 4) \u003d 48 g / 160 g \u003d 0.3 مول وفقا لمعادلة التفاعل (II) ν (Cuso 4) \u003d ν (H 2 S) \u003d 0.3 مول، ووفقا لمعادلة التفاعل (III) ν (al 2 s 3) \u003d 1 / 3ν (h 2 s) \u003d 0، 1 مول احسب كتلة كبريتيد الألومنيوم وكبريتات النحاس (II): m (al 2 s 3) \u003d 0.1 مول · 150 جم / مول \u003d 15 غرام؛ م (cuso4) \u003d 25 غرام - 15 غرام \u003d 10 غرام (al 2 s 3) \u003d 15 جم / 25 جرام · 100٪ \u003d 60٪؛ (كوزو 4) \u003d 10 جم / 25 جرام · 100٪ \u003d 40٪ المهمة رقم 34. عند حرق عينة من بعض مركب عضوي تم الحصول على الوزن 14.8 غرام 35.2 غرام من ثاني أكسيد الكربون و 18.0 غرام من الماء. من المعروف أن الكثافة النسبية لبخار هذه المادة على طول الهيدروجين تساوي 37. أثناء الدراسة الخواص الكيميائية تم إنشاء هذه المادة أنه مع تفاعل هذه المادة مع أكسيد النحاس (II)، يتم تشكيل كيتون. بناء على هذه الشروط المهمة: 1) تحسب اللازمة لإنشاء صيغة جزيئية عضوي (حدد وحدات قياس الكميات المادية المطلوبة)؛ 2) اكتب الصيغة الجزيئية للمادة العضوية الأصلية؛ 3) جعل الصيغة الهيكلية لهذه المادة، والتي تعكس بشكل فريد ترتيب الاتصالات في جزيءها؛ 4) اكتب معادلة التفاعل لهذه المادة بأكسيد النحاس (II) باستخدام الصيغة الهيكلية للمادة. تحتوي مهام الاختبار النموذجية للكيمياء على 10 خيارات لمجموعات من المهام المستمدة مع الأخذ في الاعتبار جميع ميزات ومتطلبات امتحان الدولة الموحد في عام 2017. الغرض من الدليل هو توفير معلومات القراء حول هيكل ومحتوى كيم 2017 في الكيمياء، درجة صعوبة المهام. أمثلة. من القائمة المقترحة من المواد، حدد موادتين مع كل منها يتفاعل النحاس. المحتوى تخصيص 1. تعيين كيم EGE يعد امتحان الدولة الموحد (المشار إليه فيما يلي باسم EGE) تقييم موضوعي لجودة تدريب الأشخاص الذين أتقنوا البرامج التعليمية للتعليم العام الثانوي، باستخدام مهام النموذج الموحد (مواد قياس التحكم). تعقد EGE وفقا للقانون الاتحادي ل 29 ديسمبر 2012 رقم 273-FZ "بشأن التعليم في الاتحاد الروسي". تسمح لك مواد قياس التحكم بضبط مستوى التطوير من قبل خريجي المكون الفيدرالي معيار الدولة التعليم العام المتوسط \u200b\u200b(الكامل) في الكيمياء والمستويات الأساسية والملفية. يتم التعرف على نتائج امتحان الدولة الموحد للكيمياء المنظمات التعليمية التعليم المهني الثانوي والمنظمات التعليمية التعليمية المرتفعة التعليم المهني باعتبارها نتائج اختبارات الدخول في الكيمياء. 2. المستندات التي تحدد محتوى كيم EGE 3. نهج اختيار المحتوى، تطوير هيكل كيم EGE بلغ أساس النهج لتطوير كيم EGE 2017 في الكيمياء تلك المواقف المنهجية العامة التي تم تحديدها أثناء تشكيل نماذج فحص السنوات السابقة. جوهر هذه الإعدادات كما يلي. 4. هيكل CIM EGE تم بناء كل إصدار من أعمال الفحص وفقا للخطة الموحدة: يتكون العمل من جزأين، بما في ذلك 40 مهام. يحتوي الجزء 1 على 35 مهام مع استجابة موجزة، بما في ذلك 26 مهام المستوى الأساسي للتعقيد (الأرقام الترتيبية لهذه المهام: 1، 2، 3، 4، ... 26) و 9 مهام المستوى المرتفع من التعقيد ( أرقام تسلسل هذه المهام: 27، 28، 29، ... 35). يحتوي الجزء 2 على 5 مهام ذات مستوى عال من التعقيد، مع استجابة مفصلة (أرقام ترتيبية لهذه المهام: 36، 37، 38، 39، 40).صيغة المواد
الكواشف
في المجموعة هناك إجابات لجميع خيارات الاختبار والحلول يتم تقديم جميع مهام واحد من الخيارات. بالإضافة إلى ذلك، يتم إعطاء عينات من النماذج المستخدمة في الاستخدام لتسجيل الردود والحلول.
مؤلف المهام هو عالم رائد، مدرس ومهدوجي يأخذ المشاركة المباشرة في تطوير مواد قياس الرقابة من EGE.
يهدف الدليل للمدرسين إلى إعداد الطلاب لامتحان الكيمياء، بالإضافة إلى طلاب المدارس الثانوية والخريجين - للتحضير الذاتي والتحكم الذاتي.
في كلوريد الأمونيوم هناك روابط كيميائية:
1) أيوني
2) القطبية التساهمية
3) سوينط غير قطبي
4) الهيدروجين
5) المعادن
1) كلوريد الزنك (R-P)
2) كبريتات الصوديوم (RR)
3) تخفيف حمض النيتريك
4) حامض الكبريتيك المركزة
5) أكسيد الألومنيوم
مقدمة
تعليمات لأداء العمل
الخيار 1
الجزء 1.
الجزء 2
الخيار 2.
الجزء 1.
الجزء 2
الخيار 3.
الجزء 1.
الجزء 2
الخيار 4.
الجزء 1.
الجزء 2
الخيار 5.
الجزء 1.
الجزء 2
الخيار 6.
الجزء 1.
الجزء 2
الخيار 7.
الجزء 1.
الجزء 2
الخيار 8.
الجزء 1.
الجزء 2
الخيار 9.
الجزء 1.
الجزء 2
الخيار 10.
الجزء 1.
الجزء 2
الإجابات والحلول
إجابات على مهام الجزء 1
الحلول والإجابات على مهام الجزء 2
محلول مهام الخيار 10
الجزء 1.
الجزء 2.
تحميل مجاني كتاب إليكتروني بتنسيق مناسب ومشاهدة وقراءة:
تحميل كتاب EEE 2017، الكيمياء، الاختبارات النموذجية، Medvedev Yu.n. - fileskachat.com، تحميل سريع ومجاني.
مراقبة مواد القياس
لعقد امتحان دولة واحدة في عام 2017
في الكيمياء