Cum se determină nivelul de energie externă. Niveluri de energie externă: caracteristici structurale și rolul lor în interacțiunile dintre atomi. Misiuni de autoajutorare
Raspuns de la Ksenia Gareeva[guru]
numărul perioadei
Raspuns de la Slava mikailov[incepator]
Raspuns de la Argumentați[guru]
Nivel de energie
De la Wikipedia, enciclopedia liberă
Nivel de energie - valorile posibile ale energiei sistemelor cuantice, adică sisteme formate din microparticule (electroni, protoni și alte particule elementare, nuclee atomice, atomi, molecule etc.) și respectând legile mecanicii cuantice. Caracterizează o anumită stare a unei microparticule. Distingeți între nivelurile de energie electronică și intranucleară.
[Editați | ×]
Nivelurile de energie electronică
Conceptul modern al modelului orbital al atomului, în care electronii se deplasează de la un nivel de energie la altul, iar diferența dintre nivelurile de energie determină dimensiunea cuantumului eliberat sau absorbit. În acest caz, electronii nu pot fi în intervalele dintre nivelurile de energie. Aceste goluri se numesc decalaj energetic.
Un exemplu este un electron în modelul orbital al unui atom - în funcție de valorile numărului cuantic principal n și ale numărului cuantic orbital l, nivelul de energie pe care îl posedă electronul se modifică. În consecință, fiecare pereche de valori ale numerelor n și l corespunde unui anumit nivel de energie.
[Editați | ×]
Nivelurile de energie intranucleară
Termenul provine din cercetarea radioactivității. Radiația este împărțită în trei părți: raze alfa, raze beta și raze gamma. Studiile au arătat că radiația alfa era formată din atomi de heliu, radiația beta este un flux de electroni care se mișcă rapid, iar studiul razelor gamma a arătat că energia nivelurilor electronice nu este suficientă pentru a le crea. A devenit clar că sursa de radiații radioactive (razele gamma) trebuie căutată în interiorul nucleului atomic, adică există niveluri de energie intranucleară, a căror energie este convertită în fotoni de radiație gamma. Razele gamma au lărgit spectrul undelor electromagnetice cunoscute și toate undele mai scurte de 0,01 nm sunt raze gamma.
Încercați să vă imaginați cât de mici sunt atomii în comparație cu dimensiunea moleculelor înseși în acest exemplu.
Să umplem o minge de cauciuc cu gaz. Dacă presupunem că un milion de molecule pe secundă vor ieși din minge printr-o puncție subțire, atunci va dura 30 de miliarde de ani pentru ca toate moleculele să scape din minge. Dar compoziția unei molecule poate include doi, trei și poate câteva zeci sau chiar câteva mii de atomi!
Tehnologia modernă a făcut posibilă fotografiarea atât a moleculei, cât și a atomului folosind un microscop special. Molecula a fost fotografiată cu o mărire de 70 de milioane de ori, iar atomul - de 260 de milioane de ori.
Multă vreme, oamenii de știință au crezut că atomul este indivizibil. Chiar și un cuvânt atom tradus din greacă înseamnă "indivizibil". Cu toate acestea, mulți ani de cercetări au arătat că, în ciuda dimensiunilor lor mici, atomii constau din părți și mai mici ( particule elementare).
Nu-i așa că structura atomului seamănă Sistem solar ?
V centrul atomului - nucleul în jurul căruia electronii se mișcă la o anumită distanță
Miez- partea cea mai grea a atomului, masa atomului este concentrata in ea.
Nucleul și electronii au sarcini electrice care sunt opuse ca semn, dar egale ca mărime.
Nucleul are o sarcină pozitivă, electronii sunt negativi, deci atomul în ansamblu nu este încărcat.
Tine minte
Toți atomii au un nucleu și electroni. Atomii diferă între ei: masa și sarcina nucleului; numarul de electroni.
Exercițiu
Numărați numărul de electroni din atomii de aluminiu, carbon, hidrogen. Completați tabelul.
|
· Numele atomului |
Numărul de electroni dintr-un atom |
|
Atom de aluminiu |
|
|
Atom de carbon |
|
|
Atom de hidrogen |
Vrei să afli mai multe despre structura atomului? Apoi citește mai departe.
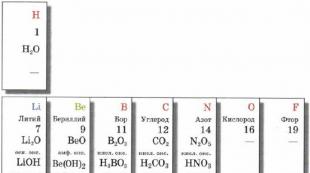
Sarcina nucleului atomic este determinată de numărul ordinal al elementului.
De exemplu , numărul ordinal al hidrogenului este 1 (determinat de Tabelul periodic al lui Mendeleev), ceea ce înseamnă că sarcina nucleului atomic este +1.
Numărul ordinal al siliciului este 14 (determinat de Tabelul periodic al lui Mendeleev), ceea ce înseamnă că sarcina nucleului atomului de siliciu este +14.
Pentru ca un atom să fie neutru din punct de vedere electric, numărul de sarcini pozitive și negative din atom trebuie să fie același
(suma va fi zero).
Numărul de electroni (particule încărcate negativ) este egal cu sarcina nucleului (particule încărcate pozitiv) și este egal cu numărul ordinal al elementului.
Un atom de hidrogen are 1 electron, siliciul are 14 electroni.
Electronii dintr-un atom se deplasează prin niveluri de energie.
Numărul de niveluri de energie dintr-un atom este determinat de numărul perioadei,în care se află elementul (determinat și de Tabelul periodic al lui Mendeleev)
De exemplu, hidrogenul este un element al primei perioade, așa că are
1 este un nivel de energie, iar siliciul este un element al celei de-a treia perioade, prin urmare 14 electroni sunt distribuiți pe trei niveluri de energie. Oxigenul și carbonul sunt elemente din a treia perioadă, astfel încât electronii se deplasează prin trei niveluri de energie.
Exercițiu
1. Care este sarcina nucleului în atomii elementelor chimice prezentate în figură?
2. Câte niveluri de energie există în atomul de aluminiu?
1 (2 puncte). Distribuția electronilor în funcție de nivelurile de energie într-un atom de potasiu:A. 2e, 8e, 8e, 1e C. 2e, 8e,
18, 8, 1
B. 2, 1 D. 2, 8, 1
2 (2 puncte). Numărul de electroni din stratul exterior de electroni al unui atom de aluminiu:
A. 1 B. 2 C. 3 D.4
3 (2 puncte). O substanță simplă cu cele mai pronunțate proprietăți metalice:
A. Calciu B. Bariu C. Stronţiu G. Radiu
4 (2 puncte). Tipul de legătură chimică într-o substanță simplă - aluminiu:
A. Ionic B. Polar covalent
B. Metalic D. Covalent nepolar
5 (2 puncte). Numărul de niveluri de energie pentru elementele unui subgrup de sus în jos:
A. Schimbări periodice. B. Nu se schimbă.
B. Creșteri. G. Scăderi.
6 (2 puncte). Atomul de litiu este diferit de ionul de litiu:
A. Sarcina nucleară. B. Numărul de electroni din nivelul de energie externă.
B. Numărul de protoni. D. Numărul de neutroni.
7 (2 puncte.). Reactioneaza cel mai putin viguros cu apa:
A. Bariu. B. Magneziu.
B. Calciu. G. Stronţiu
8 (2 puncte). Nu interacționează cu soluția de acid sulfuric:
A. Aluminiu. B. Sodiu
B. Magneziu. G. Cupru
9 (2 puncte). Hidroxidul de potasiu nu interacționează cu substanța, a cărei formulă este:
A. Na2O B. AlCl3
B. P2O5 G. Zn (NO3) 2
10 (2 puncte). Rândul în care toate substanțele reacţionează cu fierul:
A. HCI, CO2, CO
B. CO2, HCI, S
B. H2, O2, CaO
G. O2, CuS04, H2SO4
11 (9 puncte). Sugerați trei moduri de a obține hidroxid de sodiu. Confirmați răspunsul cu ecuațiile de reacție.
12 (6 puncte). Efectuați un lanț de transformări chimice, alcătuind ecuațiile de reacție în forme moleculare și ionice, denumiți produșii de reacție:
FeCl2 → Fe (OH) 2 → FeSO4 → Fe (OH) 2
13 (6 puncte). Cum, folosind orice reactivi (substanțe) și zinc, să obțineți oxidul, baza, sarea? Scrieți ecuațiile reacției sub formă moleculară.
14 (4 puncte). Scrieți ecuația pentru reacția chimică a interacțiunii litiului cu azotul. Determinați agentul reducător și agentul de oxidare în această reacție
determinat de:
A. numărul grupului;
B. numărul perioadei;
B. număr de serie.
4. Care dintre caracteristicile elementelor chimice nu se modifică în principalele subgrupe:
Și raza atomului;
B este numărul de electroni la nivelul exterior;
B. numărul de niveluri energetice.
5. Generalități în structura atomilor elementelor cu numerele de serie 7 și 15:
A. numărul de electroni la nivelul exterior, B. sarcina nucleului;
B. numărul de niveluri energetice.
Stabiliți o corespondență între simbolul unui element chimic (într-o ordine dată) și numărul de electroni la nivelul energetic exterior al atomului său.Corespunzător răspunsurilor corecte, veți compune numele instalației, ceea ce va permite omenirii să înțeleagă și mai profund structura atomului (9 litere).
Numărul e pe element Simbol
Energie
nivel Mg Si I F C Ba Sn Ca Br
2 c a p o l y s e m
4 a o v k a t d h z
7 w y l l n g o l r
1 (3 puncte). Distribuția electronilor peste nivelurile de energie din atomul de sodiuA. 2 ē, 1 ē B. 2 ē, 4 ē B. 2 ē, 8 ē, 1ē. G. 2 ē, 8 ē, 3ē.
2 (4 puncte) Numărul perioadei din Tabelul periodic al lui D.I.Mendeleev, în care nu există elemente chimice-metale: A. 1. B. 2. C. 3. D. 4.
3 (3 puncte). Tipul de legătură chimică dintr-o substanță simplă de calciu:
A. Ionic. B. Polar covalent. B. Covalent nepolar. G. Metalic.
4 (3 puncte). O substanță simplă cu cele mai pronunțate proprietăți metalice:
A. Aluminiu. B. Siliciu. B. Magneziu. G. Sodiu.
5 (3 puncte). Raza atomilor elementelor din perioada a 2-a cu creșterea sarcinii nucleare de la un metal alcalin la un halogen: A. Se modifică periodic. B. Nu se schimbă. B. Creșteri. G. Scăderi.
6 (3 puncte). Un atom de magneziu este diferit de un ion de magneziu:
A. Sarcina nucleară. B. Sarcina de particule. B. Numărul de protoni. D. Numărul de neutroni.
7 (3 puncte). Reacționează cel mai puternic cu apa:
A. Potasiu. B. Litiu. B. Sodiu. G. Rubidium.
8 (3 puncte). Nu interacționează cu acidul sulfuric diluat:
A. Aluminiu. B. Bariu. B. Fierul. G. Mercur.
9 (3 puncte). Hidroxidul de beriliu nu interacționează cu o substanță, a cărei formulă este:
A. NaOH (p p). B. NaCI (p_p). B. HC1 (p_p). G. H2SO4.
10 (3 puncte). Rândul în care toate substanțele reacţionează cu calciul:
A. CO2, H2, HC1. B. NaOH, H20, HCI. B. C12, H2O, H2S04. G. S, H2S04, S03.
PARTEA B. Sarcini cu răspuns liber
11 (9 puncte). Sugerați trei moduri de a obține sulfat de fier (II). Confirmați răspunsul cu ecuațiile de reacție.
12 (6 puncte). Determinați substanțele X, Y, Z, notați-le formulele chimice.
Fe (OH) 3 (t) = X (+ HCl) = Y (+ NaOH) = Z (t) Fe2O3
13 (6 puncte). Cum, folosind orice reactivi (substanțe) și aluminiu, pentru a obține un oxid, hidroxid amfoter? Scrieți ecuațiile reacției sub formă moleculară.
14 (4 puncte). Aranjați metalele: cupru, aur, aluminiu, plumb în ordinea creșterii densității.
15 (5 puncte). Calculați masa metalului obținut din 160 g de oxid de cupru (II).
Orez. 7. Imaginea formelor și orientărilor
s-,p-,d-, orbitali folosind suprafete de limita.
Număr cuanticm l sunt numite magnetic ... Determină locația spațială a orbitalului atomic și ia valori întregi din - l la + l prin zero, adică 2 l+ 1 valori (Tabelul 27).
Orbitali de un subnivel ( l= const) au aceeași energie. Această stare se numește energie degenerată... Asa de p-orbital - de trei ori, d- de cinci ori, și f- degenerat de șapte ori. Suprafețele de delimitare s-,p-,d-, orbitalii sunt prezentați în Fig. 7.
s -orbitali sferic simetric pentru orice nși diferă între ele doar prin dimensiunea sferei. Forma lor maxim simetrică se datorează faptului că la l= 0 și μ l = 0.
Tabelul 27
Numărul de orbitali pe subnivelurile energetice
|
Numărul cuantic orbital |
Număr cuantic magnetic |
Numărul de orbitali cu o valoare dată l |
|
m l | ||
|
–2, –1, 0, +1, +2 | ||
|
–3, –2, –1, 0, +1, +2, +3 |
p -orbitali exista la n≥ 2 și l= 1, prin urmare, sunt posibile trei opțiuni de orientare în spațiu: m l= -1, 0, +1. Toți orbitalii p au un plan nodal care împarte orbitalul în două regiuni, astfel încât suprafețele de delimitare au forma unor gantere orientate în spațiu la un unghi de 90 ° una față de cealaltă. Axele de simetrie pentru ele sunt axele de coordonate, care sunt notate p X , p y , p z .
d -orbitali sunt determinate de numărul cuantic l = 2 (n≥ 3), la care m l= –2, –1, 0, +1, +2, adică sunt caracterizate prin cinci variante de orientare în spațiu. d-se desemnează orbitale orientate de lame de-a lungul axelor de coordonate d z² și d X ²– y², iar lamele orientate de-a lungul bisectoarelor unghiurilor de coordonate - d X y , d yz , d xz .
Șapte f -orbitali corespunzător l = 3 (n≥ 4) sunt reprezentate ca suprafețe limită.
Numerele cuantice n, lși m nu caracterizează pe deplin starea unui electron într-un atom. S-a stabilit experimental că electronul mai are o proprietate - spin. Simplificat, spinul poate fi reprezentat ca rotația unui electron în jurul propriei axe. Spin numărul cuantic m s are doar două sensuri m s= ± 1/2, reprezentând două proiecții ale momentului unghiular al electronului pe axa selectată. Electroni cu diferite m s indicat de săgețile sus și jos.
Secvența de umplere a orbitalilor atomici
Populația de orbitali atomici (AO) cu electroni se realizează conform principiului energiei minime, principiul Pauli, regula Gund, iar pentru atomii cu mulți electroni - regula Klechkovsky.
Principiul energiei minime necesită electroni pentru a popula un AO în ordinea creșterii energiei electronilor în acești orbitali. Aceasta reflectă regula generală - stabilitatea maximă a sistemului corespunde minimului energiei sale.
Principiu Pauli (1925) interzice electronii cu același set de numere cuantice într-un atom cu mulți electroni. Aceasta înseamnă că oricare doi electroni dintr-un atom (sau moleculă sau ion) trebuie să difere unul de celălalt prin valoarea a cel puțin unui număr cuantic, adică într-un orbital nu pot exista mai mult de doi electroni cu spin diferiți (pereche). electroni). Fiecare subnivel conține 2 l+ 1 orbitali care conțin nu mai mult de 2 (2 l+ 1) electroni. De aici rezultă că capacitatea s-orbitali - 2, p-orbitali - 6, d-orbitali - 10 si f-orbitali - 14 electroni. Dacă numărul de electroni pentru un anumit l suma de la 0 la n- 1, apoi obținem formula Bora -Îngropa, care determină numărul total de electroni la un nivel cu un dat n:
Această formulă nu ține cont de interacțiunea electron-electron și încetează să fie îndeplinită la n ≥ 3.
Orbitalii cu aceleași energii (degenerate) sunt umpluți în conformitate cu regulă Gunda : cea mai scăzută energie este deținută de configurația electronică cu spin maxim. Aceasta înseamnă că, dacă există trei electroni pe orbital p, atunci ei sunt localizați astfel: și spinul total S= 3/2, nu așa:, S=1/2.
domnia Klechkovsky (principiul energiei minime). În atomii cu mulți electroni, ca și în atomul de hidrogen, starea electronului este determinată de valorile acelorași patru numere cuantice, dar în acest caz electronul nu se află numai în câmpul nucleului, ci și în câmpul altor electroni. Prin urmare, energia atomilor cu mulți electroni este determinată nu numai de numărul cuantic principal, ci și de numărul cuantic orbital, sau mai degrabă de suma lor: energia orbitalilor atomici creste pe masura ce suman + l; cu aceeași cantitate se umple mai întâi nivelul cu cel de josnsi marel. Energia orbitalilor atomici crește în funcție de seria:
|
1s<2s<2p<3s<3p<4s≈3d<4p<5s≈4d<5p<6s≈4f≈5d<6p<7s≈5f≈6d<7p. |
Deci, patru numere cuantice descriu starea unui electron într-un atom și caracterizează energia electronului, spinul său, forma norului de electroni și orientarea lui în spațiu. Când un atom trece de la o stare la alta, norul de electroni este rearanjat, adică se schimbă valorile numerelor cuantice, ceea ce este însoțit de absorbția sau emisia de cuante de energie de către atom.
Ce se întâmplă cu atomii elementelor în timpul reacțiilor chimice? De ce depind proprietățile elementelor? Un răspuns poate fi dat la ambele întrebări: motivul constă în structura exteriorului. În articolul nostru vom lua în considerare electronica metalelor și nemetalelor și vom afla relația dintre structura nivelului extern și proprietăți. a elementelor.
Proprietăți speciale ale electronilor
În timpul trecerii unei reacții chimice între moleculele a doi sau mai mulți reactivi, apar modificări în structura învelișurilor electronice ale atomilor, în timp ce nucleele acestora rămân neschimbate. În primul rând, să ne familiarizăm cu caracteristicile electronilor aflați la cele mai îndepărtate niveluri ale atomului de nucleu. Particulele încărcate negativ sunt aranjate în straturi la o anumită distanță de nucleu și unele de altele. Spațiul din jurul nucleului, unde este cel mai posibil să găsiți electroni, se numește orbital electronilor. Aproximativ 90% din norul de electroni încărcat negativ este condensat în el. Electronul însuși dintr-un atom prezintă proprietatea dualității; se poate comporta simultan atât ca o particulă, cât și ca o undă.
Reguli pentru umplerea învelișului de electroni a unui atom
Numărul de niveluri de energie la care se află particulele este egal cu numărul perioadei în care se află elementul. Ce indică compoziția electronică? S-a dovedit că la nivelul de energie externă pentru elementele s și p ale principalelor subgrupe de perioade mici și mari corespunde numărului de grup. De exemplu, atomii de litiu din primul grup, care au două straturi, au un electron pe învelișul exterior. Atomii de sulf conțin șase electroni la ultimul nivel de energie, deoarece elementul este situat în subgrupul principal al celui de-al șaselea grup etc. Dacă vorbim despre elementele d, atunci există următoarea regulă pentru ei: numărul de particule negative externe. este 1 (pentru crom și cupru) sau 2. Acest lucru se explică prin faptul că, pe măsură ce sarcina nucleului atomic crește, subnivelul d interior este mai întâi umplut, iar nivelurile exterioare de energie rămân neschimbate.
De ce se schimbă proprietățile elementelor perioadelor mici?
Perioadele 1, 2, 3 și 7 sunt considerate mici. O schimbare lină a proprietăților elementelor pe măsură ce cresc sarcinile nucleare, variind de la metale active la gaze inerte, se explică printr-o creștere treptată a numărului de electroni la nivel extern. Primele elemente din astfel de perioade sunt cele ai căror atomi au doar unul sau doi electroni, care pot fi desprinși cu ușurință din nucleu. În acest caz, se formează un ion metalic încărcat pozitiv.

Elementele amfoterice, de exemplu, aluminiul sau zincul, își umple nivelul de energie externă cu un număr mic de electroni (1 pentru zinc, 3 pentru aluminiu). În funcție de condițiile reacției chimice, ele pot prezenta atât proprietățile metalelor, cât și ale nemetalelor. Elementele nemetalice de perioade mici conțin de la 4 la 7 particule negative pe învelișurile exterioare ale atomilor lor și le completează până la un octet, atrăgând electronii altor atomi. De exemplu, un nemetal cu cel mai mare indice de electronegativitate - fluor, are 7 electroni pe ultimul strat și ia întotdeauna un electron nu numai din metale, ci și din elementele active nemetalice: oxigen, clor, azot. Perioadele mici, precum și cele mari, se termină cu gaze inerte, ale căror molecule monoatomice au completat complet niveluri de energie externă de până la 8 electroni.
Caracteristici ale structurii atomilor de perioade lungi
Chiar și rândurile de 4, 5 și 6 perioade constau din elemente, ale căror învelișuri exterioare conțin doar unul sau doi electroni. După cum am spus mai devreme, ele umplu subnivelurile d sau f ale penultimului strat cu electroni. Acestea sunt de obicei metale tipice. Proprietățile lor fizice și chimice se schimbă foarte lent. Rândurile impare conțin elemente în care nivelurile de energie exterioară sunt umplute cu electroni după următoarea schemă: metale - element amfoter - nemetale - gaz inert. Am observat deja manifestarea ei în toate perioadele mici. De exemplu, în rândul impar al perioadei a 4-a, cuprul este un metal, zincul este amfoter, apoi de la galiu la brom există o creștere a proprietăților nemetalice. Perioada se termină cu criptonul, ai cărui atomi au o înveliș de electroni complet completat.

Cum se explică împărțirea elementelor în grupuri?
Fiecare grup - și există opt dintre ele în forma scurtă a tabelului, este, de asemenea, împărțit în subgrupe, numite principale și secundare. Această clasificare reflectă poziția diferită a electronilor pe nivelul energetic extern al atomilor elementelor. S-a dovedit că în elementele principalelor subgrupe, de exemplu, litiu, sodiu, potasiu, rubidiu și cesiu, ultimul electron este situat la subnivelul s. Elementele din a șaptea grupă a subgrupului principal (halogeni) își umplu subnivelul p cu particule negative.
Pentru reprezentanții subgrupurilor laterale, cum ar fi cromul, umplerea cu electroni ai subnivelului d va fi tipică. Iar elementele familiei acumulează sarcini negative la subnivelul f al penultimului nivel energetic. În plus, numărul grupului, de regulă, coincide cu numărul de electroni capabili să formeze legături chimice.

În articolul nostru, am aflat ce structură au nivelurile de energie externă ale atomilor elementelor chimice și am determinat rolul acestora în interacțiunile interatomice.