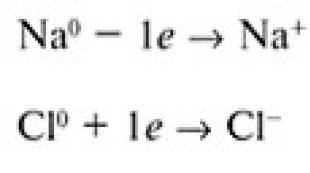Joninių deguonies jungčių susidarymo mechanizmas. III skyrius. cheminis ryšys ir molekulinė struktūra. Joninės jungties apibrėžimas
Joninis ryšys atsiranda, kai elektronegatyvumas smarkiai skiriasi vienas nuo kito (pagal Paulingo skalę Δχ > 1,7), ir tai vyksta sąveikaujant jonams, susidariusiems iš elementų, pasižyminčių žymiai skirtingomis cheminėmis savybėmis.
Joninė jungtis yra elektrostatinė trauka tarp priešingai įkrautų jonų, susidarančių dėl visiško bendros elektronų poros poslinkio iš vieno elemento atomo į kito elemento atomą.
Priklausomai nuo atskirų kai kurių elementų atomų savybių, vyrauja tendencija netekti elektronų ir virsti teigiamai įkrautais jonais (katijonais), o kitų elementų atomai, priešingai, yra linkę įgyti elektronus ir taip virsti neigiamo krūvio įkrautais. jonai (anijonai), kaip tai atsitinka su paprastojo natrio ir tipinio nemetalinio chloro atomais.
Sąlyginis Na + ir Cl jonų susidarymo modelis – visiškai perkeliant valentinį elektroną iš natrio atomo į chloro atomą
Elementų gebėjimą sudaryti paprastus jonus (tai yra iš vieno atomo) lemia jų izoliuotų atomų elektroninė konfigūracija, taip pat elektronegatyvumo, jonizacijos energijos ir elektronų giminingumo reikšmės (minimalus, kurio reikia pašalinti elektroną iš atitinkamo neigiamo jono per begalinį atstumą). Aišku, kad katijonus lengviau sudaro mažos jonizacijos energijos elementų atomai – šarminiai ir šarminiai žemės metalai (Na, K, Cs, Rb, Ca, Ba, Sr ir kt.). Kitų elementų paprastų katijonų susidarymas yra mažiau tikėtinas, nes tai susiję su didelės energijos sąnaudomis atomo jonizacijai.
Paprastuosius anijonus dėl didelio elektronų afiniteto lengviau sudaro septintos grupės p-elementai (Cl, Br, I). Vieno elektrono pridėjimą prie O, S, N atomų lydi energijos išsiskyrimas. O kitų elektronų pridėjimas, kad susidarytų daugkartinio krūvio paprastieji anijonai, yra energetiškai nepalankus.
Todėl junginių, susidedančių iš paprastų jonų, yra nedaug. Jie lengviau susidaro sąveikaujant šarminiams ir šarminiams žemės metalams su halogenais.
Joninių jungčių charakteristikos
1. Nekryptingumas. Elektriniai jonų krūviai lemia jų trauką ir atstūmimą ir paprastai lemia junginio stechiometrinę sudėtį. Jonai gali būti laikomi įkrautais rutuliais, kurių jėgos laukai yra tolygiai paskirstyti visomis erdvės kryptimis. Todėl, pavyzdžiui, NaCl junginyje natrio jonai Na+ gali sąveikauti su chlorido jonais Cl- bet kuria kryptimi, pritraukdami tam tikrą jų skaičių.
Nekryptiškumas yra joninio ryšio savybė dėl kiekvieno jono gebėjimo bet kuria kryptimi pritraukti priešingo ženklo jonus.
Taigi nekryptiškumas paaiškinamas tuo, kad jono elektrinis laukas turi sferinę simetriją ir mažėja didėjant atstumui visomis kryptimis, todėl jonų sąveika vyksta nepriklausomai nuo krypties.
2. Nesotumas. Akivaizdu, kad dviejų priešingo ženklo jonų sąveika negali visiškai kompensuoti jų jėgos laukų. Todėl tam tikrą krūvį turintis jonas išlaiko galimybę visomis kryptimis pritraukti kitus priešingo ženklo jonus. Tokių „pritrauktų“ jonų skaičių riboja tik jų geometriniai dydžiai ir abipusės atstūmimo jėgos.
Nesotumas – joninio ryšio savybė, pasireiškianti tam tikrą krūvį turinčio jono gebėjimu prijungti bet kokį priešingo ženklo jonų skaičių.
3. Jonų poliarizacija. Joninėje jungtyje kiekvienas jonas, būdamas elektros krūvio nešiklis, yra jėgos elektrinio lauko šaltinis, todėl artimu atstumu tarp jonų jie vienas kitą veikia.
Jono poliarizacija – tai jo elektroninio apvalkalo deformacija veikiant kito jono elektriniam jėgos laukui.
4. Jonų poliarizuojamumas ir poliarizacinis gebėjimas. Poliarizacijos metu išoriniame sluoksnyje esantys elektronai yra labiausiai pasislinkę. Tačiau veikiant tam pačiam elektriniam laukui skirtingi jonai deformuojasi skirtingais laipsniais. Kuo silpniau išoriniai elektronai yra prijungti prie branduolio, tuo lengviau vyksta poliarizacija.
Poliarizuojamumas yra santykinis branduolio ir elektronų apvalkalo poslinkis jone, kai juos veikia kito jono elektrinis laukas. Jonų poliarizacinis gebėjimas yra jų gebėjimas deformuoti kitus jonus.
Poliarizacinė galia priklauso nuo jonų krūvio ir dydžio. Kuo didesnis jono krūvis, tuo stipresnis jo laukas, tai yra, daugintis įkrauti jonai turi didžiausią poliarizacinę savybę.
Joninių junginių savybės
Normaliomis sąlygomis joniniai junginiai egzistuoja kaip kristalinės kietosios medžiagos, kurių lydymosi ir virimo temperatūra yra aukšta, todėl laikomi nelakiais. Pavyzdžiui, NaCl lydymosi ir virimo temperatūra yra atitinkamai 801 0 C ir 1413 0 C, CaF 2 - 1418 0 C ir 2533 0 C. Kietoje būsenoje joniniai junginiai nelaidžia elektros srovės. Jie gerai tirpsta ir silpnai arba visai netirpsta nepoliniuose tirpikliuose (žibale, benzine). Poliniuose tirpikliuose joniniai junginiai disocijuoja (skyla) į jonus. Tai paaiškinama tuo, kad jonai turi didesnę solvatacijos energiją, kuri gali kompensuoti disociacijos į jonus energiją dujų fazėje.
Nuorodos ilgis - tarpbranduolinis atstumas. Kuo šis atstumas trumpesnis, tuo stipresnis cheminis ryšys. Ryšio ilgis priklauso nuo jį sudarančių atomų spindulių: kuo mažesni atomai, tuo trumpesnis ryšys tarp jų. Pavyzdžiui, H-O jungties ilgis yra trumpesnis nei H-N jungties ilgis (dėl mažesnio deguonies atomų mainų).

Joninė jungtis yra kraštutinis polinio kovalentinio ryšio atvejis.
Metalinė jungtis.
Būtina sąlyga tokio tipo ryšiui sukurti:
1) santykinai nedidelio skaičiaus elektronų buvimas išoriniuose atomų lygiuose;
2) tuščių (laisvų orbitalių) buvimas išoriniuose metalo atomų lygiuose
3) santykinai maža jonizacijos energija.
Panagrinėkime metalo jungties susidarymą naudojant natrį kaip pavyzdį. Natrio valentinis elektronas, esantis 3s polygyje, gali gana lengvai judėti tuščiomis išorinio sluoksnio orbitalėmis: išilgai 3p ir 3d. Kai atomai suartėja dėl kristalinės gardelės susidarymo, gretimų atomų valentinės orbitalės persidengia, dėl to elektronai laisvai juda iš vienos orbitos į kitą, sukurdami ryšį tarp VISŲ metalo kristalo atomų.
Kristalinės gardelės mazguose yra teigiamai įkrauti metalų jonai ir atomai, o tarp jų yra elektronai, kurie gali laisvai judėti per visą kristalinę gardelę. Šie elektronai tampa bendri visiems metalo atomams ir jonams ir vadinami „elektronų dujomis“. Ryšys tarp visų teigiamai įkrautų metalo jonų ir laisvųjų elektronų metalinėje kristalinėje gardelėje vadinamas metalo jungtis.
Metalinės jungties buvimas lemia metalų ir lydinių fizines savybes: kietumą, elektrinį laidumą, šilumos laidumą, plastiškumą, plastiškumą, metalinį blizgesį. Laisvieji elektronai gali nešti šilumą ir elektrą, todėl būtent jie lemia pagrindines fizines savybes, skiriančias metalus nuo nemetalų – didelio elektros ir šilumos laidumo.
Vandenilinė jungtis.
Vandenilinė jungtis atsiranda tarp molekulių, kuriose yra vandenilio, ir atomų, turinčių didelį EO (deguonies, fluoro, azoto). Kovalentiniai ryšiai H-O, H-F, H-N yra labai poliniai, dėl to ant vandenilio atomo kaupiasi perteklinis teigiamas krūvis, o ant priešingų polių - perteklinis neigiamas krūvis. Tarp priešingai įkrautų polių atsiranda elektrostatinės traukos jėgos – vandeniliniai ryšiai.
Vandenilio ryšiai gali būti tarpmolekuliniai arba intramolekuliniai. Vandenilio jungties energija yra maždaug dešimt kartų mažesnė už įprasto kovalentinio ryšio energiją, tačiau nepaisant to, vandenilio ryšiai vaidina svarbų vaidmenį daugelyje fizikinių, cheminių ir biologinių procesų. Visų pirma, DNR molekulės yra dvigubos spiralės, kuriose dvi nukleotidų grandinės yra sujungtos vandenilio ryšiais. Tarpmolekuliniai vandenilio ryšiai tarp vandens ir vandenilio fluorido molekulių gali būti pavaizduoti (taškais) taip:

Medžiagos, turinčios vandenilinius ryšius, turi molekulines kristalines gardeles. Dėl vandenilio jungties susidaro molekuliniai junginiai ir dėl to padidėja lydymosi ir virimo temperatūra.
Be išvardintų pagrindinių cheminių jungčių tipų, egzistuoja ir universalios bet kokių molekulių sąveikos jėgos, dėl kurių nenutrūksta ar nesusidaro nauji cheminiai ryšiai. Šios sąveikos vadinamos van der Waals jėgomis. Jie nustato tam tikros medžiagos (ar įvairių medžiagų) molekulių trauką viena prie kitos skystoje ir kietoje agregacijos būsenoje.
Skirtingi cheminių ryšių tipai lemia skirtingų tipų kristalinių gardelių egzistavimą (lentelė).
Medžiagos, susidedančios iš molekulių, turi molekulinė struktūra. Šioms medžiagoms priskiriamos visos dujos, skysčiai, taip pat kietos medžiagos, turinčios molekulinę kristalinę gardelę, pavyzdžiui, jodas. Kietosios medžiagos, turinčios atominę, joninę ar metalinę gardelę, turi nemolekulinė struktūra, jie neturi molekulių.
Lentelė
| Kristalinės gardelės ypatybė | Grotelių tipas | |||
| Molekulinė | Joninės | Branduolinės | Metalas | |
| Dalelės gardelės mazguose | Molekulės | Katijonai ir anijonai | Atomai | Metalo katijonai ir atomai |
| Ryšio tarp dalelių pobūdis | Tarpmolekulinės sąveikos jėgos (įskaitant vandenilinius ryšius) | Joninės jungtys | Kovalentiniai ryšiai | Metalinė jungtis |
| Ryšio stiprumas | Silpnas | Patvarus | Labai patvarus | Įvairių stiprybių |
| Išskirtinės fizikinės medžiagų savybės | Mažai tirpstantis arba sublimuojantis, mažas kietumas, daugelis tirpsta vandenyje | Ugniai atsparus, kietas, trapus, daug tirpsta vandenyje. Tirpalai ir lydalai praleidžia elektros srovę | Labai atsparus ugniai, labai kietas, praktiškai netirpsta vandenyje | Didelis elektros ir šilumos laidumas, metalo blizgesys, plastiškumas. |
| Medžiagų pavyzdžiai | Paprastos medžiagos – nemetalai (kietoje būsenoje): Cl 2, F 2, Br 2, O 2, O 3, P 4, siera, jodas (išskyrus silicį, deimantą, grafitą); kompleksinės medžiagos, susidedančios iš nemetalų atomų (išskyrus amonio druskas): vanduo, sausas ledas, rūgštys, nemetalų halogenidai: PCl 3, SiF 4, CBr 4, SF 6, organinės medžiagos: angliavandeniliai, alkoholiai, fenoliai, aldehidai ir kt. . | Druskos: natrio chloridas, bario nitratas ir kt.; šarmai: kalio hidroksidas, kalcio hidroksidas, amonio druskos: NH 4 Cl, NH 4 NO 3 ir kt., metalų oksidai, nitridai, hidridai ir kt. (metalų ir nemetalų junginiai) | Deimantas, grafitas, silicis, boras, germanis, silicio oksidas (IV) - silicio dioksidas, SiC (karborundas), juodasis fosforas (P). | Varis, kalis, cinkas, geležis ir kiti metalai |
| Medžiagų palyginimas pagal lydymosi ir virimo taškus. | ||||
| Dėl silpnų tarpmolekulinės sąveikos jėgų tokios medžiagos turi žemiausią lydymosi ir virimo temperatūrą. Be to, kuo didesnė medžiagos molekulinė masė, tuo didesnė t 0 pl. tai turi. Išimtys yra medžiagos, kurių molekulės gali sudaryti vandenilinius ryšius. Pavyzdžiui, HF t0 pl. yra didesnis nei HCl. | Medžiagos turi aukštą t 0 pl., bet mažesnę nei medžiagų, turinčių atominę gardelę. Kuo didesni jonų, esančių gardelės vietose, krūviai ir kuo mažesnis atstumas tarp jų, tuo didesnė medžiagos lydymosi temperatūra. Pavyzdžiui, t 0 pl. CaF 2 yra didesnis nei t 0 pl. KF. | Jie turi didžiausią t 0 pl. Kuo stipresnis ryšys tarp gardelės atomų, tuo didesnis t 0 pl. turi substancijos. Pavyzdžiui, Si turi mažesnį t0 pl nei C. | Metalai turi skirtingą t0 pl.: nuo -37 0 C gyvsidabrio iki 3360 0 C volframo. |
Pirmasis iš jų yra joninių ryšių susidarymas. (Antrasis yra švietimas, kuris bus aptartas toliau). Susidarius joniniam ryšiui metalo atomas praranda elektronus, o nemetalinis – įgyja elektronų. Pavyzdžiui, apsvarstykite elektroninę natrio ir chloro atomų struktūrą:
Na 1s 2 2s 2 2 6 p 3 s 1 - vienas elektronas išoriniame lygyje
Cl 1s 2 2s 2 2 6 p 3 s 2 3 5 p. - septyni elektronai išoriniame lygyje
Jei natrio atomas atiduoda tik savo 3s elektroną chloro atomui, okteto taisyklė bus įvykdyta abiem atomams. Chloro atomas turės aštuonis elektronus išoriniame trečiajame sluoksnyje, o natrio atomas taip pat turės aštuonis elektronus antrame sluoksnyje, kuris dabar tapo išoriniu sluoksniu:
Na+1s2 2s 2 2 p 6
Cl – 1s 2 2s 2 2 6 p 3 s 2 3 6 p - aštuoni elektronai išoriniame lygyje
Šiuo atveju natrio atomo branduolyje dar yra 11 protonų, tačiau bendras elektronų skaičius sumažėjo iki 10. Tai reiškia, kad teigiamai įkrautų dalelių yra vienu daugiau nei neigiamai įkrautų, taigi bendras krūvis natrio „atomo“ yra +1.
Chloro „atomas“ dabar turi 17 protonų ir 18 elektronų, o jo krūvis yra -1.
Įkrauti atomai, susidarantys praradus arba padidinus vieną ar daugiau elektronų, vadinami jonų. Teigiamai įkrauti jonai vadinami katijonai, o vadinami neigiamo krūvio turintys anijonai.
Katijonai ir anijonai, turintys priešingus krūvius, yra traukiami vienas prie kito elektrostatinių jėgų. Šis priešingai įkrautų jonų pritraukimas vadinamas joniniu ryšiu.
. Jis atsiranda junginiai, sudaryti iš metalo ir vieno ar kelių nemetalų.
Šie junginiai atitinka šį kriterijų ir yra joninio pobūdžio: MgCl 2, Fel 2, CuF, Na 2 0, Na 2 S0 4, Zn (C 2 H 3 0 2) 2.
Yra dar vienas būdas pavaizduoti joninius junginius:
Šiose formulėse taškai rodo tik elektronus, esančius išoriniuose apvalkaluose ( valentiniai elektronai ). Tokios formulės vadinamos Lewiso formulėmis, pagerbiant amerikiečių chemiką G. N. Lewisą, vieną iš cheminio ryšio teorijos įkūrėjų (kartu su L. Paulingu).
Elektronų perkėlimas iš metalo atomo į nemetalų atomą ir jonų susidarymas yra įmanomas dėl to, kad nemetalų elektronegatyvumas yra didelis, o metalų – mažas.
Dėl stipraus jonų traukos vienas prie kito joniniai junginiai dažniausiai būna kieti ir turi gana aukštą lydymosi temperatūrą.
Joninė jungtis susidaro elektronams perkeliant iš metalo atomo į nemetalinį atomą. Susidariusius jonus vienas prie kito traukia elektrostatinės jėgos.
Joninis ryšys
(naudota medžiaga iš svetainės http://www.hemi.nsu.ru/ucheb138.htm)
Jonų jungtis atsiranda dėl elektrostatinės traukos tarp priešingai įkrautų jonų. Šie jonai susidaro dėl elektronų perdavimo iš vieno atomo į kitą. Joninė jungtis susidaro tarp atomų, kurių elektronegatyvumas labai skiriasi (paprastai didesnis nei 1,7 pagal Paulingo skalę), pavyzdžiui, tarp šarminio metalo ir halogeno atomų.
Panagrinėkime joninės jungties atsiradimą naudodamiesi NaCl susidarymo pavyzdžiu.
Iš elektroninių atomų formulių
Na 1s 2 2s 2 2p 6 3s 1 ir
Cl 1s 2 2s 2 2p 6 3s 2 3p 5
Matyti, kad norint užbaigti išorinį lygį, natrio atomui lengviau atsisakyti vieno elektrono, nei įgyti septynis, o chloro atomui lengviau įgyti vieną elektroną nei septynis. Cheminėse reakcijose natrio atomas atiduoda vieną elektroną, o chloro atomas jį paima. Dėl to natrio ir chloro atomų elektronų apvalkalai paverčiami stabiliais tauriųjų dujų elektronų apvalkalais (natrio katijono elektroninė konfigūracija
Na + 1s 2 2s 2 2p 6,
o elektroninė chloro anijono konfigūracija yra
Cl – - 1s 2 2s 2 2p 6 3s 2 3p 6).
Dėl elektrostatinės jonų sąveikos susidaro NaCl molekulė.
Cheminio ryšio pobūdis dažnai atsispindi medžiagos agregacijos būsenoje ir fizikinėse savybėse. Joniniai junginiai, tokie kaip natrio chloridas NaCl, yra kieti ir atsparūs ugniai, nes tarp jų „+“ ir „–“ jonų krūvių yra galingos elektrostatinės traukos jėgos.
Neigiamai įkrautas chloro jonas pritraukia ne tik „savo“ Na+ joną, bet ir kitus aplinkui esančius natrio jonus. Tai lemia tai, kad šalia bet kurio jono yra ne vienas jonas su priešingu ženklu, o keli.
Natrio chlorido NaCl kristalo struktūra.
Tiesą sakant, aplink kiekvieną chloro joną yra 6 natrio jonai, o aplink kiekvieną natrio joną – 6 chloro jonai. Šis tvarkingas jonų paketas vadinamas joniniu kristalu. Jei kristale yra išskirtas vienas chloro atomas, tai tarp jį supančių natrio atomų nebeįmanoma rasti to, su kuriuo reagavo chloras.
Elektrostatinių jėgų vienas prie kito traukiami jonai itin nenoriai keičia savo vietą veikiami išorinės jėgos ar kylant temperatūrai. Bet jei natrio chloridas ištirpsta ir toliau kaitinamas vakuume, jis išgaruoja, sudarydamas dviatomes NaCl molekules. Tai rodo, kad kovalentinio ryšio jėgos niekada nėra visiškai išjungtos.
Pagrindinės joninių ryšių charakteristikos ir joninių junginių savybės
1. Joninis ryšys yra stiprus cheminis ryšys. Šios jungties energija yra maždaug 300–700 kJ/mol.
2. Skirtingai nuo kovalentinio ryšio, joninis ryšys yra nekryptinis, nes jonas gali bet kuria kryptimi pritraukti prie savęs priešingo ženklo jonus.
3. Skirtingai nuo kovalentinio ryšio, joninis ryšys yra nesotus, nes priešingo ženklo jonų sąveika visiškai nekompensuoja jų jėgos laukų.
4. Formuojantis molekulėms su joniniu ryšiu nevyksta visiškas elektronų pernešimas, todėl šimtaprocentiniai joniniai ryšiai gamtoje neegzistuoja. NaCl molekulėje cheminis ryšys yra tik 80% joninių.
5. Junginiai su joniniais ryšiais yra kristalinės kietosios medžiagos, kurių lydymosi ir virimo temperatūra yra aukšta.
6. Dauguma joninių junginių tirpsta vandenyje. Joninių junginių tirpalai ir lydalai praleidžia elektros srovę.
Metalinė jungtis
Metalo kristalai yra skirtingos struktūros. Ištyrę natrio metalo gabalėlį pamatysite, kad jo išvaizda labai skiriasi nuo valgomosios druskos. Natris – minkštas metalas, lengvai pjaustomas peiliu, suplotas plaktuku, lengvai ištirpsta puodelyje ant spiritinės lempos (lydymosi temperatūra 97,8 o C). Natrio kristale kiekvienas atomas yra apsuptas kitų aštuonių panašių atomų.

Metalinio Na kristalinė struktūra.
Paveikslėlyje parodyta, kad Na atomas kubo centre turi 8 artimiausius kaimynus. Tačiau tą patį galima pasakyti apie bet kurį kitą kristalo atomą, nes jie visi yra vienodi. Kristalas susideda iš „be galo“ pasikartojančių fragmentų, parodytų šiame paveikslėlyje.
Metalo atomai išoriniame energijos lygyje turi nedaug valentinių elektronų. Kadangi metalo atomų jonizacijos energija yra maža, valentiniai elektronai šiuose atomuose išlaikomi silpnai. Dėl to metalų kristalinėje gardelėje atsiranda teigiamai įkrauti jonai ir laisvieji elektronai. Šiuo atveju metalo katijonai yra kristalinės gardelės mazguose, o elektronai laisvai juda teigiamų centrų lauke, sudarydami vadinamąsias „elektronines dujas“.
Neigiamai įkrauto elektrono buvimas tarp dviejų katijonų priverčia kiekvieną katijoną sąveikauti su šiuo elektronu.
Taigi, Metalinis ryšys yra ryšys tarp teigiamų jonų metalo kristaluose, kuris atsiranda pritraukiant elektronus, laisvai judančius visame kristale.
Kadangi valentiniai elektronai metale yra tolygiai pasiskirstę visame kristale, metalinė jungtis, kaip ir joninė, yra nekryptinė jungtis. Skirtingai nuo kovalentinio ryšio, metalinis ryšys yra nesočioji jungtis. Metalo jungtis taip pat skiriasi nuo kovalentinio stiprumo. Metalinio ryšio energija yra maždaug tris ar keturis kartus mažesnė už kovalentinio ryšio energiją.
Dėl didelio elektronų dujų mobilumo metalai pasižymi dideliu elektros ir šilumos laidumu.
Metalo kristalas atrodo gana paprastas, tačiau iš tikrųjų jo elektroninė struktūra yra sudėtingesnė nei joninių druskos kristalų. Metalinių elementų išoriniame elektronų apvalkale nėra pakankamai elektronų, kad susidarytų visavertis „oktetinis“ kovalentinis arba joninis ryšys. Todėl dujinėje būsenoje daugumą metalų sudaro monoatominės molekulės (t. y. atskiri atomai, nesusiję vienas su kitu). Tipiškas pavyzdys yra gyvsidabrio garai. Taigi, metalinis ryšys tarp metalo atomų atsiranda tik skystoje ir kietoje agregacijos būsenoje.
Metalinį ryšį galima apibūdinti taip: kai kurie metalo atomai susidariusiame kristale atiduoda savo valentinius elektronus erdvei tarp atomų (natriui tai yra...3s1), virsdami jonais. Kadangi visi kristalo metalo atomai yra vienodi, kiekvienas turi vienodą galimybę prarasti valentinį elektroną.
Kitaip tariant, elektronų perdavimas tarp neutralių ir jonizuotų metalų atomų vyksta nenaudojant energijos. Šiuo atveju kai kurie elektronai visada patenka į erdvę tarp atomų „elektronų dujų“ pavidalu.
Šie laisvieji elektronai, pirma, laiko metalo atomus tam tikru pusiausvyros atstumu vienas nuo kito.
Antra, jie suteikia metalams būdingą „metalinį blizgesį“ (laisvieji elektronai gali sąveikauti su šviesos kvantais).
Trečia, laisvieji elektronai suteikia metalams gerą elektros laidumą. Didelis metalų šilumos laidumas taip pat paaiškinamas laisvųjų elektronų buvimu tarpatominėje erdvėje - jie lengvai „reaguoja“ į energijos pokyčius ir prisideda prie greito jo perdavimo kristale.

Supaprastintas metalo kristalo elektroninės struktūros modelis.
******** Naudodami metalo natrio pavyzdį, panagrinėkime metalinės jungties prigimtį idėjų apie atomines orbitas požiūriu. Natrio atomui, kaip ir daugeliui kitų metalų, trūksta valentinių elektronų, tačiau yra laisvų valentinių orbitalių. Vienas 3s natrio elektronas gali judėti į bet kurią iš laisvos ir artimos energijos gretimų orbitų. Kai kristalo atomai artėja vienas prie kito, kaimyninių atomų išorinės orbitos persidengia, todėl atiduoti elektronai gali laisvai judėti kristale.
Tačiau „elektronų dujos“ nėra tokios netvarkingos, kaip gali atrodyti. Laisvieji elektronai metaliniame kristale yra persidengiančiose orbitose ir tam tikru mastu yra dalijami, sudarydami kažką panašaus į kovalentinius ryšius. Natris, kalis, rubidis ir kiti metaliniai s-elementai tiesiog turi mažai bendrų elektronų, todėl jų kristalai yra trapūs ir tirpūs. Didėjant valentinių elektronų skaičiui, metalų stiprumas paprastai didėja.
Taigi, metalinius ryšius dažniausiai sudaro elementai, kurių atomų išoriniuose apvalkaluose yra mažai valentinių elektronų. Šių valentinių elektronų, kurie atlieka metalinį ryšį, tiek dalijamasi, kad jie gali judėti visame metalo kristale ir užtikrinti aukštą metalo elektrinį laidumą.
NaCl kristalas nepraleidžia elektros, nes erdvėje tarp jonų nėra laisvų elektronų. Visi natrio atomų atiduoti elektronai yra tvirtai laikomi chloro jonų. Tai vienas iš reikšmingų skirtumų tarp joninių ir metalinių kristalų.
Tai, ką dabar žinote apie metalinį sujungimą, padeda paaiškinti daugumos metalų didelį kaliumą (plastiškumą). Metalą galima išlyginti į ploną lakštą ir ištraukti į vielą. Faktas yra tas, kad atskiri atomų sluoksniai metaliniame kristale gali gana lengvai slysti vienas po kito: judrios „elektroninės dujos“ nuolat sušvelnina atskirų teigiamų jonų judėjimą, apsaugodamos juos vienas nuo kito.
Žinoma, nieko panašaus negalima padaryti su valgomąja druska, nors druska taip pat yra kristalinė medžiaga. Joniniuose kristaluose valentiniai elektronai yra glaudžiai susieti su atomo branduoliu. Vieno jonų sluoksnio poslinkis kito atžvilgiu suartina to paties krūvio jonus ir sukelia stiprų atstūmimą tarp jų, todėl kristalas sunaikinamas (NaCl yra trapi medžiaga).

Joninio kristalo sluoksnių poslinkis sukelia didelių atstumiančių jėgų atsiradimą tarp panašių jonų ir kristalo sunaikinimą.
Navigacija
- Kombinuotų uždavinių sprendimas, remiantis kiekybinėmis medžiagos charakteristikomis
- Problemų sprendimas. Medžiagų sudėties pastovumo dėsnis. Skaičiavimai naudojant medžiagos „molinės masės“ ir „cheminio kiekio“ sąvokas
Labai retai cheminės medžiagos susideda iš atskirų, nesusijusių cheminių elementų atomų. Įprastomis sąlygomis tokią struktūrą turi tik nedaugelis dujų, vadinamų tauriosiomis dujomis: helis, neonas, argonas, kriptonas, ksenonas ir radonas. Dažniausiai cheminės medžiagos susideda ne iš izoliuotų atomų, o iš jų junginių į įvairias grupes. Tokiose atomų asociacijose gali būti keli, šimtai, tūkstančiai ar net daugiau atomų. Jėga, kuri laiko šiuos atomus tokiose grupėse, vadinama cheminis ryšys.
Kitaip tariant, galime sakyti, kad cheminis ryšys yra sąveika, kuri suteikia atskirų atomų sujungimą į sudėtingesnes struktūras (molekules, jonus, radikalus, kristalus ir kt.).
Cheminio ryšio susidarymo priežastis yra ta, kad sudėtingesnių struktūrų energija yra mažesnė už bendrą atskirų atomų, sudarančių ją, energiją.
Taigi, ypač jei atomų X ir Y sąveika sukuria molekulę XY, tai reiškia, kad šios medžiagos molekulių vidinė energija yra mažesnė nei atskirų atomų, iš kurių ji buvo suformuota, vidinė energija:
E(XY)< E(X) + E(Y)
Dėl šios priežasties, kai tarp atskirų atomų susidaro cheminiai ryšiai, išsiskiria energija.
Išorinio elektronų sluoksnio elektronai, turintys mažiausią jungimosi energiją su branduoliu, vadinami valentingumas. Pavyzdžiui, bore tai yra 2-ojo energijos lygio elektronai - 2 elektronai 2 s- orbitalės ir 1 po 2 p- orbitos:
Susidarius cheminiam ryšiui kiekvienas atomas linkęs įgyti tauriųjų dujų atomų elektroninę konfigūraciją, t.y. kad jo išoriniame elektronų sluoksnyje būtų 8 elektronai (pirmojo periodo elementams – 2). Šis reiškinys vadinamas okteto taisykle.
Atomai gali pasiekti tauriųjų dujų elektronų konfigūraciją, jei iš pradžių pavieniai atomai dalijasi kai kuriais valentiniais elektronais su kitais atomais. Tokiu atveju susidaro bendros elektronų poros.
Priklausomai nuo elektronų pasidalijimo laipsnio, galima išskirti kovalentinius, joninius ir metalinius ryšius.
Kovalentinis ryšys
Kovalentiniai ryšiai dažniausiai atsiranda tarp nemetalinių elementų atomų. Jei kovalentinį ryšį sudarantys nemetaliniai atomai priklauso skirtingiems cheminiams elementams, toks ryšys vadinamas poliniu kovalentiniu ryšiu. Šio pavadinimo priežastis yra ta, kad skirtingų elementų atomai taip pat turi skirtingus gebėjimus pritraukti bendrą elektronų porą. Akivaizdu, kad tai veda prie bendros elektronų poros poslinkio link vieno iš atomų, dėl ko ant jo susidaro dalinis neigiamas krūvis. Savo ruožtu kitame atome susidaro dalinis teigiamas krūvis. Pavyzdžiui, vandenilio chlorido molekulėje elektronų pora yra perkelta iš vandenilio atomo į chloro atomą:
Medžiagų su poliniais kovalentiniais ryšiais pavyzdžiai:
CCl 4, H 2 S, CO 2, NH 3, SiO 2 ir kt.
Kovalentinis nepolinis ryšys susidaro tarp to paties cheminio elemento nemetalų atomų. Kadangi atomai yra identiški, jų gebėjimas pritraukti bendrus elektronus taip pat yra toks pat. Šiuo atžvilgiu nepastebėtas elektronų poros poslinkis:
Aukščiau pateiktas kovalentinio ryšio susidarymo mechanizmas, kai abu atomai suteikia elektronų, kad sudarytų bendras elektronų poras, vadinamas mainais.
Taip pat yra donoro-akceptoriaus mechanizmas.
Kai kovalentinis ryšys susidaro donoro-akceptoriaus mechanizmu, dėl vieno atomo užpildytos orbitalės (su dviem elektronais) ir tuščios kito atomo orbitalės susidaro bendra elektronų pora. Atomas, suteikiantis vienišą elektronų porą, vadinamas donoru, o atomas, turintis laisvą orbitalę, vadinamas akceptoriumi. Atomai, turintys suporuotus elektronus, pavyzdžiui, N, O, P, S, veikia kaip elektronų porų donorai.
Pavyzdžiui, pagal donoro-akceptoriaus mechanizmą ketvirtoji kovalentinė N-H jungtis susidaro amonio katijone NH 4 +:
Be poliškumo, kovalentiniams ryšiams taip pat būdinga energija. Ryšio energija yra minimali energija, reikalinga ryšiui tarp atomų nutraukti.
Ryšio energija mažėja didėjant surištų atomų spinduliams. Kadangi žinome, kad atomų spindulys didėja pogrupiais, galime, pavyzdžiui, daryti išvadą, kad halogeno ir vandenilio jungties stiprumas didėja eilutėje:
Sveiki< HBr < HCl < HF
Taip pat ryšio energija priklauso nuo jos daugialypiškumo – kuo didesnis ryšio daugialypis, tuo didesnė jo energija. Ryšio daugialypiškumas reiškia bendrų elektronų porų tarp dviejų atomų skaičių.
Joninis ryšys
Joninė jungtis gali būti laikoma kraštutiniu poliarinio kovalentinio ryšio atveju. Jei kovalentiniame-poliniame ryšyje bendroji elektronų pora yra iš dalies pasislinkusi į vieną iš atomų porų, tai joninėje jungtyje ji beveik visiškai „atiduota“ vienam iš atomų. Atomas, dovanojantis elektroną (-us), įgauna teigiamą krūvį ir tampa katijonas, o iš jo elektronus paėmęs atomas įgyja neigiamą krūvį ir tampa anijonas.
Taigi joninis ryšys yra ryšys, susidarantis elektrostatiniam katijonų pritraukimui prie anijonų.
Šio tipo jungtis susidaro tipiškų metalų ir tipiškų nemetalų atomų sąveikos metu.
Pavyzdžiui, kalio fluoridas. Kalio katijonas susidaro pašalinus vieną elektroną iš neutralaus atomo, o fluoro jonas susidaro pridedant vieną elektroną prie fluoro atomo:

Tarp susidariusių jonų atsiranda elektrostatinė traukos jėga, dėl kurios susidaro joninis junginys.
Susidarius cheminiam ryšiui, elektronai iš natrio atomo pereina į chloro atomą ir susidarė priešingai įkrauti jonai, kurie turi užbaigtą išorinės energijos lygį.
Nustatyta, kad elektronai nuo metalo atomo nėra visiškai atsiskyrę, o tik pasislenka link chloro atomo, kaip kovalentiniame ryšyje.
Dauguma dvejetainių junginių, kuriuose yra metalo atomų, yra joniniai. Pavyzdžiui, oksidai, halogenidai, sulfidai, nitridai.
Joninis ryšys taip pat vyksta tarp paprastų katijonų ir paprastų anijonų (F −, Cl −, S 2-), taip pat tarp paprastų katijonų ir kompleksinių anijonų (NO 3 −, SO 4 2-, PO 4 3-, OH −). Todėl joniniams junginiams priskiriamos druskos ir bazės (Na 2 SO 4, Cu(NO 3) 2, (NH 4) 2 SO 4), Ca(OH) 2, NaOH).
Metalinė jungtis
Šio tipo ryšys susidaro metaluose.
Visų metalų atomai savo išoriniame elektronų sluoksnyje turi elektronų, kurių surišimo su atomo branduoliu energija yra maža. Daugeliui metalų išorinių elektronų praradimo procesas yra energetiškai palankus.
Dėl tokios silpnos sąveikos su branduoliu šie elektronai metaluose yra labai judrūs ir kiekviename metalo kristale nuolat vyksta toks procesas:
M 0 - ne - = M n +, kur M 0 yra neutralaus metalo atomas, o M n + yra to paties metalo katijonas. Toliau pateiktame paveikslėlyje parodyta vykstančių procesų iliustracija.
Tai yra, elektronai „skuba“ per metalo kristalą, atsiskirdami nuo vieno metalo atomo, sudarydami iš jo katijoną, prisijungdami prie kito katijono, sudarydami neutralų atomą. Šis reiškinys buvo vadinamas „elektroniniu vėju“, o laisvųjų elektronų sankaupa nemetalinio atomo kristale buvo vadinama „elektronų dujomis“. Tokio tipo metalo atomų sąveika vadinama metaliniu ryšiu.
Vandenilinė jungtis
Jei vandenilio atomas medžiagoje yra prijungtas prie didelio elektronegatyvumo elemento (azoto, deguonies arba fluoro), tai medžiagai būdingas reiškinys, vadinamas vandeniliniu ryšiu.
Kadangi vandenilio atomas yra prijungtas prie elektronneigiamo atomo, vandenilio atome susidaro dalinis teigiamas krūvis, o ant elektroninio elemento atomo susidaro dalinis neigiamas krūvis. Šiuo atžvilgiu elektrostatinė trauka tampa įmanoma tarp iš dalies teigiamai įkrauto vienos molekulės vandenilio atomo ir kitos molekulės elektronneigiamo atomo. Pavyzdžiui, vandenilio ryšys stebimas vandens molekulėms:
Vandenilio jungtis paaiškina neįprastai aukštą vandens lydymosi temperatūrą. Be vandens, stiprūs vandeniliniai ryšiai susidaro ir tokiose medžiagose kaip vandenilio fluoridas, amoniakas, deguonies turinčios rūgštys, fenoliai, alkoholiai ir aminai.