Hidrolizė. Esterių hidrolizė Esteris vyksta reakcija
Esterių ir visų kitų rūgščių darinių hidrolizei reikalinga rūgštinė arba šarminė katalizė. Rūgštinės hidrolizės metu gaunamos karboksirūgštys ir alkoholiai (atvirkštinė esterinimo reakcija), šarminės hidrolizės metu susidaro karboksirūgščių ir alkoholių druskos.
Rūgštinė esterių hidrolizė:
S N mechanizmas, nukleofilas – H 2 O, alkoksi grupė pakeista hidroksilu.
Šarminė esterių hidrolizė: reakcija vyksta dviem etapais su 2 moliais bazės, gauta rūgštis paverčiama druska.
S N mechanizmas, Nu = -OH
Druskų junginių susidarymas Amidai yra neutralios medžiagos, nes pagrindines amoniako savybes susilpnina jame esantis vandenilio atomas pakeitus rūgštine liekana. Todėl amiduose esanti NH 2 grupė, skirtingai nei aminai, tik sunkiai sudaro onio katijoną. Tačiau su stipriomis rūgštimis amidai suteikia druskų, tokių kaip Cl, kurias vanduo lengvai skaido. Kita vertus, NH 2 grupės vandenilis amiduose lengviau pakeičiamas metalais nei amoniake ir aminuose. Pavyzdžiui, acetamidas lengvai ištirpdo gyvsidabrio oksidą, sudarydamas junginį (CH 3 CONH) 2 Hg.
Tačiau gali būti, kad formuojant metalo darinius vyksta amido izomerizacija ir gautas junginys turi izomerinę (tautomerinę) imidinės rūgšties druskos struktūrą.
y., yra analogija su vandenilio cianido rūgšties druskomis.
2. Azoto rūgšties veikimas Amidai reaguoja su azoto rūgštimi, kaip ir pirminiai aminai, sudarydami karboksirūgštis ir išskirdami azotą:
3. Muilinimas Virinant su mineralinėmis rūgštimis ir šarmais, amidai įpilami vandens, sudarydami karboksirūgštį ir amoniaką:
4. Halogenidų alkilų veikimas. Alkilhalogenidams veikiant amidus arba jų metalų darinius, gaunami N-pakeisti amidai:
5. Fosforo pentachlorido veikimas. Fosforo pentachloridui veikiant amidus, chloramidai
lengvai suyra į druskos rūgštį ir imido chloridai
Pastarasis su amoniaku gali duoti druskų amidinai;
6. Virtimas aminais. Energingai redukuojant amidus, galima gauti pirminius aminus, turinčius tokį patį anglies atomų skaičių:
7. Hoffmanno reakcija. Hipohalitui arba bromui ir šarmams veikiant amidus, susidaro aminai, karbonilo grupės anglies atomas atsiskiria CO 2 pavidalu (A. Hoffman). Reakcijos eigą galima pavaizduoti taip:
Mokomuosiuose vadovuose vis dar dažnai randamas kitas šios reakcijos mechanizmo aiškinimas:
Tačiau ši reakcijos eiga yra mažiau tikėtina, nes susidaro fragmentas
su azoto atomu, turinčiu dvi laisvąsias elektronų poras, mažai tikėtina.
Šiam mechanizmui prieštarauja visų pirma tai, kad jei radikalas R yra optiškai aktyvus, jis dėl reakcijos neracemizuojasi. Tuo tarpu net trumpalaikis laisvojo radikalo R-: egzistavimas sukeltų optinio aktyvumo praradimą.
Cheminės savybės. Nitro grupė yra viena iš labiausiai stiprios elektronus atitraukiančios grupės ir geba efektyviai delokalizuoti neigiamą. mokestis. Aromatiniame conn. dėl indukcijos ir ypač mezomerinio poveikio paveikia elektronų tankio pasiskirstymą: branduolys įgyja dalinį teigiamą. mokestis, to-ry lokalizuotas Ch. arr. orto ir para padėtyse; Hammeto konstantos NO 2 grupei s m 0,71, s n 0,778, s + n 0,740, s - n 1,25. Taigi, NO 2 grupės įvedimas dramatiškai padidina reakciją. gebėjimų org. conn. nukleof.reagentų atžvilgiu ir apsunkina p-tioną su elektrof. reagentai. Tai lemia platų nitro junginių naudojimą org. sintezė: NO 2 grupė įvedama į norimą org molekulės padėtį. Kom., atlikti dekomp. p-cija, kaip taisyklė, yra susijusi su anglies skeleto pasikeitimu, o vėliau paverčiama kita funkcija arba pašalinama. Aromatiniame Iš eilės dažnai naudojama trumpesnė schema: NO 2 grupės nitrinimas-transformacija.
Nitrono to-t susidarymas aromatinių nitro junginių serijoje yra susijęs su benzeno žiedo izomerizacija į chinoidinę formą; pavyzdžiui, nitrobenzenas susidaro su konc. H 2 SO 4 spalvotas druskos produktas f-ly I, o-nitrotoluenas pasižymi fotochromizmu dėl vnutrimolio. protonų perkėlimas, kad susidarytų ryškiai mėlynas O darinys:
Bazėms veikiant pirminius ir antrinius nitro junginius, susidaro nitro junginių druskos; ambidentiniai druskų anijonai p-jonuose su elektrofilais gali duoti ir O-, ir C-darinius. Taigi, alkilinant nitro junginių druskas alkilhalogenidais, trialkilchlorsilanais arba R3O + BF-4, gaunami O-alkilinimo produktai. Neseniai m.b. taip pat gaunamas veikiant diazometaną arba N,O-bis-(trimetilsilil)acetamidą nitroalkanams su pKa< 3 или нитроновые к-ты, напр.:
Aciklinis nitrono to-t alkilo esteriai yra termiškai nestabilūs ir suyra pagal intramol. mechanizmas:
R-ts ir ir su r ir ry v o m s vyaz z ir C-N. Pirminiai ir antriniai nitro junginiai pakrovimo metu. su šachtininku. to-tami akivaizdoje. alkoholis arba vandeninis šarmo tirpalas, sudarytas iš karbonilo Comm. (žr. Neph reakciją). R-tion praeina per intervalą. nitrono susidarymas į t:
Kaip šaltinis Comm. gali būti naudojami sililo nitrono eteriai. Stiprus to-t poveikis alifatiniams nitro junginiams gali sukelti hidroksamo susidarymą, pavyzdžiui:
Yra daug būdų, kaip nitro junginius redukuoti į aminus. Plačiai naudojamos geležies drožlės, Sn ir Zn esant. to-t; su katalizatoriumi Hidrinant kaip katalizatorius naudojamas Ni-Raney, Pd/C arba Pd/PbCO 3 ir tt Alifatiniai nitro junginiai lengvai redukuojami į aminus LiAlH4 ir NaBH4. Pd, Na ir Al amalgamos, kaitinant. su hidrazinu virš Pd/C; aromatiniams nitro junginiams kartais naudojami TlCl 3, CrCl 2 ir SnCl 2, aromatiniai. polinitro junginiai selektyviai redukuojami į nitraminus su Na hidrosulfidu CH 3 OH. Yra būdų pasirinkti. NO 2 grupės atkūrimas polifunkciniuose nitro junginiuose nepaveikiant kitų f-jų.
P(III) veikiant aromatiniams nitro junginiams, atsiranda seka. NO 2 grupės deoksigenacija susidarant labai reaktyviems nitrenams. R-tionas naudojamas kondensatoriaus sintezei. heterociklai, pavyzdžiui:
R-ts ir išsaugant NO 2 grupę. Alifatiniai nitro junginiai, turintys a-H-atomą, lengvai alkilinami ir acilinami, kad susidarytų, kaip taisyklė, O dariniai. Tačiau abipusiai mod. Pirminių nitro junginių diličio druskos su alkilhalogenidais, anhidridais arba karboksirūgšties halogenidais sukelia C-alkilinimo arba C-acilinimo produktus, pavyzdžiui:
Žinomi pavyzdžiai vnutrimol. C-alkilinimas, pvz.:
Pirminiai ir antriniai nitro junginiai reaguoja su alifatiniais junginiais. aminai ir CH 2 O susidarant p-amino dariniams (p-tion Mannich); rajone galite naudoti iš anksto gautus nitro junginių ar amino junginių metilolio darinius:
Nitrometanas ir nitroetanas gali kondensuotis su dviem metilolamino molekulėmis, o aukštesni nitroalkanai - tik su viena. Esant tam tikriems reagentų santykiams p-tion gali sukelti heterociklinį. ryšys, pavyzdžiui: su sąveika. pirminis nitroalkanas su dviem pirminio amino ekvivalentais ir formaldehido pertekliumi sudaro Comm. f-ly V, jei reagentai imami santykiu 1:1:3-comm. VI formos.
Aromatiniai nitro junginiai lengvai patenka į p-jono branduolį. pakeitimas ir daug sunkiau, elektrofos rajone. pakeitimas; šiuo atveju nukleofilas nukreipiamas į orto ir porų padėtį, o elektrofilas – į meta padėtį į NO 2 grupę. Greičio konstanta nitrobenzeno nitrinimas yra 5-7 eilėmis mažesnis nei benzeno; taip susidaro m-dinitrobenzenas.
Kai karboksilinant pirminius nitroalkanus, veikiant CH 3 OMgOCOOCH 3 a-nitrokarboksi-to-jūs arba jų esteriai.
Apdorojant mononitro junginių C (NO 2) 4 druskas Ag arba šarminių metalų nitritais arba nitritus veikiant a-halogenitroalkanams šarminėje terpėje (Ter Meer rajonas), brangakmenių dinitro junginiai yra apdorojami. a-halogeninitroalkanų elektrolizė aprotiniuose p-tirpikliuose, taip pat Cl 2 nitro junginių apdorojimas šarminėje terpėje arba nitro junginių druskų elektrooksidacija sukelia vic-dinitro junginius:
Nitro grupė neperteikia būtybių. įtaka laisvųjų radikalų alkilinimui arba aromatiniam arilinimui. jungtis; p-cija veda į pagrindinį. į orto ir para-pakeistus produktus.
Norint atkurti nitro junginius nepažeidžiant NO 2 grupės, žemoje temperatūroje naudojami NaBH 4, LiAlH 4 arba diborano tirpalas THF, pavyzdžiui:
Aromatingas di- ir trinitro junginiai, ypač 1,3,5-trinitrobenzenas, sudaro stabilius ryškiaspalvius kristalus. jie sako kompleksai su aromatiniais Kom.-elektronų donorai (aminai, fenoliai ir kt.). Kompleksai su picric to-one naudojami aromatinėms medžiagoms išskirti ir išvalyti. angliavandeniliai. Intermod. Di- ir trinitrobenzenai su stipriomis bazėmis (HO - , RO - , N - 3 , RSO - 2 , CN - , alifatiniais aminais) sukelia Meisen-heimerio kompleksų susidarymą, kurie išskiriami kaip spalvotos šarminių metalų druskos.
Šioms reakcijoms tinkami oksidatoriai yra chromo arba azoto rūgštis, chromo mišinys, mangano dioksidas arba seleno dioksidas.
Oksiduojant chromo rūgštimi, alkoholis nukleofiliškai prideda prie chromo rūgšties, o vanduo išsiskiria ir susidaro chromo rūgšties esteris (tai pirmasis reakcijos etapas, panašus į karboksirūgščių esterių susidarymą, žr. E skirsnis, 7.1.5.1). Antrajame etape, kuris tikriausiai pereina per ciklinę pereinamąją būseną, alkoholio a-vandenilis pereina į chromato liekaną, o metalas iš šešiavalenčios būsenos pereina į keturvalentę būseną:
| n-CH3O> P-tret-C 4 H 9 > P-CH3> P-Cl> P- NE 2 | (G.6.20) |
Kai pirminiai alkoholiai oksiduojami, susidaręs aldehidas turi būti apsaugotas nuo tolesnio oksidacijos iki karboksirūgšties. Pavyzdžiui, galima nuolat distiliuoti aldehidą iš reakcijos mišinio: tai visiškai įmanoma, nes aldehido virimo temperatūra paprastai yra žemesnė nei atitinkamo alkoholio virimo temperatūra. Nepaisant to, aldehidų išeiga oksiduojant dichromatu retai viršija 60%. Pažymėtina, kad tinkamai vykdant reakciją, daugybinės anglies-anglies jungtys beveik nepaveikiamos.
Aldehidai susidaro ir kaitinant alkoholius vandeniniu neutraliu dichromato tirpalu, tačiau gerą derlių duoda tik benzilo alkoholiai.
Didesnę aldehidų išeigą galima gauti oksiduojant pirminius alkoholius tret-butilo chromatas (petrolio eteryje, benzene arba anglies tetrachloride) arba mangano dioksidas (acetone, petrolio eteryje, anglies tetrachloride arba praskiestoje sieros rūgštyje). Šie reagentai taip pat leidžia gauti gerą išeigą nesočiųjų ir aromatinių aldehidų.
Antrinių alkoholių oksidacija į ketonus yra dar lengvesnė nei pirminių alkoholių oksidacija. Išeiga čia didesnė, nes, pirma, antrinių alkoholių reaktyvumas yra didesnis nei pirminių, antra, susidarantys ketonai yra daug atsparesni oksidacijai, lyginant su aldehidais. Steroidų ir terpenų serijoje antrinių alkoholių oksidacija chromo rūgšties kompleksu su piridinu, taip pat chromo anhidridu dimetilformamide pasitvirtino. Geras oksidatorius taip pat yra chromo anhidridas acetone; jis gali būti naudojamas nesočiųjų antrinių alkoholių oksidavimui, nepažeidžiant daugialypio anglies-anglies ryšio.
Naujas metodas, taip pat tinkamas kliūtiems alkoholiams, yra oksidacija dimetilsulfoksidu acto rūgšties anhidride.
Pagal toliau pateiktą metodą reakcija vykdoma dviejų fazių sistemoje. Susidarę ketonai ekstrahuojami organiniu tirpikliu ir taip apsaugomi nuo tolesnio oksidacijos.
disacharidai- angliavandeniai, kurių molekulės susideda iš dviejų monosacharidų liekanų, kurios yra tarpusavyje susijusios dėl dviejų hidroksilo grupių sąveikos.
Disacharido molekulės susidarymo procese viena vandens molekulė yra atskirta:
arba sacharozei:
Todėl disacharidų molekulinė formulė yra C12H22O11.
Sacharozės susidarymas vyksta augalų ląstelėse veikiant fermentams. Tačiau chemikai rado būdą, kaip įgyvendinti daugelį reakcijų, kurios yra laukinėje gamtoje vykstančių procesų dalis. 1953 metais prancūzų chemikas R. Lemieux pirmą kartą atliko sacharozės sintezę, kurią jo amžininkai vadino „organinės chemijos Everesto užkariavimu“.
Pramonėje sacharozė gaunama iš cukranendrių sulčių (14-16%), cukrinių runkelių (16-21%), taip pat kai kurių kitų augalų, pavyzdžiui, Kanados klevo ar maltų kriaušių.
Visi žino, kad sacharozė yra kristalinė medžiaga, kurios skonis yra saldus ir gerai tirpsta vandenyje.
Cukranendrių sultyse yra angliavandenių sacharozės, paprastai vadinamos cukrumi.
Vokiečių chemiko ir metalurgo A. Marggrafo vardas glaudžiai susijęs su cukraus gamyba iš runkelių. Jis buvo vienas pirmųjų mokslininkų, savo cheminiams tyrimams panaudojęs mikroskopą, kuriuo 1747 m. burokėlių sultyse atrado cukraus kristalus.
Laktozė – kristalinė pieno cukraus, buvo gautas iš žinduolių pieno dar XVII a. Laktozė yra mažiau saldus disacharidas nei sacharozė.
Dabar susipažinkime su sudėtingesnės struktūros angliavandeniais - polisacharidai.
Polisacharidai- didelės molekulinės masės angliavandeniai, kurių molekulės susideda iš daugelio monosacharidų.
Supaprastinta forma bendrą schemą galima pavaizduoti taip:
Dabar palyginkime krakmolo ir celiuliozės – svarbiausių polisacharidų atstovų – struktūrą ir savybes.
Šių polisacharidų polimerinių grandinių struktūrinis vienetas, kurio formulė yra (C 6 H 10 O 5) n, yra gliukozės liekanos. Norint užrašyti struktūrinio vieneto sudėtį (C 6 H 10 O 5), iš gliukozės formulės reikia atimti vandens molekulę.
Celiuliozė ir krakmolas yra augalinės kilmės. Jie susidaro iš gliukozės molekulių dėl polikondensacijos.
Polikondensacijos reakcijos lygtis, taip pat atvirkštinis polisacharidų hidrolizės procesas, sąlygiškai gali būti parašytas taip:
Krakmolo molekulės gali turėti tiek linijinę, tiek šakotą struktūrą, celiuliozės molekulės gali turėti tik linijinę.
Sąveikaujant su jodu, krakmolas, skirtingai nei celiuliozė, suteikia mėlyną spalvą.
Šie polisacharidai taip pat atlieka įvairias funkcijas augalo ląstelėje. Krakmolas tarnauja kaip rezervinė maistinė medžiaga, celiuliozė atlieka struktūrinę, statybinę funkciją. Augalų ląstelių sienelės sudarytos iš celiuliozės.
KANCERŲ REAKCIJA, oksiduojantis-redukuojantis aldehidų disproporcija, veikiant šarmams, susidarant pirminiams alkoholiams ir karboksirūgštims, pavyzdžiui:
Aldehidas apdorojamas konc. vandeninis arba vandeninis-alkoholinis šarmo tirpalas aušinant arba nežymiai kaitinant Katalizatoriai - suyra. metalai (pvz., Ag, Ni, Co, Cu) ir jų oksidai. Aldehidai, neturintys atomo H a padėtyje prie karbonilo grupės, patenka į p-tioną. Priešingu atveju pirmenybė teikiama ne Cannizzaro reakcijai, o aaldolio kondensacijai. Elektronus ištraukiantys pakaitai aromatiniame žiede. aldehidai pagreitina procesą, o elektronų donorai – lėtina. Benzaldehidai su pakaitais orto padėtyse nereaguoja Cannizzaro; o- ir p-hidroksibenzaldehidai reaguoja tik esant. Ag. R-tion, naudojant du razl.aldehidus (vadinamoji kryžminė Cannizzaro reakcija) naudoja Ch. arr. gauti didelę pirminių alkoholių išeigą iš aromatinių. aldehidai. Šiuo atveju formaldehidas paprastai veikia kaip reduktorius:
ArCHO + CH 2 O: ArCH 2 OH + HCOOH
Sintezuojant polihidroksimetilintas Comm. formaldehidas dalyvauja pirmajame aldolio kondensacijos etape, o vėliau kaip reduktorius kryžminėje Cannizzaro reakcijoje:
Siūlomas Cannizzaro reakcijos mechanizmas Homoge. aplinka apima hidrido perdavimo stadiją
Dėl aromatinių aldehidai, negalima atmesti galimybės dalyvauti Cannizzaro radikalių anijonų reakcijoje, susidariusioje dėl vieno elektrono perdavimo. R-cija, panaši į Cannizzaro reakciją, atliekama naudojant intramol. a-ketoaldehidų disproporcija esant. šarmai (Cannizzaro pertvarkymas):
Cannizzaro reakcija naudojama išleistuvėms. pentaeritritolio sintezė, preparatinė alkoholių, karboksirūgščių gamyba ir kt.R-tion atrado S. Cannizzaro 1853 m.
Pirolis, furanas ir tiofenas yra penkių narių heterocikliniai junginiai, turintys vieną heteroatomą.
Atomų numeracija heterocikle prasideda nuo heteroatomo ir tęsiasi prieš laikrodžio rodyklę. 2 ir 5 pozicijos vadinamos a, 3 ir 4 - b pozicijomis.
Pagal formalius požymius šie junginiai yra aromatiniai, nes yra konjuguotos ciklinės p-sistemos, kuriose yra 6p elektronai – 4 dienų sistemos elektronai – ir heteroatomo elektronų pora. Ciklas praktiškai plokščias, vadinasi, heteroatomo hibridizacijos būsena artima sp 2 .
Rezonanso struktūros pateikiamos žemiau, iliustruojančios heteroatomo elektronų delokalizaciją išilgai heterociklinio žiedo, naudojant furaną kaip pavyzdį.
Aukščiau pateiktos rezonansinės struktūros rodo, kad heteroatomas (šiuo atveju deguonies atomas) dėl mezomerinės sąveikos su dieno π-sistema perduoda elektronų tankį į žiedą, dėl ko ant jo atsiranda tam tikras neigiamas krūvis. anglies atomai heterocikle ir deguonies atome atitinkamai teigiamo krūvio krūvis. Žinoma, deguonies atomas, be teigiamo mezomerinio efekto, taip pat turi neigiamą indukcinį poveikį. Tačiau jo pasireiškimas nagrinėjamų junginių savybėse yra ne toks ryškus, todėl penkių narių heterociklai su vienu heteroatomu vadinami p-pertekliniais aromatiniais heterocikliniais junginiais. Rezonansas lemia tam tikrą heterociklo jungčių ilgio tolygumą, o tai taip pat rodo tam tikrą sistemos aromatingumą.
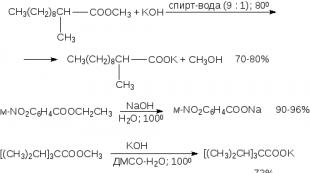
Esterių hidrolizę katalizuoja ir rūgštys, ir bazės. Rūgštinė esterių hidrolizė paprastai atliekama kaitinant vandenilio chlorido arba sieros rūgštimi vandeninėje arba vandeninėje-alkoholinėje terpėje. Organinėje sintezėje rūgštinė esterių hidrolizė dažniausiai naudojama mono- ir dialkilu pakeistiems malono esteriams (17 skyrius). Malono esterio mono- ir dipakeisti dariniai, verdami su koncentruota druskos rūgštimi, yra hidrolizuojami, po to dekarboksilinami.
Baziškai katalizuojamai hidrolizei dažniausiai naudojamas vandeninis arba vandeninis-alkoholinis NaOH arba KOH tirpalas. Geriausi rezultatai gaunami naudojant ploną kalio hidroksido suspensiją DMSO, kurioje yra nedidelis kiekis vandens.

Pastarasis metodas yra tinkamiausias trukdomų rūgščių esterių muilinimui, kita šio metodo modifikacija yra šarminė trukdomų esterių hidrolizė, esant 18-karūnų-6-poliesteriui:

Paruošimo tikslais bazinė katalizuojama hidrolizė turi daug aiškių pranašumų, palyginti su rūgštine hidrolize. Esterių bazinės hidrolizės greitis paprastai yra tūkstantį kartų greitesnis nei rūgštinės katalizės greitis. Hidrolizė rūgštinėje terpėje yra grįžtamasis procesas, priešingai nei hidrolizė esant bazei, kuri yra negrįžtama.
18.8.2.A. Esterių hidrolizės mechanizmai
Esterių hidrolizė su grynu vandeniu daugeliu atvejų yra grįžtama reakcija, dėl kurios susidaro pusiausvyrinis karboksirūgšties ir pradinio esterio mišinys:

Ši reakcija rūgštinėje ir šarminėje terpėje labai pagreitėja, o tai yra susijusi su rūgščių-šarmų katalize (3 skyrius).
Pasak K. Ingoldo, esterių hidrolizės mechanizmai klasifikuojami pagal šiuos kriterijus:
(1) Katalizės tipas: rūgštinė (simbolis A) arba bazinė (simbolis B);
(2) Skilimo tipas, parodantis, kuri iš dviejų esterio -C-O jungčių nutrūksta dėl reakcijos: acilo deguonis (indeksas AC) ar alkilo deguonis (indeksas AL):

(3) Reakcijos molekuliškumas (1 arba 2).
Iš šių trijų kriterijų galima sudaryti aštuonias skirtingas kombinacijas, kurios parodytos 18.1 pav.

Tai yra labiausiai paplitę mechanizmai. Šarminis muilinimas beveik visada yra B tipo AC 2. Rūgštinė hidrolizė (taip pat ir esterifikacija) daugeliu atvejų turi A AC 2 mechanizmą.

AAC 1 mechanizmas dažniausiai stebimas tik stipriai rūgštiniuose tirpaluose (pavyzdžiui, koncentruotame H 2 SO 4), ypač būdingas steriškai trukdomų aromatinių rūgščių esteriams.
BAC 1 mechanizmas vis dar nežinomas.

BAL 2 mechanizmas buvo nustatytas tik esant išskirtinai stiprioms erdviškai atrinktoms acilo grupėms ir neutraliai -laktonų hidrolizei. A AL 2 mechanizmas vis dar nežinomas.

Pagal mechanizmą AL 1 paprastai reaguoja su tretiniais alkilo esteriais neutralioje arba rūgštinėje aplinkoje. Tie patys substratai panašiomis sąlygomis gali reaguoti pagal B AL 1 mechanizmą, tačiau pereinant į šiek tiek šarmesnę aplinką, B AL 1 mechanizmas iš karto pakeičiamas B AC 2 mechanizmu.
Kaip matyti iš 18.1 schemos, rūgščių katalizuojamos reakcijos yra grįžtamos, o iš mikroskopinio grįžtamumo principo (2 skyrius) išplaukia, kad rūgštimi katalizuojamas esterifikavimas taip pat vyksta panašiais mechanizmais. Tačiau naudojant bazinę katalizę, pusiausvyra pasislenka link hidrolizės (muilinimo), nes pusiausvyra pasislenka dėl karboksirūgšties jonizacijos. Pagal aukščiau pateiktą schemą mechanizmo A AC 1 atveju COOR ir COOH grupės yra protonuojamos ties alkoksi arba hidroksilo deguonies atomu. Paprastai tariant, termodinamikos požiūriu karbonilo deguonies, C=O grupės protonavimas yra naudingesnis, nes Šiuo atveju teigiamas krūvis gali būti delokalizuotas tarp abiejų deguonies atomų:

Nepaisant to, tirpale nedideliais kiekiais yra ir tautomerinio katijono, būtino tarpinio junginio A AC 1 mechanizme. Abu B1 mechanizmai (kurių B AC 1 nežinomas) iš tikrųjų nėra kataliziniai, nes neutraliojo disociacija. eteris atsiranda pradžioje.
Iš aštuonių Ingoldo mechanizmų tik šeši buvo įrodyti eksperimentiškai.
APIBRĖŽIMAS
Organinės prigimties junginiai, kurie yra karboksirūgščių dariniai, susidarę pastarosioms sąveikaujant su alkoholiais:
Struktūrinė esterių formulė bendrai:

kur R ir R’ yra angliavandenilių radikalai.
Esterių hidrolizė
Vienas iš būdingiausių esterių savybių (be esterifikacijos) yra jų hidrolizė – skilimas veikiant vandeniui. Kitu būdu esterių hidrolizė vadinama muilinimu. Priešingai nei druskų hidrolizė, šiuo atveju ji yra praktiškai negrįžtama. Atskirkite šarminę ir rūgštinę esterių hidrolizę. Abiem atvejais susidaro alkoholis ir rūgštis:
a) rūgštinė hidrolizė

b) šarminė hidrolizė

Problemų sprendimo pavyzdžiai
1 PAVYZDYS
| Pratimas | Nustatykite acto rūgšties masę, kurią galima gauti muilinant etilacetatą, kurio masė yra 180 g. |
| Sprendimas | Rašome acto rūgšties etilo esterio hidrolizės reakcijos lygtį naudodami bendrąją formulę: C 4 H 8 O 2 + H 2 O ↔ CH 3 COOH + C 2 H 5 OH. Apskaičiuokite etilacetato medžiagos kiekį (molinė masė - 88 g / mol), naudodami masės vertę iš problemos sąlygų: υ (C 4 H 8 O 2) \u003d m (C 4 H 8 O 2) / M (C 4 H 8 O 2) \u003d 180/88 \u003d 2 mol. Pagal reakcijos lygtį etilo acetato ir acto rūgšties molių skaičius yra: υ (C 4 H 8 O 2) \u003d υ (CH 3 COOH) \u003d 2 mol. Tada galite nustatyti acto rūgšties masę (molinė masė - 60 g / mol): m (CH 3 COOH) \u003d υ (CH 3 COOH) × M (CH 3 COOH) = 2 × 60 \u003d 120 g. |
| Atsakymas | Acto rūgšties masė yra 120 gramų. |
Esteriai vadinami bendrosios formulės funkciniais karboksirūgščių dariniais RC(O)ARBA" .
Karboksirūgščių esteriai (taip pat ir sulfonrūgštys) vadinami panašiai kaip druskos, tik vietoj katijono pavadinimo naudojamas atitinkamo alkilo arba arilo pavadinimas, kuris dedamas prieš anijono pavadinimą ir rašomas kartu. su tuo. -COOR esterio grupės buvimas taip pat gali būti išreikštas aprašomuoju būdu, pavyzdžiui, "(tokios ir tokios) rūgšties R-esteris" (šis metodas yra mažiau pageidautinas dėl jo sudėtingumo):
Žemesniųjų alkoholių ir karboksirūgščių esteriai yra lakūs, malonaus kvapo skysčiai, blogai tirpūs vandenyje ir gerai – daugumoje organinių tirpiklių. Esterių kvapai primena įvairių vaisių kvapus, todėl maisto pramonėje iš jų ruošiamos vaisių kvapus imituojančios esencijos. Padidėjęs esterių lakumas naudojamas analitiniais tikslais.
Hidrolizė. Svarbiausia iš acilinimo reakcijų yra esterių hidrolizė, susidarant alkoholiui ir karboksirūgštims:
Reakcija vykdoma tiek rūgštinėje, tiek šarminėje aplinkoje. katalizuojama rūgštimi esterio hidrolizė - atvirkštinė esterinimo reakcija, vyksta pagal tą patį mechanizmą A AC 2:
Šios reakcijos nukleofilas yra vanduo. Pusiausvyros poslinkis link alkoholio ir rūgšties susidarymo užtikrinamas pridedant vandens pertekliaus.
Šarminė hidrolizė yra negrįžtama; reakcijos metu vienam moliui eterio sunaudojamas molis šarmo, t. y. šarmas šioje reakcijoje veikia kaip sunaudojamas reagentas, o ne kaip katalizatorius:
Esterių hidrolizė in šarminė aplinka vyksta per bimolekulinį acilo mechanizmą B AC 2 susidarant tetraedriniam tarpiniam junginiui (I). Šarminės hidrolizės negrįžtamumą užtikrina praktiškai negrįžtama karboksirūgšties (II) ir alkoksido jono (III) rūgšties ir bazės sąveika. Susidaręs karboksirūgšties (IV) anijonas pats savaime yra gana stiprus nukleofilas, todėl nėra veikiamas nukleofilų atakos.
Esterių amonolizė. Amidai gaunami esterių amonolizės būdu. Pavyzdžiui, veikiant vandeniniam amoniakui dietilfumaratui, susidaro pilnas fumaro rūgšties amidas:
Atliekant esterių amonolizę su mažo nukleofiliškumo aminais, pastarieji pirmiausia paverčiami šarminių arba šarminių žemių metalų amidais:

Karboksirūgšties amidai: nomenklatūra; amido grupės struktūra; rūgščių-šarmų savybės; rūgštinė ir šarminė hidrolizė; suskaidymas hipobromitais ir azoto rūgštimi; dehidratacija iki nitrilų; cheminis identifikavimas.
Amidai vadinami bendrosios formulės funkciniais karboksirūgščių dariniais R-C (O) -NH2- n R "n, kur n = 0-2. Nepakeistuose amiduose acilo liekana prijungta prie nepakeista amino grupe, N-pakeistuose amiduose vienas iš vandenilio atomų pakeistas vienu alkilo arba arilo radikalu, N,N-pakeistuose - dviem.
Junginiai, turintys vieną, dvi arba tris acilo grupes, prijungtas prie azoto atomo, paprastai vadinami amidais (atitinkamai pirminiais, antriniais ir tretiniais). Pirminių amidų su nepakeista grupe - NH2 pavadinimai yra kilę iš atitinkamų acilo radikalų pavadinimų, priesagą -alyva (arba -ilas) pakeičiant -amidu. Amidai, susidarę iš rūgščių su priesaga -karboksirūgštis, gauna galūnę -karboksamidas. Sulfonrūgščių amidai taip pat vadinami atitinkamų rūgščių vardais, naudojant priesagą -sulfonamidas.
Radikalų RCO-NH- (taip pat RSO 2 -NH-) pavadinimai susidaro iš amidų pavadinimų, priesagą -amidas keičiant į -amido-. Jie naudojami, jei likusioje molekulės dalyje yra senesnė grupė arba pakeitimas vyksta sudėtingesnėje struktūroje nei radikalas R:

N-pakeistų pirminių amidų RCO-NHR" ir RCO-NR"R" (taip pat panašių sulfonamidų) pavadinimuose radikalų R" ir R" pavadinimai nurodomi prieš amido pavadinimą simboliu N. -:
Šio tipo amidai dažnai vadinami antriniais ir tretiniais amidais, kurių nerekomenduoja IUPAC.
N-fenil-pakeisti amidai jų pavadinimuose turi priesagą -anilidas. Pakaitų padėtis anilino liekanoje pažymėta skaičiais su brūkšniais:
Be to, buvo išsaugoti pusiau sisteminiai pavadinimai, kuriuose priesaga -amidas jungiasi su lotyniško karboksirūgšties pavadinimo pagrindu (formamidas, acetamidas), taip pat kai kurie trivialus pavadinimai, tokie kaip „anilidai“ (acilinti anilinai) arba „toluididai“ (acilinti toluidinai).
Amidai yra kristalinės medžiagos, kurių lydymosi temperatūra yra gana aukšta ir skiriasi, todėl kai kuriuos iš jų galima naudoti kaip darinius karboksirūgštims identifikuoti. Retais atvejais tai yra skysčiai, pavyzdžiui, skruzdžių rūgšties amidai – formamidas ir N,N-dimetilformamidas – žinomi dipoliniai aprotiniai tirpikliai. Žemesni amidai gerai tirpsta vandenyje.
Amidai yra vienas atspariausių hidrolizei funkciniai karboksirūgščių dariniai, dėl kurių jie yra plačiai paplitę gamtoje. Daugelis amidų naudojami kaip vaistai. Apie šimtmetį medicinos praktikoje buvo naudojami paracetamolis ir fenacetinas, kurie yra pakeisti acto rūgšties amidai.
Amidų struktūra. Amido grupės elektroninė struktūra iš esmės yra panaši į karboksilo grupės struktūrą. Amido grupė yra p,π konjuguota sistema, kurioje vieniša azoto atomo elektronų pora yra konjuguota su C=O π jungties elektronais. Elektronų tankio delokalizaciją amido grupėje galima pavaizduoti dviem rezonansinėmis struktūromis:
Dėl konjugacijos C-N ryšys amiduose turi iš dalies dvigubai susietas pobūdį, jo ilgis yra žymiai mažesnis už viengubos jungties ilgį aminuose, o C = O ryšys yra šiek tiek ilgesnis nei C = O ryšys aldehiduose ir ketonuose. Amido grupė dėl konjugacijos turi plokščią dizainą . Žemiau pateikiami N-pakeisto amido molekulės geometriniai parametrai, nustatyti naudojant rentgeno spindulių difrakcijos analizę:

Svarbi C-N jungties iš dalies dvigubo ryšio pasekmė yra gana didelis energijos barjeras sukimuisi aplink šią jungtį, pavyzdžiui, dimetilformamidui jis yra 88 kJ/mol. Dėl šios priežasties amidai, turintys skirtingus pakaitus azoto atome, gali egzistuoti kaip π-diastereomerai. N-pakeisti amidai daugiausia egzistuoja kaip Z-izomerai:

N,N-pakeistų amidų atveju E- ir Z-izomerų santykis priklauso nuo radikalų, prijungtų prie azoto atomo, tūrio. Amidų stereoizomerai yra konfigūracijos nestabilūs, jų egzistavimas įrodytas daugiausia fizikiniais ir cheminiais metodais, o atskirai jie buvo išskirti tik keliais atvejais. Taip yra dėl to, kad amidų sukimosi barjeras vis dar nėra toks didelis kaip alkenų, kuriems jis yra 165 kJ/mol.
Rūgščių-šarmų savybės. Amidai turi silpnos tiek rūgštinės, tiek bazinės savybės . Amidų šarmiškumas yra Pk BH + intervale nuo -0,3 iki -3,5. Amido grupės aminogrupės baziškumo sumažėjimo priežastis yra azoto atomo vienišų elektronų poros konjugacija su karbonilo grupe. Sąveikaujant su stipriomis rūgštimis, amidai protonizuojasi ties deguonies atomu tiek praskiestuose, tiek koncentruotose rūgšties tirpaluose. Tokios sąveikos pagrindas rūgštinė katalizė amido hidrolizės reakcijose:
Nepakeisti ir N-pakeisti amidai silpnos NH-rūgšties savybės , panašus į alkoholių rūgštingumą ir pašalina protoną tik reakcijose su stipriomis bazėmis.
Rūgščių ir šarmų sąveika yra amidų susidarymo pagrindas tarpmolekuliniai partneriai , kurio egzistavimas paaiškina aukštą amidų lydymosi ir virimo temperatūrą. Gali būti dviejų tipų asocijuotų junginių: linijinių polimerų ir ciklinių dimerų. Vieno ar kito tipo vyravimą lemia amido struktūra. Pavyzdžiui, N-metilacetamidas, kuriam pirmenybė teikiama Z konfigūracijai, sudaro linijinį junginią, o laktamai, turintys standžiai fiksuotą E konfigūraciją, sudaro dimerus:

N, N-Dipakeisti amidai sudaro dimerus dėl 2 polinių molekulių dipolio ir dipolio sąveikos:

Acilinimo reakcijos. Dėl to, kad konjuguotoje amido sistemoje yra stipri elektronus dovanojanti amino grupė, karbonilo anglies atomo elektrofiliškumas, taigi ir amidų reaktyvumas acilinimo reakcijose, yra labai mažas. Žemas amidų acilinimo gebėjimas taip pat paaiškinama tuo, kad amido jonas NH 2 - yra blogai paliekanti grupė. Iš acilinimo reakcijų svarbi amidų hidrolizė, kuri gali būti vykdoma rūgštinėje ir šarminėje terpėje. Amidus daug sunkiau hidrolizuoti nei kitus funkcinius karboksirūgščių darinius. Amidų hidrolizė atliekama sunkesnėmis sąlygomis, palyginti su esterių hidrolize.
Rūgštinė hidrolizė amidai - negrįžtamas reakcija, dėl kurios susidaro karboksirūgštis ir amonio druska:
Daugeliu atvejų rūgštinė amidų hidrolizė vyksta pagal mechanizmą bimolekulinės rūgšties acilinimas A AC 2 t.y. panašus į esterių rūgšties hidrolizės mechanizmą. Reakcijos negrįžtamumas atsiranda dėl to, kad amoniakas arba aminas rūgščioje aplinkoje virsta amonio jonu, kuris neturi nukleofilinių savybių:

Šarminė hidrolizė Tas pats negrįžtamas reakcija; dėl to susidaro karboksirūgšties druska ir amoniakas arba aminas:
Šarminė amidų hidrolizė, kaip ir esterių hidrolizė, vyksta per tetraedrinis mechanizmas IN AC 2 . Reakcija prasideda hidroksido jonu (nukleofilu) pridedant prie amido grupės elektrofilinio anglies atomo. Gautas anijonas (I) yra protonuojamas prie azoto atomo, o tada dvipoliame jone (II) susidaro gera paliekanti grupė – amoniako arba amino molekulė. Manoma, kad lėtoji stadija yra tetraedrinio tarpinio (II) irimas.
Anilidams ir kitiems amidams, kurių azoto atomo pakaitalai yra elektronus sutraukiantys, tetraedrinio tarpinio junginio (I) skilimas gali vykti susidarant dianijonui (II):

Skaldymas azoto rūgštimi. Sąveikaujant su azoto rūgštimi ir kitais nitrozuojančiais agentais, amidai paverčiami atitinkamomis karboksirūgštimis, kurių išeiga iki 90 %:
Dehidratacija. Nepakeisti amidai, veikiami fosforo (V) oksido ir kai kurių kitų reagentų (POC1 3, PC1 5, SOCl 2), paverčiami nitrilais:
![]()
47. Karboksirūgštys: halogeninimas pagal Gell-Volhard-Zelinsky, naudojant reakciją sintezei a -hidroksi ir a -amino rūgštys.
Alifatinių karboksirūgščių halogeninimas.
Alifatinės karboksirūgštys α padėtyje halogeninamos chloru arba bromu, esant kataliziniam kiekiui raudonasis fosforas arba fosforo halogenidai (Gelio-Volhardo-Zelinskio reakcija ). Pavyzdžiui, kai heksano rūgštis brominama esant raudonajam fosforui arba fosforo(III) chloridui, 2-bromheksano rūgštis susidaro dideliu derlingumu, pavyzdžiui:
Bromuojama ne pati karboksirūgštis, o iš jos in situ susidaręs rūgšties chloridas. Rūgšties chloridas turi stipresnes CH-rūgšties savybes nei karboksirūgštis ir lengviau sudaro enolio formą.
Enolis (I) prideda bromo, kad susidarytų halogeno darinys (II), kuris toliau abstrahuoja vandenilio halogenidą ir virsta α-halogenu pakeistu rūgšties halogenidu (III). Paskutiniame etape regeneruojamas nepakeistas karboksirūgšties halogenidas.

Kitos heterofunkcinės rūgštys sintetinamos iš gautų α-halogenais pakeistų rūgščių, naudojant nukleofilines pakeitimo reakcijas.