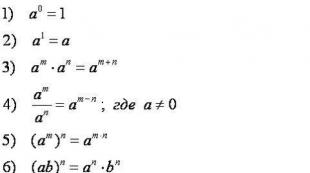रसायन विज्ञान में ege Gushchin deshchin। उद्देश्य किम ईगर
कार्य 1-3 करने के लिए, निम्न श्रृंखला का उपयोग करें रासायनिक तत्व। कार्य 1-3 में उत्तर संख्याओं का अनुक्रम है जिसके तहत इस श्रृंखला में रासायनिक तत्वों को इंगित किया जाता है।
1) एनए 2) के 3) सी 4) एमजी 5) सी
कार्य संख्या 1
तत्वों की पंक्ति में निर्दिष्ट परमाणुओं को निर्धारित करें बाहरी ऊर्जा स्तर पर चार इलेक्ट्रॉन चार इलेक्ट्रॉनों हैं।
उत्तर: 3; पांच
मुख्य उपसमूहों के तत्वों के बाहरी ऊर्जा स्तर (इलेक्ट्रॉन परत) में इलेक्ट्रॉनों की संख्या संख्या संख्या के बराबर है।
इस प्रकार, सिलिकॉन और कार्बन प्रतिनिधित्व उत्तरों से उपयुक्त हैं, क्योंकि वे टेबल डीआई के चौथे समूह के मुख्य उपसमूह में हैं। Mendeleeva (आईवीए समूह), यानी सही जवाब 3 और 5।
कार्य संख्या 2।
कई रासायनिक तत्वों में निर्दिष्ट लोगों से, तीन तत्वों का चयन करें, जो रासायनिक तत्वों की आवधिक प्रणाली में डी.आई. Mendeleev एक अवधि में हैं। चयनित वस्तुओं को अपने धातु गुणों को बढ़ाने के क्रम में रखें।
वांछित अनुक्रम में चयनित वस्तुओं के प्रतिक्रिया क्षेत्र में लिखें।
उत्तर: 3; चार; एक
सबमिट किए गए तत्वों से एक अवधि में तीन हैं - यह सोडियम ना, सिलिकॉन एसआई और मैग्नीशियम एमजी है।
जब आवधिक सारणी की एक अवधि के भीतर ड्राइविंग डी.आई. बाईं ओर दाईं ओर मेंडेलीव (क्षैतिज रेखाएं) बाहरी परत पर स्थित इलेक्ट्रॉनों की वापसी की सुविधा प्रदान करती है, यानी। तत्वों के धातु गुणों को बढ़ाया जाता है। इस प्रकार, सोडियम, सिलिकॉन और मैग्नीशियम की धातु गुण एसआई पंक्ति में तीव्र होते हैं कार्य संख्या 3। उन लोगों में से कई वस्तुओं में से, दो तत्वों का चयन करें जो -4 के बराबर ऑक्सीकरण की निचली डिग्री दिखाते हैं। चयनित वस्तुओं के प्रतिक्रिया क्षेत्र में रिकॉर्ड करें। उत्तर: 3; पांच ऑक्टेट नियम के अनुसार, रासायनिक तत्वों के परमाणु उनके बाहरी इलेक्ट्रॉन स्तर 8 इलेक्ट्रॉनों पर रहते हैं, जैसे महान गैसों। इसे बाद के स्तर के इलेक्ट्रॉनों को लौटकर या तो प्राप्त किया जा सकता है, फिर पिछले एक, जिसमें 8 इलेक्ट्रॉन होते हैं, या इसके विपरीत, अतिरिक्त इलेक्ट्रॉनों के अतिरिक्त आठ बाहरी हो जाते हैं। सोडियम और पोटेशियम क्षारीय धातुओं से संबंधित हैं और पहले समूह (आईए) के मुख्य उपसमूह में स्थित हैं। इसका मतलब है कि उनके परमाणुओं की बाहरी इलेक्ट्रॉन परत पर एक इलेक्ट्रॉन है। इस संबंध में, एक इलेक्ट्रॉन का नुकसान एक और सात के प्रवेश की तुलना में ऊर्जावान रूप से अधिक लाभदायक है। मैग्नीशियम के साथ, स्थिति समान है, केवल यह दूसरे समूह के मुख्य उपसमूह में है, यानी बाहरी इलेक्ट्रॉन स्तर पर उनके दो इलेक्ट्रॉन हैं। यह ध्यान दिया जाना चाहिए कि सोडियम, पोटेशियम और मैग्नीशियम धातुओं से संबंधित हैं, और धातुओं के लिए, सिद्धांत रूप में, ऑक्सीकरण की नकारात्मक डिग्री असंभव है। किसी भी धातु के ऑक्सीकरण की न्यूनतम डिग्री शून्य है और सरल पदार्थों में मनाया जाता है। रासायनिक तत्व कार्बन सी और सिलिकॉन एसआई गैर धातुएं हैं और चौथे समूह (आईवीए) के मुख्य उपसमूह में स्थित हैं। इसका मतलब है कि उनकी बाहरी इलेक्ट्रॉनिक परत पर 4 इलेक्ट्रॉन हैं। इस कारण से, ये तत्व इन इलेक्ट्रॉनों के रिटर्न और 8 मीटर की कुल राशि के लिए चार और के अतिरिक्त दोनों को संभव हैं। सिलिकॉन और कार्बन परमाणु के 4 से अधिक इलेक्ट्रॉनों को संलग्न नहीं किया जा सकता है, इसलिए उनके लिए न्यूनतम ऑक्सीकरण की डिग्री -4 है। कार्य संख्या 4। प्रस्तावित सूची से, दो यौगिकों का चयन करें जिसमें आयनिक रासायनिक बंधन मौजूद है। उत्तर 1; 3। मामलों के भारी बहुमत में यौगिक में एक आयनिक प्रकार के संचार की उपस्थिति को निर्धारित करना संभव है, एक ही समय में इसकी संरचनात्मक इकाइयों की संरचना के लिए यह संभव है कि सामान्य धातु के परमाणु और गैर-धातु परमाणु शामिल हों। इस आधार पर, हम स्थापित करते हैं कि आयनिक संचार संख्या 1 - सीए (क्लो 2) 2 पर एक परिसर में उपलब्ध है, क्योंकि अपने सूत्र में, आप एक सामान्य कैल्शियम धातु और गैर-मेटलुलोव परमाणुओं के परमाणुओं को देख सकते हैं - ऑक्सीजन और क्लोरीन। हालांकि, निर्दिष्ट सूची आइटम में धातु और nonmetalla के एक ही समय परमाणुओं के साथ अधिक यौगिक। उपर्युक्त सुविधा के अलावा, यौगिक में आयन बांड की उपस्थिति यह कहा जा सकता है कि अगर इसकी संरचनात्मक इकाई की संरचना में अमोनियम केशन (एनएच 4 +) या इसके कार्बनिक एनालॉग हैं - अल्किलैमोनियम केशन आरएनएच 3 +, डायलकिलेमोनिया आर 2 एनएच 2 + , ट्रायलामोनियम आर 3 एनएच + और टेट्राक्लैमोनियम आर 4 एन +, जहां आर कुछ हाइड्रोकार्बन कट्टरपंथी है। उदाहरण के लिए, आयन प्रकार का संचार cation (ch 3) 4 + और सीएल क्लोराइड-आयन के बीच यौगिक (सी 3) 4 एनसीएल में होता है। इस कार्य में संकेतित यौगिकों में अमोनियम क्लोराइड है, इसमें एनएच 4 + और सीएल क्लोराइड-आयन के अमोनियम कैशन के बीच एक आयनिक कनेक्शन लागू किया गया है। कार्य संख्या 5। पदार्थ और वर्ग / समूह के सूत्र के बीच पत्राचार सेट करें जिसमें यह पदार्थ संबंधित है: पत्र द्वारा इंगित प्रत्येक स्थिति में, संख्या द्वारा इंगित, दूसरे कॉलम से उपयुक्त स्थिति का चयन करें। प्रतिक्रिया फ़ील्ड में चयनित कनेक्शन की संख्या रिकॉर्ड करें। उत्तर: ए -4; बी -1; 3 में स्पष्टीकरण: चतुर नमकीन धातु के परिवेश, अमोनियम केशन या अल्काल्मोनियम पर हाइड्रोजन परमाणुओं को स्थानांतरित करने के अपूर्ण प्रतिस्थापन के परिणामस्वरूप लवण कहा जाता है। अकार्बनिक एसिड में जो स्कूल कार्यक्रम के ढांचे के भीतर गुजरता है, सभी हाइड्रोजन परमाणु जंगम होते हैं, यानी, वे धातु के साथ प्रतिस्थापित कर सकते हैं। प्रस्तुत सूची के बीच अम्लीय अकार्बनिक लवण के उदाहरण अमोनियम बाइकार्बोनेट एनएच 4 एचसीओ 3 - कोयले एसिड प्रति अमोनियम केशन में दो हाइड्रोजन परमाणुओं में से एक के प्रतिस्थापन का उत्पाद है। संक्षेप में, एसिड नमक सामान्य (मध्यम) नमक और एसिड के बीच कुछ हद तक होता है। एनएच 4 एचसीओ 3 के मामले में, सामान्य नमक (एनएच 4) 2 सीओ 3 और कार्बनिक एसिड एच 2 सीओ 3 के बीच औसत। में कार्बनिक पदार्थधातु परमाणुओं पर आह कार्बोक्साइल समूहों (-COOH) या फेनोल्स (एआर-ओएच) के हाइड्रोक्साइल समूहों में शामिल केवल हाइड्रोजन परमाणुओं को प्रतिस्थापित करने में सक्षम हैं। उदाहरण के लिए, सोडियम एसीटेट सी 3 कोना, इस तथ्य के बावजूद कि इसके अणु में, धातु के cations पर सभी हाइड्रोजन परमाणुओं को प्रतिस्थापित नहीं किया जाता है, एक औसत है, एक अम्लीय नमक (!) नहीं। कार्बन परमाणु से जुड़े कार्बनिक पदार्थों में हाइड्रोजन परमाणु लगभग संचार के ट्रिपल एसएसीसी के साथ हाइड्रोजन परमाणुओं के अपवाद के साथ धातु परमाणुओं के लिए प्रतिस्थापन करने में सक्षम नहीं होते हैं। ऑक्साइड काटना - गैर-धातु ऑक्साइड जो मुख्य ऑक्साइड या नमक के आधार के साथ नहीं बनते हैं, यानी, या तो उनके साथ प्रतिक्रिया नहीं दे रहा है (अक्सर) या उनके साथ प्रतिक्रिया में एक अलग उत्पाद (नमक नहीं)। अक्सर यह कहा जाता है कि गैर-बनाने वाले ऑक्साइड गैर-मेटालोल ऑक्साइड हैं जो आधारों और मुख्य ऑक्साइड के साथ प्रतिक्रिया नहीं कर रहे हैं। फिर भी, यह हमेशा गैर-बनाने वाले ऑक्साइड की पहचान करने के लिए काम नहीं करता है। उदाहरण के लिए, सह, एक गैर-निर्मित ऑक्साइड होने के नाते, लौह (द्वितीय) के मुख्य ऑक्साइड के साथ प्रतिक्रिया करता है, लेकिन गैर नमक, और मुक्त धातु के गठन के साथ: CO + FEO \u003d CO 2 + FE स्कूल की दर से असामान्य ऑक्साइड में ऑक्सीकरण +1 और +2 की डिग्री में गैर-धातु ऑक्साइड शामिल हैं। कुल मिलाकर, वे परीक्षा 4 में पाए जाते हैं - यह सह, नहीं, एन 2 ओ और सिओ (आखिरी साओ व्यक्तिगत रूप से मैंने कभी भी कार्यों में नहीं मिले)। कार्य संख्या 6। पदार्थों की प्रस्तावित सूची से, दो पदार्थों का चयन करें, जिनमें से प्रत्येक लोहे को हीटिंग के बिना प्रतिक्रिया करता है। उत्तर: 2; चार जस्ता क्लोराइड नमक से संबंधित है, और धातुओं को लोहा। धातु नमक के साथ प्रतिक्रिया करता है यदि नमक की संरचना की तुलना में यह अधिक सक्रिय होता है। धातुओं की सापेक्ष गतिविधि कई धातु गतिविधि (अलग-अलग, धातु वोल्टेज की एक पंक्ति) के लिए निर्धारित की जाती है। धातु गतिविधि की एक पंक्ति में लौह जस्ता का अधिकार है, इसका मतलब है कि यह सक्रिय रूप से कम है और नमक से जिंक को विस्थापित नहीं कर सकता है। यही है, पदार्थ संख्या 1 के साथ लोहे की प्रतिक्रिया नहीं जाती है। कोवो 4 सल्फेट (ii) क्यूसो 4 लोहे के साथ प्रतिक्रिया करेगा, क्योंकि लोहे की गतिविधि की एक पंक्ति में तांबे का बायां है, यानी, एक अधिक सक्रिय धातु है। केंद्रित नाइट्रोजन, साथ ही साथ केंद्रित सल्फ्यूरिक एसिड इस तरह की घटना को देखते हुए लोहे, एल्यूमीनियम और क्रोमियम के साथ प्रतिक्रिया करने में सक्षम नहीं हैं क्योंकि निष्क्रियता के रूप में इन धातुओं की सतह पर इन एसिड की कार्रवाई के तहत नमक को गर्म किए बिना अघुलनशील बनाया गया है, जो कार्य करता है एक सुरक्षात्मक खोल के रूप में। हालांकि, गर्म होने पर, यह सुरक्षात्मक खोल घुलता है और प्रतिक्रिया संभव हो जाती है। वे। चूंकि यह संकेत दिया जाता है कि हीटिंग नहीं है, कॉन्स के साथ लोहे की प्रतिक्रिया। HNO 3 आगे नहीं बढ़ता है। एकाग्रता से आजादी में सैलोनिक एसिड गैर-ऑक्सीडेंट एसिड को संदर्भित करता है। हाइड्रोजन रिलीज के साथ गैर-ऑक्सीडेंट एसिड के साथ, धातु हाइड्रोजन के बाईं ओर की गतिविधि की एक पंक्ति में प्रतिक्रिया करते हैं। यह धातु सिर्फ सच है। निष्कर्ष: हाइड्रोक्लोरिक एसिड प्रवाह के साथ लौह प्रतिक्रिया। धातु और धातु ऑक्साइड के मामले में, प्रतिक्रिया, नमक के मामले में, यह संभव है कि मुक्त धातु ऑक्साइड की संरचना में अधिक सक्रिय है। Fe, कई धातु गतिविधि के अनुसार, अल की तुलना में कम सक्रिय। इसका मतलब है कि अल 2 ओ 3 के साथ FE प्रतिक्रिया नहीं करता है। कार्य संख्या 7। प्रस्तावित सूची से, दो ऑक्साइड का चयन करें, जो हाइड्रोक्लोरिक एसिड के समाधान के साथ प्रतिक्रिया करता है, लेकिन प्रतिक्रिया मत करो
सोडियम हाइड्रोक्साइड समाधान के साथ। चयनित पदार्थों के प्रतिक्रिया क्षेत्र में लिखें। उत्तर: 3; चार सह - एक हानिकारक ऑक्साइड, क्षार के एक जलीय घोल के साथ प्रतिक्रिया नहीं करता है। (इसे याद किया जाना चाहिए कि, फिर भी, कठोर परिस्थितियों में - उच्च दबाव और तापमान - यह सब एक ठोस क्षार के साथ प्रतिक्रिया करता है, फॉर्मेट बनाने - फॉर्मिक एसिड के लवण।) तो 3 - सल्फर ऑक्साइड (vi) एक अम्लीय ऑक्साइड है जिसके लिए सल्फ्यूरिक एसिड मेल खाता है। एसिड ऑक्साइड एसिड और अन्य अम्लीय ऑक्साइड के साथ प्रतिक्रिया नहीं करते हैं। यही है, इसलिए 3 हाइड्रोक्लोरिक एसिड के साथ प्रतिक्रिया नहीं करता है और बेस - सोडियम हाइड्रॉक्साइड के साथ प्रतिक्रिया करता है। उपयुक्त नहीं। क्यूओ - कॉपर ऑक्साइड (ii) - मुख्य रूप से मुख्य गुणों के साथ ऑक्साइड से संबंधित है। एचसीएल के साथ प्रतिक्रिया करता है और सोडियम हाइड्रोक्साइड समाधान के साथ प्रतिक्रिया नहीं करता है। उपयुक्त एमजीओ - मैग्नीशियम ऑक्साइड - सामान्य मुख्य ऑक्साइड का संदर्भ लें। एचसीएल के साथ प्रतिक्रिया करता है और सोडियम हाइड्रोक्साइड समाधान के साथ प्रतिक्रिया नहीं करता है। उपयुक्त जेएनओ - सर्वनाम एम्फोटेरिक गुणों के साथ ऑक्साइड - आसानी से मजबूत आधार और एसिड (साथ ही अम्लीय और मुख्य ऑक्साइड) दोनों के साथ प्रतिक्रिया करता है। उपयुक्त नहीं। कार्य संख्या 8। उत्तर - 4; 2। अकार्बनिक एसिड के दो नमक के बीच प्रतिक्रिया के साथ, गैस केवल तभी गठित होती है जब तापीय अस्थिर अमोनियम नाइट्राइट के गठन के कारण नाइट्राइट और अमोनियम नमक के गर्म समाधान मिश्रण। उदाहरण के लिए, एनएच 4 सीएल + नो 2 \u003d टी ओ \u003d\u003e एन 2 + 2 एच 2 ओ + केसीएल हालांकि, सूची में नाइट्राइट और अमोनियम लवण नहीं हैं। तो, तीन नमकों में से एक (सीयू (संख्या 3) 2, के 2 एसओ 3 और ना 2 sio 3) एसिड (एचसीएल) या क्षार (NAOH) के साथ प्रतिक्रिया करता है। अकार्बनिक एसिड के लवण के बीच, क्षारियों के साथ बातचीत करते समय केवल अमोनियम नमक गैस द्वारा प्रतिष्ठित होते हैं: एनएच 4 + + ओह \u003d एनएच 3 + एच 2 ओ अमोनियम लवण, जैसा कि हमने पहले ही कहा है, सूची में नहीं। एसिड अवशेष के साथ नमक की बातचीत का केवल एक संस्करण। इन पदार्थों के बीच लवण में सीयू (संख्या 3) 2, के 2 एसओ 3 और ना 2 सायो 3 शामिल हैं। हाइड्रोक्लोरिक एसिड के साथ तांबा नाइट्रेट की प्रतिक्रिया आगे नहीं बढ़ती है, क्योंकि न तो गैस या तलछट, न ही कम सब्सिडीकरण एजेंट (पानी या कमजोर एसिड) का निर्माण नहीं किया गया है। सोलिकैट सोडियम हाइड्रोक्लोरिक एसिड के साथ प्रतिक्रिया करता है, हालांकि, सफेद सेंटीने वाले सिलिकिक एसिड तलछट की रिहाई के कारण, गैस नहीं: ना 2 SIO 3 + 2HCL \u003d 2NACL + H 2 SIO 3 ↓ अंतिम संस्करण बनी हुई है - पोटेशियम सल्फाइट और हाइड्रोक्लोरिक एसिड की बातचीत। दरअसल, सल्फाइट और लगभग किसी भी एसिड के बीच आयन एक्सचेंज की प्रतिक्रिया के परिणामस्वरूप, अस्थिर सल्फ्यूरिक एसिड बनता है, जो तुरंत एक रंगहीन गैस ऑक्साइड (iv) और पानी पर विघटित होता है। कार्य संख्या 9। उपयुक्त अक्षरों के तहत चयनित पदार्थों की तालिका संख्या में रिकॉर्ड करें। उत्तर: 2; पांच सीओ 2 एसिड ऑक्साइड को संदर्भित करता है और इसे नमक में बदलने के लिए, मुख्य ऑक्साइड या आधार को प्रभावित करना आवश्यक है। वे। सीओ 2 पोटेशियम कार्बोनेट से प्राप्त करने के लिए, या तो पोटेशियम ऑक्साइड या पोटेशियम हाइड्रॉक्साइड को प्रभावित करना आवश्यक है। इस प्रकार, पदार्थ एक्स पोटेशियम ऑक्साइड है: के 2 ओ + सीओ 2 \u003d के 2 सीओ 3 पोटेशियम बाइकार्बोनेट केएचसीओ 3, साथ ही पोटेशियम कार्बोनेट, कोलिक एसिड का नमक है, केवल अंतर के साथ कि हाइड्रोकार्बोनेट कोयलाइक एसिड में हाइड्रोजन परमाणुओं के अपूर्ण प्रतिस्थापन का उत्पाद है। खट्टा नमक के साथ सामान्य (मध्यम) नमक से प्राप्त करने के लिए, आपको या तो इस नमक द्वारा गठित एक ही एसिड के साथ कार्य करने की आवश्यकता है, या उपस्थिति में किसी दिए गए एसिड के अनुरूप एक अम्लीय ऑक्साइड के रूप में कार्य करने की आवश्यकता है पानी डा। इस प्रकार, वाई अभिकर्मक कार्बन डाइऑक्साइड है। जब यह एक जलीय पोटेशियम कार्बोनेट समाधान के माध्यम से गुजरता है, तो बाद वाला पोटेशियम बाइकार्बोनेट में जाता है: के 2 सीओ 3 + एच 2 ओ + सीओ 2 \u003d 2khco 3 कार्य संख्या 10। प्रतिक्रिया समीकरण और नाइट्रोजन तत्व की संपत्ति के बीच पत्राचार स्थापित करें, जो इस प्रतिक्रिया में मौजूद है: पत्र द्वारा इंगित प्रत्येक स्थिति में, संख्या द्वारा इंगित संबंधित स्थिति का चयन करें। उपयुक्त अक्षरों के तहत चयनित पदार्थों की तालिका संख्या में रिकॉर्ड करें। उत्तर: ए -4; बी -2; दो पर; श्री ग। ए) एनएच 4 एचसीओ 3 - नमक, जिसमें एक अमोनियम केशन एनएच 4 + शामिल है। अमोनियम केशन में, नाइट्रोजन में हमेशा -3 के बराबर ऑक्सीकरण की डिग्री होती है। प्रतिक्रिया के परिणामस्वरूप, यह अमोनिया एनएच 3 में बदल जाता है। हाइड्रोजन लगभग हमेशा (धातुओं के साथ अपने यौगिकों को छोड़कर) +1 के बराबर ऑक्सीकरण की डिग्री है। इसलिए, ताकि अमोनिया अणु एक इलेक्ट्रॉनिक है, नाइट्रोजन में -3 \u200b\u200bके बराबर ऑक्सीकरण की डिग्री होनी चाहिए। इस प्रकार, नाइट्रोजन ऑक्सीकरण की डिग्री में परिवर्तन नहीं होते हैं, यानी यह रेडॉक्स गुण नहीं दिखाता है। बी) जैसा कि ऊपर दिखाए गए हैं, अमोनिया एनएच 3 में नाइट्रोजन में ऑक्सीकरण -3 की डिग्री है। क्यूओ के साथ प्रतिक्रिया के परिणामस्वरूप, अमोनिया एक साधारण पदार्थ एन 2 में बदल जाता है। किसी भी साधारण पदार्थ में, तत्व के ऑक्सीकरण की डिग्री जो इसे बनती है वह शून्य है। इस प्रकार, नाइट्रोजन परमाणु अपने नकारात्मक शुल्क को खो देता है, और चूंकि इलेक्ट्रॉनों को नकारात्मक चार्ज के अनुरूप होता है, जिसका अर्थ है प्रतिक्रिया के परिणामस्वरूप नाइट्रोजन परमाणु का नुकसान। एक तत्व जो प्रतिक्रिया के परिणामस्वरूप अपने इलेक्ट्रॉनों के हिस्से को खो देता है उसे एक कम करने वाला एजेंट कहा जाता है। सी) नाइट्रोजन के ऑक्सीकरण की डिग्री के साथ एनएच 3 प्रतिक्रिया के परिणामस्वरूप, 3 के बराबर, नाइट्रोजन ऑक्साइड संख्या में बदल जाता है। ऑक्सीजन लगभग हमेशा -2 के बराबर ऑक्सीकरण की डिग्री होती है। इसलिए, नाइट्रोजन ऑक्साइड के अणु के लिए इलेक्ट्रॉनिक रूप से होने के लिए, नाइट्रोजन परमाणु में ऑक्सीकरण +2 की डिग्री होनी चाहिए। इसका मतलब है कि प्रतिक्रिया के परिणामस्वरूप नाइट्रोजन परमाणु ने अपनी डिग्री -3 से +2 तक ऑक्सीकरण की डिग्री बदल दी है। यह 5 इलेक्ट्रॉनों के नाइट्रोजन परमाणु के नुकसान को इंगित करता है। यही है, नाइट्रोजन, जैसा कि होता है, बी, एक कम करने वाला एजेंट है। डी) एन 2 एक साधारण पदार्थ है। सभी सरल पदार्थों में, एक तत्व जो उन्हें बनाता है, उसके पास ऑक्सीकरण की डिग्री 0 के बराबर होती है, नाइट्रोजन की प्रतिक्रिया के परिणामस्वरूप, ली 3 एन लिथियम नाइट्राइड को परिवर्तित किया जाता है। क्षार धातु ऑक्सीकरण की एकमात्र डिग्री, शून्य के अलावा (0 के ऑक्सीकरण की डिग्री किसी भी तत्व से है), +1 के बराबर। इस तरह से कि संरचनात्मक इकाई ली 3 एन इलेक्ट्रॉनिक थी, नाइट्रोजन में -3 \u200b\u200bके बराबर ऑक्सीकरण की डिग्री होनी चाहिए। यह पता चला है कि प्रतिक्रिया के परिणामस्वरूप, नाइट्रोजन ने नकारात्मक चार्ज हासिल किया, जिसका अर्थ है इलेक्ट्रॉनों के अतिरिक्त। इस ऑक्सीडाइज़र प्रतिक्रिया में नाइट्रोजन। कार्य संख्या 11। पदार्थ और अभिकर्मकों के सूत्र के बीच पत्राचार स्थापित करें, जिनमें से प्रत्येक इस पदार्थ से बातचीत कर सकते हैं: पत्र द्वारा इंगित प्रत्येक स्थिति में, संख्या से संकेतित संबंधित स्थिति का चयन करें। डी) जेएनबीआर 2 (आर-पी) 1) एग्नो 3, ना 3 पीओ 4, सीएल 2 2) बाओ, एच 2 ओ, कोह 3) एच 2, सीएल 2, ओ 2 4) एचबीआर, लियोह, सी 3 कोह 5) एच 3 पीओ 4, बीएसीएल 2, क्यूओ उपयुक्त अक्षरों के तहत चयनित पदार्थों की तालिका संख्या में रिकॉर्ड करें। उत्तर: ए -3; बी -2; 4 पर; श्री ग। ए) जब गैसीय हाइड्रोजन सल्फर पिघल के माध्यम से पारित किया जाता है, तो हाइड्रोजन सल्फाइड एच 2 एस बनता है: एच 2 + एस \u003d टी ओ \u003d\u003e एच 2 एस जब क्लोरीन जमीन के ऊपर पारित किया जाता है, तो सल्फर डिक्लोराइड कमरे के तापमान पर गठित होता है: एस + सीएल 2 \u003d एससीएल 2 के लिये अरचेस ईगे यह जानने के लिए कि क्लोरीन के साथ सल्फर कैसे प्रतिक्रिया करता है और तदनुसार, इस समीकरण को रिकॉर्ड करने में सक्षम होना आवश्यक नहीं है। मुख्य बात मुख्य रूप से याद रखने के लिए है कि क्लोरीन प्रतिक्रिया के साथ सल्फर प्रतिक्रिया करता है। क्लोरीन एक मजबूत ऑक्सीडाइज़र है, सल्फर अक्सर एक दोहरी कार्य दिखाता है - ऑक्सीडेटिव और पुनर्स्थापनात्मक दोनों। यही है, अगर एक मजबूत ऑक्सीकरण एजेंट सल्फर पर है, जो आणविक क्लोरीन सीएल 2 है, यह ऑक्सीकरण करेगा। सल्फर एक तेज गंध के साथ एक गैस बनाने के लिए ऑक्सीजन में एक नीली लौ के साथ जलता है - सल्फर डाइऑक्साइड सो 2: बी) तो 3 - सल्फर ऑक्साइड (छठी) ने अम्लीय गुणों का उच्चारण किया है। ऐसे ऑक्साइड के लिए, पानी के साथ बातचीत की प्रतिक्रियाएं, साथ ही मूल और उभयचरित ऑक्साइड और हाइड्रोक्साइड के साथ सबसे अधिक विशेषता है। सूची संख्या 2 में, हम सिर्फ दृश्यमान और पानी, मुख्य बाओ ऑक्साइड, और कोह हाइड्रॉक्साइड हैं। मुख्य ऑक्साइड के साथ एसिड ऑक्साइड की बातचीत में, उपयुक्त एसिड और धातु का नमक बनता है, जो मुख्य ऑक्साइड का हिस्सा है। एसिड ऑक्साइड एसिड से मेल खाता है, जिसमें एसिड-फॉर्मिंग तत्व में ऑक्सीकरण की एक ही डिग्री ऑक्सीकरण में होता है। तो 3 ऑक्साइड सल्फ्यूरिक एसिड एच 2 के अनुरूप है 4 (और वहां, और +6 की सल्फर ऑक्सीकरण डिग्री है)। इस प्रकार, धातु ऑक्साइड के साथ 3 की बातचीत सल्फ्यूरिक एसिड के लवण द्वारा प्राप्त की जाएगी - सल्फेट आयन युक्त सल्फेट्स सोम 2-: तो 3 + बाओ \u003d बसो 4 पानी के साथ बातचीत करते समय, अम्लीय ऑक्साइड एक उपयुक्त एसिड में बदल जाता है: तो 3 + एच 2 ओ \u003d एच 2 सो 4 और धातु हाइड्रॉक्साइड्स के साथ अम्लीय ऑक्साइड की बातचीत में, नमक उपयुक्त एसिड और पानी बनता है: तो 3 + 2koh \u003d k 2 तो 4 + H 2 o सी) जिंक हाइड्रोक्साइड जेडएन (ओएच) 2 में विशिष्ट एम्फोटेरिक गुण होते हैं, जो अम्लीय ऑक्साइड और एसिड और मूल ऑक्साइड और क्षारीय दोनों पर प्रतिक्रिया करते हैं। सूची 4 में, हम एसिड के रूप में देखते हैं - ब्रोमोमोमेनेटेड एचबीआर और एसिटिक और क्षार - लियोह। याद रखें कि क्षारीय को पानी में पानी के हाइड्रोक्साइड घुलनशील कहा जाता है: जेएन (ओएच) 2 + 2 एचबीआर \u003d जेएनबीआर 2 + 2 एच 2 ओ जेडएन (ओएच) 2 + 2CH 3 COOH \u003d ZN (CH 3 COO) 2 + 2H 2 O Zn (ओह) 2 + 2Lioh \u003d LI 2 डी) जिंक ब्रोमाइड जेएनबीआर 2 एक नमक, पानी में घुलनशील है। घुलनशील नमक के लिए, आयन एक्सचेंज प्रतिक्रियाएं सबसे आम हैं। नमक एक और नमक के साथ प्रतिक्रिया कर सकता है, बशर्ते कि दोनों स्रोत लवण घुलनशील हैं और एक प्रक्षेपण बनता है। इसके अलावा, जेएनबीआर 2 में ब्रोमाइड आयन बीआर- शामिल हैं। धातुओं के लिए हॉलिड्स के लिए, यह विशेषता है कि वे एचएएल 2 हलोजन के साथ प्रतिक्रिया करने में सक्षम हैं, जो मेंडेलीव टेबल में अधिक हैं। इस तरह? वर्णित प्रकार की प्रतिक्रियाएं सूची 1 के सभी पदार्थों के साथ आगे बढ़ती हैं: Znbr 2 + 2agno 3 \u003d 2gbr + zn (संख्या 3) 2 3ZNBR 2 + 2NA 3 PO 4 \u003d ZN 3 (PO 4) 2 + 6nabr जेएनबीआर 2 + सीएल 2 \u003d जेएनसीएल 2 + बीआर 2 कार्य संख्या 12। पदार्थ और उस वर्ग / समूह के नाम के बीच पत्राचार सेट करें जिसमें यह पदार्थ संबंधित है: पत्र द्वारा इंगित प्रत्येक स्थिति में, संख्या द्वारा इंगित उचित स्थिति का चयन करें। उपयुक्त अक्षरों के तहत चयनित पदार्थों की तालिका संख्या में रिकॉर्ड करें। उत्तर: ए -4; बी -2; 1 में स्पष्टीकरण: ए) मिथाइल बेंजीन टोल्यून है, एक संरचनात्मक सूत्र है: जैसा कि देखा जा सकता है, इस पदार्थ के अणुओं में केवल कार्बन और हाइड्रोजन होता है, इसलिए मेथिलबेन्ज़ेन (टोल्यूनि) हाइड्रोकार्बन को संदर्भित करता है बी) अनिलिन (एमिनोबेनज़ेन) का संरचनात्मक सूत्र निम्नानुसार है: जैसा कि एनीलाइन अणु के संरचनात्मक सूत्र से देखा जा सकता है, एक सुगंधित हाइड्रोकार्बन कट्टरपंथी (सी 6 एच 5 -) और एक एमिनो समूह (-एनएच 2), इस प्रकार, अनिलिन सुगंधित अमाइन को संदर्भित करता है, यानी सही जवाब 2 है। सी) 3-मेथिलबूटनल। अल का अंत "बताता है कि पदार्थ Aldehydam को संदर्भित करता है। इस पदार्थ का संरचनात्मक सूत्र: कार्य संख्या 13। प्रस्तावित सूची से, दो पदार्थों का चयन करें जो बुथेन -1 के संरचनात्मक आइसोमर हैं। चयनित पदार्थों के प्रतिक्रिया क्षेत्र में लिखें। उत्तर: 2; पांच स्पष्टीकरण: आइसोमर एक ही आणविक सूत्र और विभिन्न संरचनात्मक हैं, आई.ई. पदार्थ जो परमाणुओं के परिसर के क्रम में भिन्न होते हैं, लेकिन अणुओं की एक ही संरचना के साथ। कार्य संख्या 14। प्रस्तावित सूची से, दो पदार्थों का चयन करें, जिसमें पोटेशियम परमैंगनेट के समाधान के साथ, समाधान के रंग में बदलाव देखा जाएगा। चयनित पदार्थों के प्रतिक्रिया क्षेत्र में लिखें। उत्तर: 3; पांच स्पष्टीकरण: एल्कन्स, साथ ही साथ 5 वें या अधिक कार्बन परमाणुओं के साथ साइक्लॉकनस बहुत ही निष्क्रिय हैं और यहां तक \u200b\u200bकि मजबूत ऑक्सीकरण एजेंटों के जलीय समाधानों के साथ प्रतिक्रिया नहीं करते हैं, उदाहरण के लिए, पोटेशियम परमैंगनेट केएमएनओ 4 और पोटेशियम डिक्रोमैट के 2 सीआर 2 ओ 7 । इस प्रकार, वेरिएंट 1 और 4 गायब हो जाते हैं - पोटेशियम परमैंगनेट के जलीय घोल के लिए साइक्लोहेक्सेन या प्रोपेन के अतिरिक्त, रंग परिवर्तन नहीं होगा। बेंजीन की homologous श्रृंखला के हाइड्रोकार्बन में ऑक्सीकरण एजेंटों के जलीय समाधान की क्रिया के लिए निष्क्रिय है, केवल बेंजीन, अन्य सभी homologs माध्यम या कार्बोक्साइलिक एसिड, या संबंधित लवण के आधार पर ऑक्सीकरण किया जाता है। इस प्रकार विकल्प 2 (बेंजीन) गायब हो जाता है। सही उत्तर - 3 (टोल्यून) और 5 (प्रोपेलीन)। दोनों पदार्थ प्रतिक्रियाओं के प्रवाह के कारण पोटेशियम परमैंगनेट के बैंगनी समाधान को विकृत करते हैं: Ch 3 -ch \u003d ch 2 + 2kmno 4 + 2h 2 o → ch 3 -ch (ओह) -ch 2 ओह + 2mno 2 + 2koh कार्य संख्या 15। प्रस्तावित सूची से, दो पदार्थों का चयन करें जिनमें फॉर्मल्डेहाइड प्रतिक्रियाएं हैं। चयनित पदार्थों के प्रतिक्रिया क्षेत्र में लिखें। उत्तर: 3; चार स्पष्टीकरण: Formaldehyde Aldehydes के वर्ग को संदर्भित करता है - ऑक्सीजन युक्त कार्बनिक यौगिकों में अणु के अंत में एक Aldehyde समूह है: विशिष्ट Aldehyde प्रतिक्रियाएं कार्यात्मक समूह के माध्यम से बहने वाले ऑक्सीकरण और वसूली प्रतिक्रियाएं हैं। फॉर्मल्डेहाइड के लिए प्रतिक्रियाओं की सूची में वसूली प्रतिक्रिया होती है, जहां हाइड्रोजन को एक कम करने वाले एजेंट (बिल्ली - पीटी, पीडी, एनआई), और ऑक्सीकरण के रूप में उपयोग किया जाता है - इस मामले में, चांदी दर्पण प्रतिक्रिया। एक निकल उत्प्रेरक पर हाइड्रोजन को बहाल करते समय, फॉर्मल्डेहाइड मेथनॉल में बदल जाता है: रजत दर्पण की प्रतिक्रिया एक चांदी की वसूली प्रतिक्रिया है अमोनिया सोल्यूशंस रजत ऑक्साइड। जब अमोनिया को जलीय घोल में भंग कर दिया जाता है, तो सिल्वर ऑक्साइड को एक जटिल परिसर में परिवर्तित किया जाता है - डायमोनमिनेब्रा हाइड्रोक्साइड (i) ओह। फॉर्मल्डेहाइड जोड़ने के बाद, एक रेडॉक्स प्रतिक्रिया प्रवाह जिसमें चांदी को बहाल किया जाता है: कार्य संख्या 16। प्रस्तावित सूची से, दो पदार्थों का चयन करें जिनके साथ मेथिलामाइन प्रतिक्रिया करता है। चयनित पदार्थों के प्रतिक्रिया क्षेत्र में लिखें। उत्तर: 2; पांच स्पष्टीकरण: मेथ्यलाइन कक्षा अमाइन के कार्बनिक यौगिकों को सबसे आसान है। अमीन्स की एक विशेषता विशेषता नाइट्रोजन परमाणु पर एक औसत-मुक्त इलेक्ट्रॉनिक जोड़ी की उपस्थिति है, नतीजतन, अमाइन आधार के गुणों और प्रतिक्रियाओं में न्यूक्लिफाइल्स के रूप में कार्य करते हैं। इस प्रकार, इसके संबंध में, आधार और न्यूक्लियोफिल के रूप में मेथिलामाइन उत्तर के प्रस्तावित विकल्पों से क्लोरोमेथेन और हाइड्रोक्लोरिक एसिड के साथ प्रतिक्रिया करता है। सी 3 एनएच 2 + सी 3 सीएल → (सीएच 3) 2 एनएच 2 + सीएल - सी 3 एनएच 2 + एचसीएल → सी 3 एनएच 3 + सीएल - कार्य संख्या 17। पदार्थों के परिवर्तन की निम्नलिखित योजना दी गई है: यह निर्धारित करें कि इनमें से कौन सा पदार्थ पदार्थ एक्स और वाई हैं। उपयुक्त अक्षरों के तहत चयनित पदार्थों की तालिका संख्या में रिकॉर्ड करें। उत्तर - 4; 2। स्पष्टीकरण: अल्कोहल प्राप्त करने की प्रतिक्रियाओं में से एक हाइड्रोलिसिस हलोजन गलियों की प्रतिक्रिया है। इस प्रकार, एक जलीय क्षार समाधान के साथ बाद में प्रवेश करके क्लोरोएतन से इथेनॉल प्राप्त करना संभव है - इस मामले में NaOH। सीएच 3 सीएच 2 सीएल + नाओह (वोडन।) → सी 3 सीएच 2 ओएच + एनएसीएल अगली प्रतिक्रिया एथिल अल्कोहल ऑक्सीकरण की प्रतिक्रिया है। शराब का ऑक्सीकरण तांबा उत्प्रेरक पर या cuo का उपयोग कर किया जाता है: कार्य संख्या 18। पदार्थ और उत्पाद के नाम के बीच पत्राचार सेट करें, जो ज्यादातर ब्रोमाइन के साथ इस पदार्थ की बातचीत से गठित किया जाता है: पत्र द्वारा इंगित प्रत्येक स्थिति में, संख्या द्वारा इंगित उचित स्थिति का चयन करें। उत्तर: 5; 2; 3; 6। स्पष्टीकरण: एल्कानों के लिए, सबसे विशिष्ट प्रतिक्रियाएं मुक्त कट्टरपंथी प्रतिस्थापन की प्रतिक्रियाएं होती हैं, जिसके दौरान हाइड्रोजन परमाणु को एक हलोजन परमाणु द्वारा प्रतिस्थापित किया जाता है। इस प्रकार, ब्रोमिन इथेन ब्रोमेतन द्वारा प्राप्त किया जा सकता है, और ब्रोमाइन इसोबूटेन - 2-ब्रोमिसोबूटेन: चूंकि साइक्लोप्रोपेन और साइक्लोबुटेन अणुओं के छोटे चक्र अस्थिर हैं, जब इन अणुओं के चक्र ब्रोमिनेशन का खुलासा किया जाता है, तो इस प्रकार, कनेक्शन प्रतिक्रिया आगे बढ़ती है: विभिन्न आकारों के साइक्लोप्रोपेन चक्र और साइक्लोबुटन साइक्लोहेक्सेन चक्र के विपरीत, जिसके परिणामस्वरूप हाइड्रोजन परमाणु को ब्रोमाइन परमाणु द्वारा प्रतिस्थापित किया जाता है: कार्य №19। प्रतिक्रियाशील पदार्थों और कार्बन युक्त उत्पाद के बीच पत्राचार सेट करें, जो इन पदार्थों की बातचीत के दौरान बनाई गई है: पत्र द्वारा इंगित प्रत्येक स्थिति में, संख्या द्वारा इंगित उचित स्थिति का चयन करें। उपयुक्त अक्षरों के तहत चयनित संख्या तालिका में लिखें। उत्तर: 5; चार; 6; 2। कार्य संख्या 20। प्रतिक्रिया प्रकारों की प्रस्तावित सूची से, दो प्रकार की प्रतिक्रियाओं का चयन करें जिसके लिए पानी के साथ क्षार धातु की बातचीत को जिम्मेदार ठहराया जा सकता है। चयनित प्रतिक्रिया प्रकारों के प्रतिक्रिया फ़ील्ड में लिखें। उत्तर: 3; चार क्षार धातुओं (ली, ना, के, आरबी, सीएस, एफआर) मेज डी। के समूह के मुख्य उपसमूह I में स्थित हैं। Mendeleev और एजेंटों को कम कर रहे हैं, आसानी से बाहरी स्तर पर स्थित एक इलेक्ट्रॉन दे रहे हैं। यदि आप क्षारीय धातु पत्र एम को नामित करते हैं, तो पानी के साथ क्षार धातु की प्रतिक्रिया इस तरह दिखेगी: 2 एम + 2 एच 2 ओ → 2 एमओएच + एच 2 क्षार धातुओं को पानी के संबंध में बहुत सक्रिय हैं। प्रतिक्रिया बड़ी मात्रा में गर्मी की रिहाई के साथ हिंसक रूप से आगे बढ़ती है, अपरिवर्तनीय है और उत्प्रेरक (नॉनकटलिथिक) के उपयोग की आवश्यकता नहीं है - प्रतिक्रिया प्रतिक्रियाओं को तेज करने और प्रतिक्रिया उत्पादों का हिस्सा नहीं है। यह ध्यान दिया जाना चाहिए कि सभी अत्यधिक exothermic प्रतिक्रियाओं को उत्प्रेरक के उपयोग की आवश्यकता नहीं है और अपरिवर्तनीय रूप से आगे बढ़ें। चूंकि धातु और पानी विभिन्न कुल राज्यों में पदार्थ होते हैं, इसलिए यह प्रतिक्रिया चरण विभाजन की सीमा पर आय जाती है, इसलिए, विषम है। इस प्रतिक्रिया का प्रकार - प्रतिस्थापन। अकार्बनिक पदार्थों के बीच की प्रतिक्रिया प्रतिस्थापन की प्रतिक्रियाओं को संदर्भित करती है, यदि एक साधारण पदार्थ परिसर के साथ बातचीत करता है और नतीजतन अन्य सरल और जटिल पदार्थ बनते हैं। (तटस्थ प्रतिक्रिया एसिड और आधार के बीच आगे बढ़ती है, जिसके परिणामस्वरूप इन पदार्थों को उनके अभिन्न अंगों और नमक और थोड़ा सा सदस्यतापूर्ण पदार्थ द्वारा आदान-प्रदान किया जाता है)। जैसा कि ऊपर बताया गया है, क्षार धातुएं एजेंटों को कम कर रही हैं, बाहरी परत से इलेक्ट्रॉन दे रही हैं, इसलिए प्रतिक्रिया रेडॉक्स है। कार्य संख्या 27। बाहरी प्रभावों की प्रस्तावित सूची से, दो प्रभावों का चयन करें जो हाइड्रोजन के साथ ईथिलीन प्रतिक्रिया की दर में कमी का कारण बनते हैं। चयनित बाहरी प्रभावों की संख्या के प्रतिक्रिया क्षेत्र में लिखें। उत्तर 1; चार निम्नलिखित कारक रासायनिक प्रतिक्रिया की दर से प्रभावित होते हैं: तापमान में परिवर्तन और अभिकर्मकों की एकाग्रता, साथ ही साथ उत्प्रेरक का उपयोग। वेंट-गोफ के अनुभवजन्य नियम के अनुसार, प्रत्येक 10 डिग्री के तापमान में वृद्धि के साथ, सजातीय प्रतिक्रिया की दर निरंतर 2-4 गुना बढ़ जाती है। नतीजतन, तापमान में कमी प्रतिक्रिया दर में कमी की ओर ले जाती है। पहला उत्तर उपयुक्त है। जैसा कि ऊपर बताया गया है, प्रतिक्रिया दर का भी अभिकर्मकों की एकाग्रता का प्रभाव और परिवर्तन होता है: यदि आप ईथिलीन की एकाग्रता में वृद्धि करते हैं, तो प्रतिक्रिया दर भी बढ़ जाएगी, जो कार्य की आवश्यकता का अनुपालन नहीं करती है। हाइड्रोजन एकाग्रता में कमी स्रोत घटक है, इसके विपरीत, प्रतिक्रिया दर को कम कर देता है। नतीजतन, दूसरा विकल्प उपयुक्त नहीं है, लेकिन चौथा - उपयुक्त है। उत्प्रेरक एक पदार्थ है जो रासायनिक प्रतिक्रिया की गति को तेज करता है, लेकिन उत्पादों का हिस्सा नहीं है। उत्प्रेरक का उपयोग ईथिलीन हाइड्रोजनीकरण प्रतिक्रिया के प्रवाह को तेज करता है, जो समस्या की स्थिति के अनुरूप नहीं होता है, इसलिए यह सही जवाब नहीं है। जब हाइड्रोजन के साथ ईथिलीन की बातचीत (उत्प्रेरक नी, पीडी, पीटी), एथन का गठन किया जाता है: Ch 2 \u003d ch 2 (g) + h 2 (g) → ch 3 -ch 3 (g) प्रतिक्रिया में शामिल सभी घटक और उत्पाद गैसीय पदार्थ हैं, इसलिए, सिस्टम में दबाव प्रतिक्रिया दर को भी प्रभावित करेगा। ईथिलीन और हाइड्रोजन की दो खंडों में से एक मात्रा का गठन किया जाता है, इसलिए, प्रतिक्रिया प्रणाली में दबाव को कम करने के लिए है। दबाव बढ़ाकर, हम प्रतिक्रिया को तेज करेंगे। पांचवां उत्तर उपयुक्त नहीं है। कार्य №22। इस नमक के जलीय घोल के नमक सूत्र और इलेक्ट्रोलिसिस उत्पादों के बीच पत्राचार स्थापित करें, जो निष्क्रिय इलेक्ट्रोड पर मध्यस्थ थे: प्रत्येक स्थिति के लिए, सोलोई फॉर्मूला इलेक्ट्रोलिसिस उत्पाद उपयुक्त अक्षरों के तहत चयनित संख्या तालिका में लिखें। उत्तर 1; चार; 3; 2। इलेक्ट्रोलिसिस एक रेडॉक्स प्रक्रिया है जो एक समाधान या इलेक्ट्रोलाइट पिघल के माध्यम से प्रत्यक्ष विद्युत प्रवाह के पारित होने के दौरान इलेक्ट्रोड पर होती है। कैथोड में, यह अधिमानतः उन cations की बहाली है जिनके पास सबसे बड़ी ऑक्सीडेटिव गतिविधि है। आयनों जिनमें सबसे बड़ी पुनर्स्थापन क्षमता है, पहले एनोड पर ऑक्सीकरण किया जाता है। जलीय घोल का इलेक्ट्रोलिसिस 1) कैथोड पर जलीय समाधान की इलेक्ट्रोलिसिस प्रक्रिया कैथोड सामग्री पर निर्भर नहीं है, लेकिन तनाव की इलेक्ट्रोकेमिकल पंक्ति में धातु केन की स्थिति पर निर्भर करती है। पंक्ति में cations के लिए LI + - AL 3+ रिकवरी प्रक्रिया: 2 एच 2 ओ + 2 ई → एच 2 + 2 ओएच - (कैथोड एच 2 पर खड़ा है) जेएन 2+ - पीबी 2+ रिकवरी प्रक्रिया: मी एन + + एनई → एमई 0 और 2 एच 2 ओ + 2 ई → एच 2 + 2 ओएच - (कैथोड एच 2 पर और मैं आवंटित करेगा) सीयू 2+ - एयू 3+ रिकवरी प्रक्रिया मुझे n + + ne → एमई 0 (मैं कैथोड पर खड़ा हूं) 2) एनोड पर जलीय समाधान के इलेक्ट्रोलिसिस की प्रक्रिया एनोड सामग्री और आयन की प्रकृति पर निर्भर करती है। यदि एक एनोड अघुलनशील है, तो यानी निष्क्रिय (प्लैटिनम, सोना, कोयला, ग्रेफाइट), फिर प्रक्रिया केवल आयनों की प्रकृति पर निर्भर करेगी। आयनों के लिए एफ -, तो 4 2-, नहीं 3 - पीओ 4 3-, ओह - ऑक्सीकरण प्रक्रिया: 4oh - - 4 ई → ओ 2 + 2 एच 2 ओ या 2 एच 2 ओ - 4 ई → ओ 2 + 4 एच + (ऑक्सीजन एनोड पर जारी किया गया है) हेलिड आयनों (एफ को छोड़कर) 2hal ऑक्सीकरण प्रक्रिया - - 2 ई → एचएएल 2 (नि: शुल्क हेलोगेंस को हाइलाइट किया गया है) कार्बनिक एसिड ऑक्सीकरण प्रक्रिया: 2 आरसीओ - - 2 ई → आर-आर + 2को 2 कुल इलेक्ट्रोलिसिस समीकरण: ए) ना 3 पीओ 4 समाधान 2 एच 2 ओ → 2 एच 2 (कैथोड पर) + ओ 2 (एनोड पर) बी) केसीएल समाधान 2 केसीएल + 2 एच 2 ओ → एच 2 (कैथोड पर) + 2koh + cl 2 (एनोड पर) सी) CUBR2 समाधान CUBR 2 → सीयू (कैथोड पर) + बीआर 2 (एनोड पर) डी) सीयू समाधान (NO3) 2 2cu (संख्या 3) 2 + 2h 2 o → 2cu (कैथोड पर) + 4HNO 3 + O 2 (एनोड पर) कार्य संख्या 23। नमक के नाम और इस नमक के अनुपात के अनुपात के बीच पत्राचार को हाइड्रोलिसिस में सेट करें: पत्र द्वारा इंगित प्रत्येक स्थिति में, संख्या द्वारा इंगित उचित स्थिति का चयन करें। उपयुक्त अक्षरों के तहत चयनित संख्या तालिका में लिखें। उत्तर 1; 3; 2; चार नमक का हाइड्रोलिसिस - पानी के नमक की बातचीत, हाइड्रोजन केशन एच + पानी के अणुओं के अतिरिक्त एसिड अवशेष के आयन और हाइड्रोक्साइल समूह ओह - धातु के आण्विक के लिए जल अणुओं के आयतन के लिए अग्रणी होती है। हाइड्रोलिसिस कमजोर अड्डों के अनुरूप cations द्वारा गठित लवण के अधीन है, और कमजोर एसिड के अनुरूप आयन। ए) अमोनियम क्लोराइड (एनएच 4 सीएल) - मजबूत हाइड्रोक्लोरिक एसिड और अमोनिया (कमजोर आधार) द्वारा गठित नमक, कोण में हाइड्रोलिसिस के अधीन है। एनएच 4 सीएल → एनएच 4 + + सीएल - एनएच 4 + एच 2 ओ → एनएच 3 · एच 2 ओ + एच + (पानी में भंग अमोनिया का गठन) Sycola समाधान माध्यम (पीएच)< 7). बी) पोटेशियम सल्फेट (के 2 एसओ 4) मजबूत सल्फ्यूरिक एसिड और पोटेशियम हाइड्रोक्साइड (क्षार, यानी मजबूत आधार) द्वारा गठित एक नमक है, हाइड्रोलिसिस अधीन नहीं है। के 2 तो 4 → 2k + + तो 4 2- सी) सोडियम कार्बोनेट (एनए 2 सीओ 3) कमजोर कोयला एसिड और सोडियम हाइड्रॉक्साइड (क्षार, यानी मजबूत आधार) द्वारा गठित एक नमक है जो आयन पर हाइड्रोलिसिस के अधीन है। सीओ 3 2- + एच 2 ओ → एचसीओ 3 - + ओह - (कमजोर उपोष्णा बाइकार्बोनेट आयन का गठन) क्षारीय समाधान माध्यम (पीएच\u003e 7)। डी) एल्यूमीनियम सल्फाइड (अल 2 एस 3) - कमजोर हाइड्रोजन सल्फाइड एसिड और एल्यूमीनियम हाइड्रॉक्साइड (कमजोर आधार) द्वारा गठित नमक, एल्यूमीनियम और हाइड्रोजन सल्फाइड हाइड्रोक्साइड बनाने के लिए पूर्ण हाइड्रोलिसिस के संपर्क में आ गया: अल 2 एस 3 + 6 एच 2 ओ → 2AL (ओएच) 3 + 3 एच 2 एस माध्यम तटस्थ (पीएच ~ 7) के करीब है। कार्य संख्या 24। रासायनिक प्रतिक्रिया के समीकरण और प्रणाली में दबाव बढ़ाकर रासायनिक संतुलन विस्थापन की दिशा के बीच पत्राचार स्थापित करें: पत्र द्वारा इंगित प्रत्येक स्थिति में, संख्या से संकेतित संबंधित स्थिति का चयन करें। प्रतिक्रिया समीकरण ए) एन 2 (जी) + 3 एच 2 (जी) ↔ 2 एनएच 3 (जी) B) 2h 2 (g) + o 2 (g) ↔ 2h 2 o (g) सी) एच 2 (जी) + सीएल 2 (जी) ↔ 2 एचसीएल (जी) डी) तो 2 (जी) + सीएल 2 (जी) ↔ तो 2 सीएल 2 (जी) रासायनिक संतुलन विस्थापन की दिशा 1) प्रत्यक्ष प्रतिक्रिया की ओर बदलाव 2) रिवर्स रिएक्शन की ओर बदलाव 3) कोई संतुलन विस्थापन नहीं उपयुक्त अक्षरों के तहत चयनित संख्या तालिका में लिखें। उत्तर: ए -1; बी -1; 3 में; श्री ग। प्रतिक्रिया रासायनिक संतुलन में है, जब प्रत्यक्ष प्रतिक्रिया की दर रिवर्स की गति के बराबर होती है। वांछित दिशा में संतुलन का विस्थापन प्रतिक्रिया की स्थिति को बदलकर हासिल किया जाता है। संतुलन स्थिति का निर्धारण करने वाले कारक: - दबाव: बढ़ी हुई दबाव मात्रा में कमी की ओर बढ़ने वाली प्रतिक्रिया की ओर बढ़ती है (इसके विपरीत, दबाव में कमी वॉल्यूम में वृद्धि की प्रतिक्रिया की ओर संतुलन को प्रदर्शित करती है) - तापमान: तापमान को बढ़ाने से अंतोथर्मिक प्रतिक्रिया की ओर संतुलन बदल जाता है (इसके विपरीत, तापमान में कमी exothermic प्रतिक्रिया की ओर संतुलन बदलती है) - स्रोत पदार्थों और प्रतिक्रिया उत्पादों की एकाग्रता: प्रतिक्रिया सामग्री की एकाग्रता में वृद्धि और प्रतिक्रिया के क्षेत्र से उत्पादों को हटाने से प्रत्यक्ष प्रतिक्रिया (इसके विपरीत, प्रारंभिक सामग्रियों की एकाग्रता में कमी और प्रतिक्रिया उत्पादों में वृद्धि रिवर्स प्रतिक्रिया की ओर बढ़ने में वृद्धि) - उत्प्रेरक संतुलन विस्थापन को प्रभावित नहीं करते हैं, लेकिन केवल इसकी उपलब्धि में तेजी लाता है। ए) पहले मामले में, प्रतिक्रिया वॉल्यूम में कमी के साथ आता है, क्योंकि वी (एन 2) + 3 वी (एच 2)\u003e 2 वी (एनएच 3)। सिस्टम में दबाव को बढ़ाकर, संतुलन प्रत्यक्ष दिशा में (प्रत्यक्ष प्रतिक्रिया की ओर) में, पदार्थों की एक छोटी मात्रा के साथ बदल जाएगा। बी) दूसरे मामले में, प्रतिक्रिया भी मात्रा में कमी के साथ आता है, क्योंकि 2V (एच 2) + वी (ओ 2)\u003e 2 वी (एच 2 ओ)। सिस्टम में दबाव बढ़ाकर, संतुलन प्रत्यक्ष प्रतिक्रिया (उत्पाद की ओर) की ओर भी स्थानांतरित हो जाएगा। सी) तीसरे मामले में, प्रतिक्रिया के दौरान दबाव नहीं बदलता है, क्योंकि वी (एच 2) + वी (सीएल 2) \u003d 2 वी (एचसीएल), इसलिए कोई संतुलन विस्थापन नहीं होता है। डी) चौथे मामले में, प्रतिक्रिया मात्रा में कमी के साथ भी आती है, क्योंकि वी (एसओ 2) + वी (सीएल 2)\u003e वी (तो 2 सीएल 2)। सिस्टम में दबाव बढ़ाकर, शेष राशि उत्पाद (प्रत्यक्ष प्रतिक्रिया) के निर्माण की दिशा में बदल जाएगी। कार्य №25 पदार्थों और अभिकर्मक के सूत्रों के बीच पत्राचार सेट करें, जिसके साथ आप अपने जलीय समाधानों के बीच अंतर कर सकते हैं: पत्र द्वारा इंगित प्रत्येक स्थिति में, संख्या द्वारा इंगित उचित स्थिति का चयन करें। पदार्थों का सूत्र A) hno 3 और h 2 o सी) NACL और BACL 2 डी) एलसीएल 3 और एमजीसीएल 2 उपयुक्त अक्षरों के तहत चयनित संख्या तालिका में लिखें। उत्तर: ए -1; बी -3; 3 में; एम -2। ए) नाइट्रिक एसिड और पानी को नमक - कैल्शियम कार्बोनेट कैको 3 द्वारा प्रतिष्ठित किया जा सकता है। पानी में कैल्शियम कार्बोनेट भंग नहीं होता है, और नाइट्रिक एसिड के साथ बातचीत करते समय, यह एक घुलनशील नमक - कैल्शियम नाइट्रेट सीए (संख्या 3) 2 बनाता है, जबकि प्रतिक्रिया रंगहीन कार्बन डाइऑक्साइड को अलग करने के साथ होती है: कैको 3 + 2 एनओ 3 → सीए (नहीं 3) 2 + सीओ 2 + एच 2 ओ बी) पोटेशियम क्लोराइड केसीएल और क्षार NaOH तांबा सल्फेट (ii) के समाधान द्वारा चुना जा सकता है। केसीएल के साथ तांबा सल्फेट (ii) की बातचीत के साथ, विनिमय प्रतिक्रिया प्रवाह नहीं होती है, समाधान में के +, सीएल - सीयू 2+ और इतने 4 आयनों हैं, जो एक-दूसरे में छोटे से अधीनस्थ पदार्थ नहीं बनाते हैं। नाओह के साथ तांबा (ii) सल्फेट की बातचीत के साथ, एक्सचेंज प्रतिक्रिया बहती है, जिसके परिणामस्वरूप तांबा (ii) हाइड्रॉक्साइड (बेस बेस) प्रक्षेपण में पड़ता है। सी) सोडियम क्लोराइड एनएसीएल और बेरियम बीएसीएल 2 - घुलनशील नमक, जिसे तांबा सल्फेट (ii) के समाधान के साथ भी खुलासा किया जा सकता है। एनएसीएल के साथ तांबा (ii) सल्फेट की बातचीत में, विनिमय प्रतिक्रिया आगे नहीं बढ़ती है, समाधान में ना +, सीएल - सीयू 2+ और इतने 4 आयन हैं, जो एक दूसरे में छोटे से सदस्यतापूर्ण पदार्थ नहीं बनाते हैं। जब तांबा (ii) की प्रतिक्रिया बीएसीएल 2 आय के साथ सल्फेट की जाती है, तो एक्सचेंज प्रतिक्रिया बहती है, जिसके परिणामस्वरूप बेरियम बेरियम सल्फेट 4 प्रक्षेपण में पड़ता है। डी) एलसीएल 3 और मैग्नीशियम एल्यूमीनियम क्लोराइड एमजीसीएल 2 पानी में भंग हो जाते हैं और पोटेशियम हाइड्रॉक्साइड के साथ बातचीत करते समय अलग-अलग व्यवहार करते हैं। क्षार के साथ मैग्नीशियम क्लोराइड एक प्रक्षेपित करता है: एमजीसीएल 2 + 2koh → एमजी (ओएच) 2 ↓ + 2kcl एल्यूमीनियम क्लोराइड के साथ क्षार की बातचीत में, एक प्रक्षेपण पहली बार गठित किया जाता है, जिसे एक जटिल नमक बनाने के लिए भंग किया जाता है - पोटेशियम tetrahydroxyuminate: एलसीएल 3 + 4koh → के + 3 केसीएल कार्य संख्या 26। पदार्थ और अनुप्रयोग क्षेत्र के बीच पत्राचार स्थापित करें: पत्र द्वारा इंगित प्रत्येक स्थिति में, संख्या द्वारा इंगित उचित स्थिति का चयन करें। उपयुक्त अक्षरों के तहत चयनित संख्या तालिका में लिखें। उत्तर: ए -4; बी -2; 3 में; श्री ग। ए) अमोनिया रासायनिक उद्योग का एक आवश्यक उत्पाद है, इसका उत्पादन प्रति वर्ष 130 मिलियन से अधिक टन है। ज्यादातर अमोनिया का उपयोग नाइट्रोजन उर्वरक (नाइट्रेट और अमोनियम सल्फेट, यूरिया), ड्रग्स, विस्फोटक, नाइट्रिक एसिड, सोडा की तैयारी में किया जाता है। प्रस्तावित उत्तरों के विकल्पों में से, अमोनिया का क्षेत्र उर्वरक (चौथा उत्तर विकल्प) का उत्पादन है। बी) मीथेन सबसे सरल हाइड्रोकार्बन है, जो कई सीमा यौगिकों का सबसे थर्मलली टिकाऊ प्रतिनिधि है। यह व्यापक रूप से घरेलू और औद्योगिक ईंधन के रूप में उपयोग किया जाता है, साथ ही उद्योग के लिए कच्चे माल (दूसरा उत्तर विकल्प)। मीथेन 90-98% प्राकृतिक गैस का हिस्सा है। सी) रबड़ सामग्री कहा जाता है, हम संयुग्मित डबल बॉन्ड के साथ यौगिकों के बहुलककरण प्राप्त करते हैं। Isoprene इस प्रकार के यौगिकों का पालन कर रहा है और रबड़ के प्रकारों में से एक प्राप्त करने के लिए उपयोग किया जाता है: डी) कम आणविक भार alkenes प्लास्टिक प्राप्त करने के लिए उपयोग किया जाता है, विशेष रूप से, ethylene का उपयोग प्लास्टिक प्राप्त करने के लिए किया जाता है, जिसे पॉलीथीन कहा जाता है: एनCh 2 \u003d ch 2 → (-ch 2 -ch 2 -) n कार्य संख्या 27। पोटेशियम नाइट्रेट (ग्राम में) के द्रव्यमान की गणना करें, जिसे 12% के द्रव्यमान अंश के साथ समाधान प्राप्त करने के लिए इस नमक के द्रव्यमान के द्रव्यमान के साथ 150 ग्राम समाधान में भंग किया जाना चाहिए। (दसवीं तक की संख्या दर्ज करें।) उत्तर: 3.4 ग्राम स्पष्टीकरण: चलो x पोटेशियम नाइट्रेट का एक द्रव्यमान बनें, जिसे समाधान के 150 ग्राम में भंग कर दिया गया है। हम समाधान के 150 ग्राम में भंग पोटेशियम नाइट्रेट के द्रव्यमान की गणना करते हैं: m (kno 3) \u003d 150 G · 0.1 \u003d 15 G नमक के द्रव्यमान अंश के लिए 12% होने के लिए, पोटेशियम नाइट्रेट के एक्स जी जोड़ा गया था। समाधान का द्रव्यमान (150 + एक्स) था, समीकरण फॉर्म में समीकरण लिखेगा: (दसवीं तक की संख्या दर्ज करें।) उत्तर: 14.4 ग्राम स्पष्टीकरण: हाइड्रोजन सल्फाइड के कुल जलने के परिणामस्वरूप, सल्फर डाइऑक्साइड बनता है: 2 एच 2 एस + 3 ओ 2 → 2 एसओ 2 + 2 एच 2 ओ Avogadro कानून का परिणाम यह है कि एक ही परिस्थितियों में गैसों की मात्रा एक दूसरे के साथ-साथ इन गैसों की मात्रा से संबंधित है। इस प्रकार, प्रतिक्रिया समीकरण के अनुसार: ν (o 2) \u003d 3 / 2ν (एच 2 एस), नतीजतन, हाइड्रोजन सल्फाइड और ऑक्सीजन की मात्रा एक दूसरे के साथ एक ही तरीके से सहसंबंधी है: V (o 2) \u003d 3 / 2v (एच 2 एस), V (o 2) \u003d 3/2 · 6.72 l \u003d 10.08 l, इसलिए v (o 2) \u003d 10.08 l / 22.4 l / mol \u003d 0.45 mol हम हाइड्रोजन सल्फाइड के कुल जलने के लिए आवश्यक ऑक्सीजन के द्रव्यमान की गणना करते हैं: m (o 2) \u003d 0.45 MOL · 32 G / MOL \u003d 14.4 G कार्य संख्या 30। इलेक्ट्रॉनिक बैलेंस विधि का उपयोग करके, प्रतिक्रिया समीकरण बनाएं: ना 2 तो 3 + ... + कोह → के 2 एमएनओ 4 + ... + एच 2 ओ ऑक्सीकरण एजेंट और एजेंट को कम करने का निर्धारण करें। एमएन +7 + 1 ई → एमएन +6 │2 रिकवरी रिएक्शन एस +4 - 2 ई → एस +6 │1 ऑक्सीकरण प्रतिक्रिया एमएन +7 (केएमएनओ 4) - ऑक्सीडाइज़र, एस +4 (एनए 2 एसओ 3) - पुनर्स्थापित करें ना 2 तो 3 + 2kmno 4 + 2koh → 2k 2 mno 4 + na 2 तो 4 + एच 2 ओ कार्य संख्या 31। आयरन गर्म केंद्रित सल्फ्यूरिक एसिड में भंग कर दिया गया था। परिणामी नमक को सोडियम हाइड्रॉक्साइड के अतिरिक्त समाधान के साथ इलाज किया गया था। परिणामी भूरा precipitate फ़िल्टर और कैलसीन किया गया था। परिणामी पदार्थ लौह के साथ गरम किया गया था। चार वर्णित प्रतिक्रियाओं के समीकरण लिखें। 1) एल्यूमीनियम और क्रोम की तरह लौह, सुरक्षात्मक ऑक्साइड फिल्म को कवर करने वाले केंद्रित सल्फ्यूरिक एसिड के साथ प्रतिक्रिया न करें। प्रतिक्रिया केवल तभी होती है जब सल्फर गैस को अलग करने के साथ गरम किया जाता है: 2fe + 6h 2 तो 4 → Fe 2 (इसलिए 4) 2 + 3so 2 + 6h 2 o (जब गर्म हो) 2) लौह सल्फेट (iii) - पानी में घुलनशील नमक, एक क्षार विनिमय प्रतिक्रिया में प्रवेश करता है, जिसके परिणामस्वरूप लौह (iii) हाइड्रॉक्साइड (III कनेक्शन) के परिणामस्वरूप प्रक्षेपित किया गया है: Fe 2 (तो 4) 3 + 3NAOH → 2FE (OH) 3 ↓ + 3NA 2 SO 4 3) कैल्सिनेशन के साथ अघुलनशील धातुओं को अघुलनशील ऑक्साइड और पानी के लिए विघटन के साथ हाइड्रॉक्साइड्स: 2FE (OH) 3 → Fe 2 O 3 + 3H 2 O 4) जब लौह (iii) ऑक्साइड धातु लौह के साथ गरम किया जाता है, लौह (द्वितीय) का गठन होता है (फेओ कनेक्शन में लौह ऑक्सीकरण की मध्यवर्ती डिग्री है): Fe 2 O 3 + Fe → 3feo (जब गर्म हो) कार्य संख्या 32। प्रतिक्रिया समीकरण लिखें जिनके साथ निम्नलिखित परिवर्तन किए जा सकते हैं: प्रतिक्रिया समीकरण लिखते समय, कार्बनिक पदार्थों के लिए संरचनात्मक सूत्रों का उपयोग करें। 1) Intramolecular निर्जलीकरण 140 डिग्री सेल्सियस से ऊपर तापमान पर होता है। यह शराब कार्बन परमाणु से एक अल्कोहल हाइड्रोक्साइल (β-position में) के माध्यम से स्थित शराब कार्बन परमाणु के दरार के परिणामस्वरूप होता है। Ch 3 -ch 2 -ch 2 -oh → ch 2 \u003d ch-ch 3 + h 2 o (शर्तें - एच 2 तो 4, 180 o c) इंटरमोल्यूलर डीहाइड्रेशन सल्फ्यूरिक एसिड की क्रिया के तहत 140 डिग्री सेल्सियस के नीचे तापमान पर होता है और अंततः दो अल्कोहल अणुओं से एक पानी के अणु के क्लेवाज को कम कर देता है। 2) propylene असममित alkenes को संदर्भित करता है। हल्के हाइड्रोजन और पानी के अतिरिक्त, हाइड्रोजन परमाणु कार्बन परमाणु में बड़ी संख्या में हाइड्रोजन परमाणुओं से जुड़े एकाधिक संचार में शामिल हो जाता है: Ch 2 \u003d ch-ch 3 + hcl → ch 3 -CHCL-CH 3 3) 2-क्लोरोप्रोपेन पर NaOH के जलीय घोल के साथ अभिनय, एक हलोजन एटम को हाइड्रोक्साइल समूह द्वारा प्रतिस्थापित किया जाता है: सीएच 3 -CHCL-CH 3 + NAOH (AQ) → CH 3 -CHOH-CH 3 + NACL 4) न केवल प्रोपेनोल -1 से प्रोपेलीन प्राप्त करना संभव है, बल्कि 140 o सी से ऊपर तापमान पर इंट्रामोल्यूलर निर्जलीकरण की प्रोपेनोल -2 प्रतिक्रिया से भी: Ch 3 -ch (ओह) -ch 3 → ch 2 \u003d ch-ch 3 + h 2 o (शर्तें h 2 तो 4, 180 o c) 5) एक क्षारीय माध्यम में, पोटेशियम परमैंगनेट के जलीय घोल के साथ पतला में अभिनय, एल्केंस हाइड्रोक्साइलेशन डायल के गठन के साथ होता है: 3ch 2 \u003d ch-ch 3 + 2kmno 4 + 4h 2 o → 3hoch 2 -ch (ओह) -ch 3 + 2mno 2 + 2koh कार्य संख्या 33। मिश्रण में आयरन (ii) सल्फेट और एल्यूमीनियम सल्फाइड के बड़े पैमाने पर अंशों (% में) निर्धारित करें, यदि इस मिश्रण के 25 ग्राम प्रसंस्करण को पानी के साथ प्रदान किया गया था, जो पूरी तरह से तांबा सल्फेट के 5% समाधान के 960 ग्राम के साथ प्रतिक्रिया करता था ( Ii)। प्रतिक्रिया में, कार्य की स्थिति में निर्दिष्ट प्रतिक्रिया समीकरणों को लिखें, और सभी आवश्यक गणनाएं (वांछित माप की इकाइयों को निर्दिष्ट करें) भौतिक मात्रा). उत्तर: ω (अल 2 एस 3) \u003d 40%; Ω (cuso 4) \u003d 60% लौह (द्वितीय) सल्फेट और एल्यूमीनियम सल्फाइड के मिश्रण को संसाधित करते समय, सल्फेट को बस भंग कर दिया जाता है, और सल्फाइड एल्यूमीनियम हाइड्रॉक्साइड (iii) और हाइड्रोजन सल्फाइड बनाने के लिए हाइड्रोलाइज्ड होता है: अल 2 एस 3 + 6 एच 2 ओ → 2AL (ओएच) 3 ↓ + 3h 2 एस (i) जब हाइड्रोजन सल्फाइड तांबा (द्वितीय) सल्फेट समाधान के समाधान के माध्यम से पारित किया जाता है, तो कॉपर सल्फाइड (ii) फॉल्स: क्यूसो 4 + एच 2 एस → क्यूस ↓ + एच 2 एसओ 4 (ii) हम द्रव्यमान की गणना और कॉपर (ii) के भंग सल्फेट के पदार्थ की मात्रा की गणना करते हैं: एम (क्यूसो 4) \u003d एम (पी-आरए) · ω (क्यूएसओ 4) \u003d 960 ग्राम · 0.05 \u003d 48 ग्राम; ν (cuso 4) \u003d m (cuso 4) / m (cuso 4) \u003d 48 g / 160 g \u003d 0.3 mol प्रतिक्रिया समीकरण (ii) ν (cuso 4) \u003d ν (एच 2 एस) \u003d 0.3 मोल, और प्रतिक्रिया समीकरण (iii) ν (अल 2 एस 3) \u003d 1 / 3ν (एच 2 एस) के अनुसार 0, 1 मोल एल्यूमीनियम सल्फाइड और तांबा सल्फेट (ii) के द्रव्यमान की गणना करें: एम (अल 2 एस 3) \u003d 0.1 एमओएल · 150 ग्राम / मोल \u003d 15 ग्राम; M (cuso4) \u003d 25 g - 15 g \u003d 10 g ω (अल 2 एस 3) \u003d 15 जी / 25 जी · 100% \u003d 60%; Ω (CUSO 4) \u003d 10 G / 25G · 100% \u003d 40% कार्य संख्या 34। जब कुछ का एक नमूना जल रहा है कार्बनिक मिश्रण वजन 14.8 ग्राम कार्बन डाइऑक्साइड के 35.2 ग्राम और 18.0 ग्राम पानी प्राप्त किया गया था। यह ज्ञात है कि हाइड्रोजन के साथ इस पदार्थ के वाष्प की सापेक्ष घनत्व 37 के बराबर है। अध्ययन के दौरान रासायनिक गुण यह पदार्थ स्थापित किया गया है कि कॉपर (द्वितीय) ऑक्साइड के साथ इस पदार्थ की बातचीत के साथ, केटोन का गठन किया गया है। कार्य की इन शर्तों के आधार पर: 1) कार्बनिक पदार्थ के आणविक सूत्र को स्थापित करने के लिए आवश्यक गणना करता है (वांछित भौतिक मात्रा के माप की इकाइयों को निर्दिष्ट करें); 2) मूल कार्बनिक पदार्थ के आणविक सूत्र को लिखें; 3) इस पदार्थ के संरचनात्मक सूत्र को बनाएं, जो विशिष्ट रूप से अपने अणु में परमाणुओं के संचार के आदेश को दर्शाता है; 4) पदार्थ के संरचनात्मक सूत्र का उपयोग करके तांबा ऑक्साइड (ii) के साथ इस पदार्थ के लिए प्रतिक्रिया समीकरण लिखें। रसायन विज्ञान में परीक्षा का परिणाम बिंदुओं की न्यूनतम सेट संख्या से कम नहीं है, विशेषताओं में विश्वविद्यालयों में प्रवेश करने का अधिकार देता है, जहां प्रवेश परीक्षा की सूची में रसायन शास्त्र का विषय है। विश्वविद्यालयों को 36 अंक से नीचे न्यूनतम रसायन शास्त्र सीमा स्थापित करने का अधिकार नहीं है। प्रतिष्ठित विश्वविद्यालय, एक नियम के रूप में, अपनी न्यूनतम दहलीज को बहुत अधिक सेट करें। अध्ययन के लिए, प्रथम वर्ष के छात्रों का बहुत अच्छा ज्ञान होना चाहिए। एफआईआई की आधिकारिक वेबसाइट पर, प्रत्येक वर्ष रसायन विज्ञान के लिए ईईएम विकल्प प्रकाशित होते हैं: प्रदर्शन, प्रारंभिक अवधि। यह विकल्प है जो भविष्य की परीक्षा और कार्यों की जटिलता के स्तर की संरचना का विचार देते हैं और उपयोग की तैयारी करते समय विश्वसनीय जानकारी के स्रोत हैं। में दूतावास 2017 की रसायन शास्त्र में पिछले 2016 केआईएम की तुलना में बदलाव हुए हैं, इसलिए मौजूदा संस्करण के अनुसार तैयार करना वांछनीय है, और स्नातकों के विविध विकास के लिए पिछले वर्षों के विकल्पों का उपयोग करने के लिए। अतिरिक्त सामग्री और उपकरण निम्नलिखित सामग्री रसायन विज्ञान में परीक्षा के परीक्षा के कार्य के प्रत्येक संस्करण से जुड़ी हुई हैं: − आवधिक प्रणाली रासायनिक तत्व डी.आई. Mendeleev; - नमक की घुलनशीलता की तालिका, एसिड और पानी में अड्डों; - धातु वोल्टेज की इलेक्ट्रोकेमिकल पंक्ति। परीक्षा के कार्य के निष्पादन के दौरान, इसे एक अप्रसन्न कैलकुलेटर का उपयोग करने की अनुमति है। अतिरिक्त उपकरणों और सामग्रियों की सूची, उपयोग के लिए उपयोग की अनुमति है, रूस के शिक्षा और विज्ञान मंत्रालय के आदेश से अनुमोदित है। उन लोगों के लिए जो हाई स्कूल में अपनी शिक्षा जारी रखना चाहते हैं, वस्तुओं की पसंद चयनित विशेषता द्वारा प्रवेश परीक्षण की सूची पर निर्भर होना चाहिए सभी विशिष्टताओं (तैयारी की दिशाओं) के लिए विश्वविद्यालयों में प्रवेश परीक्षा की सूची रूस के शिक्षा और विज्ञान मंत्रालय के आदेश द्वारा निर्धारित की जाती है। प्रत्येक विश्वविद्यालय उन अन्य वस्तुओं की इस सूची से चुनता है जो उनके रिसेप्शन नियमों में इंगित करते हैं। चयनित वस्तुओं की सूची के साथ परीक्षा में भागीदारी के लिए आवेदन करने से पहले, आपको चयनित विश्वविद्यालयों की साइटों पर इस जानकारी से परिचित होना चाहिए। 11/14/2016 एफआईआई वेबसाइट पर प्रकाशित घोषणाएं प्रदर्शन विकल्प, कोडिफायर और रसायन विज्ञान सहित एकीकृत राज्य परीक्षा और मूल राज्य परीक्षा 2017 के नियंत्रण मापने सामग्री के कोडिफायर और विनिर्देश। रसायन विज्ञान डेमो चेक 2016-2015 2017 में रसायन विज्ञान में, महत्वपूर्ण परिवर्तन, इसलिए, पिछले वर्षों के विध्विस्म को खुद को परिचित करने के लिए दिया जाता है। रसायन - महत्वपूर्ण परिवर्तन: परीक्षा कार्य की संरचना अनुकूलित है: 1. किम के भाग 1 की संरचना मूल रूप से बदल दी गई है: कार्यों को एक प्रतिक्रिया की पसंद के साथ बाहर रखा गया है; कार्यों को अलग विषयगत ब्लॉक द्वारा समूहीकृत किया जाता है, जिनमें से प्रत्येक में जटिलता के बुनियादी और ऊंचे स्तर दोनों के कार्य होते हैं। 2. 40 (2016 में) से 34 तक कार्यों की कुल संख्या को कम किया गया। 3. आकलन पैमाने (1 से 2 अंक तक) बदल दिया जटिलता के मूल स्तर के कार्यों को निष्पादित करना जो अकार्बनिक और कार्बनिक पदार्थों (9 और 17) के अनुवांशिक बंधन के बारे में ज्ञान की सीखने की जांच करता है। 4. पूरी तरह से काम के प्रदर्शन के लिए अधिकतम प्राथमिक स्कोर 60 अंक (2016 में 64 अंक के बजाय) होगा। रसायन विज्ञान में परीक्षा की अवधि परीक्षा के कार्य की कुल अवधि 3.5 घंटे (210 मिनट) है। व्यक्तिगत कार्यों के निष्पादन को सौंपा गया अनुमानित समय है: 1) भाग 1 - 2-3 मिनट की जटिलता के मूल स्तर के प्रत्येक कार्य के लिए; 2) भाग 1 - 5-7 मिनट की ऊंची जटिलता के प्रत्येक कार्य के लिए; 3) प्रत्येक कार्य के लिए ऊँचा स्तर भाग 2 की जटिलता 10-15 मिनट है। रसायन शास्त्र के लिए विशिष्ट परीक्षण कार्यों में 2017 में एकीकृत राज्य परीक्षा की सभी सुविधाओं और आवश्यकताओं को ध्यान में रखते हुए कार्यों के सेट के लिए 10 विकल्प होते हैं। मैनुअल का उद्देश्य रसायन विज्ञान में किम 2017 की संरचना और सामग्री के बारे में पाठकों की जानकारी प्रदान करना है, कार्यों की कठिनाई की डिग्री। उदाहरण। पदार्थों की प्रस्तावित सूची से, दो पदार्थों का चयन करें जिनमें से प्रत्येक को तांबा प्रतिक्रिया देता है। सामग्रीपदार्थों का सूत्र
अभिकर्मकों
रसायन विज्ञान 2017 के ललाट विकल्प
साल
प्रारंभिक विकल्प डाउनलोड करें
2017
संस्करण पो हिमी।
2016
डाउनलोड
एफआईपीआई से रसायन विज्ञान 2017 में परीक्षा का डेमो संस्करण
विकल्प + उत्तर
डेमो विकल्प डाउनलोड करें
विनिर्देश
डेमो संस्करण हिमिया ईजीई
संयोगक
कोडिफिकेटर।
(तैयारी की दिशा)।उत्तर के साथ रसायन विज्ञान 2017 में Deverovyy ईजीई
विकल्प + उत्तर
डेमो संस्करण डाउनलोड करें
विनिर्देश
डेमो संस्करण हिमिया ईजीई
संयोगक
कोडिफिकेटर।
रसायन विज्ञान
डेमो + उत्तरों डाउनलोड करें
2016
ईजीई 2016।
2015
ईजीई 2015।
संग्रह में सभी परीक्षण विकल्पों और समाधानों के उत्तर हैं विकल्पों में से एक के सभी कार्य दिए गए हैं। इसके अलावा, उपयोग पर उपयोग किए गए रूपों के नमूने प्रतिक्रियाओं और समाधानों को रिकॉर्ड करने के लिए दिए जाते हैं।
कार्यों के लेखक एक प्रमुख वैज्ञानिक, एक शिक्षक और एक पद्धति विशेषज्ञ है जो ईजीई की नियंत्रण मापने वाली सामग्री के विकास में प्रत्यक्ष भागीदारी लेता है।
मैनुअल शिक्षकों के लिए रसायन विज्ञान परीक्षा के साथ-साथ हाई स्कूल के छात्रों और स्नातकों के लिए छात्रों को तैयार करने के लिए है - आत्म-तैयारी और आत्म-नियंत्रण के लिए।
अमोनियम क्लोराइड में रासायनिक कनेक्शन हैं:
1) आयनिक
2) सहसंयोजक ध्रुवीय
3) गैर-ध्रुवीय को धारण करें
4) हाइड्रोजन
5) धातु
1) जिंक क्लोराइड (आर-पी)
2) सोडियम सल्फेट (आरआर)
3) नाइट्रिक एसिड को पतला करें
4) केंद्रित सल्फ्यूरिक एसिड
5) एल्यूमीनियम ऑक्साइड
प्रस्तावना
कार्य करने के लिए निर्देश
विकल्प 1
भाग 1
भाग 2
विकल्प 2।
भाग 1
भाग 2
विकल्प 3।
भाग 1
भाग 2
विकल्प 4।
भाग 1
भाग 2
विकल्प 5।
भाग 1
भाग 2
विकल्प 6।
भाग 1
भाग 2
विकल्प 7।
भाग 1
भाग 2
विकल्प 8।
भाग 1
भाग 2
विकल्प 9।
भाग 1
भाग 2
विकल्प 10।
भाग 1
भाग 2
उत्तर और समाधान
भाग 1 के कार्यों के उत्तर
भाग 2 के कार्यों के समाधान और उत्तर
विकल्प 10 के कार्यों का समाधान
भाग 1
भाग 2।
मुफ्त डाउनलोड इलेक्ट्रॉनिक पुस्तक एक सुविधाजनक प्रारूप में, देखें और पढ़ें:
पुस्तक ईई 2017, रसायन विज्ञान, ठेठ परीक्षण, मेदवेदेव यू.एन. - fileskachat.com, तेज़ और मुफ्त डाउनलोड।