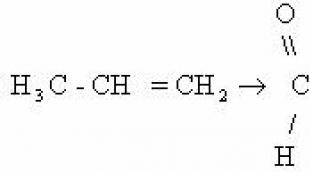रसायन विज्ञान में एकीकृत राज्य परीक्षा की तैयारी, विषय अल्केन्स है। अल्केन्स। आइसोमेरिज्म और अल्केन्स का नामकरण
अल्केन्स की संरचना
अल्केन्स हाइड्रोकार्बन होते हैं जिनके अणुओं में परमाणु एकल बंधों से जुड़े होते हैं और जो सामान्य सूत्र के अनुरूप होते हैं सी एन एच 2एन+2. अल्केन अणुओं में, सभी कार्बन परमाणु अवस्था में होते हैं एसपी 3-संकरण.
इसका मतलब यह है कि कार्बन परमाणु के सभी चार संकर कक्ष आकार, ऊर्जा में समान हैं और एक समबाहु त्रिकोणीय पिरामिड के कोनों की ओर निर्देशित हैं - चतुर्पाश्वीय. कक्षकों के बीच का कोण 109° 28′ है। एकल कार्बन-कार्बन बंधन के चारों ओर लगभग मुक्त घूर्णन संभव है, और अल्केन अणु टेट्राहेड्रल (109° 28′) के करीब कार्बन परमाणुओं पर कोणों के साथ विभिन्न प्रकार के आकार ले सकते हैं, उदाहरण के लिए, एन-पेंटेन अणु में।

यह विशेष रूप से अल्केन अणुओं में बंधों को याद रखने योग्य है। संतृप्त हाइड्रोकार्बन के अणुओं में सभी बंधन एकल होते हैं। ओवरलैप परमाणुओं के नाभिक को जोड़ने वाली धुरी के साथ होता है, यानी σ बांड. कार्बन-कार्बन बांड गैर-ध्रुवीय और खराब ध्रुवीकरण योग्य होते हैं। अल्केन्स में सी-सी बांड की लंबाई 0.154 एनएम (1.54 · 10 10 मीटर) है। सी-एच बांड कुछ छोटे होते हैं। इलेक्ट्रॉन घनत्व थोड़ा अधिक विद्युत ऋणात्मक कार्बन परमाणु की ओर स्थानांतरित हो जाता है, यानी सी-एच बंधन है कमजोर ध्रुवीय.
मीथेन की सजातीय श्रृंखला
होमोलोग्स- ऐसे पदार्थ जो संरचना और गुणों में समान हों और भिन्न हों एक या अधिक सीएच समूह 2 .


संतृप्त हाइड्रोकार्बनमीथेन की समजात श्रृंखला का गठन करें।
आइसोमेरिज्म और अल्केन्स का नामकरण
अल्केन्स की विशेषता तथाकथित है संरचनात्मक समरूपता. कार्बन कंकाल की संरचना में संरचनात्मक आइसोमर्स एक दूसरे से भिन्न होते हैं। सबसे सरल अल्केन, जो संरचनात्मक आइसोमर्स द्वारा विशेषता है, ब्यूटेन है।

आइए अल्केन्स के मूल नामकरण पर अधिक विस्तार से विचार करें आईयूपीएसी.
1. मुख्य सर्किट चयन. हाइड्रोकार्बन के नाम का निर्माण मुख्य श्रृंखला की परिभाषा से शुरू होता है - अणु में कार्बन परमाणुओं की सबसे लंबी श्रृंखला, जो मानो इसका आधार है।
2. मुख्य श्रृंखला परमाणुओं की संख्या. मुख्य श्रृंखला के परमाणुओं को संख्याएँ दी गई हैं। मुख्य श्रृंखला के परमाणुओं की संख्या उस सिरे से शुरू होती है जिसके सबसे करीब प्रतिस्थापी होता है (संरचना ए, बी)। यदि प्रतिस्थापी श्रृंखला के अंत से समान दूरी पर स्थित हैं, तो क्रमांकन उस अंत से शुरू होता है जिस पर उनमें से अधिक हैं (संरचना बी)। यदि विभिन्न प्रतिस्थापन श्रृंखला के सिरों से समान दूरी पर स्थित हैं, तो नंबरिंग उस छोर से शुरू होती है जहां वरिष्ठ निकटतम है (संरचना डी)। हाइड्रोकार्बन पदार्थों की वरिष्ठता उस क्रम से निर्धारित होती है जिसमें उनका नाम जिस अक्षर से शुरू होता है वह वर्णमाला में आता है: मिथाइल (-CH 3), फिर प्रोपाइल (-CH 2 -CH 2 -CH 3), एथिल (-CH 2) -सीएच 3 ) आदि।
कृपया ध्यान दें कि संबंधित अल्केन के नाम में प्रत्यय -ane को प्रत्यय -yl से प्रतिस्थापित करने पर प्रतिस्थापी का नाम बनता है।
3. नाम का गठन. नाम की शुरुआत में, संख्याएं इंगित की जाती हैं - कार्बन परमाणुओं की संख्या जिन पर प्रतिस्थापन स्थित हैं। यदि किसी दिए गए परमाणु में कई प्रतिस्थापन हैं, तो नाम में संबंधित संख्या को अल्पविराम (2,2-) से अलग करके दो बार दोहराया जाता है। संख्या के बाद, एक हाइफ़न प्रतिस्थापकों की संख्या (डी - दो, तीन - तीन, टेट्रा - चार, पेंटा - पांच) और प्रतिस्थापक का नाम (मिथाइल, एथिल, प्रोपाइल) इंगित करता है। फिर, रिक्त स्थान या हाइफ़न के बिना, मुख्य श्रृंखला का नाम। मुख्य श्रृंखला को हाइड्रोकार्बन कहा जाता है - मीथेन (मीथेन, ईथेन, प्रोपेन, आदि) की समजातीय श्रृंखला का एक सदस्य।




जिन पदार्थों के संरचनात्मक सूत्र ऊपर दिये गये हैं उनके नाम इस प्रकार हैं:
संरचना ए: 2-मिथाइलप्रोपेन;
संरचना बी: 3-एथिलहेक्सेन;
संरचना बी: 2,2,4-ट्राइमेथिलपेंटेन;
संरचना डी: 2-मिथाइल 4-एथिलहेक्सेन।
अणुओं में संतृप्त हाइड्रोकार्बन की अनुपस्थिति ध्रुवीय बंधनउनकी ओर ले जाता है पानी में खराब घुलनशील, आवेशित कणों (आयनों) के साथ परस्पर क्रिया न करें. अल्केन्स के लिए सबसे विशिष्ट प्रतिक्रियाएँ शामिल हैं मुक्त कण.
अल्केन्स के भौतिक गुण
मीथेन की समजात श्रृंखला के प्रथम चार प्रतिनिधि हैं गैसों. उनमें से सबसे सरल मीथेन है - एक रंगहीन, स्वादहीन और गंधहीन गैस ("गैस" की गंध, जब आप इसे सूंघते हैं, तो आपको 04 पर कॉल करने की आवश्यकता होती है, मर्कैप्टन की गंध से निर्धारित होती है - सल्फर युक्त यौगिक विशेष रूप से मीथेन में उपयोग किए जाते हैं घरेलू और औद्योगिक गैस उपकरणों में ताकि उनके बगल में स्थित लोग गंध से रिसाव का पता लगा सकें)।
से संरचना के हाइड्रोकार्बन साथ 5 एन 12 पहले साथ 15 एन 32 - तरल पदार्थ; भारी हाइड्रोकार्बन ठोस होते हैं। कार्बन श्रृंखला की लंबाई बढ़ने के साथ अल्केन्स का क्वथनांक और गलनांक धीरे-धीरे बढ़ता है। सभी हाइड्रोकार्बन पानी में खराब घुलनशील होते हैं; तरल हाइड्रोकार्बन सामान्य कार्बनिक विलायक होते हैं।


अल्केन्स के रासायनिक गुण
प्रतिस्थापन प्रतिक्रियाएँ.
अल्केन्स के लिए सबसे विशिष्ट प्रतिक्रियाएँ हैं मुक्त मूलक प्रतिस्थापन, जिसके दौरान एक हाइड्रोजन परमाणु को हैलोजन परमाणु या कुछ समूह द्वारा प्रतिस्थापित किया जाता है।
आइए हम विशिष्ट समीकरण प्रस्तुत करें हैलोजनीकरण प्रतिक्रियाएँ:
अतिरिक्त हैलोजन के मामले में, क्लोरीनीकरण आगे बढ़ सकता है, क्लोरीन के साथ सभी हाइड्रोजन परमाणुओं के पूर्ण प्रतिस्थापन तक:

परिणामी पदार्थों का व्यापक रूप से कार्बनिक संश्लेषण में विलायक और प्रारंभिक सामग्री के रूप में उपयोग किया जाता है।
डिहाइड्रोजनीकरण प्रतिक्रिया(हाइड्रोजन अमूर्तन)।
जब उच्च तापमान (400-600 डिग्री सेल्सियस) पर अल्केन्स को उत्प्रेरक (पीटी, नी, अल 2 ओ 3, सीआर 2 ओ 3) के ऊपर से गुजारा जाता है, तो एक हाइड्रोजन अणु समाप्त हो जाता है और एक एल्केन:
कार्बन श्रृंखला के विनाश के साथ प्रतिक्रियाएँ। सभी संतृप्त हाइड्रोकार्बन जल रहे हैंकार्बन डाइऑक्साइड और पानी के निर्माण के साथ। कुछ निश्चित अनुपात में हवा के साथ मिश्रित गैसीय हाइड्रोकार्बन विस्फोट कर सकते हैं।
1. संतृप्त हाइड्रोकार्बन का दहनएक मुक्त मूलक ऊष्माक्षेपी प्रतिक्रिया है, जो ईंधन के रूप में अल्केन्स का उपयोग करते समय बहुत महत्वपूर्ण है:
सामान्य तौर पर, अल्केन्स की दहन प्रतिक्रिया को इस प्रकार लिखा जा सकता है:
2. हाइड्रोकार्बन का थर्मल विभाजन.
के अनुसार प्रक्रिया आगे बढ़ती है मुक्त कण तंत्र. तापमान में वृद्धि से कार्बन-कार्बन बंधन का होमोलिटिक दरार और मुक्त कणों का निर्माण होता है।
ये रेडिकल एक अणु बनाने के लिए हाइड्रोजन परमाणु का आदान-प्रदान करते हुए एक दूसरे के साथ बातचीत करते हैं एल्केन और एल्केन अणु:
थर्मल अपघटन प्रतिक्रियाएं औद्योगिक प्रक्रिया का आधार बनती हैं - हाइड्रोकार्बन क्रैकिंग. यह प्रक्रिया तेल शोधन का सबसे महत्वपूर्ण चरण है।
3. पायरोलिसिस. जब मीथेन को 1000 डिग्री सेल्सियस के तापमान तक गर्म किया जाता है, मीथेन पायरोलिसिस- सरल पदार्थों में अपघटन:
जब 1500 डिग्री सेल्सियस के तापमान तक गर्म किया जाता है, तो इसका निर्माण होता है एसिटिलीन:
4. आइसोमराइज़ेशन. जब रैखिक हाइड्रोकार्बन को आइसोमेराइजेशन उत्प्रेरक (एल्यूमीनियम क्लोराइड) के साथ गर्म किया जाता है, तो पदार्थ शाखित कार्बन कंकाल:

5. गंध. श्रृंखला में छह या अधिक कार्बन परमाणुओं वाले अल्केन्स उत्प्रेरक की उपस्थिति में चक्रित होकर बेंजीन और उसके डेरिवेटिव बनाते हैं:

अल्केन्स ऐसी प्रतिक्रियाओं में प्रवेश करते हैं जो मुक्त मूलक तंत्र के अनुसार आगे बढ़ती हैं, क्योंकि अल्केन अणुओं में सभी कार्बन परमाणु एसपी 3 संकरण की स्थिति में होते हैं। इन पदार्थों के अणु सहसंयोजक गैर-ध्रुवीय सी-सी (कार्बन-कार्बन) बांड और कमजोर ध्रुवीय सी-एच (कार्बन-हाइड्रोजन) बांड का उपयोग करके बनाए जाते हैं। उनमें बढ़े हुए या घटे हुए इलेक्ट्रॉन घनत्व वाले या आसानी से ध्रुवीकरण योग्य बंधन वाले क्षेत्र नहीं होते हैं, यानी, ऐसे बंधन जिनमें इलेक्ट्रॉन घनत्व बाहरी कारकों (आयनों के इलेक्ट्रोस्टैटिक क्षेत्र) के प्रभाव में स्थानांतरित हो सकता है। नतीजतन, अल्केन्स आवेशित कणों के साथ प्रतिक्रिया नहीं करेंगे, क्योंकि अल्केन अणुओं में बंधन हेटेरोलिटिक तंत्र द्वारा नहीं टूटते हैं।
हम एकीकृत राज्य परीक्षा की तैयारी कर रहे हैं। अलकनी।
अल्केन (संतृप्त हाइड्रोकार्बन, पैराफिन)
अल्केन्स स्निग्ध (एसाइक्लिक) संतृप्त हाइड्रोकार्बन हैं जिनमें कार्बन परमाणु सीधी या शाखित श्रृंखलाओं में सरल (एकल) बंधों द्वारा एक साथ जुड़े होते हैं।सामान्य सूत्र C n H 2n+2 द्वारा, जहाँ n ≥1।
हाइड्रोकार्बन - अंतर्राष्ट्रीय नामकरण के अनुसार संतृप्त हाइड्रोकार्बन का नाम।
पैराफिन - एक ऐतिहासिक रूप से स्थापित नाम जो इन यौगिकों के गुणों को दर्शाता है (अक्षांश से)।पैर्रम एफिनिस – कम आत्मीयता होना, कम गतिविधि होना)।
अत्यधिक, या संतृप्त , इन हाइड्रोकार्बन का नाम हाइड्रोजन परमाणुओं के साथ कार्बन श्रृंखला की पूर्ण संतृप्ति के कारण रखा गया है।
अल्केन्स की सजातीय श्रृंखला
अल्केन्स, एक सामान्य सूत्र वालेसी एन एच 2एन+2 , समान संरचना वाले संबंधित यौगिकों की एक श्रृंखला है, जिसमें प्रत्येक बाद का सदस्य परमाणुओं के एक स्थिर समूह (-CH) द्वारा पिछले एक से भिन्न होता है 2 -). कनेक्शन के इस क्रम को कहा जाता हैसजातीय श्रृंखला(ग्रीक होमोलॉग से -समान), इस शृंखला के अलग-अलग सदस्य -सजातीय , और परमाणुओं का वह समूह जिसमें पड़ोसी समजात भिन्न होते हैंसजातीय अंतर.
- सीएच 4 - सजातीय श्रृंखला का पहला सदस्य -मीथेन (1 सी परमाणु शामिल है);
- सीएच 3-सीएच 3 या सीएच 3-सीएच 3 - ईथेन (2 सी परमाणु);
- सीएच 3 -सीएच 2 -सीएच 3 या सीएच 3 -सीएच 2 -सीएच 3 - प्रोपेन (3 सी परमाणु);
- सीएच 3 -सीएच 2 -सीएच 2 -सीएच 3 या सीएच 3 -सीएच 2 -सीएच 2 -सीएच 3 - ब्यूटेन (4 सी परमाणु)।
प्रत्यय -अ सभी अल्केन्स के नामों की विशेषता है। पांचवें समरूप से शुरू होकर, अल्केन का नाम ग्रीक अंक से बना है, जो अणु में कार्बन परमाणुओं की संख्या और प्रत्यय को दर्शाता है-एन: पेंटेन C5H12, हेक्सेन C6H14, हेप्टेन C7H16, ऑक्टेन C8H18, नॉनेन C9H20, डिकैन C10H22, आदि।
होमोलॉग्स आणविक भार में भिन्न होते हैं और इसलिए, भौतिक गुणों में भिन्न होते हैं। एक समजातीय श्रृंखला में एक अल्केन अणु में कार्बन परमाणुओं की संख्या में वृद्धि के साथ, समरूपों के भौतिक गुणों में एक प्राकृतिक परिवर्तन देखा जाता है: उबलने और पिघलने का तापमान बढ़ जाता है, और घनत्व बढ़ जाता है। सभी अल्केन्स पानी से हल्के होते हैं और उसमें अघुलनशील होते हैं, लेकिन वे गैर-ध्रुवीय सॉल्वैंट्स (उदाहरण के लिए, बेंजीन) में घुलनशील होते हैं और स्वयं अच्छे सॉल्वैंट्स होते हैं। सीएच से अल्केन्स 4 से सी 4 एच 10 - गैसें, सी 5 एच 12 से सी 17 एच 36 तक - तरल पदार्थ, फिर - ठोस। समान गुणात्मक संरचना और समान प्रकार के रासायनिक बंधन होने के कारण, होमोलॉग में समान रासायनिक गुण होते हैं। इसलिए, समजात श्रृंखला के किसी एक सदस्य के रासायनिक गुणों को जानकर, इस श्रृंखला के अन्य सदस्यों के रासायनिक व्यवहार की भविष्यवाणी करना संभव है।
अल्केन्स की संरचना
अल्केन्स में दो प्रकार के रासायनिक बंधन होते हैं:
सी-सी और सी-एच.
सी-सी बंधन सहसंयोजक गैर-ध्रुवीय है। सी-एच बंधन सहसंयोजक, कमजोर ध्रुवीय है, क्योंकि कार्बन और हाइड्रोजन इलेक्ट्रोनगेटिविटी में करीब हैं)।
अल्केन्स में सभी कार्बन परमाणु एसपी अवस्था में हैं 3-संकरण.
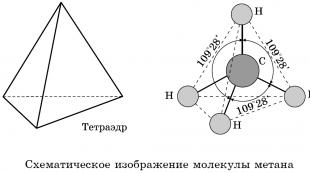
चार कार्बन σ बांड अंतरिक्ष में 109 के कोण पर निर्देशित होते हैंहे 28", जो न्यूनतम इलेक्ट्रॉन प्रतिकर्षण से मेल खाता है। इसलिए, अल्केन्स के सबसे सरल प्रतिनिधि का अणु - मीथेन सीएच 4 - इसका आकार टेट्राहेड्रोन जैसा है, जिसके केंद्र में एक कार्बन परमाणु है, और शीर्ष पर हाइड्रोजन परमाणु हैं।
अल्केन्स का समावयवता
आइसोमेरिज्म उन यौगिकों के अस्तित्व की घटना है जिनकी संरचना (समान आणविक सूत्र) समान है, लेकिन संरचनाएं अलग-अलग हैं। ऐसे कनेक्शन कहलाते हैंआइसोमर्स
अणुओं में परमाणुओं के संयोजन के क्रम में अंतर (अर्थात, रासायनिक संरचना) के कारण होता हैसंरचनात्मक समावयवता (कार्बन कंकाल समावयवता). अल्केन्स की श्रृंखला में, संरचनात्मक आइसोमेरिज्म तब प्रकट होता है जब श्रृंखला में 4 या अधिक कार्बन परमाणु होते हैं, अर्थात। ब्यूटेन सी से शुरू करें 4 एन 10 . उदाहरण के लिए, रचना C का एक अल्केन 4 एच 10 रूप में विद्यमान हो सकता हैदो संरचनात्मक आइसोमर्स:
सीएच 3 -सीएच 2 -सीएच 2 -सीएच 3 (ब्यूटेन) और सीएच 3 -सीएच(सीएच 3 ) -सीएच 3 (2-मिथाइलप्रोपेन)।
संरचनात्मक आइसोमर्स भौतिक गुणों में भिन्न होते हैं। शाखित संरचना वाले अल्केन्स, अणुओं की कम घनी पैकिंग के कारण और, तदनुसार, कम अंतर-आणविक अंतःक्रियाओं के कारण, उनके अशाखित आइसोमर्स की तुलना में कम तापमान पर उबलते हैं।
अल्केन्स के रासायनिक गुण
अल्केन्स के लिए तुच्छ (ऐतिहासिक) नाम - "पैराफिन्स" - का अर्थ है "कोई समानता नहीं।" सामान्य परिस्थितियों में अल्केन्स रासायनिक रूप से निष्क्रिय होते हैं। अल्केन्स की कम प्रतिक्रियाशीलता कार्बन और हाइड्रोजन परमाणुओं की लगभग समान इलेक्ट्रोनगेटिविटी के कारण उनके अणुओं में सी-सी और सी-एच बांड की बहुत कम ध्रुवता के कारण होती है। सामान्य परिस्थितियों में संतृप्त हाइड्रोकार्बन सांद्र अम्ल, क्षार या यहां तक कि पोटेशियम परमैंगनेट जैसे सक्रिय अभिकर्मक के साथ बातचीत नहीं करते हैं। कार्बन परमाणुओं के सभी बंधों की अत्यधिक संतृप्ति के कारण अल्केन्स आमतौर पर अतिरिक्त प्रतिक्रियाओं में असमर्थ होते हैं।
I. प्रतिस्थापन प्रतिक्रियाएँ
कुछ शर्तों के तहत (गर्म होने पर, या प्रकाश में, या उत्प्रेरक के उपयोग के साथ), सी-एच बंधन टूट जाते हैं और हाइड्रोजन परमाणुओं को अन्य परमाणुओं या परमाणुओं के समूहों द्वारा प्रतिस्थापित किया जाता है। इन प्रतिक्रियाओं में, सहसंयोजक बंधनों का होमोलिटिक दरार होता है, यानी वे एक मुक्त कट्टरपंथी (श्रृंखला) तंत्र द्वारा किए जाते हैं।
1) हैलोजनीकरण
एल्केनों का हैलोजनीकरण एक एल्केन अणु में एक या अधिक हाइड्रोजन परमाणुओं को हैलोजन से प्रतिस्थापित करने की प्रतिक्रिया है। प्रतिक्रिया उत्पादों को हेलोऐल्केन या ऐल्केनों के हैलोजन व्युत्पन्न कहा जाता हैआर-सीएल या सी एन एच 2एन+1 - सीएल।
क्लोरीन और ब्रोमीन के साथ अल्केन्स की प्रतिक्रिया प्रकाश में या गर्म होने पर होती है।
मीथेन क्लोरीनीकरण:
सीएच 4 + सीएल 2 एचν → सीएच 3 सीएल + एचसीएल (प्रथम चरण)
(एचν - प्रकाश क्वांटम; सीएच 3 सीएल - क्लोरोमेथेन)
यदि पर्याप्त क्लोरीन है, तो प्रतिक्रिया आगे भी जारी रहती है:
सीएच 3 सीएल + सीएल 2 एचν → सीएच 2 सीएल 2 + एचसीएल (चरण 2)
(सीएच 2 सीएल 2 - डाइक्लोरोमेथेन)
सीएच 2 सीएल 2 + सीएल 2 एचν → सीएचसीएल 3 + एचसीएल (तीसरा चरण)
(सीएचसीएल 3 - ट्राइक्लोरोमेथेन या क्लोरोफॉर्म)
सीएचसीएल 3 + सीएल 2 एचν → सीसीएल 4 + एचसीएल (चौथा चरण)
(सीसीएल 4 - कार्बन टेट्राक्लोराइड)
अल्केन्स की हैलोजनीकरण प्रतिक्रिया एक रेडिकल श्रृंखला तंत्र के माध्यम से होती है। शिक्षाविद् और नोबेल पुरस्कार विजेता एन.एन. सेमेनोव के कार्यों ने श्रृंखला प्रतिक्रियाओं के सिद्धांत के विकास में एक प्रमुख भूमिका निभाई।
हैलोऐल्केन में हैलोजन परमाणु के साथ हाइड्रोजन के प्रतिस्थापन की प्रतिक्रिया की दर संबंधित एल्केन की तुलना में अधिक होती है; यह अणु में परमाणुओं के पारस्परिक प्रभाव के कारण होता है। जैसे-जैसे हाइड्रोकार्बन रेडिकल बढ़ता है, सबसे अधिक गतिशील हाइड्रोजन परमाणु, प्रतिस्थापक के निकटतम कार्बन परमाणु पर बने रहते हैं:
सीएच 3-सीएच 2-सीएल + सीएल 2 एचν → सीएच 3-सीएचसीएल 2 + एचसीएल
(सीएच 3 - सीएचसीएल 2 - 1,1-डाइक्लोरोइथेन)
जब द्वितीयक या तृतीयक कार्बन परमाणुओं के साथ अल्केन को क्लोरीनेट या ब्रोमिनेट किया जाता है, तो तृतीयक परमाणु पर हाइड्रोजन को प्रतिस्थापित करना सबसे आसान होता है, द्वितीयक परमाणु पर अधिक कठिन होता है, और प्राथमिक परमाणु पर और भी अधिक कठिन होता है। इसे अयुग्मित इलेक्ट्रॉन के विस्थानीकरण के कारण प्राथमिक की तुलना में तृतीयक और द्वितीयक हाइड्रोकार्बन रेडिकल की अधिक स्थिरता द्वारा समझाया गया है। इसलिए, उदाहरण के लिए, प्रोपेन को ब्रोमिनेट करते समय, मुख्य प्रतिक्रिया उत्पाद 2-ब्रोमोप्रोपेन होता है:
फ्लोरीन के साथ प्रतिक्रिया विस्फोटक रूप से होती है.
2) नाइट्रेशन (कोनोवालोव प्रतिक्रिया)
इस तथ्य के बावजूद कि सामान्य परिस्थितियों में अल्केन्स सांद्र नाइट्रिक एसिड के साथ प्रतिक्रिया नहीं करते हैं, जब दबाव में तनु (10%) नाइट्रिक एसिड के साथ 140°C तक गर्म किया जाता है, तो एक नाइट्रेशन प्रतिक्रिया होती है - एक नाइट्रो समूह के साथ हाइड्रोजन परमाणु का प्रतिस्थापन NO2. प्रतिक्रिया उत्पाद - नाइट्रोऐल्केन R-NO 2 या C n H 2n+1 – NO 2.
प्रतिक्रिया योजना:
सीएच 4 + एचएनओ 3 टी˚सी,पी → सीएच 3 नंबर 2 + एच 2 O (मीथेन के नाइट्रेशन से नाइट्रोमेथेन उत्पन्न होता है)।
प्रतिक्रियाओं में, हाइड्रोजन परमाणुओं को तृतीयक कार्बन परमाणुओं में, फिर द्वितीयक परमाणुओं में, और अंत में, प्राथमिक कार्बन परमाणुओं में प्रतिस्थापित करना सबसे आसान होता है।
3) सल्फोनेशन
सामान्य तापमान पर सल्फ्यूरिक एसिड का अल्केन्स पर कोई प्रभाव नहीं पड़ता है, लेकिन कम तापमान पर यह केंद्रित होता हैसल्फ्यूरिक एसिडसीमा तक कार्य कर सकते हैंहाइड्रोकार्बनजिससे हाइड्रोजन परमाणु का प्रतिस्थापन सल्फो समूह SO से हो गया 3 एच
द्वितीय. अल्केन ऑक्सीकरण प्रतिक्रियाएं
सामान्य तापमान पर, अल्केन्स मजबूत ऑक्सीकरण एजेंटों (एच) के साथ भी प्रतिक्रिया नहीं करते हैं 2 सीआर 2 ओ 7, केएमएनओ 4, आदि)।
1) जब खुली लौ में डाला जाता है, तो अल्केन्स जल जाते हैं। इस स्थिति में, ऑक्सीजन की अधिकता में, वे पूरी तरह से CO में ऑक्सीकृत हो जाते हैं 2 और पानी। हाइड्रोकार्बन के दहन के साथ बड़ी मात्रा में ऊष्मा (एक्ज़ोथिर्मिक प्रतिक्रिया) निकलती है।
सीएच 4 + 2ओ 2 →सीओ 2 + 2एच 2 ओ+ क्यू
सी 5 एच 12 + 8ओ 2 →5सीओ 2 + 6एच 2 ओ + क्यू
सामान्य रूप में अल्केन्स की दहन प्रतिक्रिया के लिए समीकरण:
इस समीकरण से यह निष्कर्ष निकलता है कि कार्बन परमाणुओं की संख्या में वृद्धि के साथ (एन ) एक अल्केन में, इसके पूर्ण ऑक्सीकरण के लिए आवश्यक ऑक्सीजन की मात्रा बढ़ जाती है। उच्च अल्केन्स को जलाने पर (एन >>1) हवा में मौजूद ऑक्सीजन CO में उनके पूर्ण ऑक्सीकरण के लिए पर्याप्त नहीं हो सकती है 2
. तब आंशिक ऑक्सीकरण उत्पाद बनते हैं:कार्बन मोनोऑक्साइड CO,
कालिख (ठीक कार्बन, शून्य ऑक्सीकरण अवस्था)। इसलिए, उच्च अल्केन्स हवा में धुएँ की लौ के साथ जलते हैं, और रास्ते में निकलने वाला जहरीला कार्बन मोनोऑक्साइड (गंधहीन और रंगहीन) मनुष्यों के लिए खतरा पैदा करता है।
ऑक्सीजन की कमी के साथ मीथेन का दहन समीकरणों के अनुसार होता है:
2CH 4 + 3O 2 →2CO +4H 2 O
सीएच 4 + ओ 2 →सी +2एच 2 ओ
2) वायुमंडलीय ऑक्सीजन के साथ उत्प्रेरक ऑक्सीकरण।
अपेक्षाकृत कम तापमान पर और उत्प्रेरक के उपयोग के साथ अल्केन्स का आंशिक ऑक्सीकरण सी-सी और सी-एच बांड के केवल भाग के टूटने के साथ होता है और इसका उपयोग मूल्यवान उत्पादों को प्राप्त करने के लिए किया जाता है: कार्बोक्जिलिक एसिड, केटोन्स, एल्डिहाइड और अल्कोहल।
2CH 4 + O 2 →2CH 3 OH (CH 3 OH - मेथनॉल)
सीएच 4 + ओ 2 → एचसीओएच + एच 2 ओ (एचसीओएच - मिथेनल)
2CH 4 + 3O 2 →2HCOOH +2H 2 O (HCOOH - मेथेनोइक एसिड)
जब ब्यूटेन का अपूर्ण ऑक्सीकरण होता है, तो एसिटिक अम्ल प्राप्त होता है:
2C 4 H 10 + 5O 2 → 4СH 3 COOH + 2H 2 O
III. अल्केन्स का थर्मल परिवर्तन
1) अल्केन्स का टूटना- हाइड्रोकार्बन के थर्मल अपघटन की प्रक्रिया, जो बड़े अणुओं की कार्बन श्रृंखला को विभाजित करने की प्रतिक्रियाओं पर आधारित होती है, जिसमें छोटी श्रृंखला वाले अल्केन्स और अल्केन्स के अणु बनते हैं।
कम आणविक भार वाले उत्पाद प्राप्त करने के लिए अल्केन्स को क्रैक करना तेल शोधन का आधार है, जिसका उपयोग मोटर ईंधन, चिकनाई वाले तेल आदि के साथ-साथ रासायनिक और पेट्रोकेमिकल उद्योगों के लिए कच्चे माल के रूप में किया जाता है।
इस प्रक्रिया को करने के दो तरीके हैं:थर्मल क्रैकिंग(हवा की पहुंच के बिना गर्म होने पर) औरउत्प्रेरक क्रैकिंग(उत्प्रेरक की उपस्थिति में अधिक मध्यम तापन)।
सी 10 एच 22 टी°С → सी 5 एच 12 + सी 5 एच 10
2) अल्केन्स का डीहाइड्रोजनीकरण
उत्प्रेरक (पीटी, पीडी, नी, सीआर) की उपस्थिति में अल्केन्स को गर्म करते समय 2 ओ 3, अल 2 ओ 3 ) उनका उत्प्रेरकनिर्जलीकरण - सी-एच बांड के टूटने के कारण हाइड्रोजन परमाणुओं का अमूर्तन।
3) अल्केन्स का आइसोमेराइजेशन।
उत्प्रेरक के प्रभाव में और गर्म करने पर सामान्य संरचना के अल्केन्स अणुओं की संरचना को बदले बिना शाखित अल्केन्स में परिवर्तित होने में सक्षम होते हैं, अर्थात। आइसोमेराइजेशन प्रतिक्रियाओं में प्रवेश करें। इन प्रतिक्रियाओं में अल्केन्स शामिल होते हैं जिनके अणुओं में कम से कम 4 कार्बन परमाणु होते हैं।
उदाहरण के लिए, एन-पेंटेन का आइसोपेंटेन (2-मिथाइलब्यूटेन) में आइसोमेराइजेशन एल्यूमीनियम क्लोराइड उत्प्रेरक की उपस्थिति में 100 डिग्री सेल्सियस पर होता है:
4) डीहाइड्रोसायक्लाइजेशन या एरोमाटाइजेशन प्रतिक्रिया
6 या अधिक कार्बन परमाणुओं की मुख्य श्रृंखला वाले अल्केन्स डीहाइड्रोसाइक्लाइजेशन प्रतिक्रिया में प्रवेश करते हैं, लेकिन हमेशा 6-सदस्यीय रिंग (साइक्लोहेक्सेन और इसके डेरिवेटिव) बनाते हैं। प्रतिक्रिया स्थितियों के तहत, यह चक्र आगे डीहाइड्रोजनीकरण से गुजरता है और एक सुगंधित हाइड्रोकार्बन (एरीन) के ऊर्जावान रूप से अधिक स्थिर बेंजीन रिंग में बदल जाता है। उदाहरण के लिए:
ये प्रतिक्रियाएं सुधार प्रक्रिया का आधार हैं - एरेन्स (संतृप्त हाइड्रोकार्बन का सुगंधीकरण) और हाइड्रोजन का उत्पादन करने के लिए पेट्रोलियम उत्पादों का प्रसंस्करण। एन-अल्केन्स के एरेन्स में परिवर्तन से गैसोलीन के दस्तक प्रतिरोध में सुधार होता है।
5) सरल पदार्थों का थर्मल अपघटन
सीएच 4 टी → सी + 2एच 2
6) मीथेन का पायरोलिसिस।
1500°C पर होता हैअंतरआणविक निर्जलीकरणमीथेन
एसिटिलीन के निर्माण के साथ:
2CH 4 1500°С → C 2 H 2 + 3H 2
इस प्रतिक्रिया का उपयोग एसिटिलीन के औद्योगिक उत्पादन के लिए किया जाता है।
चतुर्थ. मीथेन रूपांतरण
जल वाष्प के साथ मीथेन की परस्पर क्रिया की प्रतिक्रिया महत्वपूर्ण है, जिसके परिणामस्वरूप हाइड्रोजन के साथ कार्बन मोनोऑक्साइड (II) का मिश्रण बनता है - "संश्लेषण गैस":
इस प्रतिक्रिया का उपयोग हाइड्रोजन के उत्पादन के लिए किया जाता है। संश्लेषण गैस विभिन्न हाइड्रोकार्बन के उत्पादन के लिए कच्चे माल के रूप में कार्य करती है।
अल्केन्स की तैयारी
अल्केन्स प्राकृतिक स्रोतों (प्राकृतिक और संबंधित गैसों, तेल) से पृथक होते हैं। प्राकृतिक गैस में 95% तक मीथेन होती है। कार्बोहाइड्रेट के जीवाणु प्रसंस्करण (सड़न) के परिणामस्वरूप बनने वाली दलदली गैस की संरचना समान होती है। संबद्ध पेट्रोलियम गैसों में मुख्य रूप से ईथेन, प्रोपेन, ब्यूटेन और आंशिक रूप से पेंटेन शामिल हैं। इन्हें विशेष तेल उपचार संयंत्रों में तेल से अलग किया जाता है। गैस कंडेनसेट स्टेशनों की अनुपस्थिति में, संबंधित पेट्रोलियम गैसों को फ्लेयर्स में जलाया जाता है, जो तेल उत्पादन में एक बेहद नासमझी और बेकार प्रथा है। गैसों के साथ-साथ, तेल को पानी, गंदगी और रेत से शुद्ध किया जाता है, जिसके बाद यह परिवहन के लिए पाइप में प्रवेश करता है। आसवन के दौरान तेल से इसे प्राप्त किया जाता है
100 से अधिक व्यक्तिगत यौगिक, सीधे और शाखित अल्केन्स, साइक्लोअल्केन्स और सुगंधित हाइड्रोकार्बन।
सिंथेटिक तरीकों का भी उपयोग किया जाता है।
- अल्केन्स का टूटना (औद्योगिक विधि)
- असंतृप्त हाइड्रोकार्बन का हाइड्रोजनीकरण:
C n H 2n + H 2 t˚С, Ni या Pd → C n H 2n+2
कम कार्बन परमाणुओं वाले मोनोहेलोऐल्केनों पर धात्विक सोडियम की क्रिया द्वारा अधिक जटिल ऐल्केनों का संश्लेषण:
2CH3–CH2Br+2Na→CH3–CH2–CH2–CH3+2NaBr
वुर्ट्ज़ प्रतिक्रिया केवल एक एल्काइल हैलाइड से तैयारी के लिए समझ में आती है, अन्यथा प्रयोगशाला स्थितियों में अल्केन्स के मिश्रण को अलग करना मुश्किल होता है।
उदाहरण के लिए:
प्रोपेन सी 3 एच 8 के अलावा ब्यूटेन बनता है C 4 H 10 (C 2 H 5 Br के 2 अणुओं से) और ईथेन C 2 H 6 (CH 3 Br के 2 अणुओं से)।
- थर्मल डीकार्बाक्सिलेशन। क्षार के साथ कार्बोक्जिलिक एसिड के लवण का संलयन (डुमास प्रतिक्रिया):
या सामान्य तौर पर
R-COONa + NaOHआर-एच + ना 2 सीओ 3
- कार्बोक्जिलिक एसिड के लवणों का इलेक्ट्रोलिसिस (कोल्बे प्रतिक्रिया):
- आइसोमेराइजेशन। उत्प्रेरक के प्रभाव में, गर्म होने पर, सामान्य संरचना के अल्केन्स आइसोमेराइजेशन से गुजरते हैं - एक शाखित संरचना के साथ अल्केन्स के निर्माण के साथ कार्बन कंकाल की पुनर्व्यवस्था
- तरल हाइड्रोकार्बन मोटर और रॉकेट ईंधन का एक महत्वपूर्ण हिस्सा बनाते हैं और विलायक के रूप में उपयोग किए जाते हैं।
- वैसलीन तेल (15 कार्बन परमाणुओं तक तरल हाइड्रोकार्बन का मिश्रण) एक पारदर्शी, गंधहीन और स्वादहीन तरल है, जिसका उपयोग दवा, इत्र और सौंदर्य प्रसाधनों में किया जाता है।
- वैसलीन (25 तक कार्बन परमाणुओं की संख्या के साथ तरल और ठोस संतृप्त हाइड्रोकार्बन का मिश्रण) का उपयोग दवा में उपयोग किए जाने वाले मलहम की तैयारी के लिए किया जाता है।
- पैराफिन (ठोस अल्केन्स सी का मिश्रण) 19-सी 35 ) - गंध और स्वाद के बिना एक सफेद ठोस द्रव्यमान (एमपी 50-70 डिग्री सेल्सियस) - चिकित्सा में थर्मल प्रक्रियाओं के लिए मोमबत्तियां बनाने, माचिस लगाने और कागज लपेटने के लिए उपयोग किया जाता है। कार्बनिक अम्ल और अल्कोहल, डिटर्जेंट और सर्फेक्टेंट के उत्पादन के लिए कच्चे माल के रूप में कार्य करता है।
- औसत आणविक भार के सामान्य संतृप्त हाइड्रोकार्बन का उपयोग तेल से प्रोटीन के सूक्ष्मजीवविज्ञानी संश्लेषण में पोषक तत्व सब्सट्रेट के रूप में किया जाता है।
- अल्केन्स के हैलोजन डेरिवेटिव का बहुत महत्व है, जिनका उपयोग आगे के संश्लेषण के लिए सॉल्वैंट्स, शीतलक और कच्चे माल के रूप में किया जाता है।
- आधुनिक पेट्रोकेमिकल उद्योग में, संतृप्त हाइड्रोकार्बन विभिन्न कार्बनिक यौगिकों के उत्पादन का आधार हैं, जो प्लास्टिक, रबर, सिंथेटिक फाइबर, डिटर्जेंट और कई अन्य पदार्थों के उत्पादन के लिए मध्यवर्ती प्राप्त करने की प्रक्रियाओं में एक महत्वपूर्ण कच्चा माल है।
सूत्रों का कहना है
- जी.आई. डेरयाबिना, जी.वी. कांतारिया। कार्बनिक रसायन विज्ञान।इलेक्ट्रॉनिक संसाधन.
- आई.आई.नोवोशिंस्काया, एन.एस.नोवोशिंस्काया। कार्बनिक रसायन विज्ञान: हाई स्कूल के छात्रों और आवेदकों के लिए एक मैनुअल। - एम.: ओओओ "पब्लिशिंग हाउस ओनिक्स 21वीं सदी", 2004
- कुज़्मेंको एन.ई., एरेमिन वी.वी., पोपकोव वी.ए. रसायन शास्त्र की शुरुआत. विश्वविद्यालयों में आवेदकों के लिए आधुनिक पाठ्यक्रम। एम.: परीक्षा, 2002.
हाइड्रोकार्बन के विशिष्ट रासायनिक गुण: अल्केन्स, एल्केन्स, डायनेज़, एल्केनीज़, एरोमैटिक हाइड्रोकार्बन
हाइड्रोकार्बन
अल्केन्स हाइड्रोकार्बन होते हैं जिनके अणुओं में परमाणु एकल बंधन से जुड़े होते हैं और जो सामान्य सूत्र $C_(n)H_(2n+2)$ के अनुरूप होते हैं।
मीथेन की सजातीय श्रृंखला
जैसा कि तुम्हें पहले से पता है, होमोलोग्स- ये ऐसे पदार्थ हैं जो संरचना और गुणों में समान हैं और एक या अधिक $CH_2$ समूहों द्वारा भिन्न हैं।
संतृप्त हाइड्रोकार्बन मीथेन की समजातीय श्रृंखला बनाते हैं।
समावयवता और नामकरण
अल्केन्स की विशेषता तथाकथित संरचनात्मक समरूपता है। कार्बन कंकाल की संरचना में संरचनात्मक आइसोमर्स एक दूसरे से भिन्न होते हैं। जैसा कि आप पहले से ही जानते हैं, सबसे सरल अल्केन, जो संरचनात्मक आइसोमर्स द्वारा विशेषता है, ब्यूटेन है:
आइए अल्केन्स के लिए IUPAC नामकरण की मूल बातों पर करीब से नज़र डालें:
1. मुख्य सर्किट का चयन करना.
हाइड्रोकार्बन के नाम का निर्माण मुख्य श्रृंखला की परिभाषा से शुरू होता है - अणु में कार्बन परमाणुओं की सबसे लंबी श्रृंखला, जो मानो इसका आधार है।
2.
मुख्य श्रृंखला के परमाणुओं को संख्याएँ दी गई हैं। मुख्य श्रृंखला के परमाणुओं की संख्या उस सिरे से शुरू होती है जिसके सबसे करीब प्रतिस्थापी होता है (संरचना ए, बी)। यदि प्रतिस्थापी श्रृंखला के अंत से समान दूरी पर स्थित हैं, तो क्रमांकन उस अंत से शुरू होता है जिस पर उनमें से अधिक हैं (संरचना बी)। यदि विभिन्न प्रतिस्थापन श्रृंखला के सिरों से समान दूरी पर स्थित हैं, तो नंबरिंग उस छोर से शुरू होती है जहां वरिष्ठ निकटतम है (संरचना डी)। हाइड्रोकार्बन प्रतिस्थापकों की वरिष्ठता उस क्रम से निर्धारित होती है जिसमें वह अक्षर जिससे उनका नाम शुरू होता है वर्णमाला में आता है: मिथाइल (-$СН_3$), फिर प्रोपाइल ($—СН_2—СН_2—СН_3$), एथिल ($—СН_2 —СН_3$ ) आदि।
कृपया ध्यान दें कि प्रत्यय का नाम प्रत्यय के स्थान पर लगने से बनता है -एकप्रत्यय लगाना -इलसंगत अल्केन के नाम पर।
3. नाम का गठन.
नाम की शुरुआत में, संख्याएं इंगित की जाती हैं - कार्बन परमाणुओं की संख्या जिन पर प्रतिस्थापन स्थित हैं। यदि किसी दिए गए परमाणु में कई प्रतिस्थापन हैं, तो नाम में संबंधित संख्या को अल्पविराम ($2.2-$) से अलग करके दो बार दोहराया जाता है। संख्या के बाद, प्रतिस्थापनों की संख्या एक हाइफ़न के साथ इंगित की जाती है ( डि- दो, तीन- तीन, टेट्रा- चार, पेंटा- पांच) और डिप्टी का नाम ( मिथाइल, एथिल, प्रोपाइल). फिर, रिक्त स्थान या हाइफ़न के बिना, मुख्य श्रृंखला का नाम। मुख्य श्रृंखला को हाइड्रोकार्बन कहा जाता है - मीथेन की समजातीय श्रृंखला का एक सदस्य ( मीथेन, ईथेन, प्रोपेन, आदि।).

जिन पदार्थों के संरचनात्मक सूत्र ऊपर दिये गये हैं उनके नाम इस प्रकार हैं:
- संरचना ए: $2$ -मिथाइलप्रोपेन;
- संरचना बी: $3$ -एथिलहेक्सेन;
- संरचना बी: $2,2,4$ -ट्राइमेथिलपेंटेन;
- संरचना जी: $2$ -मिथाइल$4$-एथिलहेक्सेन.
अल्केन्स के भौतिक और रासायनिक गुण
भौतिक गुण।मीथेन की सजातीय श्रृंखला के पहले चार प्रतिनिधि गैसें हैं। उनमें से सबसे सरल मीथेन है, एक रंगहीन, स्वादहीन और गंधहीन गैस (गैस की गंध, इसे महसूस करने पर, आपको $104$ पर कॉल करने की आवश्यकता है, मर्कैप्टन की गंध से निर्धारित होती है - सल्फर युक्त यौगिक विशेष रूप से मीथेन में उपयोग किए जाते हैं घरेलू और औद्योगिक गैस उपकरण ताकि उनके बगल में स्थित लोग गंध से रिसाव का पता लगा सकें)।
$С_5Н_(12)$ से $С_(15)Н_(32)$ तक की संरचना वाले हाइड्रोकार्बन तरल पदार्थ हैं; भारी हाइड्रोकार्बन ठोस होते हैं।
कार्बन श्रृंखला की लंबाई बढ़ने के साथ अल्केन्स का क्वथनांक और गलनांक धीरे-धीरे बढ़ता है। सभी हाइड्रोकार्बन पानी में खराब घुलनशील होते हैं; तरल हाइड्रोकार्बन सामान्य कार्बनिक विलायक होते हैं।
रासायनिक गुण।
1. प्रतिस्थापन प्रतिक्रियाएँ.अल्केन्स के लिए सबसे विशिष्ट प्रतिक्रियाएँ मुक्त मूलक प्रतिस्थापन प्रतिक्रियाएँ हैं, जिसके दौरान एक हाइड्रोजन परमाणु को हैलोजन परमाणु या कुछ समूह द्वारा प्रतिस्थापित किया जाता है।
आइए हम सबसे विशिष्ट प्रतिक्रियाओं के समीकरण प्रस्तुत करें।
हैलोजनीकरण:
$CH_4+Cl_2→CH_3Cl+HCl$.
अतिरिक्त हैलोजन के मामले में, क्लोरीनीकरण आगे बढ़ सकता है, क्लोरीन के साथ सभी हाइड्रोजन परमाणुओं के पूर्ण प्रतिस्थापन तक:
$CH_3Cl+Cl_2→HCl+(CH_2Cl_2)↙(\text"डाइक्लोरोमेथेन (मिथाइलीन क्लोराइड)")$,
$CH_2Cl_2+Cl_2→HCl+(CHСl_3)↙(\text"ट्राइक्लोरोमेथेन(क्लोरोफॉर्म)")$,
$CHCl_3+Cl_2→HCl+(CCl_4)↙(\text"कार्बन टेट्राक्लोराइड(कार्बन टेट्राक्लोराइड)")$.
परिणामी पदार्थों का व्यापक रूप से कार्बनिक संश्लेषण में विलायक और प्रारंभिक सामग्री के रूप में उपयोग किया जाता है।
2. डीहाइड्रोजनीकरण (हाइड्रोजन का उन्मूलन)।जब अल्केन्स को उच्च तापमान ($400-600°C$) पर उत्प्रेरक ($Pt, Ni, Al_2O_3, Cr_2O_3$) के ऊपर से गुजारा जाता है, तो एक हाइड्रोजन अणु समाप्त हो जाता है और एक एल्कीन बनता है:
$CH_3—CH_3→CH_2=CH_2+H_2$
3. कार्बन श्रृंखला के विनाश के साथ होने वाली प्रतिक्रियाएँ।सभी संतृप्त हाइड्रोकार्बन जल रहे हैंकार्बन डाइऑक्साइड और पानी के निर्माण के साथ। कुछ निश्चित अनुपात में हवा के साथ मिश्रित गैसीय हाइड्रोकार्बन विस्फोट कर सकते हैं। संतृप्त हाइड्रोकार्बन का दहन एक मुक्त रेडिकल एक्ज़ोथिर्मिक प्रतिक्रिया है, जो ईंधन के रूप में अल्केन्स का उपयोग करते समय बहुत महत्वपूर्ण है:
$СН_4+2О_2→СО_2+2Н_2O+880 kJ.$
सामान्य तौर पर, अल्केन्स की दहन प्रतिक्रिया को इस प्रकार लिखा जा सकता है:
$C_(n)H_(2n+2)+((3n+1)/(2))O_2→nCO_2+(n+1)H_2O$
हाइड्रोकार्बन का थर्मल विभाजन:
$C_(n)H_(2n+2)(→)↖(400-500°C)C_(n-k)H_(2(n-k)+2)+C_(k)H_(2k)$
यह प्रक्रिया एक मुक्त कण तंत्र के माध्यम से होती है। तापमान में वृद्धि से कार्बन-कार्बन बंधन का होमोलिटिक दरार होता है और मुक्त कणों का निर्माण होता है:
$R—CH_2CH_2:CH_2—R→R—CH_2CH_2·+·CH_2—R$.
ये रेडिकल एक दूसरे के साथ बातचीत करते हैं, एक हाइड्रोजन परमाणु का आदान-प्रदान करते हैं, एक अल्केन अणु और एक एल्केन अणु बनाते हैं:
$R—CH_2CH_2·+·CH_2—R→R—CH=CH_2+CH_3—R$.
थर्मल अपघटन प्रतिक्रियाएं हाइड्रोकार्बन क्रैकिंग की औद्योगिक प्रक्रिया का आधार हैं। यह प्रक्रिया तेल शोधन का सबसे महत्वपूर्ण चरण है।
जब मीथेन को $1000°C$ के तापमान तक गर्म किया जाता है, तो मीथेन पायरोलिसिस शुरू हो जाता है - सरल पदार्थों में विघटित होना:
$CH_4(→)↖(1000°C)C+2H_2$
$1500°C$ के तापमान तक गर्म करने पर, एसिटिलीन का निर्माण संभव है:
$2CH_4(→)↖(1500°C)CH=CH+3H_2$
4. आइसोमेराइजेशन।जब रैखिक हाइड्रोकार्बन को आइसोमेराइजेशन उत्प्रेरक (एल्यूमीनियम क्लोराइड) के साथ गर्म किया जाता है, तो शाखित कार्बन कंकाल वाले पदार्थ बनते हैं:
5. सुगंधीकरण।श्रृंखला में छह या अधिक कार्बन परमाणुओं वाले अल्केन्स उत्प्रेरक की उपस्थिति में चक्रित होकर बेंजीन और उसके डेरिवेटिव बनाते हैं:

क्या कारण है कि अल्केन्स मुक्त मूलक प्रतिक्रियाओं से गुजरते हैं? एल्केन अणुओं में सभी कार्बन परमाणु $sp^3$ संकरण की स्थिति में हैं। इन पदार्थों के अणु सहसंयोजक गैर-ध्रुवीय $C-C$ (कार्बन-कार्बन) बांड और कमजोर ध्रुवीय $C-H$ (कार्बन-हाइड्रोजन) बांड का उपयोग करके बनाए जाते हैं। उनमें बढ़े हुए या घटे हुए इलेक्ट्रॉन घनत्व, या आसानी से ध्रुवीकरण योग्य बांड वाले क्षेत्र शामिल नहीं हैं, अर्थात। ऐसे बंधन, इलेक्ट्रॉन घनत्व जिसमें बाहरी कारकों (आयनों के इलेक्ट्रोस्टैटिक क्षेत्र) के प्रभाव में बदलाव हो सकता है। नतीजतन, अल्केन्स आवेशित कणों के साथ प्रतिक्रिया नहीं करेंगे, क्योंकि एल्केन अणुओं में बंधन हेटरोलिटिक तंत्र द्वारा नहीं टूटते हैं।
अल्केन्स
असंतृप्त में हाइड्रोकार्बन शामिल होते हैं जिनके अणुओं में कार्बन परमाणुओं के बीच कई बंधन होते हैं। असीमित हैं एल्कीन, एल्केडीन (पॉलीनीस), एल्काइन।रिंग में दोहरे बंधन वाले चक्रीय हाइड्रोकार्बन (साइक्लोअल्केन्स), साथ ही रिंग में कम संख्या में कार्बन परमाणुओं (तीन या चार परमाणु) वाले साइक्लोअल्केन्स में भी एक असंतृप्त चरित्र होता है। असंतृप्ति का गुण इन पदार्थों की अतिरिक्त प्रतिक्रियाओं में प्रवेश करने की क्षमता से जुड़ा है, मुख्य रूप से हाइड्रोजन, संतृप्त, या संतृप्त, हाइड्रोकार्बन - अल्केन्स के निर्माण के साथ।
एल्केन्स एसाइक्लिक हाइड्रोकार्बन हैं जिनमें अणु में एकल बांड के अलावा, कार्बन परमाणुओं के बीच एक दोहरा बंधन होता है और सामान्य सूत्र $C_(n)H_(2n)$ के अनुरूप होता है।
इसका दूसरा नाम है ओलेफ़िन- एल्केन्स को असंतृप्त फैटी एसिड (ओलिक, लिनोलिक) के साथ सादृश्य द्वारा प्राप्त किया गया था, जिसके अवशेष तरल वसा - तेल (अक्षांश से) का हिस्सा हैं। ओलियम- तेल)।
एथीन की सजातीय श्रृंखला
अशाखित एल्केन्स एथीन (एथिलीन) की समजात श्रृंखला बनाते हैं:
$С_2Н_4$ - एथीन, $С_3Н_6$ - प्रोपेन, $С_4Н_8$ - ब्यूटेन, $С_5Н_(10)$ - पेंटीन, $С_6Н_(12)$ - हेक्सेन, आदि।
समावयवता और नामकरण
अल्केन्स की तरह, अल्केन्स को संरचनात्मक आइसोमेरिज्म की विशेषता होती है। कार्बन कंकाल की संरचना में संरचनात्मक आइसोमर्स एक दूसरे से भिन्न होते हैं। संरचनात्मक आइसोमर्स की विशेषता वाला सबसे सरल एल्कीन ब्यूटेन है:

एक विशेष प्रकार की संरचनात्मक समावयवता दोहरे बंधन की स्थिति का समावयवता है:
$CH_3—(CH_2)↙(ब्यूटीन-1)—CH=CH_2$ $CH_3—(CH=CH)↙(ब्यूटीन-2)—CH_3$
एकल कार्बन-कार्बन बंधन के चारों ओर कार्बन परमाणुओं का लगभग मुक्त घूर्णन संभव है, इसलिए अल्केन अणु विभिन्न प्रकार के आकार ले सकते हैं। दोहरे बंधन के चारों ओर घूमना असंभव है, जिससे एल्केन्स में एक अन्य प्रकार के आइसोमेरिज्म की उपस्थिति होती है - ज्यामितीय, या सीआईएस-ट्रांस आइसोमेरिज्म।

सीआईएस-आइसोमर्स भिन्न होते हैं ट्रान्स-$π$ बंधन के तल के सापेक्ष आणविक टुकड़ों (इस मामले में, मिथाइल समूह) की स्थानिक व्यवस्था द्वारा आइसोमर्स, और, परिणामस्वरूप, उनके गुणों द्वारा।
एल्केन्स साइक्लोअल्केन्स (इंटरक्लास आइसोमेरिज्म) के लिए आइसोमेरिक हैं, उदाहरण के लिए:

एल्केन्स के लिए IUPAC नामकरण अल्केन्स के समान है।
1. मुख्य सर्किट का चयन करना.
हाइड्रोकार्बन का नामकरण मुख्य श्रृंखला की पहचान से शुरू होता है - अणु में कार्बन परमाणुओं की सबसे लंबी श्रृंखला। एल्केन्स के मामले में, मुख्य श्रृंखला में एक दोहरा बंधन होना चाहिए।
2. मुख्य श्रृंखला परमाणुओं की संख्या.
मुख्य श्रृंखला के परमाणुओं की संख्या उस सिरे से शुरू होती है जहां दोहरा बंधन निकटतम होता है। उदाहरण के लिए, सही कनेक्शन नाम है:

$5$-मिथाइलहेक्सिन-$2$, न कि $2$-मिथाइलहेक्सिन-$4$, जैसा कि कोई उम्मीद कर सकता है।
यदि दोहरे बंधन की स्थिति श्रृंखला में परमाणुओं की संख्या की शुरुआत निर्धारित नहीं कर सकती है, तो यह संतृप्त हाइड्रोकार्बन की तरह, प्रतिस्थापन की स्थिति से निर्धारित होती है।

3. नाम का गठन.
ऐल्केनों के नाम ऐल्केनों के नामों के समान ही बनते हैं। नाम के अंत में, कार्बन परमाणु की संख्या इंगित करें जिस पर दोहरा बंधन शुरू होता है, और एक प्रत्यय इंगित करता है कि यौगिक अल्केन्स के वर्ग से संबंधित है - -एन.
उदाहरण के लिए:

एल्कीन के भौतिक और रासायनिक गुण
भौतिक गुण।ऐल्कीनों की समजात श्रृंखला के पहले तीन प्रतिनिधि गैसें हैं; संरचना के पदार्थ $С_5Н_(10)$ - $С_(16)Н_(32)$ - तरल पदार्थ; उच्च ऐल्कीन ठोस होते हैं।
यौगिकों के बढ़ते आणविक भार के साथ क्वथनांक और गलनांक स्वाभाविक रूप से बढ़ते हैं।
रासायनिक गुण।
अतिरिक्त प्रतिक्रियाएँ.आइए हम याद करें कि असंतृप्त हाइड्रोकार्बन - एल्केन्स के प्रतिनिधियों की एक विशिष्ट विशेषता अतिरिक्त प्रतिक्रियाओं में प्रवेश करने की क्षमता है। इनमें से अधिकांश प्रतिक्रियाएँ तंत्र के अनुसार आगे बढ़ती हैं
1. ऐल्कीनों का हाइड्रोजनीकरण।एल्कीन हाइड्रोजनीकरण उत्प्रेरक, धातु - प्लैटिनम, पैलेडियम, निकल की उपस्थिति में हाइड्रोजन जोड़ने में सक्षम हैं:
$CH_3—CH_2—CH=CH_2+H_2(→)↖(Pt)CH_3—CH_2—CH_2—CH_3$.
यह प्रतिक्रिया वायुमंडलीय और ऊंचे दबाव पर होती है और इसके लिए उच्च तापमान की आवश्यकता नहीं होती है, क्योंकि ऊष्माक्षेपी है. जब तापमान बढ़ता है, तो वही उत्प्रेरक विपरीत प्रतिक्रिया-डीहाइड्रोजनीकरण का कारण बन सकते हैं।
2. हैलोजनीकरण (हैलोजन का योग)।ब्रोमीन जल या कार्बनिक विलायक ($CCl_4$) में ब्रोमीन के घोल के साथ एल्कीन की परस्पर क्रिया से एल्कीन में हैलोजन अणु के शामिल होने और डाइहैलोजन एल्केन्स के निर्माण के परिणामस्वरूप इन समाधानों का तेजी से रंग खराब हो जाता है:
$CH_2=CH_2+Br_2→CH_2Br—CH_2Br$.
3.
$CH_3-(CH)↙(प्रोपीन)=CH_2+HBr→CH_3-(CHBr)↙(2-ब्रोमोप्रोपीन)-CH_3$
यह प्रतिक्रिया पालन करती है मार्कोवनिकोव का नियम:
जब एक हाइड्रोजन हैलाइड को एक एल्कीन में जोड़ा जाता है, तो हाइड्रोजन को अधिक हाइड्रोजनीकृत कार्बन परमाणु में जोड़ा जाता है, अर्थात। वह परमाणु जिस पर अधिक हाइड्रोजन परमाणु होते हैं, और हैलोजन कम हाइड्रोजनीकृत होता है।
एल्केन्स के जलयोजन से अल्कोहल का निर्माण होता है। उदाहरण के लिए, एथीन में पानी मिलाना एथिल अल्कोहल के उत्पादन के औद्योगिक तरीकों में से एक का आधार है:
$(CH_2)↙(ethene)=CH_2+H_2O(→)↖(t,H_3PO_4)CH_3-(CH_2OH)↙(इथेनॉल)$
ध्यान दें कि प्राथमिक अल्कोहल (प्राथमिक कार्बन पर हाइड्रॉक्सो समूह के साथ) केवल तभी बनता है जब एथीन हाइड्रेटेड होता है। जब प्रोपेन या अन्य एल्केन्स हाइड्रेटेड होते हैं, तो द्वितीयक अल्कोहल बनते हैं।

यह प्रतिक्रिया मार्कोवनिकोव के नियम के अनुसार भी आगे बढ़ती है - एक हाइड्रोजन धनायन अधिक हाइड्रोजनीकृत कार्बन परमाणु से जुड़ता है, और एक हाइड्रॉक्सो समूह कम हाइड्रोजनीकृत परमाणु से जुड़ता है।
5. पॉलिमराइजेशन.जोड़ का एक विशेष मामला एल्केन्स की पोलीमराइज़ेशन प्रतिक्रिया है:
$nCH_2(=)↙(एथीन)CH_2(→)↖(UV प्रकाश, R)(...(-CH_2-CH_2-)↙(पॉलीथीन)...)_n$
यह अतिरिक्त प्रतिक्रिया एक मुक्त मूलक तंत्र के माध्यम से होती है।
6. ऑक्सीकरण प्रतिक्रिया.
किसी भी कार्बनिक यौगिक की तरह, एल्केन्स ऑक्सीजन में जलकर $СО_2$ और $Н_2О$ बनाते हैं:
$СН_2=СН_2+3О_2→2СО_2+2Н_2О$.
सामान्य रूप में:
$C_(n)H_(2n)+(3n)/(2)O_2→nCO_2+nH_2O$
अल्केन्स के विपरीत, जो समाधानों में ऑक्सीकरण के प्रति प्रतिरोधी होते हैं, अल्केन्स पोटेशियम परमैंगनेट समाधानों द्वारा आसानी से ऑक्सीकृत हो जाते हैं। तटस्थ या क्षारीय समाधानों में, एल्केन्स को डायोल्स (डायहाइड्रिक अल्कोहल) में ऑक्सीकरण किया जाता है, और हाइड्रॉक्सिल समूहों को उन परमाणुओं में जोड़ा जाता है जिनके बीच ऑक्सीकरण से पहले एक दोहरा बंधन मौजूद था:

अल्केडिएन्स (डायन हाइड्रोकार्बन)
एल्काडिएन्स एसाइक्लिक हाइड्रोकार्बन हैं जिनमें अणु में एकल बांड के अलावा, कार्बन परमाणुओं के बीच दो दोहरे बंधन होते हैं और सामान्य सूत्र $C_(n)H_(2n-2)$ के अनुरूप होते हैं।
दोहरे बंधनों की सापेक्ष व्यवस्था के आधार पर, तीन प्रकार के डायन प्रतिष्ठित हैं:
- एल्केडिएन्स के साथ संचयीदोहरे बांड की व्यवस्था:
- एल्केडिएन्स के साथ संयुग्मितदोहरा बंधन;
$CH_2=CH—CH=CH_2$;
- एल्केडिएन्स के साथ एकाकीदोहरा बंधन
$CH_2=CH—CH_2—CH=CH_2$.
ये तीन प्रकार के एल्केडीन संरचना और गुणों में एक दूसरे से काफी भिन्न होते हैं। संचयी बंधों वाले एल्काडिएन्स में केंद्रीय कार्बन परमाणु (वह परमाणु जो दो दोहरे बंधन बनाता है) $sp$-संकरण की स्थिति में है। यह एक ही रेखा पर स्थित और विपरीत दिशाओं में निर्देशित दो $σ$-बंध बनाता है, और लंबवत तल में स्थित दो $π$-बंध बनाता है। $π$-बंध प्रत्येक कार्बन परमाणु के असंकरित पी-ऑर्बिटल्स के कारण बनते हैं। पृथक दोहरे बंधन वाले एल्काडिएन्स के गुण बहुत विशिष्ट हैं, क्योंकि संयुग्मित $π$-बंधन एक दूसरे को महत्वपूर्ण रूप से प्रभावित करते हैं।
संयुग्मित $π$-बॉन्ड बनाने वाले पी-ऑर्बिटल्स व्यावहारिक रूप से एक एकल प्रणाली का गठन करते हैं (इसे $π$-सिस्टम कहा जाता है), क्योंकि पड़ोसी $π$-बॉन्ड के पी-ऑर्बिटल्स आंशिक रूप से ओवरलैप होते हैं।
समावयवता और नामकरण
अल्काडिएन्स को संरचनात्मक आइसोमेरिज्म और सीआईएस-, ट्रांस-आइसोमेरिज्म दोनों की विशेषता है।
संरचनात्मक समरूपता.
— कार्बन कंकाल समरूपता:

— एकाधिक बंधों की स्थिति का समावयवता:
$(CH_2=CH—CH=CH_2)↙(ब्यूटाडीन-1,3)$ $(CH_2=C=CH—CH_3)↙(ब्यूटाडीन-1,2)$
सीआईएस-, ट्रांस-समरूपता (स्थानिक और ज्यामितीय)
उदाहरण के लिए:
अल्काडिएन्स एल्काइन्स और साइक्लोअल्कीन्स के वर्गों के आइसोमेरिक यौगिक हैं।
एल्केडीन का नाम बनाते समय, दोहरे बंधनों की संख्या इंगित की जाती है। मुख्य श्रृंखला में आवश्यक रूप से दो एकाधिक बांड होने चाहिए।
उदाहरण के लिए:

एल्केडिएन्स के भौतिक और रासायनिक गुण
भौतिक गुण।
सामान्य परिस्थितियों में, प्रोपेनडाईन-1,2, ब्यूटाडीन-1,3 गैसें हैं, 2-मिथाइलब्यूटाडीन-1,3 एक अस्थिर तरल है। पृथक दोहरे बंधन वाले अल्काडिएन्स (उनमें से सबसे सरल पेंटाडीन-1,4 है) तरल हैं। उच्च डायन ठोस होते हैं।
रासायनिक गुण।
पृथक दोहरे बंधन वाले एल्केडीन के रासायनिक गुण एल्कीन के गुणों से बहुत कम भिन्न होते हैं। संयुग्मित बंधों वाले अल्काडिएन्स में कुछ विशेष विशेषताएं होती हैं।
1. अतिरिक्त प्रतिक्रियाएँ.अल्काडिएन्स हाइड्रोजन, हैलोजन और हाइड्रोजन हैलाइड जोड़ने में सक्षम हैं।
संयुग्मित बंधों के साथ एल्काडिएन्स को जोड़ने की एक विशेष विशेषता स्थिति 1 और 2, और स्थिति 1 और 4 दोनों में अणुओं को जोड़ने की क्षमता है।

उत्पादों का अनुपात संबंधित प्रतिक्रियाओं को पूरा करने की स्थितियों और विधि पर निर्भर करता है।
2.पॉलिमराइजेशन प्रतिक्रिया.डायन की सबसे महत्वपूर्ण संपत्ति धनायनों या मुक्त कणों के प्रभाव में पोलीमराइज़ करने की क्षमता है। इन यौगिकों का पोलीमराइजेशन सिंथेटिक रबर का आधार है:
$nCH_2=(CH—CH=CH_2)↙(ब्यूटाडीन-1,3)→((... —CH_2—CH=CH—CH_2— ...)_n)↙(\text"सिंथेटिक ब्यूटाडीन रबर")$ .
संयुग्मित डायन का पॉलिमराइजेशन 1,4-जोड़ के रूप में आगे बढ़ता है।
इस मामले में, दोहरा बंधन इकाई में केंद्रीय हो जाता है, और प्राथमिक इकाई, बदले में, दोनों को ले सकती है सीआईएस-, इसलिए ट्रान्स-विन्यास

एल्काइन्स
एल्काइन एसाइक्लिक हाइड्रोकार्बन हैं जिनमें अणु में एकल बांड के अलावा, कार्बन परमाणुओं के बीच एक ट्रिपल बांड होता है और सामान्य सूत्र $C_(n)H_(2n-2)$ के अनुरूप होता है।
एथाइन की सजातीय श्रृंखला
सीधी-श्रृंखला वाले एल्काइन एथिन (एसिटिलीन) की समजातीय श्रृंखला बनाते हैं:
$С_2Н_2$ - एथिन, $С_3Н_4$ - प्रोपाइन, $С_4Н_6$ - ब्यूटिन, $С_5Н_8$ - पेंटाइन, $С_6Н_(10)$ - हेक्सिन, आदि।
समावयवता और नामकरण
एल्केन्स की तरह, एल्केन्स को संरचनात्मक आइसोमेरिज्म की विशेषता होती है: कार्बन कंकाल का आइसोमेरिज्म और एकाधिक बंधन की स्थिति का आइसोमेरिज्म। सबसे सरल एल्काइन, जो एल्काइन वर्ग की एकाधिक बंधन स्थिति के संरचनात्मक आइसोमर्स द्वारा विशेषता है, ब्यूटिन है:
$СН_3—(СН_2)↙(butine-1)—С≡СН$ $СН_3—(С≡С)↙(butine-2)—СН_3$
एल्केनीज़ में कार्बन कंकाल का आइसोमेरिज्म संभव है, जो पेंटाइन से शुरू होता है:

चूंकि ट्रिपल बॉन्ड कार्बन श्रृंखला की एक रैखिक संरचना मानता है, इसलिए ज्यामितीय ( सीआईएस-, ट्रांस-) ऐल्काइनों के लिए समावयवता असंभव है।
इस वर्ग के हाइड्रोकार्बन अणुओं में त्रिबंध की उपस्थिति प्रत्यय द्वारा परिलक्षित होती है -में, और श्रृंखला में इसकी स्थिति कार्बन परमाणु की संख्या है।
उदाहरण के लिए:

कुछ अन्य वर्गों के यौगिक एल्काइनों के लिए आइसोमेरिक हैं। इस प्रकार, रासायनिक सूत्र $C_6H_(10)$ में हेक्साइन (एल्केनीन), हेक्साडीन (एल्केडीन) और साइक्लोहेक्सिन (साइक्लोअल्कीन) हैं:

एल्केनीज़ के भौतिक और रासायनिक गुण
भौतिक गुण।यौगिकों के बढ़ते आणविक भार के साथ एल्काइनों के साथ-साथ एल्केनीज़ के क्वथनांक और गलनांक स्वाभाविक रूप से बढ़ते हैं।
एल्काइन्स में एक विशिष्ट गंध होती है। वे एल्केन और एल्केन की तुलना में पानी में अधिक घुलनशील होते हैं।
रासायनिक गुण।
अतिरिक्त प्रतिक्रियाएँ.एल्केनीज़ असंतृप्त यौगिक हैं और अतिरिक्त प्रतिक्रियाओं से गुजरते हैं। अधिकतर प्रतिक्रियाएँ इलेक्ट्रोफिलिक जोड़.
1. हैलोजनीकरण (हलोजन अणु का योग)।एक एल्काइन दो हैलोजन अणुओं (क्लोरीन, ब्रोमीन) को जोड़ने में सक्षम है:
$CH≡CH+Br_2→(CHBr=CHBr)↙(1,2-डाइब्रोमोएथेन),$
$CHBr=CHBr+Br_2→(CHBr_2-CHBr_2)↙(1,1,2,2-टेट्राब्रोमोएथेन)$
2. हाइड्रोहैलोजनीकरण (हाइड्रोजन हैलाइड का योग)।हाइड्रोजन हैलाइड की अतिरिक्त प्रतिक्रिया, जो एक इलेक्ट्रोफिलिक तंत्र के माध्यम से होती है, दो चरणों में भी होती है, और दोनों चरणों में मार्कोवनिकोव नियम संतुष्ट होता है:
$CH_3-C≡CH+Br→(CH_3-CBr=CH_2)↙(2-ब्रोमोप्रोपीन),$
$CH_3-CBr=CH_2+HBr→(CH_3-CHBr_2-CH_3)↙(2,2-डाइब्रोमोप्रोपेन)$
3. जलयोजन (पानी मिलाना)।कीटोन्स और एल्डिहाइड के औद्योगिक संश्लेषण के लिए पानी जोड़ने (जलयोजन) की प्रतिक्रिया का बहुत महत्व है, जिसे कहा जाता है कुचेरोव की प्रतिक्रिया:
4. एल्काइनों का हाइड्रोजनीकरण।एल्काइन्स धातु उत्प्रेरक ($Pt, Pd, Ni$) की उपस्थिति में हाइड्रोजन जोड़ते हैं:
$R-C≡C-R+H_2(→)↖(Pt)R-CH=CH-R,$
$R-CH=CH-R+H_2(→)↖(Pt)R-CH_2-CH_2-R$
चूँकि ट्रिपल बॉन्ड में दो प्रतिक्रियाशील $π$ बॉन्ड होते हैं, अल्केन्स चरणबद्ध तरीके से हाइड्रोजन जोड़ते हैं:
1) ट्रिमराइजेशन।
जब एथाइन को सक्रिय कार्बन के ऊपर प्रवाहित किया जाता है, तो उत्पादों का मिश्रण बनता है, जिनमें से एक बेंजीन है:

2) डिमराइजेशन.
एसिटिलीन के ट्रिमराइजेशन के अलावा, इसका डिमराइजेशन संभव है। मोनोवैलेंट कॉपर लवण के प्रभाव में, विनाइल एसिटिलीन बनता है:
$2HC≡CH→(HC≡C-CH=CH_2)↙(\text"butene-1-in-3(vinylacetylene)")$
इस पदार्थ का उपयोग क्लोरोप्रीन के उत्पादन के लिए किया जाता है:
$HC≡C-CH=CH_2+HCl(→)↖(CaCl)H_2C=(CCl-CH)↙(क्लोरोप्रीन)=CH_2$
जिसके पोलीमराइजेशन से क्लोरोप्रीन रबर प्राप्त होता है:
$nH_2C=CCl-CH=CH_2→(...-H_2C-CCl=CH-CH_2-...)_n$
एल्काइनों का ऑक्सीकरण.
एथिन (एसिटिलीन) ऑक्सीजन में जलता है, जिससे बहुत अधिक मात्रा में गर्मी निकलती है:
$2C_2H_2+5O_2→4CO_2+2H_2O+2600kJ$ ऑक्सीजन-एसिटिलीन टॉर्च की क्रिया इस प्रतिक्रिया पर आधारित होती है, जिसकी लौ का तापमान बहुत अधिक ($3000°C$ से अधिक) होता है, जो इसे काटने के लिए उपयोग करने की अनुमति देता है और वेल्डिंग धातुएँ।
हवा में, एसिटिलीन धुएँ के रंग की लौ के साथ जलता है, क्योंकि इसके अणु में कार्बन की मात्रा ईथेन और एथीन के अणुओं की तुलना में अधिक होती है।
एल्कीन, एल्कीन की तरह, पोटेशियम परमैंगनेट के अम्लीय घोल का रंग फीका कर देते हैं; इस स्थिति में, एकाधिक बंधन नष्ट हो जाता है।
ऑक्सीजन युक्त यौगिकों के उत्पादन के लिए मुख्य तरीकों की विशेषता वाली प्रतिक्रियाएं
1. हैलोऐल्केनों का जल अपघटन।आप पहले से ही जानते हैं कि जब ऐल्कोहॉल हाइड्रोजन हैलाइड के साथ अभिक्रिया करता है तो हैलोकेनैल्केन का निर्माण एक प्रतिवर्ती प्रतिक्रिया होती है। इसलिए, यह स्पष्ट है कि अल्कोहल प्राप्त किया जा सकता है हैलोऐल्केन का जल अपघटन- पानी के साथ इन यौगिकों की प्रतिक्रियाएँ:
$R-Cl+NaOH(→)↖(H_2O)R-OH+NaCl+H_2O$
पॉलीहाइड्रिक अल्कोहल प्रति अणु एक से अधिक हैलोजन परमाणु वाले हैलोऐल्केन के हाइड्रोलिसिस द्वारा प्राप्त किया जा सकता है। उदाहरण के लिए:
2. ऐल्कीनों का जलयोजन- एल्कीन अणु के $π$ बंधन के माध्यम से पानी जोड़ना - आप पहले से ही परिचित हैं, उदाहरण के लिए:
$(CH_2=CH_2)↙(एथीन)+H_2O(→)↖(H^(+))(C_2H_5OH)↙(इथेनॉल)$
मार्कोवनिकोव के नियम के अनुसार, प्रोपेन के जलयोजन से द्वितीयक अल्कोहल - प्रोपेनॉल-2 का निर्माण होता है:

3. एल्डिहाइड और कीटोन का हाइड्रोजनीकरण।आप पहले से ही जानते हैं कि हल्की परिस्थितियों में अल्कोहल के ऑक्सीकरण से एल्डिहाइड या कीटोन का निर्माण होता है। यह स्पष्ट है कि एल्डीहाइड और कीटोन के हाइड्रोजनीकरण (हाइड्रोजन के साथ कमी, हाइड्रोजन का योग) द्वारा अल्कोहल प्राप्त किया जा सकता है:

4. ऐल्कीनों का ऑक्सीकरण।ग्लाइकोल, जैसा कि पहले ही उल्लेख किया गया है, पोटेशियम परमैंगनेट के जलीय घोल के साथ एल्केन्स के ऑक्सीकरण द्वारा प्राप्त किया जा सकता है। उदाहरण के लिए, एथिलीन ग्लाइकॉल (एथेनेडिओल-1,2) एथिलीन (एथीन) के ऑक्सीकरण से बनता है:
$CH_2=CH_2+[O]+H_2O(→)↖(KMnO_4)HO-CH_2-CH_2-OH$
5. अल्कोहल उत्पादन की विशिष्ट विधियाँ।कुछ अल्कोहल उन तरीकों का उपयोग करके प्राप्त किए जाते हैं जो उनके लिए अद्वितीय होते हैं। इस प्रकार, उत्प्रेरक (जिंक ऑक्साइड) की सतह पर ऊंचे दबाव और उच्च तापमान पर कार्बन मोनोऑक्साइड (II) (कार्बन मोनोऑक्साइड) के साथ हाइड्रोजन की परस्पर क्रिया द्वारा औद्योगिक रूप से मेथनॉल का उत्पादन किया जाता है:
$CO+2H_2(→)↖(t,p,ZnO)CH_3-OH$
इस प्रतिक्रिया के लिए आवश्यक कार्बन मोनोऑक्साइड और हाइड्रोजन का मिश्रण, जिसे संश्लेषण गैस ($CO + nH_2O$) भी कहा जाता है, गर्म कोयले पर जल वाष्प प्रवाहित करके प्राप्त किया जाता है:
$C+H_2O(→)↖(t)CO+H_2-Q$
6. ग्लूकोज का किण्वन.एथिल (वाइन) अल्कोहल के उत्पादन की यह विधि मनुष्य को प्राचीन काल से ज्ञात है:
$(C_6H_(12)O_6)↙(ग्लूकोज)(→)↖(खमीर)2C_2H_5OH+2CO_2$
एल्डिहाइड और कीटोन के उत्पादन की विधियाँ
एल्डिहाइड और कीटोन का उत्पादन किया जा सकता है ऑक्सीकरणया अल्कोहल का डिहाइड्रोजनीकरण. आइए हम एक बार फिर ध्यान दें कि प्राथमिक अल्कोहल के ऑक्सीकरण या डीहाइड्रोजनीकरण से एल्डिहाइड और द्वितीयक अल्कोहल से कीटोन उत्पन्न हो सकते हैं:

कुचेरोव की प्रतिक्रिया. जलयोजन प्रतिक्रिया के परिणामस्वरूप, एसिटिलीन एसिटालडिहाइड का उत्पादन करता है, और एसिटिलीन होमोलॉग से कीटोन प्राप्त होते हैं:

गर्म होने पर कैल्शियमया बेरियम लवणकार्बोक्जिलिक एसिड कीटोन और धातु कार्बोनेट बनाते हैं:

कार्बोक्जिलिक एसिड के उत्पादन की विधियाँ
प्राथमिक एल्डिहाइड अल्कोहल के ऑक्सीकरण द्वारा कार्बोक्जिलिक एसिड तैयार किया जा सकता है:

सुगंधित कार्बोक्जिलिक एसिड बेंजीन होमोलॉग के ऑक्सीकरण से बनते हैं:

विभिन्न कार्बोक्जिलिक एसिड डेरिवेटिव के हाइड्रोलिसिस से भी एसिड बनता है। इस प्रकार, एस्टर के हाइड्रोलिसिस से अल्कोहल और कार्बोक्जिलिक एसिड उत्पन्न होता है। जैसा कि ऊपर उल्लेख किया गया है, एसिड-उत्प्रेरित एस्टरीफिकेशन और हाइड्रोलिसिस प्रतिक्रियाएं प्रतिवर्ती हैं:
क्षार के जलीय घोल के प्रभाव में एस्टर का हाइड्रोलिसिस अपरिवर्तनीय रूप से होता है; इस मामले में, एसिड नहीं, बल्कि इसका नमक एस्टर से बनता है।
अल्केन्स। अल्केन्स की संरचना
हाइड्रोकार्बन (पैराफिन)- स्निग्ध (गैर-चक्रीय) संतृप्त हाइड्रोकार्बन, जिसमें कार्बन परमाणु सीधी या शाखित श्रृंखलाओं में सरल (एकल) बंधों द्वारा एक दूसरे से जुड़े होते हैं।
अल्केन्स का सामान्य सूत्र होता है सी एन एच 2 एन +2 , कहाँ एन– कार्बन परमाणुओं की संख्या.
रासायनिक संरचना। वाल्कन में दो प्रकार के रासायनिक बंधन होते हैं:
एस-एसऔर श.
सी-सी बंधन सहसंयोजक गैर-ध्रुवीय है। सी-एच बंधन सहसंयोजक, कमजोर ध्रुवीय है, क्योंकि कार्बन और हाइड्रोजन इलेक्ट्रोनगेटिविटी में करीब हैं (कार्बन के लिए 2.5 और हाइड्रोजन के लिए 2.1)। कार्बन और हाइड्रोजन परमाणुओं के साझा इलेक्ट्रॉन जोड़े के कारण अल्केन्स में सहसंयोजक बंधों का निर्माण इलेक्ट्रॉनिक सूत्रों का उपयोग करके दिखाया जा सकता है:
इलेक्ट्रॉनिक और संरचनात्मक सूत्र प्रतिबिंबित करते हैं रासायनिक संरचना, लेकिन इसके बारे में कोई विचार न दें अणुओं की स्थानिक संरचना, जो पदार्थ के गुणों को महत्वपूर्ण रूप से प्रभावित करता है।
स्थानिक संरचना , अर्थात। अंतरिक्ष में किसी अणु के परमाणुओं की सापेक्ष व्यवस्था इन परमाणुओं के परमाणु कक्षकों (एओ) की दिशा पर निर्भर करती है। हाइड्रोकार्बन में, मुख्य भूमिका कार्बन के परमाणु कक्षाओं के स्थानिक अभिविन्यास द्वारा निभाई जाती है, क्योंकि हाइड्रोजन परमाणु के गोलाकार 1s-AO में एक विशिष्ट अभिविन्यास का अभाव होता है।
कार्बन एओ की स्थानिक व्यवस्था, बदले में, इसके संकरण के प्रकार पर निर्भर करती है। अल्केन्स में संतृप्त कार्बन परमाणु चार अन्य परमाणुओं से बंधा होता है। इसलिए, इसकी अवस्था sp 3 संकरण से मेल खाती है। इस मामले में, चार एसपी 3-हाइब्रिड कार्बन एओ में से प्रत्येक हाइड्रोजन के एस-एओ के साथ या किसी अन्य कार्बन परमाणु के एसपी 3-एओ के साथ अक्षीय (-) ओवरलैप में भाग लेता है, जिससे -सीएच या सी-सी बांड बनता है।

कार्बन के चार -बंध अंतरिक्ष में 109 o 28" के चतुष्फलकीय कोण पर निर्देशित होते हैं। इसलिए, अल्केन्स के सबसे सरल प्रतिनिधि - मीथेन सीएच 4 - के अणु में एक चतुष्फलक का आकार होता है, जिसके केंद्र में एक होता है कार्बन परमाणु, और शीर्ष पर हाइड्रोजन परमाणु हैं:

H-C-H बांड कोण 109°28' है। मीथेन की स्थानिक संरचना को वॉल्यूमेट्रिक (स्केल) और बॉल-एंड-स्टिक मॉडल का उपयोग करके दिखाया जा सकता है।

रिकॉर्डिंग के लिए स्थानिक (स्टीरियोकेमिकल) सूत्र का उपयोग करना सुविधाजनक है।

अगले समरूप के अणु में - ईथेन सी 2 एच 6 - दो टेट्राहेड्रल एसपी 3 - कार्बन परमाणु एक अधिक जटिल स्थानिक संरचना बनाते हैं:

2 से अधिक कार्बन परमाणुओं वाले अल्केन अणुओं की विशेषता घुमावदार आकृतियाँ हैं।

नामपद्धति
IUPAC नामकरण के अनुसार, संतृप्त हाइड्रोकार्बन के नामों की विशेषता प्रत्यय से होती है -एक. पहले चार हाइड्रोकार्बन के ऐतिहासिक रूप से स्थापित नाम हैं, पांचवें से शुरू होकर, हाइड्रोकार्बन का नाम कार्बन परमाणुओं की संबंधित संख्या के ग्रीक नाम पर आधारित है।
कार्बन परमाणुओं की सामान्य श्रृंखला वाले हाइड्रोकार्बन के निम्नलिखित नाम हैं:
| सीएच 4 - मीथेन | सीएच 3 -(सीएच 2) 5 - सीएच 3 - हेप्टेन |
शाखित श्रृंखला हाइड्रोकार्बन के नाम इस प्रकार बनाए गए हैं:
1. इस यौगिक का नाम मुख्य श्रृंखला में कार्बन परमाणुओं की संख्या के अनुरूप हाइड्रोकार्बन के नाम पर आधारित है।
कार्बन परमाणुओं की मुख्य श्रृंखला मानी जाती है:
ए) सबसे लंबा;
बी) सबसे जटिल (शाखाओं की अधिकतम संख्या के साथ)। यदि हाइड्रोकार्बन में दो या दो से अधिक समान रूप से लंबी श्रृंखलाओं को प्रतिष्ठित किया जा सकता है, तो सबसे बड़ी संख्या में शाखाओं वाली श्रृंखला को मुख्य के रूप में चुना जाता है:

2. मुख्य श्रृंखला स्थापित करने के बाद कार्बन परमाणुओं का पुनः क्रमांकन करना आवश्यक है। क्रमांकन श्रृंखला के उस सिरे से शुरू होता है जिसमें कोई भी एल्काइल निकटतम होता है। यदि अलग-अलग एल्काइल श्रृंखला के दोनों सिरों से समान दूरी पर स्थित हैं, तो नंबरिंग उस छोर से शुरू होती है, जहां कम संख्या में कार्बन परमाणुओं वाला रेडिकल करीब होता है (मिथाइल, एथिल, प्रोपाइल, आदि)। उदाहरण के लिए:


यदि समान रेडिकल जो नंबरिंग की शुरुआत निर्धारित करते हैं, श्रृंखला के दोनों सिरों से समान दूरी पर स्थित हैं, लेकिन उनमें से एक तरफ दूसरे की तुलना में अधिक हैं, तो नंबरिंग उस अंत से शुरू होती है जहां शाखाओं की संख्या अधिक होती है: 
2, 2, 4-ट्राइमेथिलपेंटेन

2, 3, 6-ट्राइमेथिलहेप्टेन
किसी यौगिक का नामकरण करते समय, पहले प्रतिस्थापकों को वर्णानुक्रम में सूचीबद्ध करें (अंकों को ध्यान में नहीं रखा जाता है), और मूलांक के नाम से पहले वे मुख्य श्रृंखला के कार्बन परमाणु की संख्या के अनुरूप एक संख्या डालते हैं जिस पर यह मूलक स्थित है . इसके बाद, शब्द को हाइफ़न के साथ संख्याओं से अलग करते हुए, कार्बन परमाणुओं की मुख्य श्रृंखला के अनुरूप हाइड्रोकार्बन का नाम दिया जाता है।
यदि किसी हाइड्रोकार्बन में कई समान रेडिकल होते हैं, तो उनकी संख्या को ग्रीक अंक (डी, ट्राई, टेट्रा, आदि) द्वारा दर्शाया जाता है और इन रेडिकल के नाम के सामने रखा जाता है, और उनकी स्थिति, हमेशा की तरह, संख्याओं द्वारा इंगित की जाती है। संख्याओं को अल्पविराम द्वारा अलग किया जाता है, उनकी वृद्धि के क्रम में व्यवस्थित किया जाता है और इन मूलांकों के नाम से पहले रखा जाता है, उन्हें एक हाइफ़न के साथ अलग किया जाता है।
साइक्लोअल्केन्स
साइक्लोअल्केन्स के नाम उपसर्ग जोड़ने से बनते हैं साइक्लो-कार्बन परमाणुओं की समान संख्या वाले संबंधित अशाखित संतृप्त हाइड्रोकार्बन के नाम पर:
चक्र में स्थानापन्नों को उनकी स्थिति के अनुसार इस प्रकार क्रमांकित किया जाता है कि संख्याओं का योग न्यूनतम हो:
संवयविता
आइसोमरों- ये ऐसे पदार्थ हैं जिनकी संरचना समान है और समान आणविक सूत्र और द्रव्यमान है, लेकिन एक अलग रासायनिक संरचना है, और इसलिए अलग-अलग भौतिक और रासायनिक गुण हैं।
संरचनात्मक समरूपता
अल्केन्स की श्रृंखला में संरचनात्मक आइसोमेरिज्म की अभिव्यक्ति का कारण कार्बन परमाणुओं की विभिन्न संरचनाओं की श्रृंखला बनाने की क्षमता है। इस प्रकार की संरचनात्मक समावयवता को कार्बन कंकाल समावयवता कहा जाता है।
संरचनात्मक आइसोमर्स की संरचना समान होती है, लेकिन रासायनिक संरचना में भिन्नता होती है, जबकि आइसोमर्स के रासायनिक गुण समान होते हैं, लेकिन भौतिक गुण भिन्न होते हैं। शाखित संरचना वाले अल्केन्स, अणुओं की कम घनी पैकिंग के कारण और, तदनुसार, कम अंतर-आणविक अंतःक्रियाओं के कारण, उनके अशाखित आइसोमर्स की तुलना में कम तापमान पर उबलते हैं।
मीथेन सीएच 4, ईथेन सी 2 एच 6 और प्रोपेन सी 3 एच 8 के अणुओं में परमाणुओं के कनेक्शन का केवल एक ही क्रम हो सकता है, यानी अल्केन्स की सजातीय श्रृंखला के पहले तीन सदस्यों में आइसोमर्स नहीं होते हैं। ब्यूटेन C4H10 के लिए, दो संरचनाएँ संभव हैं:

इनमें से एक आइसोमर्स (एन-ब्यूटेन) में एक सीधी कार्बन श्रृंखला होती है, और दूसरे, आइसोब्यूटेन में एक शाखित (आइसोस्ट्रक्चर) होता है।
अणुओं में कार्बन परमाणुओं की संख्या में वृद्धि के साथ, श्रृंखला शाखाकरण की संभावनाएँ बढ़ जाती हैं, अर्थात। कार्बन परमाणुओं की संख्या के साथ आइसोमर्स की संख्या बढ़ती है।

रेडिकल्स की श्रृंखला में हम आइसोमेरिज्म की घटना का भी सामना करते हैं। इसके अलावा, रेडिकल्स में आइसोमर्स की संख्या उनके संबंधित अल्केन्स की तुलना में काफी अधिक है। उदाहरण के लिए, प्रोपेन, जैसा कि ज्ञात है, कोई आइसोमर्स नहीं है, और प्रोपाइल रेडिकल में दो आइसोमर्स हैं: एन-प्रोपाइल और आइसो-प्रोपाइल:
|
सीएच 3 -सीएच 3 -सीएच 2 - और एच 3 सी-सीएच-सीएच 3
अल्केन्स का घूर्णी समावयवता
एस-बॉन्ड के चारों ओर परमाणुओं के घूमने से इसका टूटना नहीं होगा। सी-सी एस-बॉन्ड के साथ इंट्रामोल्युलर रोटेशन के परिणामस्वरूप, एल्केन अणु, इथेन सी 2 एच 6 से शुरू होकर, विभिन्न ज्यामितीय आकार ले सकते हैं।
एक अणु के विभिन्न स्थानिक रूप जो C-C s-आबंध के चारों ओर घूमते हुए एक दूसरे में परिवर्तित हो जाते हैं, कहलाते हैं रचनाया रोटरी आइसोमर्स(अनुरूपक)।
किसी अणु के घूर्णी आइसोमर्स इसकी ऊर्जावान रूप से असमान अवस्थाएँ हैं। तापीय गति के परिणामस्वरूप उनका अंतर्रूपांतरण तेजी से और लगातार होता रहता है। इसलिए, रोटरी आइसोमर्स को व्यक्तिगत रूप में अलग नहीं किया जा सकता है, लेकिन उनका अस्तित्व भौतिक तरीकों से सिद्ध हो चुका है। कुछ अनुरूपण अधिक स्थिर (ऊर्जावान रूप से अनुकूल) होते हैं और अणु लंबे समय तक ऐसी अवस्था में रहता है।
भौतिक गुण
सामान्य परिस्थितियों में, अल्केन्स की सजातीय श्रृंखला के पहले चार सदस्य गैस हैं, सी 5-सी 17 तरल हैं, और सी 18 से शुरू होकर ठोस हैं। बढ़ते आणविक भार के साथ अल्केनों के घनत्व के गलनांक और क्वथनांक बढ़ते हैं। सभी अल्केन्स पानी से हल्के होते हैं और उसमें अघुलनशील होते हैं, लेकिन वे गैर-ध्रुवीय सॉल्वैंट्स (उदाहरण के लिए, बेंजीन) में घुलनशील होते हैं और स्वयं अच्छे सॉल्वैंट्स होते हैं।
कुछ अल्केन्स के भौतिक गुण तालिका में प्रस्तुत किए गए हैं।
| नाम | FORMULA | टीपी एलडिग्री सेल्सियस | टीगांठडिग्री सेल्सियस | डी 20 4 |
| मीथेन | चौधरी 4 | (-164 डिग्री सेल्सियस पर) |
||
| एटैन | साथ 2 एन 6 | (-100 डिग्री सेल्सियस पर) |
||
| प्रोपेन | साथ 3 एन 8 | (-44.5 डिग्री सेल्सियस पर) |
||
| बुटान | साथ 4 एन 10 | (0°C पर) |
||
| पेंटेन | सी 5 एच 12 | |||
| हेक्सेन | साथ 6 एन 14 | |||
| हेपटैन | साथ 7 एच 16 | |||
| ओकटाइन | सी 8 एच 18 | |||
| नॉनन | साथ 9 एन 20 | |||
| डीन | सी 10 एच 22 | |||
| पेंटाडेकेन | सी 15 एच 32 | |||
| ईकोसन | साथ 20 एन 42 | (37 डिग्री सेल्सियस पर) |
||
| पेंटाकोसन | सी 25 एच 52 | |||
| ट्राईकॉन्टन | साथ 30 एन 62 | |||
| *
डी 4
20
– सापेक्ष घनत्व, यानी |
||||
रासायनिक गुण
अल्केन्स के लिए तुच्छ (ऐतिहासिक) नाम - "पैराफिन्स" - का अर्थ है "कोई समानता नहीं।" अल्केन्स रासायनिक रूप से निष्क्रिय होते हैं। अल्केन्स की कम प्रतिक्रियाशीलता कार्बन और हाइड्रोजन परमाणुओं की लगभग समान इलेक्ट्रोनगेटिविटी के कारण उनके अणुओं में सी-सी और सी-एच बांड की बहुत कम ध्रुवता के कारण होती है। सामान्य परिस्थितियों में संतृप्त हाइड्रोकार्बन सांद्र अम्ल, क्षार या यहां तक कि पोटेशियम परमैंगनेट जैसे सक्रिय अभिकर्मक के साथ बातचीत नहीं करते हैं।
उन्हें हाइड्रोजन परमाणुओं की प्रतिस्थापन प्रतिक्रियाओं और विभाजन की विशेषता है।
इन प्रतिक्रियाओं में, सहसंयोजक बंधनों का होमोलिटिक दरार होता है, यानी वे एक मुक्त कट्टरपंथी (श्रृंखला) तंत्र द्वारा किए जाते हैं।
सी-सी और सी-एच बांड की ताकत के कारण, प्रतिक्रियाएं या तो हीटिंग के साथ, या प्रकाश में, या उत्प्रेरक के उपयोग के साथ होती हैं।
आइए इस प्रकार की प्रतिक्रियाओं के कुछ उदाहरण देखें।
हैलोजनीकरण।यह संतृप्त हाइड्रोकार्बन की विशिष्ट प्रतिक्रियाओं में से एक है। अल्केन्स का हैलोजनीकरण चरणों में होता है - एक चरण में एक से अधिक हाइड्रोजन परमाणु प्रतिस्थापित नहीं होते हैं:
सीएच 4 + सीएल 2 → सीएच 3 सीएल + एचसीएल (क्लोरोमेथेन)
सीएच 3 सीएल + सीएल 2 → सीएच 2 सीएल 2 + एचसीएल (डाइक्लोरोमेथेन)
सीएच 2 सीएल 2 + सीएल 2 → सीएच सीएल 3 + एचसीएल (ट्राइक्लोरोमेथेन)
सीएचसीएल 3 + सीएल 2 → सीसीएल 4 + एचसीएल (कार्बन टेट्राक्लोराइड)।
नाइट्रेशन.इस तथ्य के बावजूद कि सामान्य परिस्थितियों में अल्केन्स केंद्रित नाइट्रिक एसिड के साथ बातचीत नहीं करते हैं, जब उन्हें दबाव में पतला (10%) नाइट्रिक एसिड के साथ 140 डिग्री सेल्सियस तक गर्म किया जाता है, तो एक नाइट्रेशन प्रतिक्रिया होती है - एक नाइट्रो समूह के साथ हाइड्रोजन परमाणु का प्रतिस्थापन (एम.आई. कोनोवलोव की प्रतिक्रिया)। सभी अल्केन्स एक समान तरल-चरण नाइट्रेशन प्रतिक्रिया में प्रवेश करते हैं, लेकिन नाइट्रो यौगिकों की प्रतिक्रिया दर और पैदावार कम होती है। सर्वोत्तम परिणाम तृतीयक कार्बन परमाणुओं वाले अल्केन्स के साथ देखे गए हैं।
टूटना।उत्प्रेरकों की उपस्थिति में उच्च तापमान पर, संतृप्त हाइड्रोकार्बन विभाजित हो जाते हैं, जिसे क्रैकिंग कहा जाता है। क्रैकिंग के दौरान, कार्बन-कार्बन बांड छोटी श्रृंखलाओं के साथ संतृप्त और असंतृप्त हाइड्रोकार्बन बनाने के लिए होमोलिटिक रूप से टूट जाते हैं।
सीएच 3 -सीएच 2 -सीएच 2 -सीएच 3 (ब्यूटेन) - 400 डिग्री सेल्सियस सीएच 3 -सीएच 3 (ईथेन)+ सीएच 2 =सीएच 2 (एथिलीन)
प्रक्रिया तापमान में वृद्धि से हाइड्रोकार्बन का गहरा अपघटन होता है और, विशेष रूप से, डिहाइड्रोजनीकरण, यानी। अलग करने के लिए
हाइड्रोजन. इस प्रकार, 1500ºС पर मीथेन एसिटिलीन की ओर ले जाता है।
2CH 4 –– 1500°C H–C =
सी-एच(एसिटिलीन) + 3एच 2
आइसोमेराइजेशन।उत्प्रेरक के प्रभाव में, गर्म होने पर, सामान्य संरचना के हाइड्रोकार्बन आइसोमेराइजेशन से गुजरते हैं - शाखित अल्केन्स के निर्माण के साथ कार्बन कंकाल की पुनर्व्यवस्था।
ऑक्सीकरण. सामान्य परिस्थितियों में, अल्केन्स ऑक्सीजन और ऑक्सीकरण एजेंटों के प्रति प्रतिरोधी होते हैं। हवा में प्रज्वलित होने पर, अल्केन्स जलते हैं, कार्बन डाइऑक्साइड और पानी में बदल जाते हैं और बड़ी मात्रा में गर्मी छोड़ते हैं।
सीएच 4 + 2ओ 2 - लौ सीओ 2 + 2एच 2 ओ
C 5 H 12 + 8O 2 – ज्वाला 5CO 2 + 6H 2 O
प्रकृति में रहना और प्राप्त करना
अल्केन्स के मुख्य स्रोत तेल और प्राकृतिक गैस हैं। 

मीथेन प्राकृतिक गैस का बड़ा हिस्सा है; इसमें थोड़ी मात्रा में ईथेन, प्रोपेन और ब्यूटेन भी होते हैं। मीथेन दलदलों और कोयला परतों से उत्सर्जन में पाया जाता है। हल्के समरूपों के साथ, मीथेन संबंधित पेट्रोलियम गैसों में मौजूद है। ये गैसें दबाव में तेल में घुल जाती हैं और इसके ऊपर भी स्थित होती हैं। अल्केन्स पेट्रोलियम उत्पादों का एक महत्वपूर्ण हिस्सा बनाते हैं। तेल में साइक्लोअल्केन्स भी होते हैं - इन्हें नैफ्थीन (ग्रीक से) कहा जाता है। मिट्टी का तेल- तेल)। अल्केन्स के गैस हाइड्रेट्स, मुख्य रूप से मीथेन, भी प्रकृति में व्यापक हैं; वे महाद्वीपों पर और महासागरों के तल पर तलछटी चट्टानों में पाए जाते हैं। उनका भंडार संभवतः प्राकृतिक गैस के ज्ञात भंडार से अधिक है और भविष्य में मीथेन और इसके निकटतम समरूपों का स्रोत बन सकता है। कोयले के पायरोलिसिस (कोकिंग) और उसके हाइड्रोजनीकरण (सिंथेटिक तरल ईंधन का उत्पादन) से भी अल्केन्स प्राप्त होते हैं। ठोस अल्केन्स प्रकृति में पहाड़ी मोम - ओज़ोकेराइट के जमाव के रूप में पत्तियों, फूलों और पौधों के बीजों की मोमी कोटिंग में पाए जाते हैं, और मधुमक्खी के मोम का हिस्सा होते हैं। 
उद्योग में, कार्बन ऑक्साइड CO के उत्प्रेरक हाइड्रोजनीकरण द्वारा अल्केन्स प्राप्त किए जाते हैं
पहाड़ी मोम
और सीओ 2 (फिशर-ट्रॉप्स विधि)। प्रयोगशाला में, ठोस क्षार के साथ सोडियम एसीटेट को गर्म करके मीथेन प्राप्त किया जा सकता है: CH 3 COONa + NaOH → CH 4 + Na 2 CO 3, साथ ही कुछ कार्बाइड के हाइड्रोलिसिस द्वारा: Al 4 C 3 + 12H 2 O → 3CH 4 + 4Al(OH) 3. मीथेन के होमोलॉग वुर्ट्ज़ प्रतिक्रिया द्वारा प्राप्त किए जा सकते हैं, उदाहरण के लिए: 2CH 3 Br + 2Na→CH 3 –CH 3 + 2NaBr। डाइहैलोऐल्केन के मामले में, साइक्लोऐल्केन प्राप्त होते हैं, उदाहरण के लिए: Br-CH 2 -(CH 2) 4 -CH 2 Br + 2Na→ साइक्लो-सी 6 एच 12 + 2एनएबीआर। एल्केन्स का निर्माण कार्बोक्जिलिक एसिड के डीकार्बाक्सिलेशन और उनके इलेक्ट्रोलिसिस के दौरान भी होता है।
अल्केन्स के अनुप्रयोग
संतृप्त हाइड्रोकार्बन का व्यापक रूप से मानव जीवन और गतिविधि के विभिन्न क्षेत्रों में उपयोग किया जाता है।
गैसीय अल्केन्स (मीथेन और प्रोपेन-ब्यूटेन मिश्रण) का उपयोग मूल्यवान ईंधन के रूप में किया जाता है। 
तरल हाइड्रोकार्बन मोटर और रॉकेट ईंधन का एक महत्वपूर्ण हिस्सा बनाते हैं और विलायक के रूप में उपयोग किए जाते हैं।
वैसलीन तेल (15 कार्बन परमाणुओं तक तरल हाइड्रोकार्बन का मिश्रण) एक पारदर्शी, गंधहीन और स्वादहीन तरल है, जिसका उपयोग दवा, इत्र और सौंदर्य प्रसाधनों में किया जाता है। 
वैसलीन (25 कार्बन परमाणुओं तक तरल और ठोस संतृप्त हाइड्रोकार्बन का मिश्रण) का उपयोग दवा में उपयोग किए जाने वाले मलहम तैयार करने के लिए किया जाता है।
पैराफिन (ठोस अल्केन्स सी 19 -सी 35 का मिश्रण) - गंध और स्वाद के बिना एक सफेद ठोस द्रव्यमान (एमपी 50-70 डिग्री सेल्सियस) - चिकित्सा में थर्मल प्रक्रियाओं के लिए मोमबत्तियां बनाने, माचिस लगाने और कागज लपेटने के लिए उपयोग किया जाता है। कार्बनिक अम्ल और अल्कोहल, डिटर्जेंट और सर्फेक्टेंट के उत्पादन के लिए कच्चे माल के रूप में कार्य करता है। 
औसत आणविक भार के सामान्य संतृप्त हाइड्रोकार्बन का उपयोग तेल से प्रोटीन के सूक्ष्मजीवविज्ञानी संश्लेषण में पोषक तत्व सब्सट्रेट के रूप में किया जाता है।
अल्केन्स के हैलोजन डेरिवेटिव का बहुत महत्व है, जिनका उपयोग आगे के संश्लेषण के लिए सॉल्वैंट्स, शीतलक और कच्चे माल के रूप में किया जाता है। आधुनिक पेट्रोकेमिकल उद्योग में, संतृप्त हाइड्रोकार्बन विभिन्न कार्बनिक यौगिकों के उत्पादन का आधार हैं, जो प्लास्टिक, रबर, सिंथेटिक फाइबर, डिटर्जेंट और कई अन्य पदार्थों के उत्पादन के लिए मध्यवर्ती प्राप्त करने की प्रक्रियाओं में एक महत्वपूर्ण कच्चा माल है।
हाइड्रोकार्बन- संतृप्त (संतृप्त) हाइड्रोकार्बन। इस वर्ग का एक प्रतिनिधि मीथेन है ( सीएच 4). बाद के सभी संतृप्त हाइड्रोकार्बन अलग-अलग होते हैं सीएच 2- एक समूह जिसे समजात समूह कहा जाता है, और यौगिकों को समजात कहा जाता है।
सामान्य सूत्र - साथएनएच 2 एन +2 .
अल्केन्स की संरचना.
प्रत्येक कार्बन परमाणु में है एसपी 3- संकरण, रूप 4 σ - संचार (1 एस-एसऔर 3 एस-एन). अणु का आकार 109.5° कोण वाले चतुष्फलक के रूप में है।
बंधन हाइब्रिड ऑर्बिटल्स के ओवरलैप के माध्यम से बनता है, ओवरलैप का अधिकतम क्षेत्र परमाणु नाभिक को जोड़ने वाली सीधी रेखा पर अंतरिक्ष में स्थित होता है। यह सबसे कुशल ओवरलैप है, इसलिए σ बंधन को सबसे मजबूत माना जाता है।
अल्केन्स का समावयवता।
के लिए हाइड्रोकार्बनकार्बन कंकाल की समरूपता विशेषता है। कनेक्शनों के बीच के कोण को बनाए रखते हुए सीमा कनेक्शन विभिन्न ज्यामितीय आकार ले सकते हैं। उदाहरण के लिए,

कार्बन श्रृंखला की विभिन्न स्थितियों को अनुरूपण कहा जाता है। सामान्य परिस्थितियों में, अल्केन्स की संरचना सी-सी बांड के घूर्णन के माध्यम से स्वतंत्र रूप से एक-दूसरे में परिवर्तित हो जाती है, यही कारण है कि उन्हें अक्सर रोटरी आइसोमर्स कहा जाता है। 2 मुख्य रचनाएँ हैं - "अवरुद्ध" और "ग्रहण":

अल्केन्स के कार्बन कंकाल का समावयवता।
कार्बन श्रृंखला वृद्धि के साथ आइसोमर्स की संख्या बढ़ती है। उदाहरण के लिए, ब्यूटेन में 2 आइसोमर्स हैं:

पेंटेन के लिए - 3, हेप्टेन के लिए - 9, आदि।
यदि एक अणु एल्केनएक प्रोटॉन (हाइड्रोजन परमाणु) घटाएं, आपको एक रेडिकल मिलता है:
अल्केन्स के भौतिक गुण।
सामान्य परिस्थितियों में - सी 1 -सी 4- गैसें , 5 से 17 तक- तरल पदार्थ, और 18 से अधिक कार्बन परमाणुओं वाले हाइड्रोकार्बन - ठोस।
जैसे-जैसे श्रृंखला बढ़ती है, क्वथनांक और गलनांक बढ़ते हैं। शाखित अल्केन्स का क्वथनांक सामान्य एल्केनों की तुलना में कम होता है।
हाइड्रोकार्बनपानी में अघुलनशील, लेकिन गैर-ध्रुवीय कार्बनिक सॉल्वैंट्स में घुलनशील। एक दूसरे के साथ आसानी से मिल जाएं.
अल्केन्स की तैयारी.
अल्केन्स के उत्पादन के लिए सिंथेटिक तरीके:
1. असंतृप्त हाइड्रोकार्बन से - "हाइड्रोजनीकरण" प्रतिक्रिया एक उत्प्रेरक (निकल, प्लैटिनम) के प्रभाव में और एक तापमान पर होती है:

2. हैलोजन डेरिवेटिव से - वर्ट्ज़ प्रतिक्रिया: सोडियम धातु के साथ मोनोहैलोऐल्केन की अंतःक्रिया, जिसके परिणामस्वरूप श्रृंखला में कार्बन परमाणुओं की संख्या दोगुनी हो जाती है:
3. कार्बोक्सिलिक अम्लों के लवणों से। जब नमक क्षार के साथ प्रतिक्रिया करता है, तो ऐसे अल्केन्स प्राप्त होते हैं जिनमें मूल कार्बोक्जिलिक एसिड की तुलना में 1 कम कार्बन परमाणु होता है:
4. मीथेन का उत्पादन. हाइड्रोजन वायुमंडल में एक विद्युत चाप में:
सी + 2एच 2 = सीएच 4.
प्रयोगशाला में मीथेन इस प्रकार प्राप्त की जाती है:
एएल 4 सी 3 + 12एच 2 ओ = 3सीएच 4 + 4एएल(ओएच) 3.
अल्केन्स के रासायनिक गुण।
सामान्य परिस्थितियों में, अल्केन्स रासायनिक रूप से निष्क्रिय यौगिक होते हैं; वे सांद्र सल्फ्यूरिक और नाइट्रिक एसिड, सांद्र क्षार या पोटेशियम परमैंगनेट के साथ प्रतिक्रिया नहीं करते हैं।
स्थिरता को बंधनों की मजबूती और उनकी गैर-ध्रुवीयता द्वारा समझाया गया है।
यौगिकों में बंधन तोड़ने वाली प्रतिक्रियाएं (अतिरिक्त प्रतिक्रियाएं) होने का खतरा नहीं होता है; उन्हें प्रतिस्थापन की विशेषता होती है।
1. अल्केन्स का हैलोजनीकरण। प्रकाश क्वांटम के प्रभाव में, एल्केन का आमूल-चूल प्रतिस्थापन (क्लोरीनीकरण) शुरू हो जाता है। सामान्य योजना:
प्रतिक्रिया एक श्रृंखला तंत्र का अनुसरण करती है, जिसमें हैं:
ए) सर्किट आरंभ करना:

बी) श्रृंखला वृद्धि:

बी) ओपन सर्किट:
कुल मिलाकर इसे इस प्रकार प्रस्तुत किया जा सकता है:

2. अल्केन्स का नाइट्रेशन (कोनोवालोव प्रतिक्रिया)। प्रतिक्रिया 140 डिग्री सेल्सियस पर होती है:
प्राथमिक और द्वितीयक परमाणुओं की तुलना में तृतीयक कार्बन परमाणु के साथ प्रतिक्रिया सबसे आसानी से होती है।
3. अल्केन्स का आइसोमेराइजेशन। विशिष्ट परिस्थितियों में, सामान्य संरचना के अल्केन्स शाखित अल्केन्स में परिवर्तित हो सकते हैं:

4. क्रैकिंग अल्केन। उच्च तापमान और उत्प्रेरक की कार्रवाई के तहत, उच्च अल्केन्स अपने बंधन तोड़ सकते हैं, जिससे एल्केन्स और निचले अल्केन्स बनते हैं:

5. अल्केन्स का ऑक्सीकरण। विभिन्न परिस्थितियों में और विभिन्न उत्प्रेरकों के साथ, एल्केन ऑक्सीकरण से अल्कोहल, एल्डिहाइड (कीटोन) और एसिटिक एसिड का निर्माण हो सकता है। पूर्ण ऑक्सीकरण की शर्तों के तहत, प्रतिक्रिया पूरी होने तक आगे बढ़ती है - जब तक कि पानी और कार्बन डाइऑक्साइड नहीं बन जाता:

अल्केन्स का अनुप्रयोग.
उद्योग में तेल, ईंधन आदि के संश्लेषण में अल्केन्स का व्यापक उपयोग पाया गया है।