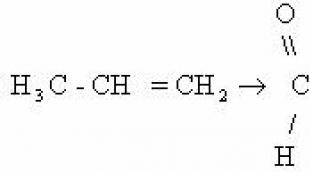Benseeni oksüdeerimine kaaliumpermanganaadiga happelises keskkonnas. Küllastumata süsivesinikud. Alküünid. Atsetüleeni reaktsioon hõbeoksiidi ammoniaagilahusega
18. Redoksreaktsioonid (jätkub 2)
18.9. OVR, mis hõlmab orgaanilisi aineid
Orgaaniliste ainete ORR-is anorgaaniliste ainetega on orgaanilised ained kõige sagedamini redutseerivad ained. Seega, kui orgaaniline aine põleb liigses hapnikus, tekib alati süsihappegaas ja vesi. Reaktsioonid on keerulisemad, kui kasutatakse vähem aktiivseid oksüdeerivaid aineid. Selles jaotises käsitletakse ainult kõige olulisemate orgaaniliste ainete klasside esindajate reaktsioone mõne anorgaanilise oksüdeeriva ainega.
Alkeenid. Kerge oksüdatsiooni käigus muudetakse alkeenid glükoolideks (kahehüdroksüülsed alkoholid). Nende reaktsioonide redutseerivad aatomid on kaksiksidemega seotud süsinikuaatomid.
Reaktsioon kaaliumpermanganaadi lahusega toimub neutraalses või kergelt aluselises keskkonnas järgmiselt:
C 2 H 4 + 2KMnO 4 + 2H 2 O CH 2 OH–CH 2 OH + 2 MnO 2 + 2KOH (jahutus)
Raskemates tingimustes põhjustab oksüdatsioon kaksiksideme süsinikahela katkemise ja kahe happe (tugevalt aluselises keskkonnas - kaks soola) või happe ja süsinikdioksiidi (tugevalt aluselises keskkonnas - soola ja karbonaat):
1) 5CH 3 CH=CHCH 2 CH 3 + 8KMnO 4 + 12H 2 SO 4 5CH 3 COOH + 5C 2 H 5 COOH + 8 MnSO 4 + 4K 2 SO 4 + 17 H 2 O (kuumutamine)
2) 5CH 3 CH=CH 2 + 10 KMnO 4 + 15H 2 SO 4 5CH 3 COOH + 5CO 2 + 10 MnSO 4 + 5K 2 SO 4 + 20 H 2 O (küte)
3) CH 3 CH=CHCH 2 CH 3 + 6KMnO 4 + 10KOH CH 3 COOK + C 2 H 5 COOK + 6H 2 O + 6K 2 MnO 4 (kuumutamine)
4) CH 3 CH=CH 2 + 10KMnO 4 + 13KOH CH 3 COOK + K 2 CO 3 + 8H 2 O + 10K 2 MnO 4 (kuumutamine)
Väävelhappekeskkonnas olev kaaliumdikromaat oksüdeerib alkeene sarnaselt reaktsioonidele 1 ja 2.
Alküünid. Alküünid hakkavad oksüdeeruma veidi raskemates tingimustes kui alkeenid, seega oksüdeeruvad nad tavaliselt kolmiksideme juures oleva süsinikuahela katkemise teel. Nagu alkaanide puhul, on siin redutseerivateks aatomiteks süsinikuaatomid, mis on sel juhul seotud kolmiksidemega. Reaktsioonide tulemusena tekivad happed ja süsihappegaas. Oksüdeerimist saab läbi viia kaaliumpermanganaadi või dikromaadiga happelises keskkonnas, näiteks:
5CH 3 C CH + 8 KMnO 4 + 12H 2 SO 4 5CH 3 COOH + 5CO 2 + 8 MnSO 4 + 4K 2 SO 4 + 12 H 2 O (kuumutamine)
Mõnikord on võimalik eraldada vahepealseid oksüdatsiooniprodukte. Sõltuvalt kolmiksideme asukohast molekulis on need kas diketoonid (R 1 –CO–CO–R 2) või aldoketoonid (R–CO–CHO).
Atsetüleeni saab oksüdeerida kaaliumpermanganaadiga kergelt aluselises keskkonnas kaaliumoksalaadiks:
3C2H2 + 8KMnO4 = 3K2C2O4 + 2H2O + 8MnO2 + 2KOH
Happelises keskkonnas toimub oksüdatsioon süsinikdioksiidiks:
C 2 H 2 + 2 KMnO 4 + 3H 2 SO 4 = 2CO 2 + 2 MnSO 4 + 4H 2 O + K 2 SO 4
Benseeni homoloogid. Benseeni homolooge saab oksüdeerida neutraalses keskkonnas kaaliumpermanganaadi lahusega kaaliumbensoaadiks:
C 6 H 5 CH 3 + 2 KMnO 4 = C 6 H 5 COOK + 2 MnO 2 + KOH + H 2 O (keemisel)
C 6 H 5 CH 2 CH 3 + 4 KMnO 4 = C 6 H 5 COOK + K 2 CO 3 + 2H 2 O + 4 MnO 2 + KOH (kuumutamisel)
Nende ainete oksüdeerimine kaaliumdikromaadi või permanganaadiga happelises keskkonnas viib bensoehappe moodustumiseni.
Alkoholid. Primaarsete alkoholide otsene oksüdatsiooniprodukt on aldehüüdid ja sekundaarsete alkoholide oksüdatsiooniproduktid on ketoonid.
Alkoholide oksüdatsioonil tekkivad aldehüüdid oksüdeeruvad kergesti hapeteks, seetõttu saadakse primaarsetest alkoholidest aldehüüdid kaaliumdikromaadiga oksüdeerimisel happelises keskkonnas aldehüüdi keemistemperatuuril. Kui aldehüüdid aurustuvad, ei ole neil aega oksüdeeruda.
3C 2 H 5 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O (kuumutamine)
Oksüdeeriva aine (KMnO 4, K 2 Cr 2 O 7) liiaga mis tahes keskkonnas oksüdeeritakse primaarsed alkoholid karboksüülhapeteks või nende sooladeks ja sekundaarsed alkoholid ketoonideks. Tertsiaarsed alkoholid nendes tingimustes ei oksüdeeru, kuid metüülalkohol oksüdeerub süsinikdioksiidiks. Kõik reaktsioonid toimuvad kuumutamisel.
Kahehüdroksüülne alkohol, etüleenglükool HOCH 2 –CH 2 OH, oksüdeerub happelises keskkonnas KMnO 4 või K 2 Cr 2 O 7 lahusega kuumutamisel kergesti süsihappegaasiks ja veeks, kuid mõnikord on võimalik eraldada vaheprodukte. (HOCH 2 –COOH, HOOC–COOH jne).
Aldehüüdid. Aldehüüdid on üsna tugevad redutseerivad ained ja seetõttu oksüdeeruvad kergesti erinevate oksüdeerivate ainete toimel, näiteks: KMnO 4, K 2 Cr 2 O 7, OH. Kõik reaktsioonid toimuvad kuumutamisel:
3CH 3 CHO + 2 KMnO 4 = CH 3 COOH + 2 CH 3 COOK + 2 MnO 2 + H 2 O
3CH 3 CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 COOH + Cr 2 (SO 4) 3 + 7 H 2 O
CH 3 CHO + 2OH = CH 3 COONH 4 + 2Ag + H 2 O + 3NH 3
Oksüdeeriva aine liiaga formaldehüüd oksüdeeritakse süsinikdioksiidiks.
18.10. Erinevate ainete redoksaktiivsuse võrdlus
Mõistete "oksüdeeriv aatom" ja "redutseeriv aatom" määratlustest järeldub, et kõrgeimas oksüdatsiooniastmes aatomitel on ainult oksüdeerivad omadused. Vastupidi, kõige madalamas oksüdatsiooniastmes aatomitel on ainult redutseerivad omadused. Vahepealses oksüdatsiooniastmes olevad aatomid võivad olla nii oksüdeerivad kui ka redutseerivad ained.
Samal ajal on ainult oksüdatsiooniastme põhjal võimatu üheselt hinnata ainete redoksomadusi. Vaatleme näitena VA rühma elementide seoseid. Lämmastiku(V) ja antimoni(V) ühendid on enam-vähem tugevad oksüdeerivad ained, vismuti(V) ühendid on väga tugevad oksüdeerijad ja fosfor(V) ühenditel praktiliselt puuduvad oksüdeerivad omadused. Sel ja teistel sarnastel juhtudel on oluline, kui iseloomulik on antud oksüdatsiooniaste antud elemendile, st kui stabiilsed on antud elemendi aatomeid sisaldavad ühendid selles oksüdatsiooniastmes.
Igasugune redoksreaktsioon kulgeb nõrgema oksüdeeriva aine ja nõrgema redutseerija moodustumise suunas. Üldjuhul saab mis tahes ORR-i toimumise võimaluse, nagu iga teise reaktsiooni, määrata Gibbsi energia muutuse märgiga. Lisaks kasutatakse ainete redoksaktiivsuse kvantifitseerimiseks oksüdeerivate ainete ja redutseerivate ainete elektrokeemilisi omadusi (redokspaaride standardpotentsiaalid). Nende kvantitatiivsete omaduste põhjal on võimalik koostada erinevate ainete redoksaktiivsuse seeriaid. Teile tuntud metallipingete jada on konstrueeritud täpselt nii. See seeria võimaldab võrrelda metallide redutseerivaid omadusi vesilahustes standardtingimustes ( Koos= 1 mol/l, T= 298,15 K), samuti lihtsate veekogude oksüdeerivad omadused. Kui asetate ioonid (oksüdeerivad ained) selle rea ülemisse ritta ja metalliaatomid (redutseerivad ained) alumisse ritta, näeb selle rea vasak pool (enne vesinikku) välja selline:
Selles seerias suurenevad ioonide oksüdeerivad omadused (ülemine rida) vasakult paremale ja metallide redutseerivad omadused (alumine rida), vastupidi, paremalt vasakule.
Võttes arvesse redoksaktiivsuse erinevusi erinevates keskkondades, on võimalik konstrueerida sarnaseid seeriaid oksüdeerivate ainete jaoks. Seega saadakse happelises keskkonnas (pH = 0) toimuvate reaktsioonide korral metallide aktiivsuse jada "jätk" oksüdatiivsete omaduste suurendamise suunas.
Nagu metallide aktiivsuse seerias, suurenevad ka selles seerias oksüdeerivate ainete oksüdeerivad omadused (ülemine rida) vasakult paremale. Kuid seda seeriat kasutades on võimalik võrrelda redutseerivate ainete redutseerimisaktiivsust (alumine rida) ainult siis, kui nende oksüdeeritud vorm langeb kokku ülemisel real näidatud vormiga; sel juhul intensiivistub paremalt vasakule.
Vaatame mõnda näidet. Et teada saada, kas see ORR on võimalik, kasutame üldreeglit, mis määrab redoksreaktsioonide suuna (reaktsioonid kulgevad nõrgema oksüdeeriva aine ja nõrgema redutseerija moodustumise suunas).
1. Kas CoSO 4 lahusest saab koobaltit redutseerida magneesiumiga?
Magneesium on tugevam redutseerija kui koobalt ja Co 2 ioonid on tugevamad oksüdeerijad kui Mg 2 ioonid, seega on see võimalik.
2. Kas happelises keskkonnas FeCl 3 lahusega on võimalik vaske oksüdeerida CuCl 2-ks?
Kuna Fe 3B ioonid on tugevamad oksüdeerijad kui Cu 2 ioonid ja vask on tugevam redutseerija kui Fe 2 ioonid, on see võimalik.
3. Kas on võimalik saada FeCl 3 lahust, puhudes hapnikku läbi vesinikkloriidhappega hapendatud FeCl 2 lahuse?
Tundub, et mitte, kuna meie seerias asub hapnik Fe 3 ioonidest vasakul ja on nendest ioonidest nõrgem oksüdeerija. Kuid vesilahuses ei redutseerita hapnik peaaegu kunagi H2O2-ks; sel juhul redutseeritakse see H2O-ks ja toimub Br 2 ja MnO 2 vahel. Seetõttu on selline reaktsioon võimalik, kuigi see kulgeb üsna aeglaselt (miks?).
4. Kas kaaliumpermanganaadiga on võimalik happelises keskkonnas H 2 O 2 oksüdeerida?
Sel juhul on H 2 O 2 redutseerija ja tugevam redutseerija kui Mn 2B ioonid ning MnO 4 ioonid on tugevamad oksüdeerijad kui peroksiidist moodustuv hapnik. Seetõttu on see võimalik.
Sarnane seeria, mis on konstrueeritud ORR jaoks leeliselises keskkonnas, on järgmine:
Erinevalt "happe" seeriast ei saa seda seeriat kasutada koos metalli tegevuste sarjaga.
Elektronioonide tasakaalu meetod (poolreaktsiooni meetod), molekulidevaheline ORR, intramolekulaarne ORR, dismutatsioon ORR (disproportsioon, iseoksüdatsioon-self-reduktsioon), ORR kommutatsioon, passivatsioon.
- Koostage elektronioonide tasakaalu meetodil võrrandid reaktsioonide kohta, mis toimuvad, kui a) väävelhappega hapendatud kaaliumpermanganaadi lahusele lisatakse H 2 S (S, täpsemalt S 8 ) lahust; b) KHS; c) K2S; d) H2S03; e) KHS03; e) K2S03; e) HNO2; g) KNO2; i) KI (I 2); j) FeS04; l) C2H5OH (CH3COOH); m) CH3CHO; n) (COOH)2 (CO2); n) K2C2O4. Siin ja allpool on vajadusel oksüdatsiooniproduktid märgitud lokkis sulgudes.
- Kirjutage üles reaktsioonide võrrandid, mis tekivad järgmiste gaaside juhtimisel läbi väävelhappega hapestatud kaaliumpermanganaadi lahuse: a) C 2 H 2 (CO 2 ); b) C2H4 (CO2); c) C3H4 (propüün) (CO2 ja CH3COOH); d) C3H6; e) CH4; e) HCHO.
- Sama, kuid neutraalsele kaaliumpermanganaadi lahusele lisatakse redutseeriva aine lahust: a) KHS; b) K2S; c) KHS03; d) K2S03; e) KNO2; e) KI.
- Sama, kuid eelnevalt lisatakse kaaliumpermanganaadi lahusele kaaliumhüdroksiidi lahust: a) K 2 S (K 2 SO 4 ); b) K2S03; c) KNO2; d) KI (KIO 3).
- Kirjutage üles võrrandid järgmiste lahuses toimuvate reaktsioonide kohta: a) KMnO 4 + H 2 S ...;
b) KMnO4 + HCl ...;
c) KMnO4 + HBr...;
d) KMnO 4 + HI ... - Koostage mangaandioksiidi ORR jaoks järgmised võrrandid:
- Väävelhappega hapendatud kaaliumdikromaadi lahusele lisati järgmiste ainete lahused: a) KHS; b) K2S; c) HNO2; d) KNO2; e) KI; f) FeS04; g) CH3CH2CHO; i) H2S03; j) KHS03; k) K 2 SO 3. Kirjutage üles toimuvate reaktsioonide võrrandid.
- Sama, kuid lahuse kaudu lastakse järgmised gaasid: a) H 2 S; b) SO 2.
- a) K 2 S (K 2 SO 4 ) lahused; b) K2S03; c) KNO2; d) KI (KIO 3). Kirjutage üles toimuvate reaktsioonide võrrandid.
- Kroom(III)kloriidi lahusele lisati kaaliumhüdroksiidi lahust, kuni algselt moodustunud sade oli lahustunud, ja seejärel lisati broomivett. Kirjutage üles toimuvate reaktsioonide võrrandid.
- Sama, kuid viimases etapis lisati kaaliumperoksodisulfaadi K 2 S 2 O 8 lahus, mis reaktsiooni käigus redutseeriti sulfaadiks.
- Kirjutage üles lahuses toimuvate reaktsioonide võrrandid:
- Kirjutage üles reaktsioonide võrrandid, mis toimuvad tahke kroomtrioksiidi ja järgmiste ainete vahel: a) C; b) CO; c) S (S02); d) H2S; e) NH3; e) C2H50H (CO2 ja H20); g) CH3COCH3.
- Kirjutage üles reaktsioonide võrrandid, mis tekivad järgmiste ainete lisamisel kontsentreeritud lämmastikhappele: a) S (H 2 SO 4 ); b) P4 ((HPO3)4); c) grafiit; d) Se; e) I 2 (HIO 3); f) Ag; g) Cu; i) Pb; j) KF; l) FeO; m) FeS; m) MgO; n) MgS; p) Fe(OH)2; c) P203; t) As203 (H3As04); y) kui 2S3; f) Fe(NO3)2; x) P4010; v) Cu2S.
- Sama, kuid järgmiste gaaside läbimisel: a) CO; b) H2S; c) N20; d) NH3; e) EI; f) H2Se; g) HI.
- Reaktsioonid kulgevad sama või erinevalt järgmistel juhtudel: a) tükk magneesiumi asetati kõrgesse katseklaasi, mis oli kahe kolmandiku ulatuses täidetud kontsentreeritud lämmastikhappega; b) magneesiumplaadi pinnale asetati tilk kontsentreeritud lämmastikhapet? Kirjutage üles reaktsioonivõrrandid.
- Mis vahe on kontsentreeritud lämmastikhappe reaktsioonil vesiniksulfiidhappega ja gaasilise vesiniksulfiidiga? Kirjutage üles reaktsioonivõrrandid.
- Kas ORR toimib samamoodi, kui kontsentreeritud lämmastikhappe lahusele lisatakse veevaba kristalne naatriumsulfiid ja selle 0,1 M lahus?
- Järgmiste ainete segu töödeldi kontsentreeritud lämmastikhappega: Cu, Fe, Zn, Si ja Cr. Kirjutage üles toimuvate reaktsioonide võrrandid.
- Kirjutage üles reaktsioonide võrrandid, mis tekivad järgmiste ainete lisamisel lahjendatud lämmastikhappele: a) I 2 ; b) Mg; c) Al; d) Fe; e) FeO; f) FeS; g) Fe(OH)2; i) Fe(OH)3; j) MnS; l) Cu2S; l) CuS; m) CuO; n) Na2Scr; p) Na2Sp; c) P4O10.
- Millised protsessid toimuvad, kui a) ammoniaak, b) vesiniksulfiid, c) süsinikdioksiid lastakse läbi lämmastikhappe lahjendatud lahuse?
- Kirjutage üles reaktsioonide võrrandid, mis tekivad järgmiste ainete lisamisel kontsentreeritud väävelhappele: a) Ag; b) Cu; c) grafiit; d) HCOOH; e) C6H12O6; f) NaClcr; g) C2H5OH.
- Kui vesiniksulfiid juhitakse läbi külma kontsentreeritud väävelhappe, tekivad S ja SO 2, kuum kontsentreeritud H 2 SO 4 oksüdeerib väävli SO 2 -ks. Kirjutage üles reaktsioonivõrrandid. Kuidas kulgeb reaktsioon kuuma kontsentreeritud H2SO4 ja vesiniksulfiidi vahel?
- Miks saadakse vesinikkloriid kristallilise naatriumkloriidi töötlemisel kontsentreeritud väävelhappega, kuid vesinikbromiidi ja vesinikjodiidi selle meetodiga ei saada?
- Kirjutage üles võrrandid reaktsioonide kohta, mis toimuvad lahjendatud väävelhappe vastasmõjul a) Zn, b) Al, c) Fe, d) kroomiga hapniku puudumisel, e) kroomiga õhus.
- Kirjutage üles reaktsioonivõrrandid, mis iseloomustavad vesinikperoksiidi redoksomadusi:
- Millised reaktsioonid toimuvad järgmiste ainete kuumutamisel: a) (NH 4) 2 CrO 4; b) NaNO3; c) CaCO3; d) Al(NO3)3; e) Pb(NO3)3; f) AgN03; g) Hg(NO3)2; i) Cu(NO3)2; j) CuO; l) NaClO4; m) Ca(ClO4)2; m) Fe(NO3)2; n) PCl5; p) MnCl4; c) H2C204; r) LiNO3; y) HgO; f) Ca(NO3)2; x) Fe(OH)3; v) CuCl2; h) KClO3; w) KClO2; y) CrO3?
- Ammooniumkloriidi ja kaaliumnitraadi kuumade lahuste ühendamisel tekib reaktsioon, millega kaasneb gaasi eraldumine. Kirjutage selle reaktsiooni võrrand.
- Kirjutage üles reaktsioonide võrrandid, mis tekivad, kui a) kloori, b) broomiauru lastakse läbi külma naatriumhüdroksiidi lahuse. Sama, aga läbi kuuma lahuse.
- Kuuma kontsentreeritud kaaliumhüdroksiidi lahusega suhtlemisel dismuteerub seleen lähima stabiilse oksüdatsiooniastmeni (–II ja +IV). Kirjutage selle ORR-i võrrand.
- Samades tingimustes toimub väävel sarnase dismutatsiooniga, kuid liigne väävel reageerib sulfitioonidega, moodustades tiosulfaadioonid S 2 O 3 2. Kirjutage üles toimuvate reaktsioonide võrrandid. ;
- Kirjutage üles võrrandid a) vasknitraadi lahuse hõbeanoodiga, b) plii nitraadi lahuse vaskanoodiga elektrolüüsireaktsioonide kohta.
a) CrCl2 + FeCl3; b) CrS04 + FeCl3; c) CrS04 + H2S04 + O2;
d) CrS04 + H2S04 + MnO2; e) CrSO4 + H2SO4 + KMnO4.
Millises neist reaktsioonidest on vesinikperoksiid oksüdeerija ja millises redutseerija?
| Kogemus 1. Kaaliumpermanganaadi oksüdatiivsed omadused happelises keskkonnas. Lisage 3-4 tilgale kaaliumpermanganaadi lahusele võrdne kogus lahjendatud väävelhappe lahust ja seejärel naatriumsulfiti lahust, kuni see on värvi muutnud. Kirjutage reaktsiooni võrrand. Kogemus 2.Kaaliumpermanganaadi oksüdeerivad omadused neutraalses keskkonnas. Lisage 5-6 tilka naatriumsulfiti lahust 3-4 tilgale kaaliumpermanganaadi lahusele. Mis aine vabanes sadena? Kogemus 3. Kaaliumpermanganaadi oksüdatiivsed omadused aluselises keskkonnas. 3-4 tilka kaaliumpermanganaadi lahusele lisada 10 tilka kontsentreeritud naatriumhüdroksiidi lahust ja 2 tilka naatriumsulfiti lahust. Lahus peaks muutuma roheliseks. Kogemus 4. Kaaliumdikromaadi oksüdatiivsed omadused happelises keskkonnas. Hapestada 6 tilka kaaliumdikromaadi lahust nelja tilga lahjendatud väävelhappe lahusega ja lisada naatriumsulfiti lahust, kuni segu värvus muutub. Kogemus 5. Lahjendatud väävelhappe oksüdeerivad omadused. Asetage ühte katseklaasi tsingigraanul ja teise vasklindi tükk. Lisage mõlemasse katseklaasi 8-10 tilka lahjendatud väävelhappe lahust. Võrrelge toimuvaid nähtusi. EKSPERIMENT LÄBI VIIDA SUITSAKONKSIS! Kogemus 6. Kontsentreeritud väävelhappe oksüdeerivad omadused. Sarnaselt katsega 5, kuid lisage kontsentreeritud väävelhappe lahus. Minut pärast gaasiliste reaktsioonisaaduste eraldumise algust sisestage katseklaasidesse kaaliumpermanganaadi ja vasksulfaadi lahustega niisutatud filterpaberi ribad. Selgitage toimuvaid nähtusi. EKSPERIMENT LÄBI VIIDA SUITSAKONKSIS! Kogemus 7. Lahjendatud lämmastikhappe oksüdeerivad omadused. Sarnaselt 5. katsega, kuid lisage lahjendatud lämmastikhappe lahus. Jälgige gaasiliste reaktsioonisaaduste värvimuutust. EKSPERIMENT LÄBI VIIDA SUITSAKONKSIS! Kogemus 8. Kontsentreeritud lämmastikhappe oksüdeerivad omadused. Asetage katseklaasi tükk vasklindi ja lisage 10 tilka kontsentreeritud lämmastikhappe lahust. Kuumutage õrnalt, kuni metall on täielikult lahustunud. EKSPERIMENT LÄBI VIIDA SUITSAKONKSIS! Kogemus 9. Kaaliumnitriti oksüdeerivad omadused. 5-6 tilgale kaaliumnitriti lahusele lisatakse võrdne maht lahjendatud väävelhappe lahust ja 5 tilka kaaliumjodiidi lahust. Millised ained tekivad? Kogemus 10. Kaaliumnitriti redutseerivad omadused. 5-6 tilgale kaaliumpermanganaadi lahusele lisatakse võrdne maht lahjendatud väävelhappe lahust ja kaaliumnitriti lahust, kuni segu on täielikult värvi muutnud. Kogemus 11.Vasknitraadi termiline lagunemine. Asetage üks vasknitraattrihüdraadi mikrospaatel katseklaasi, kinnitage see alusele ja soojendage õrnalt lahtise leegiga. Jälgige dehüdratsiooni ja sellele järgnevat soola lagunemist. EKSPERIMENT LÄBI VIIDA SUITSAKONKSIS! Kogemus 12.Plii nitraadi termiline lagunemine. Tehke sama protseduur nagu katses 11, pannes pliinitraat katseklaasi. EKSPERIMENT LÄBI VIIDA SUITSAKONKSIS! Mis vahe on nende soolade lagunemisel toimuvatel protsessidel? |
Redoksprotsessid on pikka aega huvitanud keemikuid ja isegi alkeemikuid. Looduses, igapäevaelus ja tehnoloogias toimuvate keemiliste reaktsioonide hulgas on tohutult palju redokse: kütuse põlemine, toitainete oksüdatsioon, kudede hingamine, fotosüntees, toidu riknemine jne. Sellistes reaktsioonides võivad osaleda nii anorgaanilised kui orgaanilised ained. Kui aga anorgaanilise keemia koolikursusel on olulisel kohal redoksreaktsioonidele pühendatud sektsioonid, siis orgaanilise keemia kursuses ei pöörata sellele küsimusele piisavalt tähelepanu.
Mis on redutseerimis-oksüdatsiooniprotsessid?
Kõik keemilised reaktsioonid võib jagada kahte tüüpi. Esimene hõlmab reaktsioone, mis toimuvad reageerivaid aineid moodustavate aatomite oksüdatsiooniastet muutmata.
Teine tüüp hõlmab kõiki reaktsioone, mis toimuvad reageerivaid aineid moodustavate aatomite oksüdatsiooniastme muutumisel.
Reaktsioone, mis tekivad reageerivaid aineid moodustavate aatomite oksüdatsiooniastme muutumisel, nimetatakse redoksiks.
Kaasaegsest vaatenurgast on oksüdatsiooniastme muutumine seotud elektronide eemaldumise või liikumisega. Seetõttu saame koos eelnevaga anda ka järgmise definitsiooni redoksreaktsioonidele: need on reaktsioonid, mille käigus elektronid kanduvad ühelt aatomilt, molekulilt või ioonilt teisele.
Vaatleme redoksreaktsioonide teooriaga seotud peamisi sätteid.
1. Oksüdatsioon on aatomi, molekuli või iooni elektronide loovutamise protsess, mille käigus oksüdatsiooniastmed suurenevad.
2. Redutseerimine on protsess, mille käigus aatomile, molekulile või ioonile lisatakse elektrone ja oksüdatsiooniaste väheneb.
3. Aatomeid, molekule või ioone, mis loovutavad elektrone, nimetatakse redutseerivateks aineteks. Reaktsiooni käigus need oksüdeeritakse. Aatomeid, molekule või ioone, mis omandavad elektrone, nimetatakse oksüdeerivateks aineteks. Reaktsiooni käigus need taastatakse.
4. Oksüdatsiooniga kaasneb alati redutseerimine; redutseerimine on alati seotud oksüdatsiooniga, mida saab väljendada võrranditega.
Seetõttu esindavad redoksreaktsioonid kahe vastandliku protsessi – oksüdatsiooni ja redutseerimise – ühtsust. Nendes reaktsioonides on redutseerija poolt ära antud elektronide arv võrdne oksüdeeriva aine poolt saadud elektronide arvuga. Pealegi, sõltumata sellest, kas elektronid liiguvad ühelt aatomilt teisele täielikult või tõmbavad neid ainult osaliselt ühe aatomi poole, räägime tinglikult ainult elektronide vabanemisest ja lisandumisest.
Orgaaniliste ainete redoksreaktsioonid on kõige olulisem omadus, mis neid aineid ühendab. Orgaaniliste ühendite kalduvus oksüdeeruda on seotud mitme sideme, funktsionaalrühmade ja vesinikuaatomite olemasoluga funktsionaalset rühma sisaldava süsinikuaatomi juures.
Mõiste "oksüdatsiooniaste" (CO) kasutamine orgaanilises keemias on väga piiratud ja seda rakendatakse peamiselt redoksreaktsioonide võrrandite koostamisel. Võttes aga arvesse, et reaktsioonisaaduste enam-vähem konstantne koostis on võimalik ainult orgaaniliste ainete täieliku oksüdatsiooni (põlemise) korral, kaob koefitsientide korraldamine mittetäielikes oksüdatsioonireaktsioonides. Sel põhjusel piirdutakse tavaliselt orgaaniliste ühendite muundumiste diagrammi koostamisega.
Meile tundub, et orgaaniliste ühendite kogu omaduste uurimisel on oluline märkida süsinikuaatomi CO väärtus. Oksüdeerivate ainete kohta teabe süstematiseerimine, orgaaniliste ainete struktuuri ja nende CO vahelise seose loomine aitab õpilastel õpetada:
Valige laboratoorsed ja tööstuslikud oksüdeerijad;
Leida orgaanilise aine redoksvõime sõltuvus tema struktuurist;
Looge seos orgaaniliste ainete klassi ja vajaliku tugevuse, agregatsiooniastme ja toimemehhanismiga oksüdeeriva aine vahel;
Ennustage reaktsioonitingimusi ja eeldatavaid oksüdatsiooniprodukte.
Aatomite oksüdatsiooniastme määramine orgaanilistes ainetes
Mis tahes süsinikuaatomi oksüdatsiooniaste orgaanilises aines on võrdne kõigi selle sidemete algebralise summaga rohkemate elektronegatiivsete elementidega (Cl, O, S, N jne), mis on arvestatud plussmärgiga, ja sidemete summaga vesinikuga. aatomid (või mõni muu elektropositiivsem element ), loetakse “-” märgiga. Sel juhul ei võeta arvesse sidemeid naabersüsinikuaatomitega.
Määrame süsinikuaatomite oksüdatsiooniastmed küllastunud süsivesiniku propaani ja alkoholi etanooli molekulides:
Orgaaniliste ainete järjestikust oksüdatsiooni võib kujutada järgmise transformatsioonide ahelana:
Küllastunud süsivesinik Küllastumata süsivesinik Alkohol Aldehüüd (ketoon) Karboksüülhape CO + H O.
Geneetiline seos orgaaniliste ühendite klasside vahel on siin kujutatud redoksreaktsioonide jadana, mis tagavad ülemineku ühest orgaaniliste ühendite klassist teise. Selle lõpetavad orgaaniliste ühendite klasside mis tahes esindaja täieliku oksüdatsiooni (põlemise) saadused.
Rakendus . Tabel nr 1.
CO muutused süsiniku aatomite juures süsiniku molekulis orgaaniliste ühendite molekulides on toodud tabelis. Tabeli andmetest on selge, et liikudes ühest orgaaniliste ühendite klassist teise ja suurendades teatud klassi kuuluvate ühendite molekulide süsiniku karkassi hargnemisastet, muutub süsinikuaatomi oksüdatsiooniaste, mis vastutab ühendi muutuste võime vähendamine. Orgaanilised ained, mille molekulid sisaldavad süsinikuaatomeid maksimaalse (- ja +) CO väärtusega (-4, -3, +2, +3), lähevad täielikku oksüdatsiooni-põlemisreaktsiooni, kuid on vastupidavad kergetele ja. keskmise tugevusega oksüdeerivad ained. Ained, mille molekulid sisaldavad CO -1 süsinikuaatomeid; 0; +1, oksüdeeruvad kergesti, nende redutseerimisvõimed on lähedased, nii et nende mittetäieliku oksüdatsiooni saab saavutada ühe tuntud madala ja keskmise tugevusega oksüdeeriva ainega. Need ained võivad omada kahetist olemust, toimides oksüdeeriva ainena, nagu see on omane anorgaanilistele ainetele.
Orgaaniliste ainete oksüdeerimine ja redutseerimine
Orgaaniliste ühendite suurenenud kalduvus oksüdeeruda on tingitud ainete olemasolust molekulis:

- vesinikuaatomid funktsionaalset rühma sisaldava süsinikuaatomi juures.
Võrdleme primaarseid, sekundaarseid ja tertsiaarseid alkohole nende reaktsioonivõime järgi oksüdatsiooni suhtes:

Primaarsed ja sekundaarsed alkoholid, mille funktsionaalrühma kandva süsinikuaatomi juures on vesinikuaatom; oksüdeeruvad kergesti: esimesed aldehüüdideks, teised ketoonideks. Sel juhul säilib algse alkoholi süsinikskeleti struktuur. Tertsiaarsed alkoholid, mille molekulides ei ole OH-rühma sisaldava süsinikuaatomi juures vesinikuaatomit, normaalsetes tingimustes ei oksüdeeru. Karmides tingimustes (tugevate oksüdeerivate ainete toimel ja kõrgel temperatuuril) võivad need oksüdeeruda madala molekulmassiga karboksüülhapete seguks, s.t. toimub süsiniku skeleti hävimine.
Orgaaniliste ainete elementide oksüdatsiooniastmete määramiseks on kaks lähenemisviisi.
1. Arvutage süsinikuaatomi keskmine oksüdatsiooniaste orgaanilise ühendi, näiteks propaani molekulis.
Selline lähenemine on õigustatud, kui reaktsiooni käigus hävivad kõik keemilised sidemed orgaanilises aines (põlemine, täielik lagunemine).
Pange tähele, et formaalselt võivad sel viisil arvutatud fraktsioneerivad oksüdatsiooniastmed esineda ka anorgaaniliste ainete puhul. Näiteks ühendis KO (kaaliumsuperoksiid) on hapniku oksüdatsiooniaste – 1/2.
2. Määrake iga süsinikuaatomi oksüdatsiooniaste, näiteks butaanis.
Sel juhul võrdub mis tahes süsinikuaatomi oksüdatsiooniaste orgaanilises ühendis kõigi elektronegatiivsemate elementide aatomitega sidemete arvu algebralise summaga, mis on arvestatud märgiga "+", ja vesinikuaatomitega sidemete arvuga. (või mõni muu elektropositiivsem element), loetakse „-” märgiga . Sel juhul ei võeta arvesse sidemeid süsinikuaatomitega.
Lihtsa näitena määrame süsiniku oksüdatsiooniastme metanoolimolekulis.
![]()
Süsinikuaatom on ühendatud kolme vesinikuaatomiga (neid sidemeid loetakse "-" märgiga) ja üks side on ühendatud hapnikuaatomiga (seda loetakse "+" märgiga). Saame:
Seega on süsiniku oksüdatsiooniaste metanoolis -2.
Süsiniku arvutuslik oksüdatsiooniaste, ehkki tingimuslik väärtus, näitab elektrontiheduse nihke olemust molekulis ja selle muutus reaktsiooni tulemusena näitab toimuvat redoksprotsessi.
Vaatleme ainete teisenduste ahelat:

Etaani katalüütiline dehüdrogeenimine annab etüleeni; etüleeni hüdratatsiooni produkt on etanool; selle oksüdatsioon viib etanaali ja seejärel äädikhappeni; Põlemisel tekib süsihappegaas ja vesi.
Määrame iga süsinikuaatomi oksüdatsiooniastme loetletud ainete molekulides.

Võib märkida, et iga sellise transformatsiooni käigus muutub ühe süsinikuaatomi oksüdatsiooniaste pidevalt. Suunas etaanist süsinikmonooksiidile (IV) suureneb süsinikuaatomi oksüdatsiooniaste.
Vaatamata asjaolule, et mis tahes redoksreaktsiooni käigus toimuvad nii oksüdatsioon kui ka redutseerimine, klassifitseeritakse need sõltuvalt sellest, mis orgaanilise ühendiga otse toimub (kui see oksüdeerub, räägime oksüdatsiooniprotsessist, kui redutseerimisest, siis redutseerimisprotsessist ).
Seega etanooli reaktsioonis kaaliumpermanganaadiga etanool oksüdeerub ja kaaliumpermanganaat redutseerub. Reaktsiooni nimetatakse etanooli oksüdatsiooniks.
Redoksvõrrandite koostamine
Redoksreaktsioonide võrrandite koostamiseks kasutatakse nii elektronide tasakaalu meetodit kui ka poolreaktsiooni meetodit (elektron-ioon meetod). Vaatleme mitmeid näiteid redoksreaktsioonidest, mis hõlmavad orgaanilisi aineid.
1. N-butaani põletamine.
Reaktsiooniskeem näeb välja selline:
Loome tasakaalumeetodi abil keemilise reaktsiooni täieliku võrrandi.
Süsiniku oksüdatsiooniastme keskmine väärtus n-butaanis:
Süsiniku oksüdatsiooniaste süsinikmonooksiidis (IV) on +4.
Koostame elektroonilise bilansi diagrammi:

Võttes arvesse leitud koefitsiente, näeb n-butaani põlemise keemilise reaktsiooni võrrand välja järgmine:
Selle võrrandi koefitsiendid saab leida teise meetodiga, mida on juba mainitud. Olles arvutanud iga süsinikuaatomi oksüdatsiooniastmed, näeme, et need erinevad:
Sel juhul näeb elektrooniline tasakaaludiagramm välja järgmine:

Kuna n-butaani põlemisel hävivad kõik selle molekulides olevad keemilised sidemed, on antud juhul esimene lähenemine igati õigustatud, seda enam, et teise meetodiga koostatud elektrooniline tasakaaludiagramm on mõnevõrra keerulisem.
2. Etüleeni oksüdatsioonireaktsioon kaaliumpermanganaadi lahusega neutraalses keskkonnas külmas (Wagneri reaktsioon).
Järjestame koefitsiendid reaktsioonivõrrandis elektroonilise tasakaalu meetodil.

Keemilise reaktsiooni täielik võrrand näeks välja järgmine:
Koefitsientide määramiseks võite kasutada ka poolreaktsiooni meetodit. Etüleen oksüdeeritakse selles reaktsioonis etüleenglükooliks ja permanganaadi ioonid redutseeritakse, moodustades mangaandioksiidi.
Vastavate poolreaktsioonide skeemid:
Elektronioonide summaarne võrrand:
3. Glükoosi oksüdatsioonireaktsioonid kaaliumpermanganaadiga happelises keskkonnas.
A. Elektroonilise tasakaalu meetod.
Esimene variant

Teine variant
Arvutame välja iga süsinikuaatomi oksüdatsiooniastme glükoosimolekulis:

Elektrooniline saldoskeem muutub varasemate näidetega võrreldes keerukamaks:

B. Sel juhul on poolreaktsiooni meetod järgmine:
Kogu iooniline võrrand:
Glükoosi ja kaaliumpermanganaadi reaktsiooni molekulaarvõrrand:
Orgaanilises keemias on kasulik kasutada oksüdatsiooni definitsiooni kui hapnikusisalduse suurenemist või vesinikusisalduse vähenemist. Vähenemist defineeritakse sel juhul hapnikusisalduse vähenemisena või vesinikusisalduse suurenemisena. Selle määratlusega saab orgaaniliste ainete järjestikust oksüdatsiooni kujutada järgmise skeemi abil:
![]()
![]()
Praktika näitab, et orgaaniliste ainete oksüdatsioonireaktsioonide koefitsientide valimine tekitab teatud raskusi, kuna tuleb toime tulla väga ebatavaliste oksüdatsiooniastmetega.Mõned õpilased jätkavad kogemuste puudumise tõttu oksüdatsiooniastme tuvastamist valentsiga ja kui orgaaniliste ühendite süsiniku oksüdatsiooniastet valesti määrama. Nendes ühendites on süsiniku valentsus alati neli ja oksüdatsiooniaste võib võtta erinevaid väärtusi (-3 kuni +4, sealhulgas murdosa väärtused). Ebatavaline punkt orgaaniliste ainete oksüdatsioonis on süsinikuaatomi nulloksüdatsiooniaste mõnes kompleksühendis. Kui ületate psühholoogilise barjääri, pole selliste võrrandite koostamine keeruline, näiteks:
Sahharoosi süsinikuaatomi oksüdatsiooniaste on null. Kirjutame ümber reaktsiooniskeemi, mis näitab neid muutvate aatomite oksüdatsiooniastmeid:
Koostame elektroonilised võrrandid ja leiame oksüdeerija ja redutseerija koefitsiendid ning nende oksüdatsiooni- ja redutseerimisproduktid:

Asendame saadud koefitsiendid reaktsiooniskeemi:
Ülejäänud koefitsiendid valime järgmises järjestuses: KSO, HSO, HO. Lõppvõrrand näeb välja järgmine:
Paljud ülikoolid lisavad sisseastumiseksamipiletitele ülesandeid OVR võrrandites koefitsientide valimiseks elektroonilisel meetodil (poolreaktsiooni meetod). Kui koolis sellele meetodile vähemalt veidi tähelepanu pööratakse, siis peamiselt anorgaaniliste ainete oksüdeerimiseks. Proovime kasutada poolreaktsiooni meetodit ülaltoodud näite puhul sahharoosi oksüdeerimisest kaaliumpermanganaadiga happelises keskkonnas.
Selle meetodi esimene eelis on see, et reaktsiooniprodukte pole vaja kohe ära arvata ja üles kirjutada. Neid on võrrandi abil üsna lihtne määrata. Oksüdeeriv aine happelises keskkonnas avaldab oma oksüdeerivaid omadusi kõige paremini, näiteks MnO anioon muundatakse Mn-katiooniks, kergesti oksüdeeruvad orgaanilised ained oksüdeeritakse CO-ks.
Kirjutame üles sahharoosi muundumised molekulaarsel kujul:
Vasakul pool on puudu 13 hapnikuaatomit, selle vastuolu kõrvaldamiseks lisame 13 HO molekuli. CH
2. Kartsova A.A., Levkin A.N. Oksüdatsiooni-redutseerimisreaktsioonid orgaanilises keemias // Keemia koolis. - 2004. - nr 2. – Lk.55-61.
3. Khomchenko G.P., Savostjanova K.I. Oksüdatsiooni-redutseerimisreaktsioonid: käsiraamat õpilastele. M.-: Haridus, 1980.
4. Šarafutdinov V. Oksüdatsiooni-redutseerimisreaktsioonid orgaanilises keemias // Baškortostan ukytyusyhy. - 2002. - nr 5. – Lk.79 -81.
Füüsikalised omadused
Benseen ja selle lähimad homoloogid on spetsiifilise lõhnaga värvitud vedelikud. Aromaatsed süsivesinikud on veest kergemad ega lahustu selles, kuid lahustuvad kergesti orgaanilistes lahustites – alkoholis, eetris, atsetoonis.
Benseen ja selle homoloogid on ise paljude orgaaniliste ainete head lahustid. Kõik areenid põlevad suitsuse leegiga nende molekulide suure süsinikusisalduse tõttu.
Mõne areeni füüsikalised omadused on toodud tabelis.
Tabel. Mõne areeni füüsikalised omadused
|
Nimi |
Valem |
t°.pl., |
t°.b.p., |
|
Benseen |
C6H6 |
5,5 |
80,1 |
|
Tolueen (metüülbenseen) |
C6H5CH3 |
95,0 |
110,6 |
|
Etüülbenseen |
C6H5 C2H5 |
95,0 |
136,2 |
|
Ksüleen (dimetüülbenseen) |
C6H4(CH3)2 |
||
|
orto- |
25,18 |
144,41 |
|
|
meta- |
47,87 |
139,10 |
|
|
paar- |
13,26 |
138,35 |
|
|
Propüülbenseen |
C6H5(CH2)2CH3 |
99,0 |
159,20 |
|
Kumeen (isopropüülbenseen) |
C6H5CH(CH3)2 |
96,0 |
152,39 |
|
Stüreen (vinüülbenseen) |
C6H5CH=CH2 |
30,6 |
145,2 |
Benseen - madala keemistemperatuuriga ( tpall= 80,1°C), värvitu vedelik, vees lahustumatu
Tähelepanu! Benseen - mürk, mõjutab neere, muudab vere valemit (pikaajalise kokkupuute korral), võib häirida kromosoomide struktuuri.
Enamik aromaatsetest süsivesinikest on eluohtlikud ja mürgised.
Areenide (benseen ja selle homoloogid) valmistamine
Laboris
1. Bensoehappe soolade liitmine tahkete leelistega
C6H5-COONa + NaOH t → C6H6 + Na2CO3
naatriumbensoaat
2. Wurtz-Fitting reaktsioon: (siin G on halogeen)
C 6H 5 -G + 2Na + R-G →C 6 H 5 - R + 2 NaG
KOOS 6 H5-Cl + 2Na + CH3-Cl → C6H5-CH3 + 2NaCl
Tööstuses
- eraldatud naftast ja kivisöest fraktsioneeriva destilleerimise ja reformimise teel;
- kivisöetõrvast ja koksiahju gaasist
1. Alkaanide dehüdrotsüklistamine rohkem kui 6 süsinikuaatomiga:
C6H14 t , kat→C6H6 + 4H2
2. Atsetüleeni trimmeriseerimine(ainult benseeni jaoks) – R. Zelinsky:
3С 2 H 2 600°C, seadus. kivisüsi→C6H6
3. Dehüdrogeenimine tsükloheksaan ja selle homoloogid:
Nõukogude akadeemik Nikolai Dmitrijevitš Zelinski tegi kindlaks, et benseen moodustub tsükloheksaanist (tsükloalkaanide dehüdrogeenimine
C6H12 t, kat→C6H6 + 3H2

C6H11-CH3 t , kat→C6H5-CH3 + 3H2
metüültsükloheksantolueen
4. Benseeni alküülimine(benseeni homoloogide valmistamine) – r Friedel-Crafts.
C6H6 + C2H5-Cl t, AlCl3→C6H5-C2H5 + HCl
kloroetaan etüülbenseen

Areenide keemilised omadused
I. OKSIDATSIOONI REAKTSIOONID
1. Põlemine (suitsuleek):
2C6H6 + 15O2 t→12CO2 + 6H2O + Q
2. Normaaltingimustes ei muuda benseen broomvett ja kaaliumpermanganaadi vesilahust
3. Benseeni homoloogid oksüdeeritakse kaaliumpermanganaadiga (muutb kaaliumpermanganaadi värvi):
A) happelises keskkonnas bensoehappeks
Kui benseeni homoloogid puutuvad kokku kaaliumpermanganaadi ja teiste tugevate oksüdeerivate ainetega, külgahelad oksüdeeruvad. Ükskõik kui keeruline on asendaja ahel, see hävib, välja arvatud a-süsiniku aatom, mis oksüdeerub karboksüülrühmaks.
Ühe kõrvalahelaga benseeni homoloogid annavad bensoehappe:
Kaht külgahelat sisaldavad homoloogid annavad kahealuselisi happeid:
5C6H5-C2H5 + 12KMnO4 + 18H2SO4 → 5C6H5COOH + 5CO2 + 6K2SO4 + 12MnSO4 +28H2O
5C6H5-CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 +14H2O
Lihtsustatud :
C6H5-CH3+3O KMnO4→C 6 H 5 COOH + H 2 O
B) neutraalsetes ja kergelt aluselistes kuni bensoehappe soolades
C6H5-CH3 + 2KMnO4 → C6H5COO K + K OH + 2MnO 2 + H 2 O
II. LISAREAKTSIOONID (kõvem kui alkeenid)
1. Halogeenimine
C6H6 +3Cl2 h ν → C 6 H 6 Cl 6 (heksaklorotsükloheksaan - heksakloraan)
2. Hüdrogeenimine
C6H6 + 3H2 t , PtvõiNi→C6H12 (tsükloheksaan)
3. Polümerisatsioon
III. ASENDUSREAKTSIOONID - ioonmehhanism (kergem kui alkaanid)
1. Halogeenimine -
a ) benseen
C6H6+Cl2 AlCl 3 → C6H5-Cl + HCl (klorobenseen)
C6H6 + 6Cl2 t,AlCl3→C6Cl6 + 6HCl( heksaklorobenseen)
C6H6 + Br2 t, FeCl3→ C6H5-Br + HBr( bromobenseen)
b) benseeni homoloogid kiiritamisel või kuumutamisel
Alküülradikaalide keemilised omadused on alkaanidega sarnased. Nendes olevad vesinikuaatomid asendatakse vabade radikaalide mehhanismi abil halogeeniga. Seetõttu toimub katalüsaatori puudumisel kuumutamisel või UV-kiirgusel kõrvalahelas radikaalne asendusreaktsioon. Benseenitsükli mõju alküülasendajatele toob kaasa asjaolu, et Vesinikuaatom asendatakse alati süsinikuaatomiga, mis on otseselt seotud benseenitsükliga (a-süsiniku aatom).
1) C6H5-CH3 + Cl2 h ν → C6H5-CH2-Cl + HCl
c) benseeni homoloogid katalüsaatori juuresolekul
C6H5-CH3 + Cl2 AlCl 3 → (orta segu, derivaatide paar) +HCl
2. Nitreerimine (lämmastikhappega)
C6H6 + HO-NO 2 t, H2SO4→C6H5-NO2 + H2O
nitrobenseen - lõhn mandlid!
C6H5-CH3 + 3HO-NO2 t, H2SO4→ KOOS H3-C6H2(NO2)3 + 3H2O2,4,6-trinitrotolueen (tol, TNT)
Benseeni ja selle homoloogide kasutamine
Benseen C6H6 on hea lahusti. Benseen lisandina parandab mootorikütuse kvaliteeti. See toimib toorainena paljude aromaatsete orgaaniliste ühendite tootmiseks - nitrobenseen C 6 H 5 NO 2 (lahusti, millest saadakse aniliini), klorobenseen C 6 H 5 Cl, fenool C 6 H 5 OH, stüreen jne.
Tolueen C 6 H 5 –CH 3 – lahusti, kasutatakse värvainete, ravimite ja lõhkeainete (TNT (TNT) või 2,4,6-trinitrotolueen TNT) tootmisel.
Ksüleenid C6H4(CH3)2. Tehniline ksüleen on kolme isomeeri segu ( orto-, meta- Ja paar-ksüleenid) – kasutatakse lahustina ja lähteproduktina paljude orgaaniliste ühendite sünteesil.
Isopropüülbenseen C 6 H 5 –CH(CH 3) 2 kasutatakse fenooli ja atsetooni tootmiseks.
Benseeni klooritud derivaadid kasutatakse taimekaitseks. Seega on benseeni H-aatomite asendamise produkt klooriaatomitega heksaklorobenseen C 6 Cl 6 - fungitsiid; seda kasutatakse nisu- ja rukkiseemnete kuivtöötlemiseks tatu vastu. Benseenile kloori lisamise saadus on heksaklorotsükloheksaan (heksakloraan) C 6 H 6 Cl 6 - insektitsiid; seda kasutatakse kahjulike putukate tõrjeks. Nimetatud ained kuuluvad pestitsiidide hulka – keemilised vahendid mikroorganismide, taimede ja loomade vastu võitlemiseks.
Stüreen C 6 H 5 – CH = CH 2 polümeriseerub väga kergesti, moodustades polüstüreeni ja kopolümeriseerumisel butadieeniga stüreen-butadieenkummid.
VIDEOKOGEMUSED
Redoksreaktsioonid orgaanilises keemias pakuvad suurimat huvi, sest üleminek ühest oksüdatsiooniastmest teise sõltub tugevalt reaktiivi õigest valikust ja reaktsioonitingimustest. OVR-i õpitakse kohustuslikus keemiakursuses ebapiisavalt, kuid ühtse riigieksami katsematerjalides ei leidu neid mitte ainult ülesannetes C1 ja C2, vaid ka ülesannetes S3, mis kujutavad endast orgaaniliste ainete teisenduste ahelat.
Lae alla:
Eelvaade:
Esitluse eelvaadete kasutamiseks looge Google'i konto ja logige sisse: https://accounts.google.com
Slaidi pealdised:
REDOKSREAKTSIOONID ORGAANILISES KEEMIAS
"Mõtlemine on lihtne, tegutsemine on raske ja mõtte teoks muutmine on maailma kõige raskem asi." I. Goethe Oksüdatsiooni-redutseerimisreaktsioonid orgaanilises keemias pakuvad kõige suuremat huvi, sest Ühest oksüdatsiooniolekust teise ülemineku selektiivsus sõltub tugevalt reaktiivi õigest valikust ja reaktsioonitingimustest. Kuid kohustuslikul keemiakursusel ei õpita OVR-i piisavalt täielikult. Erilist tähelepanu tuleks pöörata orgaaniliste ainete osalusel toimuvatele redoksprotsessidele. Selle põhjuseks on asjaolu, et USE katsematerjalide redoksreaktsioone ei leita mitte ainult ülesannetes C1 ja C2, vaid ka ülesannetes S3, mis kujutavad endast orgaaniliste ainete muundumiste ahelat. Kooliõpikutes on oksüdeerija sageli noole kohal kirjas [O]. Selliste ülesannete täitmise nõue ühtsel riigieksamil on kõigi lähteainete ja reaktsioonisaaduste kohustuslik määramine koos vajalike koefitsientide paigutusega. Redoksreaktsioonid on traditsiooniliselt olulised ja samas tekitab õpilastele 10. klassi kursusel “Orgaaniline keemia” õppimine teatud raskusi.
C3. Selle ploki ülesanded kontrollivad teadmisi orgaanilisest keemiast.Orgaaniliste ainete muundumiste ahelates leidub OVR-e valdavas enamuses ülesannetest. Eksperdil on õigus punkti anda ainult siis, kui üles on kirjutatud võrrand, mitte reaktsiooniskeem, s.t. Koefitsiendid on õigesti seatud. Reaktsioonides, mis hõlmavad anorgaanilisi oksüdeerivaid aineid (kaaliumpermanganaat, kroom (VI) ühendid, vesinikperoksiid jne), võib seda ilma elektroonilise tasakaaluta olla raske teha.
Aatomite oksüdatsiooniastme määramine orgaaniliste ühendite molekulides Reegel: CO (aatom) = rohkemate EO aatomitega sidemete arv miinus vähema EO aatomitega sidemete arv.
Süsinikuaatomite oksüdatsiooniastme muutused orgaaniliste ühendite molekulides. Orgaaniliste ühendite klass Süsinikuaatomi oksüdatsiooniaste -4/-3 -2 -1 0 +1 +2 +3 +4 Alkaanid CH 4 CH 3 -CH 3 CH 3 -CH 2 -CH 3 CH 3 | CH3-CH-CH3CH3 | CH3-C-CH3 | CH 3 - - - - Alkeenid - CH 2 = CH 2 CH 3 -CH=CH 2 - - - - Alküünid - - CH=CH CH 3 -C=CH - - - - Alkoholid _ _ H 3 C-CH 2 - OH H 3 C-CH-CH 3 | OH CH 3 | H 3 C - C - CH 3 | OH - - - Haloalkaanid - - H 3 C-CH 2 - CI H 3 C - CH - CH 3 | CI CH 3 | H 3 C - C - CH 3 | CI - - - Aldehüüdid ja ketoonid - - - - H 3 C-CH =O H 3 C-C OCH 3 - - Karboksüülhapped - - - - - - H 3 C-C OOH - Täielikud oksüdatsiooniproduktid - - - - - - - CO 2
Orgaaniliste ühendite kalduvus oksüdeeruda on seotud: mitmete sidemete olemasoluga (alkeenid, alküünid, alkadieenid oksüdeeruvad kergesti); kergesti oksüdeeruvad funktsionaalrühmad (-OH, -CHO, -NH 2); aktiveeritud alküülrühmad, mis asuvad mitme sideme või benseenitsükli kõrval (näiteks propeeni saab oksüdeerida küllastumata aldehüüd-akroleiiniks, tolueeni oksüdeerimine bensoehappeks kaaliumpermanganaadiga happelises keskkonnas); vesinikuaatomite olemasolu funktsionaalset rühma sisaldava süsinikuaatomi juures.
1. ORGAANILISTE ÜHENDITE PEHME OKSÜDEERIMINE Orgaaniliste ühendite (alkoholid, aldehüüdid, küllastumata ühendid) pehmeks oksüdeerimiseks kasutatakse kroom(VI) ühendeid - kroom(VI)oksiid, CrO 3, kaaliumdikromaat K 2 C r 2 O 7, jne. Reeglina toimub oksüdatsioon happelises keskkonnas, redutseerimisproduktideks on kroomi (III) soolad, näiteks: 3CH 3 –CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 → 3CH 3 –COOH + 4K 2 SO 4 + Cr 2 (SO 4) 3 + 4H 2 O t 3CH 3 – CH 2 OH + 2K 2 Cr 2 O 7 + 8H 2 SO 4 → 3CH 3 -COOH + 2K 2 SO 4 + 2Cr 2 (SO ) 4) 3 + 11H 2 O Alkoholide oksüdeerimisel kaaliumdikromaadiga külmas saab oksüdatsiooni peatada aldehüüdi moodustumise staadiumis, kuid kuumutamisel tekivad karboksüülhapped: 3CH 3 –CH 2 OH+K 2 Cr 2 O7 +4H2SO4 →3CH3 –CHO+K2SO4 +Cr2(SO4)3+7H2O
ALC EN + KMnO4 -1 KOH H 2SO4 Diool Süsinikhappe sool + karbonaat Süsinikhape + CO 2 ALC EN + KMnO4 -2 KOH H 2SO4 2 süsihappe soolad 2 süsihapped Diool 2. Oluliselt tugevam oksüdeerija on kaaliumpermanganaat NEUTRA. NEUTRAALNE
C 2 H 2 + 2KMnO 4 +3H 2 SO 4 =2CO 2 + 2MnSO 4 + 4H 2 O + K 2 SO 4 ALC IN + KMnO4 -1 KOH H 2SO4 Süsinikhappe sool + karbonaat Süsinikhape + CO 2 ALK IN + KMnO4 -2 KOH H 2SO4 2 soolad süsivesikud. ühendid 2 süsinikuühendit 5CH 3 C = CH + 8KMnO 4 + 12H 2 SO 4 = 5CH 3 COOH + 5CO 2 + 8MnSO 4 + 4K 2 SO 4 + 12H 2 O
5C 6 H 5 -CH 3 +6 KMnO 4 + H 2 SO 4 5C 6 H 5 COOH + 6MnSO 4 + K 2 SO 4 + 14H 2 O C 6 H 5 CH 3 + 2KMnO 4 C 6 H 5 COOK + 2 + KOH + H 2 O C 6 H 5 CH 2 CH 3 + 4KMnO 4 C 6 H 5 COOK + K 2 CO 3 + 2H 2 O + 4MnO 2 + KOH Benseeni homoloogid + KMnO4 KOH H 2SO4 bensoehape NEUTRAAL. Bensoaat
Hapnikku sisaldavate ühendite redoksomadused Alkoholide oksüdeerivateks aineteks on kõige sagedamini vask(II)oksiid või kaaliumpermanganaat ning aldehüüdide ja ketoonide oksüdeerijateks vask(II)hüdroksiid, hõbeoksiidi ammoniaagilahus ja muud oksüdeerivad ained.
OL + KMnO4 -1 KOH H 2SO4 ALDEHÜÜD OL + KMnO4 -2 KOH H 2SO4 ketoon OL + K MnO4 (eks.) -1 KOH H 2SO4 NEUTER Karboksüülhappe sool Karboksüülhappe sool Karboksüülhape
Aldehüüd + KMnO4 KOH H 2SO4 Karboksüülhape + karboksüülhappe sool Karboksüülhappe sool karboksüülhape NEUTRAALNE. 3CH 3 CHO + 2 KMnO 4 = CH 3 COOH + 2 CH 3 COOK + 2 MnO 2 + H 2 O
Aldehüüdid on üsna tugevad redutseerijad ja seetõttu oksüdeeruvad kergesti erinevate oksüdeerijatega CH 3 CHO + 2OH CH 3 COONH 4 + 2Ag + H 2 O + 3NH 3
Koefitsientide valimise algoritm Kuna ülesandes C3 ei ole OVR võrrandite koostamisel vaja elektroonilisi tasakaaluvõrrandeid kirjutada, on koefitsiente mugav valida lineaarse tasakaalu meetodil - elektroonilise tasakaalu lihtsustatud meetodil. 1 . Koostamisel on OVR-skeem. Näiteks tolueeni oksüdeerimiseks bensoehappeks hapendatud kaaliumpermanganaadi lahusega on reaktsiooniskeem järgmine: C 6 H 5 -CH 3 + KMnO 4 + H 2 SO 4 C 6 H 5 -C OO H + K 2 SO 4 + MnSO 4 + H 2 O 2. Näidatud on d.o. aatomid. S.o. süsinikuaatom määratakse vastavalt ülaltoodud meetodile. C 6 H 5 -C -3 H 3 + KMn +7 O 4 + H 2 SO 4 C 6 H 5 -C +3 OO H + K 2 SO 4 + Mn +2 SO 4 + H 2 O 3. Arv süsinikuaatomi (6) poolt loovutatud elektronid kirjutatakse koefitsiendina enne oksüdeeriva aine (kaaliumpermanganaadi) valemit: C 6 H 5 -C -3 H 3 + 6 KMn +7 O 4 + H 2 SO 4 C 6 H 5 -C + 3 OO H + K 2 SO 4 + Mn +2 SO 4 + H 2 O 4. Mangaani aatomi (5) poolt vastuvõetud elektronide arv kirjutatakse koefitsiendina valemi ette. redutseerija (tolueen): 5 C 6 H 5 -C -3 H 3 + 6 KMn +7 O 4 + H 2 SO 4 C 6 H 5 -C +3 OO H + K 2 SO 4 + Mn +2 SO 4 + H 2 O 5. Olulisemad koefitsiendid on paigas. Edasine valik pole keeruline: 5 C 6 H 5 -CH 3 + 6 KMnO 4 + 9 H 2 SO 4 5 C 6 H 5 -C OO H + 3 K 2 SO 4 + 6 MnSO 4 + 14 H 2 O
Näidistesti ülesanne (C3) 1. Kirjutage reaktsioonivõrrandid, mille abil saab sooritada järgmisi teisendusi: Hg 2+, H + KMnO 4, H + C l 2 (ekvimol.), h C 2 H 2 X 1 CH 3 COOH X 2 CH 4 X 3 1. Kutšerovi reaktsioon. Hg 2+, H + CH CH + H 2 O CH 3 CHO 2. Aldehüüdid oksüdeeruvad happelises keskkonnas kergesti karboksüülhapeteks, sealhulgas selliseks tugevaks oksüdeerijaks nagu kaaliumpermanganaat. CH 3 CHO + KMnO 4 + H 2 SO 4 CH 3 COOH + K 2 SO 4 + MnSO 4 + H 2 O CH 3 C +1 H O + KMn +7 O 4 + H 2 SO 4 CH 3 -C + 3 OO Н + K 2 SO 4 + Mn + 2 SO 4 + H 2 O 5 CH 3 CHO + 2 KMnO 4 + 3 H 2 SO 4 5 CH 3 COOH + K 2 SO 4 + 2 MnSO 4 + 3 H 2 O 3. Ahela järgmise lüli lõpetamiseks on vaja ainet X 2 hinnata kahest positsioonist: esiteks moodustub see ühes etapis äädikhappest ja teiseks saab sellest metaani. See aine on leelismetalli atsetaat. Kolmanda ja neljanda reaktsiooni võrrandid on kirjas. CH 3 COOH + NaOH CH 3 COONa + H 2 O liitmine 4. CH 3 COONa + NaOH CH 4 + Na 2 CO 3 5. Järgmise reaktsiooni (valgus) tingimused näitavad selgelt selle radikaalset olemust. Võttes arvesse näidatud reaktiivide suhet (ekvimolaarne), kirjutatakse viimase reaktsiooni võrrand: h CH 4 + Cl 2 CH 3 Cl + HCl
Simulaatori saidid: http://reshuege.ru/ (lahendan ühtse riigieksami) http://4ege.ru/himiya/4181-demoversiya-ege-po-himii-2014.html (Ühtse riigieksami portaal) http ://www.alleng. ru/edu/chem3.htm (Interneti õppematerjalid – keemia) http://ege.yandex.ru/ (veebitestid)