Išsiskyręs bromas atskiriamas ekstrahuojant nepoliniais tirpikliais arba distiliuojant garais. Pažiūrėkite, kas yra „bromas“ kituose žodynuose. Bromas yra skystis
Bromo atradimą paskatino prancūzų chemikas A. Balardas, kuris 1825 m., veikdamas chloru vandeninį tirpalą, gautą išplovus jūros dumblių pelenus, išskyrė tamsiai rudą, bjauraus kvapo skystį. Šį skystį jis pavadino muridu (iš lot. muria – sūrymas) ir išsiuntė žinutę apie savo atradimą Paryžiaus mokslų akademijai. Komisija naująjį elementą pavadino bromu dėl to, kad bromas turi stiprų, nemalonų garų kvapą (iš graikų k. brwmoz- smarvė).
Būnant gamtoje, gauti:
Bromo kiekis žemės plutoje (1,6*l0 -4 % masės) įvertintas 10 15 -10 16 t.Bromas yra nuolatinis chloro palydovas. Bromidų druskų (NaBr, KBr, MgBr 2) randama chlorido druskų nuosėdose (valgomojoje druskoje iki 0,03%, kalio druskose - silvite ir karnalite - iki 0,3%), taip pat jūros vandenyje (0,065%). , druskos ežerų sūrymai (iki 0,2 %) ir požeminiai sūrymai, paprastai susiję su druskos ir naftos telkiniais (iki 0,1 %).
Pramoninės bromo gamybos pradinės medžiagos yra jūros vanduo, ežero vanduo ir požeminis vanduo, kuriame yra bromo bromido jonų pavidalu. Bromas išskiriamas naudojant chlorą ir pašalinamas iš tirpalo vandens garais arba oru. Iš gauto bromo ir oro mišinio bromas pašalinamas naudojant cheminius absorbentus. Tam naudojami geležies bromido tirpalai. Iš gautų tarpinių produktų bromas išskiriamas veikiant chlorui arba rūgštimi. Tada bromas atskiriamas nuo vandens ir išvalomas nuo chloro priemaišų distiliuojant.
Laboratorijose taip pat naudojami bromido oksidacijos procesai:
6KBr + K 2Cr 2 O 7 + 7H 2 SO 4 = 3Br 2 + Cr 2 (SO 4) 3 + 4K 2 SO 4 + 7H 2 O
Fizinės savybės:
Bromas yra vienintelis nemetalas, kuris kambario temperatūroje yra skystas. Paprasta medžiaga yra sunkus raudonai rudas skystis, turintis nemalonų kvapą (tankis esant 20°C - 3,1 g/cm 3, virimo temperatūra +59,82°C), bromo garai yra gelsvai rudos spalvos. Esant -7,25°C temperatūrai bromas sukietėja į raudonai rudus adatos formos kristalus su silpnu metaliniu blizgesiu. Bromas geriau tirpsta vandenyje nei kiti halogenai (3,58 g/100 g H 2 O esant 20 °C) - " bromo vandens„Bromą daug geriau ištirpiname organiniuose tirpikliuose, nei jis naudojamas išgaunant jį iš vandeninių tirpalų.
Cheminės savybės:
Bromas yra stiprus oksidatorius, jis tiesiogiai reaguoja su beveik visais nemetalais (išskyrus tauriąsias dujas, deguonį, azotą ir anglį) ir daugeliu metalų:
2P + 3Br2 = 2PBr3; 2Al + 3Br 2 = 2AlBr 3
Vandeninėje aplinkoje bromas oksiduoja nitritus į nitratus, amoniaką – į azotą, jodidus – į laisvą jodą, sierą, o sulfitus – į sieros rūgštį:
2NH3 + 6Br2 = N2 + 6HBr; 3Br2 + S + 4H2O = 6HBr + H2SO4
Kai bromas reaguoja su šarmų tirpalais, susidaro atitinkami bromidai ir hipobromitai (šaltyje) arba bromatai:
Br 2 + 2NaOH = NaBr + NaBrO + H 2 O (esant t Bromui būdingi junginiai su nelyginėmis oksidacijos būsenomis: -1, +1, +3, +5, +7.
Svarbiausios jungtys:
Vandenilio bromidas HBr- nuodingos bespalvės aštraus kvapo dujos, kurios dėl sąveikos su vandens garais garuoja ore. Jis gerai tirpsta vandenyje: 0 ° C temperatūroje viename vandens tūryje ištirpsta 612 tūrių vandenilio bromido. Sprendimas – stiprus vienbazis vandenilio bromo rūgštis. druskos - bromidai bespalviai kristalai, gerai tirpsta vandenyje (netirpus AgBr, šviesiai geltonas).
Bromo (I) oksidas Br 2 O., rudos dujos. Susidaro bromui veikiant HgO CCl 4 . Savybės...
Hipobrominė rūgštis HBrO- stiprus oksidatorius. Susidaro bromui ištirpus vandenyje, veikiamas šviesos suyra į HBr ir deguonį; turi silpnų rūgščių savybių ir egzistuoja tik tirpale. druskos - hipobromitai, KBrO, NaBrO – gaunamas laisvos būsenos kristalinių hidratų pavidalu. Visi jie yra labai nestabilūs, kaitinami (arba parūgštinti tirpalai) skyla į bromidą ir bromatą:
3KBrO = 2KBr + KBrO 3
Bromitai, Oksiduojant hipobromitus bromu šarminėje terpėje susidaro HBrO 2 druskos - nežinomos net bromo rūgšties tirpale: Ba(BrO) 2 + 2Br 2 + 4KOH = Ba(BrO 2) 2 + 4KBr + 2H 2 O
Bromo rūgštis, HBrO 3 – koncentruotas tirpalas yra bespalvis sirupo pavidalo skystis. druskos - bromatai. Bromo rūgštis ir bromatai yra stiprūs oksidatoriai:
2S + 2NaBrO 3 = Na 2 SO 4 + Br 2 + SO 2
Bromo rūgštis HBrO 4 yra vandeniniuose tirpaluose, kurių koncentracija neviršija 6 mol/l. Nepaisant to, kad HBrO 4 yra stipriausias oksidatorius tarp bromo deguonies rūgščių, reakcijos su jo dalyvavimu vyksta labai lėtai.
Bromo trifluoridas, BrF 3 - raudonas skystis su bp. 126°C, susidaro dėl tiesioginės bromo reakcijos su fluoru. Sprogiai reaguoja su vandeniu ir organinėmis medžiagomis. Neorganinių junginių atžvilgiu jis elgiasi kaip stiprus fluorinantis agentas.
Taikymas:
Bromas ir jo junginiai plačiai naudojami pagrindinėje organinėje sintezėje. Sidabro bromidas AgBr naudojamas fotografijoje kaip šviesai jautri medžiaga. Bromo junginiai naudojami kuriant antipirenus – priedus, kurie suteikia plastikų, medienos ir tekstilės medžiagų atsparumą ugniai. Bromo pentafluoridas kartais naudojamas kaip labai galingas raketų kuro oksidatorius. 1,2-dibrometanas naudojamas kaip antidetonacinis priedas variklių degaluose. Aliejų gamyboje naudojami bromido tirpalai. Medicinoje natrio ir kalio bromidas naudojamas kaip raminamieji vaistai.
Biologinis vaidmuo ir toksiškumas:
Paprasta bromas yra nuodingas. Skystas bromas sukelia sunkiai gyjančius nudegimus. Bromo garai, kurių koncentracija yra 1 mg/m3, sukelia gleivinių dirginimą, kosulį, galvos svaigimą ir galvos skausmą, o didesnė koncentracija (>60 mg/m3) sukelia uždusimą ir mirtį.
Žmogaus organizme bromas bromido jonų pavidalu dalyvauja skydliaukės reguliavime, nes yra konkurencingas jodo inhibitorius.
Petrova M.A., Pukhova M.S.
HF Tiumenės valstybinis universitetas, 572 grupė.
Enciklopedija „Aplink pasaulį“:
Bromas
BROMAS-a (-y); m.[iš graikų kalbos bromos – blogas kvapas]
1. Cheminis elementas (Br), sunkus raudonai rudas toksiškas skystis, dūmuojantis ore (naudojamas chemijos gamyboje, druskų pavidalu – medicinoje ir fotografijoje). Bromo druskos. Potion su bromu.
2. Vaistinis preparatas, kurio sudėtyje yra šios medžiagos arba jos junginių (vartojamas kaip raminamasis arba migdomasis). Išrašyti, priimti b. Įpilkite bromo (bromo).
◁ Bromas, oi, oi. B vaistai. Bth vanduo(vandeninis bromo tirpalas). Bromas, oi, oi. B vaistai. Bromidas, oi, oi. B-druskos, metalai. Kalio bromido tirpalas(raminantys lašai).
bromas(lot. Bromum), periodinės lentelės VII grupės cheminis elementas, priklauso halogenams. Pavadinimas iš graikų kalbos. brōmos – smarvė. Sunkus raudonai rudas skystis, kuris garuoja ore ir turi aštrų nemalonų kvapą; tankis 3,1 g/cm 3, t pl –7,25°C, t kip 59,2°C. Jis naudojamas kaip brominimo priemonė bromidų, organinių ir kitų bromo junginių gamyboje analitinėje chemijoje. Bromas yra nuodingas.
BROMASBROMAS (lot. Bromum), Br (skaitykite „bromas“), cheminis elementas, kurio atominis skaičius 35, atominė masė 79,904. Pavadinimas kilęs dėl to, kad bromas turi sunkų, nemalonų garų kvapą (iš graikų kalbos bromos – smarvė).
Natūralus bromas yra dviejų nuklidų mišinys (cm. NUKLIDAS) kurių masės skaičiai 79 (50,56 masės % mišinyje) ir 81. Išorinio elektronų sluoksnio konfigūracija 4 s 2
p 5
. Junginiuose jis pasižymi oksidacijos laipsniais –1, +1, +3, +5 ir +7 (valentai I, III, V ir VII), o būdingiausios oksidacijos laipsniai yra –1 ir +5.
Mendelejevo elementų periodinės lentelės VIIA grupės ketvirtajame periode, priklauso halogenams. (cm. HALOGENAS).
Neutralaus bromo atomo spindulys yra 0,119 nm, Br -, Br 3+, Br 5+ ir Br 7+ joniniai spinduliai yra atitinkamai 0,182, 0,073, 0,045 ir 0,039 nm. Neutralaus bromo atomo nuoseklios jonizacijos energijos yra atitinkamai 11,84, 21,80, 35,9, 47,3 ir 59,7 eV. Elektronų giminingumas 3,37 eV. Pagal Paulingo skalę bromo elektronegatyvumas yra 2,8.
Atradimų istorija
Bromo atradimą lėmė prancūzų chemiko A. Balardo tyrimai (cm. BALARDAS Antuanas Džeromas), kuris 1825 m., veikdamas chloru vandeninį tirpalą, gautą išplovus jūros dumblių pelenus, išskyrė tamsiai rudą, bjauraus kvapo skystį. Šį skystį, taip pat gautą iš jūros vandens, jis pavadino muridu (iš lot. muria – druskos tirpalas, sūrymas) ir išsiuntė žinutę apie savo atradimą Paryžiaus mokslų akademijai. Šiai žinutei patikrinti sukurta komisija nepriėmė pavadinimo Balar ir pavadino naują elementą bromu. Bromo atradimas išgarsino jauną ir mažai žinomą mokslininką. Pasirodžius Balaro straipsniui, paaiškėjo, kad buteliai su panašia medžiaga laukia vokiečių chemikų K. Levigo ir J. Liebigo tyrimų. (cm. LIBICH Justus). Praleidęs galimybę atrasti naują elementą, Liebigas sušuko: „Ne Balaras atrado bromą, o bromas atrado Balarą“.
Buvimas gamtoje
Bromas yra gana retas elementas žemės plutoje. Jo kiekis joje vertinamas 0,37·10 -4% (apie 50 vieta).
Cheminiu požiūriu bromas yra labai aktyvus, todėl gamtoje laisvos formos nėra. Jis yra daugelio skirtingų junginių (natrio, kalio, magnio bromidų ir kt.), lydinčių natrio, kalio ir magnio chloridus, dalis. Paties bromo mineralai – bromargiritas (sidabro bromidas AgBr) ir embolitas (mišrus chloridas ir sidabro bromidas) – yra itin reti (žr. Natūralūs bromidai (cm. NAtūralūs BROMIDAI)). Bromo šaltinis – karčiųjų ežerų vandenys, naftą ir įvairias druskų nuosėdas lydintys druskos sūrymai, jūros vanduo (65·10–4%), Negyvoji jūra turtingesnė bromu. Šiuo metu bromas paprastai išgaunamas iš kai kurių karčiųjų ežerų vandenų, kurių vienas yra, visų pirma, mūsų šalyje Kulundos stepėje (Altajuje).
Fizinės ir cheminės savybės
Įprastomis sąlygomis bromas yra sunkus (tankis 3,1055 g/cm3), raudonai rudas, tirštas aštraus kvapo skystis. Bromas yra viena iš paprastų medžiagų, kurios normaliomis sąlygomis yra skystos (be bromo tokia medžiaga yra ir gyvsidabris). Bromo lydymosi temperatūra –7,25 °C, virimo +59,2 °C. Standartinis elektrodo potencialas Br 2 / Br - vandeniniame tirpale yra +1,065 V.
Laisva forma jis egzistuoja dviatominių molekulių Br 2 pavidalu. Pastebimas molekulių disociacija į atomus stebima esant 800 °C temperatūrai ir sparčiai didėja toliau kylant temperatūrai. Br 2 molekulės skersmuo yra 0,323 nm, atstumas tarp branduolių šioje molekulėje yra 0,228 nm.
Bromas yra šiek tiek, bet geriau nei kiti halogenai tirpsta vandenyje (3,58 g 100 g vandens 20 ° C temperatūroje), tirpalas vadinamas bromo vandeniu. Bromo vandenyje vyksta reakcija, kai susidaro vandenilio bromo ir nestabilios hipobrominės rūgštys:
Br 2 + H 2 O = HBr + HBrO.
Bromas visais atžvilgiais maišosi su dauguma organinių tirpiklių, o organinių tirpiklių molekulės dažnai bromuojamos.
Pagal cheminį aktyvumą bromas užima tarpinę padėtį tarp chloro ir jodo. Kai bromas reaguoja su jodidų tirpalais, išsiskiria laisvas jodas:
Br 2 + 2KI = I 2 + 2KBr.
Priešingai, kai chloras veikia bromidus vandeniniuose tirpaluose, išsiskiria laisvas bromas:
Cl2 + 2NaBr = Br 2 + 2NaCl.
Bromui reaguojant su siera susidaro S 2 Br 2, bromui reaguojant su fosforu, susidaro PBr 3 ir PBr 5. Bromas taip pat reaguoja su nemetalais selenu (cm. SELENIS) ir telūro (cm. TELŪRIS) .
Bromo reakcija su vandeniliu vyksta kaitinant ir susidaro vandenilio bromidas HBr. HBr tirpalas vandenyje yra vandenilio bromido rūgštis, kurios stiprumas panašus į druskos rūgšties HCl. Bromido rūgšties druskos – bromidai (NaBr, MgBr 2, AlBr 3 ir kt.). Kokybinė reakcija į bromido jonų buvimą tirpale yra šviesiai geltonų AgBr nuosėdų susidarymas su Ag + jonais, praktiškai netirpių tiek vandenyje, tiek azoto rūgšties tirpale.
Bromas tiesiogiai nereaguoja su deguonimi ir azotu. Bromas sudaro daug įvairių junginių su kitais halogenais. Pavyzdžiui, su fluoru bromas sudaro nestabilius BrF 3 ir BrF 5, o su jodu - IBr. Sąveikaujant su daugeliu metalų, bromas sudaro bromidus, pavyzdžiui, AlBr 3, CuBr 2, MgBr 2 ir kt. Tantalas ir platina yra atsparūs bromui, o kiek mažiau – sidabrui, titanui ir švinui.
Bromas yra stiprus oksidatorius; jis oksiduoja sulfito jonus į sulfatus, nitrito jonus į nitratus ir kt.
Sąveikaujant su organiniais junginiais, turinčiais dvigubą jungtį, pridedamas bromas ir gaunami atitinkami dibromo dariniai:
C 2 H 4 + Br 2 = C 2 H 4 Br 2.
Bromas taip pat prisijungia prie organinių molekulių, kuriose yra trigubas ryšys. Bromo vandens spalvos pakitimas, kai per jį praleidžiamos dujos arba įpilama skysčio, rodo, kad dujose ar skystyje yra nesočiųjų junginių.
Kaitinamas esant katalizatoriui, bromas reaguoja su benzenu ir susidaro brombenzenas C 6 H 5 Br (pakeitimo reakcija).
Kai bromas reaguoja su šarmų tirpalais ir natrio arba kalio karbonatų tirpalais, susidaro atitinkami bromidai ir bromatai, pavyzdžiui:
Br 2 + 3Na 2 CO 3 = 5NaBr + NaBrO 3 + 3CO 2.
Taikymas
Bromas naudojamas ruošiant daugybę neorganinių ir organinių medžiagų analitinėje chemijoje. Bromo junginiai naudojami kaip kuro priedai, pesticidai, antipirenai ir fotografijoje. Bromo turintys vaistai yra plačiai žinomi. Pažymėtina, kad paplitęs posakis: „gydytojas išrašė bromo po šaukštą po valgio“, žinoma, reiškia tik tai, kad buvo paskirtas vandeninis natrio (arba kalio) bromido tirpalas, o ne grynas bromas. Bromidų raminamasis poveikis pagrįstas jų gebėjimu sustiprinti slopinimo procesus (cm. STABDYMAS) centrinėje nervų sistemoje.
Darbo su bromu ypatybės
Dirbdami su bromu, turite dėvėti apsauginius drabužius, dujokaukę ir pirštines. Bromo garų MPC yra 0,5 mg/m3. Jau esant bromo kiekiui ore, kai koncentracija yra apie 0,001% (pagal tūrį), pastebimas gleivinės dirginimas, galvos svaigimas, o esant didesnei koncentracijai - kvėpavimo takų spazmai, uždusimas. Nurijus, toksinė dozė yra 3 g, mirtina - nuo 35 g.. Apsinuodijus bromo garais, nukentėjusįjį reikia nedelsiant išnešti į gryną orą; Norėdami atkurti kvėpavimą, galite naudoti tamponą, sudrėkintą amoniaku, periodiškai trumpam nunešdami jį prie aukos nosies. Tolesnis gydymas turi būti atliekamas prižiūrint gydytojui. Skystas bromas, patekęs ant odos, sukelia skausmingus nudegimus.
Dėl didelio cheminio aktyvumo ir toksiškumo tiek bromo garai, tiek skystas bromas, jį reikia laikyti stiklinėje, sandariai uždarytoje, storasienėje talpykloje. Buteliai su bromu dedami į konteinerius su smėliu, kuris purtant apsaugo kolbas nuo sunaikinimo. Dėl didelio bromo tankio jo turinčių butelių jokiu būdu negalima imti vien už kaklo (kaklelis gali nulipti, o nuodingas skystis atsidurs ant grindų).
Norint neutralizuoti išsiliejusį bromą, paviršių su juo reikia nedelsiant padengti šlapios sodos Na 2 CO 3 sruta.
enciklopedinis žodynas. 2009 .
Sinonimai:Pažiūrėkite, kas yra „bromas“ kituose žodynuose:
bromas- bromas, a ir y... Rusų kalbos rašybos žodynas
bromas- bromas/… Morfemijos rašybos žodynas
BROMAS- BROMAS, Bromas (iš graikiško bromo kvapo), skystas metaloidas, halogenų grupė, su chemine medžiaga. žymėjimas Вг; adresu. V. 79,92; eilės periodinėje elementų lentelėje užima 35 vietą, VII grupėje – 4. Tamsiai raudonai rudas skystis, spec. svoris 3188...... Didžioji medicinos enciklopedija
- (graikų bromos fetid). Paprastas skystas raudonos spalvos korpusas, turintis labai nemalonų kvapą; 1726 m. atrado Balardas jūros vandenyje ir druskos šaltiniuose. Užsienio žodžių žodynas, įtrauktas į rusų kalbą. Chudinovas A.N., 1910. BROMAS... ... Rusų kalbos svetimžodžių žodynas
BROM, bromas, vyras. (graikiškai: bromos, blogas kvapas). Cheminis elementas, kaustinis rudai raudonos spalvos skystis, turintis stiprų kvapą (cheminis). Bromas naudojamas medicinoje, fotografijoje ir technologijose. || Bromido junginiai, naudojami. medicinoje (apt.). Gydytojas paskyrė...... Ušakovo aiškinamasis žodynas
- (simbolis Br), lakus, skystas HALOGEN grupės elementas (septintoji periodinės lentelės grupė). Pirmą kartą išskirtas 1826 m. Tai vienintelis nemetalinis elementas, kuris kambario temperatūroje išlieka skystas. Jis išgaunamas iš tirpių... Mokslinis ir techninis enciklopedinis žodynas
Bromas? Buvimas mikroelementų žmogaus organizme skaičiuojant labai mažais kiekiais, nes tai medžiagos, kurių mūsų organizme yra mažiau nei 0,015 g. Iš organo ar audinio masės jų kiekis yra tūkstantosios procento dalys arba mažiau (10 -2 iki 10 -7%). , todėl jie taip pat vadinami mikroelementų. Tačiau, nepaisant tokio menko buvimo, pakankamas šių medžiagų kiekis yra svarbi sąlyga visapusiškam visų sistemų ir organų funkcionavimui. Vienas iš šių mineralų yra . Apie jį savybes ir reikšmę sveikatai bus aptartos šiame straipsnyje, pagrindinės jo kryptys naudoti terapiniais ir profilaktiniais tikslais.
Bromas: atradimo istorija
Įdomus bromo atradimo istorija, paskutinė likusi balta dėmė tarp halogenų. Tuo pačiu metu du chemikai jį išskyrė iš skirtingų medžiagų: 1825 m. Heidelbergo universiteto studentas. K. Levigas veikiant chlorui ant mineralinio vandens ir prancūzų chemikas A. Balaras, tyręs pelkių augalus, – chloro vandens reakcijos su dumblių pelenais metu. Tačiau tuo metu, kai Levigas bandė gauti didesnius kiekius naujos medžiagos, Balardas 1826 m. jau paskelbė ataskaitą apie savo atradimą, kurio dėka pelnė pasaulinę šlovę. Balaras norėjo pavadinti gautą medžiagą lotynišku žodžiu „murid“, kuris reiškia „sūrymas“. Tačiau druskos rūgštis buvo vadinama pelės rūgštimi, o iš jos gautos druskos – muriatėmis, o siekiant išvengti terminologinės painiavos mokslo bendruomenėje, atrastą mineralą nuspręsta pavadinti bromu, kuris iš senovės graikų kalbos verčiamas kaip „smarvė“. . Bromas iš tiesų turi kvapų, nemalonų kvapą. Rusijos chemijos moksle XIX amžiuje šis mikroelementas buvo vadinamas vrom, vromid ir murid.
Bromas Optimalios natūralios formos ir dozės yra bitininkystės produktuose, tokiuose kaip žiedadulkės, bičių pienelis ir tranų perai, kurie yra daugelio natūralių Parapharm kompanijos vitaminų ir mineralų kompleksų dalis: Leveton P, Elton P, Leveton Forte “, „Apitonus P“. “, „Osteomed“, „Osteo-Vit“, „Eromax“, „Memo-Vit“ ir „Cardioton“. Todėl kiekvienai natūraliai medžiagai skiriame tiek daug dėmesio, kalbame apie jos svarbą ir naudą organizmo sveikatai.
Cheminis ir fizinis
bromo savybės
Pasakojimas apie cheminės ir fizinės bromo savybėsĮžangoje apibūdinkime jo vietą Mendelejevo periodinėje cheminių elementų lentelėje. Jame jis yra po simbolisBr (iš lot. Bromum) 35 numeriu 17 grupėje, kur yra halogenų(fluoras, chloras, bromas, jodas ir astatinas). Tai nemetalai ir aktyvūs oksidatoriai, gamtoje nėra atskirai, o tik kaip junginių dalis, nes jiems būdingas didelis cheminis reaktyvumas, derinamas su beveik visomis paprastomis medžiagomis. Yra tik 2 elementai, kurių paprastos medžiagos normaliomis sąlygomis egzistuoja skystu pavidalu – gyvsidabris ir bromas, ir tik vienas skystas nemetalas – bromas, kuris yra raudonai rudi, rūkantys rusvi garai, toksiškas skystis. Bromas kristalizuojasi tik -7,25 °C temperatūroje, o verda +59 °C temperatūroje. Jis tirpsta H 2 O (gaunamas vadinamasis bromo vanduo), bet geriau – organiniuose tirpikliuose.
Grynas bromas pavaizduota 2 atomų molekule - BR 2, Bet didelis cheminis aktyvumas neleidžia gamtoje būti laisvoje būsenoje, todėl randama bromido sudėtis(junginiai su metalais). Pagal kiekį žemės viduje ir uolienose jis užima 50 vietą, todėl natūralus jo šaltinis – daugiausia druskos ežerai ir jūros; požeminis vanduo lydi naftą. Jo taip pat yra ore, labiau pakrančių zonose. Tačiau pramoninio nuotėkio atveju bromo garai daro žmonėms nuodingą ir dusinantį poveikį.
Bromo savybės leidžia jį plačiai naudoti degalų priedų, pesticidų žemės ūkyje, degimą stabdančių medžiagų, šviesai jautrios medžiagos sidabro bromido gamyboje fotografijoje, vaistams. Dirbant su šiuo mikroelementu reikia būti ypač atsargiems ir laikytis saugos priemonių. Pirštinės, kombinezonai ir dujokaukė yra geriausi jūsų sąjungininkai dirbant su šia medžiaga.
Bromo vertė
kūnui asmuo
Grynas bromas– labai toksiška medžiaga! Tik 3 gramai prarijus elementinis bromas sukelia apsinuodijimą, o 35 gramai yra mirtini. Susisiekti su skystas bromas yra kupinas skausmingų, blogai gyjančių nudegimų. 0,001 % bromo ore sukelia kosulį, užspringimą, galvos svaigimą, kraujavimą iš nosies, o viršijus šį skaičių gali atsirasti kvėpavimo takų spazmai ir mirtis. Tačiau, nepaisant toksiškumo, bromo svarba organizmui sunku sumenkinti žmogų. Jis yra mikroelementas, esantis mūsų organuose ir audiniuose: smegenyse, kraujyje, kepenyse ir inkstai, skydliaukė, raumenų audinys ir kaulai... Mums jo reikia nedideliais kiekiais!
Bromas turi poveikį ant centrinės nervų sistemos. Kaupdamasis smegenų žievėje reguliuoja neuronų veiklą, atsakingas už pusiausvyrą tarp sužadinimo ir slopinimo reakcijų. Jei reikia, jis sustiprina slopinimą per membraninius fermentus, kurie yra atsakingi už jo raminamąjį poveikį.
Šis mikroelementas svarbus ir endokrininei sistemai, nes veikia kaip savotiška jodo alternatyva ir sumažina skydliaukės poreikį jodui, užkertant kelią jos augimui – endeminės gūžės atsiradimui.
Bromo vaidmuo virškinimo trakto veikloje dėl jo aktyvavimo poveikis virškinimo fermentams:
- pepsinas (būtinas baltymams skaidyti);
- amilazė (skaido angliavandenius);
- lipazė (virškinimo metu tirpdo ir rūšiuoja riebalus).
Klausimas O bromo įtaka apie vyrų seksualinę veiklą apipintas mitais. Visų pirma, kad anksčiau kaliniai kalėjimuose, ligoninių psichiatrijos skyriuose dirbantys pacientai ir kariuomenės kareiviai buvo papildomi šiuo mineralu, siekiant susilpninti erekcijos funkciją. Ilgą laiką buvo manoma, kad bromas, turintis generolą raminantis poveikis organizmui, slopina seksualinę sferą. Tačiau vėlesni tyrimai parodė visiškai priešingą poveikį nei vartojant bromido preparatai prisideda prie vyrų reprodukcinės sistemos stabilizavimo, sėklinio skysčio padidėjimas ir spermatozoidų skaičių jame.
Bromas pašalinamas iš organizmo su šlapimu ir prakaitavimu. Taigi jo suvartojimas iš išorės per maistą (ir, jei reikia, farmakologiniuose preparatuose) yra būtinas. Tačiau jo pašalinimas yra ilgas procesas, todėl galima padidinti jo koncentraciją organuose ir audiniuose, o tai labai pavojinga sveikatai.
Kaip tai veikia bromo trūkumas
apie žmonių sveikatą?
Bromo trūkumas gali sukelti rimtų funkcinių sutrikimų. Vaikystėje ir paauglystėje jo trūkumas gali lemti lėtesnį augimą, o suaugusiems – sutrumpinti gyvenimo trukmę. Užmigimo problemos, neurasteniniai ir isteriniai pasireiškimai, mažakraujystė, kurią sukelia hemoglobino kiekio sumažėjimas, padidėjusi spontaniško persileidimo rizika nėščioms moterims, susilpnėjusios lytinės funkcijos, virškinimo problemos, kurias sukelia sumažėjęs rūgštingumas – visa tai gali būti trūkumo pasekmė. šis mineralas. Šios būklės priežastys yra medžiagų apykaitos sutrikimai arba piktnaudžiavimas diuretikais reiškia skatinti bromo pašalinimas nuo kūno. Diagnozuoti bromo trūkumas ir gydymą turi skirti specialistas, o savarankiškai gydytis nepasitarus su gydytoju šiuo atveju griežtai nerekomenduojama.
Bromo perdozavimas
Ne mažiau pavojinga bromo perdozavimas, atsirandantys tik dėl farmakologinių vaistų vartojimo. Būdingi jo simptomai bus alerginiai odos bėrimai, uždegiminiai odos pasireiškimai, virškinimo trakto sutrikimai, depresija ir energijos netekimas, miego sutrikimai, letargija, bronchitas ir rinitas, kaip reakcija į toksinį bromo poveikį. Nukenčia nervų sistema ir suvokimo organai (regėjimas ir klausa), pablogėja psichiniai procesai ir pažintinės (su suvokimu susijusios) funkcijos.
Bromo perteklius gali būti mirtinas, todėl jei įtariate perdozavimą, nedelsdami nustokite vartoti turinčių bromo vaistų ir pasikonsultuokite su gydytoju, kad juos atšauktų arba pakoreguotų dozę.
Bromo vaistų vartojimas V
terapiniais ir profilaktiniais tikslais
Studijuoja bromido poveikis apie žmonių sveikatą ir jų diegimas medicinos praktikoje prasidėjo beveik iš karto po to bromo atradimas– XIX amžiuje, taigi vartojant bromo vaistus– klinikinėje medicinoje patikrinta priemonė.
Rusų fiziologas I. P. Pavlovas svariai prisidėjo prie poveikio tyrimų bromo turintys junginiai apie nervinę veiklą. Jo eksperimentai su šunimis pasirodė esą veiksmingi bromas nuo neurozių, ir paskirtas bromido dozės turėtų būti koreliuojamas su didesnio nervinio aktyvumo tipu (su stipriu tipu, reikalingos didesnės dozės).
Bromidai kaip raminamieji vartojamas neuropsichiniams sutrikimams, nemigai, padidėjusiam jaudrumui, isterijai ir neurastenijai, traukuliams gydyti, tačiau jie beveik nebenaudojami epilepsijai gydyti. Šiandien gydytojai paprastai yra atsargūs skiriami bromidai dėl lėto pasišalinimo iš organizmo ir pavojaus išsivystyti brozmui – lėtinis apsinuodijimas bromu. Ši nuoroda galioja turinčių bromo vaistai, kaip smegenų žievės ir organų, sistemų koordinacijos pažeidimas, kuris dažnai pasireiškia skrandžio ir dvylikapirštės žarnos opalige, ankstyvoje hipertenzijos vystymosi stadijoje.
Tarp bendrų vaistai, kurių sudėtyje yra bromo, – kalio bromidas, natrio bromidas, „Adonis-bromine“, „Bromcamforas“ ir kiti, tiek geriamieji miltelių ir tirpalų pavidalu, tiek į veną. Taikomas natrio bromidas elektroforezei – esant skausmingiems uždegiminiams procesams, nuo juostinės pūslelinės. Bromido dozė apima 0,1–1 gramo tris kartus per dieną.
Kasdienis bromo poreikis
Skrandžio sulčių rūgštingumui didinti ir seksualinės funkcijos aktyvinimas vyrams nervų sutrikimų profilaktikai gydytojai rekomenduoja vartoti 3-8 mg. Tai paros bromo poreikis sveikam žmogui. Daugelyje maisto papildų šis mikroelementas yra kartu su kitais mineralais. Su maistu į mūsų organizmą vidutiniškai patenka 1 mg.
Bromo kiekis
gaminiuose mityba
Žinant, kaip tai yra bromo kiekis produktuose mityba, galite padidinti jo suvartojimą nenaudodami farmakologinių vaistų. Šis mikroelementas kaupiasi daugelyje augalų, kurie paima jį iš gelmių ir sujungia į organinius netoksiškus junginius ir druskas.
Juose ypač gausu:
- žirniai,
- pupelės,
- lęšiai,
- įvairių riešutų ir
- grūdinių kultūrų (miežių, kviečių ir kt.).
Jis paimamas į savo sudėtį iš jūros vandens
- rudadumbliai ir kiti dumbliai,
- jūros žuvis.
Bromo taip pat galime gauti iš akmens druskos. Jo taip pat yra pieno produktuose, makaronuose ir duonos gaminiuose, pagamintuose iš kietųjų kviečių.
Natūralus bromas yra dviejų nuklidų, kurių masės skaičiai yra 79 (mišinyje 50,56 masės %) ir 81, mišinys. Išorinio elektronų sluoksnio konfigūracija yra 4s 2 p 5. Junginiuose jo oksidacijos laipsniai yra 1, +1, +3, +5 ir +7 (valentai I, III, V ir VII), o būdingiausios oksidacijos laipsniai yra 1 ir +5.
Įsikūręs Mendelejevo periodinės elementų lentelės VIIA grupėje ketvirtajame periode.
Neutralaus bromo atomo spindulys yra 0,119 nm, Br , Br 3+, Br 5+ ir Br 7+ joniniai spinduliai atitinkamai lygūs 0,182; 0,073; 0,045 ir 0,039 nm. Neutralaus bromo atomo nuoseklios jonizacijos energijos yra atitinkamai 11,84; 21.80; 35,9; 47,3 ir 59,7 eV. Elektronų giminingumas 3,37 eV. Pagal Paulingo skalę bromo elektronegatyvumas yra 2,8.
Vardas: dėl to, kad bromas turi sunkų, nemalonų garų kvapą (nuo graikiško bromo kvapo).
Atradimų istorija: Bromo atradimui paskatino prancūzų chemiko A. Balardo tyrimai, kuris 1825 m., veikdamas chloru vandeninį tirpalą, gautą išplovus jūros dumblių pelenus, išskyrė tamsiai rudą, bjauraus kvapo skystį. Šį skystį, taip pat gautą iš jūros vandens, jis pavadino muridu (iš lot. muria druskos tirpalas, sūrymas) ir išsiuntė žinutę apie savo atradimą Paryžiaus mokslų akademijai. Šiai žinutei patikrinti sukurta komisija nepriėmė pavadinimo Balar ir pavadino naują elementą bromu. Bromo atradimas išgarsino jauną ir mažai žinomą mokslininką. Pasirodžius Balaro straipsniui, paaiškėjo, kad butelių su panašia medžiaga laukia vokiečių chemikų K. Levigo ir J. Liebigo tyrimai. Praleidęs galimybę atrasti naują elementą, Liebigas sušuko: „Ne Balaras atrado bromą, o bromas atrado Balarą“.
Savybės: normaliomis sąlygomis bromas yra sunkus (tankis 3,1055 g/cm3) raudonai rudas tirštas aštraus kvapo skystis. Bromas yra viena iš paprastų medžiagų, kurios normaliomis sąlygomis yra skystos (be bromo, dar viena tokia medžiaga). Bromo lydymosi temperatūra 7,25°C, virimo +59,2°C. Standartinis elektrodo potencialas Br 2 / Br vandeniniame tirpale yra +1,065 V.
Laisva forma jis egzistuoja dviatominių molekulių Br 2 pavidalu. Pastebimas molekulių disociacija į atomus stebima esant 800°C temperatūrai ir sparčiai didėja toliau kylant temperatūrai. Br 2 molekulės skersmuo yra 0,323 nm, atstumas tarp branduolių šioje molekulėje yra 0,228 nm.
Bromas šiek tiek, bet geriau nei kiti halogenai tirpsta vandenyje (3,58 g 100 g vandens 20°C temperatūroje), tirpalas vadinamas bromo vandeniu. Bromo vandenyje vyksta reakcija, kai susidaro vandenilio bromo ir nestabilios hipobrominės rūgštys:
Br 2 + H 2 O = HBr + HBrO.
Bromas visais atžvilgiais maišosi su dauguma organinių tirpiklių, o organinių tirpiklių molekulės dažnai bromuojamos.
Pagal cheminį aktyvumą bromas užima tarpinę padėtį tarp chloro (Cl) ir jodo (I). Kai bromas reaguoja su jodidų tirpalais, išsiskiria laisvasis jodas (I):
Br 2 + 2KI = I 2 + 2KBr.
Bromas yra stiprus oksidatorius, jis oksiduoja sulfito jonus į sulfatus, nitrito jonus į nitratus ir kt.
Sąveikaujant su organiniais junginiais, turinčiais dvigubą jungtį, pridedamas bromas ir gaunami atitinkami dibromo dariniai:
C 2 H 4 + Br 2 = C 2 H 4 Br 2.
Bromas taip pat prisijungia prie organinių molekulių, kuriose yra trigubas ryšys. Bromo vandens spalvos pakitimas, kai per jį praleidžiamos dujos arba įpilama skysčio, rodo, kad dujose ar skystyje yra nesočiųjų junginių.
Kaitinamas esant katalizatoriui, bromas reaguoja su benzenu ir susidaro brombenzenas C 6 H 5 Br (pakeitimo reakcija).
Kai bromas reaguoja su šarmų tirpalais ir natrio (Na) arba kalio (K) karbonatų tirpalais, susidaro atitinkami bromidai ir bromatai, pavyzdžiui:
Br 2 + 3Na 2 CO 3 = 5NaBr + NaBrO 2 + 3CO 2.
Rasti gamtoje: Bromas yra gana retas elementas žemės plutoje. Jo kiekis joje vertinamas 0,37·10 4% (apie 50 vieta).
Cheminiu požiūriu bromas yra labai aktyvus, todėl gamtoje laisvos formos nėra. Jis yra daugelio skirtingų junginių (natrio (Na), kalio (K), magnio (Mg) ir kt. bromidų, lydinčių natrio, kalio ir magnio chloridus, dalis. Vidiniai bromo mineralai bromargiritas (sidabro bromidas (Ag) AgBr) ir embolitas (chlorido ir sidabro (Ag) bromido mišinys) yra labai reti. Bromo šaltinis – karčiųjų ežerų vandenys, naftą ir įvairius druskų telkinius lydintys druskos sūrymai bei jūros vanduo (65·10 4%), Negyvoji jūra turtingesnė bromu. Šiuo metu bromas paprastai išgaunamas iš kai kurių karčiųjų ežerų vandenų, kurių vienas yra, visų pirma, mūsų šalyje Kulundos stepėje (Altajuje).
Taikymas: bromas naudojamas ruošiant daugybę neorganinių ir organinių medžiagų analitinėje chemijoje. Bromo junginiai naudojami kaip kuro priedai, pesticidai, antipirenai ir fotografijoje. Bromo turintys vaistai yra plačiai žinomi. Pažymėtina, kad paplitęs posakis: „gydytojas išrašė bromo po šaukštą po valgio“, žinoma, reiškia tik tai, kad buvo paskirtas vandeninis natrio (arba kalio) bromido tirpalas, o ne grynas bromas. Bromidų raminamasis poveikis pagrįstas jų gebėjimu sustiprinti slopinimo procesus centrinėje nervų sistemoje.
Darbo su bromu ypatybės: Dirbdami su bromu, turite dėvėti apsauginius drabužius, dujokaukę ir pirštines. Bromo garų MPC yra 0,5 mg/m3. Jau esant bromo kiekiui ore, kai koncentracija yra apie 0,001% (pagal tūrį), pastebimas gleivinės dirginimas, galvos svaigimas, o esant didesnei koncentracijai - kvėpavimo takų spazmai, uždusimas. Nurijus toksinė dozė – 3 g, mirtina nuo 35 g Apsinuodijus bromo garais, nukentėjusįjį nedelsiant išnešti į gryną orą, kvėpavimui atkurti galima trumpam, periodiškai naudoti amoniaku suvilgytą tamponą. trumpam atnešdamas aukai prie nosies. Tolesnis gydymas turi būti atliekamas prižiūrint gydytojui. Skystas bromas, patekęs ant odos, sukelia skausmingus nudegimus.
APIBRĖŽIMAS
Bromas esančios periodinės lentelės pagrindinio (A) pogrupio VII grupės ketvirtajame periode.
Nurodo elementus p- šeimos. Nemetaliniai. Pavadinimas – Br. Eilės numeris – 35. Santykinė atominė masė – 79,904 amu.
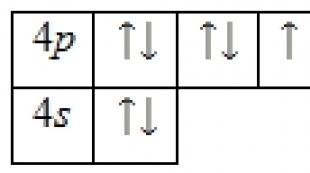
Bromo atomo elektroninė struktūra
Bromo atomą sudaro teigiamai įkrautas branduolys (+35), kurio viduje yra 35 protonai ir 45 neutronai, o 35 elektronai juda keturiomis orbitomis.
1 pav. Scheminė bromo atomo struktūra.
Elektronų pasiskirstymas tarp orbitų yra toks:
35Br) 2) 8) 18) 7 ;
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5 .
Išoriniame bromo atomo energijos lygyje yra 7 elektronai, kurie yra valentiniai elektronai. Pagrindinės būsenos energijos diagrama yra tokia:

Kiekvieną bromo atomo valentinį elektroną galima apibūdinti keturių kvantinių skaičių rinkiniu: n(pagrindinis kvantas), l(orbita), m l(magnetinis) ir s(suktis):
|
Polygis |
||||
Vieno nesuporuoto elektrono buvimas rodo, kad bromo oksidacijos būsena gali būti -1 arba +1. Kadangi ketvirtame lygyje yra laisvų orbitų 4 d-polygis, tada bromo atomui būdinga sužadinta būsena:

Štai kodėl bromo oksidacijos laipsnis yra +3. Yra žinoma, kad jo junginiuose esantis bromas taip pat gali turėti +5 ir +7 oksidacijos laipsnius.
Problemų sprendimo pavyzdžiai
1 PAVYZDYS
| Pratimas | Elementas sudaro dujinį junginį su vandeniliu, kuriame yra 12,5% vandenilio. Didžiausias šio elemento oksidas turi formulę RO 2. Nurodykite elektronų skaičių šio elemento atomo elektronų apvalkale. |
| Sprendimas | Didesni RO 2 sudėties oksidai sudaro elementus, esančius IV periodinės lentelės grupėje. Šios grupės elementai sudaro lakiuosius junginius su vandeniliu, kurio sudėtis RH 4. Norimą elementą pažymėkime X. Tada jo masės dalis vandenilio junginio sudėtyje yra lygi: ω(X) = 100 - 12,5 = 87,5 %. Raskime santykinę šio elemento atominę masę: A r (X) = ω(X) × n(H)/ω(H) = 87,5 × 4/12,5 = 28. Silicis (Si) turi tokią atominę masę. Problemos teiginyje nurodytų junginių formulės atrodys taip: SiO 2 ir SiH 4. Bendras elektronų skaičius silicio atomo elektronų apvalkale yra lygus jo eilės numeriui periodinėje lentelėje, t.y. 14. |
| Atsakymas | Bendras elektronų skaičius silicio atomo elektronų apvalkale yra 14. |