ჰიდროლიზი. ეთერების ჰიდროლიზი ესტერი განიცდის რეაქციას
ეთერების და ყველა სხვა მჟავა წარმოებულების ჰიდროლიზი მოითხოვს მჟავე ან ტუტე კატალიზს. მჟავა ჰიდროლიზით მიიღება კარბოქსილის მჟავები და სპირტები (საპირისპირო ესტერიფიკაციის რეაქცია), ტუტე ჰიდროლიზით წარმოიქმნება კარბოქსილის მჟავებისა და სპირტების მარილები.
ეთერების მჟავა ჰიდროლიზი:
S N მექანიზმი,ნუკლეოფილი - H 2 O, ალკოქსი ჯგუფი იცვლება ჰიდროქსილით.
ეთერების ტუტე ჰიდროლიზი:რეაქცია ორ ეტაპად მიმდინარეობს 2 მოლი ფუძით, შედეგად მიღებული მჟავა გარდაიქმნება მარილში.
S N მექანიზმი, Nu = -OH
მარილის ნაერთების წარმოქმნაამიდები ნეიტრალური ნივთიერებებია, რადგან ამიაკის ძირითადი თვისებები სუსტდება მასში წყალბადის ატომის მჟავე ნარჩენებით ჩანაცვლებით. ამიტომ, NH 2 ჯგუფი ამიდებში, ამინებისგან განსხვავებით, მხოლოდ გაჭირვებით ქმნის ონიუმის კატიონს. თუმცა, ძლიერი მჟავებით, ამიდები იძლევა მარილებს, როგორიცაა Cl, რომლებიც ადვილად იშლება წყლის მიერ. მეორეს მხრივ, ამიდებში NH 2 ჯგუფის წყალბადი უფრო ადვილად იცვლება ლითონებით, ვიდრე ამიაკში და ამინებში. აცეტამიდი, მაგალითად, ადვილად ხსნის ვერცხლისწყლის ოქსიდს, წარმოქმნის ნაერთს (CH 3 CONH) 2 Hg.
თუმცა, შესაძლებელია, რომ ლითონის წარმოებულების წარმოქმნის დროს მოხდეს ამიდის იზომერიზაცია და მიღებულ ნაერთს ჰქონდეს იმიდური მჟავას მარილის იზომერული (ტავტომერული) სტრუქტურა.
ანუ, არსებობს ანალოგი ჰიდროციანმჟავას მარილებთან.
2. აზოტის მჟავას მოქმედებაამიდები რეაგირებენ აზოტის მჟავასთან, ისევე როგორც პირველადი ამინები, წარმოქმნიან კარბოქსილის მჟავებს და გამოყოფენ აზოტს:
3. საპონიფიკაციამინერალური მჟავებითა და ტუტეებით მოხარშვისას ამიდები ამატებენ წყალს, წარმოქმნიან კარბოქსილის მჟავას და ამიაკას:
4. ჰალოიდური ალკილების მოქმედება.ალკილის ჰალოიდების ამიდებზე ან მათ მეტალის წარმოებულებზე მოქმედებით მიიღება N-შემცვლელი ამიდები:
5. ფოსფორის პენტაქლორიდის მოქმედება.ფოსფორის პენტაქლორიდის მოქმედებით ამიდებზე, ქლორამიდები
ადვილად იშლება მარილმჟავად და იმიდის ქლორიდები
ამ უკანასკნელს ამიაკით შეუძლია მარილების მიცემა ამიდინები;
6. გარდაქმნა ამინებად.ამიდების ენერგიული შემცირებით, პირველადი ამინები მიიღება ნახშირბადის ატომების იგივე რაოდენობით:
7. ჰოფმანის რეაქცია.ჰიპოჰალიტის ან ბრომისა და ტუტეს ამიდებზე მოქმედებით წარმოიქმნება ამინები და კარბონილის ჯგუფის ნახშირბადის ატომი იშლება CO 2-ის სახით (ა. ჰოფმანი). რეაქციის მიმდინარეობა შეიძლება წარმოდგენილი იყოს შემდეგნაირად:
საგანმანათლებლო სახელმძღვანელოებში, ამ რეაქციის მექანიზმის სხვა ინტერპრეტაცია ჯერ კიდევ ხშირად გვხვდება:
თუმცა, რეაქციის ეს კურსი ნაკლებად სავარაუდოა, რადგან ფრაგმენტი წარმოიქმნება
აზოტის ატომით, რომელსაც აქვს ორი თავისუფალი ელექტრონული წყვილი, ნაკლებად სავარაუდოა.
ამ მექანიზმს ეწინააღმდეგება, კერძოდ, ის ფაქტი, რომ თუ რადიკალი R ოპტიკურად აქტიურია, მაშინ ის არ იშლება რეაქციის შედეგად. იმავდროულად, თავისუფალი რადიკალის R-:-ის ხანმოკლე არსებობაც კი გამოიწვევს ოპტიკური აქტივობის დაკარგვას.
ქიმიური თვისებები.ნიტრო ჯგუფი არის ერთ-ერთი ყველაზე ძლიერი ელექტრონების ამომყვანი ჯგუფები და შეუძლია ნეგატივის ეფექტურად დელოკალიზაცია. დააკისროს. არომატულში კონნ. ინდუქციური და განსაკუთრებით მეზომერული ეფექტების შედეგად ის მოქმედებს ელექტრონის სიმკვრივის განაწილებაზე: ბირთვი იძენს ნაწილობრივ დადებითს. მუხტი, თორემ ლოკალიზებული ჩ. arr. ორთო და პარა პოზიციებზე; ჰამეტის მუდმივები NO 2 ჯგუფისთვის s m 0,71, s n 0,778, s + n 0,740, s - n 1,25. ასე რომ, NO 2 ჯგუფის დანერგვა მკვეთრად ზრდის რეაქციას. უნარი ორგ. კონნ. არკლეოფთან მიმართებაში.რეაგენტები და ართულებს p-tion ელექტროფთან. რეაგენტები. ეს განსაზღვრავს ნიტრო ნაერთების ფართოდ გამოყენებას ორგ. სინთეზი: NO 2 ჯგუფი შეყვანილია ორგ მოლეკულის სასურველ პოზიციაში. Comm., განახორციელოს decomp. p-tion ასოცირდება, როგორც წესი, ნახშირბადის ჩონჩხის ცვლილებასთან და შემდეგ გარდაიქმნება სხვა ფუნქციად ან ამოღებულია. არომატულში ზედიზედ ხშირად გამოიყენება უფრო მოკლე სქემა: NO 2 ჯგუფის ნიტრაცია-ტრანსფორმაცია.
ნიტრონის ტო-ტ-ის წარმოქმნა არომატული ნიტრო ნაერთების სერიაში დაკავშირებულია ბენზოლის რგოლის იზომერიზაციასთან ქინოიდურ ფორმაში; მაგალითად, ნიტრობენზოლი წარმოიქმნება კონც. H 2 SO 4 ფერადი მარილის პროდუქტი f-ly I, ო-ნიტროტოლუენი ავლენს ფოტოქრომიზმს ვნუტრიმოლის შედეგად. პროტონის გადაცემა ნათელი ლურჯი O-წარმოებულის შესაქმნელად:
პირველადი და მეორადი ნიტრონაერთების ფუძეების მოქმედებით წარმოიქმნება ნიტრონაერთების მარილები; მარილების ამბიდენტური ანიონები p-ტიონებში ელექტროფილებთან ერთად შეუძლიათ O- და C- წარმოებულების მიცემა. ასე რომ, ნიტრო ნაერთების მარილების ალკილაცია ალკილ ჰალოიდებით, ტრიალკილქლოროსილანებით ან R 3 O + BF - 4 იძლევა O-ალკილირების პროდუქტებს. ბოლო მ.ბ. ასევე მიიღება დიაზომეთანის ან N,O-bis-(ტრიმეთილსილილ)აცეტამიდის მოქმედებით ნიტროალკანებზე pK a< 3 или нитроновые к-ты, напр.:
აციკლური ნიტრონის to-t-ის ალკილის ეთერები თერმულად არასტაბილურია და იშლება ინტრამოლის მიხედვით. მექანიზმი:
R-ts და და ერთად r და ry v o m s vyaz z და C-N. პირველადი და მეორადი ნიტრო ნაერთები დატვირთვისას. მაინერთან ერთად. ტო-ტამი თანდასწრებით. სპირტი ან წყალხსნარი ტუტე ფორმა კარბონილის Comm. (იხილეთ ნეფის რეაქცია). R-tion გადის ინტერვალს. ნიტრონის ტო-ტ ფორმირება:
როგორც წყარო კომ. შეიძლება გამოყენებულ იქნას სილილის ნიტრონის ეთერები. ძლიერი to-t-ის მოქმედებამ ალიფატურ ნიტრო ნაერთებზე შეიძლება გამოიწვიოს ჰიდროქსამიკი იქამდე, მაგალითად:
არსებობს მრავალი მეთოდი ნიტრო ნაერთების ამინებამდე რედუქციისთვის. ფართოდ გამოიყენება რკინის ფილები, Sn და Zn თანდასწრებით. ტო-ტ; კატალიზატორით ჰიდროგენაცია, როგორც კატალიზატორი, იყენებს Ni-Raney, Pd/C ან Pd/PbCO 3 და ა.შ. Pd, Na და Al ამალგამები, გაცხელებისას. ჰიდრაზინით Pd/C-ზე მეტი; არომატული ნიტრო ნაერთებისთვის ზოგჯერ გამოიყენება TlCl 3, CrCl 2 და SnCl 2, არომატული. პოლინიტრო ნაერთები შერჩევით მცირდება ნიტრამინებად Na ჰიდროსულფიდით CH 3 OH-ში. არჩევის გზები არსებობს. NO 2 ჯგუფის აღდგენა პოლიფუნქციურ ნიტრო ნაერთებში სხვა f-ტიონებზე გავლენის გარეშე.
არომატულ ნიტრო ნაერთებზე P(III) მოქმედებით ხდება მემკვიდრეობა. NO 2 ჯგუფის დეოქსიგენაცია მაღალრეაქტიული ნიტრენების წარმოქმნით. R-tion გამოიყენება კონდენსატორის სინთეზისთვის. ჰეტეროციკლები, მაგალითად:
R-ts და NO 2 ჯგუფის შენარჩუნებით. ალიფატური ნიტრო ნაერთები, რომლებიც შეიცავს a-H-ატომს, ადვილად ალკილირდება და აცილირებულია, როგორც წესი, O- წარმოებულების წარმოქმნით. თუმცა, ორმხრივი mod. პირველადი ნიტრო ნაერთების დილითიუმის მარილები ალკილის ჰალოიდებით, ანჰიდრიდებით ან კარბოქსილის მჟავას ჰალოიდებით იწვევს C-ალკილირების ან C-აცილაციის პროდუქტებს, მაგალითად:
ცნობილი მაგალითები ვნუტრიმოლი. C-ალკილირები, მაგ.:
პირველადი და მეორადი ნიტრო ნაერთები რეაგირებენ ალიფატურთან. ამინები და CH 2 O p-ამინო წარმოებულების წარმოქმნით (p-tion Mannich); რაიონში შეგიძლიათ გამოიყენოთ ნიტრო ნაერთების ან ამინო ნაერთების წინასწარ მიღებული მეთილოლის წარმოებულები:
ნიტრომეთანს და ნიტროეთანს შეუძლია კონდენსირება მეთილოლამინის ორი მოლეკულით, ხოლო უმაღლესი ნიტროალკანებით მხოლოდ ერთი. რეაგენტების გარკვეული თანაფარდობით p-tion შეიძლება გამოიწვიოს ჰეტეროციკლური. კავშირი, მაგალითად: ურთიერთქმედებით. პირველადი ნიტროალკანი პირველადი ამინის ორი ეკვივალენტით და ფორმალდეჰიდის სიჭარბით ქმნის Comm. f-ly V, თუ რეაგენტები მიიღება თანაფარდობით 1:1:3-comm. ფორმები VI.
არომატული ნიტრო ნაერთები ადვილად შედიან p-tion ბირთვში. ჩანაცვლება და ბევრად უფრო რთული, ელექტროფის რაიონში. ცვლილება; ამ შემთხვევაში, ნუკლეოფილი მიმართულია ორთო და ფორების პოზიციებზე, ხოლო ელექტროფილი მიმართულია მეტა პოზიციაზე NO 2 ჯგუფისკენ. სიჩქარის მუდმივი ნიტრობენზოლის ნიტრაცია 5-7 რიგით ნაკლებია, ვიდრე ბენზოლი; ეს წარმოქმნის მ-დინიტრობენზოლს.
პირველადი ნიტროალკანების კარბოქსილირებისას CH 3 OMgOCOOCH მოქმედებით წარმოიქმნება 3 ა-ნიტროკარბოქსილის მჟავები ან მათი ეთერები.
მონონიტრო ნაერთების C (NO 2) 4 მარილების დამუშავებისას Ag ან ტუტე ლითონის ნიტრიტებით, ან ნიტრიტების ზემოქმედებით ა-ჰალო-ნიტროალკანებზე ტუტე გარემოში (ტერ მეერის რაიონი), ძვირფასი დინიტრო ნაერთებია. წარმოიქმნება ა-ჰალო-ნიტროალკანების ელექტროლიზი აპროტიურ p-გამხსნელებში, აგრეთვე Cl 2 ნიტრო ნაერთების დამუშავება ტუტე გარემოში ან ნიტრონაერთების მარილების ელექტროოქსიდაცია იწვევს ვიკ-დინიტრო ნაერთებს:
ნიტრო ჯგუფი არ იძლევა არსებებს. გავლენა თავისუფალ რადიკალების ალკილაციაზე ან არომატულ არილირებაზე. შეერთება; p-tion მივყავართ მთავარ. ორთო- და პარა-ჩანაცვლებულ პროდუქტებზე.
ნიტრო ნაერთების აღსადგენად NO 2 ჯგუფზე გავლენის გარეშე, NaBH 4, LiAlH 4 გამოიყენება დაბალ ტემპერატურაზე ან დიბორანის ხსნარში THF-ში, მაგალითად:
არომატული დი- და ტრი-ნიტრო ნაერთები, კერძოდ 1,3,5-ტრინიტრობენზოლი, ქმნიან მდგრად კაშკაშა ფერის კრისტალებს. ისინი ამბობენ კომპლექსები არომატული ელექტრონების კომმ.-დონორები (ამინები, ფენოლები და სხვ.). კომპლექსები picric to-one-ით გამოიყენება არომატულის იზოლირებისთვის და გასაწმენდად. ნახშირწყალბადები. ინტერმოდი. დი- და ტრინიტრობენზოლები ძლიერი ფუძეებით (HO-, RO-, N-3, RSO-2, CN-, ალიფატური ამინები) იწვევს მაიზენ-ჰაიმერის კომპლექსების წარმოქმნას, რომლებიც იზოლირებულია ფერადი ტუტე ლითონის მარილების სახით.
ამ რეაქციებისთვის შესაფერისი ჟანგვის აგენტებია ქრომის ან აზოტის მჟავა, ქრომის ნარევი, მანგანუმის დიოქსიდი ან სელენის დიოქსიდი.
ქრომის მჟავასთან დაჟანგვის დროს ალკოჰოლი ნუკლეოფილურად ემატება ქრომის მჟავას, ხოლო წყალი იშლება და წარმოიქმნება ქრომის მჟავას ეთერი (ეს არის რეაქციის პირველი ეტაპი, მსგავსია კარბოქსილის მჟავების ეთერების წარმოქმნას, შდრ. ნაწილი E, 7.1.5.1). მეორე ეტაპზე, რომელიც სავარაუდოდ გადის ციკლურ გარდამავალ მდგომარეობას, სპირტის a-წყალბადი გადადის ქრომატულ ნარჩენში, ხოლო ლითონი ექვსვალენტური მდგომარეობიდან ოთხვალენტიან მდგომარეობაში:
| ნ-CH3O> პ-ტერტ-C 4 H 9 > პ-CH 3 > პ-Cl> პ-არა 2 | (G.6.20) |
როდესაც პირველადი სპირტები იჟანგება, მიღებული ალდეჰიდი დაცული უნდა იყოს კარბოქსილის მჟავამდე შემდგომი დაჟანგვისგან. შესაძლებელია, მაგალითად, რეაქციის ნარევიდან ალდეჰიდის გამუდმებით გამოხდა: ეს სავსებით შესაძლებელია, რადგან ალდეჰიდის დუღილის წერტილი ჩვეულებრივ უფრო დაბალია, ვიდრე შესაბამისი ალკოჰოლის დუღილის წერტილი. მიუხედავად ამისა, ალდეჰიდების გამოსავლიანობა დიქრომატით დაჟანგვის დროს იშვიათად აღემატება 60%-ს. აღსანიშნავია, რომ რეაქციის სწორად შესრულებისას, ნახშირბად-ნახშირბადის მრავალჯერადი ბმა თითქმის არ იმოქმედებს.
ალდეჰიდები ასევე წარმოიქმნება სპირტების გაცხელებით წყალხსნარში ნეიტრალური დიქრომატის ხსნარით, მაგრამ მხოლოდ ბენზილის სპირტები იძლევა კარგ მოსავალს.
ალდეჰიდების უფრო მაღალი მოსავლიანობის მიღება შესაძლებელია პირველადი სპირტების დაჟანგვით ტერტ-ბუტილის ქრომატი (ნავთობის ეთერში, ბენზოლში ან ნახშირბადის ტეტრაქლორიდში) ან მანგანუმის დიოქსიდი (აცეტონში, ნავთობის ეთერში, ნახშირბადის ტეტრაქლორიდში ან განზავებულ გოგირდმჟავაში). ეს რეაგენტები ასევე შესაძლებელს ხდის უჯერი და არომატული ალდეჰიდების მიღებას კარგი მოსავლიანობით.
მეორადი სპირტების კეტონებამდე დაჟანგვა უფრო ადვილია, ვიდრე პირველადი სპირტების დაჟანგვა. აქ მოსავლიანობა უფრო მაღალია, რადგან, პირველ რიგში, მეორადი ალკოჰოლების რეაქტიულობა უფრო მაღალია, ვიდრე პირველადი, და მეორეც, მიღებული კეტონები ბევრად უფრო მდგრადია ჟანგვის მიმართ ალდეჰიდებთან შედარებით. სტეროიდების და ტერპენების სერიაში კარგად დაამტკიცა მეორადი ალკოჰოლების დაჟანგვა ქრომის მჟავის კომპლექსით პირიდინთან, ისევე როგორც ქრომის ანჰიდრიდმა დიმეთილფორმამიდში. კარგი ჟანგვის აგენტია ასევე ქრომის ანჰიდრიდი აცეტონში; ის შეიძლება გამოყენებულ იქნას უჯერი მეორადი სპირტების დასაჟანგად, ნახშირბად-ნახშირბადის მრავალჯერადი ბმაზე გავლენის გარეშე.
ახალი მეთოდი, რომელიც ასევე შესაფერისია შეფერხებული სპირტებისთვის, არის დიმეთილ სულფოქსიდით დაჟანგვა ძმარმჟავას ანჰიდრიდში.
ქვემოთ მოყვანილი მეთოდის მიხედვით რეაქცია ტარდება ორფაზიან სისტემაში. წარმოქმნილი კეტონები ამოღებულია ორგანული გამხსნელით და ამით დაცულია შემდგომი დაჟანგვისგან.
დისაქარიდები- ნახშირწყლები, რომელთა მოლეკულები შედგება ორი მონოსაქარიდის ნარჩენებისგან, რომლებიც დაკავშირებულია ერთმანეთთან ორი ჰიდროქსილის ჯგუფის ურთიერთქმედების გამო.
დისაქარიდის მოლეკულის წარმოქმნის პროცესში წყლის ერთი მოლეკულა იშლება:
ან საქაროზასთვის:
ამრიგად, დისაქარიდების მოლეკულური ფორმულა არის C 12 H 22 O 11.
საქაროზის წარმოქმნა ხდება მცენარეთა უჯრედებში ფერმენტების გავლენის ქვეშ. მაგრამ ქიმიკოსებმა იპოვეს მრავალი რეაქციის განხორციელების გზა, რომლებიც ველურ ბუნებაში მიმდინარე პროცესების ნაწილია. 1953 წელს ფრანგმა ქიმიკოსმა რ.ლემიემ პირველად ჩაატარა საქაროზის სინთეზი, რომელსაც მისმა თანამედროვეებმა უწოდეს "ორგანული ქიმიის ევერესტის დაპყრობა".
მრეწველობაში საქაროზას იღებენ შაქრის ლერწმის წვენისგან (შემცველობა 14-16%), შაქრის ჭარხალი (16-21%), ასევე ზოგიერთი სხვა მცენარისგან, როგორიცაა კანადური ნეკერჩხალი ან დაფქული მსხალი.
ყველამ იცის, რომ საქაროზა არის კრისტალური ნივთიერება, რომელსაც აქვს ტკბილი გემო და წყალში ძალიან ხსნადი.
შაქრის ლერწმის წვენი შეიცავს ნახშირწყლების საქაროზას, რომელსაც ჩვეულებრივ შაქარს უწოდებენ.
გერმანელი ქიმიკოსისა და მეტალურგის ა.მარგგრაფის სახელი მჭიდრო კავშირშია ჭარხლისგან შაქრის წარმოებასთან. ის იყო ერთ-ერთი პირველი მკვლევარი, რომელმაც გამოიყენა მიკროსკოპი თავის ქიმიურ კვლევებში, რომლითაც მან აღმოაჩინა შაქრის კრისტალები ჭარხლის წვენში 1747 წელს.
ლაქტოზა - კრისტალური რძის შაქარი,მიღებულ იქნა ძუძუმწოვრების რძისგან ჯერ კიდევ მე-17 საუკუნეში. ლაქტოზა საქაროზაზე ნაკლებად ტკბილი დისაქარიდია.
ახლა გავეცნოთ ნახშირწყლებს, რომლებსაც უფრო რთული სტრუქტურა აქვთ - პოლისაქარიდები.
პოლისაქარიდები- მაღალმოლეკულური ნახშირწყლები, რომელთა მოლეკულები შედგება მრავალი მონოსაქარიდისგან.
გამარტივებული ფორმით, ზოგადი სქემა შეიძლება წარმოდგენილი იყოს შემდეგნაირად:
ახლა შევადაროთ სახამებლისა და ცელულოზის სტრუქტურა და თვისებები - პოლისაქარიდების ყველაზე მნიშვნელოვანი წარმომადგენლები.
ამ პოლისაქარიდების პოლიმერული ჯაჭვების სტრუქტურული ერთეული, რომლის ფორმულაა (C 6 H 10 O 5) n, არის გლუკოზის ნარჩენები. იმისათვის, რომ ჩამოწეროთ სტრუქტურული ერთეულის შემადგენლობა (C 6 H 10 O 5), თქვენ უნდა გამოაკლოთ წყლის მოლეკულა გლუკოზის ფორმულას.
ცელულოზა და სახამებელი მცენარეული წარმოშობისაა. ისინი წარმოიქმნება გლუკოზის მოლეკულებისგან პოლიკონდენსაციის შედეგად.
პოლიკონდენსაციის რეაქციის განტოლება, ისევე როგორც პოლისაქარიდების ჰიდროლიზის შებრუნებული პროცესი, პირობითად შეიძლება დაიწეროს შემდეგნაირად:
სახამებლის მოლეკულებს შეიძლება ჰქონდეთ როგორც ხაზოვანი, ასევე განშტოებული ტიპის სტრუქტურა, ცელულოზის მოლეკულებს შეიძლება ჰქონდეთ მხოლოდ ხაზოვანი.
იოდთან ურთიერთობისას სახამებელი, ცელულოზისგან განსხვავებით, ლურჯ ფერს აძლევს.
ამ პოლისაქარიდებს ასევე აქვთ სხვადასხვა ფუნქციები მცენარეულ უჯრედში. სახამებელი ემსახურება როგორც სარეზერვო საკვებ ნივთიერებას, ცელულოზა ასრულებს სტრუქტურულ, სამშენებლო ფუნქციას. მცენარეთა უჯრედის კედლები ცელულოზისგან შედგება.
კანცერორეაქცია, დაჟანგვა-აღმდგენი ალდეჰიდების დისპროპორციულობა ტუტეების მოქმედებით პირველადი სპირტებისა და კარბოქსილის მჟავების წარმოქმნით, მაგალითად:
ალდეჰიდი მუშავდება კონც. ტუტეს წყალხსნარი ან წყალ-სპირტიანი ხსნარი გაციების ან ოდნავ გაცხელებისას.კატალიზატორები - დაშლა. ლითონები (მაგ. Ag, Ni, Co, Cu) და მათი ოქსიდები. ალდეჰიდები, რომლებიც არ შეიცავს ატომ H-ს კარბონილის ჯგუფის a-პოზიციაში, შედიან p-ტიონში. წინააღმდეგ შემთხვევაში, სასურველია არა Cannizzaro რეაქცია, არამედ აალდოლის კონდენსაცია. არომატულ რგოლში ელექტრონის ამომყვანი შემცვლელები. ალდეჰიდები აჩქარებენ პროცესს, ხოლო ელექტრონის დონორები ანელებენ მას. ბენზალდეჰიდები შემცვლელებით ორთო პოზიციებზე არ რეაგირებენ Cannizzaro-ში; o- და p-ჰიდროქსიბენზალდეჰიდები რეაგირებენ მხოლოდ თანდასწრებით. აღ. R-tion ორი razl.aldehydes-ის გამოყენებით (ე.წ. ჯვარედინი Cannizzaro რეაქცია) გამოიყენება ჩ. arr. არომატულიდან პირველადი სპირტების მაღალი მოსავლიანობის მისაღებად. ალდეჰიდები. ამ შემთხვევაში, ფორმალდეჰიდი ჩვეულებრივ მოქმედებს როგორც შემცირების აგენტი:
ArCHO + CH 2 O: ArCH 2 OH + HCOOH
პოლიჰიდროქსიმეთილირებული კომმ. ფორმალდეჰიდი მონაწილეობს პირველ ეტაპზე ალდოლის კონდენსაციაში, შემდეგ კი როგორც აღმდგენი საშუალება ჯვარედინი Cannizzaro რეაქციაში:
Cannizzaro რეაქციის შემოთავაზებული მექანიზმი Homog-ში. გარემო მოიცავს ჰიდრიდის გადაცემის ეტაპს
არომატულისთვის ალდეჰიდები, არ არის გამორიცხული ერთელექტრონული გადაცემის შედეგად წარმოქმნილი რადიკალური ანიონების Cannizzaro რეაქციაში მონაწილეობის შესაძლებლობა. R-tion, მსგავსი Cannizzaro რეაქცია, ხორციელდება ინტრამოლით. ა-კეტოალდეჰიდების დისპროპორციულობა თანდასწრებით. ტუტე (Cannizzaro გადაწყობა):
გამოსაშვებად გამოიყენება Cannizzaro რეაქცია. პენტაერითრიტოლის სინთეზი, სპირტების, კარბოქსილის მჟავების მოსამზადებელი წარმოება და ა.შ. R-tion აღმოაჩინა S. Cannizzaro-მ 1853 წელს.
პიროლი, ფურანი და თიოფენი არის ხუთწევრიანი ჰეტეროციკლური ნაერთები ერთი ჰეტეროატომით.
ჰეტეროციკლში ატომების ნუმერაცია იწყება ჰეტეროატომით და მიმდინარეობს საათის ისრის საწინააღმდეგოდ. პოზიციებს 2- და 5- ეწოდება a-პოზიციები, 3- და 4- ეწოდება b- პოზიციებს.
ფორმალური მახასიათებლების მიხედვით, ეს ნაერთები არომატულია, რადგან ისინი წარმოადგენენ კონიუგირებული ციკლური p-სისტემებს, რომლებიც მოიცავს 6p ელექტრონს - დიენის სისტემის 4 ელექტრონს - და ჰეტეროატომის წყვილ ელექტრონს. ციკლი პრაქტიკულად პლანარულია, რაც ნიშნავს, რომ ჰეტეროატომის ჰიბრიდიზაციის მდგომარეობა ახლოსაა sp 2-თან.
რეზონანსული სტრუქტურები წარმოდგენილია ქვემოთ, რომლებიც ასახავს ჰეტეროატომის ელექტრონების დელოკალიზაციას ჰეტეროციკლური რგოლის გასწვრივ, მაგალითად ფურანის გამოყენებით.
ზემოაღნიშნული რეზონანსული სტრუქტურები აჩვენებს, რომ ჰეტეროატომი (ამ შემთხვევაში, ჟანგბადის ატომი), დიენის π-სისტემასთან მეზომერული ურთიერთქმედების შედეგად, ელექტრონის სიმკვრივეს გადასცემს რგოლს, რის შედეგადაც წარმოიქმნება გარკვეული უარყოფითი მუხტი. ნახშირბადის ატომები ჰეტეროციკლში და ჟანგბადის ატომზე, შესაბამისად, დადებითი მუხტი. ჟანგბადის ატომი, რა თქმა უნდა, გარდა დადებითი მეზომერული ეფექტისა, ავლენს უარყოფით ინდუქციურ ეფექტსაც. თუმცა მისი გამოვლინება განსახილველი ნაერთების თვისებებში ნაკლებად გამოხატულია და ამიტომ ხუთწევრიანი ჰეტეროციკლები ერთი ჰეტეროატომით მოიხსენიება p-ჭარბი არომატული ჰეტეროციკლურ ნაერთებად. რეზონანსი იწვევს ჰეტეროციკლში ბმის სიგრძის გარკვეულ თანასწორობას, რაც ასევე მიუთითებს სისტემის გარკვეულ არომატულობაზე.
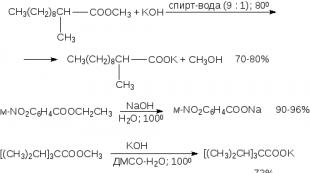
ეთერების ჰიდროლიზი კატალიზებულია როგორც მჟავებით, ასევე ფუძეებით. ეთერების მჟავა ჰიდროლიზი, როგორც წესი, ხორციელდება ჰიდროქლორინის ან გოგირდის მჟავით გაცხელებით წყალში ან წყლიან-ალკოჰოლურ გარემოში. ორგანულ სინთეზში ეთერების მჟავა ჰიდროლიზი ყველაზე ხშირად გამოიყენება მონო- და დიალკილის შემცვლელი მალონის ეთერებისთვის (თავი 17). მალონის ეთერის მონო- და დისტოპსტიტუციური წარმოებულები, კონცენტრირებულ მარილმჟავასთან ერთად მოხარშვისას, განიცდიან ჰიდროლიზს, რასაც მოჰყვება დეკარბოქსილირება.
ბაზის-კატალიზირებული ჰიდროლიზისთვის ჩვეულებრივ გამოიყენება NaOH ან KOH წყალხსნარი ან წყალ-ალკოჰოლური ხსნარი. საუკეთესო შედეგები მიიღება კალიუმის ჰიდროქსიდის თხელი სუსპენზიის გამოყენებით DMSO-ში, რომელიც შეიცავს მცირე რაოდენობით წყალს.

ეს უკანასკნელი მეთოდი სასურველია შეფერხებული მჟავების ეთერების საპონიფიკაციისთვის, ამ მეთოდის კიდევ ერთი მოდიფიკაცია არის შეფერხებული ეთერების ტუტე ჰიდროლიზი 18-გვირგვინ-6-პოლიესტერის თანდასწრებით:

მოსამზადებელი მიზნებისთვის, ბაზის კატალიზირებულ ჰიდროლიზს აქვს მრავალი აშკარა უპირატესობა მჟავა ჰიდროლიზთან შედარებით. ეთერების ძირითადი ჰიდროლიზის სიჩქარე, როგორც წესი, ათასჯერ უფრო სწრაფია, ვიდრე მჟავა კატალიზის სიჩქარე. ჰიდროლიზი მჟავე გარემოში არის შექცევადი პროცესი, განსხვავებით ჰიდროლიზისგან ფუძის არსებობისას, რომელიც შეუქცევადია.
18.8.2.ა. ესტერების ჰიდროლიზის მექანიზმები
ეთერების ჰიდროლიზი სუფთა წყლით უმეტეს შემთხვევაში არის შექცევადი რეაქცია, რაც იწვევს კარბოქსილის მჟავისა და საწყისი ეთერის წონასწორულ ნარევს:

ეს რეაქცია მჟავე და ტუტე გარემოში ძალიან დაჩქარებულია, რაც დაკავშირებულია მჟავა-ტუტოვანი კატალიზით (თავი 3).
კ.ინგოლდის მიხედვით, ეთერების ჰიდროლიზის მექანიზმები კლასიფიცირდება შემდეგი კრიტერიუმების მიხედვით:
(1) კატალიზის ტიპი: მჟავე (სიმბოლო A) ან ძირითადი (სიმბოლო B);
(2) გაყოფის ტიპი, რომელიც გვიჩვენებს, თუ რომელი -C-O ბმული იშლება ესტერში რეაქციის შედეგად: აცილის ჟანგბადი (ინდექსი AC) ან ალკილის ჟანგბადი (ინდექსი AL):

(3) რეაქციის მოლეკულურობა (1 ან 2).
ამ სამი კრიტერიუმიდან შეიძლება გაკეთდეს რვა განსხვავებული კომბინაცია, რომლებიც ნაჩვენებია სურათზე 18.1.

ეს არის ყველაზე გავრცელებული მექანიზმები. ტუტე საპონიფიკაცია თითქმის ყოველთვის არის ტიპის B AC 2. მჟავა ჰიდროლიზი (ისევე როგორც ესტერიფიკაცია) უმეტეს შემთხვევაში აქვს A AC 2 მექანიზმი.

AAC 1 მექანიზმი, როგორც წესი, შეიმჩნევა მხოლოდ ძლიერ მჟავე ხსნარებში (მაგალითად, კონკ. H 2 SO 4-ში) და განსაკუთრებით ხშირია სტერილურად შეფერხებული არომატული მჟავების ეთერებისთვის.
BAC 1-ის მექანიზმი ჯერ კიდევ უცნობია.

B AL 2 მექანიზმი იქნა ნაპოვნი მხოლოდ განსაკუთრებულად ძლიერი სივრცით სკრინინგული აცილური ჯგუფებისა და -ლაქტონების ნეიტრალური ჰიდროლიზის შემთხვევაში. A AL 2-ის მექანიზმი ჯერ კიდევ უცნობია.

მექანიზმის მიხედვით და AL 1 ჩვეულებრივ რეაგირებს მესამეულ-ალკილის ეთერებზე ნეიტრალურ ან მჟავე გარემოში. იგივე სუბსტრატებს მსგავს პირობებში შეუძლიათ რეაგირება B AL 1 მექანიზმის მიხედვით, თუმცა, ოდნავ უფრო ტუტე გარემოზე გადასვლისას, B AL 1 მექანიზმი დაუყოვნებლივ იცვლება B AC 2 მექანიზმით.
როგორც სქემიდან 18.1 ჩანს, მჟავებით კატალიზებული რეაქციები შექცევადია და მიკროსკოპული შექცევადობის პრინციპიდან (თავი 2) გამომდინარეობს, რომ მჟავით კატალიზებული ესტერიფიკაცია ასევე მიმდინარეობს მსგავსი მექანიზმებით. თუმცა, ბაზის კატალიზით, წონასწორობა გადადის ჰიდროლიზისკენ (საპონიფიკაციისაკენ), ვინაიდან წონასწორობა იცვლება კარბოქსილის მჟავას იონიზაციის გამო. ზემოაღნიშნული სქემის მიხედვით A AC 1 მექანიზმის შემთხვევაში COOR და COOH ჯგუფები პროტონირებულია ალკოქსის ან ჰიდროქსილის ჟანგბადის ატომში. ზოგადად, თერმოდინამიკის თვალსაზრისით, კარბონილის ჟანგბადის პროტონაცია, C=O ჯგუფი, უფრო ხელსაყრელია, რადგან ამ შემთხვევაში, დადებითი მუხტი შეიძლება დელოკალიზდეს ჟანგბადის ორივე ატომს შორის:

მიუხედავად ამისა, ხსნარი ასევე შეიცავს ტავტომერულ კატიონს, აუცილებელ შუალედს A AC 1 მექანიზმში, მცირე რაოდენობით. ორივე B1 მექანიზმი (რომლისგანაც B AC 1 უცნობია) სინამდვილეში საერთოდ არ არის კატალიზური, რადგან დასაწყისში დისოციაცია. ჩნდება ნეიტრალური ეთერი.
ინგოლდის რვა მექანიზმიდან მხოლოდ ექვსია ექსპერიმენტულად დადასტურებული.
განმარტება
ორგანული ბუნების ნაერთები, რომლებიც წარმოადგენენ კარბოქსილის მჟავების წარმოებულებს, წარმოიქმნება ამ უკანასკნელის სპირტებთან ურთიერთქმედებისას:
ეთერების სტრუქტურული ფორმულა ზოგადი თვალსაზრისით:

სადაც R და R' არის ნახშირწყალბადის რადიკალები.
ეთერების ჰიდროლიზი
ეთერების ერთ-ერთი ყველაზე დამახასიათებელი უნარი (ესტერიფიკაციის გარდა) არის მათი ჰიდროლიზი - გაყოფა წყლის მოქმედებით. სხვა გზით, ეთერების ჰიდროლიზს ეწოდება საპონიფიკაცია. მარილების ჰიდროლიზისგან განსხვავებით, ამ შემთხვევაში ის პრაქტიკულად შეუქცევადია. განასხვავებენ ეთერების ტუტე და მჟავა ჰიდროლიზს. ორივე შემთხვევაში წარმოიქმნება ალკოჰოლი და მჟავა:
ა) მჟავა ჰიდროლიზი

ბ) ტუტე ჰიდროლიზი

პრობლემის გადაჭრის მაგალითები
მაგალითი 1
| ვარჯიში | განსაზღვრეთ ძმარმჟავას მასა, რომელიც შეიძლება მივიღოთ ეთილის აცეტატის საპონიფიკაციის დროს 180 გ მასით. |
| გამოსავალი | ჩვენ ვწერთ რეაქციის განტოლებას ძმარმჟავას ეთილის ეთერის ჰიდროლიზის ფორმულის გამოყენებით: C 4 H 8 O 2 + H 2 O ↔ CH 3 COOH + C 2 H 5 OH. გამოთვალეთ ეთილის აცეტატის ნივთიერების რაოდენობა (მოლური მასა - 88 გ/მოლ), პრობლემის პირობების მასის მნიშვნელობის გამოყენებით: υ (C 4 H 8 O 2) \u003d m (C 4 H 8 O 2) / M (C 4 H 8 O 2) \u003d 180/88 \u003d 2 მოლ. რეაქციის განტოლების მიხედვით, ეთილის აცეტატის და ძმარმჟავას მოლი არის: υ (C 4 H 8 O 2) \u003d υ (CH 3 COOH) \u003d 2 მოლი. შემდეგ შეგიძლიათ განსაზღვროთ ძმარმჟავას მასა (მოლური მასა - 60 გ/მოლ): m (CH 3 COOH) \u003d υ (CH 3 COOH) × M (CH 3 COOH) \u003d 2 × 60 \u003d 120 გ. |
| უპასუხე | ძმარმჟავას მასა 120 გრამია. |
ესტერებიზოგადი ფორმულის კარბოქსილის მჟავების ფუნქციურ წარმოებულებს უწოდებენ RC(O)OR" .
კარბოქსილის მჟავების ეთერები (ისევე როგორც სულფონის მჟავები) მარილების ანალოგიურად არის დასახელებული, მხოლოდ კატიონის სახელის ნაცვლად გამოიყენება შესაბამისი ალკილის ან არილის სახელი, რომელიც მოთავსებულია ანიონის სახელზე წინ და იწერება ერთად. მასთან ერთად. -COOR ეთერების ჯგუფის არსებობა ასევე შეიძლება გამოხატული იყოს აღწერილობით, მაგალითად, "(ასეთი და ასეთი) მჟავის R-ესტერი" (ეს მეთოდი ნაკლებად სასურველია მისი უხერხულობის გამო):
ქვედა ალკოჰოლებისა და კარბოქსილის მჟავების ეთერები არის აქროლადი სითხეები, სასიამოვნო სუნით, წყალში ცუდად ხსნადი და კარგად - ორგანულ გამხსნელებში. ეთერების სუნი მოგვაგონებს სხვადასხვა ხილის სუნს, რის გამოც კვების მრეწველობაში მათგან ამზადებენ ესენციებს, რომლებიც მიბაძავს ხილის სუნს. ეთერების გაზრდილი არასტაბილურობა გამოიყენება ანალიტიკური მიზნებისთვის.
ჰიდროლიზი. აცილაციის რეაქციებიდან ყველაზე მნიშვნელოვანი არის ეთერების ჰიდროლიზი ალკოჰოლისა და კარბოქსილის მჟავის წარმოქმნით:
რეაქცია მიმდინარეობს როგორც მჟავე, ისე ტუტე გარემოში. მჟავა კატალიზებული ესტერის ჰიდროლიზი - ესტერიფიკაციის საპირისპირო რეაქცია, მიმდინარეობს იგივე მექანიზმით A AC 2:
ნუკლეოფილი ამ რეაქციაში არის წყალი. წონასწორობის ცვლილება ალკოჰოლისა და მჟავას წარმოქმნისკენ უზრუნველყოფილია ჭარბი წყლის დამატებით.
ტუტე ჰიდროლიზი შეუქცევადია; რეაქციის დროს ტუტის მოლი მოიხმარება ეთერის მოლზე, ანუ ტუტე ამ რეაქციაში მოქმედებს როგორც სახარჯო რეაგენტი და არა კატალიზატორი:
ეთერების ჰიდროლიზი შიგნით ტუტე გარემო მიმდინარეობს ბიმოლეკულური აცილის მექანიზმით B AC 2 ტეტრაედრული შუალედურის (I) ფორმირების სტადიის გავლით. ტუტე ჰიდროლიზის შეუქცევადობას უზრუნველყოფს კარბოქსილის მჟავას (II) და ალკოქსიდის იონის (III) პრაქტიკულად შეუქცევადი მჟავა-ტუტოვანი ურთიერთქმედება. კარბოქსილის მჟავას (IV) მიღებული ანიონი თავისთავად საკმაოდ ძლიერი ნუკლეოფილია და ამიტომ არ ექვემდებარება ნუკლეოფილურ შეტევას.
ეთერების ამმონოლიზი. ამიდები მიიღება ეთერების ამმონოლიზით. მაგალითად, დიეთილის ფუმარატზე წყალხსნარში ამიაკის მოქმედების შედეგად წარმოიქმნება სრული ფუმარინის მჟავა ამიდი:
ეთერების ამონოლიზის დროს ამინები დაბალი ნუკლეოფილურობით, ეს უკანასკნელი ჯერ გარდაიქმნება ტუტე ან ტუტე მიწის ლითონების ამიდებად:

კარბოქსილის მჟავების ამიდები: ნომენკლატურა; ამიდური ჯგუფის სტრუქტურა; მჟავა-ტუტოვანი თვისებები; მჟავა და ტუტე ჰიდროლიზი; გაყოფა ჰიპობრომიტებითა და აზოტის მჟავებით; დეჰიდრატაცია ნიტრილამდე; ქიმიური იდენტიფიკაცია.
ამიდებიზოგადი ფორმულის კარბოქსილის მჟავების ფუნქციურ წარმოებულებს უწოდებენ R-C (O) -NH 2- n R "n,სადაც n = 0-2. შეუცვლელ ამიდებში აცილის ნარჩენი დაკავშირებულია შეუცვლელ ამინოჯგუფთან, N-ჩანაცვლებულ ამიდებში წყალბადის ერთ-ერთი ატომი იცვლება ერთი ალკილის ან არილის რადიკალით, N,N-ჩანაცვლებული - ორით.
ნაერთებს, რომლებიც შეიცავს აცილის ერთ, ორ ან სამ ჯგუფს, რომლებიც მიმაგრებულია აზოტის ატომზე, ზოგადად უწოდებენ ამიდებს (შესაბამისად, პირველადი, მეორადი და მესამეული). პირველადი ამიდების სახელები შეუცვლელი ჯგუფით - NH 2 მომდინარეობს შესაბამისი აცილის რადიკალების სახელებიდან, სუფიქსი -oil (ან -yl) -ამიდით ჩანაცვლებით. მჟავებისგან წარმოქმნილი ამიდები სუფიქსით -კარბოქსილის მჟავით იღებენ სუფიქსს -კარბოქსამიდს. სულფონის მჟავების ამიდები ასევე დასახელებულია მათი შესაბამისი მჟავების მიხედვით, სუფიქსის - სულფონამიდის გამოყენებით.
რადიკალების სახელები RCO-NH- (ისევე, როგორც RSO 2 -NH-) წარმოიქმნება ამიდების სახელებიდან, ცვლის სუფიქსს -ამიდი - ამიდო-. ისინი გამოიყენება, თუ დანარჩენ მოლეკულაში არის უფრო ძველი ჯგუფი ან ჩანაცვლება ხდება უფრო რთულ სტრუქტურაში, ვიდრე რადიკალი R:

N-ჩანაცვლებული პირველადი ამიდების RCO-NHR" და RCO-NR"R" (ისევე როგორც მსგავსი სულფონამიდები) სახელწოდებებში, რადიკალების R" და R" სახელები მითითებულია ამიდის სახელამდე N სიმბოლოთი. -:
ამ ტიპის ამიდებს ხშირად მოიხსენიებენ, როგორც მეორად და მესამეულ ამიდებს, რაც არ არის რეკომენდებული IUPAC-ის მიერ.
N-ფენილ-შემცვლელი ამიდები მათ სახელებში მოცემულია სუფიქსი -ანილიდი. შემცვლელების პოზიცია ანილინის ნარჩენებში მითითებულია რიცხვებით დარტყმით:
გარდა ამისა, შემორჩენილია ნახევრად სისტემატური სახელები, რომლებშიც სუფიქსი -ამიდი უკავშირდება კარბოქსილის მჟავას ლათინური სახელწოდების ფუძეს (ფორმამიდი, აცეტამიდი), აგრეთვე ზოგიერთი. ტრივიალური სახელები, როგორიცაა "ანილიდები" (აცილირებული ანილინები) ან "ტოლუიდიდები" (აცილირებული ტოლუიდინები).
ამიდები არის კრისტალური ნივთიერებები შედარებით მაღალი და მკაფიო დნობის წერტილებით, რაც საშუალებას აძლევს მათ გამოიყენონ როგორც წარმოებულები კარბოქსილის მჟავების იდენტიფიკაციისთვის. იშვიათ შემთხვევებში ისინი სითხეებია, მაგალითად, ჭინჭრის ციების ამიდები - ფორმამიდი და N,N-დიმეთილფორმამიდი - ცნობილი დიპოლარული აპროტური გამხსნელები. ქვედა ამიდები წყალში ძალიან ხსნადია.
ამიდები არიან ერთ-ერთი ყველაზე მდგრადია ჰიდროლიზის მიმართ კარბოქსილის მჟავების ფუნქციური წარმოებულები, რის გამოც ისინი ფართოდ არის გავრცელებული ბუნებაში. ბევრი ამიდი გამოიყენება სამკურნალოდ. დაახლოებით ერთი საუკუნის განმავლობაში სამედიცინო პრაქტიკაში გამოიყენებოდა პარაცეტამოლი და ფენაცეტინი, რომლებიც ძმარმჟავას შემცვლელი ამიდებია.
ამიდების სტრუქტურა. ამიდური ჯგუფის ელექტრონული სტრუქტურა დიდწილად წააგავს კარბოქსილის ჯგუფის სტრუქტურას. ამიდური ჯგუფი არის p,π-კონიუგირებული სისტემა, რომელშიც აზოტის ატომის ერთადერთი წყვილი ელექტრონები შერწყმულია C=O π ბმის ელექტრონებთან. ელექტრონის სიმკვრივის დელოკალიზაცია ამიდის ჯგუფში შეიძლება წარმოდგენილი იყოს ორი რეზონანსული სტრუქტურით:
კონიუგაციის გამო ამიდებში C-N ბმა აქვს ნაწილობრივ ორმაგად დაკავშირებული ხასიათი, მისი სიგრძე მნიშვნელოვნად ნაკლებია ამინებში ერთი ბმის სიგრძეზე, ხოლო C=O ბმა გარკვეულწილად გრძელია ვიდრე C=O ბმა ალდეჰიდებსა და კეტონებში. ამიდური ჯგუფი კონიუგაციის გამო აქვს ბრტყელი დიზაინი . ქვემოთ მოცემულია N-ჩანაცვლებული ამიდის მოლეკულის გეომეტრიული პარამეტრები, რომლებიც განისაზღვრება რენტგენის დიფრაქციული ანალიზის გამოყენებით:

C-N ბმის ნაწილობრივ ორმაგად შეკრული ბუნების მნიშვნელოვანი შედეგია საკმაოდ მაღალი ენერგეტიკული ბარიერი ამ ბმის გარშემო ბრუნვისთვის, მაგალითად, დიმეთილფორმამიდისთვის ეს არის 88 კჯ/მოლი. ამ მიზეზით, ამიდები, რომლებსაც აქვთ სხვადასხვა შემცვლელი აზოტის ატომზე, შეიძლება არსებობდეს π-დიასტერეომერების სახით. N-შემცვლელი ამიდები ძირითადად არსებობს Z-იზომერების სახით:

N,N-ჩანაცვლებული ამიდების შემთხვევაში E- და Z-იზომერების თანაფარდობა დამოკიდებულია აზოტის ატომთან დაკავშირებული რადიკალების მოცულობაზე. ამიდების სტერეოიზომერები კონფიგურაციულად არასტაბილურია, მათი არსებობა დადასტურებულია ძირითადად ფიზიკურ-ქიმიური მეთოდებით და ცალკეულ შემთხვევებში იზოლირებულია. ეს გამოწვეულია იმით, რომ ამიდების ბრუნვის ბარიერი ჯერ კიდევ არ არის ისეთი მაღალი, როგორც ალკენებისთვის, რისთვისაც არის 165 კჯ/მოლი.
მჟავა-ტუტოვანი თვისებები. ამიდებს აქვთ სუსტი როგორც მჟავე, ასევე ძირითადი თვისებები . ამიდების საფუძვლიანობა მდგომარეობს Pk BH + -0.3-დან -3.5-მდე დიაპაზონში. ამიდებში ამინო ჯგუფის შემცირებული ბაზისურობის მიზეზი არის აზოტის ატომის ელექტრონების მარტოხელა წყვილის შეერთება კარბონილის ჯგუფთან. ძლიერ მჟავებთან ურთიერთობისას ამიდები პროტონირებულია ჟანგბადის ატომში როგორც განზავებულ, ისე კონცენტრირებულ მჟავას ხსნარებში. ამ სახის ურთიერთქმედება საფუძვლად უდევს მჟავა კატალიზი ამიდური ჰიდროლიზის რეაქციებში:
გამოფენილია შეუცვლელი და N-ჩანაცვლებული ამიდები სუსტი NH-მჟავა თვისებები სპირტების მჟავიანობასთან შედარებით და პროტონის ამოღება მხოლოდ ძლიერი ფუძეების რეაქციაში.
მჟავა-ტუტოვანი ურთიერთქმედება საფუძვლად უდევს ამიდების წარმოქმნას ინტერმოლეკულური ასოციაციები , რომლის არსებობა ხსნის ამიდების მაღალ დნობისა და დუღილის წერტილებს. შესაძლებელია ორი ტიპის ასოცირების არსებობა: წრფივი პოლიმერები და ციკლური დიმერები. ამა თუ იმ ტიპის უპირატესობა განისაზღვრება ამიდის სტრუქტურით. მაგალითად, N-მეთილაცეტამიდი, რომლისთვისაც Z- კონფიგურაცია უპირატესია, ქმნის ხაზოვან ასოცირებულს, ხოლო ლაქტამები, რომლებსაც აქვთ ხისტი ფიქსირებული E-კონფიგურაცია, ქმნიან დიმერებს:

N, N-ჩანაცვლებული ამიდები ქმნიან დიმერებს 2 პოლარული მოლეკულის დიპოლ-დიპოლური ურთიერთქმედების გამო:

აცილირების რეაქციები. კონიუგირებული ამიდის სისტემაში ძლიერი ელექტრონის შემომწირველი ამინო ჯგუფის არსებობის გამო, კარბონილის ნახშირბადის ატომის ელექტროფილურობა და, შესაბამისად, ამიდების რეაქტიულობა აცილაციის რეაქციებში, ძალიან დაბალია. ამიდების დაბალი აცილების უნარი ასევე აიხსნება იმით, რომ ამიდური იონი NH 2 არის ცუდი გამსვლელი ჯგუფი. აცილაციის რეაქციებიდან მნიშვნელოვანია ამიდების ჰიდროლიზი, რომელიც შეიძლება განხორციელდეს მჟავე და ტუტე გარემოში. ამიდები გაცილებით რთულია ჰიდროლიზებისთვის, ვიდრე კარბოქსილის მჟავების სხვა ფუნქციური წარმოებულები. ამიდების ჰიდროლიზი უფრო მძიმე პირობებში ხდება ეთერების ჰიდროლიზთან შედარებით.
მჟავა ჰიდროლიზიამიდები - შეუქცევადი რეაქცია, რომელიც იწვევს კარბოქსილის მჟავას და ამონიუმის მარილის წარმოქმნას:
უმეტეს შემთხვევაში, ამიდების მჟავა ჰიდროლიზი მიმდინარეობს მექანიზმის მიხედვით ბიმოლეკულური მჟავა აცილირება A AC 2 , ანუ ეთერების მჟავა ჰიდროლიზის მექანიზმის მსგავსი. რეაქციის შეუქცევადობა განპირობებულია იმით, რომ მჟავე გარემოში ამიაკი ან ამინი გარდაიქმნება ამონიუმის იონად, რომელსაც არ გააჩნია ნუკლეოფილური თვისებები:

ტუტე ჰიდროლიზიიგივე შეუქცევადი რეაქცია; ამის შედეგად წარმოიქმნება კარბოქსილის მჟავას მარილი და ამიაკი ან ამინი:
ამიდების ტუტე ჰიდროლიზი, ისევე როგორც ეთერების ჰიდროლიზი, მიმდინარეობს ოთხკუთხა მექანიზმი IN AC 2 . რეაქცია იწყება ამიდური ჯგუფის ელექტროფილურ ნახშირბადის ატომში ჰიდროქსიდის იონის (ნუკლეოფილის) დამატებით. შედეგად მიღებული ანიონი (I) პროტონირებულია აზოტის ატომში, შემდეგ კი წარმოიქმნება კარგი გამომავალი ჯგუფი, ამიაკის ან ამინის მოლეკულა ბიპოლარულ იონში (II). ითვლება, რომ ნელი ეტაპი არის ტეტრაედრული შუალედური ნაწილის (II) დაშლა.
ანილიდებისთვის და სხვა ამიდებისთვის, რომლებსაც აქვთ ელექტრონის ამომყვანი შემცვლელები აზოტის ატომში, ტეტრაედრული შუალედური (I) დაშლა შეიძლება განხორციელდეს დიანიონის (II) წარმოქმნით:

გაყოფა აზოტის მჟავით. აზოტის მჟავასთან და სხვა ნიტროზატორებთან ურთიერთქმედებისას ამიდები გარდაიქმნება შესაბამის კარბოქსილის მჟავებად 90%-მდე გამოსავლიანობით:
Გაუწყლოება. შეუცვლელი ამიდები ფოსფორის (V) ოქსიდის და სხვა რეაგენტების (POC1 3, PC1 5, SOCl 2) მოქმედებით გარდაიქმნება ნიტრილებად:
![]()
47. კარბოქსილის მჟავები: ჰალოგენაცია გელ-ვოლჰარდ-ზელინსკის მიხედვით, რეაქციის გამოყენებით სინთეზისთვის.ა -ჰიდროქსი დაა -ამინომჟავების.
ალიფატური კარბოქსილის მჟავების ჰალოგენაცია.
ალიფატური კარბოქსილის მჟავები ჰალოგენირებულია α-პოზიციაში ქლორთან ან ბრომთან კატალიზური რაოდენობით. წითელი ფოსფორი ან ფოსფორის ჰალოგენიდები (გელ-ვოლჰარდ-ზელინსკის რეაქცია ). მაგალითად, როდესაც ჰექსანოინის მჟავა ბრომირებულია წითელი ფოსფორის ან ფოსფორის(III) ქლორიდის თანდასწრებით, 2-ბრომოჰექსანოინის მჟავა წარმოიქმნება მაღალი მოსავლიანობით, მაგალითად:
ბრომირებას განიცდის არა თავად კარბოქსილის მჟავა, არამედ მისგან ადგილზე წარმოქმნილი მჟავა ქლორიდი. მჟავას ქლორიდს აქვს უფრო ძლიერი CH-მჟავა თვისებები, ვიდრე კარბოქსილის მჟავა და უფრო ადვილად ქმნის ენოლის ფორმას.
ენოლი (I) ამატებს ბრომს ჰალოგენის წარმოებულის (II) წარმოქმნის მიზნით, რომელიც შემდგომში აბსტრაქტებს წყალბადის ჰალოგენს და გადაიქცევა α-ჰალოგენით შემცვლელ მჟავა ჰალოგენად (III). ბოლო ეტაპზე ხდება შეუცვლელი კარბოქსილის მჟავას ჰალოიდის რეგენერაცია.

სხვა ჰეტეროფუნქციური მჟავები სინთეზირდება მიღებული α-ჰალო-შემცვლელი მჟავებიდან ნუკლეოფილური ჩანაცვლების რეაქციების გამოყენებით.