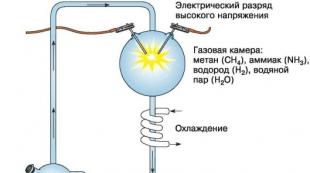
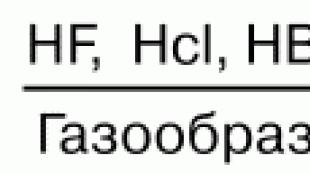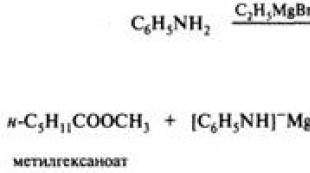ماذا تتفاعل مع أكاسيد؟ دروس في الكيمياء غير العضوية للتحضير لامتحان الدولة الموحدة. يتفاعل مع بعض اللافلزات
عند دراسة الخواص الكيميائية للماء تعلمت أن العديد من الأكاسيد (أكاسيد) اللافلزات عند تفاعلها مع الماء تشكل أحماض، على سبيل المثال:
SO 3 + H 2 O = H 2 SO 4 + Q
بعض أكاسيد المعادن عند تفاعلها مع الماء تشكل قواعد (قلويات)، على سبيل المثال:
CaO + H 2 O = Ca(OH) 2 + Q
ومع ذلك، فإن خاصية الأكاسيد للتفاعل مع الماء ليست شائعة في جميع المواد من هذه الفئة. العديد من الأكاسيد، مثل ثاني أكسيد السيليكون SiO 2، وأول أكسيد الكربون CO، وأكسيد النيتروجين NO، وأكسيد النحاس CuO، وأكسيد الحديد Fe 2 O 3، وما إلى ذلك، لا تتفاعل مع الماء.
تفاعل الأكاسيد مع الأحماض
تعلم أن بعض أكاسيد المعادن تتفاعل مع الأحماض لتكوين الملح والماء، على سبيل المثال:
CuO + H2SO4 = CuSO4 + H2O
تفاعل الأكاسيد مع القواعد
بعض الأكاسيد (ثاني أكسيد الكربون CO 2، ثاني أكسيد الكبريت SO 2، أنهيدريد الفوسفوريك P 2 O 5، إلخ) لا تتفاعل مع الأحماض لتكوين الملح والماء. دعونا نكتشف: هل يتفاعلون مع القواعد؟
املأ دورقًا جافًا بثاني أكسيد الكربون واسكب فيه الصودا الكاوية NaOH. نغلق القارورة بسدادة مطاطية مع إدخال أنبوب زجاجي فيها وأنبوب مطاطي بمشبك يوضع على نهايته الحرة. عندما نلمس الدورق بيدنا، نشعر بأن الزجاج يسخن. ظهرت قطرات من الماء على الجدران الداخلية للقارورة. كل هذه علامات على تفاعل كيميائي. إذا تفاعل ثاني أكسيد الكربون مع الصودا الكاوية، فيمكننا أن نفترض أنه قد تم إنشاء فراغ في القارورة. للتحقق من ذلك، بعد تبريد القارورة إلى درجة حرارة الغرفة، قم بخفض نهاية الأنبوب المطاطي للجهاز في جهاز التبلور بالماء وافتح المشبك. سوف يندفع الماء بسرعة إلى القارورة. تم تأكيد افتراضنا حول الفراغ الموجود في الدورق - تفاعل ثاني أكسيد الكربون مع الصودا الكاوية. أحد منتجات التفاعل هو الماء. ما هو تكوين المادة الصلبة الناتجة؟
هيدروكسيد الصوديوم + CO 2 = H 2 O + ؟ +س
من المعروف أن ثاني أكسيد الكربون يتوافق مع هيدرات أكسيد (أكسيد) - حمض الكربونيك H 2 CO 3. المادة الصلبة المتكونة في الدورق هي ملح حمض الكربونيك - كربونات الصوديوم Na 2 CO 3.
لتكوين جزيء من كربونات الصوديوم، يلزم وجود جزيئين من هيدروكسيد الصوديوم:
2NaOH + CO 2 = Na 2 CO 3 + H 2 O + Q
عندما تفاعل ثاني أكسيد الكربون مع الصودا الكاوية، تم الحصول على ملح كربونات الصوديوم Na 2 CO 3 والماء.
بالإضافة إلى ثاني أكسيد الكربون، هناك العديد من الأكاسيد (SO 2، SO 3، SiO 2، P 2 O 5، إلخ) التي تتفاعل مع القلويات لتكوين الملح والماء.
دور الكيمياء في التقدم العلمي والتكنولوجي عظيم. وتستخدم العديد من المواد البسيطة والمعقدة في مختلف مجالات البناء والتصنيع والزراعة. من بينها عدد كاف من المركبات غير العضوية. تشمل أهم فئات المركبات غير العضوية الأكاسيد والقواعد والأحماض والأملاح.
أكاسيد
أكسيد- مادة معقدة تشتمل على عنصرين أحدهما الأكسجين في حالة الأكسدة - 2. الصيغة العامة للأكاسيد هي E x O y حيث x هو عدد ذرات العنصر؛ y هو عدد ذرات الأكسجين.
تكوين الأكاسيد
يتم تحديد تكوين الأكسيد من خلال حالة الأكسدة الإيجابية للعنصر الذي يشكل الأكسيد.
يتكون اسم الأكسيد من كلمة "أكسيد" واسم العنصر. إذا أظهر العنصر تكافؤًا متغيرًا، فسيتم وضع التكافؤ بين قوسين بجوار اسم الأكسيد:
نا 2 يا - أكسيد الصوديوم؛
SO 3 - أكسيد الكبريت (السادس)؛
الحصول على أكاسيد
الحصول على أكاسيد:
أ) أكسدة العناصر بالأكسجين
4Al + 3O 2 = 2Al 2 O 3؛
S + O 2 = SO 2؛
ب) أثناء تحلل المواد المعقدة
Ca(OH) 2 → CaO + H2O;
ح 2 SO 3 → SO 2 + H 2 O؛
ج) أثناء أكسدة المواد المعقدة
2H2S + 3O2 = 2SO2 + 2H2O.
تصنيف الأكاسيد
بناءً على خواصها الكيميائية، تنقسم الأكاسيد إلى: تشكيل الملحو غير تشكيل الملحأو غير مبال (CO، NO، N 2 O، SiO).
تسمى منتجات تفاعل الأكاسيد مع الماء هيدروكسيدات، والتي يمكن أن تكون قواعد (NaOH، Cu(OH) 2)، أحماض (H 2 SO 4، H 3 PO 4)، هيدروكسيدات مذبذبة (Zn(OH) 2 = H 2 أكسيد الزنك 2).
وتنقسم أكاسيد تشكيل الملح إلى أساسي, حمضيةو مذبذب.
رئيسيتسمى الأكاسيد التي تتوافق معها القاعدة: CaO → Ca(OH) 2، حمضية- الذي يتوافق مع الحمض: CO 2 → H 2 CO 3. مذبذبتتوافق الأكاسيد مع كل من الأحماض والقواعد:
Zn(OH) 2 ← ZnO → H 2 ZnO 2 .
أساسيأكاسيد تشكل المعادن، حمضية- اللافلزات وبعض المعادن من المجموعات الفرعية الثانوية، مذبذب- معادن مذبذبة.
الخواص الكيميائية للأكاسيد
تتفاعل الأكاسيد الأساسية:
1) مع الماء لتكوين القواعد :
نا 2 O + H 2 O = 2NaOH؛
CaO + H 2 O = Ca(OH) 2;
2) مع المركبات الحمضية (أكاسيد الأحماض والأحماض) مع تكوين الأملاح والماء:
CaO + CO 2 = CaCO 3؛
CaO + 2HCl = CaCl 2 + H 2 O؛
3) مع المركبات ذات الطبيعة المذبذبة:
لي 2 يا + آل 2 يا 3 = 2لي آلو 2؛
3NaOH + Al(OH) 3 = Na 3 AlO 3 + 3H 2 O;
تفاعل الأكاسيد الحمضية:
1) مع الماء لتكوين الأحماض :
SO 3 + H 2 O = H 2 SO 4؛
2) مع المركبات الأساسية (الأكاسيد والقواعد الأساسية) مع تكوين الأملاح والماء:
SO 2 + Na 2 O = Na 2 SO 3؛
CO 2 + 2NaOH = Na 2 CO 3 + H 2 O؛
3) مع مركبات ذات طبيعة مذبذبة
CO 2 + ZnO = ZnCO 3؛
CO 2 + Zn(OH) 2 = ZnCO 3 + H 2 O؛
تظهر الأكاسيد المذبذبة خصائص الأكاسيد الأساسية والحمضية. تجيبهم الهيدروكسيدات المذبذبة:
البيئة الحمضية البيئة القلوية
Be(OH) 2 BeO H 2 BeO 2
Zn(OH) 2 ZnO H 2 ZnO 2
آل (OH) 3 آل 2 يا 3 ح 3 آلو 3، هالو 2
الكروم (OH) 3 الكروم 2 يا 3 حمض الهيدروكلوريك 2
الرصاص (OH) 2 PbO H 2 PbO 2
القصدير (OH) 2 سنو ح 2 سنو 2
تتفاعل الأكاسيد المذبذبة مع المركبات الحمضية والقاعدية:
| ZnO + SiO 2 = ZnSiO 3؛ ZnO + H 2 SiO 3 = ZnSiO 3 + H 2 O؛ | آل 2 يا 3 + 3نا 2 يا = 2نا 3 آلو 3؛ Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O. |
يمكن للمعادن ذات التكافؤ المتغير أن تشكل أكاسيد من الأنواع الثلاثة. على سبيل المثال:
CrO الأساسي Cr(OH) 2؛
Cr 2 O 3 مذبذب Cr(OH) 3 ؛
Cr 2 O 7 حمضي H 2 Cr 2 O 7 ؛
MnO، Mn 2 O 3 الرئيسي؛
MnO 2 مذبذب.
من2O7 الحمضية HMnO4.
أكاسيد- وهي مركبات غير عضوية معقدة تتكون من عنصرين أحدهما الأكسجين (في حالة الأكسدة -2).
على سبيل المثال، يتم تصنيف Na 2 O، B 2 O 3، Cl 2 O 7 كأكاسيد. كل هذه المواد تحتوي على الأكسجين وعنصر آخر. المواد Na 2 O 2 و H 2 SO 4 و HCl ليست أكاسيد: في الأول تكون حالة أكسدة الأكسجين -1، وفي الثاني لا يوجد عنصران، بل ثلاثة عناصر، والثالث لا يحتوي على أكسجين على الاطلاق.
إذا كنت لا تفهم معنى مصطلح عدد الأكسدة، فلا بأس. أولا، يمكنك الرجوع إلى المقالة المقابلة على هذا الموقع. ثانيا، حتى من دون فهم هذا المصطلح، يمكنك مواصلة القراءة. يمكنك أن تنسى مؤقتًا ذكر حالة الأكسدة.
تم الحصول على أكاسيد جميع العناصر المعروفة حاليًا تقريبًا، باستثناء بعض الغازات النبيلة وعناصر ما بعد اليورانيوم "الغريبة". علاوة على ذلك، تشكل العديد من العناصر عدة أكاسيد (للنيتروجين، على سبيل المثال، ستة معروفة).
تسميات الأكاسيد
يجب أن نتعلم تسمية الأكاسيد. انه بسيط جدا.مثال 1. قم بتسمية المركبات التالية: Li 2 O، Al 2 O 3، N 2 O 5، N 2 O 3.
Li 2 O - أكسيد الليثيوم،
آل 2 يا 3 - أكسيد الألومنيوم،
N 2 O 5 - أكسيد النيتريك (V)،
N 2 O 3 - أكسيد النيتريك (III).
يرجى ملاحظة نقطة مهمة: إذا كان تكافؤ العنصر ثابتًا، فإننا لا نذكره باسم الأكسيد. إذا تغير التكافؤ، تأكد من الإشارة إليه بين قوسين! الليثيوم والألومنيوم لهما تكافؤ ثابت، في حين أن النيتروجين له تكافؤ متغير؛ ولهذا السبب يتم استكمال أسماء أكاسيد النيتروجين بأرقام رومانية ترمز إلى التكافؤ.
التمرين 1. قم بتسمية الأكاسيد: Na 2 O، P 2 O 3، BaO، V 2 O 5، Fe 2 O 3، GeO 2، Rb 2 O. لا تنس أن هناك عناصر ذات تكافؤ ثابت ومتغير.
نقطة أخرى مهمة: الأصح تسمية المادة F 2 O ليس "أكسيد الفلور" بل "فلوريد الأكسجين"!
الخصائص الفيزيائية للأكاسيد
الخصائص الفيزيائية متنوعة للغاية. ويرجع ذلك، على وجه الخصوص، إلى حقيقة أن أنواعًا مختلفة من الروابط الكيميائية يمكن أن تظهر في الأكاسيد. تختلف نقاط الانصهار والغليان بشكل كبير. في الظروف العادية، يمكن أن تكون الأكاسيد في الحالة الصلبة (CaO، Fe 2 O 3، SiO 2، B 2 O 3)، في الحالة السائلة (N 2 O 3، H 2 O)، على شكل غازات (N 2 O). ، SO 2، NO، CO).
ألوان مختلفة: MgO وNa 2 O أبيضان، CuO أسود، N 2 O 3 أزرق، CrO 3 أحمر، إلخ.
إن ذوبان الأكاسيد ذات النوع الأيوني من الروابط يوصل الكهرباء بشكل جيد، أما الأكاسيد التساهمية، كقاعدة عامة، فهي ذات موصلية كهربائية منخفضة.
تصنيف الأكاسيد
يمكن تقسيم جميع الأكاسيد الموجودة في الطبيعة إلى 4 فئات: الأساسية والحمضية والمذبذبة وغير الملحية. في بعض الأحيان يتم دمج الفئات الثلاثة الأولى في مجموعة الأكاسيد المكونة للملح، لكن هذا ليس مهمًا بالنسبة لنا الآن. تختلف الخصائص الكيميائية للأكاسيد من مختلف الفئات اختلافًا كبيرًا، لذا فإن مسألة التصنيف مهمة جدًا لمزيد من الدراسة لهذا الموضوع!
دعنا نبدء ب أكاسيد غير الملح. يجب أن نتذكرها: NO، SiO، CO، N 2 O. فقط تعلم هذه الصيغ الأربع!
للمضي قدمًا، يجب أن نتذكر أنه يوجد في الطبيعة نوعان من المواد البسيطة - المعادن واللافلزات (أحيانًا يتم تمييز مجموعة من أشباه المعادن أو أشباه المعادن أيضًا). إذا كان لديك فهم واضح للعناصر التي تعتبر فلزات، تابع قراءة هذا المقال. إذا كان لديك أدنى شك، فارجع إلى المادة "المعادن وغير المعادن"على هذا الموقع.
لذا، دعني أخبرك أن جميع الأكاسيد المذبذبة هي أكاسيد فلزات، ولكن ليست كل أكاسيد الفلزات مذبذبة. سأدرج أهمها: BeO، ZnO، Al 2 O 3، Cr 2 O 3، SnO. القائمة ليست كاملة، ولكن يجب عليك بالتأكيد أن تتذكر الصيغ المدرجة! في معظم الأكاسيد المذبذبة، يُظهر المعدن حالة أكسدة تبلغ +2 أو +3 (ولكن هناك استثناءات).
وفي الجزء التالي من المقال سنواصل الحديث عن التصنيف؛ دعونا نناقش الأكاسيد الحمضية والقاعدية.
فيديو تعليمي 2: الخواص الكيميائية للأكاسيد الأساسية
محاضرة: الخصائص الكيميائية المميزة للأكاسيد: الأساسية، المذبذبة، الحمضية
أكاسيد- مركبات ثنائية (مواد معقدة) تتكون من الأكسجين بحالة أكسدة -2 وعنصر آخر.
تنقسم جميع الأكاسيد حسب قدرتها الكيميائية على تكوين الأملاح إلى مجموعتين:
- تشكيل الملح،
- غير تشكيل الملح.
وتنقسم المركبات المكونة للملح بدورها إلى ثلاث مجموعات: الأساسية والحمضية والمذبذبة. وتشمل تلك التي لا تشكل الملح أكسيد الكربون (II) CO، وأكسيد النيتروجين (I) N2O، وأكسيد النيتروجين (II) NO، وأكسيد السيليكون (II) SiO.
أكاسيد أساسية- هذه هي الأكاسيد التي تظهر الخصائص الأساسية التي تتكون من الفلزات القلوية والقلوية الأرضية في حالات الأكسدة +1، +2، وكذلك المعادن الانتقالية في حالات الأكسدة المنخفضة.
تتوافق هذه المجموعة من الأكاسيد مع القواعد التالية: K 2 O – KOH؛ باو - با (أوه) 2؛ لا 2 يا 3 – لا(OH) 3.
أكاسيد حمضيةهي أكاسيد تظهر خواصًا حمضية، وتتكون من اللافلزات النموذجية، بالإضافة إلى بعض الفلزات الانتقالية في حالات الأكسدة من +4 إلى +7.
هذه المجموعة من الأكاسيد تتوافق مع الأحماض: SO 3 –H 2 SO 4 ; CO 2 – H 2 CO 3 ; SO 2 - H 2 SO 3، إلخ.
أكاسيد مذبذبة- هذه هي الأكاسيد التي تظهر الخواص الأساسية والحمضية، والتي تتكون من معادن انتقالية في حالات الأكسدة +3، +4. يستثني: ZnO، BeO، SnO، PbO.
هذه المجموعة من الأكاسيد تتوافق مع القواعد المذبذبة: ZnO – Zn(OH) 2 ; آل 2 يا 3 - آل (OH) 3.
دعونا نفكر في الخواص الكيميائية للأكاسيد:
كاشف | أكاسيد أساسية | أكاسيد مذبذبة | أكاسيد حمضية |
| ماء | يتفاعلون. مثال: CaO + H2O → Ca(OH) 2 | لا يستجيبون | يتفاعلون. مثال: س O 3 + H 2 O → H 2 SO 4 |
| حامض | يتفاعلون. مثال: Fe2O3 + 6HCl → 2FeCl3 + 3H2O | يتفاعلون. مثال: ZnO + 2HCl → ZnCl 2 + H2O | لا يستجيبون |
| قاعدة | لا يستجيبون | يتفاعلون. مثال: ZnO + 2NaOH + H2O → Na2 | يتفاعلون. مثال: 2NaOH + SiO 2 → Na 2 SiO 3 + H 2 O |
| أكسيد أساسي | لا يستجيبون | يتفاعلون. مثال: أكسيد الزنك + CaO → CaZnO 2 | يتفاعلون. مثال: SiO 2 + CaO → CaSiO 3 |
| أكسيد الحمض | يتفاعلون. مثال: كاو + ثاني أكسيد الكربون 2 → كربونات الكالسيوم 3 | يتفاعلون. مثال: أكسيد الزنك + SiO 2 → ZnSiO 3 | لا يستجيبون |
| أكسيد مذبذب | يتفاعلون. مثال: لي 2 يا + آل 2 يا 3 → 2LiAlO | تتفاعل | يتفاعلون. مثال: آل 2 يا 3 + 3SO 3 → آل 2 (SO 4) 3 |
ومن الجدول أعلاه يمكننا تلخيص ما يلي:
تتفاعل الأكاسيد الأساسية للمعادن الأكثر نشاطًا مع الماء لتشكل قواعد قوية - القلويات. لا تتفاعل الأكاسيد الأساسية للمعادن الأقل نشاطًا مع الماء في الظروف العادية. تتفاعل جميع أكاسيد هذه المجموعة دائمًا مع الأحماض لتشكل الأملاح والماء. لكنهم لا يتفاعلون مع الأسباب.
تتفاعل الأكاسيد الحمضية في الغالب مع الماء. لكن لا يتفاعل الجميع في ظل الظروف العادية. تتفاعل جميع أكاسيد هذه المجموعة مع القواعد لتشكل الأملاح والماء. أنها لا تتفاعل مع الأحماض.
الأكاسيد الأساسية والحمضية قادرة على التفاعل مع بعضها البعض، يلي ذلك تكوين الملح.
أكاسيد مذبذبة لها خصائص أساسية وحمضية. ولذلك، فإنها تتفاعل مع كل من الأحماض والقواعد، وتشكل الأملاح والماء. تتفاعل الأكاسيد المذبذبة مع الأكاسيد الحمضية والقاعدية. كما أنها تتفاعل مع بعضها البعض. في أغلب الأحيان، تحدث هذه التفاعلات الكيميائية عند تسخينها لتكوين الأملاح.
| | |
الأكاسيد وتصنيفها وخصائصها هي أساس علم مهم مثل الكيمياء. يبدأون دراستهم في السنة الأولى من دراسة الكيمياء. في العلوم الدقيقة مثل الرياضيات والفيزياء والكيمياء، تكون جميع المواد مترابطة، ولهذا السبب فإن الفشل في إتقان المادة يستلزم عدم فهم المواضيع الجديدة. لذلك، من المهم جدًا فهم موضوع الأكاسيد وفهمه بشكل كامل. سنحاول التحدث عن هذا بمزيد من التفصيل اليوم.
ما هي الأكاسيد؟
الأكاسيد وتصنيفها وخصائصها هي ما يجب فهمه أولاً. إذن ما هي الأكاسيد؟ هل تتذكر هذا من المدرسة؟
الأكاسيد (أو الأكاسيد) هي مركبات ثنائية تحتوي على ذرات عنصر سالبية كهربية (أقل سالبية كهربية من الأكسجين) وأكسجين بحالة أكسدة تبلغ -2.
الأكاسيد هي مواد شائعة بشكل لا يصدق على كوكبنا. تشمل أمثلة مركبات الأكسيد الماء والصدأ وبعض الأصباغ والرمل وحتى ثاني أكسيد الكربون.

تشكيل الأكاسيد
يمكن الحصول على الأكاسيد بعدة طرق. يتم أيضًا دراسة تكوين الأكاسيد بواسطة علم مثل الكيمياء. الأكاسيد وتصنيفها وخصائصها - هذا ما يحتاج العلماء إلى معرفته لفهم كيفية تكوين هذا الأكسيد أو ذاك. على سبيل المثال، يمكن الحصول عليها عن طريق الجمع المباشر بين ذرة الأكسجين (أو الذرات) مع عنصر كيميائي - وهذا هو تفاعل العناصر الكيميائية. ومع ذلك، هناك أيضًا تكوين غير مباشر للأكاسيد، وذلك عندما تتشكل الأكاسيد عن طريق تحلل الأحماض أو الأملاح أو القواعد.

تصنيف الأكاسيد
تعتمد الأكاسيد وتصنيفها على كيفية تكوينها. وتنقسم الأكاسيد حسب تصنيفها إلى مجموعتين فقط، الأولى مكونة للملح، والثانية غير مكونة للملح. لذلك، دعونا نلقي نظرة فاحصة على كلا المجموعتين.
أكاسيد تشكيل الملح هي مجموعة كبيرة إلى حد ما، والتي تنقسم إلى أكاسيد مذبذبة وحمضية وقاعدية. نتيجة لأي تفاعل كيميائي، تشكل الأكاسيد المكونة للملح أملاحًا. كقاعدة عامة، يتضمن تكوين الأكاسيد المكونة للملح عناصر من المعادن وغير المعادن، والتي تشكل الأحماض نتيجة التفاعل الكيميائي مع الماء، ولكن عند التفاعل مع القواعد فإنها تشكل الأحماض والأملاح المقابلة.
الأكاسيد غير الملحية هي تلك الأكاسيد التي لا تشكل أملاحًا نتيجة للتفاعل الكيميائي. ومن أمثلة هذه الأكاسيد الكربون.
أكاسيد مذبذبة
تعتبر الأكاسيد وتصنيفها وخصائصها مفاهيم مهمة جدًا في الكيمياء. يتضمن تكوين المركبات المكونة للملح أكاسيد مذبذبة.
الأكاسيد المذبذبة هي أكاسيد يمكن أن تظهر خواصًا قاعدية أو حمضية، اعتمادًا على ظروف التفاعلات الكيميائية (فهي تظهر امفوتريتي). تتشكل هذه الأكاسيد (النحاس والفضة والذهب والحديد والروثينيوم والتنغستن والرذرفورديوم والتيتانيوم والإيتريوم وغيرها الكثير). تتفاعل الأكاسيد المذبذبة مع الأحماض القوية، ونتيجة للتفاعل الكيميائي تشكل أملاح هذه الأحماض.

أكاسيد حمضية
أو أنهيدريدات هي أكاسيد تظهر وتشكل أيضًا أحماضًا تحتوي على الأكسجين في التفاعلات الكيميائية. تتشكل الأنهيدريدات دائمًا من اللافلزات النموذجية، وكذلك من بعض العناصر الكيميائية الانتقالية.
تعتبر الأكاسيد وتصنيفها وخصائصها الكيميائية من المفاهيم المهمة. على سبيل المثال، الأكاسيد الحمضية لها خواص كيميائية مختلفة تمامًا عن الأكاسيد المذبذبة. على سبيل المثال، عندما يتفاعل أنهيدريد مع الماء، يتم تشكيل الحمض المقابل (الاستثناء هو SiO2 - تتفاعل الأنهيدريدات مع القلويات، ونتيجة لهذه التفاعلات يتم إطلاق الماء والصودا. عند التفاعل معها، يتم تشكيل الملح.

أكاسيد أساسية
الأكاسيد الأساسية (من كلمة "قاعدة") هي أكاسيد العناصر الكيميائية للمعادن ذات حالات الأكسدة +1 أو +2. وتشمل هذه المعادن القلوية والفلزات القلوية الأرضية، بالإضافة إلى العنصر الكيميائي المغنيسيوم. تختلف الأكاسيد الأساسية عن غيرها من حيث أنها قادرة على التفاعل مع الأحماض.
تتفاعل الأكاسيد الأساسية مع الأحماض، على عكس الأكاسيد الحمضية، وكذلك مع القلويات والماء والأكاسيد الأخرى. ونتيجة لهذه التفاعلات تتشكل الأملاح عادة.

خصائص الأكاسيد
إذا قمت بدراسة تفاعلات الأكاسيد المختلفة بعناية، فيمكنك استخلاص استنتاجات بشكل مستقل حول الخصائص الكيميائية التي تتمتع بها الأكاسيد. الخاصية الكيميائية المشتركة لجميع الأكاسيد هي عملية الأكسدة والاختزال.
ولكن مع ذلك، فإن جميع الأكاسيد تختلف عن بعضها البعض. تصنيف وخصائص الأكاسيد موضوعان مترابطان.
الأكاسيد غير الملحية وخصائصها الكيميائية
الأكاسيد غير الملحية هي مجموعة من الأكاسيد التي لا تظهر أي خصائص حمضية أو قاعدية أو مذبذبة. ونتيجة للتفاعلات الكيميائية مع الأكاسيد غير المكونة للملح، لا تتكون الأملاح. في السابق، لم يكن يطلق على هذه الأكاسيد اسم غير مكوّن للملح، بل كانت غير مبالية وغير مبالية، لكن هذه الأسماء لا تتوافق مع خصائص الأكاسيد غير المكوّنة للملح. وفقًا لخصائصها، فإن هذه الأكاسيد قادرة تمامًا على التفاعلات الكيميائية. ولكن هناك عدد قليل جدًا من الأكاسيد غير الملحية، فهي تتشكل من اللافلزات أحادية التكافؤ وثنائية التكافؤ.
من الأكاسيد غير المكونة للملح، يمكن الحصول على الأكاسيد المكونة للملح نتيجة للتفاعل الكيميائي.

التسميات
عادة ما تسمى جميع الأكاسيد تقريبًا بهذه الطريقة: كلمة "أكسيد" متبوعة باسم العنصر الكيميائي في الحالة المضافة. على سبيل المثال، Al2O3 هو أكسيد الألومنيوم. في اللغة الكيميائية، يُقرأ هذا الأكسيد على النحو التالي: الألومنيوم 2 o 3. بعض العناصر الكيميائية، مثل النحاس، يمكن أن يكون لها عدة درجات من الأكسدة؛ وبالتالي، ستكون الأكاسيد مختلفة أيضًا. ثم أكسيد CuO هو أكسيد النحاس (اثنان)، أي بدرجة أكسدة 2، وأكسيد Cu2O هو أكسيد النحاس (ثلاثة)، الذي درجة أكسدة 3.
ولكن هناك أسماء أخرى للأكاسيد، والتي تتميز بعدد ذرات الأكسجين الموجودة في المركب. أول أكسيدات أو أول أكسيدات هي تلك الأكاسيد التي تحتوي على ذرة أكسجين واحدة فقط. ثاني أكسيدات هي تلك الأكاسيد التي تحتوي على ذرتي أكسجين، والتي يشار إليها بالبادئة "دي". ثلاثيات الأكسيد هي تلك الأكاسيد التي تحتوي بالفعل على ثلاث ذرات أكسجين. لقد أصبحت أسماء مثل أول أكسيد وثاني أكسيد وثالث أكسيد قديمة بالفعل، ولكنها غالبًا ما توجد في الكتب المدرسية والكتب وغيرها من الوسائل المساعدة.
هناك أيضًا ما يسمى بأسماء تافهة للأكاسيد، أي تلك التي تطورت تاريخيًا. على سبيل المثال، ثاني أكسيد الكربون هو أكسيد أو أول أكسيد الكربون، ولكن حتى الكيميائيين يطلقون على هذه المادة في أغلب الأحيان اسم أول أكسيد الكربون.

إذن، الأكسيد هو مركب من الأكسجين مع عنصر كيميائي. العلم الرئيسي الذي يدرس تكوينها وتفاعلاتها هو الكيمياء. الأكاسيد وتصنيفها وخصائصها هي عدة مواضيع مهمة في علم الكيمياء، دون فهم أي منها لا يمكن فهم كل شيء آخر. الأكاسيد هي الغازات والمعادن والمساحيق. بعض الأكاسيد تستحق المعرفة بالتفصيل ليس فقط للعلماء، ولكن أيضًا للأشخاص العاديين، لأنها يمكن أن تشكل خطراً على الحياة على هذه الأرض. الأكاسيد موضوع مثير للاهتمام وسهل للغاية. مركبات الأكسيد شائعة جدًا في الحياة اليومية.