Shkëputje e plotë. Teoria e disociimit elektrik. Shkalla e disociimit elektrolitik
Të gjitha substancat, sipas aftësisë së tyre për të përcjellë rrymë elektrike në tretësirë ose në gjendje të shkrirë, mund të ndahen në dy grupe: elektrolite dhe jo-elektrolite.
Elektrolitet quhen substancat, tretësirat ose shkrirjet e të cilave përcjellin një rrymë elektrike. Elektrolitet përfshijnë acide, baza dhe kripëra.
Jo elektrolite quhen substanca, tretësirat ose shkrirjet e të cilave nuk përçojnë rrymë elektrike. Për shembull, shumë substanca organike.
Aftësia e elektroliteve (përçuesve të llojit të dytë) për të kryer rrymë elektrike është thelbësisht e ndryshme nga përçueshmëria elektrike e metaleve (përçuesit e llojit të parë): përçueshmëria elektrike e metaleve është për shkak të lëvizjes së elektroneve dhe përçueshmërisë elektrike të elektrolitet shoqërohen me lëvizjen e joneve.
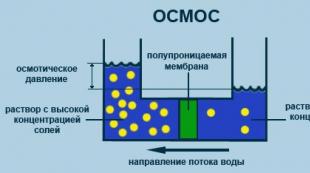
U zbulua se në tretësirat e acideve, bazave dhe kripërave, vlerat e gjetura eksperimentalisht të p, tcryst., Tboil., Posm janë më të larta se ato të llogaritura teorikisht për të njëjtën zgjidhje për sa i përket përqendrimit të saj molar në i nje here ( i- koeficienti izotonik). Për më tepër, numri i grimcave në tretësirën NaCl u rrit pothuajse 2 herë, dhe në tretësirën CaCl2 - 3 herë.
Për të shpjeguar veçoritë e sjelljes së elektroliteve, shkencëtari suedez S. Arrhenius në 1887 propozoi një teori të quajtur teoria e disociimit elektrolitik... Thelbi i teorisë është si më poshtë:
- 1. Kur treten në ujë, elektrolitet dekompozohen (shpërndahen) në grimca të ngarkuara (jone) - katione të ngarkuara pozitivisht (Na +, K +, Ca2 +, H +) dhe anione të ngarkuara negativisht (Cl-, SO42-, CO32-, OH -). Vetitë e joneve janë krejtësisht të ndryshme nga ato të atomeve që i kanë formuar ato. Zbërthimi i një lënde neutrale në jone si rezultat i ndërveprimit kimik me një tretës quhet shpërbërja elektrolitike.
- 2. Nën veprimin e një rryme elektrike, jonet fitojnë një lëvizje të drejtuar: kationet lëvizin në një elektrodë të ngarkuar negativisht (katodë), anionet - në një elektrodë të ngarkuar pozitivisht (anodë).
- 3. Shkëputja është një proces i kthyeshëm dhe ekuilibër. Kjo do të thotë se paralelisht me zbërthimin e molekulave në jone (shpërbërja), po zhvillohet procesi i bashkimit të joneve në molekula (shoqërimi): CA K + + A-.
- 4. Në tretësirë, jonet janë në gjendje të hidratuar.
Për një vlerësim sasior të disociimit elektrolitik, përdoret koncepti shkalla e disociimit elektrolitik() është raporti i numrit të molekulave të zbërthyera në jone me numrin total të molekulave të tretura. Përcaktohet shkalla e disociimit në mënyrë empirike dhe shprehet në thyesa ose përqindje. Shkalla e disociimit elektrolitik varet nga natyra e tretësit dhe substancës së tretur, temperatura dhe përqendrimi i tretësirës:
- 1. Sa më polar të jetë tretësi, aq më e lartë është shkalla e shpërbërjes së elektrolitit në të.
- 2. Substancat me lidhje polare jonike dhe kovalente i nënshtrohen shpërbërjes.
- 3. Rritja e temperaturës, rrit shpërbërjen e elektroliteve të dobëta.
- 4. Me uljen e përqendrimit të elektrolitit (me hollim) rritet shkalla e disociimit.
Në varësi të madhësisë së shkallës së disociimit, elektrolitet (në një përqendrim të zgjidhjeve të tyre prej 0,1 M) ndahen në mënyrë konvencionale në:
Sipas llojit të joneve të formuara gjatë shpërbërjes, të gjithë elektrolitet mund të ndahen në acide, baza dhe kripëra.
Acidi- elektrolitet që disociohen me formimin e vetëm kationeve H + dhe një mbetje acidi (Cl- - klorur, NO3- - nitrat, SO42- - sulfat, bikarbonat HCO3, karbonat CO32). Për shembull: НСl Н ++ Сl-, H2SO4 2Н ++ SO42-.
Prania në tretësira acide e një joni hidrogjeni, më saktë, një joni H3O + i hidratuar, përcakton vetitë e përgjithshme të acideve (shija e thartë, efekti në tregues, ndërveprimi me alkalet, ndërveprimi me metalet me çlirimin e hidrogjenit, etj.).
Në acidet polibazike, shpërbërja ndodh hap pas hapi, dhe çdo hap karakterizohet nga madhësia e vet e shkallës së disociimit. Pra, acidi fosforik shpërndahet në tre hapa:
|
Faza I |
H3РO4 Н + + H2RO4- |
|
|
Faza II |
H2РO4- Н + + HРО42- |
|
|
Faza III |
HPO42- H + + PO43- |
Dhe 3<2<1, т.е. распад электролита на ионы протекает, в основном, по первой ступени и в растворе ортофосфорной кислоты будут находиться преимущественно ионы Н+ и H2РO4-. Причины этого в том, что ионы водорода значительно сильнее притягиваются к трехзарядному иону РO43- и двухзарядному иону HРO42-, чем к однозарядному H2РO4-. Кроме того, на 2-ой и 3-ей ступенях имеет место смещение равновесия в сторону исходной формы по принципу Ле-Шателье за счет накапливающихся ионов водорода.
themelet- elektrolitet që shpërbëhen për të formuar vetëm jone hidroksid (OH-) si anione. Pas heqjes së OH- mbeten kationet: Na +, Ca2 +, NH4 +. Për shembull: NaOH Na + + OH-, Ca (OH) 2 Ca2 + + 2 OH-.
Vetitë e përgjithshme të bazave (sapunësia në prekje, veprimi në tregues, ndërveprimi me acidet etj.) përcaktohen nga prania e grupit OH- hidrokso në tretësirat bazë.
Për bazat me shumë acide, disociimi hap pas hapi është karakteristik:
|
Faza I |
Ва (ОН) 2 Ва (ОН) + + ОН- |
|
Faza II |
Ba (OH) + Ba2 + + OH- |
Shpërbërja e hidroksideve amfoterike zhvillohet si bazë ashtu edhe si acid. Pra, shpërbërja e hidroksidit të zinkut mund të vazhdojë në drejtimet e mëposhtme (në këtë rast, ekuilibri ndryshon në varësi të mediumit sipas parimit Le Chatelier):
Kripë- këto janë elektrolite që shpërndahen në katione metalike (ose grupe që e zëvendësojnë atë) dhe anione të mbetjes së acidit.
Kripërat mesatare shpërndahen plotësisht: CuSO4 Cu2 + + SO42-. Ndryshe nga kripërat mesatare, kripërat acidike dhe bazike ndahen në hapa:
|
Faza I |
NaHCO3 Na + + HCO3- |
Сu (ОН) Cl Сu (ОН) + + Cl- |
|
Faza II |
НСО3- Н + + СО32- |
Cu (OH) + Cu2 + + OH-, |
për më tepër, shkalla e shpërbërjes së kripërave në fazën e dytë është shumë e vogël.
Reaksionet e shkëmbimit në tretësirat e elektroliteve janë reaksione ndërmjet joneve. Një kusht i domosdoshëm për rrjedhën e reaksioneve të shkëmbimit në tretësirat e elektrolitit është formimi i përbërjeve ose komponimeve të dobëta të shkëputura që çlirohen nga tretësira në formën e një precipitati ose gazi.
Gjatë shkrimit të ekuacioneve të reaksioneve në formë jonike-molekulare, komponimet me dissociim të dobët, të gaztë dhe pak të tretshëm shkruhen në formë molekulat, dhe elektrolite të forta të tretshme - në formë jonet. Kur shkruani ekuacione jonike, sigurohuni që të ndiqni tabelën e tretshmërisë së acideve, bazave dhe kripërave në ujë (Shtojca A).
Le të shqyrtojmë metodën e shkrimit të ekuacioneve jonike duke përdorur shembuj.
Shembulli 1. Shkruani ekuacionin e reaksionit në formë jonike-molekulare:
ВаСl2 + K2SО4 = ВаSО4 + 2KСl
Zgjidhja: Kripërat janë elektrolite të forta dhe pothuajse plotësisht shpërndahen në jone. Meqenëse BaSO4 është një përbërës praktikisht i patretshëm (shih tabelën në shtojcën A), pjesa më e madhe e sulfatit të bariumit do të jetë në një formë të pandarë, prandaj këtë substancë do ta shkruajmë në formën e molekulave, dhe pjesën tjetër të kripërave, të cilat janë të tretshme. , në formën e joneve:
Ba2 + + 2Сl- + 2K + + SO42- = BaSО4 + 2K + + 2Сl-
Siç shihet nga ekuacioni i plotë jonik-molekular i marrë, jonet K + dhe Сl- nuk ndërveprojnë, prandaj, duke i përjashtuar ato, marrim një ekuacion të shkurtër jonik-molekular:
Ba2 + + SO42- = BaSO4,
Shigjeta tregon se substanca që rezulton është precipituar.
Çdo reaksion që ndodh në tretësirat midis elektroliteve mund të përfaqësohet me ekuacione jonike. Për më tepër, thelbi i çdo reaksioni kimik pasqyrohet pikërisht nga një ekuacion i shkurtër jonik-molekular. Bazuar në ekuacionin jon-molekular, mund të shkruani lehtësisht atë molekular.
Shembulli 2. Përputhni ekuacionin molekular me ekuacionin molekular jonik të mëposhtëm: 2H + + S2- = H2S.
Zgjidhja: Jonet e hidrogjenit formohen nga shpërbërja e çdo acidi të fortë, siç është HCl. Tek jonet e hidrogjenit në ekuacionin e shkurtër jonik, duhen shtuar dy jone klori. Kationet (për shembull, 2K +) duhet t'u shtohen joneve sulfide, duke formuar një elektrolit të tretshëm dhe të mirë-ndarë. Pastaj të njëjtat jone duhet të shkruhen në anën e djathtë. Atëherë ekuacionet e plota jonike-molekulare dhe molekulare do të kenë formën:
- 2Н + + 2Сl- + 2K + + S2- = Н2S + 2K + + 2Сl-
- 2 НСl + K2S = Н2S + 2 KСl-
Temat e kodifikuesit USE:Disociimi elektrolitik i elektroliteve në tretësirat e injektimit. Elektrolite të forta dhe të dobëta.
– këto janë substanca, tretësira dhe shkrirje të të cilave përcjellin një rrymë elektrike.
Rryma elektrike është lëvizja e urdhëruar e grimcave të ngarkuara nën ndikimin e një fushe elektrike. Kështu, ka grimca të ngarkuara në solucione ose elektrolite të shkrirë. Në tretësirat e elektrolitit, si rregull, përçueshmëria elektrike është për shkak të pranisë së joneve.
Jona Janë grimca të ngarkuara (atome ose grupe atomesh). Ndani jonet e ngarkuar pozitivisht ( kationet) dhe jonet e ngarkuar negativisht ( anionet).
Shpërbërja elektrolitike - Ky është procesi i dekompozimit të elektrolitit në jone gjatë shpërbërjes ose shkrirjes së tij.
Substanca të veçanta - elektroliteve dhe jo elektrolite... TE jo elektrolite përfshijnë substanca me një lidhje të fortë kovalente jopolare (substanca të thjeshta), të gjitha oksidet (që janë kimikisht jo ndërveprojnë me ujin), shumica e substancave organike (përveç komponimeve polare - acidet karboksilike, kripërat e tyre, fenolet) - aldehidet, ketonet, hidrokarburet, karbohidratet.
TE elektroliteve përfshijnë disa substanca me një lidhje polare kovalente dhe substanca me një rrjetë kristalore jonike.
Cili është thelbi i procesit të disociimit elektrolitik?
Vendosni disa kristale klorur natriumi në një provëz dhe shtoni ujë. Pas një kohe, kristalet do të treten. Cfare ndodhi?
Kloruri i natriumit është një substancë me një rrjetë kristalore jonike. Kristali NaCl përbëhet nga jone Na + dhe Cl - ... Në ujë, ky kristal ndahet në njësi strukturore, jone. Në këtë rast, lidhjet kimike jonike dhe disa lidhje hidrogjenore midis molekulave të ujit shpërbëhen. Jonet Na + dhe Cl - të bllokuara në ujë ndërveprojnë me molekulat e ujit. Në rastin e joneve të klorurit, mund të flasim për tërheqjen elektrostatike të molekulave dipole (polare) të ujit ndaj anionit të klorit, dhe në rastin e kationeve të natriumit, ai i afrohet natyrës dhurues-pranues (kur çifti elektronik i atomit të oksigjenit vendoset në orbitalet vakante të jonit të natriumit). Jonet e rrethuara nga molekula uji janë të mbuluaraguaskë hidratimi.
Shpërndarja e klorurit të natriumit përshkruhet nga ekuacioni:
NaCl = Na + + Cl -
Kur përbërjet me një lidhje polare kovalente treten në ujë, molekulat e ujit, që rrethojnë një molekulë polare, së pari e zgjasin lidhjen në të, duke rritur polaritetin e saj, më pas e thyejnë atë në jone, të cilët hidratohen dhe shpërndahen në mënyrë të barabartë në tretësirë. Për shembull, ksiloti klorhidrik shpërndahet në jone si më poshtë: HCl = H + + Cl -.

Gjatë shkrirjes, kur kristali nxehet, jonet fillojnë të kryejnë dridhje të forta në nyjet e rrjetës kristalore, si rezultat i së cilës shkatërrohet, formohet një shkrirje, e cila përbëhet nga jone.
Procesi i disociimit elektrolitik karakterizohet nga madhësia e shkallës së shpërbërjes së molekulave të një substance:
Shkalla e disociimit Është raporti i numrit të molekulave të shpërbëra (të shpërbëra) me numrin total të molekulave të elektrolitit. Kjo do të thotë, cila pjesë e molekulave të substancës fillestare zbërthehet në jone në tretësirë ose shkrihet.
α = N prodiss / N ref, ku:
N prodiss është numri i molekulave të disociuara,
N ref është numri fillestar i molekulave.
Sipas shkallës së disociimit, elektrolitet ndahen me pjesëtohen me të fortë dhe i dobët.
Elektrolite të forta (α≈1):
1. Të gjitha kripërat e tretshme (përfshirë kripërat e acideve organike - acetat kaliumi CH 3 COOK, formatat natriumi HCOONa, etj.)
2. Acidet e forta: HCl, HI, HBr, HNO 3, H 2 SO 4 (në fazën e parë), HClO 4, etj.;
3. Alkalet: NaOH, KOH, LiOH, RbOH, CsOH; Ca (OH) 2, Sr (OH) 2, Ba (OH) 2.
Elektrolite të forta dekompozohen në jone pothuajse plotësisht në tretësirat ujore, por vetëm në. Në tretësirat, edhe elektrolitet e forta mund të dekompozohen vetëm pjesërisht. ato. shkalla e shpërbërjes së elektroliteve të fortë α është afërsisht e barabartë me 1 vetëm për tretësirat e pangopura të substancave. Në tretësirat e ngopura ose të koncentruara, shkalla e shpërbërjes së elektroliteve të forta mund të jetë më e vogël ose e barabartë me 1: α≤1.
Elektrolite të dobëta (α<1):
1. Acidet e dobëta, përfshirë. organike;
2. Bazat e patretshme dhe hidroksidi i amonit NH 4 OH;
3. kripëra të patretshme dhe disa kripëra pak të tretshme (në varësi të tretshmërisë).
Jo elektrolite:
1. Oksidet që nuk ndërveprojnë me ujin (oksidet që ndërveprojnë me ujin, kur treten në ujë, hyjnë në një reaksion kimik me formimin e hidroksideve);
2. Substanca të thjeshta;
3. Shumica e substancave organike me lidhje të dobëta polare ose jopolare (aldehidet, ketonet, hidrokarburet, etj.).

Si shpërndahen substancat? Dallohet shkalla e disociimit të fortë dhe i dobët elektroliteve.
Elektrolite të forta shpërbëhen plotësisht (në tretësirat e ngopura), në një hap, të gjitha molekulat shpërbëhen në jone, pothuajse në mënyrë të pakthyeshme. Ju lutemi vini re se vetëm jonet e qëndrueshme formohen në tretësirë gjatë shpërbërjes. Jonet më të zakonshme mund të gjenden në tabelën e tretshmërisë - kjo është fleta juaj zyrtare e mashtrimit për çdo provim. Shkalla e shpërbërjes së elektroliteve të forta është afërsisht e barabartë me 1. Për shembull, gjatë shpërbërjes së fosfatit të natriumit formohen jonet Na + dhe PO 4 3–:
Na 3 PO 4 → 3Na + + PO 4 3-
NH 4 Cr (SO 4) 2 → NH 4 + + Cr 3+ + 2SO 4 2-
Shkëputja elektrolite të dobëta : acidet polibazike dhe bazat poliacide ndodh hap pas hapi dhe në mënyrë të kthyeshme... ato. gjatë shpërbërjes së elektroliteve të dobëta, vetëm një pjesë shumë e vogël e grimcave fillestare zbërthehet në jone. Për shembull, acidi karbonik:
H 2 CO 3 ↔ H + + HCO 3 -
HCO 3 - ↔ H + + CO 3 2-
Hidroksidi i magnezit gjithashtu shpërndahet në 2 faza:
Mg (OH) 2 ⇄ Mg (OH) + OH -
Mg (OH) + ⇄ Mg 2+ + OH -
Kripërat acide gjithashtu shpërndahen hap pas hapi, fillimisht prishen lidhjet jonike, pastaj ato polare kovalente. Për shembull, hidrogjen karbonati i kaliumit dhe hidroksikloridi i magnezit:
KHCO 3 ⇄ K + + HCO 3 - (α = 1)
HCO 3 - ⇄ H + + CO 3 2– (α< 1)
Mg (OH) Cl ⇄ MgOH + + Cl - (α = 1)
MgOH + ⇄ Mg 2+ + OH - (α<< 1)
Shkalla e shpërbërjes së elektroliteve të dobëta është shumë më e vogël se 1: α<<1.
Dispozitat kryesore të teorisë së disociimit elektrolitik, pra:
1. Kur treten në ujë, elektrolitet shpërbëhen (dekompozohen) në jone.
2. Arsyeja e shpërbërjes së elektroliteve në ujë është hidratimi i tij, d.m.th. ndërveprimi me molekulat e ujit dhe prishja e lidhjes kimike në të.
3. Nën ndikimin e një fushe elektrike të jashtme, jonet e ngarkuar pozitivisht lëvizin në një elektrodë të ngarkuar pozitivisht - katodë, ato quhen katione. Elektronet e ngarkuara negativisht lëvizin drejt elektrodës negative - anodës. Ato quhen anione.
4. Disociimi elektrolitik ndodh në mënyrë të kthyeshme për elektrolitët e dobët dhe pothuajse i pakthyeshëm për elektrolitet e fortë.
5. Elektrolitet mund të shpërbëhen në jone në shkallë të ndryshme, në varësi të kushteve të jashtme, përqendrimit dhe natyrës së elektrolitit.
6. Vetitë kimike të joneve ndryshojnë nga ato të substancave të thjeshta. Vetitë kimike të tretësirave të elektrolitit përcaktohen nga vetitë e atyre joneve që formohen prej tij gjatë shpërbërjes.
Shembuj.
1. Me ndarje jo të plotë të 1 mol kripë, sasia totale e joneve pozitive dhe negative në tretësirë ishte 3.4 mol. Formula e kripës - a) K 2 S b) Ba (ClO 3) 2 c) NH 4 NO 3 d) Fe (NO 3) 3
Zgjidhje: Së pari, le të përcaktojmë forcën e elektroliteve. Kjo mund të bëhet lehtësisht duke përdorur tabelën e tretshmërisë. Të gjitha kripërat e dhëna në përgjigjet janë të tretshme, d.m.th. elektrolite të forta. Më pas, shkruajmë ekuacionet e disociimit elektrolitik dhe përdorim ekuacionin për të përcaktuar numrin maksimal të joneve në secilën zgjidhje:
a) K 2 S ⇄ 2K + + S 2–, me shpërbërjen e plotë të 1 mol kripë, formohen 3 mol jone, më shumë se 3 mol jone nuk do të funksionojnë në asnjë mënyrë;
b) Ba (ClO 3) 2 ⇄ Ba 2+ + 2ClO 3 -, përsëri, kur 1 mol kripë prishet, formohen 3 mol jone, më shumë se 3 mol jone nuk formohen në asnjë mënyrë;
v) NH 4 NO 3 ⇄ NH 4 + + NO 3 -, gjatë zbërthimit të 1 mol nitrat amonit formohen maksimumi 2 mol jone, më shumë se 2 mol jone nuk formohen në asnjë mënyrë;
G) Fe (NO 3) 3 ⇄ Fe 3+ + 3NO 3 -, me zbërthimin e plotë të 1 mol nitrat hekuri (III) formohen 4 mol jone. Prandaj, me dekompozim jo të plotë të 1 mol nitrat hekuri, formimi i një numri më të vogël jonesh është i mundur (zbërthimi jo i plotë është i mundur në një zgjidhje të ngopur të kripës). Prandaj, opsioni 4 na përshtatet.
Tretësirat ujore të disa substancave janë përcjellës të rrymës elektrike. Këto substanca klasifikohen si elektrolite. Elektrolitet janë acide, baza dhe kripëra, shkrirje të substancave të caktuara.
PËRKUFIZIM
Procesi i zbërthimit të elektroliteve në jone në tretësirat ujore dhe i shkrirjes nën veprimin e një rryme elektrike quhet shpërbërja elektrolitike.
Tretësirat e disa substancave në ujë nuk përçojnë elektricitetin. Substancat e tilla quhen jo-elektrolite. Këto përfshijnë shumë komponime organike si sheqernat dhe alkoolet.
Teoria e disociimit elektrolitik
Teoria e disociimit elektrolitik u formulua nga shkencëtari suedez S. Arrhenius (1887). Dispozitat kryesore të teorisë së S. Arrhenius:
- elektrolitet, kur treten në ujë, shpërbëhen (shpërndahen) në jone të ngarkuar pozitivisht dhe negativisht;
- nën veprimin e një rryme elektrike, jonet e ngarkuar pozitivisht lëvizin në katodë (kationet), dhe ato të ngarkuara negativisht lëvizin në anodë (anionet);
- disociimi është një proces i kthyeshëm
KA ↔ K + + A -
Mekanizmi i disociimit elektrolitik është ndërveprimi jon-dipol ndërmjet joneve dhe dipoleve të ujit (Fig. 1).
Oriz. 1. Shpërbërja elektrolitike e tretësirës së klorurit të natriumit
Substancat me lidhje jonike shpërndahen më lehtë. Në mënyrë të ngjashme, disociimi ndodh në molekulat e formuara nga lloji i lidhjes kovalente polare (natyra e ndërveprimit është dipol-dipol).
Shpërbërja e acideve, bazave, kripërave
Gjatë shpërbërjes së acideve formohen gjithmonë jonet e hidrogjenit (H +), ose më saktë, hidronium (H 3 O +), të cilët janë përgjegjës për vetitë e acideve (shija e thartë, veprimi i treguesve, ndërveprimi me bazat, etj. ).
HNO 3 ↔ H + + NO 3 -
Gjatë shpërbërjes së bazave formohen gjithmonë jone hidroksid hidrogjeni (OH -), të cilët janë përgjegjës për vetitë e bazave (ndryshimi i ngjyrës së treguesve, ndërveprimi me acidet, etj.).
NaOH ↔ Na + + OH -
Kripërat janë elektrolite, nga shpërbërja e të cilave prodhohen katione metalike (ose kation të amonit NH 4 +) dhe anione të mbetjeve acide.
CaCl 2 ↔ Ca 2+ + 2Cl -
Acidet dhe bazat polibazike shpërndahen në shkallë.
H 2 SO 4 ↔ H + + HSO 4 - (faza I)
HSO 4 - ↔ H + + SO 4 2- (faza II)
Ca (OH) 2 ↔ + + OH - (faza I)
+ ↔ Ca 2+ + OH -
Shkalla e disociimit
Midis elektroliteve, bëhet një dallim midis zgjidhjeve të dobëta dhe të forta. Për të karakterizuar këtë masë, ekziston koncepti dhe vlera e shkallës së disociimit (). Shkalla e disociimit është raporti i numrit të molekulave të shpërbëra në jone me numrin e përgjithshëm të molekulave. shpesh shprehet në%.
Elektrolitët e dobët përfshijnë substanca në të cilat në një tretësirë decimolar (0,1 mol / l) shkalla e disociimit është më pak se 3%. Elektrolitët e fortë përfshijnë substanca në të cilat shkalla e disociimit është më e madhe se 3% në një tretësirë decimolar (0,1 mol / l). Tretësirat e elektroliteve të forta nuk përmbajnë molekula të padisociuara dhe procesi i bashkimit (unifikimit) çon në formimin e joneve të hidratuar dhe çifteve jonike.
Shkalla e shpërbërjes ndikohet veçanërisht nga natyra e tretësit, natyra e substancës së tretur, temperatura (në elektrolitet e forta, shkalla e shpërbërjes zvogëlohet me rritjen e temperaturës, dhe në elektrolitet e dobëta kalon në një maksimum në intervalin e temperaturës prej 60 o C), përqendrimi i tretësirave, futja e joneve me të njëjtin emër në tretësirë.
Elektrolitet amfoterike
Ka elektrolite që, kur shpërndahen, formojnë jone H + dhe OH -. Elektrolite të tilla quhen amfoterike, p.sh.: Be (OH) 2, Zn (OH) 2, Sn (OH) 2, Al (OH) 3, Cr (OH) 3, etj.
H + + RO - ↔ ROH ↔ R + + OH -
Ekuacionet e reaksionit jonik
Reaksionet në tretësirat ujore të elektroliteve janë reaksione ndërmjet joneve - reaksione jonike që shkruhen duke përdorur ekuacione jonike në forma molekulare, jonike të plota dhe jonike të reduktuara. Për shembull:
BaCl 2 + Na 2 SO 4 = BaSO 4 ↓ + 2NaCl (formë molekulare)
Ba 2+ + 2 Cl − + 2 Na+ + SO 4 2- = BaSO 4 ↓ + 2 Na + + 2 Cl- (formë e plotë jonike)
Ba 2+ + SO 4 2- = BaSO 4 ↓ (formë e shkurtuar jonike)
vlera e PH
Uji është një elektrolit i dobët, kështu që procesi i disociimit është i parëndësishëm.
H 2 O ↔ H + + OH -
Ligji i veprimit të masës mund të zbatohet për çdo ekuilibër dhe shprehja për konstantën e ekuilibrit mund të shkruhet:
K = /
Përqendrimi ekuilibër i ujit është një vlerë konstante, rrjedhimisht.
K = = K W
Është i përshtatshëm për të shprehur aciditetin (bazicitetin) e një tretësire ujore në terma të logaritmit dhjetor të përqendrimit molar të joneve të hidrogjenit, të marra me shenjën e kundërt. Kjo vlerë quhet vlera e pH.
Të gjitha substancat ndahen në 2 grupe të mëdha: elektroliteve dhe jo elektrolite.
Elektrolitet Quhen substanca (me përjashtim të metaleve), tretësirat ose shkrirjet e të cilave përçojnë rrymë elektrike. Elektrolitet përfshijnë komponime të formuara nga lidhje polare jonike ose kovalente. Këto janë substanca komplekse: kripërat, bazat, acidet, oksidet e metaleve (përcjellin rrymën elektrike vetëm në shkrirje).
Jo elektrolite quhen substanca, tretësirat ose shkrirjet e të cilave nuk përçojnë rrymë elektrike. Këto përfshijnë substanca të thjeshta dhe komplekse të formuara nga lidhje kovalente me polaritet të ulët ose jopolare.
Vetitë e tretësirave dhe elektroliteve të shkrirë u shpjeguan për herë të parë në fund të shekullit të 19-të nga shkencëtari suedez Svante Arrhenius. Ai krijoi një të veçantë teoria e disociimit elektrolitik , dispozitat kryesore të të cilave, të rishikuara dhe të zhvilluara nga shkencëtarë të tjerë, aktualisht janë formuluar si më poshtë.
1. Molekulat (ose njësitë e formulës) të elektroliteve në tretësirat ose shkrirjet zbërthehen në jone të ngarkuar pozitivisht dhe negativisht. Ky proces quhet disociim elektrolitik. Shuma totale e ngarkesave të joneve pozitive është e barabartë me shumën e ngarkesave të joneve negative; prandaj, tretësirat ose shkrirjet e elektroliteve në tërësi mbeten elektrikisht neutrale. Jonet mund të jenë si thjeshtë i përbërë nga vetëm një atom (Na +, Cu 2+, Cl -, S 2-), dhe komplekse i përbërë nga atome të disa elementeve (SO 4 2–, PO 4 3–, NH 4 +, -).
Jonet e thjeshta në vetitë e tyre fizike, kimike dhe fiziologjike ndryshojnë ndjeshëm nga atomet neutrale nga të cilat janë formuar. Para së gjithash, jonet janë grimca shumë më të qëndrueshme se atomet neutrale dhe mund të ekzistojnë në tretësirë ose shkrirje për një kohë të pakufizuar pa hyrë në ndërveprim të pakthyeshëm me mjedisin.
Ky ndryshim në vetitë e atomeve dhe joneve të të njëjtit element shpjegohet nga struktura e ndryshme elektronike e këtyre grimcave.
Pra, jonet e thjeshta të elementeve s dhe p janë në një gjendje më të qëndrueshme se atomet neutrale, sepse ato kanë një konfigurim të plotë elektronik të shtresës së jashtme, për shembull:
Zbërthimi i elektroliteve në jone në shkrirje kryhet për shkak të veprimit të temperaturave të larta, dhe në tretësirë për shkak të veprimit të molekulave të tretësit.
Një tipar i përbërjeve jonike është se ka jone të gatshme në nyjet e rrjetës së tyre kristalore dhe në procesin e tretjes së substancave të tilla, dipolet e tretësit (ujit) mund të shkatërrojnë vetëm këtë rrjetë jonike (Fig. 18). .
Substancat e formuara nga lidhjet kovalente polare kalojnë në tretësirë në formën e molekulave individuale, të cilat, si molekulat Н 2 О, janë dipole, për shembull:
 + –
+ –
Në këtë rast, dipolet Н 2 О, duke u orientuar në mënyrë të përshtatshme rreth molekulës së elektrolitit të tretur, shkaktojnë polarizimin e mëtejshëm të lidhjes kovalente në të, dhe më pas këputjen e saj heterolitike përfundimtare (Fig. 29).

H – ClH + + Cl
Oriz. 29. Skema e disociimit elektrolitik në një tretësirë të një molekule polare të HCl
Procesi i shpërbërjes elektrolitike vazhdon njëkohësisht me procesin e tretjes së substancave, dhe për këtë arsye në tretësirë të gjithë jonet janë në gjendje të hidratuar (të rrethuar nga predha molekulash H2O).
Sidoqoftë, për thjeshtësi, në ekuacionet e reaksioneve kimike, jonet përshkruhen pa predha hidratimi përreth: H +, NO 3 -, K +, etj.
2. Jonet e elektrolitit në tretësirë ose të shkrirë për shkak të lëvizjes termike lëvizin rastësisht në të gjitha drejtimet. Por nëse elektrodat ulen në një tretësirë ose shkrihen dhe kalohet një rrymë elektrike, atëherë jonet e ngarkuar pozitivisht të elektrolitit fillojnë të lëvizin drejt elektrodës së ngarkuar negativisht - katodës (prandaj ato quhen ndryshekationet), dhe jonet e ngarkuar negativisht - në një elektrodë të ngarkuar pozitivisht - anodë (prandaj ato quhen ndrysheanionet).
Kështu, elektrolitet janë përcjellës të klasit të dytë. Ata mbajnë një ngarkesë elektrike për shkak të lëvizjes së drejtuar të joneve. Metalet, nga ana tjetër, janë përcjellës të llojit të parë, sepse përçojnë një rrymë elektrike për shkak të lëvizjes së drejtuar të elektroneve.
3. Procesi i shpërbërjes elektrolitike është i kthyeshëm. Së bashku me zbërthimin e molekulave në jone, gjithmonë ndodh procesi i kundërt - kombinimi i joneve në molekula ose shoqërimi. Prandaj, në ekuacionet e reaksioneve të shpërbërjes elektrolitike të substancave, në vend të shenjës së barabartë "=", ata vendosin shenjën e kthyeshmërisë "", për shembull:
Substancat-elektrolitet, kur treten në ujë, zbërthehen në grimca të ngarkuara - jone. E kundërta është molarizimi, ose shoqërimi. Formimi i joneve shpjegohet me teorinë e disociimit elektrolitik (Arrhenius, 1887). Mekanizmi i dekompozimit të përbërjeve kimike gjatë shkrirjes dhe tretjes ndikohet nga karakteristikat e llojeve të lidhjeve kimike, struktura dhe natyra e tretësit.
Elektrolitet dhe jopërçues
Në tretësirat dhe shkrirjet, ndodh shkatërrimi i grilave dhe molekulave kristalore - disociimi elektrolitik (ED). Shpërbërja e substancave shoqërohet me formimin e joneve, shfaqjen e një vetie të tillë si përçueshmëria elektrike. Jo çdo përbërës është i aftë të shpërndahet, por vetëm substancat që fillimisht përbëhen nga jone ose grimca fort polare. Prania e joneve të lira shpjegon aftësinë e elektroliteve për të përcjellë rrymën. Bazat, kripërat, shumë acide inorganike dhe disa organike e kanë këtë aftësi. Jopërçuesit përbëhen nga molekula me polaritet të ulët ose jo të polarizuar. Ata nuk dekompozohen në jone, duke qenë jo-elektrolite (shumë komponime organike). Bartësit e ngarkesës janë jonet pozitive dhe negative (kationet dhe anionet).
Roli i S. Arrhenius dhe kimistëve të tjerë në studimin e disociimit
Teoria e disociimit elektrolitik u vërtetua në 1887 nga një shkencëtar nga Suedia S. Arrhenius. Por studimet e para të gjera të vetive të solucioneve u kryen nga shkencëtari rus M. Lomonosov. Kontribuar në studimin e grimcave të ngarkuara që dalin nga shpërbërja e substancave, T. Grothus dhe M. Faraday, R. Lenz. Arrhenius vërtetoi se shumë komponime inorganike dhe disa organike janë elektrolite. Shkencëtari suedez shpjegoi përçueshmërinë elektrike të tretësirave me zbërthimin e materies në jone. Teoria e Arrhenius-it për disociimin elektrolitik nuk i kushtoi rëndësi pjesëmarrjes së drejtpërdrejtë të molekulave të ujit në këtë proces. Shkencëtarët rusë Mendeleev, Kablukov, Konovalov dhe të tjerë besonin se zgjidhja ndodh - ndërveprimi i një tretësi dhe një tretësie. Kur bëhet fjalë për sistemet e ujit, përdoret emri "hidratim". Ky është një proces fiziko-kimik kompleks, siç dëshmohet nga formimi i hidrateve, fenomenet termike, ndryshimi i ngjyrës së substancës dhe shfaqja e sedimentit.

Dispozitat kryesore të teorisë së disociimit elektrolitik (TED)
Shumë shkencëtarë kanë punuar për të përmirësuar teorinë e S. Arrhenius. Kërkonte përmirësimin e tij, duke marrë parasysh të dhënat moderne për strukturën e atomit, lidhjet kimike. Dispozitat kryesore të TED, të cilat ndryshojnë nga tezat klasike të fundit të shekullit të 19-të, janë formuluar:

Dukuritë që ndodhin duhet të merren parasysh gjatë hartimit të ekuacioneve: aplikoni një shenjë të veçantë të një procesi të kthyeshëm, llogaritni ngarkesat negative dhe pozitive: ato duhet të përkojnë në total.
Mekanizmi i ED të substancave jonike
Teoria moderne e disociimit elektrolitik merr parasysh strukturën e elektrolitit dhe substancave tretëse. Kur shpërndahen, lidhjet midis grimcave të ngarkuara në mënyrë të kundërt në kristalet jonike shkatërrohen nën ndikimin e molekulave polare të ujit. Ata fjalë për fjalë "tërheqin" jonet nga pjesa më e madhe në tretësirë. Zbërthimi shoqërohet me formimin e një guaskë solvati (në ujë - hidratim) rreth joneve. Përveç ujit, ketonet dhe alkoolet e ulëta kanë një konstante dielektrike të rritur. Gjatë shpërbërjes së klorurit të natriumit në jonet Na + dhe Cl-, regjistrohet një fazë fillestare, e cila shoqërohet me orientimin e dipoleve të ujit në raport me jonet sipërfaqësore në kristal. Në fazën përfundimtare, jonet e hidratuar çlirohen dhe shpërndahen në lëng.

Mekanizmi i ED i komponimeve me një lidhje kovalente fort polare
Molekulat e tretësit ndikojnë në elementet e strukturës kristalore të substancave jojonike. Për shembull, efekti i dipoleve të ujit në acidin klorhidrik çon në një ndryshim në llojin e lidhjes në molekulë nga polare kovalente në jonike. Substanca shpërndahet, jonet e hidratuar të hidrogjenit dhe klorit hyjnë në tretësirë. Ky shembull dëshmon rëndësinë e atyre proceseve që ndodhin midis grimcave të tretësit dhe përbërjes së tretur. Është ky ndërveprim që çon në formimin e joneve të elektrolitit.

Teoria e disociimit elektrolitik dhe klasat kryesore të përbërjeve inorganike
Në dritën e dispozitave kryesore të TED, një acid mund të quhet elektrolit, gjatë dekompozimit të të cilit vetëm protoni H + mund të zbulohet nga jonet pozitive. Shkëputja e bazës shoqërohet me formimin ose lirimin nga rrjeta kristalore vetëm të anionit OH dhe të kationit metalik. Një kripë normale pas shpërbërjes jep një jon metalik pozitiv dhe një negativ - një mbetje acidi. Kripa bazë dallohet nga prania e dy llojeve të anioneve: grupit OH dhe mbetjes acide. Në një kripë acidike, vetëm hidrogjeni dhe metali janë të pranishëm nga kationet.
Fuqia e elektroliteve
Për të karakterizuar gjendjen e një substance në një tretësirë, përdoret një sasi fizike - shkalla e disociimit (α). Gjeni vlerën e tij nga raporti i numrit të molekulave të shpërbëra me numrin e tyre të përgjithshëm në tretësirë. Thellësia e ndarjes përcaktohet nga kushte të ndryshme. Parametrat dielektrikë të tretësit dhe struktura e përbërjes së tretur janë të rëndësishme. Zakonisht, shkalla e disociimit zvogëlohet me rritjen e përqendrimit dhe rritet me rritjen e temperaturës. Shpesh, shkalla e disociimit të një substance të caktuar shprehet në fraksione të një njësie.

Klasifikimi i elektroliteve
Teoria e disociimit elektrolitik në fund të shekullit të 19-të nuk përmbante dispozita mbi bashkëveprimin e joneve në tretësirë. Ndikimi i molekulave të ujit në shpërndarjen e kationeve dhe anioneve dukej i parëndësishëm për Arrhenius. Idetë e Arrhenius-it për elektrolitet e fortë dhe të dobët ishin formale. Bazuar në dispozitat klasike, mund të merrni vlerën α = 0,75-0,95 për elektrolite të forta. Eksperimentet vërtetuan pakthyeshmërinë e shkëputjes së tyre (α → 1). Kripërat e tretshme, acidet sulfurik dhe klorhidrik, alkalet janë dekompozuar pothuajse plotësisht në jone. Acidet sulfurore, azotike, hidrofluorike, ortofosforike janë pjesërisht të disociuara. Silikoni, acetiku, sulfuri i hidrogjenit dhe acidet karbonik, hidroksidi i amonit dhe bazat e patretshme konsiderohen elektrolite të dobëta. Uji quhet gjithashtu një elektrolit i dobët. Një pjesë e vogël e molekulave Н 2 О disociohet, ndërsa ndodh molarizimi i joneve.