Bromi i çliruar ndahet me ekstraktim me tretës jopolarë ose me distilim me avull. Shihni se çfarë është "bromi" në fjalorë të tjerë Bromi është një lëng në
Zbulimi i bromit u çua në kërkimin e kimistit francez A. Balard, i cili në 1825, duke vepruar me klor në një tretësirë ujore të marrë pas larjes së hirit të algave, izoloi një lëng kafe të errët, me erë të keqe. Ai e quajti këtë lëng murid (nga latinishtja muria - shëllirë) dhe i dërgoi një mesazh për zbulimin e tij Akademisë së Shkencave të Parisit. Komisioni e quajti elementin e ri brom për faktin se bromi ka një erë të rëndë, të pakëndshme avulli (nga greqishtja brwmoz- erë e keqe).
Duke qenë në natyrë, duke marrë:
Përmbajtja e bromit në koren e tokës (1,6*l0 -4% në masë) vlerësohet në 10 15 -10 16 ton.Bromi është një shoqërues i vazhdueshëm i klorit. Kripërat e bromit (NaBr, KBr, MgBr 2) gjenden në depozitat e kripërave të klorurit (në kripën e tryezës deri në 0.03%, në kripërat e kaliumit - sylvite dhe karnalit - deri në 0.3%), si dhe në ujin e detit (0.065%) , shëllirat e liqeneve të kripura (deri në 0,2%) dhe shëllirat nëntokësore zakonisht të shoqëruara me depozitat e kripës dhe naftës (deri në 0,1%).
Materialet fillestare për prodhimin industrial të bromit janë uji i detit, liqeni dhe ujërat nëntokësore, që përmbajnë bromin në formën e jonit të bromit. Bromi izolohet duke përdorur klor dhe hiqet nga tretësira me avull uji ose ajër. Bromi hiqet nga përzierja që rezulton brom-ajër duke përdorur absorbues kimikë. Për këtë qëllim përdoren tretësirat e bromit të hekurit. Bromi izolohet nga ndërmjetësit që rezultojnë nga veprimi i klorit ose acidit. Më pas, bromi ndahet nga uji dhe pastrohet nga papastërtitë e klorit me anë të distilimit.
Laboratorët përdorin gjithashtu procese të bazuara në oksidimin e bromit:
6KBr + K 2 Cr 2 O 7 + 7H 2 SO 4 = 3Br 2 + Cr 2 (SO 4) 3 + 4K 2 SO 4 + 7H 2 O
Vetitë fizike:
Bromi është i vetmi jometal që është i lëngshëm në temperaturën e dhomës. Substanca e thjeshtë është një lëng i rëndë në ngjyrë të kuqe-kafe me një erë të pakëndshme (dendësia në 20°C - 3,1 g/cm 3, pika e vlimit +59,82°C), avulli i bromit ka një ngjyrë të verdhë-kafe. Në një temperaturë prej -7,25°C, bromi ngurtësohet në kristale të kuqe-kafe në formë gjilpëre me një shkëlqim të dobët metalik. Bromi është i tretshëm në ujë më mirë se halogjenet e tjerë (3,58 g/100 g H 2 O në 20 ° C) - " ujë me brom"Ne e tretim bromin shumë më mirë në tretës organikë sesa përdoret për ta nxjerrë atë nga tretësirat ujore.
Karakteristikat kimike:
Bromi është një agjent i fortë oksidues, ai reagon drejtpërdrejt me pothuajse të gjitha jometalet (përveç gazeve fisnike, oksigjenit, azotit dhe karbonit) dhe shumë metale:
2P + 3Br 2 = 2PBr 3; 2Al + 3Br 2 = 2AlBr 3
Në një mjedis ujor, bromi i oksidon nitritet në nitrate, amoniaku në azot, jodidet në jod të lirë, squfuri dhe sulfitet në acid sulfurik:
2NH3 + 6Br2 = N2 + 6HBr; 3Br 2 + S + 4H 2 O = 6HBr + H 2 SO 4
Kur bromi reagon me tretësirat alkaline, krijohen bromidet dhe hipobromitet përkatëse (në të ftohtë) ose bromatet:
Br 2 + 2NaOH = NaBr + NaBrO + H 2 O (në t Bromi karakterizohet nga komponime me gjendje oksidimi tek: -1, +1, +3, +5, +7.
Lidhjet më të rëndësishme:
Hidrogjen bromur HBr- një gaz helmues pa ngjyrë me një erë të mprehtë që tymi në ajër për shkak të ndërveprimit me avujt e ujit. Është shumë i tretshëm në ujë: në 0°C, 612 vëllime brom hidrogjeni treten në një vëllim uji. Zgjidhja - monobazike e fortë acidi hidrobromik. kripëra - bromidet kristale pa ngjyrë, shumë të tretshëm në ujë (AgBr i patretshëm, i verdhë i zbehtë).
Oksidi i bromit (I) Br 2 O., gaz kafe. Formohet nga veprimi i bromit në HgO në CCl 4 . Vetitë...
Acidi hipobrom HBrO- një agjent i fortë oksidues. Formohet kur bromi tretet në ujë, nën ndikimin e dritës zbërthehet në HBr dhe oksigjen; ka veti të dobëta acidike dhe ekziston vetëm në tretësirë. kripëra - hipobromitet, KBrO, NaBrO - përftohet në gjendje të lirë në formë hidrate kristalore. Të gjithë ata janë shumë të paqëndrueshëm; kur nxehen (ose tretësira të acidifikuara) ato dekompozohen në brom dhe bromat:
3KBrO = 2KBr + KBrO 3
Bromitet, kripërat e HBrO 2 - të panjohura edhe në një tretësirë të acidit brom formohen gjatë oksidimit të hipobromiteve me brom në një mjedis alkalik: Ba(BrO) 2 + 2Br 2 + 4KOH = Ba(BrO 2) 2 + 4KBr + 2H 2. O
Acidi bromik, HBrO 3 - tretësira e koncentruar është një lëng shurup pa ngjyrë. kripëra - bromatet. Acidi bromik dhe bromatet janë agjentë të fortë oksidues:
2S + 2NaBrO 3 = Na 2 SO 4 + Br 2 + SO 2
Acidi bromik HBrO 4 ekziston në tretësirat ujore me një përqendrim jo më të madh se 6 mol/l. Përkundër faktit se HBrO 4 është agjenti oksidues më i fuqishëm midis acideve të oksigjenit të bromit, reagimet me pjesëmarrjen e tij vazhdojnë shumë ngadalë.
Trifluori i bromit, BrF 3 - lëng i kuq me bp. 126°C, formohet si rezultat i reaksionit të drejtpërdrejtë të bromit me fluorin. Reagon në mënyrë shpërthyese me ujin dhe substancat organike. Në lidhje me përbërjet inorganike ai sillet si një agjent i fortë fluorinues.
Aplikacion:
Bromi dhe komponimet e tij përdoren gjerësisht në sintezën organike bazë. Bromidi i argjendit AgBr përdoret në fotografi si një substancë fotosensitive. Përbërjet e bromit përdoren për të krijuar retardantë zjarri - aditivë që i japin rezistencë zjarrit plastikës, drurit dhe materialeve tekstile. Pentafluoridi i bromit ndonjëherë përdoret si një oksidues shumë i fuqishëm i karburantit të raketave. 1,2-dibromoetani përdoret si një aditiv kundër goditjes në karburantin motorik. Tretësirat e bromit përdoren në prodhimin e vajit. Në mjekësi, bromidi i natriumit dhe i kaliumit përdoren si qetësues.
Roli biologjik dhe toksiciteti:
Bromi në formën e tij të thjeshtë është helmues. Bromi i lëngshëm shkakton djegie të vështira për t'u shëruar. Avulli i bromit në përqendrim 1 mg/m3 shkakton acarim të mukozave, kollë, marramendje dhe dhimbje koke, dhe në përqendrim më të lartë (>60 mg/m3) shkakton mbytje dhe vdekje.
Në trupin e njeriut, bromi, në formën e joneve të bromit, është i përfshirë në rregullimin e gjëndrës tiroide, pasi është një frenues konkurrues i jodit.
Petrova M.A., Pukhova M.S.
Universiteti Shtetëror HF Tyumen, grupi 572.
Enciklopedia "Rreth botës":
Bromin
BROMI-a (-y); m.[nga greqishtja brōmos - erë e keqe]
1. Elementi kimik (Br), një lëng toksik i rëndë në ngjyrë të kuqe-kafe që tymi në ajër (përdoret në prodhimin kimik, në formën e kripërave - në mjekësi dhe fotografi). Kripërat e bromit. Ilaç me brom.
2. Një produkt medicinal që përmban këtë substancë ose përbërjet e saj (përdoret si qetësues ose hipnotik). Përshkruani, pranoni b. Shtoni bromin (bromin).
◁ Brom, oh, oh. B droga. Uji i dyte(tretësirë ujore e bromit). Brom, oh, oh. B droga. Bromid, oh, oh. B-kripërat, metalet. Tretësirë e bromurit të kaliumit(pika qetësuese).
bromin(lat. Bromum), element kimik i grupit VII të tabelës periodike, i përket halogjenëve. Emër nga greqishtja. brōmos - erë e keqe. Lëng i rëndë në ngjyrë të kuqe-kafe që tymos në ajër dhe ka një erë të fortë të pakëndshme; dendësia 3.1 g/cm 3, t pl –7,25°C, t kip 59,2°C. Përdoret si agjent brominues për prodhimin e bromiteve, përbërjeve organike dhe të tjera të bromit në kiminë analitike. Bromi është helmues.
BROMIBROMI (lat. Bromum), Br (lexo “bromi”), element kimik me numër atomik 35, pesha atomike 79,904. Emri vjen nga fakti se bromi ka një erë të rëndë, të pakëndshme avulli (nga greqishtja bromos - erë e keqe).
Bromi natyral është një përzierje e dy nuklideve (cm. NUKLIDI) me numra masiv 79 (në një përzierje prej 50,56% në masë) dhe 81. Konfigurimi i shtresës së jashtme elektronike 4 s 2
fq 5
. Tek komponimet shfaq gjendje oksidimi –1, +1, +3, +5 dhe +7 (valenca I, III, V dhe VII), me gjendjet më karakteristike të oksidimit –1 dhe +5.
E vendosur në periudhën e katërt në grupin VIIA të tabelës periodike të elementeve të Mendelejevit, i përket halogjenëve (cm. HALOGJEN).
Rrezja e atomit neutral të bromit është 0,119 nm, rrezet jonike të Br -, Br 3+, Br 5+ dhe Br 7+ janë, përkatësisht, 0,182, 0,073, 0,045 dhe 0,039 nm. Energjitë sekuenciale të jonizimit të atomit neutral të bromit janë, përkatësisht, 11.84, 21.80, 35.9, 47.3 dhe 59.7 eV. Afiniteti i elektroneve 3,37 eV. Sipas shkallës Pauling, elektronegativiteti i bromit është 2.8.
Historia e zbulimit
Zbulimi i bromit u drejtua nga kërkimet e kimistit francez A. Balard (cm. BALARD Antoine Jerome), i cili në vitin 1825, duke vepruar me klor në një tretësirë ujore të marrë pas larjes së hirit të algave, lëshoi një lëng kafe të errët dhe me erë të keqe. Ai e quajti këtë lëng, të marrë edhe nga uji i detit, murid (nga latinishtja muria - tretësirë e kripur, shëllirë) dhe i dërgoi një mesazh për zbulimin e tij Akademisë së Shkencave të Parisit. Komisioni i krijuar për të verifikuar këtë mesazh nuk e pranoi emrin Balar dhe e quajti elementin e ri brom. Zbulimi i bromit e bëri të famshëm shkencëtarin e ri dhe pak të njohur. Pasi u shfaq artikulli i Balar, doli se shishet me një substancë të ngjashme ishin në pritje të hulumtimit nga kimistët gjermanë K. Levig dhe J. Liebig. (cm. LIBICH Justus). Pasi humbi mundësinë për të zbuluar një element të ri, Liebig bërtiti: "Nuk ishte Balar ai që zbuloi bromin, por bromi ai që zbuloi Balar."
Të qenit në natyrë
Bromi është një element mjaft i rrallë në koren e tokës. Përmbajtja e tij në të vlerësohet në 0,37·10 -4% (afërsisht vendi i 50-të).
Kimikisht, bromi është shumë aktiv dhe për këtë arsye nuk gjendet në formë të lirë në natyrë. Është pjesë e një numri të madh përbërjesh të ndryshme (natriumi, kaliumi, bromidet e magnezit, etj.) që shoqërojnë kloruret e natriumit, kaliumit dhe magnezit. Mineralet e vetë bromit - bromargjiriti (brom argjendi AgBr) dhe emboliti (klorur i përzier dhe bromi i argjendit) - janë jashtëzakonisht të rralla (shih Bromuret natyrore (cm. BROMIDE NATYRORE)). Burimi i bromit janë ujërat e liqeneve të hidhur, shëllirërat e kripës që shoqërojnë vajin dhe depozitat e ndryshme të kripës, dhe uji i detit (65·10–4%), Deti i Vdekur është më i pasur me brom. Aktualisht, bromi nxirret zakonisht nga ujërat e disa liqeneve të hidhur, njëri prej të cilëve ndodhet, veçanërisht, në vendin tonë në stepën Kulunda (në Altai).
Vetite fizike dhe kimike
Në kushte normale, bromi është një lëng i rëndë (densiteti 3,1055 g/cm3), i kuq në kafe, i trashë me erë të athët. Bromi është një nga substancat e thjeshta që janë të lëngshme në kushte normale (përveç bromit, një substancë e tillë është edhe merkuri). Pika e shkrirjes së bromit është –7,25 °C, pika e vlimit është +59,2 °C. Potenciali standard i elektrodës Br 2 / Br - në një zgjidhje ujore është +1,065 V.
Në formë të lirë, ekziston në formën e molekulave diatomike Br 2. Një ndarje e dukshme e molekulave në atome vërehet në një temperaturë prej 800 °C dhe rritet me shpejtësi me rritjen e mëtejshme të temperaturës. Diametri i molekulës Br 2 është 0,323 nm, distanca ndërbërthamore në këtë molekulë është 0,228 nm.
Bromi është pak, por më i tretshëm se halogjenët e tjerë në ujë (3.58 g në 100 g ujë në 20 ° C), tretësira quhet ujë brom. Në ujin e bromit, një reagim ndodh me formimin e acideve hipobromike hidrobromike dhe të paqëndrueshme:
Br 2 + H 2 O = HBr + HBrO.
Bromi është i përzier në të gjitha aspektet me shumicën e tretësve organikë, dhe brominimi i molekulave të tretësit organik ndodh shpesh.
Për sa i përket aktivitetit kimik, bromi zë një pozicion të ndërmjetëm midis klorit dhe jodit. Kur bromi reagon me tretësirat e jodeve, lirohet jodi i lirë:
Br 2 + 2KI = I 2 + 2KBr.
Përkundrazi, kur klori vepron mbi bromimet në tretësirat ujore, lirohet bromi i lirë:
Cl 2 + 2NaBr = Br 2 + 2NaCl.
Kur bromi reagon me squfurin, formohet S 2 Br 2, kur bromi reagon me fosforin, formohen PBr 3 dhe PBr 5. Bromi gjithashtu reagon me selenin jometal (cm. SELENI) dhe teluri (cm. TELURIUM) .
Reagimi i bromit me hidrogjen ndodh kur nxehet dhe çon në formimin e bromit hidrogjen HBr. Një tretësirë e HBr në ujë është acidi hidrobromik, i cili është i ngjashëm në forcë me acidin klorhidrik HCl. Kripërat e acidit hidrobromik - bromidet (NaBr, MgBr 2, AlBr 3, etj.). Një reagim cilësor ndaj pranisë së joneve të bromit në një tretësirë është formimi i një precipitati AgBr të verdhë të lehtë me jone Ag +, praktikisht i pazgjidhshëm si në ujë ashtu edhe në tretësirë të acidit nitrik.
Bromi nuk reagon drejtpërdrejt me oksigjenin dhe azotin. Bromi formon një numër të madh të komponimeve të ndryshme me halogjene të tjera. Për shembull, me fluorin, bromi formon BrF 3 të paqëndrueshëm dhe BrF 5, me jod - IBr. Kur ndërvepron me shumë metale, bromi formon bromide, për shembull, AlBr 3, CuBr 2, MgBr 2, etj. Tantali dhe platini janë rezistent ndaj bromit, dhe në një masë më të vogël, argjendit, titanit dhe plumbit.
Bromi është një agjent i fortë oksidues; ai oksidon jonin sulfit në sulfat, jonin nitrit në nitrat, etj.
Kur bashkëvepron me përbërjet organike që përmbajnë një lidhje të dyfishtë, bromi shton, duke dhënë derivatet përkatëse dibromo:
C 2 H 4 + Br 2 = C 2 H 4 Br 2.
Bromi gjithashtu lidhet me molekulat organike që përmbajnë një lidhje të trefishtë. Zbardhja e ngjyrës së ujit me brom kur kalon një gaz ose i shtohet një lëng, tregon se një përbërje e pangopur është e pranishme në gaz ose lëng.
Kur nxehet në prani të një katalizatori, bromi reagon me benzenin për të formuar bromobenzen C 6 H 5 Br (reaksion zëvendësimi).
Kur bromi reagon me tretësirat e alkalit dhe me tretësirat e karbonateve të natriumit ose kaliumit, formohen bromidet dhe bromatet përkatëse, për shembull:
Br 2 + 3Na 2 CO 3 = 5 NaBr + NaBrO 3 + 3CO 2.
Aplikacion
Bromi përdoret në përgatitjen e një numri substancash inorganike dhe organike në kiminë analitike. Komponimet e bromit përdoren si aditivë të karburantit, pesticide, retardantë flakë dhe në fotografi. Barnat që përmbajnë brom janë të njohura gjerësisht. Duhet të theksohet se shprehja e zakonshme: "mjeku ka përshkruar bromin një lugë gjelle pas ngrënies" do të thotë, natyrisht, vetëm se është përshkruar një zgjidhje ujore e bromit të natriumit (ose kaliumit), dhe jo brom i pastër. Efekti qetësues i barnave bromide bazohet në aftësinë e tyre për të përmirësuar proceset e frenimit (cm. frenimi) në sistemin nervor qendror.
Karakteristikat e punës me brom
Kur punoni me brom, duhet të përdorni veshje mbrojtëse, maskë gazi dhe doreza. MPC e avullit të bromit është 0,5 mg/m3. Tashmë në një përmbajtje bromi në ajër në një përqendrim prej rreth 0.001% (në vëllim), vërehen acarim të mukozave, marramendje, dhe në përqendrime më të larta - spazma të traktit respirator, mbytje. Nëse gëlltitet, doza toksike është 3 g, vdekjeprurëse - nga 35 g. Në rast helmimi me avull bromi, viktima duhet të dërgohet menjëherë në ajër të pastër; Për të rivendosur frymëmarrjen, mund të përdorni një shtupë të lagur me amoniak, duke e sjellë periodikisht në hundën e viktimës për një kohë të shkurtër. Trajtimi i mëtejshëm duhet të kryhet nën mbikëqyrjen e një mjeku. Bromi i lëngshëm shkakton djegie të dhimbshme nëse bie në kontakt me lëkurën.
Për shkak të aktivitetit të lartë kimik dhe toksicitetit të avullit të bromit dhe bromit të lëngshëm, ai duhet të ruhet në një enë qelqi, të mbyllur fort, me mure të trasha. Shishet me brom vendosen në enë me rërë, e cila mbron shishet nga shkatërrimi kur tunden. Për shkak të densitetit të lartë të bromit, shishet që përmbajnë atë nuk duhet të merren kurrë vetëm nga qafa (qafa mund të shkëputet dhe më pas lëngu toksik do të përfundojë në dysheme).
Për të neutralizuar bromin e derdhur, sipërfaqja me të duhet të mbulohet menjëherë me një lëng sode të lagësht Na 2 CO 3.
fjalor enciklopedik. 2009 .
Sinonimet:Shihni se çfarë është "bromi" në fjalorë të tjerë:
bromin- brom, a dhe y... Fjalori drejtshkrimor rus
bromin- brom/… Fjalor morfemiko-drejtshkrimor
BROMI- BROM, Brom (nga greqishtja bromos erë e keqe), metaloid i lëngët, grup halogjen, me kimikate. emërtimi Вг; në. V. 79,92; zë vendin e 35-të në sistemin periodik të elementeve sipas renditjes, i 4-ti në grupin VII. Lëng i kuq-kafe të errët, spec. pesha 3188...... Enciklopedia e Madhe Mjekësore
- (greqisht bromos fetid). Trup i thjeshtë i lëngshëm me ngjyrë të kuqe, me erë shumë të pakëndshme; zbuluar nga Balard në 1726 në ujin e detit dhe burimet e kripura. Fjalori i fjalëve të huaja të përfshira në gjuhën ruse. Chudinov A.N., 1910. BROME... ... Fjalori i fjalëve të huaja të gjuhës ruse
BROM, brom, burri. (Greqisht: bromos, erë e keqe). Element kimik, lëng kaustik me ngjyrë kafe-kuqe me erë të fortë (kimike). Bromi përdoret në mjekësi, fotografi dhe teknologji. || Komponimet e bromit, të përdorura. në mjekësi (përshtat.). Mjeku e ka përshkruar...... Fjalori shpjegues i Ushakovit
- (simboli Br), një element i paqëndrueshëm, i lëngshëm i grupit HALOGJEN (grupi i shtatë i tabelës periodike). Izoluar për herë të parë në 1826. Është i vetmi element jo metalik që mbetet i lëngshëm në temperaturën e dhomës. Ajo nxirret nga të tretshme... Fjalor enciklopedik shkencor dhe teknik
Bromin? Prezenca elementët gjurmë në trupin e njeriut llogaritur në sasi shumë të vogla, sepse këto janë substanca nga të cilat ka më pak se 0,015 g në trupin tonë.Nga masën e një organi ose indi, përmbajtja e tyre është të mijtët e përqindjes ose më pak (10 -2 deri në 10 -7%). , prandaj edhe quhen elementët gjurmë. Por, përkundër një pranie kaq të vogël, një sasi e mjaftueshme e këtyre substancave është një kusht i rëndësishëm për funksionimin e plotë të të gjitha sistemeve dhe organeve. Një nga këto minerale është . Rreth tij vetitë dhe rëndësia shëndetësore do të diskutohet në këtë artikull, drejtimet kryesore të tij përdoret për qëllime terapeutike dhe profilaktike.
Bromi: Historia e zbulimit
Interesante historia e zbulimit të bromit, pika e fundit e bardhë e mbetur midis halogjenëve. Në të njëjtën kohë, dy kimistë e izoluan atë nga substanca të ndryshme: në 1825, një student në Universitetin e Heidelberg. K. Levig kur ekspozohet ndaj klorit në ujë mineral dhe frëngjisht kimisti A. Balar, i cili studioi bimët e kënetës, - gjatë reagimit të ujit të klorit me hirin e algave. Megjithatë, ndërsa Levig po përpiqej të merrte sasi më të mëdha të substancës së re, Balard kishte botuar tashmë një raport mbi zbulimin e tij në 1826, falë të cilit ai fitoi famë në mbarë botën. Balar donte ta quante substancën që rezulton fjalën latine "murid", që do të thotë "shëllirë". Megjithatë, acidi klorhidrik u quajt acid murik, dhe kripërat e përftuara prej tij quheshin muriate, dhe për të shmangur konfuzionin terminologjik në komunitetin shkencor, u vendos që minerali i zbuluar të quhej brom, i cili nga greqishtja e vjetër përkthehet si "erë e keqe". .” Bromi me të vërtetë ka një erë mbytëse dhe të pakëndshme. Në shkencën kimike ruse gjatë gjithë shekullit të 19-të, ky mikroelement u caktua si vrom, vromid dhe murid.
Bromin në formë dhe dozë optimale natyrale gjendet në produktet e bletarisë - si pjalmi, pelte mbretërore dhe pjellë drone, të cilat janë pjesë e shumë komplekseve natyrale të vitaminave dhe mineraleve të kompanisë Parapharm: Leveton P, Elton P, Leveton Forte ", "Apitonus P. ", "Osteomed", "Osteo-Vit", "Eromax", "Memo-Vit" dhe "Cardioton". Kjo është arsyeja pse ne i kushtojmë kaq shumë vëmendje çdo substance natyrale, duke folur për rëndësinë dhe përfitimet e saj për shëndetin e trupit.
Kimike dhe fizike
vetitë e bromit
Histori rreth vetitë kimike dhe fizike të bromit Le ta paraprijmë atë me një përshkrim të vendit të tij në tabelën periodike të elementeve kimike të Mendelejevit. Në të ndodhet nën simbolBr (nga latinishtja Bromum) në numrin 35 në grupin e 17-të, ku ka halogjene(fluor, klor, brom, jod dhe astatinë). Këto janë jometale dhe agjentë oksidues aktivë, jo të pranishme në natyrë në mënyrë të pavarur, por vetëm si pjesë e përbërjeve, pasi ato karakterizohen nga reaktivitet i lartë kimik, i kombinuar me pothuajse të gjitha substancat e thjeshta. Ekzistojnë vetëm 2 elementë, substancat e thjeshta të të cilëve ekzistojnë në formë të lëngshme në kushte normale - merkuri dhe bromi, dhe vetëm një jometal i lëngshëm - brom, i cili është një avull i kuq-kafe, i tymosur në kafe, lëng toksik. Bromi kristalizohet vetëm në një temperaturë prej -7,25 °C, dhe vlon në +59 °C. Ai shpërndahet në H 2 O (përftohet i ashtuquajturi ujë bromi), por më mirë - në tretës organikë.
Brom i pastër përfaqësohet nga një molekulë 2-atomike - BR 2, Por aktivitet i lartë kimik nuk e lejon të jetë në gjendje të lirë në natyrë, prandaj gjendet në përbërja e bromit(komponimet me metale). Për sa i përket përmbajtjes në brendësi të tokës dhe në shkëmbinj, ajo renditet e 50-ta, ndaj burimi natyror i saj janë kryesisht liqenet dhe detet e kripura; vaji shoqërues i ujërave nëntokësore. Është i pranishëm edhe në ajër, më shumë në zonat bregdetare. Megjithatë, në rast të një rrjedhjeje industriale, avujt e bromit kanë një efekt helmues dhe asfiksues te njerëzit.
Vetitë e bromit e lejojnë atë të përdoret gjerësisht për prodhimin e aditivëve të karburantit, pesticideve në bujqësi, retardantëve të djegies, agjentit fotosensitive bromidi argjendi në fotografi dhe ilaçeve. Puna me këtë mikroelement kërkon kujdes ekstrem dhe respektim të masave paraprake të sigurisë. Dorezat, tutat dhe një maskë gazi janë aleatët tuaj më të mirë kur merreni me këtë substancë.
Vlera e bromit
për trupin person
Brom i pastër– substancë shumë toksike! Vetëm 3 gram bromi elementar shkakton helmim nëse gëlltitet, dhe 35 gramë është vdekjeprurëse. Kontaktoni me brom i lëngshëmështë i mbushur me një djegie të dhimbshme, të dobët të shërimit. 0,001% brom në ajër shkakton kollitje, mbytje, marramendje, gjakderdhje nga hundët dhe tejkalimi i kësaj shifre mund të çojë në spazma të frymëmarrjes dhe vdekje. Megjithatë, pavarësisht nga toksiciteti, rëndësia e bromit për trupinështë e vështirë të nënvlerësosh një person. Ai është një element gjurmë që gjendet në organet dhe indet tona: truri, gjaku, mëlçia dhe veshkat, gjëndra tiroide, indet e muskujve dhe kockat... Na duhen ne sasi te vogla!
Bromi ka një efekt në sistemin nervor qendror. Duke u grumbulluar në korteksin cerebral, ai rregullon aktivitetin e neuroneve, duke qenë përgjegjës për ekuilibrin midis reaksioneve të ngacmimit dhe frenimit. Nëse është e nevojshme, rrit frenimin përmes enzimave të membranës, e cila është përgjegjëse për efektin e saj qetësues.
Ky mikroelement është gjithashtu i rëndësishëm për sistemin endokrin, pasi vepron si një lloj alternativë ndaj jodit dhe zvogëlon nevojën e gjëndrës tiroide për jod, duke parandaluar rritjen e saj - shfaqjen e gushës endemike.
Roli i bromit në funksionimin e traktit gastrointestinal për shkak të aktivizimit të tij efekt në enzimat e tretjes:
- pepsina (e nevojshme për zbërthimin e proteinave);
- amilaza (zbërthen karbohidratet);
- lipaza (shrin dhe rendit yndyrnat gjatë tretjes).
Pyetje O ndikimi i bromit mbi aktivitetin seksual të mashkullit i mbështjellë me mite. Në veçanti, që më parë të burgosurit në burgje, pacientët në departamentet psikiatrike të spitaleve dhe ushtarët në ushtri i shtoheshin ushqimit me këtë mineral për të dobësuar funksionin erektil. Për një kohë të gjatë besohej se bromi, duke pasur një gjeneral efekt qetësues në trup, depreson sferën seksuale. Megjithatë, studimet e mëvonshme kanë vërtetuar një efekt krejtësisht të kundërt nga marrja preparate bromide, duke kontribuar në stabilizimin e sistemit riprodhues te meshkujt, rritja e lëngut seminal dhe numri i spermatozoideve në të.
Bromi hiqet nga trupi me urinë dhe djersitje. Pra, marrja e tij nga jashtë nëpërmjet ushqimit (dhe, nëse është e nevojshme, në preparatet farmakologjike) është e nevojshme. Megjithatë, heqja e tij është një proces i gjatë, kështu që përqendrimi i tij në organe dhe inde mund të rritet, gjë që është shumë e rrezikshme për shëndetin.
Si ndikon mungesa e bromit
mbi shëndetin e njeriut?
Mungesa e bromit mund të shkaktojë një sërë dëmtimesh serioze funksionale. Në fëmijëri dhe adoleshencë, mungesa e tij mund të çojë në rritje më të ngadaltë, dhe për të rriturit mund të çojë në një ulje të jetëgjatësisë. Probleme me rënien në gjumë, manifestime neurastenike dhe histerike, anemi e shkaktuar nga rënia e niveleve të hemoglobinës, rritje e rrezikut të abortit spontan tek gratë shtatzëna, dobësim i funksioneve seksuale, probleme me tretjen e shkaktuar nga ulja e aciditetit - e gjithë kjo mund të jetë pasojë e mungesës së këtë mineral. Shkaqet e kësaj gjendje janë anomalitë metabolike ose abuzimi me diuretikët do të thotë promovim heqja e bromit nga trupi. Diagnoza mungesa e bromit dhe trajtimi duhet të përshkruhet nga një specialist, dhe vetë-mjekimi pa u konsultuar me një mjek në këtë rast nuk rekomandohet rreptësisht.
Mbidozimi i bromit
Jo më pak e rrezikshme mbidoza e bromit, që lindin ekskluzivisht në lidhje me përdorimin e barnave farmakologjike. Simptomat e tij karakteristike do të jenë skuqjet alergjike të lëkurës, manifestimet inflamatore në lëkurë, shqetësimet në traktin gastrointestinal, depresioni dhe humbja e energjisë, problemet me gjumin, letargjia, bronkiti dhe riniti si reagim ndaj efektit toksik të bromit. Sistemi nervor dhe organet e perceptimit (vizioni dhe dëgjimi) vuajnë, proceset mendore dhe funksionet njohëse (të lidhura me perceptimin) përkeqësohen.
Një tepricë e bromit mund të jetë fatale, kështu që nëse dyshoni për një mbidozë, duhet të ndaloni menjëherë përdorimin që përmbajnë brom medikamente dhe konsultohuni me një mjek për t'i anuluar ose rregulluar dozën.
Marrja e barnave me brom V
për qëllime terapeutike dhe parandaluese
Duke studiuar ekspozimi ndaj bromit mbi shëndetin e njeriut dhe futja e tyre në praktikën mjekësore filloi pothuajse menjëherë më pas zbulimi i bromit– në shekullin e 19-të, pra duke marrë medikamente me brom– një ilaç i provuar në mjekësinë klinike.
Fiziolog rus I. P. Pavlov dha një kontribut të rëndësishëm në kërkimin mbi ndikimin komponimet që përmbajnë brom mbi aktivitetin nervor. Eksperimentet e tij mbi qentë rezultuan efektive brom për neuroza, dhe të emëruar dozat e bromit duhet të lidhet me llojin e aktivitetit më të lartë nervor (me një lloj të fortë, nevojiten doza më të larta).
Bromidet si qetësues përdoret për çrregullime neuropsikike, pagjumësi, rritje të ngacmueshmërisë, histeri dhe neurasteni, konvulsione, por pothuajse kanë pushuar së përdoruri për trajtimin e epilepsisë. Sot, mjekët janë përgjithësisht të kujdesshëm janë të përshkruara bromidet për shkak të eleminimit të ngadaltë nga trupi dhe rrezikut të zhvillimit të bromizmit - kronik intoksikimi me brom. Ky tregues mbetet i vlefshëm që përmbajnë brom medikamentet, si një shkelje e koordinimit midis korteksit cerebral dhe organeve, sistemeve, që ndodh shpesh me ulçera gastrike dhe duodenale, në një fazë të hershme të zhvillimit të hipertensionit.
Ndër të përbashkëtat barna që përmbajnë brom, – bromidi i kaliumit, bromidi i natriumit, “Adonis-bromi”, “Bromcamfori” e të tjera, si nga goja në formë pluhuri dhe tretësire, ashtu edhe intravenoze. Bromi i natriumit është i aplikueshëm për elektroforezë - për procese inflamatore të dhimbshme, për herpes zoster. Doza e bromit përfshin marrjen e 0,1-1 gram tri herë në ditë.
Kërkesa ditore për brom
Për të rritur aciditetin e lëngut gastrik dhe aktivizimi i funksionit seksual tek meshkujt, për parandalimin e çrregullimeve nervore, mjekët rekomandojnë marrjen 3-8 mg. Kjo Kërkesa ditore për brom për një person të shëndetshëm. Shumë suplemente dietike përfshijnë këtë element gjurmë së bashku me minerale të tjera. Mesatarisht, 1 mg hyn në trupin tonë me ushqim.
Përmbajtja e bromit
në produkte të ushqyerit
Duke ditur se si është Përmbajtja e bromit në produkte të ushqyerit, ju mund të rrisni marrjen e tij pa përdorimin e barnave farmakologjike. Ky mikroelement grumbullohet në shumë bimë, të cilat e marrin atë nga thellësia dhe e lidhin në përbërje dhe kripëra organike jo toksike.
Ato janë veçanërisht të pasura me:
- bizele,
- fasule,
- thjerrëzat,
- arra të ndryshme dhe
- drithërat (elbi, gruri etj.).
Merret në përbërjen e tij nga uji i detit
- leshterik dhe alga të tjera,
- peshk deti.
Mund të marrim edhe pak brom nga kripa e gurit. Gjendet gjithashtu në produktet e qumështit, makaronat dhe produktet e bukës të bëra nga gruri i fortë.
Bromi natyral është një përzierje e dy nuklideve me numër masiv 79 (në një përzierje 50,56% në masë) dhe 81. Konfigurimi i shtresës së jashtme elektronike është 4s 2 p 5. Në përbërjet shfaq gjendje oksidimi 1, +1, +3, +5 dhe +7 (valenca I, III, V dhe VII), me gjendjet më karakteristike të oksidimit 1 dhe +5.
Ndodhet në periudhën e katërt në grupin VIIA të tabelës periodike të elementeve të Mendelejevit.
Rrezja e atomit të bromit neutral është 0,119 nm, rrezet jonike të Br , Br 3+, Br 5+ dhe Br 7+ janë përkatësisht të barabarta me 0,182; 0,073; 0,045 dhe 0,039 nm. Energjitë e jonizimit sekuencial të një atomi bromi neutral janë, përkatësisht, 11,84; 21.80; 35,9; 47.3 dhe 59.7 eV. Afiniteti i elektroneve 3,37 eV. Sipas shkallës Pauling, elektronegativiteti i bromit është 2.8.
Emri: për faktin se bromi ka një erë të rëndë, të pakëndshme avulli (nga erë e keqe greke bromos).
Historia e zbulimit: Zbulimi i bromit u udhëhoq nga kërkimi i kimistit francez A. Balard, i cili në vitin 1825, duke vepruar me klor në një tretësirë ujore të marrë pas larjes së hirit të algave, izoloi një lëng kafe të errët dhe me erë të keqe. Ai e quajti këtë lëng, të marrë edhe nga uji i detit, murid (nga zgjidhja latine e kripës muria, shëllirë) dhe i dërgoi një mesazh për zbulimin e tij Akademisë së Shkencave të Parisit. Komisioni i krijuar për të verifikuar këtë mesazh nuk e pranoi emrin Balar dhe e quajti elementin e ri brom. Zbulimi i bromit e bëri të famshëm shkencëtarin e ri dhe pak të njohur. Pasi u shfaq artikulli i Balar, doli se shishet me një substancë të ngjashme ishin në pritje të hulumtimit nga kimistët gjermanë K. Levig dhe J. Liebig. Pasi humbi mundësinë për të zbuluar një element të ri, Liebig bërtiti: "Nuk ishte Balar ai që zbuloi bromin, por bromi ai që zbuloi Balar."
Vetitë: në kushte normale, bromi është një lëng i trashë (dendësia 3,1055 g/cm3) i trashë në ngjyrë kafe të kuqe me erë të athët. Bromi është një nga substancat e thjeshta që janë të lëngshme në kushte normale (përveç bromit, një substancë tjetër e tillë është). Pika e shkrirjes së bromit është 7,25°C, pika e vlimit është +59,2°C. Potenciali standard i elektrodës Br 2 / Br në një tretësirë ujore është +1,065 V.
Në formë të lirë, ekziston në formën e molekulave diatomike Br 2. Një ndarje e dukshme e molekulave në atome vërehet në një temperaturë prej 800°C dhe rritet me shpejtësi me rritjen e mëtejshme të temperaturës. Diametri i molekulës Br 2 është 0,323 nm, distanca ndërbërthamore në këtë molekulë është 0,228 nm.
Bromi është pak, por më i tretshëm se halogjenët e tjerë në ujë (3,58 g në 100 g ujë në 20°C), tretësira quhet ujë bromi. Në ujin e bromit, një reagim ndodh me formimin e acideve hipobromike hidrobromike dhe të paqëndrueshme:
Br 2 + H 2 O = HBr + HBrO.
Bromi është i përzier në të gjitha aspektet me shumicën e tretësve organikë, dhe brominimi i molekulave të tretësit organik ndodh shpesh.
Për sa i përket aktivitetit kimik, bromi zë një pozicion të ndërmjetëm midis klorit (Cl) dhe jodit (I). Kur bromi reagon me tretësirat e jodeve, lirohet jodi i lirë (I):
Br 2 + 2KI = I 2 + 2KBr.
Bromi është një agjent i fortë oksidues, ai oksidon jonin e sulfitit në sulfat, jonin e nitritit në nitrat, etj.
Kur bashkëvepron me përbërjet organike që përmbajnë një lidhje të dyfishtë, bromi shton, duke dhënë derivatet përkatëse dibromo:
C 2 H 4 + Br 2 = C 2 H 4 Br 2.
Bromi gjithashtu lidhet me molekulat organike që përmbajnë një lidhje të trefishtë. Zbardhja e ngjyrës së ujit me brom kur kalon një gaz ose i shtohet një lëng, tregon se një përbërje e pangopur është e pranishme në gaz ose lëng.
Kur nxehet në prani të një katalizatori, bromi reagon me benzenin për të formuar bromobenzen C 6 H 5 Br (reaksion zëvendësimi).
Kur bromi reagon me tretësirat e alkalit dhe me tretësirat e karbonateve të natriumit (Na) ose kaliumit (K), formohen bromidet dhe bromatet përkatëse, për shembull:
Br 2 + 3Na 2 CO 3 = 5 NaBr + NaBrO 2 + 3CO 2.
Gjetja në natyrë: Bromi është një element mjaft i rrallë në koren e tokës. Përmbajtja e tij në të vlerësohet në 0,37·10 4% (afërsisht vendi i 50-të).
Kimikisht, bromi është shumë aktiv dhe për këtë arsye nuk gjendet në formë të lirë në natyrë. Është pjesë e një numri të madh përbërjesh të ndryshme (bromidet e natriumit (Na), kaliumi (K), magnezi (Mg), etj.) që shoqërojnë kloruret e natriumit, kaliumit dhe magnezit. Mineralet e brendshme të bromit bromargjirit (brom argjendi (Ag) AgBr) dhe emboliti (klorur i përzier dhe bromid argjendi (Ag)) janë jashtëzakonisht të rrallë. Burimi i bromit janë ujërat e liqeneve të hidhur, shëllirat e kripës që shoqërojnë vajin dhe depozitat e ndryshme të kripës, dhe uji i detit (65·10 4%), Deti i Vdekur është më i pasur me brom. Aktualisht, bromi nxirret zakonisht nga ujërat e disa liqeneve të hidhur, njëri prej të cilëve ndodhet, veçanërisht, në vendin tonë në stepën Kulunda (në Altai).
Aplikacion: bromi përdoret në përgatitjen e një numri substancash inorganike dhe organike në kiminë analitike. Komponimet e bromit përdoren si aditivë të karburantit, pesticide, retardantë flakë dhe në fotografi. Barnat që përmbajnë brom janë të njohura gjerësisht. Duhet të theksohet se shprehja e zakonshme: "mjeku ka përshkruar bromin një lugë gjelle pas ngrënies" do të thotë, natyrisht, vetëm se është përshkruar një zgjidhje ujore e bromit të natriumit (ose kaliumit), dhe jo brom i pastër. Efekti qetësues i barnave të bromit bazohet në aftësinë e tyre për të përmirësuar proceset e frenimit në sistemin nervor qendror.
Karakteristikat e punës me brom: Kur punoni me brom, duhet të përdorni veshje mbrojtëse, maskë gazi dhe doreza. MPC e avullit të bromit është 0,5 mg/m3. Tashmë në një përmbajtje bromi në ajër në një përqendrim prej rreth 0.001% (në vëllim), vërehen acarim të mukozave, marramendje, dhe në përqendrime më të larta - spazma të traktit respirator, mbytje. Nëse gëlltitet, doza toksike është 3 g, vdekjeprurëse nga 35 g. Në rast helmimi me avull bromi, viktima duhet të dërgohet menjëherë në ajër të pastër; për të rivendosur frymëmarrjen, mund të përdorni një shtupë të lagur me amoniak për një kohë të shkurtër, periodikisht. duke e sjellë në hundë për një kohë të shkurtër viktimën. Trajtimi i mëtejshëm duhet të kryhet nën mbikëqyrjen e një mjeku. Bromi i lëngshëm shkakton djegie të dhimbshme nëse bie në kontakt me lëkurën.
PËRKUFIZIM
Bromin ndodhet në periudhën e katërt të grupit VII të nëngrupit kryesor (A) të tabelës periodike.
I referohet elementeve fq-familjet. jo metalike. Emërtimi - Br. Numri serial - 35. Masa atomike relative - 79.904 amu.
Struktura elektronike e atomit të bromit
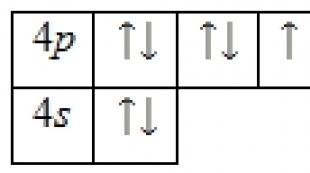
Atomi i bromit përbëhet nga një bërthamë e ngarkuar pozitivisht (+35), brenda së cilës ka 35 protone dhe 45 neutrone, dhe 35 elektrone lëvizin përreth në katër orbita.
Fig.1. Struktura skematike e atomit të bromit.
Shpërndarja e elektroneve midis orbitaleve është si më poshtë:
35Br) 2) 8) 18) 7 ;
1s 2 2s 2 2fq 6 3s 2 3fq 6 3d 10 4s 2 4fq 5 .
Niveli i jashtëm i energjisë i atomit të bromit përmban 7 elektrone, të cilat janë elektrone valente. Diagrami i energjisë i gjendjes bazë merr formën e mëposhtme:

Çdo elektron valence i një atomi bromi mund të karakterizohet nga një grup prej katër numrash kuantikë: n(kuantike kryesore), l(orbitale), m l(magnetike) dhe s(rrotullim):
|
Nënniveli |
||||
Prania e një elektroni të paçiftuar tregon se gjendja e oksidimit të bromit mund të jetë -1 ose +1. Meqenëse në nivelin e katërt ka orbitale të lira 4 d-nënnivel, atëherë atomi i bromit karakterizohet nga prania e një gjendje të ngacmuar:

Kjo është arsyeja pse bromi gjithashtu ka një gjendje oksidimi +3. Dihet se bromi në përbërjet e tij është gjithashtu i aftë të shfaqë gjendje oksidimi +5 dhe +7.
Shembuj të zgjidhjes së problemeve
SHEMBULL 1
| Ushtrimi | Elementi formon një përbërje të gaztë me hidrogjen që përmban 12.5% hidrogjen. Oksidi më i lartë i këtij elementi ka formulën RO 2. Tregoni numrin e elektroneve në shtresën elektronike të një atomi të këtij elementi. |
| Zgjidhje | Oksidet më të larta të përbërjes RO 2 formojnë elementë të vendosur në grupin IV të Tabelës Periodike. Elementet e këtij grupi formojnë komponime të paqëndrueshme me hidrogjen me përbërje RH 4. Le ta shënojmë elementin e dëshiruar si X. Atëherë pjesa masive e tij në përbërjen e përbërjes së hidrogjenit është e barabartë me: ω(X)=100 - 12,5 = 87,5%. Le të gjejmë masën atomike relative të këtij elementi: A r (X) = ω(X)× n(H)/ω(H) = 87,5×4/12,5 = 28. Siliconi (Si) e ka këtë masë atomike. Formulat e komponimeve të specifikuara në deklaratën e problemit do të duken kështu: SiO 2 dhe SiH 4. Numri i përgjithshëm i elektroneve në shtresën elektronike të një atomi silikoni është i barabartë me numrin e tij serial në Tabelën Periodike, d.m.th. 14. |
| Përgjigju | Numri i përgjithshëm i elektroneve në shtresën elektronike të një atomi silikoni është 14. |