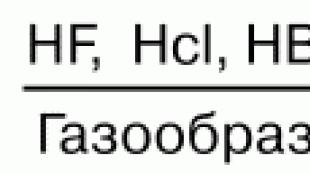ჰალოგენების ფიზიკური და ქიმიური თვისებები ნაერთების გამოყენებაში. ჰალოგენები და მათი ნაერთები. ჰალოგენური ნაერთები და მათი როლი ადამიანის ორგანიზმში
ჰალოგენები– VII ჯგუფის ელემენტები – ფტორი, ქლორი, ბრომი, იოდი, ასტატინი (რადიოაქტიურობის გამო ასტატინი ნაკლებად არის შესწავლილი). ჰალოგენები განსხვავებული არამეტალებია. მხოლოდ იოდს იშვიათ შემთხვევებში ავლენს ლითონების მსგავსი თვისებები.
აუგზნებულ მდგომარეობაში ჰალოგენის ატომებს აქვთ საერთო ელექტრონული კონფიგურაცია: ns2np5. ეს ნიშნავს, რომ ჰალოგენებს აქვთ 7 ვალენტური ელექტრონი, გარდა ფტორისა.
ჰალოგენების ფიზიკური თვისებები: F2 – უფერო, ძნელად თხევადი გაზი; Cl2 არის მოყვითალო-მომწვანო, ადვილად თხევადი გაზი მძაფრი მახრჩობელი სუნით; Br2 – წითელ-ყავისფერი სითხე; I2 არის იისფერი კრისტალური ნივთიერება.

წყალბადის ჰალოიდების წყალხსნარები წარმოქმნიან მჟავებს. HF – წყალბადის ფტორი (ფტორი); HCl – მარილწყალი (მარილი); НBr — წყალბადის ბრომიდი; HI - წყალბადის იოდიდი. მჟავების სიძლიერე მცირდება ზემოდან ქვემოდან. ჰალოგენირებული მჟავების სერიაში ყველაზე სუსტია ჰიდროფთორმჟავა, ხოლო ყველაზე ძლიერი ჰიდროიოდმჟავა. ეს აიხსნება იმით, რომ Hg-ის შებოჭვის ენერგია მცირდება ზემოდან. NG მოლეკულის სიძლიერე მცირდება იმავე მიმართულებით, რაც დაკავშირებულია ბირთვთაშორისი მანძილის ზრდასთან. ასევე მცირდება წყალში ოდნავ ხსნადი მარილების ხსნადობა:
მარცხნიდან მარჯვნივ, ჰალოიდების ხსნადობა მცირდება. AgF წყალში ძალიან ხსნადია. თავისუფალ მდგომარეობაში მყოფი ყველა ჰალოგენი არის ჟანგვის აგენტი. მათი, როგორც ჟანგვის აგენტების ძალა მცირდება ფტორიდან იოდამდე. კრისტალურ, თხევად და აირისებრ მდგომარეობებში ყველა ჰალოგენი არსებობს ცალკეული მოლეკულების სახით. ატომური რადიუსი იზრდება იმავე მიმართულებით, რაც იწვევს დნობისა და დუღილის წერტილების ზრდას. ფტორი იოდზე უკეთ იშლება ატომებად. ჰალოგენის ქვეჯგუფში გადაადგილებისას ელექტროდის პოტენციალი მცირდება. ფტორს აქვს ელექტროდის ყველაზე მაღალი პოტენციალი. ფტორი ყველაზე ძლიერი ჟანგვის აგენტია. ნებისმიერი უფრო მაღალი თავისუფალი ჰალოგენი ჩაანაცვლებს ქვედა ჰალოგენს, რომელიც იმყოფება ხსნარში უარყოფითად დატვირთული იონის მდგომარეობაში.
20. ქლორი. წყალბადის ქლორიდი და მარილმჟავა
ქლორი (Cl) -დგას მე-3 პერიოდში, პერიოდული სისტემის მთავარი ქვეჯგუფის VII ჯგუფში, სერიული ნომერი 17, ატომური მასა 35,453; ეხება ჰალოგენებს.
ფიზიკური თვისებები:ყვითელ-მწვანე გაზი მძაფრი სუნით. სიმკვრივე 3,214 გ/ლ; დნობის წერტილი -101 °C; დუღილის წერტილი -33,97 °C, ჩვეულებრივ ტემპერატურაზე ადვილად თხევდება 0,6 მპა წნევის ქვეშ. წყალში გახსნისას წარმოქმნის მოყვითალო ქლორის წყალს. ის ძალიან ხსნადია ორგანულ გამხსნელებში, განსაკუთრებით ჰექსანში (C6H14) და ნახშირბადის ტეტრაქლორიდში.
ქლორის ქიმიური თვისებები:ელექტრონული კონფიგურაცია: 1s22s22p63s22p5. გარე დონეზე არის 7 ელექტრონი. დონის დასასრულებლად გჭირდებათ 1 ელექტრონი, რომელსაც ქლორი იღებს და ავლენს ჟანგვის მდგომარეობას -1. ასევე არსებობს ქლორის დადებითი დაჟანგვის მდგომარეობები + 7-მდე. ცნობილია ქლორის შემდეგი ოქსიდები: Cl2O, ClO2, Cl2O6 და Cl2O7. ისინი ყველა არასტაბილურია. ქლორი არის ძლიერი ჟანგვის აგენტი. ის უშუალოდ რეაგირებს ლითონებთან და არალითონებთან:
რეაგირებს წყალბადთან. ნორმალურ პირობებში რეაქცია მიმდინარეობს ნელა, ძლიერი გათბობით ან განათებით - აფეთქებით, ჯაჭვის მექანიზმის მიხედვით:
![]()
ქლორი ურთიერთქმედებს ტუტე ხსნარებთან, წარმოქმნის მარილებს - ჰიპოქლორიტებს და ქლორიდებს:
როდესაც ქლორი გადადის ტუტე ხსნარში, იქმნება ქლორიდის და ჰიპოქლორიტის ხსნარების ნარევი:
ქლორი არის შემამცირებელი საშუალება: Cl2 + 3F2 = 2ClF3.
წყალთან ურთიერთქმედება:
ქლორი პირდაპირ არ რეაგირებს ნახშირბადთან, აზოტთან და ჟანგბადთან.
ქვითარი: 2NaCl + F2 = 2NaF + Cl2.
ელექტროლიზი: 2NaCl + 2H2O = Cl2 + H2 + 2NaOH.
ბუნებაში აღმოჩენა:შეიცავს შემდეგ მინერალებს: ჰალიტი (კლდის მარილი), სილვიტი, ბიშოფიტი; ზღვის წყალი შეიცავს ნატრიუმის, კალიუმის, მაგნიუმის და სხვა ელემენტების ქლორიდებს.
წყალბადის ქლორიდი HCl. ფიზიკური თვისებები:უფერო გაზი, ჰაერზე მძიმე, წყალში ძლიერ ხსნადი მარილმჟავას წარმოქმნით.
ქვითარი:ლაბორატორიაში:
მრეწველობაში: წყალბადი იწვება ქლორის ნაკადში. შემდეგ წყალბადის ქლორიდი იხსნება წყალში მარილმჟავას წარმოქმნით (იხ. ზემოთ).
ქიმიური თვისებები: მარილმჟავა ძლიერია, ერთფუძიანი, ურთიერთქმედებს ლითონებთან ძაბვის სერიაში წყალბადამდე: Zn + 2HCl = ZnCl2 + H2.
როგორც შემცირების აგენტი, ის რეაგირებს მრავალი ლითონის ოქსიდებთან და ჰიდროქსიდებთან.
ელემენტების ქიმია
VIIA ქვეჯგუფის არამეტალები
VIIA ქვეჯგუფის ელემენტები ტიპიური არამეტალებია მაღალი
ელექტრონეგატიურობა, მათ აქვთ ჯგუფის სახელი - "ჰალოგენები".
ლექციაში განხილული ძირითადი საკითხები
VIIA ქვეჯგუფის არალითონების ზოგადი მახასიათებლები. ელექტრონული სტრუქტურა, ატომების ყველაზე მნიშვნელოვანი მახასიათებლები. ყველაზე დამახასიათებელი სტე-
ჟანგვის ჯარიმები. ჰალოგენების ქიმიის თავისებურებები.
მარტივი ნივთიერებები.
ბუნებრივი ნაერთები.
ჰალოგენური ნაერთები
ჰიდროჰალიუმის მჟავები და მათი მარილები. მარილი და ჰიდროფთორმჟავა
სლოტები, ქვითარი და განაცხადი.
ჰალიდის კომპლექსები.
ჰალოგენების ორობითი ჟანგბადის ნაერთები. არასტაბილურობა დაახლ.
მარტივი ნივთიერებების რედოქს თვისებები და თანა
ერთობები. არაპროპორციული რეაქციები. ლატიმერის დიაგრამები.
შემსრულებელი: |
ღონისძიება No. |
||||||||||||||||

VIIA ქვეჯგუფის ელემენტების ქიმია
ზოგადი მახასიათებლები
მანგანუმი |
||||||||
ტექნეციუმი |
||||||||
VIIA-ჯგუფი იქმნება p-ელემენტებით: ფტორი F, ქლორი
Cl, ბრომი Br, იოდი I და ატატინი At.
ვალენტური ელექტრონების ზოგადი ფორმულა არის ns 2 np 5.
VIIA ჯგუფის ყველა ელემენტი ტიპიური არალითონია.
როგორც განაწილებიდან ჩანს |
|||||||
ვალენტური ელექტრონები |
|||||||
ატომების ორბიტალების მიხედვით |
მხოლოდ ერთი ელექტრონი აკლია |
||||||
ჩამოყალიბდეს სტაბილური რვაელექტრონული გარსი
ყუთები, ამიტომ აქვთარსებობს ძლიერი ტენდენცია
ელექტრონის დამატება.
ყველა ელემენტი ადვილად ქმნის უბრალო ერთჯერადი დამუხტვით
ny ანიონები G – .
მარტივი ანიონების სახით, VIIA ჯგუფის ელემენტები გვხვდება ბუნებრივ წყალში და ბუნებრივი მარილების კრისტალებში, მაგალითად, ჰალიტი NaCl, სილვიტი KCl, ფლუორიტი.
CaF2.
ელემენტების ზოგადი ჯგუფის სახელი VIIA-
ჯგუფი "ჰალოგენები", ანუ "მარილების დაბადება", განპირობებულია იმით, რომ ლითონებთან მათი ნაერთების უმეტესობა წინასწარ
არის ტიპიური მარილი (CaF2, NaCl, MgBr2, KI), რომელიც
რომლის მიღება შესაძლებელია პირდაპირი ურთიერთქმედების გზით
ლითონის ურთიერთქმედება ჰალოგენთან. თავისუფალი ჰალოგენები მიიღება ბუნებრივი მარილებისგან, ამიტომ სახელი "ჰალოგენები" ასევე ითარგმნება როგორც "მარილებისგან დაბადებული".
შემსრულებელი: |
ღონისძიება No. |
||||||||||||||||

მინიმალური დაჟანგვის მდგომარეობა (–1) ყველაზე სტაბილურია
ყველა ჰალოგენისთვის.
მოცემულია VIIA ჯგუფის ელემენტების ატომების ზოგიერთი მახასიათებელი
VIIA ჯგუფის ელემენტების ატომების ყველაზე მნიშვნელოვანი მახასიათებლები
ნათესავი - |
აფინურობა |
||||||
ელექტრო |
|||||||
უარყოფითი |
იონიზაცია, |
||||||
არსი (შესაბამისად |
|||||||
გამოკითხვა) |
|||||||
რაოდენობის გაზრდა |
|||||||
ელექტრონული ფენები; |
|||||||
ზომის გაზრდა |
|||||||
ელექტროენერგიის შემცირება |
|||||||
სამმაგი ნეგატივი |
ჰალოგენებს აქვთ ელექტრონის მაღალი აფინურობა (მაქსიმალური at
Cl) და ძალიან მაღალი იონიზაციის ენერგია (მაქსიმალური F-ზე) და მაქსიმალური
შესაძლო ელექტრონეგატიურობა თითოეულ პერიოდში. ფტორი ყველაზე მეტია
ყველა ქიმიური ელემენტის ელექტროუარყოფითი.
ჰალოგენის ატომებში ერთი დაუწყვილებელი ელექტრონის არსებობა განსაზღვრავს
წარმოადგენს მარტივ ნივთიერებებში ატომების გაერთიანებას დიატომურ მოლეკულებად Г2.
მარტივი ნივთიერებებისთვის, ჰალოგენებისთვის, ყველაზე დამახასიათებელი ჟანგვის აგენტებია
თვისებები, რომლებიც ყველაზე ძლიერია F2-ში და სუსტდება I2-ზე გადასვლისას.
ჰალოგენებს ახასიათებთ ყველა არამეტალური ელემენტის უდიდესი რეაქტიულობა. ფტორი, თუნდაც ჰალოგენებს შორის, გამოირჩევა
აქვს ძალიან მაღალი აქტივობა.
მეორე პერიოდის ელემენტი, ფტორი, ყველაზე ძლიერ განსხვავდება მეორისგან
ქვეჯგუფის სხვა ელემენტები. ეს არის ზოგადი ნიმუში ყველა არალითონისთვის.
შემსრულებელი: |
ღონისძიება No. |
||||||||||||||||
ფტორი, როგორც ყველაზე ელექტროუარყოფითი ელემენტი, არ აჩვენებს სექსს
რეზიდენტური ჟანგვის მდგომარეობები. ნებისმიერ კავშირში, მათ შორის კი-
ჟანგბადი, ფტორი ჟანგვის მდგომარეობაშია (-1).
ყველა სხვა ჰალოგენი ავლენს ჟანგვის დადებით ხარისხს
ლენია მაქსიმუმ +7-მდე.
ჰალოგენების ყველაზე დამახასიათებელი ჟანგვის მდგომარეობები:
F: -1, 0;
Cl, Br, I: -1, 0, +1, +3, +5, +7.
Cl-ს აქვს ცნობილი ოქსიდები, რომლებშიც ის გვხვდება ჟანგვის მდგომარეობებში: +4 და +6.
ყველაზე მნიშვნელოვანი ჰალოგენური ნაერთები, დადებით მდგომარეობებში,
ჟანგვის ჯარიმებია ჟანგბადის შემცველი მჟავები და მათი მარილები.
ყველა ჰალოგენური ნაერთი დადებითი ჟანგვის მდგომარეობაშია
არის ძლიერი ჟანგვის აგენტები.
ჟანგვის საშინელი ხარისხი.დისპროპორციულობას ხელს უწყობს ტუტე გარემო.
მარტივი ნივთიერებებისა და ჟანგბადის ნაერთების პრაქტიკული გამოყენება
ჰალოგენების შემცირება ძირითადად გამოწვეულია მათი ჟანგვის ეფექტით.
უმარტივესი ნივთიერებები, Cl2, პოულობენ ყველაზე ფართო პრაქტიკულ გამოყენებას.
და F2. ქლორისა და ფტორის ყველაზე დიდი რაოდენობა ინდუსტრიაში მოიხმარება
ორგანული სინთეზი: პლასტმასის, მაცივრების, გამხსნელების წარმოებაში,
პესტიციდები, წამლები. ქლორისა და იოდის მნიშვნელოვანი რაოდენობა გამოიყენება ლითონების მისაღებად და მათი გადამუშავებისთვის. ასევე გამოიყენება ქლორი
ცელულოზის გასათეთრებლად, სასმელი წყლის დეზინფექციისთვის და წარმოებაში
მათეთრებელი და მარილმჟავას წყალი. ასაფეთქებელი ნივთიერებების წარმოებაში გამოიყენება ოქსომჟავების მარილები.
შემსრულებელი: |
ღონისძიება No. |
||||||||||||||||

მჟავები - ჰიდროქლორინის და გამდნარი მჟავები - ფართოდ გამოიყენება პრაქტიკაში.
ფტორი და ქლორი ოც ყველაზე გავრცელებულ ელემენტს შორისაა
იქ ბუნებაში გაცილებით ნაკლებია ბრომი და იოდი. ყველა ჰალოგენი ბუნებაში გვხვდება ჟანგვის მდგომარეობაში(-1). მხოლოდ იოდი გვხვდება მარილის KIO3 სახით,
რომელიც მინარევად შედის ჩილეურ მარილიანში (KNO3).
ასტატინი არის ხელოვნურად წარმოებული რადიოაქტიური ელემენტი (ის ბუნებაში არ არსებობს). At-ის არასტაბილურობა აისახება სახელში, რომელიც ბერძნულიდან მოდის. "astatos" - "არასტაბილური". ასტატინი არის მოსახერხებელი ემიტერი კიბოს სიმსივნეების რადიოთერაპიისთვის.
მარტივი ნივთიერებები
ჰალოგენების მარტივი ნივთიერებები წარმოიქმნება დიატომური მოლეკულებით G2.
მარტივ ნივთიერებებში, F2-დან I2-ზე გადასვლისას ელექტრონების რაოდენობის ზრდით
ტახტის შრეები და ატომების პოლარიზებადობის ზრდა, მატულობს
ინტერმოლეკულური ურთიერთქმედება, რაც იწვევს აგრეგატის კო-
სტანდარტულ პირობებში დგომა.
ფტორი (ნორმალურ პირობებში) ყვითელი აირია, -181o C-ზე გადაიქცევა
თხევადი მდგომარეობა.
ქლორი არის მოყვითალო-მწვანე გაზი, რომელიც გადაიქცევა სითხეში -34oC-ზე.
სახელწოდება Cl უკავშირდება მას, ის მოდის ბერძნულიდან "chloros" - "ყვითელი-
მწვანე". Cl2-ის დუღილის მკვეთრი ზრდა F2-თან შედარებით,
მიუთითებს გაზრდილი ინტერმოლეკულური ურთიერთქმედების შესახებ.
ბრომი მუქი წითელი, ძალიან აქროლადი სითხეა, დუღს 58,8oC-ზე.
ელემენტის სახელწოდება უკავშირდება გაზის მკვეთრ უსიამოვნო სუნს და მომდინარეობს
"bromos" - "სუნიანი".
იოდი - მუქი მეწამული კრისტალები, სუსტი "მეტალიკით"
სიმსივნეები, რომლებიც გაცხელებისას ადვილად სუბლიმდება, წარმოქმნის იისფერ ორთქლს;
სწრაფი გაგრილებით |
ორთქლი 114o C-მდე |
იქმნება სითხე. ტემპერატურა |
|||||||||||||||||
შემსრულებელი: |
ღონისძიება No. |
||||||||||||||||||
იოდის დუღილის წერტილი არის 183 ° C. მისი სახელი მოდის იოდის ორთქლის ფერიდან -
"იოდოსი" - "იისფერი".
ყველა მარტივ ნივთიერებას აქვს მკვეთრი სუნი და შხამიანია.
მათი ორთქლების შესუნთქვა იწვევს ლორწოვანი გარსების და სასუნთქი ორგანოების გაღიზიანებას, ხოლო მაღალი კონცენტრაციის დროს – დახრჩობას. პირველი მსოფლიო ომის დროს ქლორი გამოიყენებოდა როგორც მომწამვლელი.
ფტორი და თხევადი ბრომი იწვევს კანის დამწვრობას. ჰა-თან მუშაობა
ლოგინს, სიფრთხილის ზომები უნდა იქნას მიღებული.
ვინაიდან ჰალოგენების მარტივი ნივთიერებები წარმოიქმნება არაპოლარული მოლეკულებით
გაცივდება, ისინი კარგად იხსნება არაპოლარულ ორგანულ გამხსნელებში:
ალკოჰოლი, ბენზოლი, ნახშირბადის ტეტრაქლორიდი და ა.შ. ქლორი, ბრომი და იოდი ნაკლებად ხსნადია წყალში, მათ წყალხსნარებს ეწოდება ქლორი, ბრომი და იოდიანი წყალი. Br2 იხსნება უკეთესად, ვიდრე სხვები, ბრომის კონცენტრაცია სატ.
ხსნარი აღწევს 0,2 მოლ/ლ, ხოლო ქლორი – 0,1 მოლ/ლ.
ფტორი ანადგურებს წყალს:
2F2 + 2H2 O = O2 + 4HF
ჰალოგენები ავლენენ მაღალ ჟანგვის აქტივობას და გარდამავალს
ჰალოიდურ ანიონებად.
Г2 + 2e– 2Г–
ფტორს აქვს განსაკუთრებით მაღალი ჟანგვითი აქტივობა. ფტორი ჟანგავს კეთილშობილ ლითონებს (Au, Pt).
Pt + 3F2 = PtF6
ის კი ურთიერთქმედებს ზოგიერთ ინერტულ აირთან (კრიპტონთან,
ქსენონი და რადონი), მაგალითად,
Xe + 2F2 = XeF4
ბევრი ძალიან სტაბილური ნაერთი იწვის F2 ატმოსფეროში, მაგ.
წყალი, კვარცი (SiO2).
SiO2 + 2F2 = SiF4 + O2
შემსრულებელი: |
ღონისძიება No. |
||||||||||||||||

ფტორთან რეაქციებში, ისეთი ძლიერი ჟანგვის აგენტებიც კი, როგორიცაა აზოტი და გოგირდი
ნიკის მჟავა მოქმედებს როგორც შემამცირებელი აგენტი, ხოლო ფტორი ჟანგავს შეყვანას
მათ შემადგენლობაში O(–2) შემცველი.
2HNO3 + 4F2 = 2NF3 + 2HF + 3O2 H2 SO4 + 4F2 = SF6 + 2HF + 2O2
F2-ის მაღალი რეაქტიულობა ქმნის სირთულეებს კონ-
სტრუქტურული მასალები მასთან მუშაობისთვის. ჩვეულებრივ ამ მიზნებისთვის ვიყენებთ
არსებობს ნიკელი და სპილენძი, რომლებიც ჟანგვის დროს ქმნიან ფტორის მკვრივ დამცავ ფენებს მათ ზედაპირზე. სახელწოდება F გამოწვეულია მისი აგრესიული მოქმედებით.
ვჭამ, ბერძნულიდან მოდის. "ფლოროსი" - "დესტრუქციული".
F2, Cl2, Br2, I2 სერიებში, ჟანგვის უნარი სუსტდება გაზრდის გამო.
ატომების ზომის გაზრდა და ელექტრონეგატიურობის შემცირება.
წყალხსნარებში, მატერიის ჟანგვითი და აღდგენითი თვისებები
ნივთიერებები ჩვეულებრივ ხასიათდება ელექტროდის პოტენციალის გამოყენებით. ცხრილი გვიჩვენებს სტანდარტული ელექტროდის პოტენციალს (Eo, V) შემცირების ნახევარრეაქციისთვის
ჰალოგენების ფორმირება. შედარებისთვის, Eo მნიშვნელობა ki-სთვის
ნახშირბადი ყველაზე გავრცელებული ჟანგვის აგენტია.
სტანდარტული ელექტროდების პოტენციალი მარტივი ჰალოგენური ნივთიერებებისთვის
Eo, B, რეაქციისთვის |
|||||||||||||
O2 + 4e– + 4H+ 2H2 O |
|||||||||||||
ეო, ვ |
|||||||||||||
ელექტროდისთვის |
|||||||||||||
2Г– +2е – = Г2 |
|||||||||||||
შემცირებული ჟანგვითი აქტივობა
როგორც ცხრილიდან ჩანს, F2 არის ბევრად უფრო ძლიერი ჟანგვის აგენტი,
ვიდრე O2, ამიტომ F2 არ არსებობს წყალხსნარებში ის აჟანგებს წყალს,
F–მდე აღდგენა. თუ ვიმსჯელებთ Eo მნიშვნელობით, Cl2-ის ჟანგვის უნარი
შემსრულებელი: |
ღონისძიება No. |
||||||||||||||||
ასევე უფრო მაღალია ვიდრე O2. მართლაც, ქლორის წყლის გრძელვადიანი შენახვის დროს ის იშლება ჟანგბადის გამოყოფით და HCl-ის წარმოქმნით. მაგრამ რეაქცია ნელია (Cl2 მოლეკულა შესამჩნევად უფრო ძლიერია ვიდრე F2 მოლეკულა და
ქლორთან რეაქციების გააქტიურების ენერგია უფრო მაღალია), დისპრო-
პორცია:
Cl2 + H2 O HCl + HOCl
წყალში ის ბოლომდე არ აღწევს (K = 3,9 . 10–4), ამიტომ Cl2 არსებობს წყალხსნარებში. Br2 და I2 ხასიათდება კიდევ უფრო დიდი სტაბილურობით წყალში.
დისპროპორციულობა ძალიან დამახასიათებელი ჟანგვითია
შემცირების რეაქცია ჰალოგენებისთვის. გაძლიერების დისპროპორციულობა
ასხამს ტუტე გარემოში.
Cl2-ის დისპროპორციულობა ტუტეში იწვევს ანიონების წარმოქმნას
Cl– და ClO–. დისპროპორციულობის მუდმივი არის 7.5. 1015 წ.
Cl2 + 2NaOH = NaCl + NaClO + H2O
როდესაც იოდი არაპროპორციულია ტუტეში, წარმოიქმნება I– და IO3–. ანა-
ლოგიკურად, Br2 არაპროპორციულად მოქმედებს იოდზე. პროდუქტის შეცვლა არაპროპორციულია
ერი განპირობებულია იმით, რომ Br და I-ში ანიონები GO– და GO2– არასტაბილურია.
ქლორის დისპროპორციაციის რეაქცია გამოიყენება ინდუსტრიაში
ძლიერი და სწრაფი მოქმედების ჰიპოქლორიტის ოქსიდიზატორის მიღების უნარი,
მათეთრებელი ცაცხვი, ბერტოლეტის მარილი.
3Cl2 + 6 KOH = 5KCl + KClO3 + 3H2 O
შემსრულებელი: |
ღონისძიება No. |
||||||||||||||||
ჰალოგენების ურთიერთქმედება მეტალებთან
ჰალოგენები ენერგიულად რეაგირებენ ბევრ მეტალთან, მაგალითად:
Mg + Cl2 = MgCl2 Ti + 2I2 TiI4
Na + ჰალოიდები, რომლებშიც ლითონს აქვს დაბალი ჟანგვის მდგომარეობა (+1, +2),
- ეს არის მარილის მსგავსი ნაერთები უპირატესად იონური ბმებით. Როგორ
აი, იონური ჰალოიდები არის მყარი დნობის მაღალი წერტილით
ლითონის ჰალოიდები, რომლებშიც ლითონს აქვს დაჟანგვის მაღალი ხარისხი
თიონები არის ნაერთები უპირატესად კოვალენტური ბმებით.
ბევრი მათგანი არის აირები, სითხეები ან დნობადი მყარი ნივთიერებები ნორმალურ პირობებში. მაგალითად, WF6 არის გაზი, MoF6 არის თხევადი,
TiCl4 არის თხევადი.
ჰალოგენების ურთიერთქმედება არალითონებთან
ჰალოგენები უშუალოდ ურთიერთქმედებენ ბევრ არამეტალთან:
წყალბადი, ფოსფორი, გოგირდი და ა.შ. მაგალითად:
H2 + Cl2 = 2HCl 2P + 3Br2 = 2PBr3 S + 3F2 = SF6
არამეტალის ჰალოგენებში კავშირი უპირატესად კოვალენტურია.
როგორც წესი, ამ ნაერთებს აქვთ დაბალი დნობის და დუღილის წერტილები.
ფთორიდან იოდზე გადასვლისას ჰალოიდების კოვალენტური ბუნება იზრდება.
ტიპიური არამეტალების კოვალენტური ჰალოგენები მჟავე ნაერთებია; წყალთან ურთიერთობისას ისინი ჰიდროლიზდებიან მჟავების წარმოქმნით. Მაგალითად:
PBr3 + 3H2 O = 3HBr + H3 PO3
PI3 + 3H2 O = 3HI + H3 PO3
PCl5 + 4H2 O = 5HCl + H3 PO4
შემსრულებელი: |
ღონისძიება No. |
||||||||||||||||

პირველი ორი რეაქცია გამოიყენება ბრომისა და წყალბადის იოდიდის წარმოებისთვის.
ნოინის მჟავა.
ინტერჰალიდები. ჰალოგენები, ერთმანეთთან შერწყმით, ქმნიან ინტერგ-
იწვევს. ამ ნაერთებში, უფრო მსუბუქი და ელექტროუარყოფითი ჰალოგენი იმყოფება (–1) დაჟანგვის მდგომარეობაში, ხოლო მძიმე – დადებით მდგომარეობაში.
ჟანგვის ჯარიმები.
გაცხელებისას ჰალოგენების უშუალო ურთიერთქმედების გამო მიიღება: ClF, BrF, BrCl, ICl. ასევე არსებობს უფრო რთული ინტერჰალიდები:
ClF3, BrF3, BrF5, IF5, IF7, ICl3.
ყველა ინტერჰალიდი ნორმალურ პირობებში არის თხევადი ნივთიერებები დაბალი დუღილის წერტილებით. ინტერჰალიდებს აქვთ მაღალი ჟანგვითი აქტივობა
აქტივობა. მაგალითად, ქიმიურად სტაბილური ნივთიერებები, როგორიცაა SiO2, Al2 O3, MgO და ა.შ. იწვის ClF3 ორთქლებში.
2Al2 O3 + 4ClF3 = 4 AlF3 + 3O2 + 2Cl2
ფტორი ClF 3 არის აგრესიული ფტორირებადი რეაგენტი, რომელიც სწრაფად მოქმედებს
ეზო F2. იგი გამოიყენება ორგანულ სინთეზებში და ნიკელის აღჭურვილობის ზედაპირზე დამცავი ფილმების მისაღებად ფტორთან მუშაობისთვის.
წყალში ინტერჰალიდები ჰიდროლიზდება მჟავების წარმოქმნით. Მაგალითად,
ClF5 + 3H2 O = HClO3 + 5HF
ჰალოგენები ბუნებაში. მარტივი ნივთიერებების მიღება
ინდუსტრიაში ჰალოგენები მიიღება მათი ბუნებრივი ნაერთებისგან. ყველა
თავისუფალი ჰალოგენების მიღების პროცესები ეფუძნება ჰალოგენის დაჟანგვას
ნიდ იონები.
2Г – Г2 + 2e–
ჰალოგენების მნიშვნელოვანი რაოდენობა გვხვდება ბუნებრივ წყლებში ანიონების სახით: Cl–, F–, Br–, I–. ზღვის წყალი შეიძლება შეიცავდეს 2,5%-მდე NaCl-ს.
ბრომი და იოდი მიიღება ნავთობის ჭაბურღილის წყლისა და ზღვის წყლისგან.
შემსრულებელი: |
ღონისძიება No. |
||||||||||||||||
ჰალოგენები ფტორი F, ქლორი C1, ბრომი Br, იოდი I არის VILA ჯგუფის ელემენტები. ჰალოგენის ატომების ვალენტური გარსის ელექტრონული კონფიგურაცია ძირითად მდგომარეობაში ns 2 np 5 .გარე p ორბიტალში ხუთი ელექტრონის არსებობა, მათ შორის ერთი დაუწყვილებელი, არის ჰალოგენების ელექტრონის მაღალი აფინურობის მიზეზი. ელექტრონის დამატება იწვევს ჰალოგენური ანიონების (F-, Cl-, Br-, I-) წარმოქმნას უახლოესი კეთილშობილი გაზის სტაბილური 8-ელექტრონული გარსით. ჰალოგენები განსხვავებული არამეტალებია.
ყველაზე ელექტროუარყოფით ელემენტს, ფტორს, აქვს მხოლოდ ერთი დაჟანგვის მდგომარეობა ნაერთებში - 1, რადგან ის ყოველთვის არის ელექტრონების მიმღები. ნაერთების სხვა ჰალოგენებს შეიძლება ჰქონდეთ ჟანგვის მდგომარეობა, რომელიც მერყეობს -1-დან +7-მდე. ჰალოგენების დადებითი დაჟანგვის მდგომარეობები გამოწვეულია მათი ვალენტური ელექტრონების გარე დონის თავისუფალ d-ორბიტალებზე გადასვლით (ნაწილი 2.1.3) უფრო ელექტროუარყოფით ელემენტებთან ბმების ფორმირებისას.
ჰალოგენის მოლეკულები დიატომურია: F 2, C1 2, Br 2, I 2. სტანდარტულ პირობებში, ფტორი და ქლორი არის აირები, ბრომი არის აქროლადი სითხე (Tbp = 59 °C), ხოლო იოდი არის მყარი, მაგრამ ის ადვილად ამაღლდება (გარდაიქმნება თხევადი მდგომარეობის გვერდის ავლით).
რედოქსის თვისებები.ჰალოგენები არის ძლიერი ჟანგვის აგენტები, რომლებიც რეაგირებენ თითქმის ყველა ლითონთან და ბევრ არამეტალთან:
ფტორი ავლენს განსაკუთრებით მაღალ ქიმიურ აქტივობას, რომელიც გაცხელებისას რეაგირებს თუნდაც კეთილშობილ აირებთან ქსენონთან, კრიპტონთან და რადონთან:
![]()
ჰალოგენების ქიმიური აქტივობა მცირდება ფტორიდან იოდამდე, ვინაიდან ატომური რადიუსის მატებასთან ერთად მცირდება ჰალოგენების ელექტრონების მიმაგრების უნარი:

რაც უფრო აქტიურია ჰალოგენი ყოველთვის ანაცვლებს ნაკლებად აქტიურს ლითონებთან მისი ნაერთებისგან. ამრიგად, ფტორი ანაცვლებს ყველა სხვა ჰალოგენს მათი ჰალოგენებისგან, ხოლო ბრომი ანაცვლებს მხოლოდ იოდს იოდიდებისგან:
ჰალოგენების განსხვავებული ჟანგვითი თვისებები სხეულზე მათ ზემოქმედებაშიც ვლინდება. აირისებრი ქლორი და ფტორი, მათი ძალიან ძლიერი ჟანგვის თვისებების გამო, ძლიერი ტოქსიკური ნივთიერებებია, რომლებიც ძლიერ აზიანებენ ფილტვებს და თვალების, ცხვირის და ხორხის ლორწოვან გარსებს. იოდი არის უფრო რბილი ჟანგვის აგენტი, რომელიც ავლენს ანტისეპტიკურ თვისებებს, ამიტომ ფართოდ გამოიყენება მედიცინაში.
ჰალოგენების რედოქს თვისებებში განსხვავებები ასევე ჩნდება წყალთან ურთიერთქმედებისას. ფტორი ჟანგავს წყალს, შემცირების აგენტი არის წყლის მოლეკულის ჟანგბადის ატომი:
სხვა ჰალოგენების წყალთან ურთიერთქმედება თან ახლავს მათი ატომების რედოქს დისმუტაციას. ამრიგად, როდესაც ქლორი რეაგირებს წყალთან, ქლორის მოლეკულის ერთ-ერთი ატომი, რომელიც იძენს ელექტრონს სხვა ატომიდან, მცირდება, ხოლო მეორე ქლორის ატომი, რომელიც ტოვებს ელექტრონს, იჟანგება. ეს ქმნის ქლორიანი წყალი,შეიცავს წყალბადის ქლორიდს (ჰიდროქლორინის მჟავას) და ჰიპოქლორულ (ჰიპოქლორმჟავას):
რეაქცია შექცევადია და მისი წონასწორობა ძლიერად არის გადატანილი მარცხნივ. ჰიპოქლორის მჟავა არასტაბილურია და ადვილად იშლება, განსაკუთრებით შუქზე, ძალიან ძლიერი ჟანგვის აგენტის - ატომური ჟანგბადის წარმოქმნით:
ამრიგად, ქლორის წყალი სხვადასხვა კონცენტრაციაში შეიცავს სამ ჟანგვის აგენტს სხვადასხვა ჟანგვის უნარით: მოლეკულურ ქლორს, ჰიპოქლორმჟავას და ატომურ ჟანგბადს, რომელთა ჯამს ხშირად ე.წ. "აქტიური ქლორი".
შედეგად მიღებული ატომური ჟანგბადი ათეთრებს საღებავებს და კლავს მიკრობებს, რაც განმარტავს ქლორის წყლის მათეთრებელ და ბაქტერიციდულ ეფექტს.
ჰიპოქლორის მჟავა უფრო ძლიერი ჟანგვის აგენტია, ვიდრე ქლორის აირი. ის რეაგირებს ორგანულ ნაერთებთან RH როგორც ჟანგვის აგენტი და როგორც ქლორირებადი რეაგენტი:
ამიტომ, როდესაც სასმელი წყალი, რომელიც შეიცავს ორგანულ ნივთიერებებს, როგორც მინარევები ქლორირებულია, ისინი შეიძლება გადაიქცეს უფრო ტოქსიკურ ორგანულ ქლორურ ნაერთებად RC1. ეს აუცილებლად გასათვალისწინებელია წყლის გაწმენდის მეთოდების შემუშავებისას და მათი გამოყენებისას.
როდესაც ტუტე ემატება ქლორის წყალს, წონასწორობა გადადის მარჯვნივ ჰიპოქლორის და მარილმჟავების ნეიტრალიზაციის გამო:
მარილების ნარევის შედეგად მიღებული ხსნარი ე.წ ჯაველის წყალი,გამოიყენება როგორც გაუფერულება და სადეზინფექციო საშუალება. ეს თვისებები განპირობებულია იმით, რომ კალიუმის ჰიპოქლორიტი CO2 + H 2 0 გავლენის ქვეშ და ჰიდროლიზის შედეგად გარდაიქმნება არასტაბილურ ჰიპოქლორმჟავად, წარმოქმნის ატომურ ჟანგბადს. შედეგად ჯაველის წყალი ანადგურებს საღებავებს და კლავს მიკრობებს.
როდესაც აირისებრი ქლორი მოქმედებს სველ ჩამქრალ კირზე Ca(OH) 2, მიიღება CaCl 2 და Ca(0C1) 2 მარილების ნარევი, ე.წ. გაუფერულება:
კირის ქლორიდი შეიძლება ჩაითვალოს ჰიდროქლორინის და ჰიპოქლორის მჟავების შერეულ კალციუმის მარილად CaCl(OCl). ტენიან ჰაერში, მათეთრებელი, წყალთან და ნახშირორჟანგთან ურთიერთქმედებით, თანდათანობით გამოყოფს ჰიპოქლორმჟავას, რომელიც უზრუნველყოფს მის მათეთრებელ, სადეზინფექციო და გაზგამტარ თვისებებს:
როდესაც გაუფერულება ექვემდებარება მარილმჟავას, თავისუფალი ქლორი გამოიყოფა:
გაცხელებისას ჰიპოქლორის მჟავა იშლება რედოქსის დისპროპორციულობის შედეგად ჰიდროქლორინის და პერქლორინის მჟავების წარმოქმნით:
![]()
როდესაც ქლორი გადადის ცხელ ტუტე ხსნარში, როგორიცაა KOH, წარმოიქმნება კალიუმის ქლორიდი და კალიუმის ქლორატი KClO 3 (ბერტოლეტის მარილი):
ჟანგბადის შემცველი ქლორის მჟავების ანიონების ჟანგვის უნარი წყალხსნარებში СlO - - СlO4(-) სერიებში მცირდება მათში ქლორის დაჟანგვის ხარისხის ზრდის მიუხედავად:
![]()
ეს აიხსნება ამ სერიაში ანიონების სტაბილურობის ზრდით მათი უარყოფითი მუხტის გაზრდილი დელოკალიზაციის გამო. ამავდროულად, LiC10 4 და KClO 4 პერქლორატები მშრალ მდგომარეობაში მაღალ ტემპერატურაზე არის ძლიერი ჟანგვის აგენტები და გამოიყენება სხვადასხვა ბიომასალის მინერალიზაციისთვის მათში შემავალი არაორგანული კომპონენტების განსაზღვრისას.
ჰალოგენურ ანიონებს (გარდა F-ისა) შეუძლიათ ელექტრონების დონაცია, ამიტომ ისინი შემცირების აგენტები არიან. მათი რადიუსის მატებასთან ერთად, ჰალორიდის ანიონების შემცირების უნარი იზრდება ქლორიდის ანიონიდან იოდიდის ანიონამდე:

ამრიგად, ჰიდროიოდური მჟავა იჟანგება ატმოსფერული ჟანგბადით უკვე ნორმალურ ტემპერატურაზე:
![]()
მარილმჟავა არ იჟანგება ჟანგბადით და, შესაბამისად, ქლორიდის ანიონი სტაბილურია სხეულის პირობებში, რაც ძალზე მნიშვნელოვანია ფიზიოლოგიისა და მედიცინის თვალსაზრისით.
მჟავა-ტუტოვანი თვისებები.წყალბადის ჰალოიდები HF, HC1, HBr, HI, მათი მოლეკულების პოლარობის გამო, წყალში ძალიან ხსნადია. ამ შემთხვევაში ხდება მოლეკულების ჰიდრატაცია, რაც იწვევს მათ დისოციაციას ჰიდრატირებული პროტონებისა და ჰალოგენური ანიონების წარმოქმნით. მჟავების სიძლიერე HF, HC1, HBr, HI სერიებში იზრდება ანიონების რადიუსისა და პოლარიზადობის გაზრდის გამო F-დან I-მდე.
მარილმჟავა, როგორც კუჭის წვენის კომპონენტი, მნიშვნელოვან როლს ასრულებს საჭმლის მონელების პროცესში. ძირითადად მარილმჟავას გამო, რომლის მასური წილი კუჭის წვენში არის 0,3%, მისი pH შენარჩუნებულია 1-დან 3-მდე დიაპაზონში. მარილმჟავა ხელს უწყობს პეპსინის ფერმენტის აქტიურ ფორმაზე გადასვლას, რაც უზრუნველყოფს ცილების მონელებას. პეპტიდური ობლიგაციების ჰიდროლიზური დაშლის გამო სხვადასხვა ამინომჟავების წარმოქმნით:
კუჭის წვენში მარილმჟავას და სხვა მჟავების შემცველობის განსაზღვრა განხილული იყო განყოფილებაში. 8.3.3.
ქლორის ჟანგბადის შემცველი მჟავების სერიაში მისი დაჟანგვის მდგომარეობის მატებასთან ერთად იზრდება მჟავების სიძლიერე.

ეს გამოწვეულია O-H ბმის პოლარობის ზრდით მისი ელექტრონული სიმკვრივის ქლორის ატომისკენ ცვლის გამო, ასევე ანიონების სტაბილურობის გაზრდის გამო.
კომპლექსური თვისებები.ჰალოგენური ანიონები ქმნიან კომპლექსებს ლიგანდების სახით. ჰალოგენური კომპლექსების სტაბილურობა ჩვეულებრივ მცირდება F- > Cl- > Br- > > I- რიგით. სწორედ დაკომპლექსების პროცესი ხსნის ფტორის ანიონების ტოქსიკურ ეფექტს, რომლებიც ფერმენტების აქტიურ ცენტრებში შემავალ ლითონის კათიონებთან ფტორიდის კომპლექსების წარმოქმნით თრგუნავენ მათ აქტივობას.
იოდის მოლეკულა ავლენს საინტერესო კომპლექსის წარმომქმნელ თვისებებს. ამრიგად, წყალში მოლეკულური იოდის ხსნადობა მკვეთრად იზრდება კალიუმის იოდიდის არსებობისას, რაც დაკავშირებულია რთული ანიონის წარმოქმნასთან.
ამ რთული იონის დაბალი სტაბილურობა უზრუნველყოფს მოლეკულური იოდის არსებობას ხსნარში. ამიტომ მედიცინაში იოდის წყალხსნარი KI-ს დამატებით გამოიყენება როგორც ბაქტერიციდული საშუალება. გარდა ამისა, მოლეკულური იოდი აყალიბებს ინკლუზიურ კომპლექსებს სახამებელთან (ნაწილი 22.3) და პოლივინილის სპირტით. (ლურჯი იოდი).ამ კომპლექსებში იოდის მოლეკულები ან მათი ასოცირებული იოდიდ ანიონებთან ავსებენ არხებს, რომლებიც წარმოიქმნება შესაბამისი პოლიჰიდროქსი პოლიმერების ხვეული სტრუქტურით. ინკლუზიური კომპლექსები არ არის ძალიან სტაბილური და შეუძლიათ თანდათანობით გაათავისუფლონ მოლეკულური იოდი. ამიტომ, ისეთი პრეპარატი, როგორიცაა ლურჯი იოდი, ეფექტური, მაგრამ რბილი, ხანგრძლივი მოქმედების ბაქტერიციდული აგენტია.
ჰალოგენების და მათი ნაერთების ბიოლოგიური როლი და გამოყენება მედიცინაში.ჰალოგენები სხვადასხვა ნაერთების სახით ცოცხალი ქსოვილების ნაწილია. სხეულში ყველა ჰალოგენს აქვს ჟანგვის მდგომარეობა 1. ამავდროულად, ქლორი და ბრომი არსებობს ჰიდრატირებული Cl- და ბრანიონების სახით, ხოლო ფტორი და იოდი წყალში უხსნადი ბიოსუბსტრატების ნაწილია:
ფტორის ნაერთები ძვლოვანი ქსოვილის, ფრჩხილებისა და კბილების კომპონენტებია. ფტორის ბიოლოგიური ეფექტი უპირველეს ყოვლისა დაკავშირებულია სტომატოლოგიური დაავადებების პრობლემასთან. ფტორის ანიონი, რომელიც ანაცვლებს ჰიდროქსიდის იონს ჰიდროქსიაპატიტში, ქმნის დამცავ მინანქრის ფენას მყარი ფტორაპატიტისგან:
სასმელი წყლის ფტორირება 1 მგ/ლ ფტორის იონების კონცენტრაციამდე და ნატრიუმის ფტორიდის დამატება კბილის პასტაში მნიშვნელოვნად ამცირებს კბილთა კარიესს პოპულაციაში. ამავდროულად, როდესაც სასმელ წყალში ფტორის ანიონის კონცენტრაცია 1,2 მგ/ლ-ზე მეტია, იზრდება ძვლებისა და კბილის მინანქრის მყიფეობა და ჩნდება ორგანიზმის ზოგადი გამოფიტვა, ე.წ. ფლუოროზი.
ქლორიდის ანიონები უზრუნველყოფენ იონურ ნაკადს უჯრედის მემბრანებში, მონაწილეობენ ოსმოსური ჰომეოსტაზის შენარჩუნებაში და ქმნიან ხელსაყრელ გარემოს კუჭის წვენის პროტოლიზური ფერმენტების მოქმედებისა და გააქტიურებისთვის.
ბრომიდის ანიონები ადამიანის ორგანიზმში ლოკალიზებულია ძირითადად ჰიპოფიზის ჯირკვალში და სხვა ენდოკრინულ ჯირკვლებში. დადგენილია ორგანიზმში ბრომიდისა და ქლორიდის ანიონების შემცველობას შორის დინამიური კავშირის არსებობა. ამრიგად, სისხლში ბრომიდის ანიონების გაზრდილი შემცველობა ხელს უწყობს თირკმელების მიერ ქლორიდის ანიონების სწრაფ გამოყოფას. ბრომიდები ლოკალიზებულია ძირითადად უჯრედშორის სითხეში. ისინი აძლიერებენ ინჰიბიტორულ პროცესებს ცერებრალური ქერქის ნეირონებში და ამიტომ ფარმაკოლოგიაში გამოიყენება კალიუმის, ნატრიუმის და ბრომოკამფორის ბრომიდები.
იოდი და მისი ნაერთები გავლენას ახდენს ცილების, ცხიმების და ჰორმონების სინთეზზე. იოდის ოდენობის ნახევარზე მეტი ფარისებრი ჯირკვალშია შეკრულ მდგომარეობაში ფარისებრი ჯირკვლის ჰორმონების სახით. ორგანიზმში იოდის არასაკმარისი მიღებით ვითარდება ენდემური ჩიყვი. ამ დაავადების თავიდან ასაცილებლად სუფრის მარილს უმატებენ NaI ან KI (1-2 გ 1 კგ NaCl-ზე). ამრიგად, ყველა ჰალოგენი აუცილებელია ცოცხალი ორგანიზმების ნორმალური ფუნქციონირებისთვის.
თავი 13
განმარტება
ჰალოგენები– VIIA ჯგუფის ელემენტები – ფტორი (F), ქლორი (Cl), ბრომი (Br) და იოდი (I).
ჰალოგენების გარე ენერგიის დონის ელექტრონული კონფიგურაცია ns 2 np 5. ვინაიდან ჰალოგენებს აკლიათ მხოლოდ ერთი ელექტრონი ენერგიის დონის დასრულებამდე, ORR-ში ისინი ყველაზე ხშირად ავლენენ ჟანგვის აგენტების თვისებებს. ჰალოგენების ჟანგვის მდგომარეობები: "-1"-დან "+7"-მდე. ჰალოგენური ჯგუფის ერთადერთი ელემენტი, ფტორი, ავლენს მხოლოდ ერთ ჟანგვის მდგომარეობას "-1" და არის ყველაზე ელექტროუარყოფითი ელემენტი.
ჰალოგენის მოლეკულები დიატომურია: F 2, Cl 2, Br 2, I 2. ქიმიური ელემენტის ატომის ბირთვის მუხტის გაზრდით, ე.ი. ფტორიდან იოდზე გადასვლისას, ჰალოგენების ჟანგვის უნარი მცირდება, რაც დასტურდება ჰიდროჰალიუმის მჟავებიდან და მათი მარილებისგან ქვედა ჰალოგენების უფრო მაღალით გადაადგილების უნარით:
Br 2 + 2HI = I 2 + 2HBr
Cl 2 + 2KBr = Br 2 + 2KCl
ჰალოგენების ფიზიკური თვისებები
ნომერზე ფტორი არის ღია ყვითელი გაზი მკვეთრი სუნით. შხამიანი. ქლორი არის ღია მწვანე გაზი, ისევე როგორც ფტორს, მას აქვს მკვეთრი სუნი. უაღრესად შხამიანი. ამაღლებული წნევისა და ოთახის ტემპერატურაზე ადვილად გადადის თხევად მდგომარეობაში. ბრომი არის წითელ-ყავისფერი ფერის მძიმე სითხე დამახასიათებელი უსიამოვნო მძაფრი სუნით. თხევადი ბრომი, ისევე როგორც მისი ორთქლი, ძალიან ტოქსიკურია. ბრომი ცუდად იხსნება წყალში და კარგად არაპოლარულ გამხსნელებში. იოდი არის მუქი ნაცრისფერი მყარი, მეტალის ბზინვარებით. იოდის ორთქლი იისფერია. იოდი ადვილად ამაღლდება, ე.ი. მყარიდან გარდაიქმნება აირად მდგომარეობაში, თხევადი მდგომარეობის გვერდის ავლით.
ჰალოგენების წარმოება
ჰალოგენების მიღება შესაძლებელია ხსნარების ან ჰალოგენების დნობის ელექტროლიზით:
MgCl 2 = Mg + Cl 2 (დნება)
ყველაზე ხშირად, ჰალოგენები მიიღება ჰიდროჰალიუმის მჟავების დაჟანგვის რეაქციით:
MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O
K 2 Cr 2 O 7 + 14HCl = 3Cl 2 + 2KCl +2CrCl 3 +7H 2 O
2KMnO 4 +16HCl = 2MnCl 2 +5Cl 2 +8H 2 O +2KCl
ჰალოგენების ქიმიური თვისებები
ფტორს აქვს უდიდესი ქიმიური აქტივობა. ქიმიური ელემენტების უმეტესობა, თუნდაც ოთახის ტემპერატურაზე, ურთიერთქმედებს ფტორთან, ათავისუფლებს დიდი რაოდენობით სითბოს. წყალიც კი იწვის ფტორში:
2H 2 O + 2F 2 = 4HF + O 2
თავისუფალი ქლორი ნაკლებად რეაქტიულია ვიდრე ფტორი. ის უშუალოდ არ რეაგირებს ჟანგბადთან, აზოტთან და კეთილშობილ გაზებთან. ის ურთიერთქმედებს ყველა სხვა ნივთიერებასთან, როგორიცაა ფტორი:
2Fe + Cl 2 = 2 FeCl 3
2P + 5Cl 2 = 2PCl 5
როდესაც ქლორი ურთიერთქმედებს წყალთან სიცივეში, ხდება შექცევადი რეაქცია:
Cl 2 + H 2 O↔HCl +HClO
რეაქციის პროდუქტების ნარევს ქლორიანი წყალი ეწოდება.
როდესაც ქლორი ურთიერთქმედებს ტუტეებთან სიცივეში, იქმნება ქლორიდების და ჰიპოქლორიტების ნარევები:
Cl 2 + Ca(OH) 2 = Ca(Cl)OCl + H 2 O
როდესაც ქლორი იხსნება ცხელ ტუტე ხსნარში, ხდება შემდეგი რეაქცია:
3Cl 2 + 6KOH=5KCl +KClO 3 +3H 2 O
ბრომი, ისევე როგორც ქლორი, იხსნება წყალში და ნაწილობრივ რეაგირებს მასთან, წარმოქმნის ეგრეთ წოდებულ „ბრომიან წყალს“, ხოლო იოდი პრაქტიკულად წყალში უხსნადია.
იოდი ქიმიური აქტივობით მნიშვნელოვნად განსხვავდება სხვა ჰალოგენებისგან. ის არ რეაგირებს არამეტალების უმეტესობასთან და ნელა რეაგირებს მეტალებთან მხოლოდ გაცხელებისას. იოდის ურთიერთქმედება წყალბადთან ხდება მხოლოდ ძლიერი გაცხელებით; რეაქცია არის ენდოთერმული და უაღრესად შექცევადი:
H 2 + I 2 = 2HI - 53 კჯ.
პრობლემის გადაჭრის მაგალითები
მაგალითი 1
| ვარჯიში | გამოთვალეთ ქლორის მოცულობა (არა.), რომელიც რეაგირებდა კალიუმის იოდიდთან, თუ წარმოიქმნება იოდი 508 გ მასით. |
| გამოსავალი | დავწეროთ რეაქციის განტოლება: Cl 2 + 2KI = I 2 + 2KCl ვიპოვოთ წარმოქმნილი იოდის რაოდენობა: v(I 2)=m(I 2)/M(I 2) v(I 2)=508/254=2 მოლი რეაქციის განტოლების მიხედვით ქლორის ნივთიერების რაოდენობა. ქიმიის სახელმძღვანელოდან ბევრმა იცის, რომ ჰალოგენები მოიცავს მენდელეევის პერიოდული სისტემის ქიმიურ ელემენტებს ცხრილში 17 ჯგუფიდან. ბერძნულიდან ითარგმნა როგორც დაბადება, წარმოშობა. თითქმის ყველა მათგანი ძალიან აქტიურია, რის გამოც ისინი ძალადობრივად რეაგირებენ მარტივ ნივთიერებებთან, რამდენიმე არამეტალის გარდა. რა არის ჰალოგენები და რა თვისებები აქვს მათ? კონტაქტში ჰალოგენების სიაჰალოგენები კარგი ჟანგვის აგენტებია; ამ მიზეზით, ბუნებაში ისინი მხოლოდ ზოგიერთ ნაერთში გვხვდება. რაც უფრო მაღალია ატომური რიცხვი, მით ნაკლებია ამ ჯგუფის ელემენტების ქიმიური აქტივობა. ჰალოგენური ჯგუფი მოიცავს შემდეგ ელემენტებს:
ეს უკანასკნელი შეიქმნა ბირთვული კვლევების ინსტიტუტში, რომელიც მდებარეობს ქალაქ დუბნაში. ფტორი არის მომწამვლელი გაზი, რომელსაც აქვს ღია ყვითელი ფერი. ქლორი ასევე შხამიანია. ეს არის გაზი, რომელსაც აქვს ღია მწვანე ფერის საკმაოდ მძაფრი და უსიამოვნო სუნი. ბრომს აქვს მოწითალო-ყავისფერი ფერი და არის ტოქსიკური სითხე, რომელსაც შეუძლია გავლენა მოახდინოს ყნოსვაზეც კი. ის ძალიან აქროლადია, ამიტომ ინახება ამპულაში. იოდი არის კრისტალური, ადვილად სუბლიმირებული, მუქი მეწამული ნივთიერება. ასტატინი რადიოაქტიურია, ბროლის ფერი: შავი ლურჯი, ნახევარგამოყოფის პერიოდი 8,1 საათია.
ფტორი ურთიერთქმედებს ინერტულ აირებთან და დასხივდება (Xe + F 2 = XeF 2 + 152 კჯ). როდესაც თბება, ფტორი ზემოქმედებს სხვა ჰალოგენებზე, ჟანგვის მათ. ფორმულა მოქმედებს: Hal 2 + F 2 = 2HalF, სადაც Hal = Cl, Br, I, At, იმ შემთხვევაში, როდესაც ქლორის, ბრომის, იოდის და ასტატინის ნახევარი ჟანგვის მდგომარეობა უდრის + 1-ს. ფტორი ასევე საკმაოდ ენერგიულად ურთიერთქმედებს რთულ ნივთიერებებთან. შედეგი არის წყლის დაჟანგვა. ამ შემთხვევაში ხდება ფეთქებადი რეაქცია, რომელიც მოკლედ იწერება ფორმულით: 3F 2 + ZH 2 O = OF 2 + 4HF + H 2 O 2. ქლორითავისუფალი ქლორის აქტივობა ოდნავ ნაკლებია ფტორზე, მაგრამ მას ასევე აქვს რეაქციის კარგი უნარი. ეს შეიძლება მოხდეს ბევრ მარტივ ნივთიერებასთან ურთიერთობისას, იშვიათი გამონაკლისების გარდა ჟანგბადის, აზოტისა და ინერტული აირების სახით. ის შეუძლია ძალადობრივი რეაქცია რთულ ნივთიერებებთან, შემცვლელი რეაქციების შექმნა, ნახშირწყალბადების დამატების თვისება ასევე თანდაყოლილია ქლორში. როდესაც თბება, ბრომი ან იოდი გამოიყოფა წყალბადის ან ლითონების ნაერთებიდან.
Cl2+ თν → 2Cl, Cl + H2 → HCl + H, H + Cl2 → HCl + Cl, Cl + H2 → HCl + H და ა.შ. ფოტონები, აღგზნებისას, იწვევენ Cl 2 მოლეკულების ატომებად დაშლას და ხდება ჯაჭვური რეაქცია, რაც იწვევს ახალი ნაწილაკების გამოჩენას, რომლებიც იწყებენ შემდეგი ეტაპის დაწყებას. ქიმიის ისტორიაში ეს ფენომენი შესწავლილია. რუსი ქიმიკოსი და ნობელის პრემიის ლაურეატი N.N. Semenov. 1956 წელს მან შეისწავლა ფოტოქიმიური ჯაჭვური რეაქცია და ამით დიდი წვლილი შეიტანა მეცნიერებაში. ქლორი რეაგირებს ბევრ რთულ ნივთიერებასთან, ეს არის ჩანაცვლების და დამატების რეაქციები. წყალში კარგად იხსნება. Cl 2 + H 2 O = HCl + HClO - 25 კჯ. ტუტეებთან ერთად, როცა გაცხელდება, ქლორს შეუძლია არაპროპორციული.
ბრომი, იოდი და ატატინიბრომის ქიმიური აქტივობა ოდნავ ნაკლებია, ვიდრე ზემოაღნიშნული ფტორისა და ქლორის, მაგრამ ასევე საკმაოდ მაღალია. ბრომი ხშირად გამოიყენება თხევადი სახით. ის, როგორც ქლორი, ძალიან კარგად იხსნება წყალში. ნაწილობრივი რეაქცია ხდება მასთან, რაც საშუალებას აძლევს ადამიანს მიიღოს "ბრომი წყალი". იოდის ქიმიური აქტივობა შესამჩნევად განსხვავდება ამ სერიის სხვა წარმომადგენლებისგან. ის თითქმის არ ურთიერთქმედებს არალითონებთან, არამედ მეტალებთან რეაქცია ხდება ძალიან ნელა და მხოლოდ გაცხელებისას. ამ შემთხვევაში ხდება სითბოს დიდი შთანთქმა (ენდოთერმული რეაქცია), რომელიც ძლიერ შექცევადია. გარდა ამისა იოდი წყალში არანაირად არ იხსნება, გახურებითაც კი ამის მიღწევა შეუძლებელია, რის გამოც ბუნებაში „იოდის წყალი“ არ არსებობს. იოდის გახსნა შესაძლებელია მხოლოდ იოდიდის ხსნარში. ამ შემთხვევაში წარმოიქმნება რთული ანიონები. მედიცინაში ამ ნაერთს ლუგოლის ხსნარს უწოდებენ. ასტატინი რეაგირებს ლითონებთან და წყალბადთან. ჰალოგენების სერიაში ქიმიური აქტივობა მცირდება ფტორიდან ატატინის მიმართულებით. F - At სერიის თითოეულ ჰალოგენს შეუძლია გადაიტანოს შემდგომი ელემენტები ლითონების ან წყალბადის ნაერთებისგან. ასტატინი ამ ელემენტებს შორის ყველაზე პასიურია. მაგრამ მას ახასიათებს ლითონებთან ურთიერთქმედება. განაცხადიქიმია მტკიცედ არის შემორჩენილი ჩვენს ცხოვრებაში, აღწევს ყველა სფეროში. ადამიანმა ისწავლა ჰალოგენების, ისევე როგორც მისი ნაერთების გამოყენება საკუთარი სარგებლისთვის. ჰალოგენების ბიოლოგიური მნიშვნელობა უდაოა. მათი გამოყენების სფეროები განსხვავებულია:
ქლორი ყველაზე ფართოდ გამოიყენება ჩვენს ცხოვრებაში. მისი გამოყენების სფერო საკმაოდ მრავალფეროვანია. გამოყენების მაგალითები:
უნდა გვახსოვდეს, რომ ჰალოგენები ძალიან ტოქსიკური ნივთიერებებია. ეს თვისება განსაკუთრებით გამოხატულია ფტორში. ჰალოგენებმა შეიძლება გამოიწვიოს ასფიქსია, სუნთქვის გაღიზიანება და ბიოლოგიური ქსოვილის დაზიანება. ქლორის ორთქლი შეიძლება იყოს უკიდურესად საშიში, ისევე როგორც ფტორის აეროზოლი, რომელსაც აქვს სუსტი სუნი და იგრძნობა მაღალი კონცენტრაციით. ადამიანმა შეიძლება განიცადოს დახრჩობის ეფექტი. ასეთ კავშირებთან მუშაობისას სიფრთხილის ზომები უნდა იქნას მიღებული. ჰალოგენების წარმოების მეთოდები რთული და მრავალფეროვანია. ინდუსტრიაში ამას უახლოვდება გარკვეული მოთხოვნები, რომლებიც მკაცრად არის დაცული. მეტი თემაზე |
 ჰალოგენების მაღალი ჟანგვის აქტივობა მცირდება ფტორიდან იოდამდე. მისი ძმებიდან ყველაზე აქტიურია ფტორი, რომელიც აქვს უნარი რეაგირება მოახდინოს ნებისმიერ მეტალთან, წარმოქმნას მარილები, ზოგიერთი მათგანი სპონტანურად ანთებს, გამოყოფს უზარმაზარ სითბოს. გათბობის გარეშე, ეს ელემენტი რეაგირებს თითქმის ყველა არამეტალთან, რეაქციებს თან ახლავს გარკვეული რაოდენობის სითბოს გამოყოფა (ეგზოთერმული).
ჰალოგენების მაღალი ჟანგვის აქტივობა მცირდება ფტორიდან იოდამდე. მისი ძმებიდან ყველაზე აქტიურია ფტორი, რომელიც აქვს უნარი რეაგირება მოახდინოს ნებისმიერ მეტალთან, წარმოქმნას მარილები, ზოგიერთი მათგანი სპონტანურად ანთებს, გამოყოფს უზარმაზარ სითბოს. გათბობის გარეშე, ეს ელემენტი რეაგირებს თითქმის ყველა არამეტალთან, რეაქციებს თან ახლავს გარკვეული რაოდენობის სითბოს გამოყოფა (ეგზოთერმული). ამ ელემენტს თავისებური კავშირი აქვს წყალბადთან. ოთახის ტემპერატურაზე და სინათლის ზემოქმედების გარეშე, ქლორი არანაირად არ რეაგირებს ამ გაზზე, მაგრამ როგორც კი გაცხელდება ან მიმართულია სინათლეზე, ფეთქებადი ჯაჭვური რეაქცია მოხდება. ფორმულა მოცემულია ქვემოთ:
ამ ელემენტს თავისებური კავშირი აქვს წყალბადთან. ოთახის ტემპერატურაზე და სინათლის ზემოქმედების გარეშე, ქლორი არანაირად არ რეაგირებს ამ გაზზე, მაგრამ როგორც კი გაცხელდება ან მიმართულია სინათლეზე, ფეთქებადი ჯაჭვური რეაქცია მოხდება. ფორმულა მოცემულია ქვემოთ: ბუნებრივი ნაერთი კრიოლიტიდან, რომლის ქიმიური ფორმულა ასეთია: Na3AlF6. ალუმინის. ფტორის ნაერთები ფართოდ გამოიყენება წარმოებაში კბილის პასტები. ცნობილია, რომ ფტორი ხელს უწყობს კარიესის თავიდან აცილებას. გამოიყენება იოდის ალკოჰოლური ნაყენი ჭრილობების დეზინფექციისა და დეზინფექციისთვის.
ბუნებრივი ნაერთი კრიოლიტიდან, რომლის ქიმიური ფორმულა ასეთია: Na3AlF6. ალუმინის. ფტორის ნაერთები ფართოდ გამოიყენება წარმოებაში კბილის პასტები. ცნობილია, რომ ფტორი ხელს უწყობს კარიესის თავიდან აცილებას. გამოიყენება იოდის ალკოჰოლური ნაყენი ჭრილობების დეზინფექციისა და დეზინფექციისთვის.